Чем отличается бактериемия от сепсиса
Бактериемия (присутствие инфекции в системном кровотоке) — одно из возможных, но не обязательных проявлений сепсиса. Отсутствие бактериемии не должно влиять на постановку диагноза при наличии обозначенных выше критериев сепсиса. Даже при самом скрупулёзном соблюдении техники забора крови и использовании современных технологий определения микроорганизмов у самых тяжёлых больных частота положительных результатов, как правило, не превышает 45%. Обнаружение микроорганизмов в кровотоке без клиниколабораторных подтверждений синдрома системного воспаления нужно расценивать как транзиторную бактериемию. Клиническая значимость бактериемии может заключаться в следующем:
- подтверждении диагноза и определении этиологии инфекционного процесса;
- доказательстве механизма развития сепсиса (например, катетерсвязанная инфекция);
- обосновании выбора схемы антибиотикотерапии;
- оценке эффективности терапии.
Роль полимеразной цепной реакции в диагностике бактериемии и интерпретация полученных результатов остаётся неясной для практического применения. Наличие предполагаемого или подтверждённого инфекционного процесса устанавливают на основании следующих признаков:
- обнаружение лейкоцитов в жидких средах организма, которые в норме стерильны;
- перфорация полого органа;
- рентгенографические признаки пневмонии, наличие гнойной мокроты;
- клинические синдромы, при которых высока вероятность инфекционного процесса.
ЭТИОЛОГИЯ
На сегодняшний день в большинстве крупных медицинских центров частота грамположительного и грамотрицательного сепсиса оказалась приблизительно равной. Перестал быть исключением сепсис, вызываемый грибковой флорой типа Candida. Риск его возникновения существенно повышается у больных с высоким индексом тяжести общего состояния, при длительном пребывании в отделении интенсивной терапии (более 21 дня), находящихся на полном парентеральном питании, получавших глюкокортикоиды; больных с тяжёлой почечной дисфункцией, потребовавшей проведения экстракорпоральной детоксикации.
Этиологию гинекологического сепсиса определяют источником инфицирования:
Влагалищный источник:
―Peptostreptococcus spp.;
―Bacteroides bivus;
―Стрептококки группы В;
―Gardnerella vaginalis;
―Mycoplasma hominis;
―S. aureus.
Интестинальный источник:
―E. coli;
―Enterococcus spp.;
―Enterobacter spp.;
―Clostridium spp.;
―Bacteroides fragilis;
―Candida spp.
Сексуальнотрансмиссивный:
―Neisseria gonorrhoeae;
―Chlamydia trachomatis.
Гематогенный:
―Listeria monocytogenes;
―Campylobacter spp.;
―Стрептококки группы А.
ПАТОГЕНЕЗ
Развитие органносистемных повреждений при сепсисе прежде всего связано с неконтролируемым распространением из первичного очага инфекционного воспаления провоспалительных медиаторов эндогенного происхождения с последующей активацией под их влиянием макрофагов, нейтрофилов, лимфоцитов и ряда других клеток в других органах и тканях, с вторичным выделением аналогичных эндогенных субстанций, повреждением эндотелия и снижением органной перфузии и доставки кислорода. Диссеминация микроорганизмов может вообще отсутствовать или быть кратковременной, трудноуловимой. Однако и в такой ситуации возможен выброс провоспалительных цитокинов на дистанции от очага. Экзо и эндотоксины бактерий также могут активировать гиперпродукцию цитокинов из макрофагов, лимфоцитов, эндотелия.
Суммарные эффекты, оказываемые медиаторами, формируют синдром системной воспалительной реакции. В её развитии стали выделять три основных этапа.
1й этап. Локальная продукция цитокинов в ответ на инфекцию.
Особое место среди медиаторов воспаления занимает цитокиновая сеть, контролирующая процессы реализации иммунной и воспалительной реактивности. Основные продуценты цитокинов — Тклетки и активированные макрофаги, а также в той или иной степени другие виды лейкоцитов, эндотелиоциты посткапиллярных венул, тромбоциты и различные типы стромальных клеток. Цитокины приоритетно действуют в очаге воспаления и на территории реагирующих лимфоидных органов, выполняя в итоге ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов.
2й этап. Выброс малого количества цитокинов в системный кровоток.
Малые количества медиаторов способны активировать макрофаги, тромбоциты, выброс из эндотелия молекул адгезии, продукцию гормона роста. Развивающуюся острофазовую реакцию контролируют провоспалительные медиаторы (интерлейкины ИЛ1, ИЛ6, ИЛ8, фактор некроза опухолей α [TNFα] и др.) и их эндогенные антагонисты, такие, как ИЛ4, ИЛ10, ИЛ13, растворимые рецепторы к TNFα и другие, получившие название антивоспалительных медиаторов. За счёт поддержания баланса и контролируемых взаимоотношений между про и антивоспалительными медиаторами в нормальных условиях создаются предпосылки для заживления ран, уничтожения патогенных микроорганизмов, поддержания гомеостаза. К системным адаптационным изменениям при остром воспалении можно отнести стрессорную реактивность нейроэндокринной системы, лихорадку, выход нейтрофилов в циркуляцию из сосудистого и костномозгового депо, усиление лейкоцитопоэза в костном мозге, гиперпродукция белков острой фазы в печени, развитие генерализованных форм иммунного ответа.
3й этап. Генерализация воспалительной реакции.
При выраженном воспалении или его системной несостоятельности некоторые виды цитокинов:TNFα, ИЛ1, ИЛ6, ИЛ10, TGFβ, INFγ (при вирусных инфекциях) — могут проникать в системную циркуляцию, накапливаться там в количествах, достаточных для реализации своих длиннодистантных эффектов. В случае неспособности регулирующих систем к поддержанию гомеостаза деструктивные эффекты цитокинов и других медиаторов начинают доминировать, что приводит к нарушению проницаемости и функции эндотелия капилляров, запуску синдрома диссеминированного сосудистого свёртывания, формированию отдалённых очагов системного воспаления, развитию моно и полиорганной дисфункции. В качестве факторов системного повреждения, повидимому, могут выступать и любые нарушения гомеостаза, способные восприниматься иммунной системой как повреждающие или потенциально повреждающие.
На этой стадии синдрома системной воспалительной реакции с позиций взаимодействия про и антивоспалительных медиаторов возможно условное выделение двух периодов. Первый, начальный — период гипервоспаления, характеризующийся выбросом сверхвысоких концентраций провоспалительных цитокинов, оксида азота, что сопровождается развитием шока и ранним формированием синдрома полиорганной недостаточности (ПОН). Однако уже в данный момент происходит компенсаторное выделение антивоспалительных цитокинов, скорость их секреции, концентрация в крови и тканях постепенно нарастает с параллельным снижением содержания медиаторов воспаления.
В генезе острой сосудистой недостаточности, лежащей в основе септического шокового синдрома, ведущую роль отводят оксиду азота, концентрация которого увеличивается в десятки раз в результате стимуляции макрофагов ТNFα, ИЛ1, IFN, а в дальнейшем секреция окисида азота осуществляется и клетками гладкой мускулатуры сосудов, и уже сами моноциты активируются под её действием. В нормальных условиях оксид азота выполняет роль нейротрансмиттера, участвует в вазорегуляции, фагоцитозе. Характерно, что нарушения микроциркуляции при сепсисе носят неоднородный характер: зоны дилатации сочетаются с участками вазоконстрикции. Факторы риска развития септического шока — онкологические заболевания, тяжесть состояния больных по шкале SOFA более 5 баллов, хронические обструктивные заболевания лёгких, пожилой возраст.
В результате дисфункции печени, почек, кишечника появляются новые, дистальные по отношению к цитокинам факторы повреждающего воздействия. В роли таковых выступают промежуточные и конечные продукты нормального обмена в высоких концентрациях (лактат, мочевина, креатинин, билирубин), накопленные в патологических концентрациях компоненты и эффекторы регуляторных систем (калликреинкининовой, свёртывающей, фибринолитической), продукты извращённого обмена (альдегиды, кетоны, высшие спирты), вещества кишечного происхождения типа индола, скатола, путресцина.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина сепсиса складывается из клинической картины синдрома системной воспалительной реакции (тахикардия, лихорадка или гипотермия, одышка, лейкоцитоз или лейкопения со сдвигом лейкоцитарной формулы) и многообразия синдромов, характерных для органной дисфункции (септическая энцефалопатия, септический шок, острая дыхательная, сердечная, почечная, печёночная недостаточность).
Септическая энцефалопатия чаще всего служит следствием отёка головного мозга и может быть связана как с развитием синдрома системной воспалительной реакции, так и с развитием септического шока, гипоксией, сопутствующими заболеваниями (атеросклероз сосудов головного мозга, алкогольная или наркотическая зависимость и т.д.). Проявления септической энцефалопатии разнообразны — беспокойство, ажитация, психомоторное возбуждение и, наоборот, заторможённость, апатия, вялость, сопор, кома.
Появление острой дыхательной недостаточности при сепсисе связано чаще всего с развитием острого повреждения лёгких или острого респираторного дистресссиндрома, диагностическими критериями которых служат гипоксемия, двусторонние инфильтраты на рентгенограмме, снижение отношения парциального давления кислорода в артериальной крови к инспираторной фракции кислорода (PaO2/FiO2) ниже 300, отсутствие признаков левожелудочковой недостаточности.
Оценку органной дисфункции при сепсисе осуществляют по представленным ниже критериям (табл. 31-3).
Таблица 31-3. Критерии органной дисфункции при сепсисе
Общая информация
Бактериемия — это присутствие бактерий в циркулирующем кровотоке (крови).
- Бактериемия может возникнуть в результате обычной деятельности (например, тщательной чистки зубов), медицинских или стоматологических процедур или инфекций (таких как пневмония или инфекция мочевыводящих путей).
- Наличие искусственного сердечного клапана или наличие отклонений в работе сердечного клапана повышает риск развития бактериемии или возникновения проблем.
- Бактериемия обычно не вызывает симптомов, но иногда бактерии накапливаются в определенных тканях или органах, вызывая серьезные инфекции.
- Перед проведением некоторых стоматологических и медицинских процедур пациентам с высоким риском осложнений назначаются антибиотики.
Как правило, бактериемия, особенно если она возникает во время обычной деятельности, не вызывает инфекций, поскольку бактерии обычно присутствуют только в небольших количествах и быстро выводятся из кровотока иммунной системой. Но если бактерии присутствуют в крови достаточно долго и их достаточно много, особенно у людей с ослабленной иммунной системой, бактериемия может привести к другим инфекциям и иногда вызывать серьезную реакцию всего тела, называемую сепсисом.
Бактерии, которые не удаляются иммунной системой, могут накапливаться в различных местах по всему телу, вызывая следующие инфекции:
- Ткани, покрывающие мозг (менингит).
- Мембрана, которая окружает сердце (перикардит).
- Клетки, выстилающие сердечные клапаны и сердце (эндокардит).
- Кости (остеомиелит).
- Суставы (инфекционный артрит).
При бактериемии бактерии склонны откладываться и накапливаться в определенных структурах организма, например, в аномальных сердечных клапанах. Бактерии особенно склонны накапливаться в любых искусственных материалах в организме, таких как внутривенные катетеры и искусственные (протезные) суставы и клапаны сердца. Эти скопления (колонии) бактерий могут оставаться прикрепленными к участкам материалов и высвобождать бактерии в кровоток непрерывно или периодически.
Причины бактериемии
Бактериемия может возникнуть во время:
- определенных общих процедур;
- медицинских или стоматологических процедур;
- бактериальных инфекций;
- рекреационной инъекции препаратами.
Некоторые обычные процедуры иногда вызывают бактериемию у здоровых людей. Например, энергичная чистка зубов может вызвать бактериемию, потому что бактерии, которые живут в деснах вокруг зубов, попадают в кровоток. Бактерии также могут попадать в кровоток из кишечника во время пищеварения. Бактериемия, возникающая во время обычной деятельности, редко приводит к инфекциям.
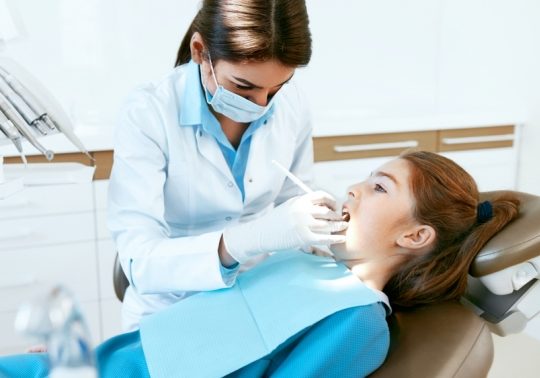
Медицинские или стоматологические процедуры могут привести к бактериемии. Во время стоматологических процедур (таких как чистка зубов стоматологом-гигиенистом) бактерии, живущие в деснах, могут сместиться и попасть в кровоток. Бактериемия также может возникать при установке катетеров или трубок мочевого пузыря в пищеварительном или мочевом тракте. Бактерии могут присутствовать в области, в которую был вставлен катетер или трубка (например, мочевой пузырь или кишечник). Поэтому, хотя используются стерильные методы, эти процедуры могут ввести бактерии в кровоток. Хирургическое лечение инфицированных ран, абсцессов (скоплений гноя) и пролежней может привести к попаданию бактерий из зараженного участка в кровоток, что вызовет бактериемию.
При некоторых бактериальных инфекциях, таких как пневмония и кожные абсцессы, бактерии могут периодически попадать в кровоток, вызывая бактериемию. Многие распространенные в детстве бактериальные инфекции могут увеличивать наличие бактерий в крови.
Инъекционное введение рекреационных лекарств может вызвать бактериемию, поскольку используемые иглы обычно загрязнены бактериями и люди часто не очищают свою кожу должным образом.
Патофизиология
Все бактериальные инфекции зависят от иммунной системы хозяина, которая зависит от ее генетической сигнатуры, а также от врожденных и приобретенных недостатков. Клеточные врожденные и адаптивные иммунные ответы ответственны за первоначальное очищение от микробов, в то время как печень и селезенка фильтруют активные бактерии уже в циркулирующей крови.
В своей основной форме бактерии начинают колонизировать место своего первичного местоположения. В этот момент бактерии могут становиться преходящими и клинически незначимыми или могут избегать иммунного ответа хозяина, увеличиваться в количестве и становиться локальной инфекцией, которая в конечном итоге может мигрировать в другие части тела. Если бактерии жизнеспособны и попадают в циркулирующий кровоток, инфекция все еще может спонтанно исчезать или прогрессировать до сепсиса.
Первым барьером для бактериальной инвазии является поверхность кожи и слизистой оболочки. Условия, которые мешают этим естественным защитным барьерам, обычно являются медицинские процедуры, которые проходят через кожу и анатомическое просветление. Кроме того, события могут ускорить срыв защитного барьера, например из-за травмы, ожогов, язв и естественных элементов старения.
Симптомы бактериемии

Как правило, бактериемия, возникающая в результате общих процедур, таких как стоматологические процедуры, носит временный характер и не вызывает никаких симптомов. Бактериемия, возникающая в результате других клинических состояний, может вызвать повышение температуры.
Если у людей с бактериемией есть лихорадка, учащенное сердцебиение, озноб, низкое кровяное давление, желудочно-кишечные симптомы (такие как боль в животе, тошнота, рвота и диарея), учащенное дыхание и/или спутанность сознания, — это может свидетельствовать о сепсисе или септическом шоке.
Бактериемия и сепсис часто используются взаимозаменяемо: однако это разные термины. Бактериемия — это термин, обозначающий присутствие бактерий в крови человека. В некоторых ситуациях бактериемия не вызывает каких-либо симптомов и не обязательно представляет серьезную опасность для больных. Например, вероятно, что бактерии локально попадают в кровоток каждый раз, когда мы чистим зубы.
Сепсис — это клиническое заболевание, в которое также входят присутствие бактерий в крови, поэтому его часто путают с бактериемией. Тем не менее, сепсис также имеет клинический компонент и включает воспаление организма с рядом других серьезных симптомов, таких как лихорадка, спутанность сознания и учащенное дыхание.
Диагностика
Если подозревают бактериемию, сепсис или септический шок, врачи обычно собирают образец крови, чтобы сделать анализ в лаборатории. При необходимости врачи могут взять бактерии из других образцов (например, мочи или мокроты).
Лечение бактериемии
Наличие бактерий в крови почти всегда требует лечения антибиотиками. Это связано с тем, что существует высокий уровень смертности от прогрессирования процесса до сепсиса, в случае задержки приема антибиотиков.
Лечение бактериемии следует начинать с эмпирической антибиотической терапии. Любому пациенту с признаками или симптомами бактериемии или положительным посевом крови следует начинать с внутривенного введения антибиотиков. Выбор антибиотика определяется наиболее вероятным источником инфекции и характерными организмами, которые обычно вызывают эту инфекцию.
Другие важные соображения включают прошлый опыт использования антибиотиков пациентом, тяжесть симптомов и любые аллергические реакции на антибиотики. Антибактериальная терапия должна быть сужена, предпочтительно до одного препарата, после возвращения образцов крови с выделенной конкретной бактерией.
Не существует оптимальной продолжительности лечения. В большинстве случаев лечение антибиотиками следует продолжать в течение 7-14 дней и всегда следует вводить парентерально. Пероральные препараты рекомендуются, когда пациенты находятся в состоянии лихорадки не менее 48 часов и в остальном клинически стабильны.
Профилактика
Люди с высоким риском осложнений, вызванных бактериемией (например, с сердечным клапаном или искусственным суставом, определенными нарушениями сердечного клапана), часто получают антибиотики перед процедурами, которые могут вызвать бактериемию. Они назначаются при:
- стоматологических процедурах;
- хирургическом лечение инфицированных ран;
- установки катетера в мочевой пузырь.
Антибиотики помогают предотвратить бактериемию и, следовательно, инфекции и развитие сепсиса.
Прогноз и осложнения
Пациенты с бактериемией, которых лечат антибиотиками и за которыми наблюдают, имеют хорошие результаты. Но редко бактериемия может вызывать эндокардит, остеомиелит, пневмонию, целлюлит (инфекция), менингит, сепсис и полиорганную дисфункцию с последующей смертью.
За последние четыре десятилетия доступность лучших антибиотиков и вакцинация привели к снижению уровня смертности среди людей всех возрастов. До эры вакцинации уровень смертности от бактериемии составлял более 20%. Сегодня наибольшую озабоченность вызывает развитие устойчивости к антибиотикам, которая в настоящее время распространена в отношении большинства организмов.
Бактериемия - выделение микроорганизмов из крови – является одним из возможных, но не обязательных проявлений сепсиса. Отсутствие бактериемии не должно исключить возможность диагноза при наличии обозначенных выше критериев сепсиса. Даже при самом скрупулезном соблюдении техники забора крови и использовании современных микробиологических технологий, даже у самых тяжелых больных частота выявления бактериемии, как правило, не превышает 45%. Обнаружение микроорганизмов в кровотоке у лиц без клинико-лабораторных подтверждений синдрома системного воспаления может расцениваться как транзиторная бактериемия и не быть обусловлено септическим процессом. Однако микробиологические исследования, в том числе крови, при строгом соблюдении техники ее забора и транспортировки являются обязательным компонентом диагностического поиска даже при подозрении о возможности сепсиса. Стойкая гипертермия, озноб, гипотермия, лейкоцитоз, признаки полиорганной дисфункции являются категорическими показаниями для микробиологического исследования крови. Пробы крови необходимо забирать как можно раньше от начали лихорадки, 2 - 3 раза с интервалом в 30-40 мин.
Клиническая значимость регистрации бактериемии может заключаться в следующем:
• подтверждении диагноза и определении этиологии инфекционного процесса;
• доказательстве механизма развития сепсиса (например, катетер-связанная инфекция):
• для некоторых ситуаций аргументации тяжести течения патологического процесса (септический эндокардит, синегнойная и клебсиеллезная инфекции);
• обосновании выбора или смены режима антибиотикотерапии;
• оценке эффективности терапии.
Наличие инфекционного процесса устанавливается на основании следующих признаков:
• обнаружение лейкоцитов в жидких средах организма, которые в норме остаются стерильными;
• перфорация полого органа;
• рентгенографические признаки пневмонии с образование гнойной мокроты;
• другие клинические синдромы, при которых высока вероятность инфекционного процесса.
Достоверный диагноз сепсиса основывается на следующих признаках
1. Клинические проявления инфекции или выделение возбудителя.
3. Лабораторные маркеры системного воспаления [специфичным является повышение в крови уровня прокальцитонина, С-реактивного протеина, а также интерлейкинов (1L)-1, 6, 8, 10 и фактора некроза опухоли (TN F)].
С учетом новой суммы знаний о системном воспалении инфекционной природы была признана необходимость разработки концепции PIRO (табл. 3), которая характеризует предрасположенность к инфекции (P), описывает особенности этиологии и локализации первичного очага (I), системную реакцию организма (R) и наличие органной дисфункции (О).
Таблица 3. Концепция PIRO
| Фактор | Проявления |
| Predisposition (предрасположенность) Infection (инфекция) Response (реакция) Organ dysfunction (органная дисфункция) | Возраст, генетические факторы, сопутствующие Заболевания, иммуносупрессивнаяя терапия и др. Локализация очага инфекции, возбудитель инфекции Клинические проявления инфекционного процесса (температура тела , ЧСС, уровень лейкоцитоза, концентрация прокальцитонина, С-реактивного белка и др.) Для оценки степени органной дисфункции используется шкала SOFA |
Таблица 4. Диагностические критерии сепсиса
| Инфекция, предполагаемая или подтвержденная, в сочетании с несколькими из следующих критериев |
Гипертермия, температура тела выше 38,3°С
Гипотермия, температура тела ниже 36°С
ЧСС ≥ 90 уд/мин (>2 стандартных отклонений от нормального
Необходимость инфузионной поддержки (>20 мл/кг за 24 ч)
Гипергликемия (>7,7 ммоль/л) в отсутствие сахарного диабета
Лейкоцитоз >12х10 9 /л
Сдвиг в сторону незрелых форм (>10%) при нормальном
Содержание С-реактивного белка в крови более 2 стандартных
отклонений от нормы
Содержание прокальцитонина в крови более 2 стандартных
отклонений от нормы
Артериальная гипотензия: САД 70%
Сердечный индекс >3,5 л/мин/м2
Критерии органной дисфункции
Артериальная гипоксемия PaO2/FiO2 60 с или МНО>1,5
Тромбоцитопения 9 /л
Парез кишечника (отсутствие кишечных шумов)
Показатели тканевой гипоперфузии
Гиперлактагемия >1 ммоль/л
Симптом замедленного заполнения капилляров, мраморность
Примечание. АЧТВ — активированное частичное тромбопластиновое время; MHO — международное нормализованное отношение.
В процессе диагностики, в особенности при неустановленном инфекционном очаге, целесообразно ориентироваться на расширенные клинико-лабораторные критерии сепсиса (табл. 3).
Наконец, следует иметь в виду, что взаимодействие каскадов провоспалите-
льных и противовоспалительных медиаторов при любом соотношении тенденций в конечном итоге реализуется в развитии системной мультиорганной дисфункции, клиническая характеристика которой совершенно необходима для лечения тяжелого сепсиса и септического шока ).
Критерии диагноза органно – системной дисфункции / недостаточности/ и общей тяжести состояния больных с сепсисом.
Сепсис с современной точки зрения относится к синдрому системного воспалительного ответа (SIRS), развивающемуся в ответ на действие ЛПС грамотрицательных бактерий (или других компонентов условно–патогенных микроорганизмов) и сопровождающемуся в последствии развитием органно–системных повреждений на дистанции от первичного очага.
Важно выявить ранние симптомы развития сепсиса, чтобы своевременной коррекцией назначений предотвратить его манифестацию, так как известно, что сепсис лучше поддается лечению на ранних стадиях.
Клинические признаки сепсиса общеизвестны, часть их использована в определении SIRS. Лихорадка является главным диагностическим признаком сепсиса. Ее возникновение связывают с повышенным уровнем IL– 1, простогландина Е2. Гипотермия, иногда наблюдающаяся у больных с сепсисом, является неблагоприятным признаком, свидетельствующим либо о нарушении терморегуляции у новорожденных и грудных детей, либо о грубых микроциркуляторных нарушениях.
Инициальный ответ организма на инфекцию индуцирует провоспалительноес состояние с продукцией воспалительных медиаторов: тумор-некротического фактора (TNF– а), интерлейкинов (IL– 1, IL– 6), простагландинов. Для защиты от деструктивного действия избыточных концентраций провоспалительных медиаторов организм выделяет противовоспалительные медиаторы, в частности IL– 4, IL– 10. При сепсисе регуляция раннего ответа на инфекцию утрачивается и наблюдаются массивные системные реакции от избытка провоспалительных медиаторов, что приводит к тканевому повреждению и органной дисфункции.
Процессы воспаления и коагуляции взаимосвязаны. При сепсисе провоспалительные цитокины IL– lα, IL–lβ, TNF–α индуцируют выделение из эндотелиальных клеток и моноцитов тканевого фактора (TF ), являющегося ключевым медиатором между иммунной и свертывающей системами и принципиальным активатором коагуляции. TF взаимодействует с фактором VIIα , формируя VIIα-TF-комплекс, активирующий факторы X и IX. Усиление коагуляции через тромбин– опосредованные процессы сочетается с активацией факторов XI, VIII, V в заключительной стадии и сопровождается образованием значительного количества тромбина. Фибриновые нити формируют клубок с активацией тромбоцитов в местах эндотелиального повреждения с последующим образованием стабильного тромба.
Фибринолитическая система непосредственно вовлекается в септический процесс. У многих больных сепсисом фибринолиз, как нормальный ответ организма для устранения избыточного тромбообразования, угнетается в то время, как активация коагуляции продолжается.
Плазмин, как принципиальный эффектор фибринолиза, образуется тогда, когда тканевой плазминоген – активирующий фактор (t– PA) запускает преобразование плазминогена в плазмин, разрушающий затем нити фибрина с деградацией фибриногена и факторов коагуляции V и VIII.
Угнетает фибринолиз ингибитор активатора плазминогена-1 (PAI– 1) и тромбин – активирующий ингибитор фибринолиза (TAF– 1). У больных сепсисом наблюдается повышение их активности при одновременном снижении активности тканевого плазмин– активирующего фактора, уровней плазминогена и эндогенно активированного протеина С – универсального модулятора воспаления, коагуляции и фибринолиза.
Таким образом, новая парадигма патогенеза сепсиса рассматривает нарушение гомеостаза как результат происходящих одновременно в процессе болезни не контролируемых изменений в каскадах воспаления, коагуляции и фибринолиза с переходом от системного воспалительного ответа к тканевой гипоперфузии, органной дисфункции и полиорганной недостаточности.
Общность патофизиологических механизмов органной недостаточности и сепсиса обусловливает повышенный интерес к феномену системной и органной дисфункции. Выделение на фоне интенсивной терапии полиорганных нарушений – клинического синдрома прогрессирующей, но потенциально обратимой дисфункции двух или более органов (систем) с угрожающими нарушениями гомеостаза, получило название – MODS (Multiple Organ Dysfunction Syndrome ) ]. По современным представлениям полиорганная дисфункция представляет собой конечную стадию SIRS, манифестируемую острыми повреждениями легких.
Сегодня MODS является наиболее частой причиной гибели пациентов реанимационного профиля. Поэтому вопросы его патогенеза, диагностики и лечения представляются чрезвычайно актуальными. Среди причин, вызывающих развитие MODS, хирургический сепсис занимает одно из ведущих мест.
Имеются различные подходы к определению тяжести этого синдрома, которые обычно основаны на оценке количества пораженных органов и систем, и степени функциональных нарушений органов. Как правило , выделяют следующие виды острой органной дисфункции: сердечно - сосудистая, дыхательная, почечная, печеночная, надпочечниковая, синдром диссеминированного внутрисосудистого свертывания и другие (табл.5).
Таблица 5 Клиническиекие и лабораторные критерии органной недостаточности при сепсисе (R. Balk и соавт., 2001)
↑ Септицемия
Септицемия - форма сепсиса, для которой характерны выраженный токсикоз (высокая температура, затемненное сознание), повышенная реактивность организма (гиперергия), отсутствие гнойных метастазов и быстрое течение. Развитие септицемии часто связано со стрептококком.
При вскрытии умерших от септицемии септический очаг, как правило, отсутствует или выражен слабо (входные ворота инфекции не обнаруживаются). Кожа и склеры нередко желтушны (гемолитическая желтуха), отчетливо выражены признаки геморрагического синдрома в виде петехиальной сыпи на коже, кровоизлияний в серозных и слизистых оболочках, во внутренних органах. Характерна гиперплазия лимфоидной и кроветворной зканей. В связи с этим резко увеличиваются селезенка, которая дает обильный соскоб пульпы (септическая селезенка), и лимфатические узлы. В селезенке и лимфатических узлах находят не только пролиферацию лимфоидных и ретикулярных клеток, но и скопления зрелых и незрелых форм клеток гемопоэза. В костном мозге плоских костей и диафизах трубчатых костей отмечается усиленное кроветворение с образованием большого числа юных форм. Появляются также очаги внекостномозгового кроветворения. В паренхиматозных органах - сердце, печени, почках - развивается межуточное воспаление. Строма этих органов отечна и инфильтрирована нейтрофилами, лимфоцитами, гистиоцитами. Для септицемии характерны повышение сосудисто-тканевой проницаемости, развитие фибриноидных изменений стенок сосудов, аллергических васкулитов, с чем в значительной мере связаны проявления геморрагического синдрома.
↑ Септикопиемия
Септикопиемия - форма сепсиса, при котором ведущими являются гнойные процессы в воротах инфекции и бактериальная эмболия ("метастазирование гноя") с образованием гнойников во многих органах и тканях; в отличие от септицемии признаки гиперергии проявляются весьма умеренно, поэтому заболевание не имеет бурного течения. Главная роль в развитии септикопиемии принадлежит стафилококку и синегнойной палочке.
При вскрытии умерших от септикопиемии, как правило, находят септический очаг, обычно расположенный в воротах инфекции, с гнойным лимфангитом и лимфаденитом, причем ткань лимфатического узла нередко подвергается гнойному расплавлению. В области септического очага обнаруживается также гнойный тромбофлебит, который является источником тромбобактериальной эмболии. В связи с тем что источники последней появляются чаще в венах большого круга кровообращения, первые метастатические гнойники появляются в легких. Затем при вовлечении в процесс легочных вен (тромбофлебит легочных вен) гнойники появляются в органах системы большого круга кровообращения - в печени (абсцессы печени), почках (гнойничковый нефрит), подкожной клетчатке, костном мозге (гнойный остеомиелит), в синовиальных оболочках (гнойный артрит), клапанах сердца (острый септический полипозно-язвенный эндокардит). Гнойники могут распространяться на соседние ткани. Например, при абсцессе легкого развиваются гнойный плеврит и перикардит, при метастатическом абсцессе печени - гнойный перитонит; гнойники почки осложняются пери- и паранефритом, гнойники кожи - флегмоной и т. д. Гиперпластические процессы в лимфатической (иммунокомпетентной) и кроветворной тканях выражены слабее, чем при септицемии. Поэтому лимфатические узлы резко не увеличиваются, однако селезенка может быть типично септической, причем в пульпе ее обнаруживается большое число лейкоцитов (септический лейкоцитоз селезенки). В костном мозге омоложение его клеточного состава встречается редко. Межуточные воспалительные реакции в паренхиматозных органах весьма умеренны или отсутствуют.
↑ Хрониосепсис
Хрониосепсис характеризуется наличием длительно не заживающего септического очага и обширных нагноений. Такие септические очаги находят в кариозных зубах, миндалинах, однако чаще ими являются обширные нагноения, возникающие после ранений. Гной и продукты распада тканей всасываются, ведут к интоксикации, нарастающему истощению и развитию амилоидоза. В годы войны случаи хрониосепсиса наблюдались довольно часто. Существует мнение [Давыдовский И. В., 1944], что подобные состояния не являются сепсисом, а представляют собой гнойно-резорбтивную лихорадку, ведущую к травматическому истощению. Изменения в органах и тканях при хрониосепсисе носят в основном атрофический характер. Выражены истощение, обезвоживание. Селезенка уменьшается. В печени, миокарде, поперечно-полосатой мускулатуре обнаруживается бvрая атрофия.
Читайте также:


