Что такое септического шока патогенез
Токсины микроорганизмов, поступая в сосудистое русло, разрушают мембрану клеток ретикуло-эндотелиальной системы печени и легких, тромбоцитов и лейкоцитов. При этом высвобождаются лизосомы, богатые протеолитическими ферментами, приводящие в движение вазоактивные вещества: кинины, гистамин, серотонин, катехоламины.
При шоке первичные расстройства возникают в периферическом кровообращении. Вазоактивные вещества вызывают вазоплегию в капиллярной системе, вследствие чего снижается периферическое сопротивление. (И даже увеличенный сердечный выброс не может компенсировать нарушение капиллярного кровообращения). Умеренно снижается АД. Это первая фаза септического шока — гипердинамическая, в которой, несмотря на довольно высокий периферический кровоток, капиллярная перфузия снижена. В этой стадии в результате снижения периферического сопротивления, рефлекторно возрастает работа сердца, т.е. сердечный выброс. Из-за поражения клеток нарушено усвоение кислорода и энергетических веществ. Возникает гиперактивация тромбоцитарного и прокоагулянтного звеньев гемостаза с развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС) крови. Ранняя фаза шока характеризуется нарушением обменных процессов в тканях.
Происходит периферическая вазоконстрикция с прогрессированием синдрома ДВС крови. Секвестрация крови в системе микроциркуляции приводит к гиповолемии. Приток крови к сердцу значительно уменьшается. Минутный объем сердца, несмотря на резкую тахикардию, не может компенсировать нарастающего нарушения гемодинамики. Наступает стойкое снижение АД — вторая, гиподинамическая, фаза септического шока — нарушения перфузии и оксигенации, вторичные в отношении к регионарной вазоконстрикции и дисфункции миокарда. Прогрессируют гипоксия и тканевый ацидоз, что приводит к поражению тканей и органов.
Наибольшему повреждению при септическом шоке подвергаются легкие, печень, почки, мозг, желудочно-кишечный тракт, кожа. Некротические изменения в жизненно важных органах могут происходить через 6–8 часов после начала функциональных расстройств.
Углубление тканевого ацидоза, микротромбоз легочных сосудов, недостаточная продукция сурфактанта ведут к возникновению интраальвеолярного отека легких, микроателектазов, гиалиновых мембран. В результате развивается острая дыхательная недостаточность (ОДН), которую называют респираторным дистресс-синдромом взрослых.
О поражении печени при шоке свидетельствует увеличение в крови количества специфических ферментов и гипербилирубинемия.
Нарушение микроциркуляции с участками тромбозов и кровоизлияний наблюдается в аденогипофизе и диэнцефальной области.
Спазмы и микротромбозы в сосудах кишечника и желудка приводят к образованию эрозий и язв.
Отмечаются экстравазаты и некротические поражения кожи в связи с нарушением микроциркуляции.
Под действием токсинов при септическом шоке возникает коагулопатия: происходит активация коагуляционного каскада, агрегация тромбоцитов с последующим отложением фибрина в мелких сосудах и развитием синдрома ДВС крови. Также ранним клиническим симптомом сепсиса является тромбоцитопения.
КЛИНИКА
Септический (инфекционно-токсический) шок наступает остро. Развитию шока предшествует гипертермия. Температура повышается до 39–41 °С с повторными ознобами, держится около 1–3 суток, затем критически падает на 2–4 °С до субфебрильных, нормальных или субнормальных цифр.
Основной признак септического шока — резкое снижение артериального давления без предшествующей кровопотери либо несоответствующее ей. АД на уровне 80–90 мм рт.ст. держится недолго — от 15–30 минут до 1–2 часов, реже — до 6–12 часов. Это — гипердинамическая (теплая) фаза. Иногда она остается незамеченной.
Клиника шока часто наслаивается симптомами острой почечной недостаточности: олигурия, азотемия, анурия. Затем присоединяются брадикардия, аритмия, возможны клонические судороги и остановка сердца.
Некоторые исследователи выделяют третью фазу — необратимый шок, для которой характерны: анурия, сердечно-сосудистая и дыхательная недостаточность, кома.
Септический шок представляет смертельную опасность, поэтому важна своевременная и ранняя его диагностика. Фактор времени при шоке играет решающую роль, ибо необратимые изменения в организме наступают чрезвычайно быстро: в пределах от 6 до12 часов.
ДИАГНОСТИКА
Диагноз устанавливается на основании следующих клинических проявлений. В случае развития тяжелого сепсиса наблюдается:
— тромбоцитопения 9 /л, которую невозможно объяснить другими причинами;
— повышение уровня С-реактивного белка;
— повышение уровня прокальцитонина > 6,0 нг/мл;
— положительный посев крови с выявлением циркулирующих микроорганизмов;
— положительный тест на эндотоксин (LPS-тест).
Диагноз септического шока устанавливается, если к вышеперечисленным клинико-лабораторным признакам присоединяются:
— артериальная гипотензия (систолическое давление меньше 90 мм рт.ст. или сниженное более чем на 40 мм рт.ст. от исходного уровня);
— тахикардия больше 100 уд/мин;
— тахипноэ больше 25 в мин;
— нарушение сознания (менее 13 баллов по шкале Глазго);
— олигурия (диурез меньше 30 мл/ч);
— гипоксемия (РаО2 меньше 75 мм рт.ст. при дыхании атмосферным воздухом);
— SpО2 12 000/мл, в отдельных случаях может отмечаться лейкемоидная реакция с количеством лейкоцитов до 50–100 тыс. и выше; иногда может встречаться лейкопения;
— морфологические изменения нейтрофилов включают токсичную зернистость, появление телец Доле и вакуолизацию;
— тромбоцитопению, лимфопению.
ЛЕЧЕНИЕ
Основные принципы интенсивной терапии септического шока:
1. Немедленная госпитализация в отделение интенсивной терапии.
2. Коррекция гемодинамических нарушений путем проведения инотропной терапии и адекватной инфузионной терапии с постоянным мониторингом гемодинамики.
3. Поддержание адекватной вентиляции и газообмена.
4. Хирургическая санация очага инфекции.
5. Нормализация функции кишечника и раннее энтеральное питание.
6. Своевременная коррекция метаболизма под постоянным лабораторным контролем.
7. Антибактериальная терапия под постоянным микробиологическим контролем.
8. Антимедиаторная терапия.
Основной целью инфузионной терапии у септических больных является поддержание адекватного кровоснабжения тканей. Объем инфузионной терапии в случае септического шока определяется комплексной оценкой реакции гемодинамики на инфузию (реакция АД, особенно пульсового АД, ЦВД, ЧСС, скорость диуреза). Особое значение в этих случаях имеет определение ЦВД в динамике. Ориентиром является проверка реакции ЦВД на дозированное введение жидкости (проба с объемной нагрузкой). Больной в течение 10 минут вводят внутривенно тест-дозу жидкости (табл. 1) и оценивают реакцию гемодинамики.

Реакцию гемодинамики оценивают следующим образом. Если ЦВД увеличилось больше чем на 5 см вод.ст., то инфузию прекращают и проводят инотропную поддержку. Если ЦВД увеличилось не больше чем на 2 см вод.ст., то продолжают инфузионную терапию без инотропной поддержки.
Рекомендована следующая программа инфузионной терапии в случае септического шока.
Сначала жидкость вводят со скоростью 10 мл/мин на протяжении 15–20 мин, а потом — в обычном темпе, в зависимости от показателей гемодинамики, дыхания, диуреза и прочего.
Для проведения инфузии применяют производные гидроксиэтилкрахмала (венофундин, рефортан, ХАЕС-стерил) и кристаллоиды (0,9% раствор хлорида натрия, раствор Рингера) в соотношении 1 : 2. В отличие от других коллоидов растворы гидроксиэтилкрахмала уменьшают степень повреждения эндотелия капилляров, улучшают функцию легких и уменьшают проявления системной воспалительной реакции.
Для коррекции гипопротеинемии назначают концентрированные 20–25% растворы альбумина. Применение 5% раствора альбумина при критических состояниях способствует повышению летальности больных.
Включение в состав трансфузионных сред глюкозы нецелесообразно. Назначение глюкозы больным в критическом состоянии повышает продукцию лактата и СО2, а также увеличивает ишемические повреждения головного мозга и других тканей. Инфузия глюкозы оправдана только в случаях гипогликемии и гипернатриемии.
В состав инфузионных сред целесообразно включать свежезамороженную плазму (600–1000 мл), которая является донатором антитромбина. Антитромбин является ингибитором активации лейкоцитов и предотвращает повреждение эндотелия сосудов, благодаря чему уменьшаются проявления системного воспалительного ответа и эндотоксемии. Кроме того, введение свежезамороженной плазмы необходимо также для лечения ДВС-синдрома, который, как правило, развивается при прогрессировании септического шока.
Наряду с симпатомиметиками оправдано одновременное применение налоксона до 2,0 мг, который повышает артериальное давление, учитывая роль β-эндорфинов в патогенезе септического шока.
При неэффективности комплексной гемодинамической терапии рационально применение глюкокортикостероидов. Эквивалентной дозой (в перерасчете на гидрокортизон) является 2000 мг/сут. С целью профилактики эрозивных повреждений желудка введение глюкокортикостероидов необходимо комбинировать с Н2-блокаторами (ранитидин, фамотидин) .
Поддержка адекватной вентиляции и газообмена у пациентов с септическим шоком проводится следующим образом. В тяжелых случаях дыхательной недостаточности на фоне прогрессирования полиорганной дисфункции необходимо немедленно решать вопрос о переведении больной на ИВЛ.
Показания к ИВЛ:
— РаО2 50 мм рт.ст. или
Используйте навигацию по текущей странице
Септический шок — это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока.
Причины и патогенез развития септического шока:
Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать.
Тому причинами являются:
1. Все более широкое использование для интенсивной терапии инвазивных устройств, то есть внутрисосудистых катетеров и др.
2. Распространенное применение цитотоксических и иммуносупрессивных средств (при злокачественных заболеваниях и трансплантациях), которые вызывают приобретенный иммунодефицит.
3. Рост продолжительности жизни больных сахарным диабетом и злокачественными опухолями, у которых высок уровень предрасположенности к сепсису.
Бактериальная инфекция — это наиболее частая, причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60% больных в состоянии септического шока. У 10-30% больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии — это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация.
В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов, взаимодействия клеток и молекул систем врожденного иммунитета и, соответственно, иммуно-компетентных клеток.
Сепсис, системная воспалительная реакция и септический шок — это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия — это патологический рост содержания в крови агентов ауто- паракриннои регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции.
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов.
Критический дефицит эффекторов обуславливает множественную системную недостаточность.
Симптомы и признаки септического шока:
О развитии системной воспалительной реакции говорит наличие двух или более следующих признаков:
• Температура тела более высокая, чем 38 о С, или на уровне ниже 36 о С.
• Частота дыханий выше 20/минуту. Дыхательный алкалоз при напряжении углекислого газа в артериальной крови ниже 32 мм рт. ст.
• Тахикардия при частоте сердечных сокращений большей 90/минуту.
• Нейтрофилия при росте содержания полиморфноядерных лейкоцитов в крови до уровня выше 12х10 9 /л, или нейтропения при содержании нейтрофилов в крови на уровне ниже 4х10 9/ л.
• Сдвиг лейкоцитарной формулы, при котором палочкоядерные нейтрофилы составляют более 10% общего числа полиморфноядерных лейкоцитов.
О сепсисе свидетельствуют два или более признаков системной воспалительной реакции при подтвержденном данными бактериологических и других исследований наличии патогенных микроорганизмов во внутренней среде.
Течение септического шока
При септическом шоке гиперцитокинемия повышает активность синтетазы оксида азота в эндотелиальных и других клетках. В результате снижается сопротивление резистивных сосудов и венул. Снижение тонуса данных микрососудов уменьшает общее периферическое сосудистое сопротивление. Часть клеток организма при септическом шоке страдает от ишемии, обусловленной расстройствами периферического кровообращения. Расстройства периферического кровообращения при сепсисе и септическом шоке — это следствия системной активации эндотелиоцитов, полиморфоядерных нейтрофилов и мононуклеарных фагоцитов.
Воспаление данного генеза имеет сугубо патологический характер, происходит во всех органах и тканях. Критическое падение числа структурно-функциональных элементов большинства органов-эффекторов составляет основное звено патогенеза так называемой множественной системной недостаточности.
Согласно традиционным и верным представлениям, сепсис и системную воспалительную реакцию вызывает патогенное действие грамотрицательных микроорганизмов.
В возникновении системной патологической реакции на инвазию во внутреннюю среду и кровь грамотрицательных микроорганизмов определяющую роль играют:
• Эндотоксин (липид А, липополисахарид, ЛПС). Этот термостабильный липополисахарид составляет наружное покрытие грамотрицательных бактерий. Эндотоксин, воздействуя на нейтрофилы, вызывает высвобождение полиморфноядерными лейкоцитами эндогенных пирогенов.
• ЛПС-связывающий белок (ЛПССБ), следы которого определяют в плазме в физиологических условиях. Данный протеин образует с эндотоксином молекулярный комплекс, циркулирующий с кровью.
• Рецептор клеточной поверхности мононуклеарных фагоцитов и эндотелиальных клеток. Его специфическим элементом является молекулярный комплекс, состоящий из ЛПС и ЛПССБ (ЛПС-ЛПССБ).
В настоящее время растет частота сепсиса, обусловленного инвазией во внутреннюю среду грамположительных бактерий. Индуцирование сепсиса грамположительными бактериями обычно не связано с высвобождением ими эндотоксина. Известно, что предшественники пептидогликана и другие компоненты стенок грамположительных бактерий вызывают высвобождение клетками систем иммунитета фактора некроза опухолей-альфа и интерлейкина-1. Пептидогликан и другие компоненты стенок грамположительных бактерий активируют систему комплемента по альтернативному пути. Активация системы комплемента на уровне всего организма вызывает системное патогенное воспаление и вносит свой вклад в эндотоксикоз при сепсисе и системной воспалительной реакции.
Ранее считалось, что септический шок всегда вызывается эндотоксином (липополисахаридом бактериального происхождения), который высвобождается грамотрицательными бактериями. Теперь общепризнанным является тот факт, что менее чем в 50% случаев септический шок вызывается грамположительными возбудителями.
Расстройства периферического кровообращения при септическом шоке, адгезия активированных полиморфоядерных лейкоцитов к активированным эндотелиоцитам — все это ведет к выходу нейтрофилов в интерстиций и воспалительной альтерации клеток и тканей. Одновременно эндотоксин, фактор некроза опухолей-альфа, а также интерлейкин-1 повышают образование и высвобождение эндотелиальными клетками тканевого фактора свертывания. В результате активируются механизмы внешнего гемостаза, что вызывает отложение фибрина и диссеминированное внутрисосудистое свертывание.
Артериальная гипотензия при септическом шоке в основном представляет собой следствие снижения общего периферического сосудистого сопротивления. Гиперцитокинемия и рост концентрации в крови оксида азота при септическом шоке обуславливает расширение артериол. При этом посредством тахикардии компенсаторно растет минутный объем кровообращения. Артериальная гипотензия при септическом шоке возникает, несмотря на компенсаторный рост минутного объема кровообращения. Общее легочное сосудистое сопротивление при септическом шоке растет, что можно отчасти связать с адгезией активированных нейтрофилов к активированным эндотелиоцитам легочных микрососудов.
Выделяют следующие основные звенья патогенеза расстройств периферического кровообращения при септическом шоке:
1)рост проницаемости стенки микрососудов;
2) рост сопротивления микрососудов, который усиливается клеточной адгезией в их просвете;
3) низкая реакция микрососудов на вазодилатирующие влияния;
4) артериоло-венулярное шунтирование;
5) падение текучести крови.
Гиповолемия — это один из факторов артериальной гипотензии при септическом шоке.
Выделяют следующие причины гиповолемии (падения преднагрузки сердца) у больных в состоянии септического шока:
1) дилатация емкостных сосудов;
2) потеря жидкой части плазмы крови в интерстиций из-за патологического роста проницаемости капилляров.
Можно считать, что у большинства больных в состоянии септического шока падение потребления кислорода организмом преимущественно обусловлено первичными нарушениями тканевого дыхания. При септическом шоке умеренный лактатный ацидоз развивается при нормальном напряжении кислорода в смешанной венозной крови.
Лактатный ацидоз при септическом шоке считают следствием снижения активности пируватдегидрогеназы и вторичной аккумуляции лактата, а не падения тока крови на периферии.
Расстройства периферического кровообращения при сепсисе носят системный характер и развиваются при артериальной нормотензии, которую поддерживает рост минутного объема кровообращения. Системные нарушения микроциркуляции проявляют себя снижением рН в слизистой оболочке желудка и падением насыщения кислородом гемоглобина крови в печеночных венах. Гипоэргоз клеток кишечного барьера, действие иммуносупрессивных звеньев патогенеза септического шока — все это снижает защитный потенциал кишечной стенки, что служит еще одной из причин эндотоксемии при септическом шоке.
Диагноз септического шока
- Септический шок - сепсис (синдром системной воспалительной реакции плюс бактериемия) в сочетании со снижением АД сист. менее 90 мм рт. ст. при отсутствии видимых причин для артериальной гипотензии (дегидратация, кровотечение). Наличие признаков гипоперфузии тканей несмотря на проведение инфузионной терапии. Перфузионные нарушения включают ацидоз, олигурию, острые нарушения сознания. У пациентов, получающих инотропные препараты, перфузионные нарушения могут сохраняться при отсутствии артериальной гипотензии.
- Рефрактерный септический шок - септический шок, продолжающийся более одного часа, рефрактерный к инфузионной терапии.
Лечение септического шока:
1. Инфузионная терапия
- Катетеризация двух вен.
- 300-500 мл раствора кристаллоидов в/в в виде болюса, затем 500 мл раствора кристаллоидов в/в капельно в течение 15 минут. Оценить венозную гипертензию и наличие сердечной декомпенсации.
- При наличии сердечной недостаточности целесообразна катетеризация a. pulmonalis катетером Swan-Ganz для оценки волемического статуса: оптимальное PCWP = 12 мм рт. ст. при отсутствии ОИМ и 14-18 мм рт. ст. при наличии ОИМ;
- если после инфузионного болюса величина PCWP превысит 22 мм рт. ст., то следует предположить прогрессирование сердечной недостаточности и прекратить активную инфузию кристаллоидов.
- Если, несмотря на высокие значения давления заполнения левого желудочка, артериальная гипотензия сохраняется - допамин 1-3-5 и более мкг/кг/мин, добутамин 5- 20 мкг/кг/мин.
- Бикарбонат натрия в расчетной дозе с целью коррекции метаболического ацидоза.
2. Терапия гипоксемии/РДСВ - оксигенотерапия, ИВЛ с использование PEEP.
3. Терапия сниженной контрактильной способности миокарда - строфантин К 0,5 мг 1-2 раза в сутки в/в в 10-20 мл 5- 20 %-ного раствора глюкозы или физиологического раствора; дигоксин 0,25 мг 3 раза в сутки per os в течение 7- 10 суток, затем 0,25-0,125 мг в сутки; добутамин 5- 20 мкг/кг/мин в/в.
6. Эмпирическая антибиотикотерапия (учитывается локализация источника септического процесса и предполагаемый спектр возможных микроорганизмов).
7. Хирургическое дренирование очагов инфекции.
8. Препараты, эффективность которых не подтверждена:
Септический шок связан с тяжелыми гемодинамическими нарушениями, поэтому данный тип шока опишем более подробно. Уровень смертности от септического шока достигает 20%. Септический шок стоит первым в списке причин смерти в отделениях реанимации и ежегодно в США уносит жизни около 200 тыс. человек.
Кроме того, продолжающийся рост частоты септических синдромов объясняется улучшением жизнеобеспечения больных с высоким риском смерти, увеличением количества инвазивных процедур и растущим числом иммунонекомпетентных пациентов (из-за химиотерапии, иммуносупрессии или ВИЧ-инфекции).
При септическом шоке системная вазодилатация и сброс крови приводят к развитию гипоперфузии периферических тканей даже при сохранном или увеличенном сердечном выбросе. Это сопровождается генерализованной активацией и повреждением эндотелия, что часто заканчивается развитием состояния гиперкоагуляции, которое манифестирует ДВС.
Кроме того, септическому шоку сопутствуют изменения метаболизма, которые напрямую подавляют клеточные функции. Конечный эффект этих изменений — гипоперфузия и мультиорганная дисфункция, приводящие к высокой смертности, связанной с развитием сепсиса.
Способность различных микроорганизмов вызывать септический шок (иногда при наличии инфекции только в одном участке тела) согласуется с фактом инициации процесса несколькими микробными компонентами. Макрофаги, нейтрофилы и другие клетки системы врожденного иммунитета экспрессируют множество рецепторов, которые отвечают на разные продукты микроорганизмов.
После активации эти клетки высвобождают медиаторы воспаления и различные факторы иммуносупрессии, которые изменяют ответ организма-хозяина. Кроме того, продукты микроорганизмов активируют гуморальные элементы врожденного иммунитета, особенно системы комплемента и коагуляции. Эти медиаторы и комплексное прямое воздействие на эндотелиальные клетки, оказываемое продуктами микроорганизмов, вызывают септический шок.

Основные факторы патофизиологических механизмов септического шока:
- медиаторы воспаления. Различные компоненты стенки клетки микроорганизма связываются с поверхностными рецепторами нейтрофилов, мононуклеарных клеток воспаления и эндотелиоцитов, вызывая их активацию. TLR распознают элементы микроорганизмов и запускают ответ, который инициирует сепсис. Тем не менее мыши с генетической недостаточностью TLR все еще умирают от сепсиса, поэтому считается, что есть и другие пути инициации септической реакции у человека (например, через G-белок-связанные рецепторы, которые распознают бактериальные пептиды и нуклеотиды олигомеризационного домена белков 1 и 2 [NOD1, NOD2]).
Во время активации клетки воспаления продуцируют TNF, IFN-y, IL-1, IL-12 и IL-18, а также другие медиаторы воспаления, например белок HMGB1. В этом процессе принимают участие и АФК, и липидные медиаторы, такие как простагландины и PAF. Эти эффекторные молекулы активируют эндотелиальные клетки (и другие типы клеток), приводя к экспрессии молекул адгезии, прокоагулянтному фенотипу и продукции цитокинов второй волны. Продукты микроорганизмов активируют каскад системы комплемента напрямую и через протеолитическую активность плазмина, приводя к продукции анафилотоксина (С3а, С5а), хемотаксических фрагментов (С5а) и опсонинов (С3b), которые запускают провоспалительную реакцию.
Кроме того, такие продукты микроорганизмов, как эндотоксин, могут активировать коагуляцию прямым воздействием на фактор XII и опосредованно через измененную функцию эндотелия. Системное прокоагулянтное состояние, вызванное сепсисом, не только приводит к тромбозу, но и усиливает воспаление через расположенные на клетках воспаления рецепторы, активируемые протеазами;
- активация и повреждение эндотелиоцитов. Активация эндотелиоцитов и выброс лейкоцитарных медиаторов воспаления могут привести к тромбозу, повышению сосудистой проницаемости и вазодилатации. У 50% септических пациентов нарушение коагуляции грозит развитием опасного осложнения — ДВС-синдрома. Сепсис меняет экспрессию многих факторов для усиления коагуляции.
Провоспалительные цитокины вызывают повышение продукции тканевого фактора эндотелиальными клетками (а также моноцитами), в то же время сдерживая фибринолиз, повышая экспрессию ингибитора-1 активатора плазминогена. Продукция других эндотелиальных факторов коагуляции, например ингибитора пути тканевого фактора, тромбомодулина и С-белка, падает.
Прокоагулянтная тенденция усугубляется уменьшением периферического кровотока, стазом и снижением вымывания активированных факторов коагуляции. Совместное действие этих факторов приводит к накоплению тромбов, богатых фибрином, что также способствует гипоперфузии тканей. При развившемся ДВС-синдроме наблюдается значительный расход факторов коагуляции и тромбоцитов, вследствие чего возникает их дефицит, ведущий к кровотечениям и кровоизлияниям.
Повышение сосудистой проницаемости ведет к экссудации жидкости в интерстиций с отеком и повышением давления интерстициальной жидкости, что в дальнейшем препятствует кровотоку в тканях, особенно у пациентов на искусственной вентиляции легких.
Эндотелий тоже повышает экспрессию iNOS и продукцию NO. Эти изменения вместе с повышением концентрации вазоактивных медиаторов воспаления (например, С3а, С5а и PAF) вызывают системную релаксацию гладких мышц сосудов, ведущую к гипотензии и снижению перфузии тканей;
- метаболические изменения. Септическое состояние сопровождается инсулиновой резистентностью и гипергликемией. Цитокины (например, TNF и IL-1), стресс-индуцированные гормоны (например, глюкагон, гормон роста и глюкокортикостероиды), а также катехоламины усиливают глюкогенез. В то же время провоспалительные цитокины подавляют высвобождение инсулина, одновременно усиливая инсулиновую резистентность в печени и других тканях, в большей степени снижая экспрессию GLUT-4, являющегося транспортером глюкозы.
Гипергликемия ведет к снижению функции нейтрофилов (тем самым ослабляя их бактерицидную активность) и вызывает повышенную экспрессию молекул эндотелиальной адгезии. Тем не менее сепсису сначала сопутствует резкий подъем продукции глюкокортикостероидов. Данная фаза часто сопровождается недостаточностью надпочечников и функциональным дефицитом глюкокортикостероидов. Эта фаза может начаться с депрессии способности к синтезу интактных надпочечников или выраженного некроза надпочечников вследствие ДВС-синдрома (синдром Уотерхауса-Фридериксена);
- иммуносупрессия. Гипервоспалительная реакция, вызванная сепсисом, может активировать иммуносупрессивные механизмы обратной связи, которые могут вовлекать адаптационные механизмы и врожденного, и приобретенного иммунитета. Предположительными механизмами иммунной супрессии могут быть смена провоспалительных цитокинов (Тh1-клеток) на противовоспалительные (Тh2-клетки), продукция противовоспалительных медиаторов (например, растворимого рецептора TNF, антагониста рецептора IL-1 и IL-10), лимфоцитарный апоптоз, иммуносупрессивные действия апоптозных клеток и индукция клеточной анергии. До сих пор непонятно, каким свойством обладают иммуносупрессивные медиаторы при сепсисе: разрушающим или протективным;
- органная дисфункция. Системная гипотензия, интерстициальный отек и тромбоз мелких сосудов снижают доставку кислорода и питательных веществ к тканям, которые не могут нужным образом использовать питательные вещества вследствие изменения клеточного метаболизма. Высокие уровни цитокинов и вторичных медиаторов могут снизить сократимость миокарда и сердечный выброс и повысить сосудистую проницаемость, а повреждение эндотелия — привести к развитию респираторного дистресс-синдрома взрослых. В итоге эти факторы могут вызвать полиорганную недостаточность, включая почки, печень, легкие и сердце, что может стать причиной смерти.
Назначение активированного С-белка в целях профилактики образования тромбина и снижения коагуляции и воспаления в некоторых случаях при тяжелом сепсисе может быть полезным, но это спорно. Даже в лучших клиниках септический шок остается сложной клинической ситуацией.
Дополнительная группа бактериальных белков-суперантигенов тоже вызывает синдром, близкий к септическому шоку (например, синдром токсического шока). Суперантигены — это поликлональные активаторы Т-лимфоцитов, которые вызывают высвобождение большого количества цитокинов, что приводит к развитию разных клинических симптомов, начиная от диффузной крапивницы до вазодилатации, а также к гипотензии и в конечном итоге к летальному исходу.
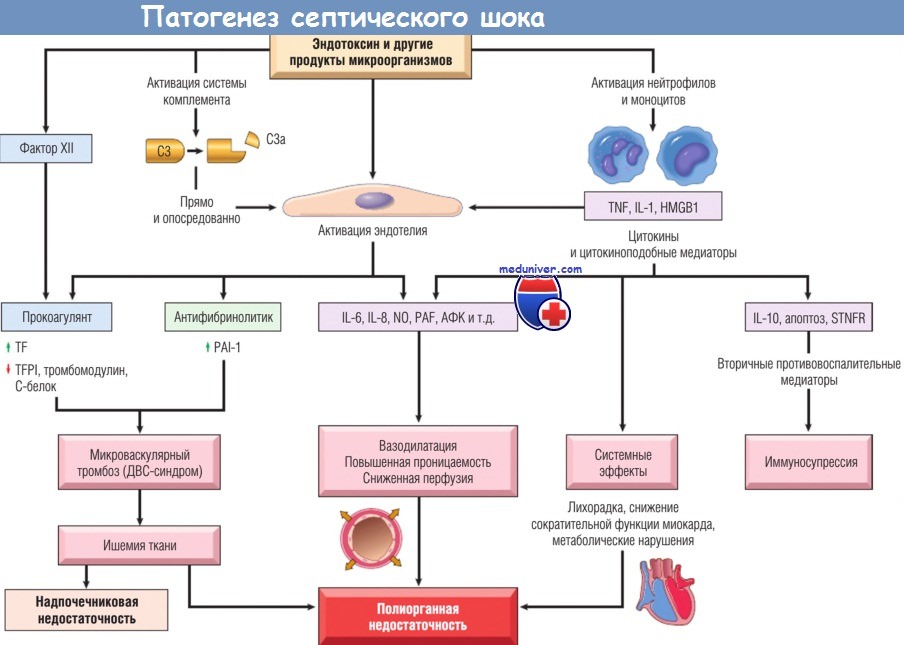
Основные патогенетические пути септического шока.
Продукты микроорганизмов активируют эндотелиальные клетки, а также клеточные и гуморальные элементы врожденного иммунитета,
инициируя цепь событий, приводящих к последней стадии — полиорганной недостаточности.
HMGB1 — белок из высокомобильной группы 1; IL — интерлейкин; NО — оксид азота;
PAF — фактор активации тромбоцитов; PAI — ингибитор активатора плазминогена; STNFR — растворимый рецептор фактора некроза опухоли;
TF — тканевый фактор; TFPI — ингибитор пути тканевого фактора; TNF — фактор некроза опухоли;
АФК — активные формы кислорода; ДВС — диссеминированное внутрисосудистое свертывание.
- Рекомендуем ознакомиться со следующей статьей "Стадии шока, их морфология и клиника"
Читайте также:


