Диагностические среды для возбудителя сибирской язвы
Глава 30. Возбудитель сибирской язвы
Возбудитель сибирской язвы Bacillus anthracis включен в семейство Bacillaceae, род Bacillus. Название болезни - "углевик" дано русским врачом Андриевским, который в конце XVIII века изучал это заболевание в Сибири во время большой эпизоотии среди коров.
Возбудитель сибирской язвы был открыт Паллендером в 1849 г. Большой вклад в изучение этого заболевания внесли Р. Кох, Л. Пастер и Л. С. Ценковский.
Морфология. Возбудители сибирской язвы - крупные палочки 6-8 × 1-1,5 мкм с обрубленными или несколько вогнутыми концами. Грамположительны. В организме они располагаются попарно или в виде коротких цепочек. На питательных средах встречаются длинные цепочки. Бациллы сибирской язвы неподвижны. В организме образуют капсулу, окружающую одну, две особи или всю цепочку. Бациллы сибирской язвы образуют споры овальной формы, расположенные в центре и не превышающие поперечника микробной клетки. Спорообразование лучше всего происходит при доступе кислорода и температуре 30-40° С. При температуре выше 43° С и ниже 15° С спорообразование прекращается. В период образования спор цитоплазма клетки почти полностью лизируется, клеточная стенка разрывается и спора выходит наружу (рис. 47).
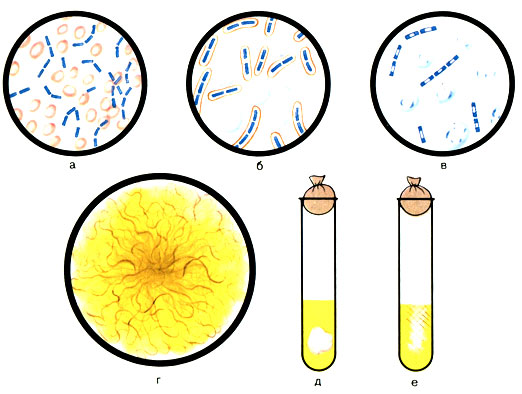
Рис. 47. Морфологические и культуральные свойства возбудителя сибирской язвы (Bacillus anthracis). а - В. anthracis (в крови мыши); б - образование капсул; в - споры; г - рост колонии; д - рост культуры на МПБ; е - рост культуры на желатине
Культивирование. Возбудители сибирской язвы - факультативные анаэробы. Неприхотливы. Растут при температуре 35-38° С и рН среды 7,2-7,6. На МПА образуют крупные колонии с неровными бахромчатыми краями (R-форма). От края колонии отходят пучки нитей. Вид колоний напоминает голову медузы или львиную гриву. R-форма является характерной для вирулентных штаммов сибиреязвенных бацилл. В старых культурах появляются гладкие S-формы колоний - не вирулентные.
В бульоне рост сибиреязвенных бацилл характеризуется придонным ростом. На дне пробирки образуется осадок в виде комка ваты, при этом среда остается прозрачной.
При посеве на 10-12% желатин после 2-3-дневной инкубации появляется рост по ходу укола в виде белых тяжей, уменьшающихся книзу (вид опрокинутой елочки).
При посеве возбудителей на МПА с пенициллином (на пластинчатом агаре) наблюдается распад бацилл на шары, цепь из которых напоминает жемчужное ожерелье. Характер роста на средах имеет диагностическое значение (см. рис. 47).
Ферментативные свойства. Сибиреязвенные бациллы обладают выраженной ферментативной активностью. Сахаролитические свойства: расщепляют глюкозу, лактозу, мальтозу, левулезу и другие сахара до образования кислоты.
Протеолитические свойства выражаются в пептонизации молока, разжижении желатина, свертывании молока (медленно). Они образуют сероводород и аммиак, переводят нитраты в нитриты, гидролизируют крахмал и т. д. Не гемолизируют эритроциты, чем отличаются от Вантракоида. Лизируются противосибиреязвенным фагом. Сибиреязвенные бациллы образуют ферменты: диастазу, пероксидазу, липазу.
Токсинообразование. В. anthracis образует токсин - протеиновый комплекс, содержащий отечный и летальные факторы. Этот токсин называют "мышиный токсин" (ввиду высокой чувствительности мышей). Большая роль в вирулентности сибиреязвенных бацилл принадлежит капсуле, которая связана с токсическим веществом.
Антигенная структура. Бациллы сибирской язвы содержат два антигена: 1) соматический (полисахаридный), который находится в клеточной стенке микроба. Термоустойчив. Против этого антигена антитела не продуцируются. Этот антиген длительно сохраняется в культурах и трупном материале. На его обнаружении основана реакция преципитации Асколи; 2) капсульный (протеиновый) антиген, обусловливающий антифагоцитарное действие.
Находясь в организме или на средах, содержащих экстракты тканей, бациллы сибирской язвы вырабатывают протективный термолабильный антиген, который является атоксичным, но обладает иммунизирующей способностью.
У сибиреязвенных бацилл имеется общий антиген с антракоидом и другими спорообразующими сапрофитами (В subtilis, B. cereus и др.).
Устойчивость к факторам окружающей среды. Вегетативные формы возбудителей сибирской язвы малоустойчивы. При 100° С они погибают мгновенно, температура 55-60° С губит их через 30-40 мин. Обычные концентрации дезинфицирующих растворов убивают их через несколько минут. Капсулы сибиреязвенных бацилл обладают большой устойчивостью. При исследовании трупов животных, подвергнутых действию гнилостной микрофлоры, можно обнаружить пустые капсулы (тени). Споры устойчивы: они выдерживают кипячение на протяжении 15-20 мин. Автоклавирование (120° С) убивает их через 20 мин. К низким температурам не чувствительны. В сухом состоянии сохраняются до 30 лет, в почве - десятилетия.
Обычные растворы дезинфицирующих веществ губят их через 2-3 сут (табл. 46).
Таблица 46. Свойства возбудителей сибирской язвы
Примечание. B. anthracoides обладают слабой подвижностью, вызывают гемолиз эритроцитов, непатогенны для морских свинок.
Восприимчивость животных. К сибиреязвенным бациллам чувствительны коровы, овцы, лошади, олени, свиньи. Заражаются они друг от друга пищевым путем, поглощая с кормом споры возбудителя.
Из лабораторных животных наиболее восприимчивы белые мыши, морские свинки, кролики. Эти животные после заражения погибают через 2-4 сут от септицемии. На месте введения наблюдаются отек и гиперемия. Кровь у погибших животных густая и темно-красного цвета, так как сибиреязвенные бациллы обладают антикоагулирующим действием.
Источники заболевания. Больные животные.
Пути передачи. Контактно-бытовой, воздушно-пыльевой, пищевой (при использовании продуктов, зараженных бациллами сибирской язвы).
Человек от человека обычно не заражается, тем не менее при заболевании человека сибирской язвой принимаются все необходимые меры предосторожности.
Патогенез. Входными воротами являются кожа и слизистые оболочки дыхательных путей и пищеварительного тракта. В зависимости от локализации различают кожную, легочную и кишечную формы. Каждая форма может генерализоваться.
Кожная форма - в месте проникновения появляется покраснение, переходящее в папулу (зудящую). Папула медно-красного цвета переходит в везикулу с серозно-геморрагическим содержимым, после подсыхания образуется черный струп (углевик).
Легочная форма - развивается специфическая пневмония, протекающая по типу отека легких. Обычно заканчивается летально.
Кишечная форма - все вышеописанные явления развиваются в слизистой кишечника. Обычно заканчивается летально.
Иммунитет. Довольно стойкий, антимикробный и антитоксический. Зависит от образования протективных антител. Большая роль принадлежит фагоцитарной реакции. В сыворотке переболевших сибирской язвой обнаруживаются антитела, разрушающие капсульную субстанцию бацилл.
При сибирской язве развивается гиперчувствительность, регистрируемая в аллергической пробе с антраксином.
Профилактика. Все мероприятия по предупреждению сибирской язвы проводят совместно с ветеринарной службой Они предусматривают своевременное выявление, изоляцию больных животных, тщательную дезинфекцию территории.
Специфическая профилактика. В настоящее время используют вакцину СТИ, которая была изготовлена в 1942 г. Н. Н. Гинсбургом из бескапсульной культуры. Вакцинируют обычно людей, которые по характеру своей работы связаны с сельскохозяйственными животными. Для экстренной профилактики (людям, контактировавшим с больными) вводят противосибиреязвенный иммуноглобулин и антибиотики.
Лечение. Противосибиреязвенный иммуноглобулин, антибиотики: пенициллин, стрептомицин, тетрациклин.
1. Опишите морфологию возбудителя сибирской язвы.
2. Опишите культуральные свойства и какая форма: S или R является вирулентной?
3. Какими свойствами обладает сибиреязвенный токсин?
4. Пути передачи и формы заболевания сибирской язвой.
5. Какие факторы обусловливают иммунитет при сибирской язве.
Цель исследования: выявление возбудителей сибирской язвы и дифференциация его от антракоида, выявление антигенов возбудителя.
Работа с возбудителем сибирской язвы проводится в строго режимных условиях!
1. Содержимое везикул, карбункула, отторгнутый струп (кожная форма).
2. Мокрота (легочная форма).
3. Испражнения (кишечная форма).
4. Кровь (септическая форма).
5. Почва, шерсть животных (для постановки реакции Асколи).

Способы сбора материала
5. Реакция преципитации Асколи.

Первый день исследования
1. Посевы вынимают из термостата. Изучают рост на плотной и жидкой питательной среде. Колонии на плотной питательной среде изучают под микроскопом при малом увеличении. При наличии подозрительных колоний выделяют чистую культуру на скошенный МПА. Посевы инкубируют в термостате.
2. Из бульонной культуры (рост в виде комка ваты на дне, бульон прозрачный) делают висячую каплю (для установления неподвижности - дифференциации от антракойда).
3. Ставят тест "жемчужного ожерелья" (ускоренный метод исследования). С этой целью к бульону Хоттингера добавляют 30% инактивированной лошадиной сыворотки и пенициллин из расчета 0,5 ЕД на 1 мл бульона. Приготовленную среду разливают в пробирки по 2-3 мл и в каждую вносят 2 капли исследуемой бульонной культуры. Посевы инкубируют в термостате 3 ч при температуре 37° С. Затем вынимают их из термостата. Из каждой пробирки делают 2-3 мазка, высушивают на воздухе и фиксируют в жидкости Карнуа (6 частей этилового спирта + 3 части хлороформа + 1 часть ледяной уксусной кислоты). Фиксацию проводят до полного испарения жидкости. Полученные мазки окрашивают метиленовым синим и микроскопируют.
В мазках сибиоеязвенные бациллы обнаруживаются в виде цепи шаров, напоминающих жемчужное ожерелье - результат действия пенициллина.
4. Осматривают зараженных животных. Павших животных вскрывают, делают мазки и мазки-отпечатки, которые фиксируют, окрашивают и изучают под микроскопом. При наличии подозрительных палочек производят посевы на МПА и МПБ.
Вынимают посевы из термостата, делают мазки, микроскопируют. На МПА и МПБ бациллы сибирской язвы растут в виде бескапсульных особей. Производят посев на сахара, лакмусовое молоко, желатин, на чашки с 2% кровью и ставят пробу с сибиреязвенным бактериофагом. Посевы инкубируют в термостате.
Вынимают посевы из термостата и учитывают полученные результаты (см. табл. 46).
Исследование мокроты, испражнений и крови после специальной обработки ведут так же.
Для диагностики сибирской язвы используют аллергическую пробу с сибиреязвенным антигеном (антраксин). Для этого внутрикожно на внутренней поверхности предплечья вводят антраксин. Реакцию учитывают через 24-48 ч. Положительная реакция проявляется с первых дней заболевания.
Реакцию ставят для обнаружения специфического антигена бацилл сибирской язвы в шерсти животных, коже, трупах, почве и т. д.
Приготовление антигена: исследуемый материал измельчают в ступке, заливают 25-50-кратным объемом изотонического раствора натрия хлорида и кипятят (антиген термоустойчив). Полученный экстракт фильтруют через смоченную тем же раствором фильтровальную бумагу. Фильтрат-термоэкстракт - прозрачная жидкость. Для реакции используют преципитирующую сибиреязвенную сыворотку и для контроля сибиреязвенный антиген (рис. 48).
Рис. 48. Реакция Асколи. 1 - преципитирующая сыворотка + исследуемый термоэкстракт; 2 - преципитирующая сыворотка + стандартный сибиреязвенный антиген (контроль); 3 - преципитирующая сыворотка + антиген из шерсти здорового животного (чужеродный антиген); 4 - преципитирующая сыворотка + изотонический раствор хлорида натрия; 5 - нормальная сыворотка + испытуемый антиген
Постановка реакции: 1-я пробирка - преципитирующая сыворотка + исследуемый термоэкстракт;
2-я пробирка - преципитирующая сыворотка + стандартный сибиреязвенный антиген (контроль).
3-я пробирка - преципитирующая сыворотка + термоэкстракт из шерсти здорового животного (контроль).
При положительной реакции в первых двух пробирках образуется преципитационное кольцо, в третьей - кольцо отсутствует.
Реакция эта очень чувствительна (см. рис. 48).
МПА, МПБ, желатиновая среда (см. главу 7).
1. Какой материал используют для бактериологического исследования?
2. Основные методы микробиологического исследования.
3. Какие имеются ускоренные методы исследования? Как получить тест "жемчужного ожерелья?"
4. Каким методом можно выявить сибиреязвенные бациллы во внешней среде?
Нарисуйте схему лабораторного исследования сибирской язвы но дням.
Престижные индивидуалки согласны оттянуться в полный рост с вами предельно пышным отдыхом сексуального характера. Они изящные проститутки будут рады, если вы насвистите им в пустое время и посоветуйте увидеть друг друга.
| Классы МПК: | C12N1/20 бактерии; питательные среды для них C12Q1/04 установление присутствия и(или) вида микроорганизма; использование селективных сред для испытания антибиотиков или бактерицидов; составы, содержащие химический индикатор для этих целей | |||||
| Автор(ы): | Рязанова Алла Геннадьевна (RU) , Ерёменко Евгений Иванович (RU) , Буравцева Нина Пантелеймоновна (RU) , Аксёнова Людмила Юрьевна (RU) , Цыганкова Ольга Ивановна (RU) , Цыганкова Елена Анатольевна (RU) , Головинская Татьяна Михайловна (RU) | |||||
| Патентообладатель(и): | Федеральное государственное учреждение здравоохранения Ставропольский научно-исследовательский противочумный институт Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (RU) | |||||
| Приоритеты: |
| цефтазидим | - 20 мг |
| амфотерицин В | - 10 мг |
| динатриевая соль пара-нитрофенил фосфата (p-NPP) | - 500 мг |
Цефалоспорин III поколения цефтазидим обладает активностью в отношении широкого спектра грамположительных и грамотрицательных бактерий, подавляет рост сопутствующей микрофлоры и не оказывает влияния на рост бацилл группы Bacillus cereus.
Полиеновый антибиотик амфотерицин В, характеризующийся высокой антимикотической активностью, подавляет рост грибов.
Для дифференциации колоний возбудителя сибирской язвы от колоний близкородственных бацилл группы Bacillus cereus предлагается тест для обнаружения фермента щелочной фосфатазы, а в качестве субстрата для действия этого фермента - динатриевая соль пара-нитрофенилфосфата (p-NPP). Метод основан на гидролизе щелочной фосфатазой p-NPP с образованием пара-нитрофенола (p-NP), обладающего ярко-желтым цветом, не требует дополнительной обработки выросших на среде колоний парами аммиака для выявления ферментативной активности щелочной фосфатазы, что исключает раздражающее действие паров аммиака на слизистые оболочки глаз и носоглотки персонала, производящего исследования, упрощает учет результатов и является преимуществом предлагаемой среды.
Возбудитель сибирской язвы не образует щелочную фосфатазу, поэтому гидролиз p-NPP не происходит, и цвет агара вокруг колоний не изменяется. Спорообразующие сапрофиты группы Bacillus cereus, как правило, обладают фосфатазной активностью, в результате чего образуется p-NP, придающий толще агара вокруг колоний желтое окрашивание.
Способ приготовления селективной дифференциально-диагностической среды.
Селективную дифференциально-диагностическую среду готовят следующим образом. На первом этапе подготавливают основные растворы дифференциально-диагностического и селективных компонентов среды. Навеску p-NPP 500 мг помещают в пробирку, растворяют в минимальном объеме (до 1 мл) стерильной дистиллированной воды, прогревают на водяной бане при температуре 56°С в течение 30 минут. 1000 мг цефтазидима во флаконе растворяют в 10 мл стерильной дистиллированной воды. 50 мг (50000 ЕД) амфотерицина В во флаконе растворяют в 5 мл стерильной дистиллированной воды. Далее агар Хоттингера во флаконах расплавляют в кипящей водяной бане, затем охлаждают до 40-50°С. Перед розливом в чашки к 1 л агара добавляют 1 мл л p-NPP, 0,2 мл цефтазидима, 0,1 мл амфотерицина В из основных растворов. Приготовленную среду тщательно перемешивают, разливают в чашки Петри, подсушивают в течение 1,5-2 ч. Так как в состав среды включен раствор амфотерицина В, чашки со средой до использования следует поместить в защищенное от света место. Чашки со средой после розлива можно хранить в условиях холодильника 1-2 суток.
Готовят взвеси спор испытуемых штаммов возбудителя сибирской язвы Bacillus anthracis 81/1,5. anthracis СТИ-1 и близкородственных бацилл группы Bacillus cereus В. cereus 96, В. thuringiensis Ser. 5 с мутностью, равной 10 единицам отраслевого стандарта мутности ГИСК им. Л.А.Тарасовича, затем десятикратными разведениями в физиологическом растворе в объеме 4,5 мл доводят до концентрации 100 спор в 1 мл. Аналогичным образом готовят взвеси штаммов Staphylococcus aureus 209-P, Escherichia coli 11, Proteus vulgaris НХ-19 концентрацией 100 микробных клеток (м.к.) в 1 мл. Из данных разведении взвеси штаммов засевают 0,1 мл на поверхность агаровой пластинки опытной и контрольной сред, растирают микробиологическим шпателем. В качестве контрольной среды используют агар Хоттингера, рН 7,3. По одной чашке Петри каждой среды оставляют незасеянными. Посевы инкубируют 18-20 ч при температуре 37°С, после чего проводят оценку ростовых, селективных и дифференциально-диагностических свойств опытной среды. Колонии бациллярных штаммов (B. anthracis 81/1, В. anthracis СТИ-1, В. cereus 96, В. thuringiensis Ser. 5) имели типичную морфологию, цвет агара вокруг колоний В. anthracis 81/1 и СТИ-1 не изменился, толща агара вокруг колоний В. cereus 96, В. thuringiensis Ser.5 приобрела ярко-желтое окрашивание. Рост штаммов S. aureus 209-Р, Е. coli 11, Р. vulgaris HX-19 на агаровых пластинах экспериментальной среды отсутствовал. Незасеянные среды не изменили своего цвета. На агаре Хоттингера отмечен рост колоний всех тестируемых штаммов типичной морфологии.
Возможность осуществления предполагаемого изобретения подтверждается примерами конкретного выполнения.
Пример 1. Готовили среду следующего состава: агар Хоттингера, рН 7,3 - 1 л, цефтазидим - 10 мг, амфотерицин В - 5 мг, p-NPP - 250 мг. В колбу помещали пробу почвы (10 г), заливали физиологическим раствором (100 мл), добавляли по 0,1 мл взвесей штаммов В. anthracis СТИ-1, В. cereus 96, S. aureus 209-Р, Е. coli 11, P. vulgaris HX-19, перемешивали, засевали 0,1 мл на поверхность агаровой пластинки экспериментальной среды, растирали микробиологическим шпателем и, не обжигая его, делали посев переносом на вторую чашку с этой средой. Через 18-20 ч инкубирования при 37°С формировались колонии бацилл с характерной морфологией, которые можно было дифференцировать по тесту на щелочную фосфатазу: цвет агара вокруг колоний В. anthracis СТИ-1 не изменился, толща агара вокруг колоний В. cereus 96 и почвенных бацилл окрасилась в желтый цвет. Рост штаммов S. aureus 209-Р, Е. coli 11, Р. vulgaris HX-19 отсутствовал. Отмечен рост сопутствующих микроорганизмов, в том числе почвенных грибов.
Пример 2. Готовили среду следующего состава: агар Хоттингера, рН 7,3 - 1 л, цефтазидим - 18 мг, амфотерицин В - 8 мг, p-NPP - 490 мг. В колбу помещали пробу почвы (10 г), заливали физиологическим раствором (100 мл), добавляли по 0,1 мл взвесей штаммов В. anthracis СТИ-1, В. cereus 96, S. aureus 209-P, E.coli 11, P. vulgaris HX-19, перемешивали, засевали 0,1 мл на поверхность агаровой пластинки экспериментальной среды, растирали микробиологическим шпателем и, не обжигая его, делали посев переносом на вторую чашку с этой средой. Через 18-20 ч инкубирования при 37°С рост штаммов S. aureus 209-P, E. coli 11, Р. vulgaris HX-19 и почвенных грибов отсутствовал, цвет агара вокруг колоний с типичной морфологией штамма В. anthracis СТИ-1 не изменился, толща агара вокруг характерных колоний В. cereus 96 и почвенных бацилл приобрела ярко-желтое окрашивание в связи с активностью щелочной фосфатазы.
Пример 3. Готовили среду следующего состава: агар Хоттингера, рН 7,3 - 1 л, цефтазидим - 20 мг, амфотерицин В - 10 мг, p-NPP - 500 мг. В колбу помещали пробу почвы (10 г), заливали физиологическим раствором (100 мл), добавляли по 0,1 мл взвесей штаммов В. anthracis СТИ-1, В. cereus 96, S. aureus 209-P, E. coli 11, P. vulgaris HX-19, перемешивали, засевали 0,1 мл на поверхность агаровой пластинки экспериментальной среды, растирали микробиологическим шпателем и, не обжигая его, делали посев переносом на вторую чашку с этой средой. Через 18-20 ч инкубирования при 37°С формировались типичные колонии преимущественно бацилл, которые можно было дифференцировать по тесту на щелочную фосфатазу: цвет агара вокруг колоний В. anthracis СТИ-1 не изменился, толща агара вокруг колоний В. cereus 96 и почвенных бацилл приобрела ярко-желтое окрашивание.
Пример 4. Эксперимент проводили так же, как описано в предыдущих примерах, среду готовили, используя концентрации дифференциально-диагностического и селективных компонентов на 1 л агара Хоттингера в следующих пределах: цефтазидим - 22 мг, амфотерицин В - 12 мг, p-NPP - 510 мг. Результаты, полученные при проведении данного опыта, были аналогичны результатам, представленным в примере 3.
Полученные результаты, обобщенные в таблице 1, дали возможность определить оптимальный состав селективной дифференциально-диагностической среды для выделения возбудителя сибирской язвы и близкородственных бацилл группы Bacillus cereus (пример 3), позволяющий ингибировать рост посторонней микробной флоры и надежно дифференцировать бациллярные штаммы.
Таким образом, на основании вышеизложенного можно сделать вывод о преимуществах предлагаемой селективной дифференциально-диагностической среды, содержащей агар Хоттингера (1 л) в качестве питательной основы, 18-22 мг/л цефтазидима, 8-12 мг/л амфотерицина В, 490-510 мг/л p-NPP. Преимущества среды определяются наличием селективных и дифференциально-диагностического компонентов в вышеуказанных концентрациях: цефтазидим обладает активностью в отношении широкого спектра грамположительных и грамотрицательных бактерий, подавляет рост сопутствующей микрофлоры и не оказывает влияния на рост бацилл группы Bacillus cereus, амфотерицин В ингибирует рост грибов, субстрат для действия щелочной фосфатазы p-NPP дает возможность проведения дифференциации колоний возбудителя сибирской язвы от колоний близкородственных бацилл группы Bacillus cereus, не требуя дополнительной обработки выросших на среде колоний парами аммиака для выявления ферментативной активности щелочной фосфатазы, исключая раздражающее его воздействие на слизистые оболочки глаз и носоглотки персонала, производящего исследования, упрощая учет результатов.
Сибирская язва - острая антропонозная инфекционная болезнь, вызываемая Bacillus anthracis, характеризуется тяжелой интоксикацией, поражением кожи, лимфатических узлов.
Таксономия. Возбудитель относится к отделу Firmicutes, роду Bacillus.
Морфологические свойства. Очень крупные грамположительные палочки с обрубленными концами, в мазке из чистой культуры располагаются короткими цепочками (стрептобациллы). Неподвижны; образуют расположенные центрально споры, а также капсулу.
Культуральные свойства. Аэробы. Хорошо растут на простых питательных средах в диапазоне температур 10—40С, температурный оптимум роста 35С. На жидких средах дают придонный рост; на плотных средах образуют крупные, с неровными краями, шероховатые матовые колонии (R-форма). На средах, содержащих пенициллин, через 3ч роста сибиреязвенные бациллы образуют сферопласты, расположенные цепочкой и напоминающие в мазке жемчужное ожерелье.
Биохимические свойства. Ферментативная активность достаточно высока: возбудители ферментируют до кислоты глюкозу, сахарозу, мальтозу, крахмал, инулин; обладают протеолитической и липолитической активностью. Выделяют желатиназу, обладают слабой гемолитической, лецитиназной и фосфатазной активностью.
Выделяют желатиназу, проявляют низкую гемолитическую, лецитиназную и фосфатазную активность.
Антигены и факторы патогенности. Содержат родовой соматический полисахаридный и видовой белковый капсульный антигены. Образуют белковый экзотоксин, обладающий антигенными свойствами и состоящий из нескольких компонентов (летальный, протективный и вызывающий отеки). Вирулентные штаммы в восприимчивом организме синтезируют сложный экзотоксин и большое количество капсульного вещества с выраженной антифагоцитарной активностью.
Резистентность. Вегетативная форма неустойчива к факторам окружающей среды, споры чрезвычайно устойчивы и сохраняются в окружающей среде, выдерживают кипячение. Чувствительны к пенициллину и другим антибиотикам; споры устойчивы к антисептикам.
Эпидемиология и патогенез. Источник инфекции — больные животные, чаще крупный рогатый скот, овцы, свиньи. Человек заражается в основном контактным путем, реже алиментарно, при уходе за больными животными, переработке животного сырья, употреблении мяса. Входными воротами инфекции в большинстве случаев являются поврежденная кожа, значительно реже слизистые оболочки дыхательных путей и желудочно-кишечного тракта. В основе патогенеза лежит действие экзотоксина, который вызывает коагуляцию белков, отек тканей, приводят к развитию токсико-инфекционного шока.
Клиника. Различают кожную, легочную и кишечную формы сибирской язвы. При кожной (локализованной) форме на месте внедрения возбудителя появляется характерный сибиреязвенный карбункул, сопровождается отеком. Легочная и кишечная формы относятся к генерализованным формам и выражаются геморрагическим и некротическим поражением соответствующих органов.
Иммунитет. После перенесенной болезни развивается стойкий клеточно-гуморальный иммунитет.
Микробиологическая диагностика:
Наиболее достоверным методом лабораторной диагностики сибирской язвы является выделение из исследуемого материала культуры возбудителя. Диагностическую ценность представляют также реакция термопреципитации по Асколи и кожно-аллергическая проба.
Бактериоскопическое исследование. Изучение окрашенных по Граму мазков из патологического материала позволяет обнаружить возбудителя, представляющего собой грамположительную крупную неподвижную стрептобациллу. В организме больных и на белковой питательной среде микроорганизмы образуют капсулу, в почве— споры.
Бактериологическое исследование.Исследуемый материал засевают на чашки с питательным и кровяным агаром, а также в пробирку с питательным бульоном. Посевы инкубируют при 37С в течение 18ч. В бульоне В. anthracis растет в виде хлопьевидного осадка; на агаре вирулентные штаммы образуют колонии R-формы. Авирулентные или слабовирулентные бактерии образуют S-формы колоний.
Биопроба.Исследуемый материал вводят подкожно морским свинкам кроликам. Готовят мазки из крови и внутренних органов, делают посевы для выделения чистой культуры возбудителя.
Экспресс-диагностикапроводится с помощью реакции термопреципитации по Асколи и иммунофлюоресцентного метода.
Реакцию Асколи ставят при необходимости диагностировать сибирскую язву у павших животных или у умерших людей. Образцы исследуемого материала измельчают и кипятят в пробирке с изотоническим раствором хлорида натрия в течение 10 мин, после чего фильтруют до полной прозрачности.
Метод иммунофлюоресценции позволяет выявить капсульные формы В. anthracis в экссудате. Мазки из экссудата через 5—18 ч после заражения животного обрабатывают капсульной сибиреязвенной антисывороткой, а затем флюоресцирующей антикроличьей сывороткой. В препаратах, содержащих капсульные бациллы, наблюдается желто-зеленое свечение возбудителя.
Кожно-аллергическая проба.Ставится на внутренней поверхности предплечья — внутрикожно вводят 0,1 мл антраксина. При положительной реакции через 24 ч появляются гиперемия и инфильтрат.
Лечение: антибиотики и сибиреязвенный иммуноглобулин. Для антибактериальной терапии препарат выбора – пенициллин.
Профилактика. Для специфической профилактики используют живую сибиреязвенную вакцину. Для экстренной профилактики назначают сибиреязвенный иммуноглобулин.
Преципитирующая сибиреязвенная сыворотка.Получена из крови кролика, гипериммунизированного культурой В. anthracis. Применяется для постановки реакции термопреципитации по Асколи.
Сибиреязвенная живая вакцина СТИ.Высушенную взвесь живых спор В. anthracis авирулентного бескапсульного штамма. Применяется для профилактики сибирской язвы.
Противосибиреязвенный иммуноглобулин.Гамма-глобулиновая фракция сыворотки крови лошади, гипериммунизированной живой сибиреязвенной вакциной и вирулентным штаммом В.anthracis, используется с профилактической и лечебной целью.
Читайте также:
- Коммунизм это красная чума
- Трускиновская сыск во время чумы
- Внебольничной пневмонии пневмококковой этиологии
- Боли в печени могут быть из за хеликобактер
- Комбинированная вакцина для профилактики коклюша


