Дифференциация энтерококков от стрептококков
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Внутри группы энтерококки делятся по ферментативным, редуцирующим и гемолитическим свойствам на ряд видов и подвидов. Дифференциация культур энтерококка внутри группы ведется по схеме, представленной в таблице 5.
Первый день. Бульонные культуры энтерококков для установления их видовой принадлежности высевают параллельно на 3 среды: а) на энтерококковую дифференциально - диагностическую среду (далее-ЭДДС) для определения гемолитической, протеолитической активности и способности редуцировать ТТХ; б) на сахарно - дрожжевой агар для испытания резистентности исследуемой культуры к теллуриту калия, в) в столбик с 0,2% агаром для определения подвижности энтерококков.
Дифференциация энтерококков внутри группы
| Виды и подвиды | Резистент-ность к теллуриту калия | Энтерококковая дифференци- ально-диагностическая среда | Подвижность | ||
| Редук-ция ТТХ | Гемо-лиз | Проте-олиз | |||
| S. faecalis | + | + | - | - | - |
| S.faecalis subsp zymogenes | + | + | + | +- | - |
| S.faecalis subsp liquefaciens | + | + | - | + | - |
| S. faecium | - | - | + - | - | - |
| Подвижные энтерококки | + | + | +- | - | + |
Второй день. 1. Через 15-18 часов предварительно учитывают гемолитическую активность энтерококков, ввиду того, что при инкубации в термостате многие штаммы энтерококков вырабатывают кислые продукты метаболизма со снижением рН питательной среды до 3,8-4,2, разрушением гемоглобина и появлением вокруг колоний зон бурого цвета.
При учете ферментативной (гемолитической и протеолитической) активности определяется 4 возможных варианта изменения ЭДДС: гемолитически активные штаммы энтерококков образуют вокруг колоний белые зоны, соответствующие цвету молочного агара; у протеолитически активных штаммов появляются четко выраженные темно - красные или бурые зоны вокруг колоний; при наличии обоих (гемолитического и протеолитического) ферментов среда вокруг колоний просветляется, приобретая вид обычного питательного агара; штаммы энтерококков, не продуцирующие этих ферментов, сред не изменяют.
В конце первых суток инкубации учитывают на этой же среде способность исследуемых культур к редукции 2,3,5-трифенилтетразолия хлорида (ТТХ). S. faecalis и его варианты (S. faecalis subsp. zymogenes, S. faecalis subsp. liquefaciens), восстанавливающие ТТХ, растут в виде вишнево - красных колоний с белыми ободками.
Вид S. faecium не восстанавливает ТТХ - колонии его бесцветны или окрашены в слабо - розовый цвет.
Подвижные формы энтерококков, обладая слабой редуцирующей активностью, образуют (особенно в первичном посеве материала) карликовые колонии розовых оттенков разной интенсивности.
На сахарно - дрожжевом агаре с теллуритом калия (0,07%) растут только штаммы вида S. faecalis, устойчивые к высоким концентрациям теллурита калия. В процессе роста они восстанавливают теллурит калия, образуя при этом черные колонии, окруженные узким бесцветным ободком.
В полужидком (0,2%) агаре, засеянном уколом, подвижные формы энтерококков вызывают диффузное помутнение всего столбика среды, тогда как неподвижные виды (S. faecium, S. faecalis и его разновидности) растут только по ходу прокола.
Таким образом, основными тестами дифференциации видов S. faecalis, S. faecium являются редукция ТТХ и устойчивость к теллуриту калия.
S. faecalis и его варианты: S. faecalis zymogenes, S. faecalis liquefaciens различаются по образованию гемолитического и протеолитического ферментов.
Основным диагностическим признаком подвижных энтерококков, позволяющим дифференцировать их от всех остальных видов этой группы, является подвижность.
Для лабораторного анализа используются микроскопический, бактериологический и серологический методы диагностики.
Назначение, особенности и диагностическая ценность микроскопического исследования такие же, как и при стафилококковых инфекциях.
1. БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Для выделения чистой культуры стрептококков важное значение имеет создание оптимальной питательной среды, так как стрептококки предъявляют к ней особые требования. Им необходимо значительное количество углеводов и нативного белка. Поэтому наряду с общепринятыми сахарным МПБ, кровяным МПА, молочно-солевым МПА и МПБ (см. рецепты выше) при стрептококковых инфекциях применяются асцитические и сывороточные среды.
АСЦИТИЧЕСКИЙ МПБ И МПА готовятся с добавлением отчетной жидкости, получаемой стерильно из брюшной полости больных терапевтического и хирургического профиля. Жидкость прогревают 3 дня при +56-58 °C по 1 часу, стерилизуют фильтрованием через фильтр Зейтца или добавляют 40% глицерина и хранят на холоду. Для приготовления асцит-бульона и асцит-агара 1 часть жидкости смешивают с 2-3 частями МПБ (или Хоттингеровского бульона) или растопленного и остуженного МПА.
СЫВОРОТОЧНЫЙ МПБ готовят из простого свежего мясопептонного бульона с pH 7,6, к 1 части которого добавляют 2 части свежей сыворотки человека или лошади. Сыворотку перед прибавлением к среде инактивируют при + 56 °C в течение 30 минут.
При осложнении капельных стрептококковых инфекций сепсисом необходим и посев крови. Для бактериологического исследования крови Э. Г. Кассирская рекомендует комплексное использование трех видов питательных субстратов, засеваемых из расчета 1 часть патологического материала на 10-15 частей среды. В качестве последней используются 0,2% полужидкий агар с 10% асцитической жидкости, бульон Левинталя с кровью и печеночная среда Китт-Тароцци.
ДЛЯ БУЛЬОНА ЛЕВИНТАЛЯ отдельно готовят следующие компоненты: № 1 - к 100 мл мясного фарша добавляют 300 мл дистиллированной воды и 10 мл нормального раствора соды; № 2 - 0,5 г панкреатина растворяют в 20-30 мл воды с 2 мл 1 N раствора соды и 10 мл хлороформа; № 3 - буферный раствор фосфорно-кислого натрия в дистиллированной воде (разведение 8:1000). С помощью раствора НСl устанавливают pH, равное 5,6-6.
В первый день смесь № 1 инкубируют в термостате при + 37 °C 1-2 часа, добавляют к ней раствор № 2, перемешивают и при тех же условиях выдерживают еще 24 часа. Сосуд со средой периодически встряхивают. После этого берут равные количества мясной кашицы и буферного раствора № 3. Кипятят, фильтруют. Устанавливают рН-7,2-7,4. Вновь кипятят. Разливают по пробиркам и стерилизуют 2 дня подряд по 30 минут текучим паром.
СРЕДУ КИТТ-ТАРОЦЦИ готовят из говяжьей печени или мяса. Последние нарезают кусочками, взвешивают, заливают тройным количеством МПБ (рН-7,4-7,6) кипятят 30 минут. Затем бульон фильтруют, кусочки печени отмывают водопроводной водой. Далее пробирки с 3-4 кусочками печени, залитыми 7-8 мл фильтрата и слоем вазелинового масла, стерилизуют под давлением 1 атм. в течение 30 минут.
Высеваемость стрептококков возрастет при использовании ПОЛУЖИДКОГО АГАРА ГАРОЦЦИ: в бульон Мартена (рН-7,6-7,8) добавляют 0,3-0,5% глюкозы и 0,1-0,15% агар-агара. В стерильные пробирки помещают кусочки печени или вареного мяса, добавляют по 9 мл среды и стерилизуют при температуре +120 °C в течение 30 минут.
Зеленящий стрептококк, выделяемый при септическом эндоркардите, развивается очень медленно. В связи с этим посевы крови выдерживают 2-3 суток в термостате.
В некоторых случаях выделить культуру стрептококка при широкой аэрации не удается. Более успешным оказывается применение анаэробиоза. Для создания последнего можно использовать три простейших способа.
I. ИССЛЕДУЕМЫЙ МАТЕРИАЛ ЗАСЕВАЮТ В ПРОБИРКУ с 0.25% глюкозным бульоном и быстро всасывают его в стерильные пастеровские пипетки, концы которых тотчас же запаивают над пламенем горелки. Пипетки устанавливают вертикально в термостате. Через 24 часа нижние концы пипеток отламывают (стрептококки растут только внизу), первые капли используют для микроскопии и дальнейшего выделения чистой культуры возбудителя.
2. КУЛЬТИВИРОВАНИЕ ПОСЕВОВ В АТМОСФЕРЕ, НАСЫЩЕННОЙ УГЛЕКИСЛЫМ ГАЗОМ. Необходимую концентрацию СО2 получают при добавлении в загруженный пробирками эксикатор вначале 1г двууглекислой соды на 1 литр объема, а затем из того же расчета 8-9 мл 10% Н2SO4 или HCl.
3. ДОВОЛЬНО ПРОСТ и менее эффективен следующий прием: на дно неплотно закрытого эксикатора ставят зажженную свечку. Она горит 1-3 минуты и гаснет. По окончании первой или второй процедуры эксикаторы покрывают крышками, края которых смазаны вазелином и помещают в термостат.
Выделение чистой культуры

Биохимическая активность стрептококков непостоянна и ее выяснение не имеет диагностического значения. Изучение стрептококков в этом плане используется лишь для дифференциации с энтерококками (табл. 1.).
| Таблица 1. Дифференциация стрептококков от энтерококков | ||
| Критерии Шермена для различия стрептококков группы А (истинные) oт группы Д (энтрококки) | ||
| Тесты | Группы | |
| Группа А (стрептококки) | Группа Д (энтерококки) | |
| Длина цепочек | длинные (5-12 звена) | короткие (1-2 звеньев) |
| Рост на солевом МПА с 6,5% | + | - |
| Рост на желчно-кровяном МПА Д. Э. Беленького к П. Н. Поповой | - | + |
| Рост на молоке с метиленовой синькой | - | + (редукция) |
| Рост на МПБ с pH - 9,6 (в присутствии 0,05 М р-ра Na2CO3) | - | + |
| Чувствительность к пенициллину | + | - |
| Термоустойчивость при +60 °C в течение 30 минут. | - | + |
Состав дифференциально-диагностических сред, применяемых для этой цели следующий.
- ЖЕЛЧНЫЙ И ЖЕЛЧНО-КРОВЯНОЙ МПА Д. 3. Беленького и Н. Н. Поповой готовятся из расплавленного и отфильтрованного 3% МПА с любой бульонной основой. К 60 мл этого МПА добавляют 40 мл нативной профильтрованной желчи, разливают по флаконам и стерилизуют при давлении в 1 атм. 30 минут. Для приготовления агара с кровью к этому желчному МПА добавляют 5% дефибринированной крови.
- МОЛОКО С МЕТИЛЕНОВЫМ СИНИМ приготовляется из обезжиренного стерильного молока, к 100 мл которого добавляют 2 мл 10% водного раствора метиленового синего.
ОПРЕДЕЛЕНИЕ ВИРУЛЕНТНОСТИ СТРЕПТОКОККОВ
Для доказательства патогенности стрептококков важное значение имеют гиалуронидазная активность, выявление стрептокиназы или фибринокиназы, плазмокоагулазы, лейкотоксическое действие стрептококка, наличие гемолизина. Определение этих показателей осуществляется по методикам, описанным выше, но выявление гемолизирующей активности стрептококка лучше идет на средах с человеческой кровью.
ОПРЕДЕЛЕНИЕ ЛЕЙКОЦИДИНА. Берут цитратную кровь человека или какого-либо животного, центрифугируют, верхний желтый слой лейкоцитов отсасывают пипеткой, переносят в другую пробирку и готовят 2-5% лейкоцитарную взвесь. Последнюю разливают по 1-1,5 мл в узкие пробирки. Сюда же вносят 1 петлю 1-2 млрд. суточной культуры стрептококка и на 1 час помещают в термостат при +37 °C. После инкубации, из лейкоцитарно-микробной массы делают мазки (по типу мазков из цельной крови), высушивают, фиксируют 15 мин. в смеси Никифорова, окрашивают 45-60 минут по Романовскому-Гимза, микроскопируют. Массовое разрушение лейкоцитов свидетельствует о наличии лейкоцидина.
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ выделенных культур к лекарственным веществам производится общепринятыми способами.
СЕРОЛОГИЧЕСКАЯ ТИПИЗАЦИЯ обнаруженных стрептококков после их изоляции требуется только для особых эпидемиологических целей и применяется редко.
II. СЕРОЛОГИЧЕСКИЙ МЕТОД ДИАГНОСТИКИ СТЕПТОКОККОВЫХ ИНФЕКЦИЙ
Ферменты вирулентности стрептококков (гиалуронидаза, фибринокиназа, плазмокоагулаза) и их токсины (например, гемотоксин) являются мощными антигенами, в ответ на действие которых вырабатываются соответствующие антитела: антигиалуронидаза, антистрептокиназа, антистрептолизин и т. д. По обнаружению этих антител можно диагностировать заболевание и фазу развития инфекционного процесса.
ОПРЕДЕЛЕНИЕ АНТИСТРЕПТОЛИЗИНА (АНТИГЕМОЛИЗИНА)
Стрептолизин представляет собой разновидность гемотоксина. Его присутствие проверяют на эритроцитариой массе. В ответ на действие этого антигена в организме формируются антитела, способные нейтрализовать его гемолизирующую активность. При выявлении антистрептолизина необходимы: сыворотка больного с антистрептолизинами (антителами); стрептолизин (очищенный), стандартный, лиофилизированный; 5% взвесь кроличьих, бараньих или человеческих эритроцитов; фосфатный буфер для разведения сывороток и приготовления взвеси эритроцитов: в 1 л дистиллированной воды растворяют 7,6 NaCl, 3,17 г КН2Р04 и 1,81 г Na2HPO4, добавляют по каплям концентрированную NaОН и доводят pH до 6.5-6,7. Буферный раствор сохраняется в рефрижераторе при -4 °C 2-3 недели.
Определение антистрептолизина складывается из двyx этапов: первый - установление титра и рабочей дозы стандартного стрептолизина, второй - выявление и количественное определение антистрептолизина. Схемы их выполнения приводятся ниже.
| Схема определения рабочей дозы стандартного стрептолизина | |||||||
| Компоненты в мл | Пробирки | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| (контроль эритроцитов) | |||||||
| Стрептолизин | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | - |
| Буферный раствор | 0,9 | 0,8 | 0,7 | 0,6 | 0,5 | 0,4 | 1,5 |
| Взвесь эритроцитов | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| В термостат на 15 минут при +37 °C, встряхнуть, снова в термостат на 30 минут. | |||||||
| Результат | - | - | - | - | гемолиз | гемолиз | - |
Титром и рабочей дозой стрептолизина считается его минимальное количество, давшее четкий гемолиз эритроцитов. В данном примере они равны 1,0 мл.
В последнее время выпускается стандартный лиофилизированный стретолизин, на флаконе с которым и в приложенной инструкции указан способ разведения препарата для получения рабочей дозы. Такой стрептолизин обеспечивает хорошую повторяемость результатов.
| Схема постановки реакции для определения антистрептолизина | ||||||
| Компоненты в мл | Пробирки | |||||
| 1 | 2 | 3 | 4 | Контроль | ||
| 5 | 6 | |||||
| стрептолизина | эритроцитов | |||||
| Буферный раствор | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Сыворотка больного | 1:50 | 1:100 | 1:200 | 1:400 | 1:800 | - |
| Стрептолизин в раб. дозе. | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | - |
| Встряхнуть, в термостат при + 37 °C на 15 минут. | ||||||
| Взвесь эритроцитов | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| В термостат на 45 минут при +37 °C с периодическими встряхиваниями. | ||||||
| Результат | - | - | гемолиз | гемолиз | гемолиз | - |
Антистрептолизин в данной пробе сыворотки обследуемого больного обнаружен в титре 1:200.
Принцип выявления основан на регистрации разрушительного действия фермента гиалуронидазы на гиалуроновый субстрат. Антитела сыворотки больного, направленные против этого фермента, нейтрализуют его и гиалуроновая кислота остается неизмененной.
Необходимые реактивы: сыворотка больного с антителами (антигиалуронидазой); экстракт гиалуроновой кислоты с известной рабочей дозой (способ описан выше); гиалуронидаза (химически чистый препарат); 15% уксусная кислота - индикатор; физиологический раствор.
Определение антигиалуронидазы состоит из трех этапов: первый - определение титра и рабочей дозы гиалуроновой кислоты, второй - гиалуронидазы, третий - выявление наличия и титра антигиалуронидазы.
Титрование гиалуронового субстрата описано выше. Титр и рабочая доза стандартной гиалуронидазы соответствует тому минимальному ее количеству, которое способно разрушить гиалуроновую кислоту, взятую в рабочей дозе.
После выяснения титра гиалуронидазы проводят определение титра антигиалуронидазы.
| Схема постановки реакции определения титра сывороточной антигиалуронидазы | ||||||||
| Ингредиенты в мл | Пробирки | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | Контроль | ||
| 7 | 8 | |||||||
| гиалуронидаза | гиалуроновая кислота | |||||||
| Физ. раствор | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,7 |
| Сыворотка больного в разведении 1:25 | 1:50 | 1:100 | 1:200 | 1:400 | 1:800 | 1:1600 | ||
| Гиалуронидаза в рабочей дозе | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | 0,2 | - |
| В термостат при + 37°C на 30 минут. | ||||||||
| Гиалуроновая кислота в рабочей дозе | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| В термостат при +37 °C на 30 минут. 15% уксусная кислота по 2-3 капли в пробирку. | ||||||||
| Результаты | сгусток | сгусток | сгусток | - | - | - | - | сгусток |
В данном примере титр антигиалуронидазы в сыворотке крови больного 1:200. Это количество антител при указанном разведении сыворотки еще обладает нейтрализующим действием в отношении гиалуронидазы и предотвращает разрушение гиалуроновой кислоты. Ее целостность регистрируется по образованию сгустка после добавления индикатора - 15% раствора уксусной кислоты.
Источник: Мотавкина Н.С., Пьянова Р.Е. Микробиологическая диагностика некоторых капельных инфекций и токсоплазмоза. Методическая разработка для студентов. ВГМУ, 1973
в пищевой промышленности
Энтерококки
Энтерококки входят в семейство Lactobacillaeeae, род Streptococcus. Ввиду того что энтерококки отличаются от стрептококков рядом морфологических, культуральных, ферментативных свойств и антигенной структурой, их предложили выделить в самостоятельную группу (род) Enterococcus. В эту группу входят два вида энтерококков: Str. faecalis (с вариантами zymogenes и liquefaciens) и Str. faecium (с вариантом durans).
По ряду биологических свойств к энтерококкам близки два вида стрептококков, составляющих нормальную микрофлору кишечника, крупного рогатого скота (Str. bovis) и лошадей (Str. equinus).
Морфология . Энтерококки представляют собой грам-положительные, попарно расположенные кокки, несколько вытянутые в длину, наружные концы их заострены. В жидких средах встречаются короткие цепочки кокков. Энтерококки не образуют спор и капсул. Им свойствен значительный полиморфизм, т. е. клетки различаются по размерам и по форме (круглые, длинные, иногда вытянутые настолько, что напоминают коккобактерии). Величина отдельных кокков колеблется от 0,5 до 1,2 мкм. В отличие от стрептококков среди энтерококков есть штаммы, обладающие подвижностью. Среди Str. bovis также встречаются подвижные штаммы.
Культуральные свойства . Энтерококки растут на МПА, МПБ, но лучший рост отмечен на средах, содержащих углеводы и факторы роста (дрожжевой экстракт, диализат). В жидких средах наблюдают диффузное помутнение с образованием вначале аморфного, затем ослизняющегося осадка. На плотных средах энтерококки растут в виде мелких, прозрачных, голубоватых колоний. При обильном посеве образуют сплошной рост в отличие от стрептококков, которые и при густом посеве дают изолированные колонии.
Ферментативные свойства . Энтерококки ферментируют лактозу, маннит, глицерин, а сорбит, арабинозу, сахарозу не постоянно и не все штаммы энтерококков. Желатин разжижают и пептонизируют молоко только var. liquefaciens; var. zymogenes непостоянно.
Санитарно-показателыгое значение энтерококков. Энтерококки наряду с бактериями группы кишечных палочек являются постоянными обитателями кишечника человека и животных, в большом количестве выделяются во внешнюю среду, и обнаружение их в почве, воде, пищевых продуктах свидетельствует о фекальном загрязнении этих объектов, продуктов.
При изучении вопроса о санитарно-показательном значении отдельных видов энтерококков было установлено, что в кишечнике человека преобладают Str. faecalis и его варианты, в меньшем количестве обнаруживают Str. faecium, в кишечнике крупного рогатого скота преобладает Str. bovis, у лошадей — Str. equinus, у свиней — Str. faecium, Str. bovis, у овец—Str. bovis, Str. faecium, в меньшем количестве Str. faecalis.
Следовательно, обнаружение во внешней среде Str. faecalis и его вариантов имеет определенное санитарное и эпидемиологическое значение как показатель загрязнения объекта фекалиями человека; обнаружение Str, bovis и Str, equinus — показатель загрязнения фекалиями животных.
Наряду с бактериями группы кишечных палочек энтерококк используют в качестве санитарно-показа-тельного микроорганизма при санитарной оценке воды открытых водоемов.
В международном и европейском стандарте по исследованию питьевой воды энтерококк введен как дополнительный показатель фекального загрязнения воды.
Энтерококки как санитарно-показательные микроорганизмы имеют значительные преимущества перед бактериями группы кишечных палочек. Энтерококки не подвергаются столь глубоким изменениям и не размножаются (за исключением пищевых продуктов) в объектах внешней среды. Их легче идентифицировать и дифференцировать от сходных видов, а также выявить из загрязненных другими микробами объектов благодаря наличию избирательных сред (среда Хайна и Перри с азидом натрия, среда накопления Мак-Конки с теллуритом калия, щелочная полимиксиновая среда Калины). Энтерококки более устойчивы, чем кишечные палочки, к физическим и химическим воздействиям, в частности к повышенным концентрациям солей, нагреванию, хлорированию. В связи с этим их рекомендуют использовать в качестве санитарно-показательных микроорганизмов при оценке качества хлорирования питьевой воды, при исследовании минеральных источников, а также пищевых продуктов с повышенной концентрацией соли.
Дифференциация . Чтобы отличить группу энтерококков от других видов рода Streptococcus, используют ряд признаков (тесты Шермена). В основу дифференциации положена более высокая устойчивость энтерококков по сравнению со стрептококками к воздействию физических и химических факторов.
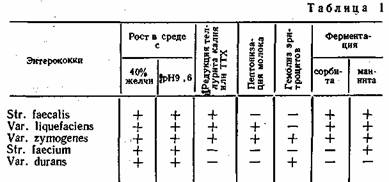
Внутри группы, между собой, энтерококки различаются способностью редуцировать трифенилтетразолхло-рид (ТТХ), теллурит калия, ферментировать сорбит и маннит, пептонизировать молоко, вызывать гемолиз на средах с добавлением крови (табл. 1).
Str. bovis и Str. equinus в отличие от энтерококков неспособны ферментировать глицерин, расти при рН 9,6.
Сходные по культуральным и биохимическим свойствам штаммы энтерококков и стрептококков идентифицируют серологическим методом, с помощью реакций преципитации и агглютинации.
Энтерококкометрия . Энтерококкометрией называют количественный учет энтерококков в объектах внешней среды, пищевых продуктах.
Благополучной в санитарном отношении считают воду рек, колодцев, если в 50 мл ее энтерококк не обнаружен.
Энтерококкометрию используют при санитарной оценке таких мясных продуктов, как солонина, консервированная ветчина. Консервированную ветчину считают неудовлетворительной по качеству, если в 1 г ее обнаруживают энтерококк. В 50 мл доброкачественного рассола также не должен содержаться энтерококк.
Энтерококкометрию нельзя применять при исследовании молочнокислых продуктов, сыров, ввиду того что энтерококки содержатся в этих продуктах постоянно и способны размножаться.
ЭНТЕРОКОККИ — фекальные стрептококки, бактерии семейства Streptococcaceae, род Streptococcus.
Энтерококки являются обитателями кишечника человека и теплокровных животных, они рассматриваются как санитарно-показательные и условно-патогенные микроорганизмы. По антигенному строению (группоспецифической тейхоевой кислоте) они объединены в серологическую группу D по Лансфилд (R. S. Lancefield), куда включены и S. bovis, S. equinus, близкие к энтерококкам по экологии. Различают следующие виды и биовары энтерококков:. S. faecalis, S. faecalis var. liquefaciens, S. faecalis var. zymogenes, S. faecium, S. faecium var. durans. Внутри вида S. faecalis выделено 11 серотипов (сероваров), а внутри вида S. faecium — 19. Попытки фаготипирования, дифференциации энтерококков по чувствительности к бактериоцинам оказались безуспешными. Среди энтерококков широко распространена способность продуцировать специфические антибиотические вещества — бактериоцины, подавляющие жизнедеятельность бактериальных клеток других штаммов того же вида или филогенетически родственных видов (см. Бактериоциногения). Известен антагонизм энтерококков (см. Антагонизм микробов) к ряду других микробов (например, стафилококкам, палочке чумы).
Четкие отличия энтерококков от стрептококков (см.) по ряду признаков указывают на необходимость выделить энтерококки в самостоятельный род. Это было подтверждено в сравнительных исследованиях по гибридизации нуклеиновых кислот, а также анализом иммунотипирования белкового комплекса энтерококков, в котором не обнаружено родства со стрептококками других серологических групп. Однако до сих пор энтерококки в виде родового ранга не выделены.
Энтерококки обнаруживают в воде, почве, пищевых продуктах и на различных предметах. Основным местом обитания S. faecalis является кишечник человека, S. faecium — кишечник свиней, S. bovis — кишечник коров, S. equinus — кишечник лошадей.
Как санитарно-показательные микроорганизмы энтерококки имеют ряд преимуществ перед кишечными палочками: более стойки к физическим и химическим воздействиям, не размножаются в окружающей среде, могут быть выделены из сильно загрязненных объектов посевом на селективные среды. Существуют различия между энтерококками человеческого и животного происхождения. В ряде стран энтерококки используются в качестве санитарнопоказательного микроба для определения фекального загрязнения воды открытых водоемов, централизованного и индивидуального водоснабжения. Этот показатель введен в Европейский и Международный стандарты качества питьевой воды и унифицированные методы исследования, разработанные комиссией экспертов СЭВ. В СССР индекс энтерококков определяется при коли-индексе более 10 000 (см. Колииндекс, колититр). Для этого десятикратные разведения воды засевают в два параллельных ряда щелочно-полимиксиновой среды. После инкубации в течение 24 часов при t° 37° производят предварительный учет и высев из флаконов или пробирок с признаками роста (помутнение, изменение цвета среды) на сектора молочно-ингибиторной среды в чашках Петри. Еще через 24 часа инкубации осуществляют второй высев на молочно-ингибиторную среду. Рост энтерококков на молочно-ингибиторной среде характеризуется образованием колоний с черным блеском. Индекс рассчитывают по специальным таблицам. Так как S. faecalis отмирают в окружающей среде быстрее, чем S. faecium, обнаружение первого вида энтерококков свидетельствует о свежем фекальном загрязнении человеком исследуемого объекта.
Энтерококки способны размножаться в пищевых продуктах даже при комнатной температуре. Загрязненная энтерококком пища вызывает пищевые токсикоинфекции (см. Токсикоинфекции пищевые), при которых чаще выделяются протеолитические варианты S. faecalis.
Энтерококки способны вызвать у человека гнойно-воспалительные процессы различной локализации, которые протекают обычно вяло, хронически. Могут возникать моноинфекции, но чаще энтерококки находятся в ассоциациях с кишечной палочкой (см.), протеем (см. Proteus), стафилококками (см.). Из гноя, отделяемого ран, верхних дыхательных путей чаще выделяются гемолитические варианты S. faecalis. Большинство взятых штаммов оказываются устойчивыми к пенициллину, неомицину, обладают рядом признаков патогенности — коагулируют плазму, продуцируют гиалуронидазу, ДНК-азу, фибринолизин, лецитиназу, протеиназу, лизоцим, вирулентны в опытах заражения мышей. Признаки патогенности проявляются у свежевыделенных культур и исчезают при пересевах в лабораторных условиях.
Библиогр.: Беляков В. Д., Ходырев А. П. и Тотолян А. А. Стрептококковая инфекция, Л.,1978; Вершинина В. И. и Исхакова С. X. Белковые комплексы энтерококков, антигенный спектр и вопросы таксономии, Журн. микр., эпид. и иммун., № 2, с. 51, 1982; Корш Л. Е. и Артемова Т. 3. Ускоренные методы санитарно-бактериологического исследования воды, М., 1978; Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней, под ред. H. Н. Жукова-Вережникова, т. 6, с. 489, М., 1964; Справочник по микробиологическим и вирусологическим методам исследования, под ред. М. О. Биргера, с. 254, М., 1982; Bergey’s manual of determinative bacteriology, ed. by R. E. Buchanan a. N. E. Gibbons, Baltimore, 1975.
Читайте также:


