Дифтерийный токсин ингибирует стадию в процессе трансляции
Собственно трансляция происходит в рибосомах и включает три стадии:
1. Инициация: образование инициирующего комплекса, который включает метионин-тРНКи (инициирующая), мРНК и рибосомальные белки. Комплекс состоит из 40S и 60S субъединиц, объединенных в 80S-рибосому. Целостная рибосома имеет аминоацильный (А-сайт) и пептидильный участок (Р-сайт). Первый отвечает за связывание аминоацил-тРНК, а второй – за связывание растущей полипептидной цепи.
2. Элонгация. Суть элонгации заключается в возникновении пептидных связей между остатками аминокислот с образованием полипептидной цепи, в которой последовательность аминокислот отвечает последовательности кодонов в мРНК. Элонгации нуждается в энергии ГТФ и факторах элонгации – EF1 и EF2.
Элонгация начинается после того, как мет-тРНКи займет пептидильний центр рибосомы. В свободный аминоацильний сайт рибосомы могут поступать любые аминоацил-тРНК, но остается в нем лишь та, антикодон которой комплементарен кодону на мРНК. В результате метионил-тРНК и вторая аминоацил-тРНК сближаются между собой, а пептидилтрансфераза (точнее пептидилтрансферазный центр), катализирует образование пептидной связи между ними. Заметим, что пептидилтрансферазный центр есть рибозимом и образуется как рибосомальной РНК (28S рРНК), так и белками большой субъединицы рибосом. После образования пептидной связи со второй аминокислотой высвобождается мет тРНКи и происходит транслокация (перемещение) образованного дипептида (дипептидил-тРНК) из аминоацильного сайта в пептидильный. Процессу нужна энергия ГТФ и фактор элонгации ЕF2. В результате транслокации освобождается аминоацильний сайт, в который поступает новая аа-тРНК, антикодон которой комплементарен очередному кодону на мРНК, а пептидилтрансфераза наращивает цепь белка еще на одну аминокислоту по такой схеме:
Пептидил-тРНК(1)+ аминоацил-тРНК(2) >тРНК(1)+ пептидиламиноацил- тРНК(2).
Этот конвеер работает непрерывно до того момента, пока на мРНК не появятся терминирующие кодоны (UAA, UGA, UAG).
3.Терминация трансляции. Появление терминирующих кодонов на мРНК
способствует завершению трансляции, поскольку этим кодонам не отвечает ни одна из аа-тРНК. С этими кодонами связываются факторы терминации (eRF1 и eRF2), которые стимулируют гидролазную активность пептидильного центра. От новообразованного пептида отщепляется тРНК, и он отделяется от пептидильного центра. Рибосома диссоциирует на две субъединицы, а мРНК гидролизуется на свободные мононуклеотиды.
Полисомы (полирибосомы). В трансляции мРНК могут принимать участие несколько рибосом. Как только первая рибосома покидает инициирующий кодон на мРНК, он становится доступным для другой рибосомы и т.д. Поэтому на одну цепь мРНК может быть нанизано 5- 6 рибосом. Конвеерный характер трансляции существенно повышает скорость синтеза белка.
Ингибиторы трансляции у прокариот: стрептомицин блокирует стадию инициации; тетрациклин - связывание аминоацил-тРНК с рибосомами, хлорамфеникол - пептидилтрансферазную активность, эритромицин - процесс транслокации. Циклогексимид тормозит пептидилтрансферазную активность у эукариот, а пуромицин конкурирует с аминоацил-тРНК за аминоацильний сайт рибосомы. Ингибитором трансляции является дифтерийный токсин. А-фрагмент токсина имеет активность АДФ-рибозилтрансферазы и переносит АДФ-рибозу с НАД на фактор элонгации eEF2, инактивируя его. Интерфероны – белки, которые продуцируются лимфоцитами при заражении организма вирусами, активируют протеинкиназы, фосфорилирующие фактор инициации eIF2 и инактивируют его. Блокируется синтез вирусных и клеточных белков, наступает гибель инфицированных клеток, чем предупреждается распространение вируса.
4 Нематричный синтез полипептидов. В клетке может происходить синтез полипептидов и без участия мРНК и рибосом. Он осуществляется двумя путями. Первый: синтез из аминокислот при участии мультиферментных комплексов. Так синтезируется глутатион, пептидная часть пептидогликанов бактериальной стенки, антибиотик грамицидин, рилизинг-факторы гипоталамуса и другие небольшие пептиды. Второй: нарезание пептидов из более длинной полипептидной цепи специальными протеазами. Так из белка-предшественника проопиомеланокортина синтезируются липотропины, меланоцитстимулирующий гормон, кортикотропин, эндорфины и энкефалины.
Токсин дифтерийной палочки (Corynebacterium diphtheriae) является простым. Он синтезируется в виде одной полипептидной цепи с м.в. 62 кД. В результате активации происходит гидролиз пептидной связи в области дисульфидной петли белковой молекулы, в присутствии тиоловосстанавливающих агентов и белок протоксина фрагментируется на 2 полипептида: фрагмент А с м.в. 22-24 тыс. и фрагмент В - 38-39 тыс.
Фрагмент А - обладает ферментативными свойствами, является активатором (218 а.о.) и фрагмент В (371 а.о.) является рецептором.
Субьединица А обладает НАД - гликогидролазной активностью и АДФ - рибозилтрансферазной активностью.
Токсическое действие дифтерийного токсина осуществляется в результате последовательных процессов:
1) адсорбция на специфических клеточных рецепторах;
2) транспорт через плазматическую мембрану;
3) инактивация внутриклеточной мишени, участвующей в биосинтезе белка.
Клеточным рецептором, с которым взаимодействует дифтерийный токсин, является гликопротеин плазматической мембраны, м.в. 160 000. Этот гликопротеин обнаружен лишь у чувствительных к токсину клеток. Предполагается, что он обладает свойством протеазы.
Транспорт токсина через плазматическую мембрану может быть осуществлен 2 путями: активаторная субьединица проникает при помощи везикул, включающихся в эндоцитоз или проникновение активаторной субьединицы А идет с помощью специальных каналов в липидных двухслойных мембранах. Эти каналы образуются с помощью гидрофобного фрагмента В.
В основе токсического действия дифтерийного токсина лежит его способность подавлять биосинтез белка в чувствительных клетках.
Дифтерийный токсин специфически инактивирует фактор элонгации - 2, который соединяется с рибосомами и участвует в элонгации полипептидных цепей.
На первом этапе токсин гидролизует НАД до АДФ-рибозы и никотинамида, на втором - переносит АДФ - рибозу на EF-2. При этом образовавшийся комплекс полностью неактивен.
Под действием формалина в молекуле токсина образуется метиленовый мостик, который препятствует диссоциации токсина на фрагменты А и В. Особое значение имеют детерминанты, локализованные на С - терминальном участке фрагмента В. От них зависит присоединение токсина к клеточной мембране. Поэтому антитела только против этого участка полностью нейтрализуют токсин.
Другие токсины бактерий вызывающие блок синтеза белков.
Также как и у коринебактерий экзотоксин А Pseudomonas aeruginosa вызывает АДФ-рибозилирование фактора элонгации 2 (EF-2), нарушая синтез белка.
Shigella dysenteriae серотипа 1 и некоторые другие клинически значимые бактерии, например Stx-продуцирующие (Stx - Токсин Шига) E.coli (ЕНЕС [энтерогеморрагические E.coli]), вырабатывают Stx-токсины (или веротоксины). Stx-токсины инактивируют рибосомальную РНК, нарушая ее взаимодействие с факторами эллонгации. Подавление белкового синтеза данной группой токсинов приводит в конечном итоге к гибели клетки-мишени.
Stx-токсины являются мощными цитотоксинами и могут быть разделены на две группы, отличающиеся по антигенным свойствам и имеющие 50-60% гомологии: Stx=Stx-1 и Stx2-токсины. Stx-токсин S.dysenteriae серотипа 1 и Stx1-токсин E.coli отличаются только одной аминокислотой. Различные модификации Stx2-токсинов обнаружены у штаммов E.coli. Хотя Stx2-токсин рассматривается в качестве прототипа этой группы, были найдены различные модификации, отличающиеся по антигенным свойствам, степени сродства к рецепторам и способности активироваться под действием интестинальной слизи. Некоторые из перечисленных свойств обусловлены различиями в одном-двух нуклеотидах кодирующих генов.
Ген stx у S.dysenteriae всегда расположен на хромосоме, тогда как гены, кодирующие Stx1 и Stx2, могут входить в состав бактериальной хромосомы или генетического материала лизогенных бактериофагов. Гены, кодирующие А и В субъединицы Stx-токсинов (stxA и stxB соответственно), объединены в оперон. Оперон Stx/Stx1-токсинов (но не Stx2) содержит область, ответственную за регуляцию экспрессии Stx- и Stx1-токсинов, которая в свою очередь зависит от наличия ионов железа. На экспрессию Stx2-токсина не влияют ни наличие железа, ни другие внешние факторы. Однако кишечная слизь усиливает активность некоторых разновидностей Stx2-токсина. Stx-токсины, не способны активно выделяться через стенку бактериальной клетки. Предполагается, что в данном случае токсин попадает во внешнюю среду при лизисе клетки.
Stx-токсины имеют типичную АВ-структуру, то есть ферментативно активная субъединица А нековалентно связана с субъединицей В, непосредственно взаимодействующей с мишенью.
Субъединица А, обладающая ферментативной активностью, действует как N-гликозидаза, отщепляя единичный адениновый остаток от 28S рибосомальной РНК. Подобная депуринизация в конечном итоге подавляет синтез белка в пораженной клетке. При этом к действию N-гликозидазы одинаково чувствительны рибосомы про- и эукариот.
EHEC лишь недавно приобрела статус "проблемного" микроорганизма после вспышки в 1983 г. геморрагического колита, вызванного употреблением гамбургеров, подвергнутых недостаточной термической обработке. EHEC О157:Н7 ежегодно вызывает в США около 20 тыс. случаев геморрагического колита, тысячу случаев гемолитико-уремического синдрома и 100 летальных исходов.
Ингибиторы синтеза белка
Одним из путей выяснения механизмов синтеза нуклеиновых кислот и белков в клетках является использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не оказывая влияния на организм человека. Некоторые препараты действительно обладают таким действием, однако многие из них оказываются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена ниже с целью выяснения механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Одним из мощных ингибиторов белкового синтеза является пуромицин. В результате структурного сходства с концевым остатком АМФ в аминоацил-тРНК' он легко взаимодействует с А-участком пептидил-тРНК с образованием пептидил-пуро-мицина.

Поскольку пептидил-пуромицин не несет на себе триплета антикодона, он тем самым тормозит элонгацию пептидной цепи, вызывая обрыв реакции. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин тормозит синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, который вследствие высокой токсичности применяется редко. Он оказывает тормозящее влияние на синтез всех типов клеточной РНК, в особенности мРНК. Это свойство вызвано тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней. Можно считать, что актиномицин D ингибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу путем связывания с ферментом. Наиболее чувствительна к нему бактериальная РНК-полимераза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина t). Следует указать на недавно открытое противовирусное действие рифамицина, в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. По-видимому, этот антибиотик найдет применение в лечении опухолей, вызываемых вирусами.
Выяснены механизмы действия ряда других антибиотиков, применяемых при лечении тифозных инфекций. Так, хлорамфеникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий. На этот процесс в 80S рибосоме он не действует. Противоположное тормозящее действие на синтез белка в 80S (без поражения процесса в 70S рибосоме) оказывает циклогексимид, являющийся ингибитором транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделен способностью катализировать реакцию АДФ-рибозилирования фактора элонгации (трансляционный фактор-2, TF-2). выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину обусловлена трудностью проникновения токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним -штаммов бактерий. Высказано предположение, что эти антибиотики вызывают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами; например, кодон УУУ вместо фенилаланина начинает кодировать лейцин — в результате образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считается, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S субчастице рибосомы. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомального механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т. е. тормозят синтез белка в клетках животных.
Полученные к настоящему времени данные по механизму действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 13.2 (по Харперу).
Рекомендуем к прочтению:
Выводы
1. В физиологическом состоянии спортсмены и контрольная группа характеризовались одинаковым уровнем обмена глюкозы. 2. При максимальной физической нагрузке у спортсменов высокой квалификации наблюдается экономизация потока глюкозы за счё .
Результаты исследования и их обсуждение. Реакции сердечно-сосудистой системы юношей и девушек на стрессорные воздействия в зависимости от вида стресса и психоэмоционального состояния испытуемых
В исследованиях на людях изучали влияние стрессов на ССС с использованием разнообразных стрессорных воздействий, близких к средовым ситуациям и адекватных социо-биологическим особенностям человека. Проведенные исследования позволили выяви .
Продолжительность жизни, численность и плотность населения ласки в Приморском крае
Плотность населения ласки сильно варьирует в зависимости от условий обитания в конкретной стации и конкретном году, так как эти зверьки очень зависимы от состояния их кормовой базы (численности мелких млекопитающих). При массовом размноже .
Один из путей выяснения тонких молекулярных механизмов синтеза нуклеиновых кислот и белков в клетках – использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не влияя на клетки организма человека. Некоторые препараты, действительно, оказывают такое избирательное действие, взаимодействуя с белками рибосом прокариот и выключая бактериальный синтез белка. Однако многие из них являются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена с целью выяснения молекулярного механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Один из мощных ингибиторов белкового синтеза – пуромицин. Он представляет собой аналог концевого участка аминоацил-тРНК адениловой кислоты и поэтому легко взаимодействует с А-центром пептидил-тРНК с образованием пептидил-пуромицина :
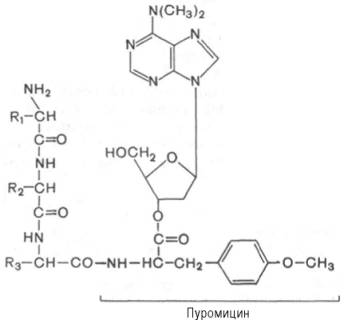
Пептидил-пуромицин не несет на себе триплета антикодона и поэтому тормозит элонгацию пептидной цепи, вызывая обрыв реакции, т.е. преждевременную терминацию синтеза белка. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин оказывает тормозящее действие на синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, однако вследствие высокой токсичности препарат применяется редко. Он тормозит синтез всех типов клеточной РНК, особенно мРНК. Данное свойство объясняется тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней; это дает основание считать, что актиномицин D ин-гибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу, связываясь с ферментом. Наиболее чувствительной к нему оказалась бактериальная РНК-полиме-раза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина D. Следует указать, кроме того, на недавно открытое противовирусное действие рифамицина; в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. Это дает основание предположить, что данный антибиотик найдет применение в клинической онкологии при лечении опухолей, вызываемых вирусами.
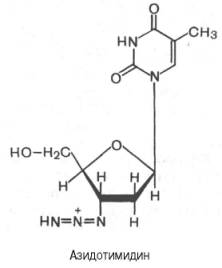
Одним из мощных ингибиторов синтеза вирусной РНК оказался азидотимидин (3'-азидо-2',3'-дидезокситимидин), синтезированный еще в 1964 г. в надежде на его противоопухолевый эффект. Было показано, что вирус иммунодефицита человека (ВИЧ) содержит РНК-й геном, в составе которого имеются как стандартные гены ретровирусов, так и необычные небольшие гены со множеством функций. Последние, в частности, подвержены мутациям с высокой скоростью вследствие низкой точности репликации, вызванной свойствами обратной транскриптазы. Эта вирусная обратная транскриптаза иммунодефицита человека оказалась наделенной значительно большим сродством к азидотимидину, чем к природному дезокситимидинтрифосфату (dTТФ). Азидотимидин конкурентно тормозит связывание dTТФ, вызывая тем самым терминацию (окончание) синтеза вирусной РНК.
Выяснены некоторые детали механизма действия ряда других антибиотиков, используемых при лечении тифозных инфекций. Так, хлорам-феникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий; на этот процесс в 80S рибосоме он не действует. Тормозит синтез белка в 80S рибосоме (без поражения процесса в 70S рибосоме) циклогексимид – специфический ингибитор транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделенным способностью катализировать реакцию АДФ-рибозилирования фактора элонгации эукариот (eEF-2), выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину, вероятнее всего, обусловлена трудностью или полным отсутствием проникновения (транспорта) токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним штаммов бактерий. Было высказано предположение, что эти антибиотики обусловливают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами: например, кодон УУУ вместо фенилаланина начинает кодировать лейцин, в результате чего образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считают, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S рибосоме. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Пенициллины не являются истинными ингибиторами синтеза белка, однако их антибактериальный эффект связан с торможением синтеза гексапептидов, входящих в состав клеточной стенки. Механизм их синтеза отличается от рибосомного механизма синтеза белка. Эритромицин и олеандомицин тормозят активность транслоказы в процессе трансляции, подобно циклогексимиду, исключительно в 80S рибосомах, т.е. тормозят синтез белка в клетках животных.
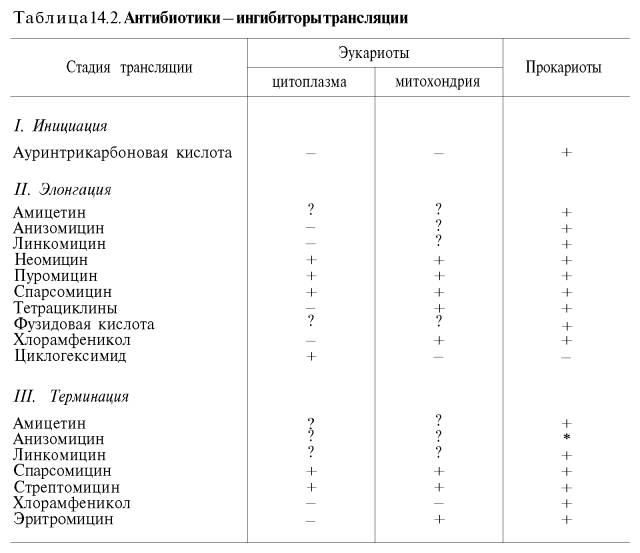
Полученные к настоящему времени данные о механизме действия антибиотиков на синтез белка с учетом стадии и топографии процесса трансляции суммированы в табл. 14.2 (по Харперу с небольшими изменениями).
Следует еще раз подчеркнуть, что нарушение или выпадение любого звена, участвующего в синтезе белка, почти всегда приводит к развитию патологии, причем клинические проявления болезни будут определяться природой и функцией белка, синтез которого оказывается нарушенным (структурный или функциональный белок). Иногда синтезируются так называемые аномальные белки как результат действия мутагенных факторов и соответственно изменения генетического кода (например, гемоглобин при серповидно-клеточной анемии). Последствия этих нарушений могут выражаться в развитии самых разнообразных синдромов или заканчиваться летально.
Следует отметить, однако, что организм располагает мощными механизмами защиты. Подобные изменения генетического аппарата быстро распознаются специфическими ферментами – рестриктазами, измененные последовательности вырезаются и вновь замещаются соответствующими нуклеотидами при участии полимераз и лигаз.
Дифтерийный токсин — простой белок. Его составу и механизму действия посвящено много работ Рарреnheimer и его школы (Pappenheimer, 1966), а также Barksdale с сотрудниками и многих других исследователей (Barksdale, 1970). Pope и Stivens (1952, 1958) получили Кристаллический токсин, у которого относительная молекулярная масса была примерно 62 000—64 000, константа седиментаций 4, 2S (Pope, Stivens, 1952, 1958; Gill, Pappenheimer, 1971, и др.).
Токсины различных серологических вариантов С. diphtheriae var. gravis и mitis идентичны токсину производственного штамма PW-8 и нейтрализуются производственной антитоксической сывороткой.
В кристаллическом токсине методом преципитации в геле обнаруживают до 3, а нередко и 4 антигенов (Pope, Stiwens, 1958). Такая иммунохимическая неоднородность могла зависеть, во-первых, от небольшой примеси других белков, продуцируемых коринебакте- риями и способных кристаллизоваться совместно с токсином. В частности, такая возможность показана для ДНК-азы и нейраминидазы (Morijama, Barksdale, 1967). Во-вторых, нельзя исключить, что молекула токсина с относительной молекулярной массой 62 000 имеет более чем одну антигенную детерминанту. В настоящее время известны 2 иммунохимически неоднородных антигенных фрагмента токсина — А и В. Они получаются из кристаллического токсина при действии на него некоторых протеаз, в частности трипсина, в присутствии тиоловых соединений (Gill, Pappenheimer, 1971, и др.). Примесь таких фрагментов всегда есть в кристаллическом токсине (Ushida е. а., 1971). С антитоксической сывороткой и кристаллическим токсином эти фрагменты дают. самостоятельные линии преципитации (Libich, 1964, и др.).
Токсин очень ядовит: 0,06 мкг токсина убивает морскую свинку массой 250 г (Barksdale е. а., 1960). Еще в 1957 г. Lennox и Kaplan на перевиваемых культурах клеток HeLa впервые показали, что токсин не влияет на дыхание, которое в течение нескольких часов после интоксикации продолжалось в нормальном ритме. В то же время токсин резко тормозил синтез белков: задерживалось включение радиоактивного метионина. Через 7 ч клеши погибали.
В настоящее время механизм действия дифтерийного токсина на ткани и органы млекопитающих изучают на молекулярном уровне. Дифтерийный токсин, по-видимому, действует как специфический ингибитор фермента (аминоацилтрансфераза 2), участвующего у эукариотических клеток в сборке полипептидных цепей из аминокислот ( Gill е. а., 1969). Токсин действует на этот фермент как катализатор реакции его связывания с никотинамиддинуклеотидом — НАД: НАД + аминоацилтрансфераза 2 ⇆ аденозиндифосфорибоза- аминоацилтрансфераза 2 + никотинамид + Н + .
При этом молекула НАД расщепляется с высвобождением никотинамида. Аденозинфосфорибозная половина НАД связывается с аминоацилтрансферазой устойчивой ковалентной связью. Связанная аминоацилфераза неактивна, белок не строится, клетки погибают (Collier, 1967; Honjo е. а., 1968; Gill е. а., 1969, и др.).
Хотя эта реакция обратима, равновесие сдвигается в сторону инактивации аминоацилтрансферазы 2. Только в свободном состоянии этот фермент инактивируется токсином; если он связан на рибосомах, токсин его не атакует (Gill е. а., 1969). Реакция связывания фермента в присутствии дифтерийного токсина высокоспецифична: ни один из тканевых белков не в состоянии отщепить аденозиндифосфорибозу от никотинамиддинуклеотида в присутствии токсина (Collier, 1967, и др.). В клеточных экстрактах этот инактивированный фермент удавалось реактивировать до полной активности только при избытке токсина и никотинамида (Gill е. а., 1969). Поскольку токсин катализирует реакцию связывания аминоацилтраноферазы 2, а ее в клетке мало, ничтожно малое число молекул токсина вызывает гибель клеток.
Baseman и соавт. (1970) обнаруживали меченный 1251 токсин во всех тканях и органах морских свинок и кроликов, исключая нервы и мозг. Особая тропность токсина к мышечной ткани не подтвердилась. Первичное действие токсина на ткани в живом организме так же, как и в пробирке, по мнению авторов, заключается в инактивации аминоацилтрансферазы 2.
При окислительном дезаминировании глутамата образуется:
Дифтерийный токсин ингибирует стадию в процессе трансляции:
В синтезе пуриновых азотистых оснований принимает участие:
Источником аминогруппы в биосинтезе ГМФ из ИМФ является...
Нарушение синтеза меланина происходит при патологии обмена .
Вещество, необходимое для биосинтеза пуриновых нуклеотидов:
На рибосомах происходит этап биосинтеза белка :
Транспорт меди осуществляется..
Активная форма витамина D3 способствует:
всасыванию Са и Р в кишечнике
Основной катион внутриклеточной жидкости представлен.
В крови взрослого человека преобладает.
Содержание воды в организме человека при старении:
Содержание кальция в сыворотке крови составляет.
Общее содержание воды в организме взрослого человека составляет:
гемоглобин, связанный с углекислым газом
Непрямой билирубин - это.
комплекс с альбуминами плазмы крови
Ионы хлора участвуют в процессах..
синтеза HCl в желудке
Физиологическое значение рН крови.
Функционирование белковой буферной системы обеспечивается:
наличием кислотно-основных групп в молекуле белков
Белковый коэффициент - это
отношение количества альбуминов к количеству глобулинов
Одной из функций неорганического фосфора является:
компонент костной ткани
Транспорт непрямого билирубина осуществляется.
Гормоном стимулирующим обратное всасывание ионов натрия в почечных канальцах является.
появление патологических белков
Причиной развития серповидноклеточной анемии является.
замена глу на вал в β-цепи гемоглобина
В белковом спектре гаптоглобин располагается.
α - глобулиновой зоне
Ретинолсвязывающий белок находится .
α - глобулиновой зоне
Предшественником стеркобилина является.
К патологическим белкам относят.
Основной биологической функцией магния является:
участие в киназных реакциях (с затратой АТФ)
Белки поддерживают онкотическое давление крови благодаря.
способности связывать воду
В синтезе гема участвует .
В процессах свёртывания крови участвует.
При лейкозах в плазме крови появляется .
Реакцию образования вердоглобина из гемоглобина катализирует..
Основное количество билирубина выводится из организма:
ИТОГОВЫЙ
При ковалентной модификации фермента происходит реакция:
Концентрация глюкозы в крови здорового человека, находящегося на ритмичной полноценной диете и вне эмоционального стресса:
О ходе ферментативной реакции свидетельствуют признаки:
уменьшение количества субстрата
Энергетическая ценность реакций окислительного декарбоксилирования пирувата составляет:
Транспорт непрямого билирубина осуществляется..
Акцептором протонов и электронов от активированных жирных кислот служит кофермент:
Пепсиноген секретируется клетками желудка:
Характер связи между остатками глюкозы в молекуле клетчатки:
При увеличении концентрации субстрата скорость ферментативной реакции:
увеличивается до полного насыщения активного центра фермента
Гидролитическое расщепление липидов у взрослого человека начинается в
. в 12-ти перстной кишке
Возможная причина физиологической гипергликемии:
всасывание глюкозы из кишечника – после приема пищи
Устойчивость белков в растворах обеспечивают факторы:
гидратная оболочка и заряд молекул
γ-Глобулины относятся к классу сложных белков.
Оротовая кислота используется для биосинтеза .
Биохимический ответ клетки на действие тиреоидных гормонов:
Фермент, участвующий в гидролитическом расщеплении триацилглицеринов пищи:
Молекулу хондроитинсульфата стабилизирует связь
Простетической группой цитохромов является.
Источником рибозо-5-фосфата для синтеза пуриновых нуклеотидов является.
Причиной развития серповидноклеточной анемии является
замена глу на вал в β-цепи гемоглобина
Источник энергии для синтеза лимонной кислоты в ЦТК:
макроэргическая связь ацетил-КоА
Белки поддерживают онкотическое давление крови благодаря.
способности связывать воду
В укороченную цепь переноса электронов не входит кофермент:
Кодон-терминатор в процессе трансляции:
К увеличению содержания холестерина в крови при атеросклерозе может привести избыточное употребление:
Ретинолсвязывающий белок находится
α - глобулиновой зоне
Из α - аминокислот синтезируется гормон:
Фермент гликолиза, катализирующий восстановление пирувата до лактата:
Моноацилглицерины в тонком кишечнике всасываются в форме
в составе мицелл
При окислительном дезаминировании глутамата образуется:
Геранилпирофосфат из активного изопрена (С5) образуется в процессе синтеза холестерина по схеме:
В субстратном фосфорилировании участвует метаболит гликолиза:
Гормон, регулирующий процесс окислительного фосфорилирования в митохондриях:
Участие в гидроксилировании субстратов принимает цитохром:
ЛПВП выполняют функцию:
переносят эфиры холестерина из тканей в печень
Четвертичная структура белка это - ..
объединение нескольких отдельных полипептидных цепей в единую структуру
Незаменимые аминокислоты - это.
аминокислоты, которые не могут синтезироваться в организме человека
Водорастворимым антиоксидантом является:
Состав 3’-концевого триплета всех транспортных РНК:
В организме синтезируется жирная кислота.
| синтез глюкозы из неуглеводных предшественников |
Биологическая роль АТФ:
запасная форма энергии в организме человека
Вторичная структура белка это - .
укладка линейной полипептидной цепи в пространстве
Наилучшими эмульгирующими свойствами обладает желчная кислота:
Тормозит распад гликогена и стимулирует его синтез гормон.
Растворимость белка повышают радикалы аминокислот.
Основой глицерофосфолипидов является - .
Генетическую информацию из ядра к рибосомам переносит:

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Читайте также:


