Факторами патогенности хеликобактер являются
Язвенная болезнь - заболевание, которое характеризуется наличием язвенного дефекта в слизистой желудка или двенадцатиперсной кишке. Открытие H.pylori обусловило переворот в представлениях об этиологии, патогенезе, лечении и профилактике язвенной болезни. Язвенная болезнь практически в 100% ассоциирована с хеликобактером пилори. Существенную роль имеют также стрессовые факторы и психологические особенности больных, а также генетические факторы в развитии болезни.
Морфологические и культуральные свойства - аналогичны Campylobacter. Предпочитает шоколадный агар.
Биохимические свойства. Имеет уреазу, оксидаза- и каталаза- положителен.
Антигенные свойства. Имеет О- и Н- антигены.
Патогенез поражений. Хеликобактеры проникают через слой слизи (чаще в антральной части желудка и двенадцатиперсной кишке), прикрепляются к эпителиальным клеткам, проникают в крипты и железы слизистой оболочки. Антигены бактерий (в первую очередь ЛПС) стимулируют миграцию нейтрофилов и вызывают острое воспаление. Хеликобактеры локализуются в области межклеточных ходов, что обусловлено хемотаксисом на мочевину и гемин (разрушение гемоглобина эритроцитов в микроциркуляторном русле). Под действием уреазы хеликобактеров мочевина расщепляется до аммиака, с действием которого связано повреждение слизистой оболочки желудка и двенадцатиперсной кишки. Многие ферменты (муциназа, фосфолипаза и др.) также могут стимулировать нарушения целостности слизистых.
К факторами патогенности H.pylori в первую очередь относят факторы колонизации (адгезию, подвижность), факторы персистенции и факторы, вызывающие заболевание. Ключевые факторы в тропизме и патогенности H.pylori включают механизмы адгезии и секреции бактериальных токсинов. Представлены доказательства ведущей роли Lewis B антигена как рецептора для адгезии. Кроме них имеют значение муцины желудка и сульфатиды слизистой желудка. Выявлен белок Bab A возбудителя (адгезин), который позволяет микроорганизму связываться с групповым антигеном крови Lewis B, присутствующим на поверхности клеток эпителия желудка. Другими факторами патогенности являются cag A (цитотоксин- ассоциированный ген) и vac A (вакуолизирующий цитотоксин). Штаммы, экспрессирующие эти маркеры вирулентности, относятся к штаммам первого типа, которые ассоциированы с повышенным ульцерогенным и воспалительным потенциалом, в отличии от штаммов второго типа, не имеющих этих факторов.
Присутствие всех трех факторов (Bab A, cag A, vacA) является существенным для проявления патогенных свойств H.pylori (триплет - позитивные штаммы). Повреждающее действие на слизистую может быть связано как с прямым действием бактериальных токсинов, так и с опосредованным влиянием через иммунную систему. Длительная персистенция возбудителя связана с рядом механизмов, позволяющих преодолевать защитные барьеры слизистой, и способностью формирования кокковых, не обладающих патогенным потенциалом, форм.
H.pylori не всегда приводит к развитию язвенной болезни, однако при язвенной болезни этот возбудитель выявляют постоянно. Факторы, определяющие ульцерогенность H.pylori, усиленно изучаются.
Лабораторная диагностика должна быть комплексной, основанной на нескольких тестах. Методы выявления могут быть инвазивными (связанными с необходимостью взятия биоптата слизистой) и неинвазивными (косвенными).
Основные методы выявления H.pylori в биоптатах слизистой.
1.Микроскопические методы (окраска гематоксилином - эозином, акридиновым оранжевым, по Граму, водным фуксином, инпрегнация серебром; фазово - контрастная микроскопия с определением подвижности).
2.Определение уреазной активности.
3.Выделение и идентификация возбудителя на плотных средах (чаще кровяных). Посевы осуществляют на кровяной агар, кровяной агар с амфотеррицином, эритрит - агар с амфотеррицином. Культивируют 5-7 суток при 37о С в микроаэрофильных, аэробных и анаэробных условиях. Принадлежность определяют по морфологии микроорганизмов и их колоний, винтообразной подвижности, росту в микроаэрофильных условиях и отсутствию роста в аэробных и анаэробных условиях и при температурах +25 и +42о С, по наличию оксидазной, каталазной и уреазной активности.
4.Выявление антигенов возбудителя в ИФА.
5.ПЦР- диагностика - наиболее чувствительный и специфичный тест.
Среди неинвазивных методов - "дыхательный тест", ИФА для выявления IgG и IgA - антител.
Лечение комплексное, с применением методов санации (эррадиации возбудителя). Применяют Де- НОЛ (коллоидный субцитрат висмута), ампициллин, трихопол (метронидазол) и др.
Контрольные вопросы:
1.Общая характеристика бактерий кишечной группы. Общие принципы микробиологической диагностики кишечных инфекций.
2.Классификация патогенных кишечных палочек. Морфологические, биологические и антигенные свойства эшерихий.
3.Патогенез эшерихиозов, вызванных разными группами патогенных эшерихий. Микробиологическая диагностика.
4.Морфологические и биологические свойства сальмонелл. Классификация сальмонелл. Антигенная структура сальмонелл. Схема Кауфмана-Уайта.
5.Патогенез тифопаратифозных инфекций и сальмонеллезных пищевых токсикоинфекций.
6. Методы микробиологической диагностики брюшного тифа и паратифов в разные сроки заболевания. Серологическая диагностика брюшного тифа. Реакция Видаля.
7.Методы микробиологической диагностики сальмонеллезных токсикоинфекций
8. Классификация, морфологические и биологические свойства шигелл.
9. Патогенез и микробиологическая диагностика бактериальной дизентерии (шигеллеза).
10.Классификация, морфологические и биологические свойства холерных вибрионов.
11.Методы микробиологической диагностики холеры. Экспресс диагностика холеры.12.Препараты для специфической профилактики, лечения и диагностики заболеваний, вызванных патогенными бактериями кишечной группы.
Набор факторов патогенности Н. pylori весьма выразителен, он складывается из ферментов агрессии, жгутиков, факторов ацидопротекции, адгезинов, поверхностных антигенов, индукторов воспаления, токсина. Экспрессия факторов патогенности зависит как от условий окружающей среды, в первую очередь, от ее кислотности, так и от фазы развития патологического процесса. Отдельные факторы патогенности выполняют по две и более сочетанные функции — активную локомоцию и адгезию, ацидопротекцию, индукцию воспаления и токсическое воздействие.
а) Жгутики. Молекулярная структура жгутика Н. pylori напоминает таковую прочих жгутиконосных бактерий: основная филамента, состоящая из упорядоченно расположенных субъединиц белка флагеллина, соединена крючком со стержневидным базальным телом, посредством трех колец фиксированном в толще наружной мембраны, пептидогликана и цитоплазматической мембраны.
Хотя в процессе вращения пучок переплетенных между собой жгутиков функционирует как единое целое, вращение каждого отдельного жгутика обеспечивается индивидуально так называемым жгутиковым мотором — расположенным у основания жгутика субмембранным ферментным комплексом.
От жгутиков бактерий иных родов жгутики Н. pylori отличаются наличием защитного чехла и колбовидного утолщения, венчающего их дистальный конец. Чехол жгутика, являющийся продолжением наружной мембраны бактериальной клетки, отличается наличием ацидорезистентных липидов и сохраняет отдельные структурные компоненты наружной мембраны, в первую очередь, липополисахарид.
Синтез в цитозоле белковых субъединиц жгутика, их экспорт на поверхность бактериальной клетки, сборка структурно и функционально полноценной органеллы представляют собой сложный стадийный процесс, контролирующийся почти четырьмя десятками генов, экспрессия которых усиливается, в частности при низких значениях pH окружающей среды.
Жгутики являются фактором патогенности, чьи патогенные свойства реализуются тотчас же по попадании бактериальных клеток в просвет желудка. Описанные выше структурные и функциональные особенности жгутикового пучка позволяют клеткам не только преодолевать толщу желудочного содержимого и достигать поверхности эпителиального пласта в относительно короткие сроки, но и противостоять желудочной перистальтике.
б) Ферменты агрессии. Упоминавшиеся выше ферменты Н. pylori обладают выраженным патогенным потенциалом: одни выполняют деструктурирующую фукцию, другие способствуют образованию токсических продуктов. Так, муциназа деполимеризует муцин желудочной слизи, разнообразные протеазы гидролизуют пепсин, фосфолипазы А1, А2 и С дезинтегрируют фосфолипиды апикальных мембран эпите-лиоцитов с образованием токсичного лизолецитина и освобождением биологически активных веществ, алкоголь-дегидрогеназа обусловливает образование токсичного ацетальдегида, уреаза — токсичного иона аммония.
Факторы ацидопротекции. Важнейшим, хотя и не единственным, фактором ацидопротекции, является уреаза, локализующаяся в цитозоле, в периплазматическом пространстве и в наружной мембране бактериальных клеток. Фермент представляет собой мультимерный белок массой 550 кД, состоящий из шести пар структурных субъединиц — UreA и UreB. Каждая субъединица UreB содержит в своем активном центре по два иона никеля Ni 2+ в качестве кофактора. Уреаза катализирует гидролиз мочевины до аммония и углекислоты, сопровождающийся весьма значительным защелачиванием окружающей среды: pH ее возрастает в среднем с 2 до 6.
Помимо уреазы, ацидопротекцию обеспечивают белки наружной мембраны, экспрессия которых усиливается при низких значениях pH, а также ЛПС, молекулярная структура которого также подвержена влиянию pH: в кислой среде экспрессируется более резистентная к действию кислоты конфигурация. Наконец, Н. pylori способен к продукции белка, ингибирующего выработку хлористоводородной кислоты париетальными клетками ямочного эпителия желудка.
в) Белки наружной мембраны. В состав наружной мембраны входят не менее сорока структурных белков, составляющих так называемое семейство белков наружной мембраны. Важнейшей их особенностью является то, что значительная часть молекулы оказывается выступающей за пределы мембраны, способствуя тем самым возникновению контакта с теми или иными окружающими бактериальную клетку объектами — метаболитами, сигнальными молекулами, поверхностными структурами эпителиальных клеток.
К числу белков наружной мембраны относятся в частности упоминавшиеся выше порины — белки, формирующие поры, и шапероны двух типов — Hsp60 и Hsp70 — белки, выполняющие вспомогательные, но незаменимые функции, например, связывание ионов никеля, предшествующее включению последнего в молекулу уреазы. Уровень содержания шаперонов в бактериальной клетке возрастает при стрессах различного рода, в частности при возрастании температуры окружающей среды, за что они получили название белков теплового шока. Шапероны являются эволюционно древними белками, вследствие чего у бактерий различных видов они отличаются высокой степенью гомологии не только между собой, но и с аналогичными белками цитоплазматических мембран эукариотических клеток.
Отдельные белки наружной мембраны обладают свойствами адгезинов, т.е. способностью к специфическому высокоаффинному связыванию с рецепторами — разнообразными по своей природе соединениями гомологичной им структуры. Белки подобного типа рассматриваются в соответствующем разделе.
г) Прочие белки наружной мембраны. К числу белков наружной мембраны относится и так называемый NapA-белок, способный активизировать фагоцитарную активность нейтрофилов. При этом NapA-белок является типичным бактериоферритином — белком, способным связывать одной своей молекулой до 40 атомов экзогенного железа, нейтрализуя тем самым его бактерицидное действие. Кроме того, описан белок, активирующий макрофаги (НР-МР1) — индуцирующий выброс ими разнообразных медиаторов воспаления. Оба белка изучены весьма слабо, однако их участие в индукции воспалительной реакции вполне очевидно.
д) Адгезины. H.pylori обладает широким набором адгезинов, взаимодействующих с рецепторами апикальных мембран эпителиоцитов и молекулами межклеточного матрикса, что способствует избирательному прикреплению бактериальных клеток к клеткам поверхностного эпителия желудка. Большинство адгезинов относится к классу лектинов — белков, способных специфически связываться с определенными олигосахаридными последовательностями, входящими в состав молекул тех или иных веществ, в частности, гликопротеинов. Так, входящие в число наиболее значимых адгезины BabA и BabB в качестве своего рецептора используют так называемый Lewis b -антиген — гликопротеин с терминально расположенными молекулами фукозы, экспрессирующийся на поверхности апикальных мембран клеток поверхностного эпителия желудка (а также эукариотических клеток иных типов, в первую очередь, эритроцитов).
Другой адгезии НраА, входящий, в частности, в состав чехла жгутика, взаимодействует с терминально расположенными молекулами сиаловой кислоты, входящей в состав огромного числа биологически значимых веществ — ганглиозидов апикальных мембран эпителиоцитов, муцина, молекул межклеточного матрикса — ламинина, витронектина, гепарансульфата, коллагена типа IV. Описаны также адгезины AlpA и AlpB, рецепторы к которым остаются неизвестными. В общей сложности описано более двадцати адгезинов Н. pylori, многие из которых не имеют специального названия и характеризуются лишь значениями молекулярных масс — от 19,6 до 64 кД; большинство из них отличается сродством к сиаловой кислоте.
Адгезивной активностью обладает также и ЛИС, рассматривающийся отдельно.
е) Липополисахарид (ЛПС). Как всякая грамотрицательная бактерия, Н. pylori обладает ЛПС — компонентом наружной мембраны, относящимся к классу фосфорилированных гликолипидов. Молекула ЛПС состоит из трех следующих друг за другом доменов: заякоренного во внешний слой наружной мембраны токсичного липида А и выдающихся за пределы бактериальной клетки сердцевины и О-специфической цепи. Липид А, состав которого характерен для вида в целом, состоит из дисахарида глюкозамина и связанных с ним остатков четырех жирных кислот. Сердцевина ЛПС состоит из олигосахарида — гомополимера 10-15 остатков гексоз; состав их варьирует в некоторых пределах от штамма к штамму. Наконец, О-специфическую цепь ЛПС составляют повторяющиеся субъединицы — гетерополимерные олигосахариды, вариации которых открывают широкие возможности для формирования штаммовых различий. Поскольку О-специфические цепи обладают антигенной специфичностью, упомянутые штаммовые различия представляют собой, в первую очередь, различия антигенные.
ЛПС Н. pylori способен выполнять функции адгезина: связываться терминальными остатками О-специфических цепей с молекулами муцина, а олигосахаридом сердцевины — с ламинином межклеточного матрикса. Отличительной и чрезвычайно важной в патогенетическом отношении характеристикой Н. pylori является его способность изменять олигосахаридный состав О-специфических цепей своего ЛПС таким образом, что он становится идентичным строению Lewis x - и Lewis y -анти-генов эукариотических клеток, т.е. мимикрирует под них, обеспечивая тем самым формирование одного из механизмов иммунного уклонения.
ЛПС грамотрицателытых бактерий обладает пирогенностью и летальной токсичностью, выраженной у разных их видов в различной степени в зависимости от химического состава каждого из доменов. У H. pylori упомянутые свойства проявляются в минимальной степени: его ЛПС в 1000 раз менее токсичен, нежели ЛПС бактерий рода Salmonella.
ж) Вакуолизирующий цитотоксин. H. pylori обладает способностью к продукции уникального экзотоксина, оказывающего специфическое повреждающее действие на эпителиоциты желудка — формирование в их цитозоле крупных вакуолей. Вакуолизирующий цитотоксин VacA синтезируется в цитозоле бактериальных клеток в виде белка массой 140 кД, состоящего из трех фрагментов. В процессе секреции в окружающую среду вакуолизирующий токсин утрачивает два вспомогательных фрагмента и трансформируется в активную токсическую форму молекулярной массой 95 кД. Шесть или семь копий 95-кД VacA при нейтральных значениях pH ассоциируют в неактивную четвертичную олигомерную структуру, диссоциирующую в обратном направлении на мономеры при pH — 3.
Мономер 95-кД VacA обладает всеми характеристиками токсина АВ-типа: состоит из двух субъединиц, одна из которых (А), массой 37 кД, обладает собственно токсичностью, вторая же (В), массой 58 кД, выступает в качестве связующего звена с цитоплазматической мембраной эпителиоцита. Последняя связывает В-субъеди-ницу VacA своим рецептором с эпидермальным фактором роста (EGF) — широко распространенным цитокином, регулирующим пролиферацию клеток эпителия желудка. В результате такого связывания в толще цитоплазматической мембраны формируется пора, сквозь которую субъединица А и проникает в цитозоль эпителиоцита.
Субъединица A VacA активирует систему тирозин-киназы клетки хозяина — комплекса ферментов, в свою очередь, активирующих разнообразные метаболические пути. В данном случае речь идет о локализующейся на мембранах эндоплазматического ретикулума аденозинтрифосфотазе (АТФазе) V-типа, способной формировать вакуоли с кислым содержимым, отделяющиеся от материнских мембран ретикулума. Мелкие вакуоли способны к слиянию друг с другом с образованием более крупных, подчас занимающих более половины объема цитозоля.
Хотя ген vacA, детерминирующий структуру апоферментной формы токсина массой 140 кД, имеют все без исключения штаммы Н. pylori, способностью к активной секреции указанного токсина обладают в среднем около половины их. Такой фенотип обозначается как tox+, а штаммы, им обладающие, относятся к типу I штаммов Н. pylori. Именно такие штаммы достоверно чаще ассоциируются с язвенной болезнью, дистальным раком и MALT-лимфомой желудка, тогда как нетокси-генные штаммы типа II с фенотипом tox чаще встречаются при хроническом гастрите.
Различия в способности к активной секреции токсина связывают с различными аллелями гена vacA. Так, штаммы H.pylori, несущие аллели si/ml гена vacA являются активно секретирующими вакуолизирующий цитотоксин, чего нельзя сказать о штаммах, несущих аллели sl/m2 и s2/m2.
Наконец, способность того или иного штамма H.pylori к секреции токсина определяется его cagA-статусом, биологическая характеристика которого приводится отдельно.
з) CagA-белок и сходные с ним белки. Части штаммов Н. pylori свойственна способность к образованию белка массой 128 кД, ассоциированного с цитотоксичностью и являющегося продуктом гена cagA. Этот белок является мощным индуктором воспалительной реакции в эпителии желудка; он активизирует так называемый ядерный фактор NF-kB клеток поверхностного эпителия желудка, в свою очередь, стимулирующий образование и секрецию интерлейкина-8 (IL-8) — собственно индуктора воспаления. Проникновение интегрированного в наружную мембрану бактериальной клетки CagA-белка в цитозоль эпителиоцита обеспечивается системой секреции IV типа, весьма редко встречающегося у патогенных для человека бактерий типа секреции. Система секреции IV типа предусматривает установление прямого сообщения между цитозолем эукариотической клетки хозяина и цитозолем бактериальной.
В формировании соответствующего канала принимает участие несколько специализированных белков, и сборка его становится возможной лишь по установлении тесного контакта между клетками, в свою очередь, обеспечивающегося адгезией. Помимо CagA-белка, H.pylori способен к образованию функционально сходных с ним белков — продуктов генов iceA и picB, также являющихся индукторами воспаления.
Ген cagA, как и гены, детерминирующие строение разнообразных белков, формирующих необходимый для секреции IV типа канат, локализуются в составе описанного выше острова патогенности cag PAI, присутствующего в геноме лишь части штаммов H.pylori — около половины их. Такие штаммы обладают положительным cagA-статусом и обозначаются как cagA -штаммы; в противоположность им cagA -штаммы имеют отрицательный cagA-статус.
Интересно, что способность к активной секреции вакуолизирующего цитотоксина ассоциируется с наличием гена cagA, иными словами, с наличием острова патогенности cag PAI. Хотя молекулярные механизмы этой связи остаются неизвестными (гены vacA и cagA не являются сцепленными), фенотипу tox+, очевидно, соответствует генотип cagA+ vacA+, тогда как фенотипу tox — генотип cagA- vacA+.
и) Биологические модели инфекции. Инфекционный процесс хеликобактерной этиологии может быть с успехом смоделирован in vitro на модели культур тканей различного типа и in vivo — на животных различных видов. Среди культур тканей, пригодных для моделирования хеликобактериоза, используются линии HeLa (для оценки вакуолизирующей цитотоксической активности), Нер-2 (для оценки адгезивной и инвазивной активности), AGM (для оценки способности H.pylori индуцировать злокачественную трансформацию эпителия). Среди животных в качестве объектов моделирования хеликобактериоза используются мыши (для моделирования гастрита и аденокарциномы желудка), монгольские песчанки (для моделирования гастрита и оценки эффективности действия антибактериальных средств противохеликобактерной направленности), морские свинки (для оценки эффективности противохеликобактерных вакцин), гнотобионтные поросята-сосунки и нечеловекообразные приматы (для экспериментального изучения деталей патогенеза хеликобактериоза и терапевтической эффективности различных схем противохеликобактерной эрадикационной терапии).
Редактор: Искандер Милевски. Дата публикации: 11.1.2020












Алгоритм диагностики и лечения сочетанной патологии желудочно-кишечного тракта и пародонта с учетом факторов патогенности Helicobacter pylori
В статье обсуждаются основные принципы комплексной диагностики пациентов с аболеваниями, ассоциированными с инфекцией Helicobacterpylori. Анализируется роль факторов патогенности микроорганизма. Приведен поэтапный алгоритм обследования пациентов с сочетанной хеликобактерной контаминацией пародонта и гастродуоденальной зоны.
Инфекция Helicobacter pylori является одной из наиболее распространенных среди людей. Более 50 % населения мира (более 3 млрд человек) инфицированы H. pylori. В странах Европы уровень инфицированности колеблется в пределах от 7 до 33 %, в России в настоящее время инфицированы 60–90 % населения в зависимости от частоты природных характеристик региона, этнографических особенностей жителей и социально-экономических условий [1, 2]. Носителем Н. pylori служит почти каждый второй человек, и передача микроба чаще всего осуществляется от человека к человеку. Колонизация слизистой оболочки желудка (СОЖ) происходит в раннем детском возрасте при тесном контакте ребенка с матерью. При этом почти в половине случаев возникает острое заболевание, которое в последующем переходит в разные формы хронического страдания. Все пути передачи возбудителя хеликобактериоза, очевидно, связаны только с человеком – без участия промежуточных хозяев или переносчиков. Наиболее изучен контактный путь передачи инфекции от больного человека или бактерионосителя орально-оральным или фекально-оральным путем [3].
К настоящему времени не только расшифрован геном Н. руlori, но и изучены достоверные характеристики его свойств, ассоциированность бактерии с широко распространенной патологией желудка и двенадцатиперстной кишки. Наиболее важные факторы патогенности микроорганизма приводят к синтезу белковых продуктов, которые вносят изменения в регуляторные и защитные механизмы организма хозяина, дезорганизуя их работу [4]. Наиболее изученной частью генома H. pylori является остров патогенности (PAI). Это область хромосомы, в которой сконцентрировано около 40 генов, кодирующих синтез факторов патогенности, обусловливающих вирулентность H. pylori. Чем больше генов PAI присутствует в геноме H. pylori, тем выше его потенциальная опасность для человека. Наиболее патогенными считаются гены группы cag, кодирующие синтез цитотоксинов; ureA, ureB, ureC, VacA – васкуолизирующий цитотоксин; sodB, кодирующий супероксидисмутазу; kat – каталазу; flaA, flab – жгутиковые антигены; iceA – ген, кодирующий фермент, вырабатываемый при контакте с эпителиальными клетками; BabA – белок, обеспечивающий адгезию к эпителиальной клетке и др. Кроме того, при лечении инфекции H. pylori необходимо учитывать, что в геноме микроорганизма присутствуют гены и точечные мутации, определяющие развитие резистентности к лекарственным препаратам, например frxA, fdxB, rdxA – кодирующие ферменты окислительного метаболизма, которые формируют резистентность к метронидазолу, широко используемому в лечении как хеликобактериоза, так и заболеваний пародонта [5, 6].
Впервые в 1998 г. в России на морфологическом уровне была доказана возможность генерации активных форм кислорода мембранными структурами самого микроорганизма благодаря генам, кодирующим ферменты окислительного метаболизма, что также совпадает с результатами исследований, проведенных в Японии [7, 8]. Позже группой ученых во главе с В.Г. Жуховицким было выявлено, что способность к продукции и динамика выброса активных форм кислорода у разных штаммов существенно различаются, что обусловливает различную степень их вирулентности [9]. Доказано, что при старении культуры H. pylori и применении антибактериальной терапии резко уменьшается количество вегетативных бактерий и возрастает число кокковых форм, которые считаются нежизнеспособными и некультивируемыми. Однако даже ферменты кокковых форм обладают очень высокой окислительной активностью [10]. Это весьма существенно, т.к. неудачная попытка эрадикации или прием антибиотиков по поводу интеркуррентных заболеваний создает опасность активации окислительных ферментов микроорганизма с усилением генерации активных форм кислорода и как следствие – опасность повреждения СОЖ [11]. Это говорит о необходимости следования утвержденным стандартам эрадикации хеликобактерной инфекции желудочно-кишечного тракта, в т.ч. сочетанной с воспалительными заболеваниями пародонта. Самым мощным фактором патогенности H. pylori считается белок CagA, кодируемый геном cagA, результатом деятельности которого является активная продукция интерлейкина-8, сильнейшего провоспалительного цитокина. Инфицирование штаммами H. pylori, содержащими cagA, сопровождается более выраженной воспалительной реакцией в СОЖ и двенадцатиперстной кишки и, соответственно, увеличивает риск развития ассоциированных с H. pylori язвенной болезни и рака желудка [12].
Наиболее благоприятными условиями для жизни, роста и размножения микроорганизма считаются температура +37 °С и рН среды 4,0–6,0, хотя H. pylori выживает и при более низких значениях рН. Способность H. pylori выживать в кислом содержимом желудка обеспечивается в основном высокой уреазной активностью и продукцией белка, ингибирующего секрецию соляной кислоты. В желудке всегда присутствует мочевина, проникающая в его полость через стенки капилляров. Уреаза расщепляет мочевину и за счет аммиака нейтрализует ионы водорода. Характерной особенностью H. pylori является то, что уреаза располагается не только в цитоплазме бактерии, но и на поверхности клеток. Будучи сильным антигеном, фермент связывает антитела, которые могли бы повредить H. pylori, и комплекс уреаза-антитело удаляется с поверхности клеток. Уреаза H. pylori действует как токсин, поскольку ионы аммония, образующиеся при гидролизе мочевины, повреждают эпителий; усиливает воспалительные реакции за счет активации моноцитов и нейтрофилов, стимуляции секреции цитокинов, образования радикалов кислорода и окиси азота, кроме того, большая субъединица уреазы (UreB) действует как аттрактант для лейкоцитов. Взаимодействие оксидазной и уреазной систем позволяет микроорганизму перекрывать большой диапазон изменений pH в своем микроокружении. В условиях кислой среды работает уреаза, ощелачивая среду, тогда как оксидазы не работают, при повышении pH > 6 включаются в работу оксидазные ферменты, закисляющие микросреду. Велико значение муциназы, продуцируемой H. pylori, в уменьшении защитных свойств СОЖ. Под влиянием фермента происходит разрушение муцина желудочной слизи, что приводит к локальному снижению ее вязкости. Гликосульфатная активность H. pylori снижает вязкость слизи с помощью сульфатированных гликопротеинов, которые выполняют роль механического барьера, защищающего слизистую оболочку от инфицирующих агентов. В качестве обязательных факторов колонизации H. pylori считают γ-глутамилтранспептидазу – ключевой фермент в метаболизме глутатиона.
Вслед за инвазией существенным этапом на пути развития большинства инфекционных заболеваний является адгезия бактерий к клеткам и элементам соединительной ткани. У H. pylori выявлено несколько адгезинов, определяющих выбор хозяина и взаимодействующих с эпителиальными клетками. Из их числа лучше всего изучены – белки Bab, гемагглютинин (NLBH).
В качестве рецепторов адгезины H. pylori используют остатки сиаловых кислот (как, например, NLBH), сульфогруппы гликопротеинов, гликолипиды, фосфолипиды и остатки фукозы Льюис-подобных антигенов (как Bab) [13].
Помимо адгезинов к числу факторов, предохраняющих H. pylori от действия защитных сил и химиотерапевтических средств, следует отнести способность микроба к инвазии эпителиальных клеток. Высокая патогенность H. pylori связана с наличием токсинов, из которых лучше всего изучен цитотоксин А, вызывающий вакуолизацию эпителия путем образования пор в цитоплазматической мембране, уменьшение содержания АТФ в эпителиоцитах, изменение цитоскелета эпителиоцитов, что приводит к замедлению заживления микродефектов эпителия. Предполагается, что с цитотоксичностью могут быть также связаны поверхностные белки H. pylori, которые реагируют с плазминогеном и одновременно с ингибитором-2 плазмина, а также макроглобулином-2. В итоге происходит превращение плазминогена в плазмин, обладающий высокой протеолитической активностью. Большое значение имеет способность H. pylori индуцировать, активировать или стимулировать целлюлярные продукты макроорганизма, вызывать индукцию фактора активации тромбоцитов, лейкотриенов, прокоагулянтной активности, стимуляцию интерлейкинов и фактора некроза опухоли, активацию цитохрома P450, активацию системы комплимента, что приводит к инфильтрации лейкоцитами СОЖ. К факторам патогенности также относят наличие ферментов: каталазы, оксидазы, щелочной фосфатазы, алкогольдегидрогеназы, глюкосульфосфатазы, протеазы, фосфолипазы. Изучение факторов патогенности важно для расшифровки механизма развития инфекционного процесса и для решения проблемы специфической профилактики заболевания.
В настоящее время доказано, что проблема хеликобактериоза касается не только патологии желудочно-кишечного тракта, но и смежных областей, в частности стоматологии, т.к. многие авторы рассматривают полость рта как возможный источник инфицирования H. pylori и рецидивирования язвенной болезни [1, 14, 15]. Активно обсуждается вопрос и об участии полости рта в реинфицировании организма H. pylori и рецидивах заболевания. Ряд российских и зарубежных ученых в своих работах отмечают высокую вероятность рецидива язвенной болезни и хронического гастрита, ассоциированных с H. pylori, в результате неполноценной эрадикационной терапии, возможной из-за неэффективности некоторых хеликобактерных средств, недостаточности сроков лечения, сохранения резервуаров инфекции, в т.ч. в полости рта пациентов [14, 16].
За последние годы обсемененность полости рта H. pylori стали учитывать и как фактор, оказывающий влияние на развитие и течение стоматологических заболеваний. Обсуждается возможность выделения такого термина, как Helicobacter pylori-ассоциированные заболевания пародонта. В связи с этим встает вопрос об эрадикационной терапии как о базисной лечения заболеваний пародонта и гастродуоденальной зоны у больных язвенной болезнью двенадцатиперстной кишки, ассоциированной с H. pylori [16].
Эрадикация (уничтожение) H. pylori с помощью адекватных комбинаций антибактериальных средств способствует регрессу воспалительно-дистрофических изменений СОЖ и двенадцатиперстной кишки; восстановлению защитных свойств слизистой оболочки гастродуоденальной зоны; существенному снижению частоты рецидивов язвенной болезни (с 60–70 до 1–3 % в течение двух лет наблюдений), а следовательно, и ее осложнений; профилактике развития мальтомы и рака желудка [17]. Количество антибактериальных препаратов, используемых в эрадикационных схемах, ограничено из-за уникальной способности обитания этого микроорганизма в подслизистом пространстве. Бóльшая часть антибактериальных препаратов, попадая в желудок, остается там короткое время, которого, как правило, бывает недостаточно для проявления его активности в отношении Н. pylori.
К главным факторам, ограничивающим активность антибактериальных препаратов в отношении Н. pylori, относятся также низкое значение рН среды и ограниченная диффузия антибактериальных препаратов в СОЖ.
При наличии сочетанной H. pylori-ассоциированной патологии желудочно-кишечного тракта и пародонта целью лечения является:
- в кратчайший срок устранить симптомы заболеваний;
- уничтожить бактерии H. pylori в гастродуоденальной слизистой оболочке и полости рта;
- купировать активное воспаление в СОЖ, двенадцатиперстной кишке и пародонтальных карманах;
- предупредить развитие обострений и осложнений, включая лимфому, рак желудка, пародонтит тяжелой степени.
К сожалению, широкое и не всегда оправданное использование антибактериальных препаратов в целом и неадекватная противохеликобактерная терапия в частности (в смысле как доз, так и длительности лечения) зачастую приводят к формированию приобретенной резистентности у Н. pylori, что сокращает и без того малое количество антибактериальных препаратов, которые могут быть использованы для лечения хеликобактериоза [18–20].
В настоящее время самый высокий уровень резистентности у Н. pylori имеется к производным нитроимидазола, который в некоторых странах достигает 80–90 % [6, 21]. Резкое увеличение во всем мире штаммов H. pylori, устойчивых к нитроимидазолам, сделало актуальным поиск более действенных режимов эрадикации микроорганизма [22]. В связи с этим наиболее эффективной в регионах с низкой резистентностью хеликобактера к кларитромицину остается схема на основе комбинации ингибитора протонной помпы (ИПП), макролидного антибиотика (кларитромицина) и амоксициллина [17, 23]. В регионах с высокой резистентностью или там, где достоверные данные об уровне резистентности отсутствуют, хорошие результаты обнаруживаются при применении как классической квадротерапии, так и модифицированных схем с препаратом висмута в качестве терапии первой линии [23].
Доказано, что амоксициллин нарушает синтез гликопротеидов в стенке бактерий, обладает бактерицидным эффектом в отношении H. рylori и является одним из препаратов первого выбора при системной антибиотикотерапии заболеваний пародонта. В многочисленных работах показана эффективность применения схем, включающих макролиды для эрадикации H. pylori. Так, кларитромицин благодаря своим фармакокинетическим и фармакодинамическим особенностям присутствует в рекомендациях Маастрихт-2, -3 и -4 [17]. По мнению ведущих ученых, макролидные антибиотики, в частности кларитромицин, считаются наиболее перспективной группой антибиотиков в лечении одонтогенной инфекции, в т.ч. и у больных, имеющих изменения со стороны иммунной системы, что позволяет широко использовать их в лечении заболеваний пародонта.
В настоящее время описана резистентность Н. pylori к большинству антибиотиков, которые используются в схемах противохеликобактерной терапии [6]. Выходом из сложившейся ситуации могут стать принципиально новые пути воздействия на хронический воспалительный процесс и поиск оптимально эффективного комплекса лечебных и профилактических мероприятий для пациентов с сочетанной патологией. Работа, проведенная нашим коллективом в 2004–2007 гг., доказывает, что комбинированная со стоматологическим лечением и пролонгированная до 14 дней эрадикационная терапия сопровождается более выраженной положительной динамикой клинических проявлений и объективных симптомов пародонтита и язвенной болезни, а 2-недельный курс антибиотикотерапии приводит к достоверному снижению количества пародонтопатогенных микроорганизмов в пародонтальном кармане больных язвенной болезнью двенадцатиперстной кишки, ассоциированной с H. pylori.
В целом наш многолетний опыт использования кларитромицина и амоксициллина свидетельствует о хорошей переносимости данных лекарственных препаратов как при 7-, так и при 14-дневной эрадикационной терапии, позволяющей проводить полноценное лечение практически 100 % нуждающихся в ней больных без каких-либо серьезных последствий. По результатам проведенного лечения, эффективность тройной семидневной схемы эрадикации H. pylori составила 83,4 %. Двухнедельная схема тройной терапии оказалась более эффективной – 96,7 %.
Разница в 13,3 % говорит о несомненном преимуществе 14-дневного курса эрадикационной терапии [14, 16]. Использование рабепразола при лечении язвенной болезни в качестве базисного препарата терапии первой линии по Маастрихт-3 в режиме как 7-, так и 14-дневной терапии, имело ряд преимуществ перед антисекреторными препаратами предыдущих поколений, обусловленных более сильным, быстрым, продолжительным и достаточно предсказуемым антисекреторным действием [15, 24].
Таким образом, хронические воспалительные процессы в полости рта и гастродуоденальной зоне представляют собой не только воспаление слизистых оболочек, вызванное патогенными микроорганизмами, а сложное сочетание разбалансированности барьерных механизмов, механизма регуляции желудочной секреции, окислительно-восстановительных реакций и клеточного обновления.
Различная клиническая картина, выраженность субъективных симптомов у пациентов связаны с вирулентностью штамма хеликобактера, микрофлоры полости рта, в т.ч. пародонтопатогенов; состоянием иммунной системы; генетических факторов; особенностей пищевого поведения и образа жизни.
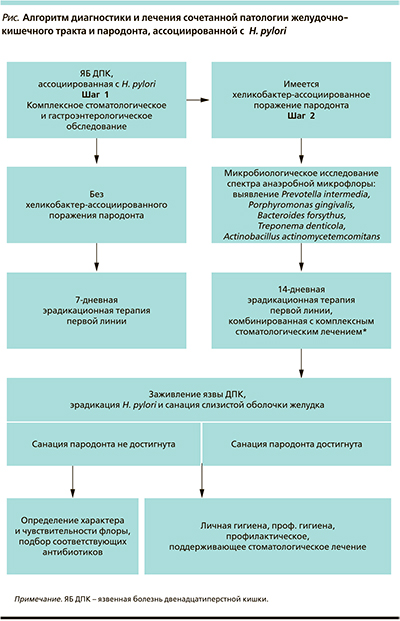
Серьезность последствий хронического воспалительного процесса в слизистой оболочке осознается через несколько лет после инфицирования, поэтому следование алгоритму обследования пациентов с сочетанной хеликобактерной контаминацией пародонта и гастродуоденальной зоны (см. рисунок), применение эффективных методов лечения имеют первостепенное значение в профилактике тяжелых осложнений язвенной болезни, онкологической патологии желудка и двенадцатиперстной кишки.
Читайте также:


