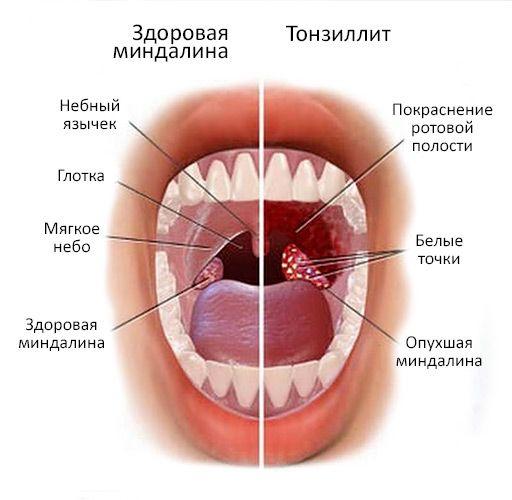
Гнойно септические осложнения в послеоперационном периоде
Осложнения в виде местных инфекционных и нагноительных процессов после операций на спине в общей структуре всех вмешательств занимают от 1% до 8%. Среди хирургических манипуляций на позвоночнике, связанных с установкой имплантатов, металлоконструкций, частота подобного рода воспалительных реакций существенно выше (6%-20%). Инфекционно-гнойный постхирургический патогенез способен негативно сказаться на окончательном исходе примененной тактики хирургической коррекции позвоночника, даже если она была выполнена безукоризненно.
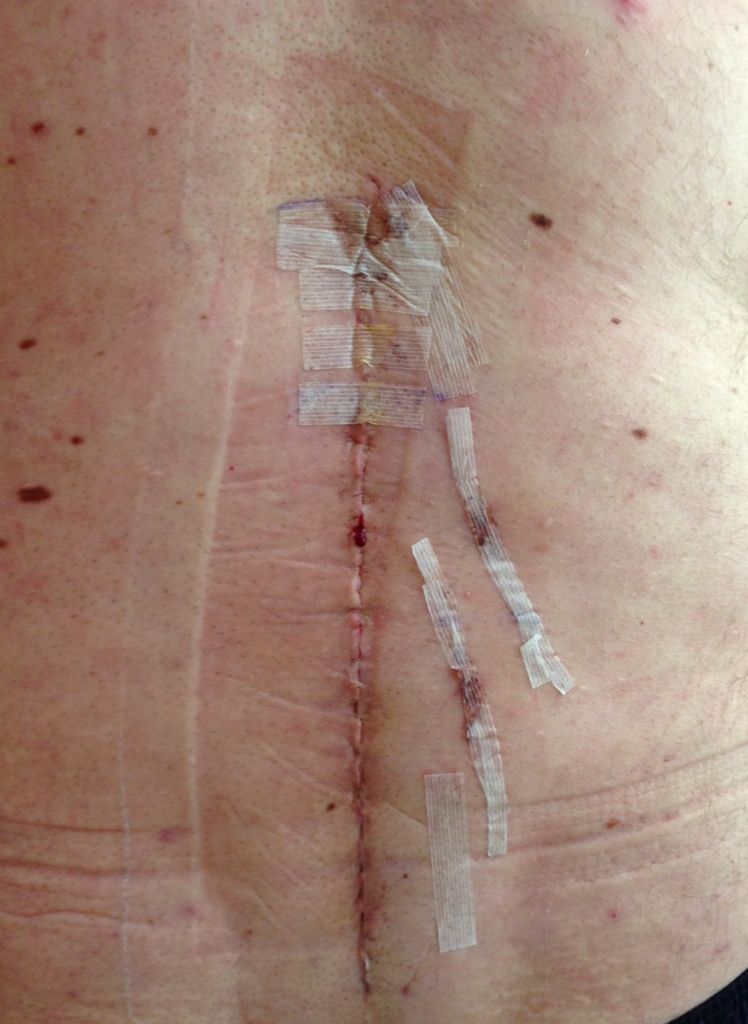
Хороший спокойный шов после операции.
Несмотря на огромные достижения спинальной нейрохирургии в сфере интра-, постоперационного инфекционного контроля, инфекции и гнойные воспаления все еще остаются лидерами среди всех возможных осложнений. К развитию неблагополучного патогенеза могут подтолкнуть разные факторы: от специфики организма пациента до предоперационных, операционных и послеоперационных нарушений.
Инфекции, воспаления гнойного характера в проекции хирургического поля могут быть поверхностными и глубокими, ранними и поздними. При этом каждый тип требует экстренной медицинской помощи, направленной на усиленное искоренение патогенной среды. Интенсивные лечебные меры необходимы не только для увеличения вероятности наступления позитивного функционального исхода в отношении прооперированного отдела спины. Их ценность заключается также в недопущении развития и распространения сепсиса по организму, который ставит под большую угрозу жизнь человека.
Чем обширнее вмешательство, тем выше вероятность осложнений.
Инфекционное осложнение (ИО) – проблема достаточно серьезная, не всегда легко решаемая, поэтому о ней должен быть ознакомлен каждый пациент, независимо от того, есть она у него или нет. Как говорится: предупрежден – вооружен. Далее подробно проинформируем об осложнениях инфекционного, гнойного характера после операций на спине: после удаления грыжи, протезирования диска, резекции новообразований, вмешательств с использованием металлоконструкций, др. Обязательно ознакомим и с тем, как в такой ситуации специалисты лечат пациентов.
Симптомы и признаки осложнения
Инфекционные и гнойные реакции в области хирургического вмешательства принято классифицировать на 2 основных вида:
- поверхностные (надфасциальные) – инфицирование затрагивает исключительно кожные поверхности и подкожно-жировой слой в месте разреза;
- глубокие – инфекция проникает глубже, поражая фасциальные, мышечные структуры (запущенные случаи приводят к инфицированию костных тканей).
Поверхностное инфицирование раневого участка образуется не позже первого месяца с момента проведенной операции, возбудителем обычно является стафилококк. Глубинное развитие пагубной микрофлоры больше ассоциировано с отдаленными сроками, и, как правило, появляется в течение 3 или более месяцев после сеанса хирургии.
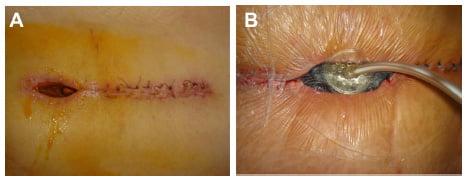
Один из примеров открывшегося шва.
Первыми специфическими проявлениями диссеминации патогенных микроорганизмов в пределах операционного поля являются:
- покраснение тканей вокруг шва;
- уплотнение;
- болезненные ощущения.
Независимо от вида патогенного агента, об активизированном воспалительном процессе в зоне, имеющей причастность к оперативному вмешательству, можно судить также по наличию одного или нескольких симптомов:
- выделение серозной, серозно-гнойной жидкости из поверхностных тканей разреза;
- ограниченная тканевая отечность;
- локализированная болезненность, которая имеет тенденцию к нарастанию;
- локальная гиперемия кожных покровов с повышением местной температуры;
- гнойное отделяемое из глубины операционной раны, наличие фистул;
- самопроизвольное расхождение шва с разъединением краев раны, если добавочно присутствуют болевой синдром и/или гипертермия организма (общая температура тела до 38 или более градусов).
Воспаление на спине в месте хирургического доступа и вокруг него не всегда свидетельствует об инфекционном осложнении. Отечность, болевые признаки, покраснение практически всегда проявляются сразу после операции как естественная реакция организма на операционную агрессию. И такая симптоматика может быть вариантом нормы, но с условием, что через 3-5 дней эти три признака после миниинвазивной хирургии (без применения имплантов) ликвидировались. Когда речь идет об обширной открытой операции с фиксацией металлоконструкций или протезов, нормальным считается динамичное сокращение выраженности воспаления травмированных тканей в ранний период, окончательное избавление от него максимум на 7-10 сутки.
Причины инфекции
Согласно рекомендательным предупреждениям специалистов по хирургическому лечению патологий позвоночника, факторы риска инфекционно-гнойных последствий классифицируют на несколько условных групп.
Последствия, обусловленные состоянием пациента
Изначально по основному диагнозу тяжелое клиническое состояние больного, поступившего в стационар.
Сопутствующие болезни и состояния, которые понижают сопротивляемость организма к патогенам или мешают нормальной регенерации ран:
- сахарный диабет;
- иммунодепрессия;
- ожирение;
- дерматозы;
- онкология;
- пожилой возраст;
- младенческий возраст.
- Наличие активного инфекционно-бактериального, гноеродного очага в совершенно любой части организма (кариес зубов, инфекции мочеполовой системы, горла/носа, пр.).
![]()
Дооперационные факторы риска
- Продолжительный срок госпитализации до операции на спине. Установлено, что чем больше больной находится в больничных условиях, тем выше риски возникновения нозокомиальной (внутрибольничной) инфекции.
- Отсутствие антибиотикотерапии или неадекватная ее схема назначения на этапе предоперационной подготовки пациента, особенно у ослабленных пациентов.
- Некачественная дезинфекция кожных покровов антисептическими средствами перед началом хирургической процедуры.
Интраоперационные причины
Послеоперационные причины
- недостаточное количество или, наоборот, слишком частое проведение бактерицидной обработки раны, процедур перевязки;
- низкокачественное обеспечение очистки раневых зон, замены тампонов и дренажей;
- несоблюдение норм асептики в ходе перевязочных манипуляций (слабая дезинфекция оборудования, использование нестерильных салфеток/бинтов, невыполнение техники мытья рук и применения одноразовых перчаток со стороны медработника, медработник является носителем штамма инфекции MRSA и т. п.);
- несоблюдение правил содержания раны в сухости и повязочной защите (пациент раньше срока мочит водой рану водой и/или обнажает ее, вопреки озвученному врачами запрету);
- некорректная техника перевязки в домашних условиях, выполняемой пациентом самостоятельно.
![]()
- некорректность рекомендованного пациенту курса лечения антибиотиком (вида, кратности, дозы, срока применения препарата), пропуски или полное отсутствие обязательной антибиотикотерапии после любой спинальной операции;
- несоблюдение пациентом послеоперационного режима физической активности, что тоже может увеличивать риски ИО (ранний отказ от физического покоя, недопустимо высокая нагрузка на прооперированную область, самовольное назначение себе упражнений, игнорирование ношения ортопедических корсетов, др.).
Лечение инфекционного (гнойного) очага
Базисный принцип лечения, одинаково распространяющийся на всех больных с подобным осложнением, основывается на фундаментальной санации раны и интенсивной антибиотикотерапии. Однако шаблонов в приемах оказания медицинской помощи здесь не может быть, лечебная программа разрабатывается индивидуально и только на основании характера, тяжести послеоперационного последствия. После диагностической оценки пораженной области могут быть применены разные стратегические подходы с возможной компоновкой:
- хирургическое вскрытие гнойного очага с эвакуацией патологического содержимого раны и удалением очагов некроза;
- очистка от гноеродного компонента, промывание раны струей антибактериального раствора, внутрираневое введение антибиотика;
- использование ультразвуковой/лазерной кавитации гнойной полости;
- применение способов VAC-терапии на базе вакуум-систем;
- рыхлый марлево-антисептический тампонаж и проточно-промывное дренирование раны;
- установка специальных систем всасывающего и/или ирригационного типа;
- в случае глубокой инфекции чаще рекомендовано снятие вживленных имплантов диска, металлических конструкций, эндофиксаторов, чтобы произвести максимально полную санацию и эррадикацию очагов инфекции. В единичных случаях сразу допускается замена извлеченного инструментария/имплантов на новые изделия.
Местное лечение с использованием выше перечисленных методик, как правило, включает иммобилизацию пациента. Локально мероприятия продолжаются обычно от 5 дней до 14 суток. Однако при генерализированном патогенном процессе, незначительном прогрессе лечения их могут продлить на месяц или дольше.
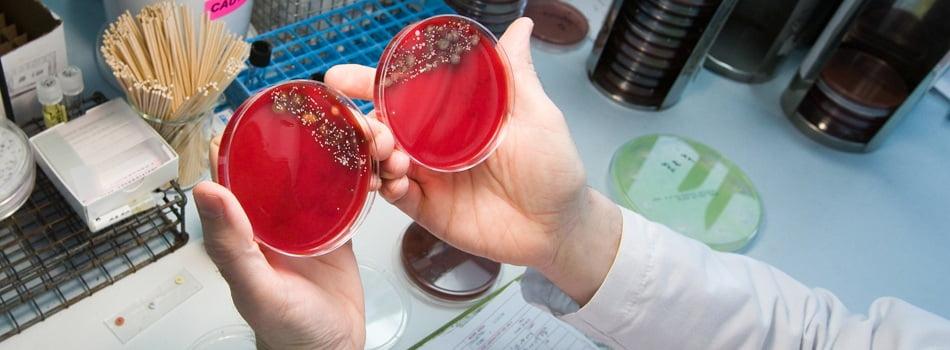
Бактериальный посев на выявление роста колоний.
Следующая обязательная лечебная мера – общее антибактериальное медикаментозное пособие. Оно подбирается с учетом результатов выполненного бактериологического посева и чувствительности конкретного возбудителя к антибиотикам. Общая антибактериальная терапия (в основном инъекционная) в среднем назначается на 6-8 недель. К пероральному приему антибиотиков при данном последствии медики настроены скептически, не считая такой способ надежным.
В комплексе с антибиотикотерапией неотъемлемо должны присутствовать детоксикационные, иммунокорректирующие, симптоматические методы лечения. Грамотно разработанный алгоритм борьбы с развившейся инфекционно-воспалительной, гноеродной средой позволяет в подавляющем количестве случаев прийти к положительному прогнозу.
Профилактика, минимизация рисков развития раневой инфекции на спине
Профилактические меры нацелены на выявление и учет всех возможных провокационных факторов, которые могут вызвать осложнение. Исходя из этого, на протяжении всего периоперационного периода должны в полном объеме обеспечиваться адекватные действия со стороны медперсонала и пациента. Только так реально исключить или максимально обезопасить человека от местной инфекционной атаки. Перечислим ведущие принципы профилактики ИО в хирургии позвоночного столба.
Запомните, что инфекционные осложнения на начальной стадии легче остановить и устранить, чем запущенные его формы, причем в ряде случаев безоперационно. И, безусловно, не допустить отторжения имплантов, расшатывания, смещения, поломки, миграции по анатомическим просторам чужеродного тела. Ранняя диагностика, своевременное лечение ИО – основополагающие критерии благополучного исхода, менее тяжелого и длительного восстановления после перенесенной спинальной хирургии.
по общей хирургии
Исполнитель: студ. III курса Селявко Юрий Александрович
Московский Государственный Университет имени М.В. Ломоносова
Несмотря на достижения современной медицины, частота послеоперационных инфекционных осложнений в нейрохирургии, челюстно-лицевой, торакальной, абдоминальной и сосудистой хирургии, травматологии и ортопедии, акушерстве и гинекологии остается высокой.
Остро стоит и сама проблема послеоперационных инфекционных осложнений, развитие которых заметно отягощает основное заболевание, удлиняет время пребывания больного в стационаре, увеличивает стоимость лечения, нередко служит причиной летальных исходов и негативно сказывается на сроках восстановления трудоспособности оперированных больных.
Поэтому изучение этиологической структуры, патогенетических аспектов, клинических проявлений, совершенствование методов диагностики, а также организация рациональной профилактики и лечения послеоперационных инфекционных осложнений являются актуальными на сегодняшний день задачами для всех областей хирургии.
Часть 1. Общие аспекты послеоперационных инфекционных осложнений.
Хирургические гнойно-септические послеоперационные осложнения входят в группу внутрибольничных инфекций. К этой группе, на долю которой приходится 15–25% от всех инфекций в стационаре, относятся инфекции хирургических, ожоговых и травматических ран. Частота их развития зависит от типа оперативного вмешательства: при чистых ранах – 1,5–6,9%, условно чистых – 7,8–11,7%, контаминированных – 12,9–17%, грязных – 10–40%.1
В многочисленных публикациях, посвященных проблеме нозокомиальных инфекций в хирургии, было убедительно доказано, что послеоперационные инфекционные осложнения:
ухудшают результат хирургического лечения;
увеличивают длительность госпитализации;
увеличивают стоимость стационарного лечения.
1.1. Послеоперационные инфекционные осложнения как особая категория внутрибольничных инфекций.
Несомненно, что четкое определение какого-либо понятия исключает его неоднозначное толкование. Это правомерно и в отношении определения такого явления, как "внутрибольничные инфекции" (ВБИ). Наиболее удачным и достаточно полным следует считать определение ВБИ, предложенное Европейским региональным бюро ВОЗ в 1979 г.: внутрибольничная инфекция (больничная, госпитальная, внутригоспитальная, нозокомиальная) - любое клинически распознаваемое инфекционное заболевание, которое поражает больного в результате его поступления в больницу или обращения в нее за лечебной помощью, или инфекционное заболевание сотрудника больницы вследствие его работы в данном учреждении вне зависимости от появления симптомов заболевания до или во время пребывания в больнице.
Естественно, что наиболее значительная часть ВБИ приходится на заражение пациентов в стационарах. Частота ВБИ составляет не менее 5%.2 Официальные отчеты отражают лишь небольшую часть хирургических ВБИ, а по данным, приведенным зарубежными исследователями, на долю хирургических инфекций приходится 16,3-22%.2
История сохранила высказывания и наблюдения известных врачей о значении проблемы внутрибольничного заражения. Среди них слова Н.И.Пирогова: "Если я оглянусь на кладбище, где схоронены зараженные в госпиталях, то не знаю, чему больше удивляться: стоицизму ли хирургов или доверию, которым продолжают пользоваться госпитали у правительства и общества. Можно ли ожидать истинного прогресса, пока врачи и правительства не выступят на новый путь и не примутся общими силами уничтожать источники госпитальных миазм".
Или ставшее классическим наблюдение I. Semmelweis, установившего связь высокой заболеваемости "родильной горячкой" в акушерских палатах Венской больницы во второй половине XIX века с несоблюдением врачами правил гигиены.
Такие примеры в полном смысле слова внутрибольничного заражения можно найти и в более позднее время. В 1959 г. мы описали вспышки гнойных послеродовых маститов у женщин, рожавших в родильном отделении одной из крупных московских больниц.2 Большинство из заболевших обращались и лечились затем в хирургическом отделении поликлиники при той же больнице. Во всех случаях возбудителем был белый стафилококк, выделенный из абсцессов молочной железы. Характерно, что аналогичный стафилококк был выделен при систематических бактериологических исследованиях, осуществляемых в родильном отделении. После проводимых в отделении плановых санитарных мероприятий число больных маститом уменьшалось, а по мере бактериального загрязнения помещений родильного отделения вновь увеличивалось. В настоящее время не вызывает сомнений тот факт, что нарушение санитарно-гигиенического режима в лечебных учреждениях приводит к росту заболеваемости и возникновению вспышек ВБИ. Это наиболее характерно для возникновения респираторных и кишечных инфекций.
Однако существует особая категория ВБИ, которая привлекает внимание различных специалистов, прежде всего хирургов, и не имеет однозначного решения. Речь идет о послеоперационных осложнениях в хирургических отделениях больниц различного профиля и мощности коечного фонда, удельный вес которых достаточно велик.
Некоторые авторы считают, что послеоперационные осложнения составляют от 0,29 до 30%2, но большинство приводят более однородные данные - 2-10%.2 Чаще всего речь идет о нагноениях послеоперационной раны,2 однако после операций, выполненных в связи с острыми заболеваниями, сопровождающимися диффузным перитонитом, довольно часто (1,8-7,6%) развиваются абсцессы брюшной полости.2
По данным Н.Н.Филатова и соавторов,2 частота гнойно-септических осложнений у оперированных в стационарах хирургического профиля Москвы составляет 7,1%. Более высокую частоту хирургических раневых инфекций (от 11,5% до 27,8%) приводят М.Г.Аверьянов и В.Т.Соколовский,2 причем осуществленный ими мониторинг выявил высокий уровень гнойных осложнений (9,7%-9,8%) при I-II классах операционных ран, при которых практически не должно быть осложнений, а при допустимом варианте - не более 1%. На более чем 53 тыс. операций частота гнойно-септических послеоперационных осложнений составляет только 1,51%.2
Противоречивость приведенных данных не снижает значимость проблемы послеоперационных раневых осложнений, развитие которых заметно отягощает развитие основного заболевания, удлиняет время пребывания больного в стационаре, увеличивает стоимость лечения, нередко служит причиной летальных исходов и негативно сказывается на сроках восстановления трудоспособности оперированных больных.
1.2. Классификация хирургической инфекции.
1. Первичные хирургические инфекции, возникающие самопроизвольно.
2. Вторичные, развивающиеся как осложнения после травм и операций.
Хирургические инфекции (в том числе и вторичные) также классифицируют3:
I. В зависимости от вида микрофлоры:
1. Острая хирургическая инфекция: а) гнойная; б) гнилостная; в) анаэробная: г) специфическая (столбняк, сибирская язва и др.).
2. Хроническая хирургическая инфекция: а) неспецифическая (гноеродная):
б) специфическая (туберкулез, сифилис; актиномикоз и др.).
II. В зависимости от этиологии: а) стафилококковая; б) стрептококковая:
в) пневмококковая; г) колибациллярная; д) гонококковая; е) анаэробная неспо-рообразующая; ж) клостридиальная анаэробная; з) смешанная и др.
III. С учетом структуры патологии: а) инфекционные хирургические болезни: б) инфекционные осложнения хирургических болезней; в) послеоперационные инфекционные осложнения; г) инфекционные осложнения закрытых и открытых травм.
IV. По локализации: а) поражения кожи и подкожной клетчатки; б) поражения покровов черепа, мозга и его оболочек; в) поражения шеи; г) поражения грудной клетки, плевральной полости, легких; д) поражения средостения (медиастинит. перикардит); е) поражения брюшины и органов брюшной полости; ж) поражения органов таза; з) поражения костей и суставов.
V. В зависимости от клинического течения:
1. Острая гнойная инфекция: а) общая; б) местная.
2. Хроническая гнойная инфекция.
1.3. Этиология послеоперационных инфекционных осложнений.
Гнойно-воспалительные заболевания имеют инфекционную природу, они вызываются различными видами возбудителей: грамположительными и грамотрицательными, аэробными и анаэробными, спорообразующими и неспорообразующими и другими микроорганизмами, а также патогенными грибами. При определенных, благоприятных для развития микроорганизмов условиях воспалительный процесс может быть вызван условно-патогенными микробами: Klebsiella pneumoniae, Enterobacrer aemgenes, сапрофитами — Proteus vulgaris и др. Заболевание может быть вызвано одним возбудителем (моноинфекция) или несколькими (смешанная инфекция). Группа микробов, вызвавших воспалительный процесс, называется микробной ассоциацией. Микроорганизмы могут проникать в рану, в зону повреждения тканей из внешней среды (экзогенное инфицирование) или из очагов скопления микрофлоры в самом организме человека (эндогенное инфицирование).
Этиологическая структура госпитальных инфекций в хирургии имеет определенные различия в зависимости от профиля стационара и типа оперативного вмешательства (Табл. 1). Ведущим возбудителем раневых инфекций в отделениях общего профиля остается золотистый стафилококк; коагулазонегативные стафилококки наиболее часто вызывают посттрансплантационные инфекции; кишечная палочка и другие представители семейства Enterobacteriaceae являются доминирующими возбудителями в абдоминальной хирургии и инфекций в акушерстве и гинекологии (Табл. 2). Однако разные авторы отмечают высокий уровень P.aeruginosa (18,1%) и E.coli (26,9%)2, обращают внимание на преобладание энтеробактерий (42,2%) и золотистого стафилококка (18,1%)2; стафилококк был выделен в 36,6% случаев, E.coli - в 13,6, P.aeruginosa - в 5,1%.2
Для выделенных госпитальных штаммов характерна высокая устойчивость к антибиотикам;2 устойчивость к наиболее применяемым антибиотикам может достигать 70-90%2. Отмечена высокая резистентность к пенициллинам и хорошая чувствительность к фторхинолонам.2
| Область операционного вмешательства | Бактерии |
| Сердечно-сосудистая система | Золотистый и эпидермальный стафилококки, дифтероиды, грамотрицательные энтеробактерии |
| Голова и шея | Аэробы и анаэробы полости рта, золотистый стафилококк, стрептококки, грамотрицательные энтеробактерии |
| Пищевод | Анаэробы полости рта, золотистый стафилококк, стрептококки, грамотрицательные энтеробактерии |
| Верхние отделы желудочно-кишечного тракта | Золотистый стафилококк, флора полости рта и глотки, грамотрицательные энтеробактерии |
| Желчные пути | Грамотрицательные энтеробактерии, золотистый стафилококк, энтерококки, клостридии, иногда синегнойная палочка |
| Нижние отделы желудочно-кишечного тракта | Аэробы и анаэробы кишечника, грибы |
Таблица 1. Основные возбудители инфекционных осложнений после различных оперативных вмешательств.1
Частота гнойно-септических осложнений после ранений груди и живота в течение многих лет остается на постоянном уровне. Официальные источники указывают, что в хирургических стационарах такие осложнения развиваются у 12-18,5% пострадавших. Спектр возбудителей представлен микроорганизмами, относящимися к различным группам бактерий (анаэробы, аэробы), вирусам, грибам, и включает как патогенные, так и условно-патогенные микроорганизмы. Однако, по данным некоторых авторов, в зависимости от характера и локализации повреждений количество осложнений может достигать 48% [Бисенков Л.Н., Ерюхин И. А. и др., Роостар Л., Розанов В.Е. и др., Tacyiliz I.H. et al., Degiannis E. et al., Bostrom L., Nilsson В., Nagy K.K. et al.].
Хирургическое лечение ранений шеи, груди и живота сопряжено с риском инфицирования тканей, частота которого, по некоторым данным, достигает 25% [Baric P. S. et al.].
Н. Wacha и соавт. приводят следующие факторы риска возникновения раневой инфекции:
— квалификация хирурга;
— продолжительность операции более 2 ч с увеличением риска с каждым часом;
— инфицирование зоны ранения;
— гемотрансфузия;
— продолжительность наркоза;
— одновременные операции в нескольких областях тела;
— гипоксия;
— переохлаждение;
— использование ранорасширителя.
P. Gastmeier и соавт. пришли к выводу, что плохая хирургическая техника может привести к нарушению асептики или непреднамеренному вскрытию полого органа с контаминацией зоны хирургического вмешательства.
Обращает на себя внимание тот факт, что авторы этих исследований на первое место ставят уровень квалификации хирурга, и с этим выводом приходится согласиться. Подчеркнем еще такие факторы, относящиеся непосредственно к нашим пациентам, как вмешательство сразу в нескольких областях тела, что и имеет место при сочетанных ранениях, а также использование реберного расширителя, без которого не обходится ни одна классическая торакотомия.
Что касается послеоперационного периода, то Н. Wacha и соавт. выделяют такие факторы риска:
— наличие дренажей серозных полостей на протяжении более 3 сут;
— острый респираторный дисстресс-синдром;
— переохлаждение;
— инвазивные методики лечения (катетеризация мочевого пузыря, дренирование плевральной полости, назогастральное дренирование, катетеризация центральных вен).
С нашей точки зрения, для возникновения гнойно-септических осложнений необходимо сочетание нескольких факторов — внешних (по отношению к организму пострадавшего) и внутренних.
К внешним факторам, не зависящим от организма, следует отнести в первую очередь степень контаминации нанесенных пациенту ран. При наличии более 100 тыс. микроорганизмов на 1 г ткани риск нагноения существенно возрастает даже при высоком уровне иммунитета. Бактериальное загрязнение из внешней среды обусловлено либо самим ранящим предметом, либо частицами земли, одежды и т.д. При нарушении целости органов пищеварительного тракта, мочеполовых и воздухоносных путей обширная контаминация стерильных тканей происходит как в момент ранения, так и в течение времени, пока рана остается открытой. Т. Krizek и соавт. показали, что при наличии инородных тел порог для возникновения раневой инфекции снижается в 1000 раз.

Не менее важными факторами являются вид ран (резаная, рвано-ушибленная, огнестрельная), ее глубина, локализация, наличие некротических тканей и степень кровоснабжения тканей в ее окружности. Последний упомянутый фактор хорошо известен — чем скуднее кровоснабжение тканей, тем легче возникает инфекционно-воспалительный процесс.
К внешним, не менее значимым факторам, следует отнести многие медицинские манипуляции, которые, нарушая естественные механические и биологические барьеры, также способствуют инвазии микробной флоры. Эндотрахеальные и трахеостомические трубки, желудочные и тонкокишечные зонды, сосудистые и мочевые катетеры являются инородными телами и представляют собой факторы риска, даже при строгом соблюдении асептики. Если же учесть, что реально при критическом состоянии пострадавшего с ранами шеи, груди и живота рутинными правилами асептики нередко пренебрегают, становится ясным значение этих факторов в генезе гнойно-септических осложнений.
Однако более существенную роль играют внутренние факторы, весь спектр которых в конечном итоге сводится к состоянию иммунитета (степень кровопотери, сопутствующая хроническая патология, возраст и т.д.). Еще в 1988 г. D. H. Livingston и М.А. Malungoni в экспериментах на животных доказали прямую зависимость тяжести течения гнойно-септических процессов от степени кровопотери. В последующем было уточнено, что одним из главных факторов, определяющих риск возникновения инфекции, является уровень напряжения кислорода в тканях, поскольку активность полиморфноядерных лейкоцитов зависит от содержания кислорода [Kinighton D.R. et al.].
Одним из важных, но по-прежнему дискуссионных вопросов является целесообразность назначения антибиотиков в целях профилактики гнойных осложнений. В связи с этим следует признать, что проведенные еще в середине XX века исследования показали неэффективность антибактериальной профилактики пневмонии у пациентов в группе риска. Гораздо действенней оказались такие меры, как полноценное обезболивание, коррекция гомеостаза, тщательная санация трахеобронхиального дерева, строгое соблюдение правил асептики при установке и смене эндотрахеальных трубок и возможно более раннее их удаление.
В ряде более поздних исследований — D. Demetriades и соавт., Р. J. Cant и соавт., R. P. Gonzalez и соавт. — доказывается эффективность профилактического назначения антибиотиков, в то время как в других — R. L. Nichols и соавт., А. К. Mandall и соавт. — не было выявлено заметной разницы в частоте развития осложнений в группах пациентов, которым антибиотики применяли и которым — не применяли. На основании 5474 наблюдений дренирования плевральной полости А. К. Mandall и соавт. доказали, что единственным фактором риска развития эмпиемы плевры при этом является остаточный (свернувшийся) гемоторакс.
Действительно, если считать, что частота развития эмпиемы плевры при проникающих ранениях груди составляет в среднем около 2 %, то для предотвращения двух случаев развития эмпиемы необходимо пролечить антибиотиками 100 пострадавших с проникающими ранениями и получить у них устойчивую к антибиотику микрофлору.
Однако на самом деле приведенные выше исследования не учитывают наиболее значимый, с нашей точки зрения, фактор — степень кровопотери. Любые, даже самые совершенные методы компенсации кровопотери, включая аппаратные методы реинфузии крови, не могут восполнить все компоненты циркулирующей крови и прекратить процесс, запущенный в организме самим фактом острой кровопотери.
Целесообразность введения антибиотиков в группах риска (массивная кровопотеря, повреждения полых органов, позднее поступление пациентов с проникающими ранениями) не вызывает сомнений. Многими исследователями — D. H. Livingston и соавт., C.D. Ericsson и соавт., R. L. Reed и соавт. — установлено, что в группах риска высокие дозы антибиотиков в тканях на начальных этапах лечения более важны, чем большая продолжительность курса лечения. При этом в работе С. D. Ericsson и соавт. доказана одинаковая эффективность профилактического введения антибиотиков в течение 24 ч и на протяжении 72 ч после ранения.
Профилактическое применение современных сильных антибиотиков резко уменьшило частоту гнойных осложнений, в том числе и при ранениях толстой кишки. Это позволило ряду хирургов пересмотреть хирургическую тактику и сократить показания к наложению колостом [Nichols R. L. et al., Demetriadcs D. et al.]. С точки зрения этих авторов, единственной причиной несостоятельности швов, наложенных на стенку толстой кишки, является недостаточная декомпрессия желудочно-кишечного тракта в послеоперационном периоде. Однако эту точку зрения поддерживают далеко не все хирурги, тем более что опыт последних лет свидетельствует о том, что вера в эффективность антибактериальной терапии себя не оправдала.

Мы считаем, что ведущим фактором, влияющим на развитие гнойно-септических осложнений послеоперационного периода, является объем кровопотери. Руководствуясь современной концепцией деэскалационной антибактериальной терапии, мы рекомендуем профилактическое применение антибиотиков у пострадавших с кровопотерей более 2 л и у пострадавших с повреждением полых органов. Первое введение антибиотиков должно быть на операционном столе либо в первый час после операции в условиях отделения интенсивной терапии. При ранениях шеи и груди (без повреждений полых органов) можно ограничиться применением цефалоспоринов 3-го поколения, при ранениях живота и повреждениях полых органов — сочетанием аминогликозидов с клиндамицином.
Эти же группы риска с первых суток послеоперационного периода нуждаются в проведении неспецифической иммунной терапии. Как известно, для реализации адекватного иммунного ответа на повреждающее действие необходимо определенное время, в течение которого происходит пролиферация иммунокомпетентных клеток и синтез специфических белков. Особенно уязвимой иммунная система становится при дефиците иммуноглобулинов и снижении фагоцитарной активности вследствие большой кровопотери.
В связи с этим большое значение приобретает профилактическая иммунокоррекция. Ее мы рассматриваем не только как средство заместительной терапии, восполняющей дефицит быстро потребляемых при тяжелых ранениях факторов иммунитета, но и как средство направленного изменения иммунного ответа для профилактики системных нарушений гомеостаза.
Наиболее известными препаратами являются тактивин (тимоген), который способствует дифференцировке Т-лимфоцитов и восстанавливает прямую и обратную связь между иммунной и эндокринной системой, и миелопид, который активирует окислительный метаболизм и фагоцитоз нейтрофилов, образование зрелых моноцитов и функциональную активность Т-хелперов. Эти препараты применяют в течение первых 3 сут после ранения и хирургической операции.
Однако не всегда их применение сопровождается заметным клиническим эффектом, так как при тяжелой травме иммунокомпетентные клетки не в состоянии отвечать на введение подобного рода препаратов.
Полноценные иммуноглобулины и специфические антибактериальные антитела, содержащиеся в высокой концентрации в плазме от иммунизированных доноров, восстанавливают комплексообразование и процессы опсонизации, в результате чего активируется фагоцитоз, уменьшается эндотоксикоз и снижается риск инфицирования.
Одним из необходимых компонентов, определяющих полноценное функционирование всех регулирующих систем организма, являются плазменные белки, дефицит или дисбаланс которых вследствие острой кровопотери поддерживает состояние иммунного дисбаланса. Донорская плазма содержит фибронектин в концентрации, необходимой для обеспечения репаративных и санирующих процессов, в том числе — фагоцитарной активности, выведения циркулирующих иммунных комплексов и белковых фрагментов, а также антиоксиданты, предупреждающие воспалительную деструкцию тканей.
Содержащиеся в плазме иммунизированных доноров медиаторы ускоряют дифференцировку клеток и их межклеточные взаимодействия, что способствует процессу иммунореабилиации после ранения и кровопотери.
Учитывая нарушение механизмов синтеза белков в раннем послеоперационном периоде у пострадавших с массивной кровопотерей, мы широко используем свежезамороженную антибактериальную плазму или плазму неиммунизированных доноров как средство заместительной терапии.
Опыт показывает, что тяжелые гнойные осложнения чаще всего развиваются у пострадавших с повреждениями, сопровождающимися массивной кровопотерей, с повреждениями нескольких анатомических областей и жизненно важных органов, а также с повреждениями, сопровождающимися массивным инфицированием. Поэтому проведение иммунопрофилактики у пострадавших с признаками развития вторичного иммунодефицитного состояния мы основываем на следующих положениях:
1) при множественных сочетанных ранениях шеи, груди и живота обоснованная иммунопрофилактика должна быть начата как можно ранее с момента получения ранения;
2) основанием к назначению иммуномодуляторов является несоответствие клинической картины и данных лабораторных методов исследования: если при наличии обширных повреждений с массивной кровопотерей в первые 2 сут отсутствует лейкоцитоз, имеется абсолютная лимфопения с преобладанием незрелых форм гранулоцитов, диспротеинемия;
3) основной задачей иммунопрофилактики является возмещение утраченных звеньев иммунорегуляции для обеспечения адекватной воспалительной реакции;
4) не менее важно обоснованное применение препаратов, способных снизить чрезмерную воспалительную активность моноцитов/макрофагов и полиморфноядерных нейтрофилов и ограничить поступление в кровоток избыточного количества медиаторов системной воспалительной реакции, эндо- и экзотоксинов (препараты антиоксидантного действия, ингибиторы протеаз, нестероидные противовоспалительные препараты).
Читайте также: