Гнойно септической хирургической патологией


Профилактика и лечение хирургической инфекции в связи с ее распространением составляет одну из важнейших проблем современной хирургии.
Снижение иммунной реактивности организма связано с ухудшением экологической обстановки. В особенности губительное действие на иммунитет оказывает ионизирующая радиация. Значительную роль играет и ухудшение социальных условий жизни, а также пребывание некоторых людей в состоянии хронического стресса.
Высокий процент осложнений, рост травматизма, внедрение новых терапевтических и хирургических методик, снижение иммунорезистентности организма, отрицательное влияние антибактериальных препаратов побуждают к поискам новых методов лечения.
Гнойно-септический процесс за последние годы стал не только хирургической, но и общебиологической проблемой, так как патологические процессы, которые составляют его основу, базируются на сложных молекулярных и клеточных механизмах.
По современной концепции, септический процесс базируется на системном воспалительном ответе организма, который может проявляться при разной этиологии заболевания. Она имеет расхождения с предшествующими взглядами, согласно которым основной причиной тяжести состояния и смертности являлось наличие бактерий в крови. Тем не менее, совсем не учитывать роль инфекционного начала в возникновении септического процесса было бы неправильно.
Иммунный статус больных с гнойной инфекцией и его роль в характере клинического течения. Иммунитет — усиленная специфическая реакция организма на посторонние антигены, а также защита от бактериальных или вирусных инфекций.
Все факторы противоинфекционного иммунитета могут быть разделены на такие группы:
1. Кожа и слизистые — это первая линия защиты от инфекции, которая всегда повреждается во время хирургического вмешательства.
2. Система фагоцитарных клеток (нейтрофилы, моноциты, макрофаги и др.), которые также оказывают неспецифичное действие и являются одним из важнейших компонентов системной защиты организма от бактерий и грибов.
3. Гуморальный иммунитет.
4. Клеточный иммунитет, что вместе с предшествующим, является специфическим механизмом системной защиты организма, развитие которого протекает на протяжении нескольких недель.
Одной из основных причин сохранения высокого уровня частоты гнойно-септических осложнений и летальности выступает постоянное изменение видов бактериальной флоры и ее биологических свойств под воздействием антибактериальной терапии, и, что в особенно актуально, нерациональных программ применения антибиотиков. Costle и соавторы на примере одного госпиталя (1977 г.) доказали, что в 64% случаев антибиотики использовали нерационально, как по выбору, так и по дозированию, которое оказывало содействие быстрому развитию резистентности бактерий к ним, то есть стимулировало образование полирезистентных и высоковирулентных штаммов бактерий.
Антибиотики осуществляют отрицательное влияние на организм больного, которое проявляется в виде сенсибилизации организма, развития дисбактериоза, снижения иммунорезистентности.
В наше время ведущую роль играет граммотрицательная флора (кишечная палочка, палочка сине-зеленого гноя, клебсиелла, протей). Одним из мощнейших, пусковых агентов сепсиса является липополисахарид мембран граммотрицательных бактерий, который обозначается как эндотоксин. Следует помнить, что эндотоксин выделяется как в процессе жизнедеятельности микроорганизмов, так и вследствие их гибели под действием антибиотиков, причем степень выделения эндотоксина неодинаковая при действии разных антибиотиков.
Результаты ряда лабораторных, экспериментальных и клинических исследований подтверждают гипотезу, по которой эндотоксин выделяется под действием антибиотиков граммотрицательными бактериями.
Под нашим клиническим наблюдением находилось 100 больных в возрасте от 18 до 70 лет (69 мужчин и 31 женщина). Всем прооперированным больным было проведено хирургическое лечение гнойных очагов, их дренирование, иммунологические, бактериологические и цитологические исследования.
Установлено, что содержание Ig G у 43% больных было значительно ниже нормы, содержание Ig М и Ig А превышало норму соответственно у 41% и 71% больных. Содержание циркулирующих иммунных комплексов в 2,45—2,6 раза превышало норму, что клинически проявлялось в виде интоксикации.
Показатели клеточного иммунитета также изменялись: уровни Т- и В-лимфоцитов, а также популяции Т-супресоров были ниже нормы соответственно у 64, 48 и 84 % больных.
Наиболее информативными оказались функциональные иммуноло-гические показатели: у 96% больных тест на пирогенал был снижен, у 84% больных — сниженная фагоцитарная активность нейтрофилов.
Изучение чувствительности к антибиотикам основных факторов хирургической инфекции (золотистый стафилококк, синегнойная палочка, протей и кишечная палочка) показало, что к действию традиционных антибиотиков вышеуказанные микроорганизмы практически нечувствительны или слабо чувствительны.
Преобладающим возбудителем гнойно-септических заболеваний и связанных с ними осложнений в современных условиях является золотистый стафилококк, который встречается как монокультура в 61 % исследований, а у 27% больных он сочетается с граммотрицательными микроорганизмами (протеем, синегнойной палочкой).
Как известно, инфицированные раны являются частым осложнением и риск их возникновения зависит от нескольких параметров: вида операции, возраста пациента, состояния питания, сопутствующих заболеваний, продолжительности операции и пребывания больного в стационаре, использования протезов и дренажей, квалификации хирурга.
Антибактериальная активность может видоизменяться после внутриклеточной локализации бактерии вследствие фагоцитоза. Прежде чем антибиотик сможет действовать на размещенную внутри клетки бактерию, он должен быть захвачен фагоцитом и при этом сохранить свою активность.
Бактерии разными путями могут выживать во внутриклеточной среде. Некоторые локализуются внутри фагосомы (Staphylcoccusaureus, Escherihia Coli), другие вырабатывают механизмы выхода из фагосомы и последующего внутриклеточного размножения (Listeria monocytogenes, Legionella рпеитота).
Учитывая, что большинство клиник в схеме лечения гнойных ран продолжительное время и широко использовали традиционные антибактериальные препараты группы пенициллинов (бензилпенициллин, ампициллин, карбенициллин, метициллин), макролидов (эритромицин), аминогликозидов (стрептомицин, канамицин, гентамицин, неомицин), тетрациклинов (тетрациклин, доксициклин), другие антибиотики (левомицетин, полимиксин, рифампицин, линкомицин, ристомицин, фузидин), а мы, хотя бы раз в жизни, применяли эти препараты во время лечения, то отрицательное влияние токсичных соединений практически затронуло все население.
Современные антибактериальные препараты, которые применяются с целью монотерапии, такие как цефтриаксон, тиэнам, мефоксин, не лишены такого недостатка, как токсическое влияние на полезные сапрофитные бактерии.
В отличие от традиционной схемы лечения гнойно-септического процесса, в которую также входит оперативное вмешательство, назначение антибактериальных препаратов широкого спектра действия, применение местных антисептиков, хотелось бы предложить новые схемы, скомпонованные из фитопрепаратов фирмы NSP.
После проведения оперативного вмешательства, которое было и остается ключевым в лечении гнойно-септического процесса, дальнейшее назначение фитопрепаратов базируется на таких принципах:
- Дезинтоксикационный эффект (удаление метаболитов-продуктов распада).
- Повышение естественной иммунорезистености организма.
- Проведение санации инфекционных очагов, как острых, так и хронических.
- Коррекция витамино-минерального баланса организма.
- Восстановление нормального биоценоза кишечника.
С учетом вышеупомянутых принципов я предлагаю такие схемы:
Chlorophyll Liquid (Хлорофилл) по 1 чайной ложке на 1 стакан воды 2 раза в день за 30 мин. до еды на протяжении 1,5 месяцев, потом Kelp по 1 капсуле 2 раза в день на протяжении следующих 1,5 месяцев.
Defence Maintenance (Защитная формула) по 1 капсуле 2 раза в день 60 дней.
Colloidal Silver (Коллоидное Серебро) по 1 чайной ложке на 1 стакан воды на протяжении 20 дней.
Alfalfa (Люцерна) по 1 капсуле 2 раза в день на протяжении 1,5 месяцев, потом Kelp по 1 капсуле 2 раза в день на протяжении следующих 1,5 месяцев.
Вее pollen (Цветочная пыльца) по 1 капсуле 2 раза в день на протяжении 1,5 месяцев.
Colloidal Silver (Коллоидное Серебро) по 1 чайной ложке на 1 стакан воды на протяжении 20 дней.
Alfalfa (Люцерна) по 1 капсуле 2 раза в день на протяжении 1,5 месяцев, потом Kelp по 1 капсуле 2 раза в день на протяжении следующих 1,5 месяцев.
Capsicum, Garlic, Parsley (Перец, Чеснок, Петрушка) 1 капсуле 2 раза в день на протяжении 1,5 месяцев.
Alfalfa (Люцерна) по 1 капсуле 2 раза в день на протяжении 1,5 месяцев, потом Red Clover по 1 капсуле 3 раза в день на протяжении следующих 1,5 месяцев.
Capsicum, Garlic, Parsley (Перец, Чеснок, Петрушка) по 1 капсуле 2 раза в день на протяжении 1,5 месяцев.
Alfalfa (Люцерна) по 1 капсуле 2 раза в день на протяжении 1,5 месяцев, потом Red Clover по 1 капсуле 3 раза в день на протяжении следующего месяца.
Очевидно, что использование эубиотиков, таких как, эффективный препарат фирмы NSP Bifidophilus Flora Force (Бифидофилус Флора Форс), усилит любую из вышеперечисленных программ.
Во всех вышеуказанных схемах промывания раны и перевязки следует проводить 2 раза в сутки, применяя раствор коллоидного серебра, хлорофилла, обрабатывая кожу вокруг раны Маслом Чайного Дерева Теa Tree Oil.
Конечно, никто не умоляет роль традиционных антисептиков, которые хорошо сочетаются с выше указанными препаратами.
Здесь приведены примеры 5 наиболее рациональных схем, тем не менее их можно составить намного больше, используя природные антибактериальные свойства растений.
Это препараты: Una de Gato (Кошачий Коготь), Pau D'Arco (По Д'Арко), Mortnda (Моринда), Nony Juice (Сок Нони), Gotu Cola (Готу Кола), Colloidal Silver (Коллоидное Серебро) для приема внутрь и местно и др.
Как показал мой опыт, эти фитопрепараты действительно повышают природную иммунорезистентость больных гнойно-септической патологией. Несмотря на мнение некоторых коллег-оппонентов, которые категорически против применения БАД в практике врачей и не рекомендуют их пациентам, фитотерапия займет свое законное место в медицинской практике, в том числе и в хирургии.
Хотелось бы также остановиться на той ситуации, которая часто случается на практике: существует ошибочное мнение, что с заживлением раны на 7—12-й день санацию организма можно закончить. Тем не менее, будет рационально продолжать прием БАД до полной стабилизации иммунного статуса организма, на что может понадобиться не менее 2—3 месяцев.
Возникновение и течение гнойной хирургической инфекции зависит как от состояния иммунной системы, так и от свойств микрофлоры, факторов окружающей среды и их взаимодействия друг с другом. Провести коррекцию иммунного статуса организма возможно с помощью фитопрепаратов корпорации NSP, которые оказывают дезинтоксикационное, бактерицидное, иммуностимулирующее и общеукрепляющее действие на организм больных с гнойно-септической патологией.
Коржик Н. П., к.м.н., врач-хирург высшей категории, Киев

Наверх 
Вернуться назад

Главная 
Статьи 
Гнойно-септичекая патология
Что такое гнойная хирургия
Понятие "гнойная хирургия" является собирательным термином, который включает в себя лечение заболеваний и осложнений, протекающих с участием патогенных микроорганизмов и требующих хирургического вмешательства. Присоединение инфекции может осложнить течение широкого круга заболеваний и хирургических операций.
Трудно найти область медицины, в которой не работают специалисты по хирургической инфекции:
Травматология: инфицированные посттравматические и ожоговые раны, посттравматический остеомиелит, гнойные осложнения металлоостеосинтеза
Ортопедия: гнойные артриты, гнойные осложнения протезирования суставов и других ортопедических вмешательств
Абдоминальная хирургия: осложненные варианты интраабдоминальной инфекции, инфицированный панкреонекроз, гнойные осложнения после "открытых" и лапароскопических операций на органах брюшной полости
Ревматология: инфицированные трофические язвы на фоне системных васкулитов и заболеваний соединительной ткани.
Эндокринология: инфицированные формы синдрома диабетической стопы
Ангиология: гангрены на фоне критической ишемии конечностей
Флебология: трофические язвы нижних конечностей на фоне хронической венозной недостаточности
Дерматология: инфекции кожи, осложненные абсцедированием
Онкология: осложнения после хирургического и лучевого лечения опухолей различной локализации
Пластическая и эстетическая хирургия: гнойные осложнения после использования медицинских имплантатов, а также применение методов пластической хирургии для закрытия обширных ран.
Инфекционные болезни: заболевания, протекающие с некрозом и воспалением мягких тканей
Неврология: пролежни различной локализации
Формы заболеваний
Острые гнойные заболевания мягких тканей:
- абсцесс - ограниченный очаг воспаления с образованием гнойной полости;
- флегмона - разлитое гнойное воспаление мягких тканей, не имеющее сформированной капсулы. Наиболее грозным вариантом флегмоны является некротизирующая инфекция мягких тканей, которая стремительно, в течение нескольких часов поражает обширные участки соединительной ткани, мышц или подкожной клетчатки. В этих случаях жизнь пациента напрямую зависит от скорости и радикальности выполненной хирургической операции, а также от грамотно проведенной интенсивной терапии в условиях специализированного учреждения. Раньше эти заболевания называли газовой гангреной или анаэробной инфекцией.
Хронические гнойные заболевания:
- трофические язвы, инфицированные раны, гнойные свищи, гангрены - являются, по сути, не самостоятельными нозологическими формами, а осложнениями самых разных заболеваний. Успех в их лечении в первую очередь зависит от правильно установленного диагноза и от возможности воздействовать на причину образования раны и нарушения ее заживления.
При генерализации инфекции (переход местного процесса в общий, развитие вторичных очагов) развивается сепсис, который сопровождается дисфункцией внутренних органов и систем и при неблагоприятном течении может привести к смерти пациента.
Симптомы заболеваний
- Боль в пораженном участке - главный симптом острых гнойных заболеваний мягких тканей.
- Нарушение целостности кожных покровов – характерные, но не обязательный симптом, так называемые "входные ворота" инфекции.
- Болезненная припухлость.
- Кожа над очагом гнойного воспаления часто бывает горячей, покрасневшей, иногда с багровым оттенком.
- Повышение температуры тела, нарастание признаков интоксикации.
Следует отметить, что яркая клиническая картина наблюдается не всегда, и иногда обширные гнойные процессы протекают со скудными местными проявлениями. Особенно это характерно для пожилых и ослабленных пациентов.
Симптомы хронических гнойных заболеваний: образование незаживающих ран, язв, свищей или некроза кожи и мягких тканей.
Причины заболеваний
Комплекс причин, вызывающих образование и длительное существование гнойных очагов, включает в себя:
- Инфекцию, то есть локальную и системную воспалительную реакцию организма на патогенную микрофлору. Инфицирование, как правило происходит:
- при нарушении целостности кожных покровов (при травмах, хирургических операциях, инъекциях),
- контактно (через неповрежденный кожный покров или слизистые оболочки),
- гематогенно (с током крови).
Особенно упорно протекает инфекция при наличии эндопротезов, имплантов и других инородных материалов.
- Ишемию, или нарушение питания тканей вследствие нарушенного кровоснабжения. Некротизированные ткани становятся идеальной питательной средой для раневой микрофлоры, что делает патологический процесс неконтролируемым. Добиться купирования гнойного процесса без восстановления кровоснабжения бывает чрезвычайно трудно.
- Венозную недостаточность, которая приводит к формированию длительно незаживающих трофических язв.
- Сахарный диабет, сопровождающийся нарушением кровоснабжения, иннервации и иммунного ответа. Хирургическая инфекция, протекающая на фоне сахарного диабета, отличается упорным течением и требует комплексного подхода с участием различных специалистов.
Наиболее распространенные возбудители раневых инфекций - грам-положительные (стафилококки, стрептококки и др.) и грам-отрицательные (синегнойная палочка, протей, клебсиелла) микроорганизмы.
Следует отметить, что в последние годы отмечается возрастание числа устойчивых к антибиотикам штамммов возбудителей раневой инфекции. Это делает чрезвычайно ответственным назначение стартовой антибактериальной терапии и определяет необходимость бактериологического контроля за микрофлорой раны.
Диагностика
Современные методы диагностики основаны на определении состояния тканей, обнаружении очагов деструкции (разрушения тканей), скоплений патологического содержимого, наличия воспалительных изменений.
Для оценки распространенности гнойного процесса используется ультразвуковое исследование мягких тканей, компьютерная томография (КТ), магнито-резонансная томография (МРТ), радиоизотопное сканирование с использованием меченых аутолейкоцитов. Обязательным является исследование клеточного состава крови для выявления общей реакции на воспаление, бактериологическое исследование для установления характера микрофлоры и определения чувствительности возбудителей к антибиотикам.
Особенности лечения
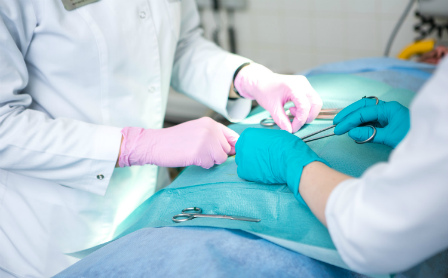
Основа лечения всех вариантов хирургической инфекции - радикальная хирургическая обработка гнойного очага, включающая удаление некротизированных тканей и адекватную санацию раны. В послеоперационном периоде проводят антибактериальную терапию, местное лечение раны с применением современных мазей, раневых покрытий и перевязочных материалов. После купирования воспаления и перехода раны в стадию регенерации решают вопрос о хирургическом закрытии раны (швами, перемещенными полнослойными лоскутами, либо свободными кожными лоскутами). Возможно и самостоятельное заживление небольших ран под повязкой, хотя это удлиняет сроки лечения и приводит к формированию более грубого рубца.
Профилактика
Профилактика хирургической инфекции заключается, прежде всего, в контроле над "входными воротами" инфекции, применении методов антисептики для обработки случайных ран. Важным является своевременное лечение заболеваний, усугубляющих течение инфекции, в первую очередь сахарного диабета, заболеваний артерий и вен нижних конечностей.
Новые технологии диагностики и лечения ран
В последние годы разрабатываются и входят в практику новые методы лечения ран.
К методикам, позволяющим существенно улучшить результаты лечения, можно отнести применение лечения ран локальным отрицательным давлением (NPWT – negative pressure wound treatment, V.A.C. - vacuum assisted clossure). Применение этого метода позволяет оптимизировать течение всех фаз раневого процесса, добиться быстрого купирования воспаления, снизить бактериальную обсемененность раны и способствует быстрому сокращению глубины и размеров раны. Данный метод лечения не требует частых болезненных перевязок, смена повязки производится 1 раз в 3 – 7 дней в зависимости от фазы раневого процесса.
Кардинально улучшить результаты лечения пациентов с синдромом диабетической стопы удается с помощью эндоваскулярных методов восстановления магистрального артериального кровотока в нижних конечностях. Применение баллонной ангиопластики и стентирования позволяет сохранить конечность даже при начинающейся гангрене.
Преимущества гнойной хирургии в ЕМС
Клиника ЕМС является современным лечебным учреждением, обладающим всеми современными возможностями диагностики и лечения. Круглосуточная работа лечебно-диагностического комплекса позволяет комплексно решать проблемы, возникающие при тяжелой хирургической инфекции мягких тканей, в кратчайшие сроки выполнить полноценное обследование и предоперационную подготовку. Радикальное хирургическое лечение производится в кратчайшие сроки в современных операционных, оборудованных лучшей хирургической и анестезиологической аппаратурой.
Перевязки ран выполняются с применением обезболивания. Используются раневые покрытия, препараты для местного лечения ран и перевязочные материалы ведущих производителей.
Использование вакуум-ассистированных повязок позволяет максимально ускорить заживление ран и снизить число перевязок. Возможно амбулаторное лечение локальным отрицательным давлением с редкими (1 раз в 3 – 7 дней) визитами в клинику.
Доступность в стенах одной клиники современных методов обследования и лечения, а также ведущих специалистов позволяет оперативно производить восстановление кровоснабжения, купировать фоновые и сопутствующие заболевания одновременно с контролем за состоянием очага инфекции и комплексным лечением ран.
Хирургическое закрытие ран производится с применение методов пластической хирургии для достижения максимально функционального и эстетического результата.
B.C. Савельев
далекого прошлого — термин введен Гиппократом - сепсис остается проблемой медицинского, демографического и экономического значения. К сожалению, в нашей стране отсутствуют обобщающие эпидемиологические и статистические данные, поэтому приходится ссылаться на зарубежные. В конце XX века США ежегодно регистрировали около 700 000 случаев сепсиса. Во Франции частота сепсиса составляет 6 случаев на 1000 больных в обычных отделениях и 119 случаев на 1000 пациентов, находящихся в отделениях интенсивной терапии.
Метанализ показал, что летальность, связанная с сепсисом, за последние 50 лет снизилась лишь на 20%, и к началу XXI века в среднем составляет около 40%.
Большое значение для организации здравоохранения имеют данные об отдаленных результатах лечения сепсиса. Так, через 8 лет после успешного непосредственного лечения умерли 82% больных, перенесших сепсис. Прогнозируемая продолжительность жизни после перенесенного сепсиса в среднем составляет 5 лет (Quartin AA et al, 1997). При этом качество жизни выживших больных значительно ниже нормы для соответствующих попу-ляционных групп.
Концептуальные вопросы сепсиса - как в отношении понимания его этиопатогенеза и нозологической сущности, так и диагностики и лечения — всегда были предметом противоречий и дискуссий. В последнее время благодаря достижениям фундаментальных наук и клинической медицины получены новые данные об этиологии, патогенезе и та-натогенезе этого патологического процесса. Выяснение новых закономерностей взаимосвязи микроб - человек и общебиологических механизмов ответа на повреждение позволило прийти к заключению, что в основе сепсиса как генерализованного процесса лежит общая, системная реакция макроорганизма, связанная с выбросом различных медиаторов воспаления под действием микроорганизмов. Иначе говоря, сепсис - это проявление системной воспалительной реакции в ответ на микробную агрессию. Однако при сепсисе возникает не просто гиперпродукция про- и противовоспалительных медиаторов и активация других регуля-торных систем - от апоптоза и коагуляции до выброса гормонов. При сепсисе происходит дисрегу-
Координация усилий в исследовании сепсиса позволила унифицировать его диагноз. О сепсисе свидетельствуют клинические признаки системной воспалительной реакции при наличии очага инфекции. Такой унифицированный подход в диагностике сепсиса создает основу для определения эффективности и стандартов лечения, оценки прогноза, а также позволяет проводить эпидемиологические исследования.
хирургическая инфекция и гнойно-септическая хирургия
процесс, начальные проявления которого могут быстро перейти в фатальную стадию полиорганной недостаточности и необратимого инфекционно-токсического шока.
В августе 2001 г. исполнилось 10 лет со времени Согласительной конференции по сепсису, которая предложила стандартизировать терминологию, касающуюся синдрома системной воспалительной реакции (ССВР) и сепсиса. Десятилетний опыт показал, что концепция системной воспалительной реакции имеет не только клиническое, но и общебиологическое значение.
Признаки ССВР являются чувствительными критериями для выявления популяции риска инфекционных осложнений и служат основой опережающего принципа диагностики сепсиса и других критических состояний. При адекватной клинической трактовке симптоматика ССВР имеет существенное дифференциально-диагностическое значение. Частота выявления признаков ССВР в отделениях интенсивной терапии весьма высока — до 75%. Лишь у 25-50% больных с признаками ССВР подтверждается его инфекционная этиология. При этом вероятность ее инфекционной причины четко коррелирует с количеством выявляемых признаков.
В последние годы произошли определенные изменения в микробиологической структуре сепсиса. Если 15-20 лет назад в этиологии хирургического сепсиса доминировали грамотрицательные бактерии и золотистый стафилококк, то сейчас существенно возросла роль сапрофитных стафилококков, энтерококков и грибов. Увеличилась частота выделения микробов, наименования которых ранее были вообще неизвестны клиницистам.
Причина этого - селекция резистентных микробов под влиянием антибиотиков, широкое применение инвазивных методов диагностики и лечения, влияние различных факторов, вызывающих иммунодепрессию.
Сепсис является одной из основных причин летальности хирургических больных и может осложнять течение различных заболеваний и локальных воспалительных процессов.Септическая реакция возникает при перитоните, пневмонии и уроинфекции, нагноении раны, инфицировании внутрисосудистых устройств и катетеров. Выявление первичного очага важно для успешного лечения сепсиса любого ге-неза. Особое значение это имеет для хирургической практики, где успешная оперативная санация невозможна без топического диагноза.
Абдоминальный сепсис, осложняющий течение различных внутрибрюшных воспалительных и деструктивных процессов, представляет наиболее сложную проблему как в диагностическом и лечебном плане, так и в экономическом отношении. В нозологической структуре абдоминального сепсиса приоритетное место занимают различные формы перитонита и гнойно-воспалительные осложнения деструктивного панкреатита. Большая частота развития сепсиса объясняет весьма высокую летальность при этих заболеваниях. Отличительные особенности абдоминального сепсиса, связанные со сложнейшей анатомией, физиологией и биоэкологией органов брюшной полости, включают:
наличие многофокусных и крупномасштабных очагов инфекции, быстрое включение механизма эндогенного инфицирования, сверхактивацию медиаторов и других каскадов системной воспалительной реакции, ускоренное развитие полиорганной недостаточности и септического шока, трудности топической и дифференциальной диагностики. Частое возникновение при абдоминальном сепсисе дистантных и метахронных очагов инфекции, в частности нозокомиальной пневмонии и ан-гиогенного инфицирования, вносят свою лепту в танатогенез этой формы хирургического сепсиса. С учетом особенностей приоритетного спектра возбудителей, путей инфицирования, динамики развития патологического процесса, классификация хирургического сепсиса с учетом локализации первичного очага имеет важное клиническое значение и позволяет обосновать стратегию и тактику различных направлений лечения.
Полиорганная недостаточность, патогномонич-ная для сепсиса, особенно абдоминального, включает поражение различных систем и органов, практически у 60% больных.
Нарушения кровообращения и транспорта кислорода в начальных стадиях сепсиса носят гипердинамический характер с последующим возникновением гиподинамии, синдрома малого сердечного выброса с резким падением доставки и потребления кислорода.
В последние годы уточнена роль различных звеньев коагуляционного каскада в патогенезе и тана-тогенезе тяжелого сепсиса и септического шока. В частности, установлено, что потребление протеина С при ССВР не только приводит к нарушениям гемокоагуляции, но и является причиной дисрегу-ляции системного воспаления, резкого нарушения функции клеток, повреждению эндотелия сосудов и недостаточности органов-мишеней.
Огромную роль в патогенезе сепсиса играет возникновение кишечной недостаточности. Под влиянием медиаторов воспаления, гиперкатаболизма, нарушений системного и висцерального кровотока быстро нарастает повреждение энтероцитов, нарушаются практически все функции желудочно-кишечного тракта — барьерная, метаболическая, иммунозащитная, эндокринная. Кишечная недостаточность - важнейший компонент порочного круга при сепсисе, поскольку транслокация бактерий и их токсинов поддерживает воспалительную реакцию, усугубляя нарушения обмена веществ.
Разрыв порочного круга и успешное лечение больных с сепсисом зависят от своевременной и комплексной реализации 3 стратегических направлений: устранения очагаи блокады дальнейшей генерализации инфекции, воздействия на воспалительные каскадные реакции и
хирургическая инфекция и гнойно-септическая хирургия
комплексной интенсивной поддержки функции органов-мишеней.
Первостепенное значение для хирургического сепсиса имеет инвазивная, хирургическая санация инфекционного очага. Для его выявления нам часто приходится прибегать к различным методам лучевой диагностики, а в ряде случаев даже к радиоизотопным методам исследования. Невозможность одномоментной санации очага, особенно при абдоминальном сепсисе, диктует необходимость неоднократных оперативных вмешательств, которые сами по себе могут быть дополнительным фактором поддержания системной воспалительной реакции.
Важнейшую роль играет адекватная и своевременная антимикробная терапия. Выбор антибиотиков зависит не только от спектра их действия и фармакокинетических характеристик, но и определяется тяжестью состояния больного. Чем тяжелее больной, тем рациональнее должна быть тактика антибактериальной терапии. Фактор времени решает многое. Неадекватная антибактериальная терапия существенно повышает летальность больных с сепсисом. Рациональное использование антибактериальных препаратов,как показывает наш опыт, позволяет на 20% сократить расходы на лечение.
Основа интенсивной терапии - коррекция тканевой гипоксии, оптимизация доставки кислорода, респираторная поддержка.
В отношении коррекции кишечной недостаточности наши возможности пока весьма ограничены, но и их необходимо использовать в полной мере.
Особое значение в ведении больных с сепсисом играет профилактика тромбоза глубоких вен и фатальных тромбоэмболических осложнений. Как правило, у больных с сепсисом выявляют один или несколько факторов риска этих осложнений. По данным доказательных исследований, фармакологическая профилактика ТЭО с помощью нефрак-ционированного или низкомолекулярного гепарина в 2-3 раза снижает частоту фатальных тромбоэмболических осложнений и существенно влияет на летальность больных с сепсисом.
Важную роль в борьбе за жизнь больного играет метаболическая, нутритивная поддержка с приоритетным использованием энтерального питания.
Что касается новых экспериментальных направлений лечения сепсиса, направленных на блокаду и связывание токсинов бактерий, цитокинов и других медиаторов воспаления, то убедительных данных об их эффективном влиянии на летальность при сепсисе пока не получено. Дело, по-видимому, не только в том, что гуморальная воспалительная реакция в силу ее многокомпонентности, разнонаправленное™ и лабильности похожа на китайскую головоломку. Определение активности циркулирующих в крови медиаторов - лишь верхушка айсберга, под водой скрыто много неизвестного. Генетический полиморфизм цитокиногенеза, его зависимость от вида возбудителя не дают пока нам четкого и клинически значимого маркера для целенаправленного лечебного воздействия на медиатор-ном уровне. Сепсис - намного более сложный патологический процесс, чем известная нам сейчас сумма его составляющих. Клинических и лабора-
торных критериев сепсиса достаточно, чтобы своевременно его заподозрить и сформулировать диагноз. Но этих критериев мало для эффективного и своевременного вмешательства в каскады ме-диаторной бури.
Новые данные о роли нарушений гемокоагуля-ции в патогенезе сепсиса привели к разработке нового препарата - активированного человеческого протеина С (АРС). Многокомпонентное благоприятное действие АРС подтверждено результатами только что проведенных международных клинических испытаний. Под влиянием этого препарата удалось улучшить шансы выживания больных с тяжелым сепсисом на 38%. Впервые за 10 лет получен столь значительный успех при применении нового направления лечения сепсиса. По мнению экспертов, вполне вероятно включение АРС в стандарт лечения этой тяжелой категории больных.
На сегодняшний день эффективность применения препаратов иммуноглобулинов в отношении снижения летальности больных доказана как в рандомизированных испытаниях, так и путем ме-танализа опубликованных данных. В настоящее время изучается также эффективность энзимоте-рапии в лечении больных с сепсисом (вобэнзим, флогэнзим).
Особые проблемы связаны с ангиогенным инфицированием, ангиогенным сепсисом. Основная причина этих осложнений - широкое использование для лечения и мониторного контроля длительной катетеризации сосудов. Масштабы этой проблемы отражают эпидемиологические данные. Летальность при ангиогенной инфекции (не атрибутивная, а общая) составляет 25-60%. Следует иметь в виду, что почти 75% случаев бактериемии в послеоперационном периоде связано именно с инфицированием внутрисосудистых катетеров. Кроме того, ангиогенные инфекционные осложнения могут возникнуть при имплантации любого жизнеспаси-тельного устройства в сердечно-сосудистую систему - от клапанов сердца до кава-фильтров для профилактики тромбоэмболии легочных артерий. Следует подчеркнуть, что диагностика и лечение ангиогенной инфекции и сепсиса - крайне сложная проблема.
Значительные трудности связаны с диагностикой и лечением нозокомиальной пневмонии, в частности у хирургических больных. Особенно высока частота возникновения такой пневмонии при проведении искусственной вентиляции легких -до 50%.
Участие в этиологии нозокомиальной пневмонии проблемных микроорганизмов ограничивает арсенал эффективных антибактериальных препаратов, и это осложнение вносит свой весомый вклад в танатогенез хирургических больных. Сле-
хирургическая инфекция и гнойно-септическая хирургия
дует отметить, что целенаправленная антимикробная терапия позволила нам существенно - почти на 20% - ограничить фатальный потенциал, связанный с нозокомиальной пневмонией.
В проблеме госпитальной инфекции есть и существенные достижения. В частности, совершенствование хирургической техники прежде всего и применение так называемой интраоперационной профилактики антибиотиками привело к значительному снижению частоты раневых инфекционных осложнений после операций различных категорий - как чистых, так и контаминированных. И к концу XX века проблема послеоперационной раневой инфекции стала в определенной степени контролируемой.
Основные клинические достижения инфектоло-гии и учения о сепсисе касаются многих аспектов диагностики и лечения, оценки прогноза, внедрения новых антибиотиков, иммунокорригирующих средств, новых фундаментальных представлений о патогенезе и взаимоотношений микроба с челове-
ком. Не менее значительными выглядят нерешенные проблемы.
Особо отметим резистентность бактерий ко многим антибиотикам, возрастание роли грибковой инфекции, сохранение высокой летальности при сепсисе, несостоятельность лечебных воздействий на уровне септического медиаторного каскада.
Перспективным является решение ряда задач научного и организационно-методического плана. Необходимо продолжить разработку современной концепции сепсиса и углубить наши представления о взаимоотношениях микроб—человек Весьма существенным является стандартизация диагностики и лечения госпитальных инфекций на основе доказательных микробиологических, фармакологических и клинических исследований. Решение этих задач невозможно без тесного сотрудничества представителей фундаментальных, прикладных и клинических наук.
ИЛ. Ерюхин
ложность и драматизм проблемы перитонита "растворяются" в клинической неопределенности обобщающего понятия. Диагноз перитонита в общем смысле подразумевает любую форму и любую степень выраженности воспаления брюшины. В данной связи еще И.И. Греков с горькой иронией замечал, что "исправить" угнетающую статистику исходов перитонита довольно просто: стоит лишь "разбавить" наблюдения истинного перитонита теми его формами, для излечения которых достаточно одной адекватной и своевременно выполненной операции без каких-либо дополнительных усилий. Опыт показывает, что подобные тенденции проявляются и поныне. Они служат причиной сосуществования оптимистических заключений некоторых диссертационных исследований и отдельных публикаций с серьезной озабоченностью большинства клиницистов в связи с сохраняющейся высокой летальностью при перитоните. Согласно публикуемым сводным данным Б.КЩуркалина (2000), средние показатели летальности удерживаются на уровне 20-30%, а при наиболее тяжелых формах перитонита, к примеру, послеоперационном перитоните — достигают 40 - 50%.
Перитонит остается хирургической, общеклинической и общепатологической проблемой, актуальность которой не снижается, несмотря на несомненные успехи клинической медицины, вооруженной новыми перспективными технологиями. Поэтому вновь, далеко не в первый раз, прослеживается необходимость более четкого определения и рационального ограничения проблемы перитонита с тем, чтобы сконцентрировать внимание на
профилактике и лечении тяжелых его форм. Начинать обсуждение лечения перитонита каждый раз приходится с уточнения позиций относительно клинической его классификации, имея в виду три исходных положения.
Во-первых, всякая классификация условна и потому не способна полностью исключить те или иные дискуссионные разногласия. Во-вторых, клиническая классификация должна быть краткой, удобной в использовании и ориентированной на решение вполне конкретной практической задачи: обеспечения дифференцированного подхода к лечебно-диагностической тактике. В-третьих, не идеальная, но согласованная общепринятая классификация всегда имеет преимущества перед прочими, возможно и более точными по общепатологическому смыслу, но не получившими широкого признания классификационными вариантами.
Читайте также:


