Иммунодефицитные состояния и сепсис
Иммунная система выполняет роль щита для человека. Она защищает его как внутри, так и снаружи для того, чтобы собственные органы и ткани функционировали правильно.
Но, как и любые системы организма, иммунная система подвержена патологическим процессам. Могут выпадать или быть недостаточными одно или несколько звеньев в цепочке иммунного ответа. В результате возникают иммунодефицитные состояния, первичные или вторичные иммунодефициты.
Первичные иммунодефициты
Эти заболевания, в основе которых лежит наследственно заложенный дефект строения и функционирования иммунной системы, достаточно распространены. Они проявляются серьезными нарушениями иммунной защиты. Многие синдромы сцеплены с Х-хромосомой, поэтому проявляются гораздо чаще у мальчиков. Другая часть имеет аутосомно-рецессивный тип наследования и встречается в равной степени и у девочек.
В целом, это группа состоит из более 100 различных заболеваний, частота возникновения от одного больного на 1000000 человек до одного на 100000. Почти всегда встречаются в детском возрасте, так как значительная часть этих пациентов имеет тяжелые формы иммунодефицита и не доживает до 20 лет. При легких формах иммунологические дефекты могут с возрастом частично компенсироваться и не создавать риска для жизни носителя, тяжелые, наоборот, вызывают летальный исход еще в младенческом возрасте.
Классификация
Первичные иммунодефициты подразделяют по уровню поражения на:
- Клеточные иммунодефициты:
- дефицит CD4 клеток (проявляется в раннем детстве в виде криптококкового менингита и хронического кандидоза ротовой полости);
- дефицит CD7 клеток (описан один клинический случай):
- дефицит интерлейкина двух или нескольких интерлейкинов;
- недостаточность одного или нескольких цитокинов;
- синдром Ди Джорджи (на ранних сроках беременности вилочковая железа эмбриона не получает предшественников Т-клеток, остаются недоразвитыми и паращитовидные железы - как следствие тетания, судороги, а также пороки сердца, нарушения строения лица в виде расщелины губы и неба, аномалии развития костей скелета, нервной системы, почек).
2. Гуморальные иммунодефициты
- Гипер-IgM-синдром: Т-клетки начинают синтезировать иммуноглобулин только одного типа М. При этом возникает дефицит остальных видов Ig. Проявляется с раннего возраста нейтропенией, пневмоцистной пневмонией, в течение первых лет жизни наблюдаются частые гнойные синусо-пульмональные инфекции. Если ребенок доживает до пубертатного периода, часто возникает цирроз печени или В-клеточные лимфомы.
- Дефицит IgA. Так как этот иммуноглобулин обеспечивает местный иммунитет кожи и слизистых оболочек, проявлениями дефицита становятся бронхит, конъюнктивит, диарея, синусит, пневмония, фурункулезные поражения кожи. Также возможна непереносимость лактозы, множественные аллергические проявления, аутоиммунные патологии.
- Дефицит IgG. Проявления зависят от того, какой именно G-субкласс страдает. В основном это постоянные отиты, синуситы, бронхиты, конъюнктивиты.
- Болезнь Брутона (агаммаглобулинемия, сцепленная с Х-хромососой) - проявляется гнойными инфекциями желудочно-кишечного тракта, ЛОР-органов, костно-мышечной системы, абсцессы и фурункулез, частые осложнения - менингиты и сепсис.
- Дефицит антител с нормальным уровнем иммуноглобулинов. Проявляется рецидивирующими синусо-пульмональными инфекциями, а также атопическими заболеваниями (астма, ринит, дерматит). Выявляется редко ранее возраста двух лет.
3. Комбинированные иммунодефициты
- Синдром Луи-Бар (атаксия телеангиэктазия), поражается много функций: недоразвита вилочковая железа, дефицит Т-клеток, IgG, IgE, IgA, атаксия, поражения сосудов, нарушение пигментации, синуситы, инфекции дыхания.
- Комбинированная иммунная недостаточность (проявления тяжелые, многочисленные поражения, прогноз плохой).
- Дефицит отдельных ферментов (пуриннуклеотидфосфорилазы, аденозиндезаминазы). Из-за накопления в клетках токсичных продуктов метаболизма в первом случае страдают Т-клетки, во втором - Т-клетки и В-лимфоциты. Клинически - это задержка развития, неврологические нарушения - спазмы, умственная отсталость, тиреоидит, системная красная волчанка.
- Дефицит CD3 и 8 - отличаются стандартными проявлениями иммунодефицитных состояний.
- Синдром "лысых лимфоцитов" - страдает количество Т-хелперов, проявляется иммунными расстройствами совместно с задержкой умственного развития и постоянной диареей.
- Синдром Вискотта-Олдрича - тромбоцитопения с геморрагическим синдромом, новообразования, экзема и комбинированный иммунодефицит.
4. Дефициты специфических факторов иммунитета
- Недостаточность системы комплемента. В зависимости от компонента, который поражен, клиническая картина различна. При одних это васкулиты, лимфомы, сепсис, синуситы, отиты, менингиты, при других пневмонии, поражения кожи, аутоиммунные патологии.
- Дефекты фагоцитоза - нейтропении (множество вариантов), частые поражения легких внутриклеточными возбудителями либо грибковыми инфекциями.
Клиника
Клинически первичные и вторичные иммунодефицитные состояния проявляются нарушением иммунной защиты и инфекционным синдромом. Понижается резистентность к инфекционным агентам не только патогенным, но и входящим в состав нормальной микрофлоры (например, Candida, Pneumocystis, цитомегаловирус, стафилококк, энтеровирусы, простейшие).
Характер проявлений нарушений иммунной защиты определяется локализацией поражения в иммунной системе и/или комбинацией пострадавших факторов.
- Возникают хронические поражения верхних дыхательных путей, уха, придаточных пазух, желудочно-кишечного тракта, кожи и слизистых. Инфекции склонны к генерализации и септицемии, не поддаются стандартной терапии.
- Аутоиммунные заболевания - склеродермия, тиреоидит, гепатит, артрит т.д.
- Анемии, снижение числа лейко- и лимфоцитов, тромбоцитопения.
- Задержка роста и развития ребенка.
- Часто присутствует склонность к аллергическим реакциям в виде гиперчувствительности немедленного типа - отек Квинке, экзема, аллергия на лекарственные препараты и продукты.
- Расстройства пищеварения, мальабсорбция, диарейный синдром.
- Неадекватная реакция организма на введение сывороток и вакцин, при введении живой вакцины возможно возникновение сепсиса.
- Предрасположенность к онкологическим заболеваниям, особенно клеток крови.

Диагностика
И первичные и вторичные иммунодефицитные состояния имеют схожую картину инфекционных поражений. Установить более точную причину поможет клинико-иммунологическое обследование. Если дефект локализован, можно выявить, например, отсутствие Т или В-лимфоцитов, либо снижение концентрации комплемента, цитокинов или определенных иммуноглобулинов.
Лечение
Поскольку причина первичных иммунодефицитов в дефекте генома, этиотропное лечение - генная терапия (если определен ген, ответственный за конкретный иммунодефицит). Ген можно выявить путем полимеразной цепной реакции. Остальные подходы - заместительная терапия (трансплантация костного мозга, переливание нейтрофилов и лимфоцитов, введение ферментов и цитокинов. И симптоматическое лечение - терапия инфекционных заболеваний, иммуномодуляторы, витамины.

Вторичные иммунодефицитные состояния
Приобретенные вторичные иммунодефициты развиваются вследствие действия внешних или внутренних факторов и не связаны с генетическим аппаратом. Фактически, это состояния, сопутствующие известным заболеваниям или действию повреждающих факторов.
Вторичные иммунодефицитные состояния: классификация
По развитию бывают:
- острые (из-за травмы, операции, острого инфекционного заболевания);
- хронические (при злокачественных новообразованиях, хронических инфекциях, гельминтозах, аутоиммунных процессах).
По степени тяжести:
- компенсированный (легкий, с неполным выпадением звена иммунитета);
- субкомпенсированный (состояние средней тяжести, полностью страдает какое-то звено иммунитета);
- декомпенсированный (чаще носит системный характер, состояние тяжелое).
По уровню патологического процесса: первичные и вторичные иммунодефицитные состояния. Патофизиология их очень схожа:
- нарушение Т-клеточного иммунитета;
- нарушение В-клеточного иммунитета;
- патология системы фагоцитоза;

Вторичное иммунодефицитное состояние, МКБ 10:
D50-D89. Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм.
D80-D89. Отдельные нарушения, вовлекающие иммунный механизм.
D84. Другие иммунодефициты:
D84.9 Иммунодефицит неуточненный.
Причины
Причины вторичных иммунодефицитных состояний могут быть экзогенными и эндогенными.
Внешние причины - все разрушительные факторы окружающей среды - плохая экологическая ситуация, хроническое отравление организма, вредные излучения (ионизирующее, СВЧ и т.д.), вредные воздействия шума, пыли, прием некоторых иммуносупрессивных и гормональных препаратов.
Внутренние причины - вторичные иммунодефицитные и иммунодепрессивные состояния в данном случае гораздо более многочисленны и разнообразны:
- детский возраст, до 1 года, особенно если при рождении была низкая масса тела, когда к физиологическому иммунодефициту добавляется недостаток питания (или искусственное вскармливание);
- беременность и лактация - несут за собой физиологическую иммуносупрессию, нередко сочетаются с железодефицитной анемией;
- хронический дефицит питания, белков, микроэлементов, витаминов или воды;
- травмы, операции, длительное восстановление после них;
- хронические инфекции (бактериальные, вирусные, грибковые) практически все очень сильно влияют на иммунитет (хронические гепатиты, гломерулонефриты, туберкулез, краснуха и т.д. Особенно, конечно же, ВИЧ);
- гельминтозы - вызывают и усиливают вторичные иммунодефицитные состояния (аскаридоз, трихинеллез, токсоплазмоз);
- потери плазмы - кровопотери, ожоги, поражения почек;
- злокачественные онкологические образования;
- сахарный диабет, гипер- и гипотиреоз;
- аутоиммунные патологии (ревматоидный артрит, склеродермия, системная красная волчанка и т.д), при них собственная иммунная система нацеливается против своих же органов и систем;
- прием некоторых видов лекарственных препаратов (циклоспорин, карбамазепин, вальпроат, азатиоприн, кортикостероиды, цитостатики, антибиотики);
- хроническая кровопотеря (например, при язвенной болезни желудочно-кишечного тракта);
Как мы видим, вторичные иммунодефицитные состояния имеют совершенно различное происхождение. Их вызывают и экзогенные, и эндогенные факторы. Они чрезвычайно широко распространены и сопутствуют как некоторым физиологическим, так и многим патологическим процессам. Так, в результате инфекций, стресса, неблагоприятных факторов внешней среды и особенно их сочетания, возникают вторичные иммунодефицитные состояния.
Патофизиология: основой проявлений вторичных иммунодефицитов является гибель клеток иммунной системы, которая происходит двумя путями. Первый - по типу некроза, когда клетки гибнут из-за повреждения мембраны, и второй - по типу апоптоза, гибель тогда происходит в результате деградации ДНК под действием собственных ферментов. Также нередко вторичные иммунодефицитные состояния появляются из-за нарушения баланса клеток иммунной системы, например хелперных и супрессорных.
Диагностика
- Анамнез, жалобы, изучение наследственности.
- Определение в крови Т-лимфоцитов, активности и числа фагоцитов, спектра иммуноглобулинов.
- Тест на наличие ВИЧ, гепатитов, гельминтов и т.д.
- Протеинограмма.
- Выявление хронических инфекций.
Все исследования назначает специалист.
Лечение
Тактика лечения зависит напрямую от причины, вызвавшей вторичные иммунодефицитные состояния. Примеры терапии:
- При действии неблагоприятных факторов (например, ионизирующего излучения) поможет только их устранение и иммунокоррекция.
- При недостатке питания, белка или витаминов - добавление их в рацион.
- При беременности и лактации - прием дополнительных витаминов и микроэлементов, лечение анемии (если имеется).
- При хронических инфекциях и гельминтозе - в первую очередь санация инфекционных очагов и потом уже иммунотерапия.
- При аутоиммунных заболеваниях необходима стойкая их ремиссия, поэтому проводится курсовая гормонотерапия.
- Как симптоматическое лечение - заместительная терапия. Например, интерфероны, интерлейкины, цитокины, плазма.

В заключение
Первичные и вторичные иммунодефицитные состояния имеют совершенно разное происхождение, поэтому и проявляются в разном возрасте.
При этом патофизиологические механизмы у них очень сходные и идут всего несколькими путями. И если первичные иммунодефициты сложно поддаются терапии из-за дефекта генома, то вторичные вылечить вполне реально. Для этого необходимо лишь установить причину, по которой выпало звено иммунитета. Особенно гибко, в этом плане, вторичное иммунодефицитное состояние у ребенка - при своевременной коррекции прогноз в большинстве случаев очень благоприятный.
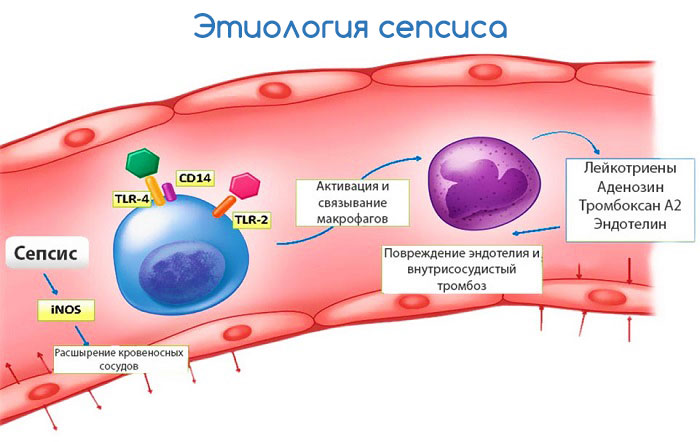
Сепсис – тяжелое состояние, которое вызывается попаданием в кровь и другие ткани организма микроорганизмов и продуктов их жизнедеятельности (токсинов).
Отличительной особенностью этой патологии является то, что воспалительный процесс протекает не локально, а во всем организме и характеризуется тяжелым прогрессирующим течением.
Обычно сепсис является осложнением тяжелых инфекционных процессов (в том числе – артритов) или травм, сопровождающихся инфицированием.
В зависимости от скорости прогрессирования симптомов заболевания, различают следующие варианты течения сепсиса:
- молниеносное (все проявления развиваются в течение 1-2 суток);
- острое (состояние прогрессирует 5-7 дней);
- подострое (длится до 3-4 месяцев);
- рецидивирующее (протекает в виде обострений и ремиссий, длится до 6 месяцев);
- хроническое (до года и более).
Молниеносные формы чаще наблюдаются у детей. У ослабленных и пожилых пациентов патология нередко протекает подостро или хронически.
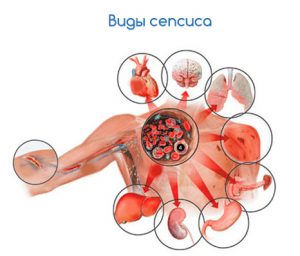
Традиционно выделяют следующие виды сепсиса:
- септицемия (сопровождается возникновением очагов инфекции в различных органах и тканях);
- септикопиемия (наличие возбудителей инфекции и их токсинов в крови больного, при отсутствии очагов воспаления в органах).
Но такое деление заболевания достаточно условно. Обычно те и другие проявления в той или иной степени сочетаются.
Возбудителями сепсиса являются патогенные и условно-патогенные микроорганизмы – стрептококки, стафилококки, реже – пневмококк, кишечная палочка, менингококк, сальмонелла, энтерококк, синегнойная палочка и другие. В редких случаях, у ослабленных пациентов в условиях иммунодефицита, сходные с сепсисом состояния могут вызываться грибковой инфекцией, вирусами, простейшими.
Основными факторами риска возникновения сепсиса являются:
- иммунодефицитные состояния (как врожденные, так и приобретенные на фоне тяжелой сопутствующей патологии, применения гормональной терапии или химиопрепаратов);
- наличие тяжелых заболеваний (сахарный диабет, алкоголизм, системные заболевания соединительной ткани, новообразования и другие);
- наличие травм и хирургические вмешательства (особенно, сопровождающиеся большой площадью раневой поверхности, кровопотерей, длительной иммобилизацией);
- недостаточность питания (гипотрофия, кахексия).
В зависимости от ворот инфекции (места, через которое она проникла) различают: черезкожный, акушерско-гинекологический, сепсис вследствие хирургических вмешательств и диагностических манипуляций и другие виды сепсиса.
Источником воспаления является очаг острой или хронической инфекции в организме. Это может быть инфекционный артрит, сопровождающийся возникновением других осложнений (флегмона, остеомиелит) или без них. К сепсису также могут приводить тяжелые заболевания дыхательной (пневмония, плеврит) или нервной системы (менингит, энцефалит), желудочно-кишечного тракта (болезнь Крона, неспецифический язвенный колит), заболевания кожи (пиодермии, обширные раневые поверхности после ожогов) и другая патология.
Патогенез сепсиса связан с массивным проникновением микроорганизмов в кровь или лимфатические системы из очага воспаления. Затем возбудитель инфекции разносится по всему организму с током крови и лимфы, оседает в различных органах, вызывая образование вторичных очагов воспаления в них. С такой массивной инфекционной атакой организм не может адекватно справиться, и состояние прогрессивно ухудшается.
Если вторичные очаги воспаления крупные и их можно выявить клинически, то говорят о септицемии. Если видимых мест локализации инфекции не обнаруживается, при наличии симптомов сепсиса и нахождении возбудителя в крови, то говорят о септикопиемии. Симптомы при этих формах могут не сильно различаться, но в случае септицемии могут понадобиться дополнительные хирургические методы лечения (вскрытие очага инфекции и его санация).
В тяжелых случаях сепсис приводит к нарушению свертываемости крови (ДВС-синдрому), может развиваться шоковое состояние (инфекционно-токсический шок), полиорганная недостаточность.
Симптомы сепсиса
Если инфекция попадает в организм извне, то инкубационный период (время от момента проникновения возбудителя до появления клинических симптомов) длится от нескольких часов до нескольких дней. Если возбудитель перенесен из другого очага в организме, то длительность инкубационного периода определить сложно. 
Симптомы сепсиса могут различаться. Для него всегда характерно наличие интоксикации, а другие проявления могут различаться в зависимости от места расположения первичного и вторичных очагов инфекции. К проявлениям этой патологии будут относиться:
- интоксикация, обуславливающая тяжелое общее состояние: высокая лихорадка (чаще держится постоянная температура, но бывают и кратковременные эпизоды снижения), выраженный озноб, нарушение сознания, головные, суставные и мышечные боли, учащенное дыхание и сердцебиение (одышка и тахикардия), могут быть тошнота и рвота, нарушения стула, обезвоживание, кожа становится бледной, с землистым оттенком;
- проявления гнойного артрита (или другой инфекционной патологии, которая привела к возникновению сепсиса): отек, боль и ограничение движений в суставе;
- при образовании очагов гнойного воспаления в органах появляется характерная симптоматика, в зависимости от их локализации (например, появление очаговых неврологических симптомов бывает при поражении головного мозга) – формируются артриты, миозиты, остеомиелит, конъюнктивит, плеврит, менингит и другая тяжелая патология, может быть гнойничковая сыпь на коже;
- в наиболее тяжелых случаях – симптомы полиорганной недостаточности, нарушение свертывания крови (ДВС-синдром) и другие изменения, характеризующие наиболее тяжелое проявление данной патологии – инфекционно-токсический шок.
Подострые, рецидивирующие и хронические формы сепсиса прогрессируют постепенно. Они вначале могут проявлять себя в виде кратковременных беспричинных подъемов температуры до высоких цифр, волнообразного течения или стойкой длительной лихорадки. Постепенно присоединяются и другие симптомы.
Диагноз бывает затруднен из-за наличия проявлений другого инфекционного заболевания (например, гнойного артрита), имеющего сходные симптомы. Однако при наличии сепсиса они обычно более резко выражены.
Помимо осмотра, используются методы лабораторной и инструментальной диагностики.
В лабораторных анализах могут выявляться:
Инструментальные методы диагностики носят вспомогательный и симптоматический характер. Например, для исключения артрита проводится рентгенография, для выявления менингита – пункция спинномозговой жидкости, гнойные очаги в различных органах можно определить с помощью рентгенографии, ультразвукового исследования, магнитно-резонансной томографии.
Но основным методом для постановки диагноза сепсиса должно быть обнаружение патогенных микроорганизмов в крови (проводится бактериологический анализ – посев крови на питательные среды). Как правило, исследование повторяют неоднократно, так как возможно кратковременное нахождение микроорганизмов в крови и при отсутствии сепсиса. Часто встречаются и отрицательные анализы при наличии возбудителя в крови, что бывает на фоне антибактериальной терапии.
Лечение, профилактика и прогноз сепсиса
Терапия всегда проводится в стационаре. Обычно – в отделении реанимации.
- Массивную антибактериальную терапию, направленную на борьбу с инфекцией.
- Симптоматическое лечение: инфузионная терапия, коррекция водно-электролитных нарушений, детоксикация, обезболивающие и гормональные препараты, кислородотерапия, иммуномодуляторы, витаминные препараты и другие методы.
- Хирургическое лечение сопутствующего инфекционного артрита и других его осложнений (флегмон, остеомиелита, затеков), гнойных очагов сепсиса.
- При улучшении состояния постепенно переходят к другим методам лечения: диетическое питание для больных с инфекционными заболеваниями на стадии выздоровления, физиотерапевтические процедуры и лечебная физкультура – в зависимости от характера очагов инфекции и сопутствующей патологии.
Прогноз заболевания часто бывает неутешительным. Фактически, это терминальное состояние. Сепсис отличает тяжелое течение, прогрессирующее ухудшение и развитие шока и полиорганной недостаточности. Большую роль играет фон, на котором возникла данная патология. Особенно тяжело она протекает у ослабленных пациентов с дефектами иммунитета.
Профилактикой является своевременное и полноценное лечение очагов инфекции в организме.
Согласно современным концепциям этиологии инфекционного процесса, при нарушении специфического защитного механизма возникает инфекция, тип которой зависит от природы иммунного дефекта. Если ранее иммунная недостаточность рассматривалась как редкое событие, то сейчас считается, что она встречается довольно часто: в неонатальном периоде, при недостатке белка или витаминов в пище при различного рода интоксикациях, злокачественных опухолях и в процессе их лечения, при различного рода стрессах, нарушениях обмена и др. Существуют и генетические поздно проявляющиеся дефекты.
Реализм сменил эйфорию, продолжавшуюся несколько десятилетий и связанную с успешным применением антибиотиков. Возникли проблемы, связанные с инфекциями микроорганизмами, являющимися частью нормальной микрофлоры, с которыми больной еще несколько дней назад поддерживал мирное сосуществование. При нарушении иммунной защиты происходят быстрый рост и распространение безвредной в норме микрофлоры дыхательных путей, кожи, желудочно-кишечного тракта, мочевыводящих путей.
Сепсис представляет собой тяжелейшую форму генерализованной инфекции, являющуюся следствием несостоятельности защитных реакций. В механизмах его возникновения и патогенезе в определенные периоды на первый план могут выступать различные факторы: снижение фагоцитоза, обусловленное недостаточностью или потреблением антител, появление в крови блокирующих субстанций и вторичный иммунный дефицит, смена или присоединение другого возбудителя, интоксикация и поражение внутренних органов, нарушение в свертывающей системе крови и др.
Нарушение иммунной защиты при сепсисе. В системе противоинфекционной защиты организма существуют три функциональных уровня. Первый — это барьеры на пути инвазии. Они включают кожу, слизистые оболочки, секрет, который нередко оказывает бактерицидное или бактериостатическое действие, механически выводит микроорганизмы или стимулирует рост одних микробов, препятствующих размножению других. В большинстве случаев клиническим проявлениям сепсиса предшествуют механические, физические или трофические нарушения целости кожных покровов или слизистых оболочек. Входными воротами инфекции могут быть локальные очаги воспаления, места инъекций, введения катетера и др. Тщательно собранный анамнез и клиническое обследование в большинстве случаев позволяют выявить места повреждения.
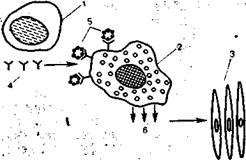
Рис. 9.1.Аллергическая атоническая реакция с участием клеток иммунной системы, гуморальных факторов и клеток-мишеней (схема).
1 — Ig Е — образующая клетка; 2 — лаброцит; 3 — клетки-мишени; 4 — lg Е-антитела; 5 — аллергены; 6 — медиаторы.
Кроме антител, главным опсонином является комплемент, особенно его третий компонент — С3b. Например, антитела к пневмококку типа 7 не инициируют фагоцитоз нейтрофильными гранулоцитами, выделенными из крови человека. Только после того, как С3b фиксируется на стенке бактерий, происходит иммунное прилипание и фагоцитоз становится эффективным. Инкапсулированные стафилококки могут быть опсонизированы как антителами, так и С3b-компонентом комплемента. В ряде случаев опсонизация может быть нарушена и ничто не сдерживает лавинообразного нарастания концентрации патогенного фактора и продуктов его метаболизма. Сказанное можно проиллюстрировать следующими примерами.
1. При изучении плевральной жидкости у больных тяжелым гнойным плевритом определялись продукты расщепления IgG. Протеазы Streptococcus pneumoniae разрушают иммуноглобулины (антитела) у человека. Аналогичным образом могут действовать и протеазы Pseudomonas aeruginosa [Doring G. et al, 1984].
3. Процесс фагоцитоза может быть нарушен в самом начале и привести к непредсказуемым осложнениям. Так, циркулирующие антитела класса IgA, не активирующие систему комплемента и не инициирующие фагоцитоз, могут своим присутствием на бактериальной стенке блокировать начальный период иммунного эффекторного механизма фагоцитоза, что может привести к генерализации инфекции. Такой опосредованный IgA-ингибирующий эффект может представлять большую опасность при менингите. Этим феноменом объясняются слабая опсонизация менингококка и нередкий летальный исход при менингите.
В то же время свободно циркулирующие в крови иммунные комплексы независимо от их природы могут блокировать рецепторы к Fc IgG на поверхности фагоцитов и снижать их бактерицидную активность. Эта ситуация нередко встречается при уже развившейся инфекции. При уточнении анамнеза в таких случаях выясняется, что сепсису предшествовало заболевание, протекавшее с повышением температуры и клиническими проявлениями нарушения функций легких, кишечника или мочеполовых органов.
Диагностика иммунной недостаточности. Современная лаборатория клинической иммунологии имеет довольно широкий набор диагностических тестов. Существуют тесты общего порядка: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови. При необходимости выполняются дополнительные исследования [Зимин Ю. И. и др., 1982].
У детей, родившихся преждевременно (срок беременности: 30—37 нед), обнаруживается выраженная гипогаммаглобулинемия. Она является следствием незрелости плаценты и ее неспособности транспортировать IgG, а также отсутствия синтеза антител у плода. У детей, рожденных в срок, сохраняется довольно высокий уровень IgG в сыворотке. Однако данный белок имеет материнское происхождение и концентрация его понижается в течение первых недель жизни. Частота тяжелых генерализованных инфекций у новорожденных составляет от 0,2 до 1,5%. Следует помнить, что в 35% случаев смерть в течение первого года жизни является следствием сепсиса или септической пневмонии. Иммунологическая незрелость плода является важнейшим фактором возникновения перинатальных инфекций. Даже в настоящее время, несмотря на антибиотики, летальность новорожденных при сепсисе очень высока.
По мере инволюции органов иммунной системы у лиц пожилого или старческого возраста первичный иммунный ответ может существенно не изменяться. Однако снижение разнообразия иммуноглобулинов (антитела) прогрессирует. Их концентрация в сыворотке может оставаться нормальной, а за счет избыточной моноклональной пролиферации даже увеличиваться.
Врожденная недостаточность антител проявляется как аномальная подверженность инфекциям, особенно рецидивирующим инфекциям респираторного или желудочно-кишечного тракта. Нередко начало септицемии связано с локальным воспалительным процессом. Врожденные нарушения проявляются клинически в раннем детском возрасте или позже, особенно в 20—30 лет. Диагностика этой формы недостаточности антител основывается обычно на определении иммуноглобулинов сыворотки крови. Происходит снижение уровня всех иммуноглобулинов или отдельных классов, или субклассов. Селективный врожденный дефект, проявляющийся отсутствием или снижением синтеза одного из субклассов IgG или отсутствием антител определенной специфичности, возможен и при нормальном уровне иммуноглобулинов.
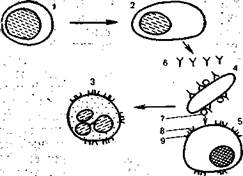
Рис. 9.2. Клеточный и гуморальный иммунные ответы (схема).
1 — В-лимфоцит; 2 — плазматическая клетка: 3— нейтрофильный гранулодит; 4 — бактерия; 5 — звездчатый ретику-лоэндотелиоцит; 6 — иммуноглобулины (антитела); 7 — С3b-компонент комплемента; 8 —рецептор к С3b; 9 —рецептор к Fc иммуноглобулина.
Приобретенный (симптоматический) синдром недостаточности антител встречается довольно часто при многих заболеваниях. Не всегда можно установить, является недостаточность антител вторичной для данного заболевания или она была причиной и вызвала его. Нарушения этого типа наиболее характерны при опухолях лимфоретикулярных тканей, особенно имеющих В-клеточную природу: хроническом лимфолейкозе, лимфомах, доброкачественной и злокачественной парапротеинемии и др. Происходит уменьшение числа или полное исчезновение нормальных поликлональных, секретирующих иммуноглобулины плазматических клеток в костном мозге и лимфоидной ткани. Нормальные клетки замещаются злокачественными, внешне имеющими интактную структуру. В некоторых случаях ткани, участвующие в формировании иммуноглобулинов, могут быть разрушены лимфотропным вирусом (в частности, при инфекционном мононуклеозе).
В большинстве случаев при сепсисе изменяются многие иммунологические показатели. Характеризуя состояние иммунной системы при сепсисе в целом, можно говорить о глубоком иммунном дефиците, который, несомненно, является причинным и осложняющим фактором в течении заболевания. Сепсис, начавшись на фоне иммунной недостаточности, усугубляет ее, нередко до фатального состояния. Этим можно объяснить присоединение другой инфекции, смену возбудителя, появление аллергических процессов, нарушение регенерации.
На рис. 9.3 в виде радиусов в системе полярных координат отложены иммунологические показатели, конкретных людей в процентах к норме (группа из 25 здоровых людей), представленной в виде окружности. Результаты отдельных тестов, характеризующих функционирование иммунной системы, представлены в виде векторов: лимфоциты в 1 мм 3 крови (Лф), Т-лимфоциты в абсолютных значениях на 1 мм 3 крови и в процентах (Т, Т%), вспомогательные клетки (Т4 и Т4%), супрессорные Т-клетки (Т8 и Т8%), реакция бласттрансформации in vitro под влиянием КонА (Is), IgM, IgA, IgG, IgE —иммуноглобулины в сыворотке крови, В-лимфоциты (В), фагоцитоз (Фг), соотношение к- и А,-цепей иммуноглобулинов в сыворотке. Иммунологические показатели интактного донора (см. рис. 9.3) отличаются не более чем на 10% от средних значений нормы. Площадь многоугольника, в определенной степени характеризующая иммунный статус человека, приближается к площади круга (норма).
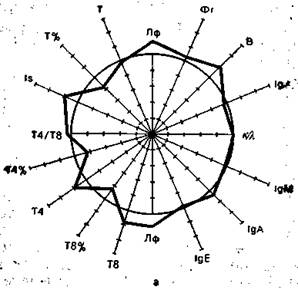
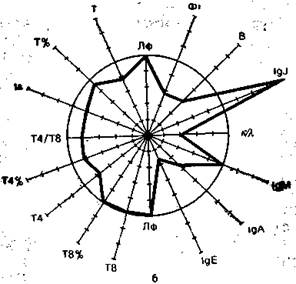
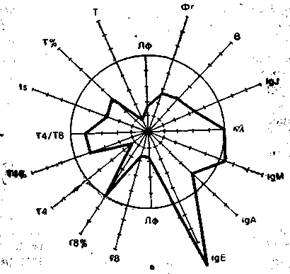
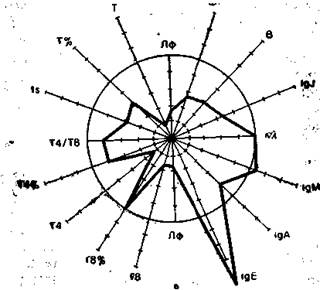
Рис. 9.3. Иммунный статус интактного донора (а), больного в предсептиче-ском состоянии (б) и при сепсисе (в). Объяснение в тексте.
Принципы профилактики и терапии септических состояний. Адекватная терапия заболеваний, вызывающих недостаточность иммунитета, компенсация сопутствующих нарушений микроциркуляции, водно-солевого баланса, потери белка, а также хирургическая санация абсцесса, флегмоны или эмпиемы, детоксицирующая терапия и др. являются важными моментами эффективной профилактики и терапии сепсиса.
К основным принципам терапии и профилактики сепсиса необходимо отнести: уход, применение антибиотиков, выведение ингибирующих факторов (плазмаферез, гемосорбция, гемодиализ, селективная плазмафильтрация), заместительную терапию (препараты иммуноглобулинов для внутривенного введения, тимопептиды, свежезамороженная плазма, гипериммунная сыворотка, лейкоцитная масса), стимуляцию эффекторного звена клеточного иммунитета.
Независимо от природы иммунной недостаточности (гипопротеинемия, облучение, интоксикация, кровопотеря и др.) у больных выявляется повышенная чувствительность к инфекции. В соответствии с этим и строится режим. В особо тяжелых случаях (агаммаглобулинемия, агранулоцитоз) больного помещают в палату, где обеспечивается стерильное содержание.
Антибиотики были и остаются эффективным средством лечения инфекционных осложнений при иммунной недостаточности. Следует указать на два важных аспекта. Во-первых, антибиотики эффективны только при сохранившихся иммунных реакциях. Многолетний опыт лечения больных с врожденным иммунодефицитом свидетельствует, что без иммунного ответа не удается достигнуть положительных результатов. Во-вторых, при нарушении фагоцитоза рекомендуется использовать антибиотики, избирательно накапливающиеся в макрофагах (например, рифампицин). Некоторые микроорганизмы способны выживать в фагоцитах и даже размножаться в них, следствием чего нередко бывает хроническая инфекция. Антибиотики, накапливающиеся в фагоцитах, усиливают функцию инактивирования бактерий.
Успех лечения антибиотиками зависит от ряда факторов: 1) идентификации возбудителя, что является крайне сложной задачей, если лечение сепсиса уже начато; 2) чувствительности микроорганизма к антибиотику; 3) транспорта антибиотика к месту инфекции в достаточной терапевтической концентрации.
Опыт показывает, что необходимы дополнительные знания, касающиеся взаимоотношений между организмом, антибиотиком и микробом. Антибиотики сами по себе недостаточно эффективны при лечении септических состояний. В лучшем случае они помогают выиграть время для проявления защитных реакций и для иммунологической ликвидации инфекции. В тех нередких случаях, когда защитные системы организма не работают, ан-тибиотикотерапия безуспешна.
При многих септических состояниях в сыворотке крови появляются блокирующие факторы макромолекулярной природы, препятствующие нормальному течению иммунных реакций. Это могут быть иммунные комплексы, продукты жизнедеятельности микроорганизмов, эндо- и экзотоксины, разного рода протеазы, продукты распада тканей. Применение плазмафереза, гемосорбции или гемодиализа может способствовать восстановлению иммунного реагирования (рис. 9.3). На фоне детоксикационной терапии, достигаемой экстракорпоральными методами, повышается эффективность всех последующих вмешательств.
Классическим показанием к заместительной терапии препаратами иммуноглобулинов для внутривенного введения является гуморальная иммунная недостаточность. Этот вид лечения рекомендуется при тяжелых бактериальных или вирусных инфекциях у больных со сниженным или нормальным уровнем иммуноглобулинов в сыворотке. При назначении препаратов этой группы исходят из того, что в основе тяжелых инфекций лежит либо первичная, либо вторичная недостаточность (потребление) антител. Поливалентные препараты иммуноглобулинов (иммуноглобулин внутривенный, гипериммунная сыворотка) содержат по крайней мере 10 млн различных типов антител.
Стимуляция эффекторного механизма клеточного иммунитета позволяет усилить, иммунный ответ при профилактике бактериальных и вирусных инфекций. Результат зависит от дозы и времени применения, а также от возраста больного и генетических факторов. Препараты иммуноглобулинов эффективны при хронических рецидивирующих инфекциях и при вспомогательной терапии у больных различными видами опухолей. Их используют с целью компенсации иммунодепрессии, вызванной облучением, химио- или стероидной терапией, а также при различного рода стрессах. К стимуляторам эффекторного механизма иммунных реакций относят левамизол, диуцифон, цимети-дин, интерферон и его индукторы.
Таким образом, достижения клинической иммунологии и иммунофармакологии и накопленный в последние годы опыт коррекции иммунодефицитных состояний позволяют сделать вывод, что современная клиническая медицина располагает средствами диагностики, профилактики и лечения иммунной недостаточности, предшествующей сепсису или усугубляющейся на фоне era течения.
Читайте также:


