Мышиный токсин чумы формула

Попков В. М., Чеснокова Н. П., Ледванов М. Ю.,
Особенности структуры и биологических эффектов токсинов возбудителя чумы
Наличие природных очагов чумы, занимающих значительные территории, в том числе и в России, усиление международной и внутренней миграции населения, военные конфликты, а также возможность использования биотеррористами возбудителя в рецептуре биологических агентов создают неустойчивую эпидемиологическую обстановку и не только потенциальную, но и реальную угрозу возникновения вспышек чумы среди населения [2, 3, 34, 35, 70, 73].
В настоящее время достигнуты большие успехи в разработке профилактических мероприятий с использованием различных методов вакцинации, а также методов этиотропного лечения чумной инфекции, основанных на использовании антибиотиков широкого спектра действия, сульфаниламидных, нитрофурановых препаратов и т.д. [2, 47]. Использование высокоэффективных бактерицидных препаратов освобождает организм от возбудителя, однако сопровождается интенсивным распадом микробных клеток и выделением в системный кровоток разнообразных токсических и ферментных факторов патогенности возбудителя, в том числе эндотоксина. Персистирование токсинов в организме сопровождается сорбцией их структурами различных органов и тканей, развитием сенсибилизации, вторичных иммунопатологических и метаболических нарушений, во многом определяющих тяжесть течения и исход заболевания. Значимость указанных вторичных расстройств, отсутствие высокоэффективных методов их медикаментозной коррекции обусловливают необходимость дальнейшего изучения проблем патогенеза чумы, выявления общих закономерностей и особенностей эффектов токсинов и ферментов возбудителя и совершенствования принципов патогенетической терапии этого грозного заболевания.
Следует отметить, что патогенные эффекты эндотоксина Y. pestis потенцируются и модифицируются за счет экзотоксина, а также ферментов патогенности [48, 49].
Наряду с вышеуказанными общими закономерностями молекулярно-клеточной организации ЛПС многих представителей грамотрицательных бактерий, установлены определенные особенности нативного ЛПС чумного микроба.
В ряде отечественных и зарубежных работ опубликованы результаты всестороннего анализа структуры ЛПС, синтезируемых разными штаммами Y.pestis, отличающимися по географическому происхождению, эпидемической значимости, условиям культивирования: bv.medievalis ssp.pestis, bv.orientalis ssp.pestis, bv.antique ssp.pestis, bv.antique ssp.caucasica, bv.medievalis ssp.altaica и др.
ЛПС Y.pestis относится к R-форме молекул и не содержит полисахаридной цепи. Основными структурными единицами ЛПС чумного микроба являются кор и липид А. Внутренний кор образован 3-дезокси-?-D-манно-октулозовой кислотой, представленной двумя остатками L-глицеро-?-D-манно-гептозного трисахарида [24]. Липофильная часть молекулы ЛПС Y. pestis представлена липидом А, который был впервые описан в качестве нерастворимого в воде осадка, полученного при кислотной деградации молекулы ЛПС. Свободный липид А Y. pestis может быть получен только в результате мягкого кислотного гидролиза ЛПС, поскольку кетозидная связь между коровым олигосахаридом и липидом А является одной из наиболее кислотостабильных связей.
К числу основных биологических свойств ЛПС чумного микроба относится способность вызывать местный и генерализованный феномен Шварцмана, активировать продукцию белков острой фазы воспаления, летальную активность, пирогенность, иммуногенность, митогенность, индуцировать освобождение фагоцитирующими клетками лизосомальных ферментов, цитокинов, токсических радикалов, стимулировать альтернативный путь активации комплемента, влиять на коагуляционный потенциал крови. Широкий спектр биологических эффектов ЛПС Y. pestis обусловлен гетерогенностью структуры рецепторов биологических мембран клеток различной морфофункциональной организации [12, 14, 16, 17].
Эндотоксин, попадая в кровоток, связывается с LBP–белком плазмы крови (lipopolysaccharid binding protein), относящимся к категории острофазовых белков. В комплексе с LBP-белком ЛПС транспортируется от мицеллярных агрегатов к мембранам и взаимодействует с CD14-рецепторами на поверхности клеток, в частности лейкоцитов, что ведет к активации клеточных функций, обеспечивающих фагоцитоз, представление антигенов, продукции NO, активных форм кислорода, низкомолекулярных медиаторов воспаления и группы провоспалительных цитокинов с полимодальными эффектами локального и системного действии, к которым относятся IL-1, IL-2, IL-6, IL-18, TNF, интерфероны I типа, хемокины и другие индукции цитокинобразования.
Однако катионные антимембраннные пептиды (КАМП) – факторы неспецифической защиты клеток различных тканей – имеют более высокое сродство к ЛПС по сравнению с сывороточным LBP–белком и таким образом препятствуют связыванию ЛПС с TLR. Y. рestis обладает способностью противостоять КАМП, причем на уровень устойчивости к ним влияет температура культивирования бактерий.
Методом проточной цитофлоуриметрии установлена способность ЛПС чумного микроба вызывать характерную для апоптоза деградацию ДНК лимфоцитов и перитонеальных макрофагов белых мышей in vitro, с учетом, что макрофаги более чувствительны к ЛПС, чем лимфоциты. Способность ЛПС чумного микроба индуцировать апоптоз макрофагов и лимфоцитов является дозозависимой.
Следует отметить, что эндотоксин чумного микроба оказывает выраженное патогенное действие на систему мононуклеарных фагоцитов, угнетая их поглотительную и секреторную активность. При этом наблюдаются изменения размеров и формы макрофагов, увеличивается объем цитоплазмы, появляются многочисленные вакуоли. Внутри фагоцитов ЛПС способен нейтрализовать действие катионных белков [1].
Сравнительный анализ влияния препаратов ЛПС на первичную культуру перитонеальных макрофагов экспериментальных животных показал, что метод выделения ЛПС и температура выращивания бактерий не оказывают существенного влияния на цитотоксичность препаратов.
Г.И. Васильева и соавт. отмечают более высокий дозозависимый эффект липополисахаридных препаратов в отношении макрофагов мышей, чем морских свинок, который обусловлен, по–видимому, большей чувствительностью макрофагов мышей к цитотоксическому действию ЛПС [24].
В соответствии с данными А.М. Дмитровского и Т.И. Тугамбаева (1986), после внутрибрюшинной инъекции ЛПС чумного микроба мышам выделяются три фазы изменения степени активности кислородзависимых бактерицидных систем фагоцитов: первая фаза – резкого угнетения, вторая – стимуляции и третья – стадия постепенного возврата активности к исходному уровню. При активации эндотоксином нейтрофилов и последующей их дегрануляции выделяется ряд биологически активных веществ, обусловливающих развитие инфекционно–токсического шока [28].
В ряде работ показано, что структура ЛПС определяет чувствительность микробных клеток к бактерицидному действию катионных антимикробных пептидов (КАМП) и других факторов неспецифической резистентности сыворотки крови, участвуя в связывании С3-фракции системы комплемента с поверхностью бактериальной клетки Y. pestis. Несмотря на то, что многие штаммы (за исключением штамма КIMD1, содержащего плазмиду pPst) способны фиксировать этот компонент комплемента, тем не менее, лизис микробных клеток под действием сыворотки возникает только при действии глубокого R– мутанта EV11M (ssp. pestis) и штаммов 1146 и 1680 р (ssp. caucasica). При этом лизис бактерий обеспечивается активацией комплемента по альтернативному пути.
Эндотоксин, взаимодействуя с рецепторами практически всех клеток крови и эндотелия сосудов, обеспечивает нарушение баланса различных биорегуляторных молекул, в частности, простагландинов [58]. Установлено, что ЛПС чумного микроба, как и другие бактериальные ЛПС, активирует циклоксигеназный и липоксигеназный пути метаболизма ненасыщенных жирных кислот. Изменения содержания простагландинов под влиянием ЛПС обусловливают развитие процессов тромбообразования, внутрисосудистой коагуляции, вазо- и бронходилятацию [39, 58].
Прямые и цитокинопосредованные патогенные эффекты эндотоксина Y.pestis на клетки различной морфофункциональной организации сопровождаются выраженными сдвигами интегративной деятельности прокоагулянтной, антикоагулянтной и фибринолитической систем с последующими расстройствами гемостаза, в том числе инициацией ДВС-синдрома и соответствующими нарушениями системной, регионарной гемодинамики и микроциркуляции. Так, гиперкоагуляционные сдвиги, обнаруженные Е.В. Понукалиной (1990) на начальных этапах развития чумной интоксикации, были обусловлены активацией внешнего механизма формирования протромбиназной активности за счет контактной активации XII фактора Хагемана [41].
В работах А.В. Захарова (1991 г.) показано, что введение живой чумной вакцины в дозах, не превышающих 100 млн микробных клеток, вызывает развитие однотипной компенсированной гиперкоагуляции, усиливающейся на пятые и седьмые сутки с нормализацией гемостатического потенциала крови к тридцатому дню после вакцинации.
Как известно, геморрагический синдром является одним из ведущих при чумной инфекции и интоксикации, осложняя течение всех клинических форм чумы, определяя тяжесть указанной патологии, отсутствие эффекта антибактериальной терапии, а зачастую, и развитие летальных исходов.
Характерной особенностью эндотоксемии является активация протеолитических систем, в частности, фибринолитической, которая опосредуется за счет калликреин-кининовой системы, системы комплемента, снижения концентрации ингибиторов и нарастание активности активаторов фибринолиза [41].
В исследованиях Е.В. Понукалиной (1990 г.) выявлены стабильная активация антикоагулянтных механизмов гемостаза и системы фибринолиза, сочетающиеся с развитием выраженного геморрагического синдрома [41].
Так, подкожное введение белым мышам ЛПС Y. pestis, а также гигадоз живой чумной вакцины (до 10 млрд. микробных клеток), ее аутолизата, и антигена, приготовленного по методу Буавена, сопровождаются развитием острого диссеминированного внутрисосудистого свертывания крови и усилением фибринолиза. ЛПС, живая чумная вакцина штамма ЕВ и ее аутолизат вызывают существенное снижение активности фактора XIII – фибриназы.
До настоящего времени остается практически неизученным состояние реологических свойств крови как при чумной инфекции и интоксикации, так и при действии основных токсических и антигенных фракций чумного микроба.
Принимая во внимание приведенные выше данные литературы относительно биологических эффектов ЛПС чумного микроба, проявляющиеся выраженными сдвигами интегративной деятельности прокоагулянтной, антикоагулянтной и фибринолитической систем с последующими расстройствами гемостаза, изменением функций эндотелия, клеток периферической крови, представляется целесообразным дополнить существующие концепции механизмов нарушений реологических свойств крови при чумной интоксикации.
В связи с этим в экспериментах с использованием внутрибрюшинного введения белым крысам ЛПС чумного микроба нами изучены вязкость цельной крови, сыворотки, плазмы при различных скоростях сдвига, а также индексы деформируемости и агрегации эритроцитов, показатели гематокрита. В различных вариантах моделирования чумной интоксикации с использованием ЛПС в возрастающих дозах (от ЛД25 до 2ЛД50), выявлена общая закономерность снижения реологических свойств крови, индексов деформируемости и агрегации эритроцитов при различных скоростях сдвига, коррелирующая с тяжестью течения изучаемой патологии.
Полученные нами результаты позволяют заключить, что к числу ведущих патогенетических факторов расстройств регионарного кровотока и микроциркуляции при чумной интоксикации, индуцируемой ЛПС Y. pestis, относится снижение реологических свойств крови при различных скоростях сдвига, индексов деформируемости и агрегации эритроцитов, коррелирующее с тяжестью клинических проявлений патологии.
На основании этих результатов можно сделать вывод, что уменьшение вязкости цельной крови при малых скоростях сдвига в значительной мере обусловливается развитием системного воспалительного ответа и резким возрастанием в крови уровня острофазных высокомолекулярных белковых и липопротеидных фракций, опосредующих межклеточные взаимодействия. Возрастание вязкости крови при малых скоростях сдвига вызвано резким увеличением гематокритного показателя. Возрастание индексов деформируемости и агрегации эритроцитов, а также вязкости крови при высоких скоростях сдвига связаны, возможно, с изменением структуры мембраны эритроцитов под влиянием ЛПС чумного микроба [7–12, 14–16].
В последние годы в качестве одного из интегративных показателей тяжести аутоинтоксикации при патологии инфекционной и неинфекционной природы используют определение в крови так называемых средних молекул – веществ молекулярной массой от 500 до 5000, накапливающихся в крови при интоксикациях. Как известно, из пула молекул средней массы выделены олигопептиды с высоким содержанием дикарбоновых аминокислот, цистеина, лизина, глицина и низким содержанием ароматических аминокислот, а также углеводные компоненты, соединения глюкуроновой кислоты и олигосахара. Некоторые из этих веществ являются продуктами деградации сывороточных белков, в частности ?-цепи фибриногена и ?2-цепи-микроглобулина. Установлено, что группа веществ средней молекулярной массы включает в себя и продукты липопероксидации. В последующем нами проведены сравнительные серии экспериментов на белых крысах по изучению эффектов ЛПС чумного микроба на интенсивность процессов ПОЛ и уровень молекул средней массы. Как оказалось, воздействие ЛПС сопровождалось прогрессирующим накоплением продуктов липопероксидации в плазме крови и эритроцитах экспериментальных животных, что закономерно сочеталось с накоплением средних молекул в крови. Интенсификация процессов ПОЛ и повышение уровня средних молекул коррелировали с нарастанием тяжести симптомов интоксикации [4, 5, 6].
Очищенный токсин не вступает в реакцию с антикапсульными сыворотками, а антитоксин не реагирует с капсульным антигеном. Однако антитоксические сыворотки не предохраняют против чумы, а токсин нельзя превратить в настоящий анатоксин, хотя при соответствующей обработке он теряет токсичность и продолжает связываться со специфическими антителами.
В изменении функции тромбоцитов и содержания в них циклических нуклеотидов выявляется определенная стадийность. Гиперагрегация, возникающая на ранних этапах интоксикации, сменяется гипоагрегацией на поздних, необратимых стадиях. Последнее обусловлено резким повышением уровня цГМФ в кровяных пластинках [56].
Полученные данные свидетельствуют о важной роли активации перекисного окисления липидов в дестабилизации эритроцитарных мембран, снижении их перекисной устойчивости, деформируемости и вязкостных свойств крови, обусловливающих нарушение процессов микроциркуляции, оксигенации и трофики тканей при чумной интоксикации.
Обращает на себя внимание тот факт, что чумная инфекция и интоксикация сопровождаются развитием выраженной гипоксии сложного генеза, включающего в себя циркуляторные, гемические, дыхательные, тканевые расстройства.
Следует отметить, что в основе развития циркуляторных расстройств при чумной инфекции и интоксикации лежит, по-видимому, сложный комплекс патогенетических механизмов. Так, очевиден прямой миокардиотоксический эффект факторов патогенности чумного микроба, клиническими признаками которого являются расширение границ сердца, глухость сердечных тонов, аритмия, прогрессирующая тахикардия, резкое падение артериального давления и т.д.
С другой стороны, не исключена возможность прямого цитопатогенного воздействия токсических и ферментных факторов патогенности возбудителя на сосуды. Известно, что нейраминидаза, гиалуронидаза, фосфолипаза, протеазы чумного микроба воздействуют на компоненты межклеточного вещества, биологических мембран, такие как гиалуроновая кислота и продукты ее деградации, гликопротеиды, гликолипиды, олигосахариды, аминокислоты и пептиды, фосфолипиды и др. [29, 48].
Как известно, в динамике чумной инфекции и интоксикации возникает не только циркуляторная, но и гемическая гипоксия, обусловленная способностью различных фракций гемолизина, аденилатциклазы и цАМФ-связывающего белка чумного микроба вызывать дезорганизацию мембран эритроцитов [22]. Известны также неспецифические гемолизины – аммиак и другие летучие амины, обеспечивающие интенсивный распад эритроцитов. Таким образом, продукция гемолизинов и других факторов патогенности чумного микроба является одной из важных причин развития гемической гипоксии при чумной инфекции и интоксикации.
В основе развития тяжелой гипоксии, свойственной различным клиническим формам чумной инфекции, может быть и дыхательная недостаточность, обусловленная развитием первичной и вторичной пневмонии, нарушением кровообращения в легочной ткани, отеком легких, а также возникновением периодического дыхания [46, 47].
Расстройства микрогемодинамики, регионарного и системного кровотоков могут быть обусловлены также нарушениями коагуляционного потенциала крови, ее реологических свойств.
Общей закономерностью гипоксических состояний различного происхождения, в том числе возникающих в динамике чумной инфекции и интоксикации, являются формирование метаболического ацидоза за счет избыточного накопления в крови и тканях продуктов гликолиза, протеолиза, липолиза, нарушение электролитного баланса клеток, а также активация процессов свободнорадикального окисления липидов, вызывающих дестабилизацию биологических мембран клеток различных органов и тканей, нарушение их возбудимости и функциональной активности [23, 31, 62].
Данные многочисленных экспериментальных и клинических исследований, направленных на выяснение роли свободнорадикального окисления липидов в патогенезе разнообразных патологических процессов и заболеваний, позволяют рассматривать процессы перекисного окисления липидов (ПОЛ) как универсальный механизм повреждения мембранных структур клеток различных органов и тканей при воздействии патогенных факторов инфекционной и неинфекционной природы [18, 26, 33, 42, 53].
Таким образом, в условиях бактериально–токсического шока при чумной инфекции и интоксикации возникает сложный комплекс вторичных неспецифических метаболических и функциональных расстройств, заметно усугубляющих тяжесть течения заболевания и нередко являющихся причиной отсутствия должного эффекта терапевтических мероприятий.
В связи с этим не подлежит сомнению актуальность дальнейших исследований взаимосвязи и значимости специфических эффектов токсических и ферментных факторов патогенности чумного микроба и вторичных неспецифических нарушений метаболических процессов и функций различных органов и систем в патогенезе чумной инфекции и интоксикации. Использование в целях депотенцирования цитопатогенного и летального действий токсических компонентов возбудителя чумы антиоксидантов, антигипоксантов, мембранопротекторов, донаторов сульфгидрильных групп может в значительной мере повысить эффективность комплексного лечения указанной патологии, расширить возможности объективной оценки тяжести заболевания, прогнозирования его развития.

Чума – острое антропозоонозное инфекционное заболевание, характеризующееся тяжелой интоксикацией, поражением лимфоузлов с развитием септицемии и тенденцией к эпидемическому и пандемическому распространению.
В самом начале третьей пандемии были сделаны важнейшие открытия: выделен возбудитель и доказана роль крыс в распространении чумы. Заболевание изучил Г.Н. Минх (1878 г.). Возбудителя чумы обнаружили во время эпидемии в Гонконге одновременно и независимо друг от друга французские ученые А. Иерсен и Ш. Китазато в 1894 году.
Возбудитель расщепляет многие сахара (глюкозу, галактозу, мальтозу, маннит и многие другие) до кислоты без газа. По отношению к глицерину различают 2 варианта возбудителей: глицерин-позитивный (континентальный – с суши) и глицерин-негативный (океанический – с моря). Не ферментирует лактозу, сахарозу и рамнозу. Реакция Фогес-Поскауэра – отрицательная. Протеолитическая активность отсутствует (желатин не разжижает, не восстанавливает нитраты, индол, сероводород и аммиак не образует, молоко не свертывает).
Yersinia pestis содержит до 18 антигенов, но не все они хорошо изучены. Выделяют антигены клеточной стенки:
1. О-антиген – соматический антиген, термостабильный липополисахарид, является эндотоксином.
2. ОСА – основной соматический антиген, белковой природы, является экзотоксином, обладающим гемолитическими свойствами, токсичен для человека и животных (белых крыс и мышей).
1. F1-антиген (фракция-1) – термолабильный гликопептид, не обладает токсическими свойствами, но защищает возбудителей чумы от фагоцитоза и обуславливает иммуногенные свойства.
2. VW – антиген вирулентности, это фактически два антигена, но они всегда встречаются вместе: V-антиген – белок, а W-фракция – липопротеин. VW обладает антифагоцитарным действием и способствует внутриклеточному размножению возбудителя чумы.
Ферменты – гиалуронидаза, нейроминидаза, лецитиназа, фибринолизин, плазмокоагулаза.
Структурные и химические компоненты клетки: пили I порядка, капсула, плазмиды (в них локализованы гены, детерминирующие синтез большинства факторов патогенности), бактериоцины (пестицины).
Из-за наличия большого набора агрессивных факторов возбудитель чумы относится к I группе микроорганизмов по степени опасности для человека.
Возбудитель чумы обладает значительной устойчивостью во внешней среде:
- В воде, почве, на одежде – от 1 до 5 месяцев;
- В трупах погибших больных, особенно при низких температурах – неопределенно длительное время (психрофилы);
- В организме блох – живут до 1 года;
- В гнойном содержимом бубонов – 20-30 дней;
- В мокроте больных – до 10 суток;
- На овощах, фруктах – 6-11 суток.
Но высоко чувствительны к УФЛ, высушиванию, повышенной температуре (до 60 0 С – погибают за 1 час, кипячение – 1 минута), действию дезинфиктантов (5% раствор карболовой кислоты убивает за 5-10 минут), антибиотикам (стрептомицину, тетрациклину, левомицитину, хлоранфениколу).
Зооантропоноз (больные легочной формой могут выделять возбудителя). Основной резервуар и источник инфекции – грызуны (около 300 видов):
- в природе – сурки, суслики, песчанки, полевки;
- в синантропных очагах (городах) – серые крысы, домашняя мышь.
- Чаще всего трансмиссивный (путь – контаминационный, т.е. при втирании в ранку от укуса блохи ее фекалий и рвотных масс, содержащих возбудителя, переносчики – блохи);
- Фекально-оральный (путь – алиментарный – при приеме пищи, инфицированной возбудителем, например, мяса больных животных, не подвергавшегося достаточной термической обработке);
- Контактный (путь – прямой контактный, когда возбудитель проникает через поврежденную кожу или слизистые при разделке туш зараженных животных);
- Аэрогенный (путь – воздушно-капельный, реализуется при легочной форме чумы, когда возбудитель в больших количествах попадает в воздух с мокротой больного, выделяемой при кашле).
Инкубационный период – 3-6 суток.
Патогенез и клинические особенности.
Патогенез чумы включает три стадии:
1. Внедрение возбудителя в организм в месте укуса блохи (на месте проникновения образуется карбункул), от куда он быстро попадает в лимфоузлы (чаще подмышечные и паховые), где развивается некрозно-геморрагическое воспаление (образуются чумные бубоны, размером могут достигать куриного яйца).
2. Распространение возбудителя в кровоток (бактериемия).
3. Диссеминация возбудителя по различным органам и системам.
Клинически различают следующие формы чумы:
Постинфекционный иммунитет – в основном, клеточный, напряженный, пожизненный.
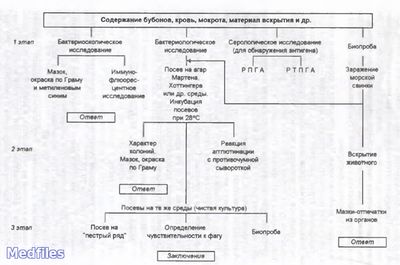
Основным методом является бактериологическое исследование. Выделенную культуру дифференцируют от других иерсиний по биохимическим и серологическим признакам. Для серодиагностики используют РНГА и другие реакции.
Проводится вакцинация по эпидпоказаниям, а также планово – группам риска (в основном, военнослужащим) живой аттенуированной вакциной из штамма EV или химической вакциной.
Специфическое лечение – противочумной иммуноглобулин.
05 октября 2017
- 1109
- 0,9
- 0
- 0




Один монах, странствуя по белому свету, встретил Чуму, которая направлялась в его город.
— Ты куда это направляешься, Чума? — спросил он ее.
— Иду в твой родной город, — ответила она. — Мне нужно забрать там тысячу жизней.
Через некоторое время монах снова встретил Чуму на своем пути.
— Почему ты меня обманула тогда? — спросил он ее с укором. — Ты говорила, что должна забрать тысячу жизней, а забрала пять тысяч.
— Я тогда сказала тебе правду, — ответила Чума. — Я действительно забрала тысячу жизней. Остальные умерли от страха.
Жертвы чумы исчислялись сотнями тысяч и даже миллионами человек, вымирали города, становились безлюдными целые области, и ужас пандемий чумы затмевал ужасы всех войн, какие знала история человечества. Целые тысячелетия люди не понимали, что является источником заболевания [2].
Библия — одно из древнейших дошедших до нас свидетельств эпидемий чумы (1 книга Царств, глава 5; 4 книга Царств, глава 19, стихи 35–36). В мировой истории отмечают три пандемии этой болезни:
Крупные вспышки чумы регистрируют с определенной периодичностью (Индия — 1994 г.; Мадагаскар — 2011 и 2013 гг.). В США с 1965 по настоящее время ежегодно регистрируют до 40 случаев заражения людей чумой (в среднем 10 больных в год) [5]. В России в сентябре 2014 г. и в августе 2015 г. впервые за последние 35 лет были зарегистрированы два случая заражения человека чумой [6], [7].
Бубонная форма чумы является наиболее распространенной формой заболевания и при отсутствии лечения приводит к гибели 40–60% заболевших. Легочная форма возникает либо как осложнение бубонной или септической форм, либо при вдыхании воздуха, зараженного возбудителем чумы. Если лечение не начинают в первые 24 часа после появления симптомов, смерть наступает через 48 часов [8].
В природе чумной микроб встречается практически на всех континентах, исключая Австралию, Антарктиду, а также Арктику, что обусловливает ежегодно регистрируемые случаи этой болезни. Стремительная эволюция микроорганизмов приводит к появлению популяций бактерий (штаммов), устойчивых к антибиотикам [9], что в случае с возбудителем чумы особенно опасно. Кроме того, этих бактерий могут использовать в качестве агента биотерроризма. Все вышесказанное объясняет необходимость изучения чумного микроба.
Возбудитель чумы Yersinia pestis — самая опасная бактерия в мире [10]. Что делает ее столь смертоносной?
Факторы вирулентности, или вооружен и очень опасен
Со времен открытия возбудителя чумы в 1894 году французом Александром Йерсеном и японцем Китасато Сибасабуро ученые пытались выяснить, что определяет патогенность Y. рestis. В результате многолетней тяжелой и рискованной работы, которая продолжается и по сей день, выделили следующие факторы патогенности возбудителя:
- белки внешней мембраны (Yersinia outer proteins — называемые Yop-белками, эффекторными белками, или комплексом Yop-вирулона) [11];
- комплекс области пигментации [12];
- активатор плазминогена [13];
- капсульный антиген [14];
- пили адгезии или pH6-антиген [15].
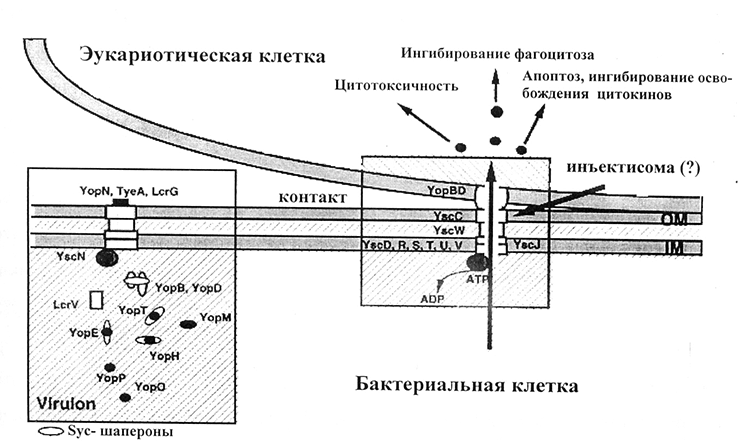
Рисунок 1. Схема действия системы секреции III типа.
При вдыхании чумных микробов (и развитии легочной чумы) этот белок обеспечивает быстрое размножение бактерий в тканях легких и приводит к развитию молниеносной пневмонии и отеку легких, тогда как в отсутствии Pla инфекция не развивается в смертельную пневмонию. Установлено, что активатор плазминогена нарушает постоянство внутренней среды организма хозяина и блокирует иммунные реакции, направленные на уничтожение патогена [27].
Бактерии окружены капсулой из слизистого вещества (фракция I, Fra1), которая препятствует поглощению и обезвреживанию Y. pestis иммунными клетками организма-хозяина в процессе фагоцитоза. На выявлении этого вещества-антигена основаны многие современные методы лабораторной диагностики чумы, оно входит в состав многих экспериментальных химических вакцин против чумы. Однако позднее обнаружили популяции бактерий, лишенные капсулы [28]. Кроме того, слизистая капсула есть у многих других микроорганизмов, например, возбудителя сибирской язвы, туляремии. Капсульное вещество иерсинии образуют при температуре 37 °С.
Антигены, схожие с рН6, были обнаружены у ряда возбудителей, вызывающих менее опасные болезни — кишечные инфекции (Y. pseudotuberculosis [31], Y. enterocolitica [32], Escherichia coli [8]).
Температурный фактор, или то, что действительно имеет значение
Необходимо заострить внимание на особой роли температуры в физиологии чумного микроба. Именно при температуре 37 °С у него повышаются питательные потребности [33] и синтезируются практически все известные детерминанты вирулентности (рис. 2) [34]. У других бактерий подобная зависимость выражена в меньшей степени, что позволяет говорить о ведущей роли температурного фактора в вирулентности возбудителя чумы [8].
Геном или все важное внутри
Помимо хромосомы у чумного микроба есть плазмиды — внехромосомные участки ДНК [38]. Большинство белковых факторов вирулентности закодированы на плазмидах: эффекторные белки на плазмиде pCad; капсула — pFra; активатор плазминогена — рPla (pPst, pPCP). Плазмиды pFra и рPla обнаружены только у Y. pestis (видоспецифические), pCad является общей с возбудителем псевдотуберкулеза (родоспецифическая) [20].
Заключение
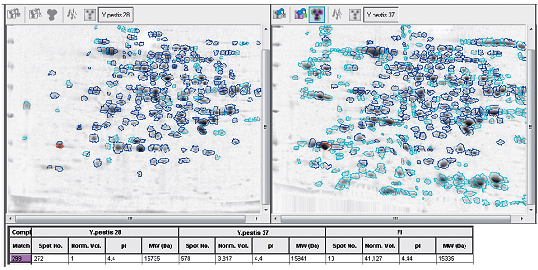
В настоящее время продолжается работа по выявлению новых, еще не изученных маркеров вирулентности [39]. С использованием 2D-электрофореза, масс-спектрометрии, полногеномного секвенирования проводят сравнительный анализ отличающихся по вирулентности популяций чумного микроба для выявления различий в их белковых спектрах и геномных последовательностях. Ранее не известные белки и участки генома становятся объектом пристального внимания и изучения как потенциальные детерминанты вирулентности.
Таким образом, патогенность возбудителя чумы — это множественный (полидетерминантный) признак. Соединение многих факторов в единое целое создает страшную угрозу чумных эпидемий, с противостоянием которым, однако, прогрессивное человечество успешно справляется.
Читайте также:


