Проказа лепра микробиология характеристика biologylib
Микобактерии лепры — Mycobacterium leprae (син.: микобактерия Хансена) впервые были обнаружены в 1873 г. норвежским ученым Армауэром Хансеном в препаратах тканей, взятых из очагов поражения у больных лепрой.
Несмотря на многочисленные попытки вырастить М. leprae in vitro, никому до сих пор этого сделать не удалось. Отсутствие методов культивирования М. leprae чрезвычайно затрудняет изучение биологических свойств этих бактерий, а также решение многих важнейших проблем практической лепрологии, например, разработку диагностикумов, получение профилактической вакцины, скрининг новых лекарственных средств, испытание М. leprae на лекарственную чувствительность и т.д.
При попытках изучения традиционными методами биохимических свойств М. leprae, выделенных из инфицированных тканей человека, исследователи сталкивались с проблемой недостаточного количества изучаемого материала. Поэтому всегда оставалось сомнение, не обусловлены ли получаемые результаты фрагментами клетки-хозяина, адсорбированными на поверхности бактерий. Hanks (1954) пришел к выводу, что М. leprae не способны самостоятельно использовать окружающие их субстраты для роста и размножения, чем и объясняется их внутриклеточный паразитизм и неспособность расти на микробиологических питательных средах in vitro. Однако позже Camargo et.al. (1974) показали, что М. leprae в буфере или специальной жидкой питательной среде, в которые добавляли ацетат или глицерин, меченные 14 С, выделяли меченый углекислый газ ( 14 CO2), что указывало на их способность усваивать питательные вещества вне организма хозяина. При помощи радиоизотопного метода установлено, что М. leprae также инкорпорируют гликоген, аминокислоты, тимидин, пурины и неорганический фосфор, т.е. вещества, необходимые для активного синтеза нуклеиновых кислот и белков самой бактерии.
Знания о биологии возбудителя лепры значительно пополнились только с развитием электронной цитохимии, появлением высокоразрешающих электронных микроскопов и высокочувствительных радиоизотопных методов исследования.

Г.А. Хансен (1841-1912) 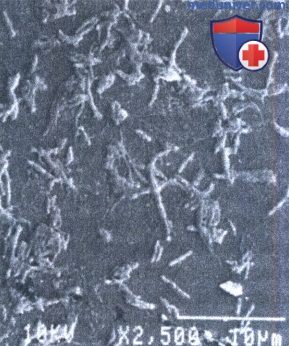
Микобактерии лепры под сканирующим микроскопом. 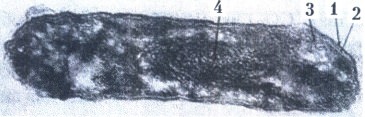
Микобактерия лепры (продольный срез):
1 - клеточная стенка;
2 - цитоплазматическая мембрана;
3 - мезосома;
4 - нуклеоид.
Электронограмма. х 100 000.
М. leprae, по классификации Runyon et. al., 1974 (Определитель бактерий Bergey, 8th Ed.), относятся к роду Mycobacterium, порядку Actinomycetalis, семейству Mvcobacteriacae.
Микобактерии лепры обычно имеют вид прямой или изогнутой палочки с закругленными концами, неподвижны, типичных спор не образуют; длина микобактерий — 1-7 мкм, диаметр — 0,2-0,5 мкм.
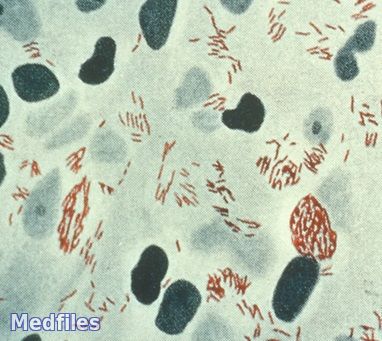
М. leprae, подобно возбудителю туберкулеза, относится к группе кислотои спиртоустойчивых грамположительных микобактерий. По Цилю-Нельсену окрашиваются в ярко-красный цвет. Являются внутриклеточными паразитами системы мононуклеарных фагоцитов. В лепрозных поражениях, наряду с палочковидными гомогенно окрашенными микобактериями, встречаются также фрагментированные и зернистые формы. В теле фрагментированных палочек содержится 2-5 более плотных зернышек, разделенных слабоокрашенными или неокрашенными промежутками. Нередко палочки М. leprae раздуты, напоминают колбы, запятые, восклицательные знаки, имеют гантелевидную форму, что некоторыми исследователями рассматривается как инволютивная форма.
В определенных условиях микобактерии лепры могут утрачивать кислотоустойчивость, оставаясь грамположительными. Длительное пребывание мазков на солнце или в растворе формалина, воздействие антилепрозными препаратами приводят к снижению или исчезновению кислото- и спиртоустойчивости М. leprae. В 1971 г. было показано, что обработка пиридином приводит к потере способности М. leprae к окрашиванию карболовым фуксином. Этот феномен стал одним из способов идентификации возбудителя лепры.
К внутренней поверхности клеточной стенки примыкает трехслойная плазматическая мембрана (элементарная мембрана Робертсона), внутренний слой которой плотно связан с цитоплазмой бактериальной клетки. В цитоплазме выявляется небольшое число (1-2) мезосом, представляющих собой инвагинаты в цитоплазму плазматической мембраны и характеризующихся выраженным полиморфизмом (петлевидные, гроздевидные, трубчатые). Собственно цитоплазма представлена мелкогранулярным умеренно электронно-плотным веществом, в котором находятся рибосомы, небольшие электронно-плотные включения волютина, включения типа вакуолей (предположительно, липидные), крупные гомогенные включения невыясненной природы, а иногда так называемые спороподобные тельца.
Недавно (1996) возможность формирования спороподобных структур была подтверждена J. Gomez, J. De Maio, С. Ко и W. Bishai, которые сообщили об обнаружении ими в геноме М. tuberculosis и М. leprae генов sigF и whiB, являющихся регуляторными генами спорообразования у Bacillus subtilis и Streptomyces coelicolor.
М. leprae отличаются необычно длинным для бактерий циклом размножения; время их генерации (скорость одного деления) — около 12 сут. Микобактерии лепры в наибольшем количестве обнаруживаются в поверхностно расположенных участках организма (кожа, слизистая носа, периферические нервы, особенно поверхностные), что предполагает предпочтение возбудителем лепры температуры ниже 37°. Позднее это было подтверждено экспериментами на мышах, а также получением генерализованной инфекции при заражении девятипоясных броненосцев, отличающихся естественной нивкой температурой тела.
Методами электронной микроскопии установлено, что М. leprae так же, как и растущие на средах микобактерии, обладают достаточно выраженной активностью ферментов окислительного фосфорилирования, т. е. имеют автономные системы дыхания, что свидетельствует о перспективности дальнейшего поиска методов их культивирования in vitro.
М. leprae имеют определенные отличия от других микобактерий, заключающиеся в размере генома, характерных составах генома (56% гуанин+цитозин, тогда как у других видов — 64-70%) и пепгидогликана клеточной стенки (преобладание L-формы глицина над D- и L-формами аланина), а также в присутствии специфического фенольного гликопида-1.
На основании данных о генах рибосомальной РНК было подтверждено, что микобактерия лепры принадлежит к группе медленно растущих микобактерий, видоспецифическими признаками которой принято считать наличие диоксифенилаланиноксидазы (ДОФА-оксидазы) и своеобразный набор миколовых кислот. В то время как для других микобактерий характерно присутствие трех типов микозидов, ковалентно связанных с клеточной стенкой, у М. leprae имеются лишь 2-альфа-миколаты и кетомиколаты, отсутствует дикарбоксимиколаты.
Второй липид из М. leprae, представляющий особый интерес, — это фтиоцерол-демикоцерозат, который структурно весьма схож с гликолипидом, но не содержит углевода.
Хотя из М. tuberculosis и других видов микобактерий был также выделен фтиоцерол-демикоцерозат, он химически значительно отличается от полученного из М. leprae.
В 1967 г. впервые описана ДОФА-оксидаза М. leprae — фермент, идентифицированный впоследствии как О-дифенолоксидаза. Получено достаточно много данных, свидетельствующих о важной роли О-дифенолоксидазы в сохранении жизнеспособности и процессах размножения М. leprae. Высказывалось предположение, что в клетках возбудителя лепры, которые характеризуются низким уровнем активности их цитохромной и флавопрогеидной систем, ДОФА-хинон, образующийся при участии О-дифенолоксидазы из ДОФА, выступает в качестве переносчика электронов в альтернативном дыхательном пути. Установлено также, что, окисляя ДОФА, синтезируемый в меланоцитах кожи, ДОФА-оксидаза М. leprae участвует в формировании таких клинических проявлений лепры, как гипопигментация кожи. Радиоизотопными методами показана прочная связь ДОФА-оксидазы с поверхностными органоидами М. leprae, однако, в каких именно морфофункциональных структурах бактериальной клетки локализуется этот фермент, остается невыясненным.
М. leprae обладают более низким уровнем супероксиддисмутазы и пероксидазы по сравнению с другими микобактериями, при этом у них отсутствует каталаза. М. leprae утилизируют глюкозу и глицерин в качестве источников энергии, у них так же, как и у других микроорганизмов, обнаружены все ключевые ферменты, участвующие в процессе гликолиза. Были выделены также специфические ферменты для окисления глицерина.
Устойчивость к факторам внешней среды. В 40%-ном растворе глицерина при комнатной температуре М. leprae сохраняют жизнеспособность не менее 10 лет. Температурные условия хранения тканей лепром не имеют существенного значения. На протяжении первых месяцев и даже лет эксперимента характеристики размножения М. leprae в тканях мякоти лап мышей не изменялись. То есть продемонстрировано, что М. leprae, находясь во внешней среде, могут в течение многих лет оставаться жизнеспособными.
М. leprae для исследовательских целей успешно сохраняют при температуре от -15° до —60°С, используя в качестве протективного агента диметил сульфоксид. При транспортировке в лаборатории для исследования сосуд с суспензией М. leprae или тканями от больных помещают в мокрый лед. Потери жизнеспособности не отмечается в течение 7 дней.
Жизнеспособность микобактерий лепры, замороженных при -80°С и затем подвергнутых оттаиванию, значительно снижалась, если судить по результатам роста в подушечке лапки мыши, при этом резко сокращалась их метаболическая активность.
В выделениях из носа М. leprae вне организма при средней температуре 20,6°С и влажности 43,7% сохраняют жизнеспособность до 7 дней, при средней температуре 36,7° и влажности 77,6% — до 9 дней.
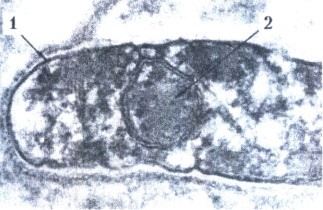
Микобактерия лепры, начало лизиса цитоплазмы:
1 - клеточная стенка; 2 - спороподобное тельце.
Электронограмма. х 120 000. 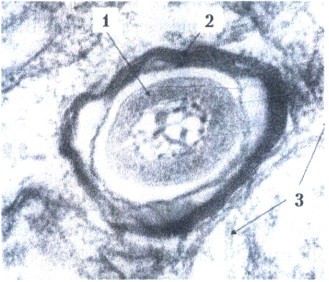
Поперечный срез микобактерии лепры:
1 - М.leprae;
2 - полимембранная фагосома;
3 - цитоплазма клетки-хозяина. Электронограмма. х 100 000. 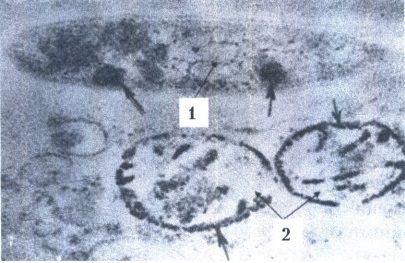
Микобактерия лепры (электроноцитохимическое выявление пероксидазы -стрелки):
1 - М. leprae; 2 - митохондрии клетки-хозяина.
Электронограмма. х 70 000.
Редактор: Искандер Милевски. Дата публикации: 6.12.2019
Лепра (проказа , от греч. lepros – чешуйчатый, шероховатый, шелушащийся) – это хроническое генерализованное заболевание, характеризующееся специфическим гранулематозным поражением производных эктодермы (кожи, слизистых оболочек, периферической нервной системы) и патологическими изменениями во внутренний органах.
Проказа – одна из древнейших болезней, известная человечеству задолго до нашей эры, подробные описания встречаются в египетских папирусах, индийских писаниях, относящихся к периоду 1500 лет до нашей эры. Известно, что она была распространена в Китае, Японии, Персии. Распространению заболевания способствовали развитие мореплавания и торговли, а так же завоевательнве походы – в античном море это были финикияне (morbus phoenicicus) и греки (elephantiasis graecorum), в Европу проказу принесли легионы Рима. В Европе максимальное распространение лепры относится к 11-13 столетиям (войны, крестовые походы, стихийные бедствия, эпидемии других заболеваний), откуда заболевание проникло в Новый Свет (15-16 вв.), Австралию и Океанию (начало 19 в.). В большинстве стран заболевание приравнивалось к гражданской смерти с исключением из общества и лишением наследства; больных либо убивали, либо изгоняли в пустынные места.

Изгнание больного проказой (лепрой).
Само библейское zaraath (проказа) было собирательным термином, обозначающим моральную и физическую нечистоту. Для изоляции больных еще в Византии были организованы ксенодохии, в средневековье их заменили лепрозории (созданы священником Лазарем – человека клали в гроб и в храме отпевали заупокойную, заболевание проказой приравнивалось к смерти), порядки которых напоминали тюрьмы, а побег всегда карался смертью. Однако драконовские методы дали свои плоды. Начиная с 14 в. заболеваемость в Европе резко снизилась, и сейчас проказа встречается в виде отдельных очагов. В настоящее время в мире насчитывается от 2 до 13 млн. больных, преимущественно в странах Третьего мира. Наибольшее количество больных находится в Азии (Индия – 64%, Китай, Бирма), Африке, Южной и Центральной Америке. На территории бывшего СССР районами эпидемии по лепре были Прибалтика, устья Волги, Дуная, Кавказ и Закавказье, Средняя Азия. На этих территориях располагаются лепрозории (сейчас крупнейший лепрозорий в СНГ располагается на территории Астраханской области).
Возбудитель – M. leprae был открыт норвежским врачом Г.А. Хансеном в 1873 г. в соскобе с поверхности лепромы.
Морфология и тинкториальные свойства.
Строгие аэробы, оптимальная температура – 30-35 0 С (поражает, в основном, охлажденные участки организма – кожу). M. leprae – облигатный внутриклеточный паразит тканевых макрофагов, поэтому на питательных средах не растет, культивируется на животных (заболевание воспроизводится на девятипоясных броненосцах, а также используется экспериментальная модель –заражение белых тимусэктомированных мышей в подушечки лап (метод Шепарда) с последующим развитием гранулем). К настоящему времени установлена возможность естественного инфицирования броненосцев и обезьян мангобеев. Однако по некоторым литературным данным, M. leprae выращивают на глицериново-картофельном и кровяном агарах, яичных средах, среде Вассермана – рост наблюдается через 6-8 недель (период генерации – от 12 до 20-30 дней) в виде сухого морщинистого налета.
Утилизируют глицерин и глюкозу. Выделяют ферменты – пероксидазу, цитохромоксидазу, щелочную фосфатазу и специфический – О-дифенолоксидазу (ДОФА-оксидаза), отсутствующий у других микобактерий.
- Полисахаридные АГ – термостабильные, групповые для микобактерий;
- Белковые АГ – термолабильные, видоспецифические;
- Имеют перекрестнореагирующие антигены с антигенами людей 0 (I) группы крови Rh-.
- Высокое содержание липидов;
- Облигатное внутриклеточное паразитирование.
Вне организма человека возбудитель быстро утрачивает жизнеспособность, но в трупах людей может сохраняться долгое время. Также остаются жизнеспособными после 10-12 лет хранения при комнатной температуре в 40% формалине.
Заболевание мало контагиозно.
Источник инфекции – больной человек. От больного бактерии выделяются через кожу, при кашле, чихании, даже при разговоре. Есть сообщения о выделении возбудителя с семенной жидкостью, фекалиями, мочой, слезами.
Для лепры характерен длительный инкубационный период – 3-5 и даже до 20-30 лет, поэтому из памяти больного исчезают события, с которыми они могли бы связать заражение.
Механизм и пути передачи инфекции до конца не выяснены из-за трудности их изучения. Считается, что заражение происходит при непосредственных длительных и тесных бытовых контактах (прямых и непрямых), а также воздушно-капельным путем. Старые авторы называют проказу болезнью домашнего сожительства. Доказана возможность внутриутробного заражения, но дети, отделенные от больных родителей после рождения, не заболевают. Существует предположение, что в распространении лепры могут играть роль кровососущие насекомые (блохи, вши, клопы, комары).
Входные ворота: полагают, что возбудитель попадает в организм человека через нарушенные кожные и слизистые покровы.
Ведущая роль в распространении принадлежит социально-экономическим факторам – неблагоприятным бытовым и жилищным условиям: скученность, низкая санитарная культура, низкий жизненный уровень.
Лица, контактирующие с больными, не опасны для окружающих.
Патогенез и клинические проявления.
Особенности болезни определяются следующими свойствами возбудителя:
- Медленное размножение (инкубационный период до 20 лет) и хроническое течение;
- Поражение нервной системы ведет к инвалидности;
- Оптимальная температура ниже 37 0 С, следовательно, поражаются охлаждаемые ткани;
- Вызывает иммунологическую толерантность у людей с лепроматозной формой, и такие пациенты становятся главным источником заражения.
M. leprae проникает в нервные окончания, а оттуда в лимфатические и кровеносные капилляры, не вызывая видимых поражений в месте внедрения. В большинстве случаев возбудитель погибает и элиминируется, или болезнь протекает латентно, не проявляясь в течение всей жизни. Проявление заболевания прямо зависит от состояния факторов резистентности. При небольших отклонениях развивается абортивная инфекция в виде ограниченных гранулематозных высыпаний (иногда могут самопроизвольно исчезать).
Классификация лепры (Ридли-Джоплинга):
1. ТТ-тип – у лиц с хорошим иммунитетом развивается относительно доброкачественная туберкулоидная форма. Она характеризуется образованием гранулем из эпителиоидных и гигантских клеток, окруженных лимфоцитарным валом, на коже и слизистых оболочках, а также поражением периферических нервов, реже поражаются внутренние органы. Кожные элементы сыпи (одиночные слегка пигментированные пятна, папулезные высыпания, бляшки расположенные ассиметрично) постепенно рассасываются, оставляя местную анестезию, атрофию (не растут волосы, не функционируют потовые железы). Поражение периферических нервов приводит к нарушению чувствительности, а поражение крупных стволов к парезам, параличам, контрактуре пальцев, трофическим язвам.
3. Промежуточное положение занимает недифференцированная форма, встречаемая у людей с неустойчивым иммунитетом. Протекает с поражением периферических нервов и слабо выраженными кожными проявлениями. Со временем (3-5лет) этот тип трансформируется в туберкулоидный или лепроматозный.
4. Кроме того, различают погранично-туберкулоидную, пограничную и погранично-лепроматозную формы.
Естественная резистентность высокая. В результате контактов с больными заболевают далеко не все (не более 1-2 из каждых 100 контактных). Однако все факторы, способствующие ослаблению иммунитета, повышают риск заболеваемости. Известно много случаев, когда члены семьи больного, жившие с ними с самого начала заболевания, оставались долгое время здоровыми, что может свидетельствовать о формировании иммунитета у контактирующих с больными. Это подтверждается также в очень редких случаях заболевания лепрой врачей, обслуживающего персонала лепрозориев – в редких случаях, когда нарушались, установленные там правила, и контакт с больными выходили за пределы официальных отношений.
Более частая заболеваемость детей, по всей вероятности, связана с несовершенством их иммунной системы.
В процессе заболевания возникают изменения иммунокомпетентных клеток: снижается количество Т-лимфоцитов, падает их активность – в результате теряется способность реагировать на антигены возбудителя (формирование расщепленной толерантности к M. leprae). Гуморальный иммунитет не нарушается – в сыворотке крови больных обнаруживаются антитела к микобактериям лепры в высоких титрах, но они не играют защитной роли.
Для определения активности иммунитета больных, с диагностической целью, а также для определения эффективности лечения применяется проба Мицуды – кожная проба с лепромином. Лепромин – автоклавированная или прокипяченная взвесь лепроматозной ткани. Вводится внутрикожно по 0,1 мл. Стандартный препарат лепромина содержит в 1,0 мл 100 млн. микобактерий лепры. Реакция положительна у здоровых людей и у больных туберкулоидной формой. Отрицательна – при лепроматозной форме, что свидетельствует о резком снижении иммунитета. Различают раннюю реакцию (48 ч) – гиперемия, небольшая папула и позднюю реакцию, которая появляется через 2-4 недели в виде бугорка, узелка, иногда с некрозом.
Исследуемый материал – соскоб слизистой оболочки носа (с обеих сторон перегородки), содержимое лепрозных узлов, мокрота, отделяемое язв, пунктаты лимфатических узлов, кусочки органов, кровь (в период лихорадки).
1. Бактериоскопический метод (основной).
2. Биологический метод.
3. Аллергологический метод – проба Мицуды для определения способности к иммунному ответу.
4. Молекулярно-биологический метод – ПЦР, ДНК-гибридизация.
Профилактика и лечение.
Специфической профилактики (создана экспериментальная вакцина) и лечения нет.
Основные мероприятия неспецифической профилактики:
- Раннее выявление больных и изоляция их в лепрозории, где они пребывают до излечения;
- Наблюдение за членами семьи больного и их обследование первые 10 лет – 2 раза в год, в дальнейшем – 1 раз в год;
- Новорожденные дети сразу же изолируются от больной матери и вскармливаются искусственно, затем здоровые дети воспитываются в детском доме при лепрозории;
- Применяется превентивное введение вакцины БЦЖ населению тех районов, где часто встречается лепра.
Для лечения проказы испробовано огромное количество различных способов, включая и препараты золота (золото в разных соединениях убивает кислотоустойчивые бактерии) – кризолган, сольганол, санакризин; подсадки растительных и животных тканей с целью стимуляции иммунитета (йодистый калий).
Издавна применяется чаульмугровое масло, добываемое из тропических бобовых растений. Масло содержит ненасыщенные жирные кислоты, которые влияют на содержание в крови липазы, разрушающей клеточную оболочку бактерий.
В настоящее время основными средствами лечения проказы являются:
- Препараты сульфонового ряда (ДДС/дапсон – 4,4-диаминодифенилсульфон и др.);
- Рифампицин, клофазимин, фторхинолоны (офлоксацин);
- Противотуберкулезные препараты (фтивазид, тибон);
- Чаульмугровое масло и его препараты (мигрол, интилепрол).
Препаратами выбора считают: дапсон, рифампицин и клофазимин, применяемые отдельно или в комбинации.
Лечение проводится комплексное, длительными курсами и иногда пожизненно.
Возбудитель проказы М. leprae был впервые описан в 1874 г. Г. Ганзеном.
Представляют собой типичные микобактерии. Это мелкие палочки, реже выглядят как изогнутые или извитые формы. Грамположительны, кислотоустойчивы. В состав входит большое количество липидов (миколовые кислоты, фенольные гликолипиды), спирты, полисахариды (галактан), которые прочно связаны с пептидогликаном клеточной стенки. По Циль-Нильсену окрашиваются в красный цвет.
Спор, жгутиков не имеют. Снаружи возбудитель покрыт капсулоподобным слоем, состоящим из гликолипидов, фосфолипидов, маннозидов.
Являются строгими внутриклеточными паразитами. Не растут на искусственных питательных средах.
Для выращивания М. leprae разработаны различные модели экспериментальной инфекции на лабораторных животных.
Возбудители культивируются при заражении в подушечки лапок белых мышей. Также они могут размножаться в организме девятипоясных броненосцев (армадиллов).
Относятся к микроаэрофилам. Метаболизм медленный и до конца не изучен. Анализ генома показал, что М. leprae способна окислять глюкозу с образованием АТФ в цикле Кребса, однако в сравнении с М. tuberculosis возбудитель содержит укороченную цепь дыхательных ферментов и ограниченный набор ферментов катаболизма (оксигеназ, дегидрогеназ, липаз).
Бактерии продуцируют супероксиддисмутазу, что способствует их выживанию при фагоцитозе.
Антигены М. leprae включают белковые, липидные и полисахаридные компоненты. Многие из них являются общими с возбудителем туберкулеза. Специфичность проявляют фенольные гликолипиды клеточной стенки (фракция ФГЛ-1). Антигенными свойствами обладает фермент супероксиддисмутаза
Действие токсических факторов до конца не выяснено. Токсические компоненты возбудителя связаны с микробной клеткой и обычно высвобождаются при ее разрушении.
Гликолипидная капсула защищает от фагоцитоза и участвует в адгезии.
Фенольный гликолипид 1 подавляет активность дендритных клеток и Т-лимфоцитов, участвует в связывании М. leprae с клетками Шванна в миелиновых нервных волокнах.
Супероксиддисмутаза угнетает дыхательный взрыв в макрофагах.
Резистентность возбудителя достаточно высока. В трупном материале он способен сохраняться длительное время. Быстро теряет жизнеспособность вне организма человека при попадании в окружающую среду.
Патогенез и характеристика заболевания
Проказа – хроническое инфекционное антропонозное заболевание. Это тяжелая патология, которая часто имеет генерализованный характер и сопровождается поражением кожи, слизистых оболочек, периферических нервов, внутренних органов.
Несмотря на постепенное снижение количества больных лепрой, число новых случаев заболевания из года в год остается высоким. К 2010 г. в мире было зарегистрировано более 210 тыс пациентов с проказой. Основное количество заболевших приходится на страны Юго-Восточной Азии (Индия – 120 тыс случаев в год), Латинской Америки и Африки.
Единственный источник инфекции – больной человек, который может выделять возбудителя в окружающую среду при кашле, чихании.
В развитии болезни важную роль играет генетическая предрасположенность. Считается, что более 95% всей человеческой популяции проявляет естественную устойчивость к возбудителю. Генетические механизмы такой устойчивости до конца не установлены. Показано, что здесь участвуют гены, отвечающие за реакции клеточного иммунитета (распознавание возбудителя, процессинг и презентацию его АГ, продукцию цитокинов клетками иммунной системы, в первую очередь – ФНО-α).
Инкубационный период составляет 3-5 лет и более. Для возникновения болезни необходим длительный контакт с возбудителем.
Основные пути передачи – воздушно-капельный, реже – контактный, трансплацентарный.
Входные ворота инфекции – слизистые оболочки и кожа, особенно если они имеют повреждения.
От входных ворот происходит медленное распространение возбудителя лимфо- и гематогенным путями. Бактерии вступают в контакт с макрофагами и дендритными клетками кожи и лимфоузлов. В зависимости от результата их взаимодействия болезнь может протекать по-разному.
Выделяют 3 основные клинические формы заболевания и несколько промежуточных вариантов. Самой тяжелой является лепроматозная форма, для которой характерна постепенная генерализация инфекции. Более благоприятно протекает туберкулоидная форма болезни. Существует также недифференцированная форма, которая может переходить в I или II вариант заболевания.
Комитет экспертов ВОЗ по лепре в 1990 г. предложил рабочую классификацию, по которой выделяют многобациллярную лепру (лепроматозную) и малобациллярную лепру (туберкулоидную и недифференцированную).
При туберкулоидной лепре развиваются клеточно-опосредованные иммунные реакции. Они обусловлены активацией Т-хелперов 1 типа, стимуляцией макрофагов и дендритных клеток, которые обеспечивают презентацию липидных антигенов микобактерий и выделение провоспалительных цитокинов (ФНОα, γ-интерферона, ИЛ 1, ИЛ 12, ИЛ 18). Возникает реакция ГЧЗТ, что препятствует распространению инфекции.
Данный вариант болезни имеет более легкое течение и менее заразен. Чаще поражается только кожа, на которой появляются симметрично расположенные папулы. Они сопровождаются потерей чувствительности. В очагах находится меньшее количество возбудителя.
При лепроматозной форме активны Т-хелперы 2 типа, выделяющие ИЛ 4, а также супрессорные лимфоциты. Подавление клеточных иммунных реакций ведет к развитию тяжелого инфекционного процесса.
Возбудитель проникает в кровь, лимфу, нервную систему, внутренние органы. Образуются гранулемы, состоящие из макрофагов, содержащих много микобактерий, т.е. выражен незавершенный фагоцитоз. Угнетается миграция макрофагов и бласт-трансформация лимфоцитов.
Без лечения смерть наступает через 5-10 лет от кахексии, иммунодефицита и сопутствующих заболеваний.
При всех формах заболевания поражается периферическая нервная система. Возбудитель с током крови и лимфы поступает к эпиневрию миелиновых нервных волокон, адсорбируется и проникает в эндоневрий. Бактерии поглощаются шванновскими клетками и макрофагами и размножаются внутриклеточно. В итоге развивается гранулематозное воспаление, которое приводит к демиелинизации нервных волокон.
Естественный иммунитет носит клеточный характер. Антитела не выполняют защитной роли. Для заболевания характерен незавершенный фагоцитоз, снижается число и активность Т-лифоцитов, развивается вторичный иммунодефицит.
Диагноз заболевания может быть установлен по характерной клинической картине.
Для лабораторного подтверждения диагноза применяют микроскопический метод.
Применяют РИФ с люминесцирующими сыворотками для выявления лепрозных антигенов.
Аллергическая проба имеет больше прогностическое, чем диагностическое значение. Вводят внутрикожно аллерген лепромин, который получают длительным кипячением тканей лепроматозного узла с последующей фильтрацией. Учет пробы производится через 8-24 дня (поздняя реакция).
При туберкулоидной форме реакция положительна (выявляют ГЧЗТ). При тяжелой лепроматозной форме реакция на лепромин отрицательная (развивается анергия).
Серологический метод применяют редко в связи с невысоким уровнем АТ. Разработан ИФА для выявления АТ к антигену ФГЛ-1.
Перспективным является использование молекулярно-генетических методов (ПЦР) для обнаружения ДНК М. leprae в исследуемом материале.
Назначают комбинированную химиотерапию с учетом чувствительности возбудителя. Наиболее эффективными препаратами для лечения заболевания являются дапсон, рифампицин, клофазимин, кларитромицин, миноциклин, фторхинолоны. В зависимости от формы заболевания лечение может длиться от 6 месяцев до 1-2 лет.
Неспецифическая – изоляция больных многобациллярными формами лепры и их лечение до перевода болезни в малобациллярную форму. Необходима изоляция детей от больных родителей с проведением иммунопрофилактики.
Для специфической иммунопрофилактики применяют вакцину БЦЖ, однако ее эффективность недостаточна (20-70%). Тем не менее, заболевание у вакцинированных детей протекает в более легкой форме. Испытывается действие убитой лепроматозной вакцины совместно с вакциной БЦЖ для профилактики контактных лиц и групп риска. Эффект вакцинации можно проследить только через 5-10 лет.
Читайте также:


