Сепсис при лейкозе прогноз

Распространённость рака крови
Рак крови не относится к особо распространённым онкологическим заболеваниям. Согласно данным американских гематологов, им заболевает в год всего лишь 25 из 100000 человек. Более часто заболевают дети в возрасте 3-4 года и люди пожилого возраста (от 60 до 70 лет).
В группу злокачественных заболеваний кроветворной ткани входит несколько заболеваний. Статистическое управление США приводит следующие данные заболеваемости на рак крови, прогноз при котором зависит от формы заболевания:
лейкоз определён у 327500 человек;
761600 человек страдают лимфомой Ходжкина или неходжкинскими лимфомами;
миелодиспластический синдром диагностирован у 1 51000 пациентов;
Раком крови болеют разные группы населения, у которых он проявляется с разной частотой. Так, дети страдают в основном от острой миелической лейкемии, а проявления лейкоза чаще всего можно выявить у лиц старше 60 лет. Лейкемия составляет 2-3% онкологических диагнозов. Она в разной пропорции поражает мужское и женское население. Так, в Германии ежегодно выявляют 8 случаев лейкемии на 10000 женщин, в то же время, как у мужчин диагностируют 12,5 случаев на 100000 населения.
Специалисты выделяют такие формы рака крови:
лейкозы (лимфоцитарный и миелобластный);
лимфомы (лимфома Ходжкина и неходжкинские лимфомы);
Прогноз выживаемости при лейкозах
Лейкоз относится к группе онкологических заболеваний кроветворной, лимфатической системы и костного мозга. В дальнейшем процесс распространяется на периферическую кровь, селезёнку и другие органы. Согласно статистическим данным, в России в 2014 году выявлено более 8000 новых случаев этой патологии крови, а в США – около33500 . Афроамериканцы болеют в 1,5 раза чаще представителей белой расы.
Известны четыре причины лейкозов:
1. Инфекционно-вирусная. В 30% случаев мутация клеток крови происходит под воздействием вирусов и бактерий.
2. Наследственность. Наличие в анамнезе родственников, болеющих лейкозом, в 2 раза повышает риск заболеваемости. Наследственные хромосомные аберрации в 28% случаев могут спровоцировать лейкоз.
3. Химические вещества и цитостатики. Линолеум, ковровые покрытия и синтетические моющие средства в 2 раза повышают риск заболеть лейкозом. Не контролированное введение в организм цефалоспоринов и антибиотиков пенициллинового ряда в 2,5 раза повышает риск развития гемобластозов.
4. Лучевое воздействие. Острый лейкоз развивается у 100% лиц, которые были подвергнуты облучению.
Прогноз заболеваемости лейкозом одинаков во всех возрастных группах. Наибольшая степень риска заболеваемости этим заболеванием у следующих групп населения:
1) работников атомных станций;
2) рентгенологов и врачей радиологов;
3) населения, которое проживает возле атомных станций.
На прогноз заболеваемости лейкозом влияет несколько факторов:
гистологической структуры опухоли;
варианта течения злокачественного процесса;
В международном классификаторе болезней выделены две формы лейкоза: острая и хроническая. При острой форме лейкоза в периферической крови находят до 90% бластных клеток. Патологический процесс протекает слишком стремительно и прогноз неутешительный – двухлетняя выживаемость составляет около 20%, пятилетняя выживаемость равна 0-1%. Если лечение начато вовремя и проведено в полном объёме, то положительный прогноз наблюдается в диапазоне от 45% до 86% пациентов.
Прогноз жизни пациентов, страдающих раком крови, улучшается при хронической форме заболевания. В этом случае в периферической крови находят приблизительно по 50% зрелых и незрелых форм лейкоцитов. Пятилетняя выживаемость от 85 до 90%.
Однако не стоит забывать, что хронический лейкоз протекает относительно благополучно до развития бластного криза, когда заболевания приобретает черты острого процесса. После проведения соответствующего химиотерапевтического лечения пятилетняя выживаемость этой категории больных хроническим лейкозом достаточно высока и составляет 45-48%. Только 25% пациентов после полуторагодичной ремиссии умирает.
Во многом прогноз зависит от возраста человека. Процент пятилетней выживаемости детей, страдающих лейкозом, колеблется от 60% до 80%. Шансы на излечение имеет 50% людей среднего возраста, однако, в 10-15% случаев у них наблюдается рецидив опухоли. Пятилетняя выживаемость лиц старше шестидесяти лет значительно ниже. Она находится в пределах от 25% до 30%.
Рак крови имеет особенность: нет очага новообразования, раковые клетки как бы разбросаны по всему организму. Однако в его течении выделяют несколько стадий, которые позволяют определить прогноз жизни. Только для хронического гемобластоза характерны три стадии развития патологического процесса. С ними связан прогноз выживаемости. Это можно увидеть на таблице №1.
Таблица №1. Прогноз выживаемости при хроническом гемобластозе.
Для того чтобы определиться с методом лечения заболевания, необходимо выполнить некоторые обследования, которые помогут установить диагноз. Это общий и биохимический анализ крови, пункция костного мозга и трепанационная биопсия.
Далее назначают противоопухолевые препараты и кортикостероиды. При остром процессе проводится противовоспалительная и дезинтоксикационная терапия, выполняются гемотрансфузии и переливание компонентов крови. Далее выполняется пересадка донорского костного мозга. Она необходима из-за того, что в процессе лечения лейкоза используют высокие дозы химиотерапевтических препаратов, от которых погибают не только атипичные, но и здоровые стволовые клетки.
Пересадку костного мозга выполняют при таких видах рака крови:
a) острый миелобластный лейкоз;
b) острый лимфобластный лейкоз;
c) миелодиспластические синдромы;
d) хронический миелолейкоз;
e) заболевания плазматических клеток;
f) ювенильная миеломоноцитарная лейкемия;
g) лимфома Ходжкина;
h) неходжкинские лимфомы.
Конечно же, что более благоприятный прогноз выживаемости после трансплантации костного мозга у пациентов с неонкологическими заболеваниями: он составляет от 70% до 90% в том случае, когда донором был родственник пациента или он сам, и от 36% до 65%, когда в качестве донора выступал не родственник. При пересадке костного мозга пациентам, страдающим лейкемией в стадии ремиссии, прогноз выживаемости составляет от 55% до 68% в случае забора трансплантанта от донора-родственника, и от 26% до 50% тогда, когда донор не был родственником.
К тому же, на прогноз выживаемости после пересадки костного мозга влияют такие факторы:
I. Степень выраженности совпадения между реципиентом и донором костного мозга по системе HLA.
II. Состояние пациента накануне пересадки костного мозга: если болезнь до трансплантации имела либо стабильное течение, либо же находилась в стадии ремиссии, то в этом случае прогноз улучшается на 52%.
III. Возраст. Чем меньше возраст пациента, перенесшего пересадку стволовых клеток, тем выше его шансы на выживание.
IV. Инфекционные заболевания, вызванные цитомегаловирусом у донора или же у реципиента, на 79% ухудшают прогноз.
V. Доза пересаженных стволовых клеток: чем она выше, тем больше шансов на выживание. Однако слишком большое количество костномозговых клеток на 26% увеличивает риск отторжения трансплантата.
Прогноз при миеломе
Множественная миелома также относится к заболеваниям, которые называют раком крови. Она развивается из плазматических клеток, являющихся своего рода белыми кровяными клетками, которые помогают организму бороться с инфекцией. При множественной миеломе раковые клетки растут в красном костном мозге. Они продуцируют аномальные белки, которые повреждают почки. При множественной миеломе поражается несколько участков тела.
Конечно же, большинство пациентов не обращаются за медицинской помощью до тех пор, пока не разовьются признаки заболевания. В 90% пациентов вначале появляется боль и ломкость костей. 95% людей обращают внимание на участившиеся инфекционные заболевания и приступы лихорадки. У 100% лиц, обратившихся за медицинской помощью, имеет место жажда и частое мочеиспускание. Потеря веса, тошнота и запоры беспокоят 98% пациентов с миеломой.
Лечение заболевания включает химиотерапию, радиационное лечение и плазмофорез. Шансом излечения 70% пациентов является трансплантация костного мозга или же стволовых клеток. Невзирая на успехи онкологической гематологии, а также трансплантологии, прогноз при этой форме рака крови неблагоприятный.
Известны 14 вариантов миеломы, но в 90% случаев регистрируется лейкемия и лимфома. Прогноз выживаемости зависит от многих факторов, однако, не следует забывать, что прогноз основывается лишь на статистических данных. Чем раньше поставлен диагноз и начато лечение, тем лучше прогноз.
Выделяют 4 стадии множественной миеломы. При ранней стадии заболевания в 100% пациентов не удаётся обнаружить каких-либо патогномоничных симптомов. Не определяются и повреждения костной ткани. На первой стадии встречается незначительное количество миеломных клеток, а в 97% пациентов находят незначительные повреждения костной ткани.
Появление умеренного количества миеломных клеток трактуется как 2 стадия заболевания. На третьем этапе развития миеломной болезни в 100% случаях находят большое количество атипичных клеток и многочисленные повреждения костной ткани. На прогноз выживаемости при таком виде рака крови, как миелома, является возраст пациента. Лица молодого возраста в 2 раза лучше поддаются лечению, чем пожилые пациенты.
В 10% случаев множественная миелома протекает бессимптомно и прогрессирует медленно. Прогноз ухудшается в 100% лиц с нарушением функции почек. Однако, прогноз выздоровления на 30% лучше у тех пациентов, которые реагируют на проводимую терапию в начальной стадии заболевания.
После проведенного лечения 100% пациентов нуждается в регулярном наблюдении и обследовании. Этим людям рекомендуется употреблять большое количество жидкости для того чтобы улучшить функцию почек. Из-за ослабления иммунитета они вынуждены более тщательно предохраняться от инфекционных заболеваний.
Какова же ожидаемая продолжительность жизни и прогнозируемая выживаемость пациентов, страдающих миеломой? В исследованиях представлен анализ выживаемости пациентов с миеломой по сравнению с их сверстниками, которые не болеют данным заболеванием.
Таблица №2. Средняя продолжительность жизни пациентов с миеломой по данным ACS (Американского онкологического общества).
Средняя продолжительность жизни (в месяцах)
У онкологических пациентов риск сепсиса повышен. Его развитию способствует снижение иммунитета, серьезные хирургические вмешательства. В Европейской клинике есть всё необходимое, чтобы вовремя выявить это осложнение и провести эффективное лечение.
Не совсем так. Между обычной инфекцией и сепсисом есть принципиальная разница.
Инфекция развивается, когда болезнетворные агенты – например, бактерии или вирусы – попадают в организм, повреждают органы. Естественно, наш иммунитет пытается дать чужакам отпор. У человека возникают определенные симптомы. Некоторые инфекции протекают легко, некоторые смертельны. Онкологические больные находятся в группе повышенного риска. Инфекция, которая не опасна для здорового человека, может стать для них фатальной из-за снижения защитных сил организма.
Сепсис – это когда иммунитет реагирует на попавшие в тело микроорганизмы слишком бурно. Он начинает повреждать собственные ткани по всему организму, из-за этого нарушается функция органов, и это опасно для жизни. То есть, помимо инфекции есть еще синдром системного воспалительного ответа. И здесь онкологические больные тоже находятся в группе повышенного риска.
Бактериемия и септицемия у больных раком
Бактериемией называют состояние, когда в крови человека присутствуют бактерии. Ее выявляют с помощью посева крови. Считается, что в норме кровь должна быть стерильна. Впрочем, некоторые исследования показали, что даже в крови здоровых людей могут находиться бактерии, но в целом это не доказано.
Бактериемия может возникать при некоторых инфекциях, например, при брюшном тифе, туляремии, сибирской язве. При пневмонии (воспалении легких) и менингите она уже считается тяжелым осложнением. Если бактерии попали в кровь, и иммунитет слишком бурно начал на них реагировать, развивается септицемия – это синоним сепсиса.
Самая тяжелая форма сепсиса – септический шок. Его диагностируют, когда сильно нарушается работа сердечно-сосудистой системы, ухудшается кровоснабжение всех органов, они перестают получать нужное количество кислорода и справляться со своими функциями. Такие пациенты часто погибают.
Причины возникновения сепсиса у больных раком
Существует несколько причин, из-за которых риск сепсиса у онкологических больных повышен:
- Эти пациенты часто и подолгу находятся в клиниках. Существует такое понятие, как внутрибольничная инфекция: как бы строго персонал больницы ни придерживался правил асептики и антисептики, как бы тщательно ни проводили уборки и ни включали ультрафиолетовые лампы – стопроцентной стерильности достичь невозможно, в медицинском учреждении всегда будут циркулировать микробы. Некоторые из них становятся особенно опасными, потому что постоянно существуют бок о бок с антибиотиками и успевают выработать к ним устойчивость.
- Химиопрепараты атакуют все быстро размножающиеся клетки без разбору: и раковые, и здоровые. Из-за этого могут развиваться осложнения, одно из них – снижение иммунитета.
- Организм многих онкологических больных ослаблен: из-за возраста, злокачественной опухоли и сопутствующих заболеваний, проблем с питанием. Естественно, в такой ситуации снижаются защитные силы организма.
- Для лечения в онкологии часто прибегают к инвазивным процедурам, хирургическим вмешательствам. Когда организм готов неправильно реагировать на инфекцию, сепсис может возникнуть даже из-за укола иглой, не говоря уже, например, о серьезных полостных операциях в брюшной полости.
Вывод: врачи в онкологической клинике должны внимательно наблюдать за состоянием пациентов, знать первые симптомы сепсиса, уметь его диагностировать и своевременно проводить эффективное лечение. Именно так работают в Европейской клинике. У нас есть современные методы диагностики. Например, мы одна из немногих клиник в Москве, где проводится анализ крови на бактериальный эндотоксин.
Причиной сепсиса могут стать самые разные микроорганизмы, как в результате внутрибольничной инфекции, так и заражения вне стен клиники. Согласно некоторым данным, более чем в половине случаев (52,9%) виновниками септицемии становятся грамположительные бактерии, в частности, стафилококки, стрептококки и энтерококки.
На втором месте (41,6%) – грамотрицательные бактерии: кишечные палочки, синегнойные палочки, протеи, клебсиеллы.
Реже встречается сепсис, вызванный грибками (4,1%), обычно кандидами – возбудителями молочницы.
Зачастую анализы показывают, что микроорганизмы, которые поселились в теле пациента, устойчивы ко многим антибиотикам. Поэтому подбор эффективного антибактериального лечения может стать непростой задачей.
Симптомы сепсиса при раке
Сепсис может проявляться разными симптомами, и они бывают выражены в различной степени. Иногда его сложно распознать из-за незначительных проявлений, легко спутать с другими состояниями, такими как инсульт, инфаркт, тромбоэмболия легочной артерии, анафилактический шок. Существуют специальные критерии, которые помогают врачам выявить начинающуюся септицемию и понять, что пациенту требуется обследование, лечение.
Например, если обнаружены два симптома из этого списка, диагностируют синдром системного воспалительного ответа:
- Температура тела менее 36° C или более 38° C.
- Частота сердечных сокращений более 90 ударов в минуту.
- Частота дыхания более 20 в минуту.
- Парциальное давление углекислого газа в крови более 32 мм рт. ст.
- Количество лейкоцитов в крови менее 4 000 или более 12 000 на литр.
Существуют критерии сепсиса по “быстрой” шкале qSOFA. Если есть все три из списка, скорее всего, это сепсис, нужно провести обследование:
- Частота дыхания более 22 в минуту.
- Систолическое (“верхнее”) артериальное давление 100 мм рт. ст. или менее.
- Изменение мышления.
Есть более точная шкала SOFA, она учитывает симптомы и результаты обследования.
В целом, наиболее распространенные симптомы сепсиса: повышение температуры тела, увеличение частоты сердечных сокращений, повышенная потливость, учащенное дыхание. При септическом шоке состояние резко ухудшается, падает артериальное давление, возникает спутанность сознания, ноги, руки и губы становятся холодными, синюшными. Возникают симптомы нарушений функций различных органов. Например, при поражении почек уменьшается суточный объем мочи, легких - развивается одышка, дыхательная недостаточность.
Методы лечения сепсиса при раке
Лечение при сепсисе носит комплексный характер. Основные направления:
- Если есть очаг инфекции - его нужно ликвидировать, например, вскрыть и обработать гнойник.
- Лечение антибиотиками, к которым чувствителен возбудитель (в случае с грибками - противогрибковые препараты).
- Препараты, которые помогают стабилизировать кровообращение: вазопрессоры (сосудосуживающие), инотропные (увеличивающие силу сердечных сокращений).
- Инфузионная терапия - внутривенные вливания растворов через капельницу.
- При необходимости - искусственная вентиляция легких, плазмаферез, переливание компонентов крови.
В Европейской клинике применяется инновационная методика лечения сепсиса - селективная сорбция на картриджах для экстракорпоральной гемоперфузии Toramyxin PMX-20R. Во время этой процедуры, напоминающей плазмаферез, кровь пациента пропускают через специальный фильтр, который очищает ее от эндотоксина. Этот метод помогает эффективно бороться с сепсисом, вызванным грамотрицательной и смешанной флорой.
Прогнозы на выздоровление
Смертность при септицемии составляет от 10 до 40%. Среди пациентов, у которых развился септический шок, она выше. Прогноз главным образом зависит от трех факторов:
- Разновидности и характеристик инфекционного агента.
- Особенностей, физиологии организма пациента.
- От того, насколько правильно и своевременно был установлен диагноз, начато лечение.
В Европейской клинике работает отделение интенсивной терапии, оснащенное всем необходимым оборудованием. У нас есть все возможности для того, чтобы быстро и в полном объеме оказать помощь пациенту в состоянии любой степени тяжести.


Пациент с лейкозом может жить полноценной жизнью долгие годы. Главное – вовремя диагностировать болезнь и выбрать правильную тактику лечения.
Лейкоз – наиболее распространенная форма злокачественных заболеваний крови. Существует множество разновидностей лейкозов, каждый из которых отличается течением и иными характеристиками. Прогноз выживаемости при лейкозах рассчитывается индивидуально и зависит от многих факторов, в первую очередь – от вида лейкоза. В целом, раннее обнаружение патологии часто позволяет говорить о благоприятном исходе – длительной ремиссии и даже полном выздоровлении.
Прогнозы при остром лимфолейкозе
При остром лимфолейкозе лечение, главным образом, сводится к проведению химиотерапевтических курсов. Как правило, используются несколько цитостатических препаратов (как правило, 3). Лечение острого лимфолейкоза длительное и составляет несколько лет.
Изначально проводится индукционная химиотерапия, основной целью которой является уничтожение раковых клеток костного мозга и крови. Затем проводится консолидационная химиотерапия, которая необходима для уничтожения менее активных атипичных клеток, что нужно для предотвращения возможного рецидива заболевания. Последний этап лечения – профилактическая химиотерапия, при которой уничтожаются остаточные злокачественные клетки, чтобы предотвратить появление метастаз.
Лучевая терапия при остром лимфолейкозе используется в случаях, когда поражается нервная система.
В ряде случаев проводится высокодозная полихимиотерапия, после которой больному делают пересадку костного мозга. К пересадке прибегают в случаях, когда речь идет о рецидивах заболеваниях, и стандартизированные методики консервативного лечения не оказывают должного терапевтического эффекта.
Пересадка костного мозга – достаточно сложная процедура, требующая высокой точности проведения лечения, а также положительной приживаемости донорского материала.
Острый лимфолейкоз – болезнь, при которой сложно спрогнозировать выживаемость больного. У некоторых пациентов наступает ремиссия на долгие годы, и они живут полноценной жизнью. Иногда болезнь возвращается спустя короткий промежуток времени. При успешной пересадке костного мозга, обычно, прогнозы на длительную ремиссию благоприятны, особенно для детей до 10 лет. В период ремиссии симптомы заболевания почти отсутствуют.

Прогноз выживаемости при остром миелолейкозе
Лечение острого миелолейкоза сводится к использованию мощных химиопрепаратов, уничтожающих раковые клетки, а также антибиотиков, поскольку при лечении данной патологии существует повышенная вероятность присоединения серьезных инфекций вплоть до наступления сепсиса.
Химиотерапия, как и в случае острого лимфолейкоза, комбинированная, и предусматривает применение 2-3 видов цитостатических препаратов.
На выживаемость пациента при остром миелолейкозе влияют сразу несколько факторов: возраст больного, разновидность клеток, подвергшихся патологическому изменению, правильность выбранной тактики лечения и другие.
Если пациенту не более 60 лет, то при стандартном лечении выживаемость при остром миелолейкозе составляет не более 6 лет. С возрастом вероятность длительной ремиссии снижается. Так, если речь идет о пациентах старше 60 лет, то пятилетняя выживаемость отмечается у 10% пациентов.
Если при острых лейкозах развивается сепсис, то часто это заканчивается смертью больного. Если после 5-6 лет ремиссии не наступает рецидива болезни, то можно говорить о полном выздоровлении больного. Если лечение было успешным, а пациент следит за собой, придерживаясь всех рекомендаций врачей, то нередко выживаемость составляет 10 и более лет.

Прогноз выживаемости при хроническом миелоидном лейкозе
Что касается хронических форм лейкозов, то прогнозы тут, как правило, гораздо благоприятнее, чем при острых формах патологий.
При хроническом миелоидном лейкозе прогноз выживаемости больного зависит от ряда факторов, которых определяют на стадии диагностики заболевания. В среднем, 5-летняя выживаемость при хроническом миелоидном лейкозе отмечается более чем в 90% случаев. С появлением современных методов биологической и таргетной терапии вероятность выздоровления или достижения длительной (на долгие годы) ремиссии существенно увеличилась.
В случае, когда стандартные курсы химиотерапии, биотерапии и таргетного лечения не приводят к желаемым результатам, то прибегают к трансплантации стволовых клеток костного мозга. Такое лечение, в случае его успешности, дает хорошие результаты и позволяет добиться ремиссии на 15 лет и более. Однако такой благоприятный исход возможен в случае, когда болезнь выявляют на ранней стадии. Что касается лечения хронического миелоидного лейкоза поздних стадий, то прогноз часто неблагоприятный.

Прогнозы при хроническом лимфоцитарном лейкозе
Хронический лимфоцитарный лейкоз – заболевание, которое не поддается лечению. Однако с помощью современных фармакологических препаратов, применяющихся в онкогематологии, болезнь можно долгие годы держать под контролем. Примерно 50% пациентов живет минимум 5 лет после постановки диагноза. При благоприятных обстоятельствах и успешном лечении выживаемость может составить 10 и более лет.
Прогноз при хроническом лимфоцитарном лейкозе зависит от стадии заболевания, на которой было начато лечение. Так, на стадии А (начальная стадия) выживаемость составляет 10 лет и более. Если лечение начато на стадии В, то пациент живет от 5 до 8 лет. На стадии С – от 1 до 3 лет.
Безусловно, вышеперечисленные цифры являются условными. Прогноз при данной патологии рассчитывается в индивидуальном порядке с врачом.
Отметим, что в настоящее время проводятся серьезные клинические испытания с новейшими препаратами для прицельного уничтожения злокачественных клеток крови при хронических формах лейкоза. Внедрение подобных методов лечения в практику существенно улучшит прогнозы при хронических лейкозах.

Прогнозы при волосатоклеточном лейкозе
Это достаточно редкое заболевание крови, являющееся одним из вариантов хронического лейкоза. При волосатоклеточном лейкозе поражаются В-лимфоциты, и раковые клетки имеют рваные или волосатые края, из-за чего болезнь и получила такое название.
Хорошая новость в том, что волосатоклеточный лейкоз развивается достаточно медленно, и при выявлении этой патологии больные живут минимум 10 лет. Примерно у 40% больных спустя 10 лет ремиссии болезнь рецидивирует. А при вторичном лечении заболевания прогноз составляет 5 и более лет.
Как вы понимаете, выживаемость при раке крови и кроветворных органов сильно зависит от стадии, на которой было выявлено заболевание. Своевременная диагностика и верная тактика лечения позволяют добиться длительной стойкой ремиссии и даже полного выздоровления. Современные технологии биотерапии и таргетного лечения существенно увеличили продолжительность жизни пациентов с раком крови, а самое главное – улучшили качество жизни, что позволяет пациенту жить в привычном для него ритме и быть полезным для своей семьи и общества.
У многих пациентов уже до начала лечения выявляются лихорадка и нейтропения. Нераспознанные инфекции могут быстро диссеминировать и закончиться фатально, поэтому недопустима отсрочка назначения антибиотиков до появления развернутой клинической картины.
Наиболее важным предрасполагающим фактором развития инфекций является нейтропения. Риск инфекции зависит от уровня и длительности постцитостатической нейтропении и возрастает при количестве нейтрофилов меньше 1 • 10 9 /л.
При развитии агранулоцитоза (нейтрофилов меньше 0,5 • 10 9 /л) вероятность инфекции очень велика, а при количестве нейтрофилов меньше 0,1 • 10 9 /л инфекции развиваются у большинства пациентов и имеют чрезвычайно тяжелое течение.
До середины 1980-х годов грамотрицательные бактерии кишечного происхождения были причиной 70-80% бактериальных инфекций у больных острым лейкозом. В настоящее время 60-80% бактериальных инфекций вызывается грамположительными микроорганизмами. Это обусловлено:
1) использованием сосудистых катетеров;
2) проведением деконтаминации кишечника, подавляющей грамотрицательную микрофлору;
3) выбором антибактериальных препаратов для эмпирической антибактериальной терапии.
Наряду с бактериальными инфекциями большое значение у больных с нейтропенией имеют грибковые (кандидоз, аспергиллез), вирусные (вызванные herpes simplex и zoster, ЦМВ) и протозойные инфекции.
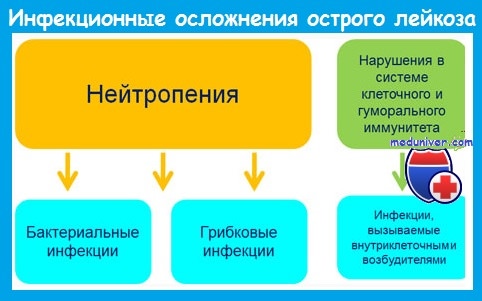
Инфекционные осложнения при остром лейкозе отличаются атипичным течением. Это обусловлено следующими обстоятельствами:
1) агранулоцитоз существенно изменяет реакцию организма на инфекционный агент, что клинически чаще всего проявляется развитием фебрильной температуры без других признаков локальной или системной инфекции;
2) многие антибиотики нарушают микрофлору больного, подавляют чувствительные микроорганизмы и способствуют пролиферации резистентных бактерий и грибов рода Candida (суперинфекция);
3) большое влияние на защитные механизмы оказывает химиотерапия, вызывающая миелосупрессию и повреждение эндотелия;
4) глюкокортикостероиды, часто вводимые больным как часть специфической терапии, также отрицательно влияют на защитные механизмы;
5) интубация, зондовое энтеральное питание и использование сосудистых катетеров вызывают нарушение целостности кожных покровов и/или повреждение слизистых оболочек.
В связи с высокой вероятностью развития инфекционных осложнений у больных острым лейкозом разработан комплекс профилактических мероприятий:
1) изоляция больного в период нейтропении, которая обеспечивает снижение частоты инфекций, передающихся воздушно-капельным путем;
2) обработка кожи и слизистых оболочек дезинфицирующими растворами (хлоргексидин и др.);
3) деконтаминация кишечника (per os назначаются неабсорбируемые антибактериальные препараты, например канамицин, и противогрибковые средства, чаще всего нистатин или суспензия амфотерицина В), позволяющая снизить количество грамотрицательных организмов кишечного происхождения;
4) гигиена ротовой полости (регулярное полоскание и использование мягких зубных щеток с целью предотвращения травмирования десен);
5) системная профилактика (бисептол или фторхинолоны);
6) отказ от ректальных и вагинальных манипуляций (кроме проводимых по неотложным и жизненным показаниям);
7) назначение препаратов гранулоцитарного или гранулоцитарно-моноцитарного колониестимулирующего фактора (КСФ) для более быстрого восстановления нейтрофилов и уменьшения вероятности инфекционных осложнений.
Показанием к назначению эмпирической антибактериальной терапии на фоне агранулоцитоза является фебрильная температура тела (выше 38 °С) более 2 часов, не связанная с инфузиями или аллергическими реакциями. Оптимально сочетание антипсевдомонального пенициллина или цефалоспорина с аминогликозидом.
Допустима монотерапия цефалоспорином 3-го или 4-го поколения или карбепенемом, например имепенемом. При отсутствии эффекта в течение 2-3 суток необходимо дополнение эмпирической антибактериальной терапии ванкомицином; в случае сохранения лихорадки в течение 4-6 дней назначается амфотерицин В в связи с высокой вероятностью системной грибковой инфекции. После идентификации возбудителя проводится целенаправленная антибактериальная, противовирусная и антимикотическая терапия.
Антибактериальная терапия проводится до повышения абсолютного содержания нейтрофилов в крови больше 0,5 • 10 9 /л и нормализации температуры тела. Длительность терапии у пациентов с документированной инфекцией должна быть не менее 10-14 дней.
Трансфузии гранулоцитов используются крайне редко. Единственным показанием к трансфузии является развившийся на фоне агранулоцитоза бактериальный сепсис при отсутствии ответа на адекватную антибактериальную терапию.
Читайте также:


