Современные представления о сепсисе
Сепсис остается актуальной проблемой медицины с тех пор, как Гиппократ в IV в. до н.э. описал гнилокровие, а Цельс в I веке н.э. – признаки воспаления. В 1850-х гг. Л. Пастером открыты болезнетворные свойства бактерий, в 1928 г. А. Флемингом – бактерицидное действие пенициллина.
Несмотря на это революционное открытие, сейчас очевидно, что лечение сепсиса выходит за рамки антибактериальной терапии. Эффективное лечение этого заболевания возможно только при воздействии на основные звенья его патогенеза.
В патогенезе сепсиса можно выделить несколько последовательных универсальных ключевых этапов развития. Это важно также и для определения подходов к терапии.
- Индукционная фаза – в результате локального взаимодействия организма человека и инфекционного агента формируется местная контролируемая воспалительная реакция.
- Каскадная фаза – при продолжении действия инфекционного агента и поступлении токсинов и медиаторов в системную циркуляцию запускается каскадный механизм продукции медиаторов воспаления (ИЛ-1, ИЛ-6, ИЛ-8, ФНО-а, простагландинов и др.), формируется системная воспалительная реакция, заключающаяся в активации гуморальных и клеточных механизмов иммунной системы.
Взаимодействие инфекционного агента и макроорганизма на системном уровне носит комплексный характер: происходит активация системы комплемента, клеток крови – нейтрофилов, моноцитов, макрофагов и тромбоцитов, выделение кислородных радикалов, протеаз, изменение адгезивных свойств эндотелиоцитов. Нормальная регуляция системного воспаления опосредуется через выделение противовоспалительных медиаторов ИЛ-4, ИЛ-10, ИЛ-11, ИЛ-13, которые ограничивают воспалительную реакцию.
- Фаза вторичной аутоагрессии – выраженная и/или продолжительная стимуляция иммунокомпетентных клеток – приводит к накоплению воспалительных медиаторов в системном кровотоке, что в конечном счете нарушает баланс про- и противовоспалительных агентов. В результате утраты регуляции системной воспалительной реакции формируются аутоагрессия и гиперкатаболизм.
Избыточная продукция цитокинов стимулирует синтез дополнительных естественных медиаторов воспаления: эйкозаноидов (тромбоксаны, лейкотриены, простагландины), интерлейкина, брадикинина, оксида азота и др., участвующих в нарушениях микроциркуляции и проницаемости капилляров.
Под действием циркулирующих биологически активных молекул (фактора активации тромбоцитов, ингибитора активатора плазминогена, цитокинов, эндотоксина) активируется свертывание, что приводит к прогрессированию нарушений микроциркуляции, тромбообразованию и в итоге – к формированию синдрома диссеминированного внутрисосудистого свертывания.
- Фаза полиорганной недостаточности. В результате неадекватного физиологического ответа (нарушений центральной гемодинамики, микроциркуляции, уменьшения объема циркулирующей крови, ишемических и реперфузионных повреждений) происходит повреждение клеток с формированием органной дисфункции.
Течение сепсиса возможно в трех клинических вариантах:
Пики SIRS и CARS чаще не следуют один за другим, поляризуя иммунный ответ, а образуют множество наслаивающихся разнонаправленных пиков, что делает выбор адекватной терапии крайне сложным. При этом можно наблюдать картину, когда в тканях отмечаются признаки SIRS, а в периферической крови – CARS.
На протяжении многих лет адекватная хирургическая санация гнойного очага и антибактериальная терапия считались главными средствами борьбы с сепсисом. В настоящее время общепризнано, что главная роль в патогенезе сепсиса принадлежит не инфекционному агенту, который служит лишь пусковым звеном, а чрезмерной и неадекватной воспалительной реакции, вызванной медиаторами, образующимися под действием бактериальных токсинов.
Доказанным является тот факт, что прогрессирование системной воспалительной реакции в рамках сепсиса и отягощение полиорганной недостаточности могут происходить уже при санированном гнойном очаге. Возникающий порочный круг аутоагрессии приводит к тому, что обменные процессы в организме направлены не на регенерацию, а скорее на деструкцию тканей.
В настоящее время ведущую роль в патогенезе сепсиса и формировании септической полиорганной недостаточности отводят медиаторам воспаления. В 1927 г. Т. Льюис описал химические регуляторы воспаления. С тех пор науке стало известно огромное количество медиаторов, которые принимают важное участие в патогенезе сепсиса.
Тем не менее в исследованиях было установлено, что применение антител к ФНО-а, антагониста рецептора ИЛ-1, антагониста MD2-TLR4, ингибитора пути тканевого фактора, антител к эндотоксину, фактора активации тромбоцитов, активированного протеина С, ингибитора синтазы оксида азота не повысило выживаемость больных при клинических испытаниях.
Отчасти это можно объяснить следующими факторами:
- диапазон концентраций, в которых эти медиаторы оказывают свое выраженное биологическое действие, чрезвычайно велик, они обладают как местным (паракринным), так и дистантным (эндокринным) эффектами, плейотропностью, избыточностью действия, синергизмом или антагонизмом биологического действия;
- выброс одного медиатора индуцирует продукцию других (каскадность), индуцировать синтез и выделение этих медиаторов может множество внешних агентов.
В связи с этим была высказана гипотеза, что неселективное, но одновременное удаление многих медиаторов воспаления может быть благоприятно для больного. Эта гипотеза была многократно подтверждена множеством клинических исследований.
Патологические процессы в организме больного с сепсисом (гипоксия, некробиоз, воспаление) под действием бактериальных токсинов не только приводят к продукции различных медиаторов воспаления, но и инициируют ряд функциональных и гуморальных расстройств, которые приводят к накоплению в крови различных токсичных продуктов обмена.
В процессе развития сепсиса быстро устанавливается равновесие между внутри- и внесосудистой жидкостью, что является скорее положительным фактом, так как кровь и лимфа – доступные среды для экстракорпорального удаления токсичных субстанций.
Современные методы заместительной почечной терапии позволяют не только адекватно корректировать уремию, гиперкалиемию и гипергидратацию, улучшать легочную и центральную гемодинамику, снижать уровень эндотоксемии, обусловленной генерализованным воспалением, массивным цитолизом и выраженным протеинолизом, но и снижать активность системной воспалительной реакции.
Высоким потенциалом в коррекции нарушений гомеостаза при сепсисе, септической полиорганной недостаточности и шоке обладают фильтрационные методики – гемофильтрация и гемодиафильтрация.
С учетом патогенеза сепсиса можно выделить три основные гипотезы механизма действия гемофильтрации:
- устранение пиковых концентраций цитокинов на ранней стадии способно остановить формирование и прогрессирование сепсиса;
- удаление циркулирующих цитокинов сопровождается снижением их тканевой концентрации (возможно, поэтому состояние больного может улучшаться даже без значительного снижения плазменной концентрации цитокинов);
- нормализация функции иммунной системы.
Peng и соавт. сообщают, что в результате продленной вено-венозной гемофильтрации при сепсисе отмечается эффективное удаление цитокинов плазмы (у-интерферона, ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-10, ИЛ-13) и уменьшается экспрессия HLA-DR на моноцитах. Концентрации ИЛ-6 и ФНО-а при этом изменились не сильно.
Терапевтическое действие гемо- и гемодиафильтрации опосредуется не только конфекционным механизмом. Некоторые мембраны, используемые для заместительной почечной терапии (особенно полиакрилонитриловые и полисульфоновые), имеют значительную адсорбирующую возможность.
Такие гемофильтры способны адсорбировать СЗа, С5а и другие цитокины на своей поверхности, уменьшая тем самым системное воздействие комплементарной активации. М. Nakamura и соавт. при проведении гемодиафильтрации на мембране из полиметилметакрилата отметили снижение концентрации ФНО-а, ИЛ-6, ИЛ-8, ИЛ-10.
Однако сорбционная емкость этих мембран недостаточно высока. Удаление медиаторов воспаления, таких как эндотоксин и цитокины, при сепсисе также возможно при высокообъемной гемофильтрации в случае использования мембран с высокой пропускной способностью (high-flux). Эффективность удаления цитокинов может быть повышена за счет применения специальных сорбентов, обладающих высокой сорбционной емкостью и скоростью сорбции.
Появлению комбинированных фильтрационно-сорбционных методик также способствовал тот факт, что при эффективном конвекционном удалении некоторых медиаторов воспаления резко снижается транспорт через мембрану других, поскольку эти молекулы обладают различным зарядом, молекулярной массой, конформацией молекулы, гидрофобностью или гидрофильностью и др.
Сочетанная плазмофильтрация и адсорбция (СПФА) является высокоэффективным методом удаления циркулирующих медиаторов, потенциально участвующих в патогенезе сепсиса. Схема этой процедуры представлена на рис.
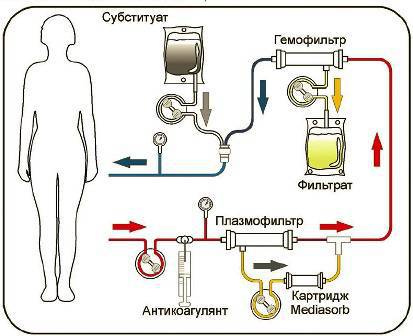
Сочетанная плазмофильтрация и адсорбция
В состав экстракорпорального контура при СПФА входят плазмофильтр, гемофильтр и специальный сорбент на основе смолы – Mediasorb. Этот сорбент обладает способностью эффективно удалять большое количество медиаторов.
Гипотеза, что удаление этих медиаторов полезно для больного с сепсисом подтверждена многими исследователями. Так, М. Formica и соавт. установили, что в результате снижения уровня циркулирующих про- и противовоспалительных медиаторов отмечалось улучшение показателей гемодинамики и газообмена в легких, снижение потребности в инотропной поддержке.
Bellomo и соавт. сообщают, что удаление циркулирующих цитокинов – высокоэффективная процедура при сепсисе и септическом шоке. Проведение СПФА приводит к нормализации гемодинамики и активности лейкоцитов, увеличению выживаемости лабораторных животных.
H.J. Мао и соавт. оценили эффект от применения СПФА и выявили, что после процедур наблюдается уменьшение концентрации ФНО-а и повышение концентрации антагониста рецептора ИЛ-IR. Также отмечены увеличение экспозиции HLA-DR и иммуностимулирующее действие – возрастание эндотоксин-опосредованного выделения ФНО-а, чего авторы не наблюдали при проведении высокообъемной гемофильтрации.
Т. Taniguchi и соавт. считают, что сорбционное удаление таких медиаторов, как ФНО-а, ИЛ-1, ИЛ-6, ИЛ-8 может иметь большой терапевтический потенциал при таких состояниях, как септическая полиорганная недостаточность и острое легочное повреждение.
Однако многие исследователи считают эффективность СПФА спорной. Есть и работы, в которых сообщается о недостаточной функции этого метода. Так, G. Berlot и соавт. сообщают, что комплексное удаление воспалительных медиаторов при сепсисе путем 12-часовой СПФА способствовало улучшению микроциркуляции и перфузии тканей. Однако этот эффект носил временный характер, и вскоре после прекращения процедуры показатели вернулись к исходным.
М. Stengl и соавт. наблюдали улучшение сократительной способности миокарда при удалении циркулирующих факторов, что может быть достигнуто при гемодиализе, но не при изолированной СПФА.
Sykora и соавт. в экспериментальной модели сепсиса у животных оценили эффективность СПФА. Несмотря на снижение концентрации циркулирующих медиаторов и токсинов после 12-часовой процедуры, авторы не отметили улучшения гемодинамики и уменьшения потребности в инотропной поддержке. Повреждения легких и печени, нарушения микроциркуляции, активация эндотелия, маркеры оксидативного стресса достоверно не различались в основной группе и группе сравнения, где СПФА не применялась.
В другом исследовании эти авторы также в эксперименте оценили возможности различных доз гемофильтрации при сепсисе. Они установили, что высокие объемы этой методики способны предотвратить или уменьшить выраженность гипотензии. Однако применение как высокообъемной, так и стандартной гемофильтрации не смогло предотвратить прогрессирование сепсиса.
Недостаточная эффективность как гемофильтрации, так и более сложных методик, таких как СПФА, может быть обусловлена многими факторами. По мнению ряда авторов, при проведении гемофильтрации у септического больного существенное значение имеет скорость фильтрации. Так, при скорости не менее 35 мл/час летальность среди больных с сепсисом достоверно снижается почти на 20%.
Кроме объема фильтрации важное значение имеет и длительность терапии. Известно, что интермиттирующая высокообъемная гемофильтрация (50-70 и даже 100-120 мл/кг/час) с применением высоко- пропускающих мембран (так называемая пульс- гемофильтрация) неспособна эффективно удалять воспалительные медиаторы из интерстициального сектора и часто сопровождается синдромом рикошета. Высокообъемная гемофильтрация может быть эффективной при терапии катехоламин-резистентного шока.
Ratanarat и соавт. применили сочетание высокообъемной (в дозе 85 мл/кг/час в течение 6 часов) и стандартной (в дозе 35 мл/кг/час в течение 18 часов) гемофильтрации при лечении больных с септическим шоком. Они отметили улучшение показателей центральной гемодинамики и снижение летальности с 72 до 47%. При лечении сепсиса без шока авторы отдают предпочтение постоянной вено-венозной гемофильтрации в режиме предилюции.
Простое увеличение скорости фильтрации при сепсисе выше 35-45 мл/кг/час или размера пор фильтра не способствует увеличению транспорта медиаторов и токсинов в системный кровоток и не сопровождается выраженным повышением выживаемости. Отчасти это может быть объяснено увеличением клиренса не только токсинов, но и полезных субстанций: антибиотиков, гормонов, витаминов и др. Многих этих недостатков лишены фильтрационно-сорбционные каскадные методики.
Интересное многоцентровое открытое проспективное исследование проведено D. Рауеп и соавт. Авторы оценили влияние раннего применения продленной гемофильтрации в дозе 25 мл/кг/час при сепсисе на тяжесть септической полиорганной недостаточности (ПОН) и концентрацию цитокинов плазмы. Они пришли к парадоксальному выводу: тяжесть и частота развития септической ПОН оказались выше у больных, которым была проведена гемофильтрация. Авторы заключили, что, вероятно, эффективность этой методики можно повысить, изменив ее дозу. С другой стороны, данный факт может свидетельствовать о необходимости применения дополнительных методов терапии.
Эти исследования подтверждают, что удаление пиковых концентраций цитокинов может быть эффективно при сепсисе, однако необходим более тонкий и дифференцированный подход к терапии.
Таким образом, глубокое изучение патогенеза сепсиса способствует улучшению выживаемости больных. Но тот факт, что летальность от тяжелого сепсиса за последние 100 лет принципиально не изменилась, свидетельствует о том, что для успешного решения этой проблемы необходимо проведение дополнительных исследований.
А.Б. Зулькарнаев, А.В. Ватазин, С.А. Пасов, А.А. Подойницын
Однако, несмотря на разнообразие этиологии и локализации инфекционного процесса, отмечают общность клинических проявлений. В ходе исследований последних лет стало очевидно, что в основе септических состояний и различных неинфекционных процессов, таких так шок, ожоги, отморожения, острый панкреатит и др., лежат общие неспецифические процессы системного воспаления, приводящие к формированию полиорганной недостаточности (ПОН) и, в конечном итоге, к смерти. Причем ход воспалительного процесса неинфекционной природы часто осложняется присоединением инфекции вследствие транслокации бактерий через ишемизированную в результате нарушений микроциркуляции стенку кишечника или присоединения внутрибольничной пневмонии и так далее — т. е. развивается вторичная инфекция, еще больше осложняя течение основного заболевания. Ситуация усугубляется тем, что тяжелые гнойно-септические заболевания часто сопровождаются парезом желудочно-кишечного тракта, что влечет за собой усиленный рост кишечной грамотрицательной и анаэробной флоры и поступление большого количества токсинов в брюшную полость вследствие нарушения барьерной функции интестинального эпителия и увеличения проницаемости кишечной стенки.
В результате взаимодействия организма человека и инфекции при определенных условиях (повреждение естественных барьеров, увеличение количества или изменения соотношений сапрофитных микроорганизмов и др.) формируется местная воспалительная реакция. Возникает нормальная контролируемая реакция на действие инфекционного агента, и, если оно продолжается, запускается каскадный механизм активации медиаторов воспаления (ИЛ-1, ИЛ-6, ИЛ-8, ФНОа, простаг- ландины и др.) — формируется системная воспалительная реакция (СВР, inflammatory response syndrome — SIRS). Наличие микробных токсинов приводит к активации системы комплемента, активации нейтрофилов, моноцитов, макрофагов, эндотелиоцитов и тромбоцитов, повышению их адгезивных свойств, дегрануляции и выделению кислородных радикалов, протеаз — происходит активация гуморальных и клеточных механизмов иммунной системы. Вместе с тем выделяются такие медиаторы, как ИЛ-4, ИЛ-10, ИЛ-11, ИЛ-13, которые ограничивают воспалительную реакцию. При выраженной и/или продолжительной стимуляции им- мунокомпетентных клеток цитокины, проникая в системную циркуляцию и накапливаясь там в достаточном количестве, могут приводить к нарушению баланса про- и противовоспалительных агентов. Происходит срыв гомеостаза. Утрачивается регуляция ответа на инфекцию. ФНОа и ИЛ-1 опосредуют непреодолимый физиологический эффект, приводящий к тканевому повреждению и заключающийся в развитии диффузного капиллярного повреждения, органной дисфункции [49]. Под действием таких веществ, как фактор активации тромбоцитов, ингибитор активатора плазминогена, цитокины, непосредственно или опосредованно активируются факторы свертывания. Повреждение эндотелиальных клеток инициирует цитокиновый каскад. Избыточная выработка цитокинов является вредной, так как стимулирует синтез дополнительных естественных медиаторов воспаления, таких как эйкозаноиды, интерлейкины, тромбоксан, лейкотриены, брадикинин, оксид азота, участвующие в нарушениях микроциркуляции, проницаемости капилляров. Формируется замкнутый крут. Антикоагулянтные факторы активно потребляются и неизбежно наступает их дефицит, который прогрессирует по мере утяжеления сепсиса. Развивается сначала гиперкоагуляционное, а позднее — гипокоагуляцион- ное состояние. Под действием ДВС, нарушений центральной гемодинамики, микроциркуляции, уменьшения ОЦК, ишемических и реперфузионных повреждений, а также на фоне повреждений органов и тканей, вызванных непосредственным действием бактериальных токсинов, развивается органная дисфункция, а позже — полиорганная недостаточность, которая, несмотря на достигнутые медициной успехи, до сих пор остается основной причиной высокой летальности при сепсисе. При участии в полиорганной недостаточности четырех систем и более летальность приближается к абсолютной. (рис. 15.4).

Некоторые общие механизмы развития СПОН.
На протяжении многих лет адекватная хирургическая санация гнойного очага и антибактериальная терапия считались главными средствами борьбы с сепсисом [29, 30,31,115]. В настоящее время общепризнанно, что основная роль в патогенезе сепсиса принадлежит не инфекционному агенту, который является лишь пусковым звеном, а чрезмерной и неадекватной воспалительной реакции, вызванной медиаторами, которые образуются под действием бактериальных токсинов. Бактериальная инвазия же рассматривается как механизм, запускающий множество каскадных реакций и стимулирующий их дальнейшее течение. Доказанным является тот факт, что прогрессирование системной воспалительной реакции в рамках сепсиса, отягощение полиорганной недостаточности могут происходить уже при санированном гнойном очаге. Возникающий порочный круг аутоагрессии, аутоканнибализма приводит к тому, что обменные процессы в организме направлены не на регенерацию, а, скорее, на деструкцию тканей [19, 38, 39,154].
Одним из главных факторов, запускающих системную воспалительную реакцию, является эндотоксин грамотрицательных бактерий, являющийся облигатным липополисахаридом бактериальной стенки. В настоящее время, достаточно хорошо изучена химическая структура эндотоксина и биологическое действие, оказываемое им на организм [19, 20]. Эндотоксин состоит из длинной цепи жирной кислоты (липид А) и полисахаридного ядра, которые одинаковы у всех грамотрицательных бактерий. К сердцевине ядра прикреплена вариабельная углеводная цепочка — О-антиген, который уникален для каждой бактерии и определяет ее серотип. Структура эндотоксина представлена на рис. 15.5.

Структура эндотоксина грамотрицательных бактерий.
За счет внедрения эндотоксина в двуслойную мембрану (клеточную стенку) гидрофобной частью молекулы происходит ее реорганизация: изменение гидро- фобности, поверхностного заряда, функциональной стабильности. Это приводит к угнетению клеточного дыхания, нарушению функций митохондрий, ускорению окислительных процессов. Взаимодействие эндотоксина с нейтрофилами является триггером для выделения активных кислородных радикалов — основных медиаторов тканевого повреждения при эндотоксинемии [62, 80]. Это усугубляется тем, что эндотоксин способен угнетать активность антиоксидантных систем (уровень эндогенного глутатиона и сульфгидрильных групп белков в крови) и снижать способность гепатоцитов противостоять перекисному повреждению мембран, что приводит к развитию печеночной недостаточности [105].
При разрушении бактериальной стенки освобожденный эндотоксин проникает в различные жидкие среды организма, но именно возникающая эндотоксемия приводит к различным патофизиологическим эффектам, ухудшающим состояние и в значительной мере определяющим тяжесть клинического состояния больного. Высокая биологическая активность липополисахарида бактериальной стенки обусловливает тяжелые осложнения грамотрицательных инфекций. J.S. Solomkin и соавт. [179] рассматривали первоначальный ответ организма на эндотоксин как анафилактическую реакцию. Установлено, что эндотоксин является специфическим активатором комплемента, в результате чего генерируются фракции С3а, С5а, которые в свою очередь обладают способностью стимулировать выделение гистамина. Е.К. Pinkard и соавт. [151] сообщают об опосредованном действии на тромбоциты, приводящем к их агрегации и выбросу серотонина [15, 19, 33, 38, 39, 40, 41, 184, 186]. В результате метаболических нарушений, которые приводят к комплемент-зависимой агрегации лейкоцитов, развивается повреждение эндотелия, вызывая эмболизацию капилляров легких, приводя к дистресс-синдрому [76].
Установлено, что большое количество эндотоксина выделяется при разрушении грамотрицательных бактерий под действием защитных сил организма и приводит к быстрому истощению физиологических эндотоксинсвязывающих систем. Кроме этого, патогенные бактерии способы спонтанно выделять эндотоксин в окружающую среду. Адекватная терапия, антибиотиками бактерицидного действия неизбежно приводит к выделению эндотоксина в системный кровоток. Подобный эффект наиболее выражен у широко применяющихся антибиотиков цефалоспориновой группы.
Повреждение сосудистого эндотелия при сепсисе является одной из важнейших составляющих полиорганной недостаточности. Механизм эндотелиальных поражений комплексный: наличие микробных токсинов в кровотоке приводит к активации свертывающей системы крови, системы комплемента, активации нейтрофилов и тромбоцитов, повышению их адгезивных свойств, дегрануляции и выделению кислородных радикалов, протеаз. Активность эндотоксина в сыворотке макроорганизма во многом зависит от концентрации липополисахаридсвязывающего белка, в комплексе с которым он взаимодействует с рецептором CD 14, активируя макрофаги, что в свою очередь сопровождается выделением цитокинов, фактора активации тромбоцитов, колониестимулирующих факторов, метаболитов цикла арахидоновых кислот, тромбоксанов, простагландинов, лей- котриенов, активацией Т-лимфоцитов с выделением ИЛ-2, гамма-интерферона. На поверхности клеток имеются также специфичные для эндотоксина рецепторы CD18, CD54. Названные факторы вызывают прямые повреждения эндотелия. Клиническими проявлениями указанных процессов являются системная воспалительная реакция, системные нарушения микроциркуляции.
Попавший в брюшную полость эндотоксин поступает в кровь быстрее, чем бактерии. Обнаружена способность фибрина адсорбировать эндотоксин при перитонитах. При каловых перитонитах в эксперименте патологическую эндоток- синемию считали одной из главных причин гибели лабораторных животных, а некоторые авторы отождествляют токсическую фазу перитонита с эндотокси- новым шоком. Установлено, что летальная доза эндотоксина при внутривенном и внутрибрюшном введении одинакова. Этот факт свидетельствует о том, что эндотоксин быстро всасывается из брюшной полости в кровеносные и лимфатические капилляры [15, 39].
Наиболее уязвимыми с клинической точки зрения являются почки, легкие и кроветворная система. Несмотря на сродство клинико-лабораторной картины (нарушение гемодинамики, повреждение легких, требующее проведение ИВЛ ) при введении в эксперименте летальных доз экзотоксина грамположительных и эндотоксина грамотрицательных бактерий, во втором случае можно наблюдать более выраженные нарушения и проявляются они быстрее.
В мировой литературе имеется множество работ, посвященных изучению изменений концентрации эндотоксина при различных септических состояниях. Установлено, что максимальная концентрация эндотоксина при распространенных перитонитах наблюдается на 3-и сутки с постепенным снижением у выживших. У умерших впоследствии пациентов отмечался дальнейший рост концентрации эндотоксина в крови несмотря на этапные санации брюшной полости, что в конечном итоге приводило к летальному исходу. При местных перитонитах отмечался кратковременный подъем уровня эндотоксина в 1-е сутки и максимальная его концентрация на 2-е сутки с полным исчезновением его из системного кровотока уже на 5—7-е сутки послеоперационного периода при условии отсутствия хирургических осложнений [66, 94, 131, 132, 191]. Множеством авторов подтверждена корреляция между клиническим состоянием больного и уровнем эндотоксина в крови.
В то же время концентрация эндотоксина в крови не всегда четко коррелирует с клиническим состоянием больного. У ряда больных с подтвержденным грамотрицателъным сепсисом (выявление грамотрицательных возбудителей и наличие системной воспалительной реакции) при наличии клинических признаков эндотоксинемии эндотоксин в плазме не выявлялся или концентрации его были крайне малы. В то же время клинические проявления системной эндотоксинемии запаздывают за появлением эндотоксина в крови. Это можно объяснить различной чувствительностью макроорганизма к эндотоксину, состоянием дезинтоксикационных систем, направленных на инактивацию эндотоксина, не- специфичностью LAL-теста — самого распространенного на сегодняшний день метода определения концентрации эндотоксина к крови. Поэтому большинство авторов считают, что при обнаружении эндотоксина в крови оценка его концентрации может быть полуколичественной и оцениваться только в динамике. Известно, что начальные этапы эндотоксикоза обусловлены взаимодействием липо- полисахарида с различными клетками крови и тканей. Из клеток, акцептирующих эндотоксин, главными участниками и индукторами эндотоксикоза являются эндотелиальные клетки, тромбоциты, макрофаги, нейтрофилы, базофилы, тучные клетки, гепатоциты, что свидетельствует об отсутствии селективного связывания эндотоксина клетками. Активная клеточная акцепция эндотоксина объясняет феномен несоответствия между явлениями эндотоксемии и эндотоксикоза, когда при отсутствии содержания в крови циркулирующего эндотоксина развивается характерная картина эндотоксикоза и шока [118,142].
Различное действие эндотоксинемии на организм может зависеть от конечного результата взаимодействия циркулирующего эндотоксина с физиологическими детоксицирующими системами [40].
Установлено, что в крови портальной вены концентрация эндотоксина выше, чем в крови нижней полой вены. Разрушение попавшего в кровь эндотоксина происходит в купферовских клетках печени, клетках ретикулоэндотелиальной системы, однако, скажем при перитонитах, можно наблюдать быстрое истощение эндотоксинсвязывающего потенциала этих систем [138, 212]. В связи с этим не менее важное значение имеет инактивация эндотоксина непосредственно в крови [143, 144].
Y. Yamagushi и соавт. [211] установили, что возможности нормальной плазмы и печеночной ткани инактивировать эндотоксин практически одинаковы.
Многие авторы заявляют о неантительных системах в плазме крови, способных инактивировать эндотоксин, однако природа этих систем до конца не ясна. В качестве инактиваторов эндотоксина предлагались различные компоненты нативной плазмы человека. Так K.D. Schultz и соавт. [173] не обнаружили способности сыворотки инактивировать эндотоксин, однако наблюдали ее в плазме гепаринизированных животных. Авторы объяснили это действием липопротеиновой липазы, которая активируется при введении гепарина и способна разрушать эндотоксин. K.J. Johnson и соавт. [102, 103] изолировали инактиватор из нормальной человеческой плазмы и отнесли его к альфа-глобулинам. Авторы отрицали его энзиматическую природу. Y. Yamaguchi и соавт. [211] связывали инактиватор с действием комплемента: после декомплементации сыворотки на 90% от исходного уровня снижалась ее способность инактивировать эндотоксин, a R.S. Skames и соавт. [175] вообще отрицали участие комплемента в инактивации эндотоксина. В ряде работ сообщается о способности липопротеидов высокой плотности образовывать устойчивый комплекс с эндотоксином, приводя к его инактивации. Имеются сообщения об участии в процессах детоксикации ЛПС лизоцима, интерферона, макроглобулинов, термолабильного сывороточного инактиватора с эстеразной активностью, фосфатаз, комплемента [2]. Таким образом, научные данные в этой области весьма противоречивы.
В клинической практике иногда приходится наблюдать, как практически полное удаление эндотоксина из системного кровотока не приводит к улучшению состояния больного. Данный факт требует более тщательного определения показаний к проведению весьма дорогостоящих процедур селективного удаления эндотоксина из кровотока, а также оптимизации методики селективной адсорбции.
Читайте также:


