Стандарты лечения хеликобактер ассоциированных заболеваний
С чем связаны трудности лечения ЯБ, ассоциированной с Hp? Почему во все резервные схемы эрадикационной терапии включены препараты висмута? Какие больные подлежат обязательной эрадикационной терапии? Причиной развития, рецидивирования и прогрессиро
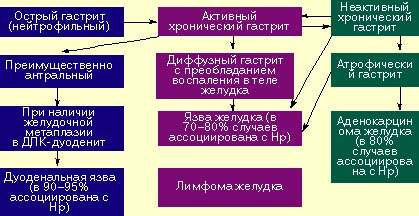
Причиной развития, рецидивирования и прогрессирования эрозивно-язвенного процесса в желудке и ДПК, несомненно, является преобладание факторов агрессии (в основном HCl и пепсин) над факторами защиты (слизисто-гидрокарбонатный барьер, кровоток, клеточная регенерация и др.).
Продолжающаяся колонизация Helicobacter pylori в гастродуоденальной СО является причиной усиления факторов агрессии и ослабления факторов защиты. Иногда усиление факторов агрессии может быть связано с приемом нестероидных лекарственных средств (аспирин и др.), кофеинсодержащих, а также крепких алкогольных напитков.
Если имеются показания к проведению диагностической эндоскопии (ЯБЖ, язвенное кровотечение, геморрагический гастрит, новообразования желудка и др.), то наиболее предпочтительными методами для выявления Hp считаются прицельная биопсия СО из преддверия привратника (из одного участка) и тела (из двух участков — передняя и задняя стенки) желудка, проведение гистологического исследования и определение уреазной активности (ускоренные уреазные тесты). Фиксация и окраска препаратов для гистологического исследования обычно занимают несколько дней, а оценка результата уреазного теста — несколько часов. По особым показаниям могут быть проведены посев бактериальной культуры, полимеразная цепная реакция (ПЦР), уреазный дыхательный тест. Однако перечисленные исследования являются трудоемкими, дорогостоящими и пока еще используются редко. Метод ПЦР в средах (например, слюне) позволяет идентифицировать Hp без выделения чистой культуры по присутствующим в исследуемом материале фрагментам его генома. Если диагноз, например ЯБДПК, был установлен ранее, во время эзофагогастродуоденоскопии, то методом выбора для выявления инфицирования СО желудка Hp могут быть серологический или уреазный дыхательный тесты. Данные методы неинвазивны и достаточно точны. Уреазный дыхательный тест с мочевиной может быть также использован для выявления инфекции после курса эрадикационной терапии. При этом исследование проводится не ранее чем через 4 недели после окончания антигеликобактерной терапии. Бактериологическое исследование хотя и представляет собой ценный метод выявления Hp в гастродуоденальной СО, но на практике проводится крайне редко в связи с тем, что этот процесс является достаточно трудоемким, требует наличия специальной обогащенной среды и продолжительной инкубации (3-5 дней) в особо контролируемых микроаэрофильных (микроаэробных) условиях. Данный метод в основном применяется только для выявления чувствительности Hp к антибиотикам при лечении устойчивых форм заболеваний, как правило, у больных с рецидивом язвы после курса эрадикационной терапии.
Для обнаружения Hp чаще всего используется материал (биоптат), полученный при эндоскопическом исследовании. Участок СО, взятый при биопсии, помещается на стекло или пленку, которые содержат мочевину и рН-индикатор. Если в ткани имеется Hp, происходит гидролиз мочевины до аммиака и бикарбонатов, в результате чего повышается рН и изменяется цвет индикатора (обычно с желтого до красного). Чувствительность и специфичность этого теста достигает 95% и более.
Современный подход к устранению (эрадикации) инфекции в гастродуоденальной СО базируется на использовании многокомпонентных схем из трех и даже четырех лекарственных средств. Установлено, что для успешной эрадикации Hp необходимо на период лечения повысить уровень внутрижелудочного рН до 5,0-7,0 с помощью включенного в лекарственную комбинацию антисекреторного препарата. Предпочтение отдается ингибитору протонного насоса (омепразол, рабепразол, лансопразол, пантопразол), но не исключаются также и антагонисты Н2-гистаминовых рецепторов (ранитидин, фамотидин). Такое комбинированное лечение, несомненно, является трудоемким, дорогостоящим и не лишено побочных эффектов. Однако пока что других подходов, позволяющих достичь эрадикации Hp, не существует.
Научные исследования, подтверждающие роль Hp в возникновении болезней человека, и создание антисекреторных и антибактериальных препаратов позволяют принять новые рекомендации по диагностике и лечению геликобактерной инфекции (Маастрихтский консенсус, февраль 2000 г.). Остановимся только на двух аспектах этой проблемы: как надо лечить больных и кому следует проводить терапию, направленную на уничтожение (эрадикацию) Hp инфекции, персистирующей в гастродуоденальной СО.
Абсолютными показаниями к проведению курса (курсов) эрадикационной терапии являются:
- рецидивирующие язвы или острые эрозии в СО желудка или в СО ДПК, независимо от фазы развития болезни (обострение, затухающее обострение, осложнение, оперативное вмешательство), т. е. при ЯБ, ассоциированной с Hp-инфекцией;
- лимфома или рак желудка, независимо от проводимого лечения (химиотерапия, операция и др.);
- гастроэзофагеальная рефлюксная болезнь (ГЭРБ), сочетающаяся с хроническим активным гастритом (гастродуоденитом) или ЯБ, ассоциированная с Hp-инфекцией.
Независимо от успеха эрадикационной терапии обследование и лечение этих больных осуществляются в объеме, который предусматривается соответствующими государственными стандартами.
Эрадикационную терапию проводить не обязательно, но она может быть также полезна, если у больного с симптомами диспепсии отсутствуют деструктивные изменения в гастродуоденальной СО (эрозии и изъязвления) или они возникают в результате приема НПВС, в том числе ацетилсалициловой кислоты. В подобных ситуациях наряду с курсами эрадикационной терапии очень большое значение имеет пролонгированный прием антисекреторного препарата, в том числе блокатора Н2-рецепторов гистамина (ранитидин, фамотидин и др.), ингибиторов протонной помпы (омепразол, лансопразол и др.), а также мизопростола (сайтотек и др.). В данной ситуации цитопротекторы типа сукральфата неэффективны, и их применять не следует.
1-я схема эрадикационной терапии включает: ингибитор протонной помпы или ранитидин висмут цитрат (пилорид) в стандартной дозе, принимаемой внутрь два раза в день, и один из следующих препаратов:
- омепразол (гастрозол**, лосек, омез, омепрол, ромесек* и др.) по 20 мг два раза в день;
- париет по 20 мг один-два раза в день;
- лансопразол (ланзофед, ланзап и др.) по 30 мг два раза в день;
- ранитидин висмут цитрат (пилорид) по 400 мг два раза в день.
 |
Кларитромицин (клацид, фромалид) по 500 мг два раза в день + амоксициллин (флемоксин, хиконцил) по 1000 мг два раза в день или метронидазол* (или тинидазол) по 0,5 г два раза в день. Курс лечения составляет не менее 7 дней.
Кларитромицин и амоксициллин относятся к кислотонеустойчивым антибиотикам, их бактерицидное действие распространяется на бактерии Hp, находящиеся в стадии деления (размножения) при рН среды от 6,0 до 7,0. Такой уровень рН в желудке может быть создан только с помощью ингибитора протонной помпы (с первого дня париетом и с третьего дня другими препаратами этой группы), принимаемого в удвоенной (эффективной) суточной дозе, а метронидазол (или тинидазол), тетрациклин и висмут оказывают бактерицидное действие на бактерии Hp, потерявшие способность к размножению. Однако следует иметь в виду, что висмут также предупреждает адгезию Hp к желудочному эпителию. При отсутствии побочных эффектов от комбинированной семидневной терапии возможно пролонгирование ее до 14 дней, как это практикуется, например, в США и некоторых других странах. С целью упрощения схемы лечения в последнее время специалисты все настойчивее рекомендуют сокращать кратность приема препаратов, приурочивая его к приему пищи. В случае неудачи эрадикационной терапии, т. е. если через 4-6 недель после окончания лекарственной терапии любой из тестов на Hp (уреазный дыхательный и др.) оказывается положительным, или если спустя 5-6 месяцев после окончания лечения возникает обострение болезни с рецидивом язвы или острой эрозии в СО желудка или в СО двенадцатиперстной кишки на фоне хронического активного гастрита (гастродуоденита), — во всех этих ситуациях рекомендуется провести повторный курс эрадикационной терапии, включающей любой из перечисленных ранее ингибиторов протонного насоса в стандартной разовой дозе два раза в день + коллоидный висмут субцитрат по 120 мг четыре раза в день (три раза за 30 минут до еды и четвертый раз спустя 2 часа после еды перед сном), или два раза в день по 240 мг за 30 минут до еды + метронидазол (трихопол и др.), или тинидазол по 500 мг три раза в день с едой + тетрациклин 500 мг четыре раза в день с едой. Курс лечения составляет не менее 7 дней. Если в такой комбинации выявляется непереносимость висмута, то в дальнейшем он исключается из схемы эрадикационной терапии.
Бактерии Hp могут быть резистентны к основным антибиотикам, применяемым для эрадикации этой инфекции. Резистентность Hp не установлена только к висмутсодержащим препаратам (де-нол, вентрисол, пилорид). В связи с этим данные препараты теперь включаются во все резервные классические эрадикационные схемы. Если микроорганизм приобретает резистентность к тем или иным антигеликобактерным средствам, она сохраняется на протяжении длительного периода, тем самым сокращаются возможности выбора терапевтических средств для проведения повторных курсов. Выбор адекватной лекарственной комбинации, обеспечивающей успешную эрадикацию Hp, оказывается проблематичным как в России, так и за рубежом. Решить эту проблему можно, используя только стандартизованные, рекомендованные Минздравом РФ схемы эрадикационной терапии.
1. Стандарты (протоколы) диагностики и лечения больных с заболеваниями органов пищеварения. Приказ № 125 МЗ РФ от 17.08.98.
2. Григорьев П. Я., Яковенко Э. П. Современные представления о пилорическом геликобактериозе // Практикующий врач, 1998. № 13. С. 14-17.
3. Пасечников В. Д., Чуков С. З. Значение геномной гетерогенности штаммов Helicobacter pylori в развитии ассоциированной патологии гастродуоденальной зоны // Росс. журн. гастроэнтерол., гепатол., колопроктол. 2000. № 3. С. 7-12.
Стандарты диагностика и терапия кислотозависимых заболеваний, в том числе и ассоциированных с Helicobacter pylori
3-6 февраля 2005 г. в Москве проведен V съезд Научного общества гастроэнтерологов России и XXXII Научная сессия Центрального научно-исследовательского института гастроэнтерологии.
Под руководством председателя Правления Научного общества гастроэнтерологов России, директора Центрального научно-исследовательского института гастроэнтерологии, доктора медицинских наук, профессора Л.Б. Лазебника были обсуждены и приняты Стандарты "Диагностика и терапия кислотозависимых заболеваний, в том числе и ассоциированных с Helicobacter pylori".
Для лечения больных, страдающих различными кислотозависимыми заболеваниями, необходимы альтернативные варианты лечения больных, что обусловлено следующим:
а) наличием возможной врожденной резистентности у части больных к тем или иным медикаментозным препаратам;
б) появлением вторичной, перекрестной или других видов резистентности к тем или иным препаратам, в том числе и к препаратам, применяемым в антихеликобактерной терапии;
в) наличием возможной непереносимости конкретными больными тех или иных препаратов;
г) отсутствием возможности лечения всех больных теми или иными препаратами в стационарах и по месту жительства больных (в том числе и по финансовым соображениям). Учет выше перечисленного позволит врачу выбрать наиболее оптимальный вариант для лечения конкретных больных.
ГЭРБ - гастроэзофагеальная рефлюксная болезнь;
НФД - неязвенная (функциональная) диспепсия;
HP - Helicobacter pylori;
ПЦР - полимеразная цепная реакция;
НПВП - нестероидные противовоспалительные препараты;
УЗИ - ультразвуковое исследование.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
Методы диагностики ГЭРБ:
- терапевтический тест с одним из ингибиторов протонного насоса в терапевтических дозировках в течение 5-10 дней;
- в необходимых случаях - рентгенологическое исследование верхних отделов желудочно-кишечного тракта (для проведения диагностики/дифференциальной диагностики пептических язв и/или пептической стриктуры пищевода, прежде всего, со злокачественным поражением пищевода и желудка).
Медикаментозная терапия ГЭРБ
Лечение больных ГЭРБ в стадии обострения болезни (для предлагаемого стандарта) целесообразно начинать одним из ингибиторов протонного насоса (омепразол, лансопразол, пантопразол, рабепразол или эзомепразол) в терапевтических дозировках (соответственно 20 мг, 30 мг, 40 мг, 20 мг и 20-40 мг) 1-2 раза в сутки (см. ниже).
При наличии у больных, кроме основных клинических симптомов и симптомов, чаще всего ассоциируемых с нарушением моторики и/или с гиперчувствительностью желудка к растяжению, а также при наличии атипичных (внепищеводных) симптомов, целесообразно дополнительное лечение больных прокинетиками (домперидон или метоклопрамид) по 10 мг 3-4 раза в день.
Примечание. В практической работе выбор дозировки того или иного препарата при лечении больных ГЭРБ в значительной степени зависит от конкретных факторов, в частности, от выраженности основных клинических проявлений ГЭРБ и/или степени выраженности эзофагита, по данным эзофагоскопии, в том числе наличия/отсутствия эрозий, пептических язв и/или стриктуры пищевода, особенностей механизма действия того или иного препарата, лечения больных в стационарных или в амбулаторно-поликлинических условиях, в том числе и от отношения конкретных больных к своему здоровью (выполнение рекомендаций врачей).
Продолжительность "активного" медикаментозного лечения большей части больных ГЭРБ в период обострения ГЭРБ (предполагается условно) - 4-8 недель, при необходимости лечение больных должно быть продолжено.
Основные критерии окончания сроков "активного" лечения больных ГЭРБ - сроки исчезновения симптомов и эндоскопических признаков эзофагита, в том числе с исчезновением диффузных признаков эзофагита (отечности и гиперимии слизистой оболочки пищевода), заживлением эрозий и пептических язв пищевода.
Варианты ведения больных ГЭРБ после стойкого устранения симптомов и эзофагита:
- при быстром положительном эффекте лечения больных - динамическое наблюдение (вопрос о дальнейшей тактике решается только при ухудшении состояния больных на основании клинических и эндоскопических данных);
- "поддерживающая" терапия (для закрепления результатов лечения больных) - омепразол по 20 мг, лансопразол по 15 мг, рабепразол по 10 мг или эзомепразол по 20 мг, соответственно один раз в день в течение двух месяцев;
- терапия "по требованию" - при очень редких случаях появления изжоги (жжения) и/или боли за грудиной и/или в эпигастральной области - один из антацидных препаратов, при более частом появлении изжоги (2 и более раз в неделю) - омепразол по 20-40 мг, лансопразол по 15-30 мг, рабепразол по 10-20 мг или эзомепразол по 20-40 мг соответственно 1 раз в день в течение 1,5-2 месяцев;
- периодическая курсовая терапия одним из ингибиторов протонного насоса в терапевтических дозировках, продолжительность которой зависит от наличия/отсутствия симптомов ГЭРБ и эзофагита, по данным эзофагоскопий;
- постоянная терапия одним из ингибиторов протонного насоса в терапевтических дозировках (замена одного из них на другой в случаях недостаточной эффективности в течение 2-4 недель, а также в случаях первичной или вторичной резистентности (снижение эффективности становится заметным при длительном приеме препарата);
- дополнительное проведение эрадикационной терапии HP показано лишь тем больным ГЭРБ, у которых имеется хронический гастрит, ассоциированный с Helicobacter pylori, и которым не менее, чем в течение года проведена постоянная антисекреторная терапия;
- дифференцированный отбор среди больных, нуждающихся в проведении постоянной терапии, для проведения эндоскопической или "открытой" фундопликации по Ниссену.
Язвенная болезнь, ассоциированная с Helicobacter Pylori (НР)
Методы диагностики язвенной болезни:
- эндоскопический, для исключения малигнизации язв - прицельная биопсия (5-7 фрагментов) дна и краев язв (в обязательном порядке - язв желудка);
- рентгенологический, для выявления/подтверждения пенетрирующих язв и исключения злокачественного поражения (в необходимых случаях как дополнение к эндоскопическому исследованию).
Методы диагностики Helicobacter pylori (HP):
- быстрый уреазный тест;
- морфологический (гистологический) метод для изучения материалов множественных прицельных биопсий (не менее 3) тела и антрального отдела желудка;
- уреазный дыхательный тест с 13С-мочевиной;
- различные модификации бактериологического метода;
- полимеразная цепная реакция (ПЦР), по материалам изучения биоптатов слизистой оболочки желудка или по материалам выявления антигена HP в кале (слюне, зубном налете, моче); в последнее время ПЦР проводится не столько для выявления HP, сколько для выявления штаммов HP;
- серологические методы исследования, позволяющие с помощью иммуноферментного анализа выявлять антититела различных классов как следствие реактивного ответа на HP;
- иммунологический неинвазивный фекально-антигенный тест;
- цитологический метод (по материалам получения фрагментов слизистой оболочки с помощью прицельных биопсий);
Медикаментозная терапия язвенной болезни, ассоциированной с HP
С целью уменьшения вероятности появления побочных эффектов и осложнений, как и в схемах терапии ГЭРБ, а также уменьшения стоимости лечения больных предложены альтернативные варианты антихеликобактерной терапии первой линии, терапия второй линии (квадротерапия) и терапия третьей линии.
Примечание. Предоставить врачам возможность иметь в своем распоряжении альтернативные варианты лечения больных язвенной болезнью, ассоциированной с HP (выбор варианта терапии язвенной болезни может зависеть от различных фактов:
а) от индивидуальной устойчивости отдельных больных к тем или иным препаратам;
б) от непереносимости некоторыми больными тех или иных препаратов;
в) наличия/отсутствия некоторых препаратов в аптеках конкретных стационаров или по месту жительства больных;
г) от финансовых возможностей больных при лечении их вне стационара.
Альтернативные варианты антихеликобактерной терапии язвенной болезни, ассоциированной с HP
Как дополнение к изложенному выше, в практической работе (в стационарных или в амбулаторно-поликлинических условиях) лечение больных обычно проводится, исходя из имеющихся возможностей, которые зависят от разных причин; пока еще в России имеется значительное количество больных с так называемыми "длительно незаживающими язвами" и/или с пенетрирующими язвами, которые отказываются от хирургического лечения и настаивают на консервативном лечении или хирургическое лечение этим больным из-за сопутствующих заболеваний противопоказано. Все это определяет необходимость наличия нескольких альтернативных вариантов лечения больных (в том числе и с учетом их финансовой стоимости).
Варианты первой линии антихеликобактерной терапии язвенной болезни
Первый вариант. Один из ингибиторов протонного насоса (омепразол, лансопразол, пантопразол, рабепразол, эзомепразол) в стандартной дозировке и кларитромицин по 500 мг в сочетании с амоксициллином по 1000 мг или с метронидазолом по 400-500 мг (соответственно, все препараты 2 раза в день) в течение не менее 7 дней.
Примечание. Оценка эффективности лечения больных в заживлении язв не осложненной язвенной болезни двенадцатиперстной кишки и желудка проводится, по результатам контрольной ЭГДС, на 8-9 день от начала лечения больных; при отсутствии заживления язвы - продолжение лечения больных одним из ингибиторов протонного насоса в стандартной дозировке 2 раза в день в течение еще 3 недель.
Второй вариант. Висмута трикалия дицитрат (международное непатентованное название препарата, который более знаком практическим врачам под названием коллоидный субцитрат висмута или де-нол) по 240 мг в сочетании с амоксициллином по 1000 мг и кларитромицином по 250 мг (соответственно, все препараты 2 раза в день) в течение 10 дней.
1) При отсутствии заживления язвы (по результатам контрольной ЭГДС на 11-12 день) - продолжение лечения больных еще в течение 2,5 недель висмутом трикалием дицитратом по 240 мг 2 раза в день.
2) При наличии (до лечения) у больных выраженных болей в эпигастральной и/или пилородуоденальной области целесообразно в эту терапию на первые 10 дней добавить ранитидин или фамотидин, соответственно по 300 мг или 40 мг на ночь.
3) При больших по размерам язвах желудка или двенадцатиперстной кишки (1,5-2 см и более) выше указанная антихелико-бактерная терапия (одним из вариантов, в которых в качестве базисного препарата предложен один из ингибиторов протонного насоса, в другом - висмута трикалия дицитрат в сочетании с двумя антибиотиками) проводится в течение 10 дней, с последующей терапией одним из базисных препаратов в течение 3 недель; после этого целесообразно проведение первой контрольной эндоскопии; при отсутствии заживления язвы лечение больных следует продолжить базисным препаратом еще в течение 4 недель.
Третий вариант. Один из ингибиторов протонного насоса в стандартной дозировке в сочетании с амоксициллином по 1000 мг и висмута трикалия дицитратом про 240 мг, соответственно 2 раза в день в течение 10 дней.
Примечание. При отсутствии заживления язвы, по результатам контрольной ЭГДС, лечение продолжить ингибитором протонного насоса или висмута трикалия дицитратом еще в течение 3 недель.
Четвертый вариант. При лечении больных с большими язвами (более 2 см), а также с так называемыми "длительно незаживающими" язвами и/или с пенетрирующими язвами желудка и двенадцатиперстной кишки (независимо от размеров), ассоциированными с HP (при отказе больных от хирургического лечения или в связи с наличием противопоказаний), целесообразно сразу же в лечении больных использовать "квадротерапию" (см. ниже) в течение 10 дней с последующим лечением больных еще в течение 3 недель висмутом трикалия субцитратом по 240 мг 2 раза в день и ранитидином или фамотидином (соответственно, по 300 мг или 40 мг на ночь) или одним из ингибиторов протонного насоса в стандартных дозировках вечером, один раз в день); при отсутствии заживления язвы, по данным ЭГДС, лечение продолжить еще в течение 4 недель.
Антихеликобактерная терапия второй линии (квадротерапия) проводится при отсутствии эрадикации HP после лечения больных одним из представленных выше вариантов тройной терапии первой линии, а также в качестве терапии первой линии при лечении больных с "длительно незаживающими" язвами и/или с пенетрирующими язвами (см. выше):
- один из ингибиторов протонного насоса в стандартной дозировке 2 раза в день, висмута трикалия дицитрат по 120 мг 4 раза в день, метронидазол по 400-500 мг 3 раза в день, тетрациклин 500 мг 4 раза в день в течение 7 дней.
Антихеликобактерная терапия третьей линии проводится при отсутствии эрадикации HP после проведения терапии второй линии:
- один из ингибиторов протонного насоса в стандартной дозировке, висмута трикалия дицитрат по 240 мг, фуразолидон по 200 мг (соответственно, все препараты 2 раза в день) в течение 7 дней.
Язвы желудка и двенадцатиперстной кишки, ассоциируемые с нестероидными противовоспалительными препаратами (НПВП)
- клинический (изучение жалоб больных и анамнеза заболевания, физикальный осмотр);
- эндоскопический и/или рентгенологический.
Медикаментозное лечение больных с язвами желудка и двенадцатиперстной кишки, ассоциированных с НПВП
Для медикаментозного лечения язв желудка и двенадцатиперстной кишки, ассоциированных с приемом НПВП целесообразно использовать в течение 4 недель ингибиторы протонного насоса в терапевтических дозировках 2 раза в день, мизопростол по 200 мкг 4 раза в день или трикалия висмута дицитрат по 240 мг 2 раза в день.
При проведении эрадикационной терапии применяются схемы аналогичные лечению язвенной болезни (см. выше).
Проведение эрадикационной терапии при наличии обсемененности HP показано лишь больным, у которых в анамнезе была язвенная болезнь.
Эрадикационная терапия не показана больным у которых в анамнезе нет указания на язвенную болезнь, но которые принимали НПВП до появления язвы.
Хронический гастрит с синдромом неязвенной (функциональной) диспенсией (НФД)
- в необходимых случаях рентгенологический, УЗИ и другие методы исследования.
Медикаментозное лечение больных хроническим гастритом с синдромом НФД
При проведении медикаментозного лечения больных целесообразно использовать препараты, механизм действия которых позволяет устранить симптомы заболевания, наиболее беспокоящие больных:
- при наличии болей и жжения в эпигастральной области - ингибиторы протонного насоса в терапевтической дозе 1 раз в день в течение недели, с последующим переводом на антагонисты Н2-рецепторов в течение 2-3 недель в терапевтических дозировках 1-2 раза в день;
- при наличии лишь симптомов, ассоциированных с нарушением опорожнения желудка и/или с гиперчувствительностью желудка к растяжению - прокинетики (домперидон, метоклопрамид) по 10 мг 3 раза в день в сочетании с ферментными препаратами в терапевтических дозах;
- при сочетании вышеуказанных симптомов можно использовать комбинацию предложенных выше препаратов;
- курс лечения составляет 14 дней, при необходимости лечение может быть продолжено.
- инструментальный (УЗИ, компьютерная томография, рентгенологическое исследование и др.).
- проведение общепринятого лечения больных хроническим панкреатитом (с учетом клинико-лабораторных данных и результатов инструментального обследования больных);
- дополнительное проведение антисекреторной терапии одним из ингибиторов протонного насоса в стандартных дозировках 1 раз в день (продолжительность лечения определяется общим состоянием больных, сроками исчезновения болей и диспепсических расстройств, "нормализации" лабораторных данных и т.п.), в последующем лечение проводится антагонистами Н2-рецепторов (ранитидин, фамотидин) в терапевтических дозах (150 и 20 мг соответственно) 2 раза в день;
- длительность лечения определяется состоянием больных.
Примечание: при наличии выраженной внешне-секреторной недостаточности поджелудочной железы подходить к лечению больных ингибиторами протонного насоса необходимо дифференцированно (в связи с вероятностью усиления диарейного синдрома).
В составлении данного документа принимали участие доктора медицинских наук и профессоры:
Helicobacter pylori
Многочисленные серологические тесты, основанные на обнаружении иммуноглобулина G (IgG), широко доступны для диагностики H. pylori. Определять IgM и IgA не рекомендуется поскольку. H. pylori является хронической инфекцией.
Диагностическая точность серологических методов диагностики инфекции H. pylori варьируется в зависимости от продолжительности воздействия H. pylori, перекрестной антигенности с другими распространенными антигенно родственными бактериями, такими как Campylobacter, разнообразием штаммов H. pylori в разных регионах, от антигена, используемого в коммерческом наборе, иммунного ответа хозяина, степени гастрита и обсемененности H. pylori [ 50 ].
Серологические тесты часто используются для скрининга в эпидемиологических исследованиях из-за их не дороговизны, быстроты и приемлемы для пациентов. Серологические тесты следует использовать для первичной диагностики H. pylori [22].
Колонизация H. pylori вызывает системный иммунный ответ. Через 3-4 недели после инфицирования в крови больных появляются антитела к H. pylori. Эти антитела определяются путем иммуноферментного анализа (ИФА). Поскольку инфекция является хронической и ее спонтанный клиренс невозможен, то положительные серологические тесты у нелеченых пациентов указывают на наличие текущей инфекции. Специфичность метода 93-94%, чувствительность 59-71% [ 51 ].
Преимуществом серологического метода для первичной диагностики
H. pylori является возможность его использования у лиц, принимающих ИПП и антибиотики [4], а так же после состоявшегося желудочно-кишечного кровотечения и при атрофии слизистой оболочки желудка. Все перечисленные ситуации ассоциированы со снижением бактериальной
Helicobacter pylori
13С-уреазный дыхательный тест ( 13 C-УДТ) для выявления H. pylori впервые был разработан и применен Дэвидом Грэмом в 1987 году [ 53 ]. С 1996 года FDA (Food and Drug Administration) в США и EMA (European Medicines Agency) в Европе разрешили применять 13 С-УДТ в клинических целях. В 2000 году (Маастрихт II-2000) 13 С-УДТ был принят в качестве
Метод 13 С-УДТ основан на способности H. pylori продуцировать фермент уреазу, которая в желудке гидролизует мочевину до NH4+ и HCO3- с последующим образованием диоксида углерода и аммиака. Уреаза является ферментом с абсолютной субстратной специфичностью и способна катализировать превращение только одного вещества, т.е. катализирует гидролиз только мочевины [ 55 ].
13С-УДТ является неинвазивным методом диагностики H. pylori. Основным реагентом в данном тесте является водный раствор мочевины, обогащенной изотопом углерода 13 С, в которой 12 С-атом углерода заменён
на 13 С-изотоп. При наличии в желудке H. pylori продуцируемая бактерией уреаза расщепляет поступившую в желудок 13 С-мочевину на аммиак и 13 С- углекислый газ, который затем всасывается в кровь, попадает в лёгкие и выводится с выдыхаемым воздухом, изменяя в нем соотношение 13 С/ 12 С в сторону увеличения 13 С, которое регистрируется на приборе (Рисунок 6). Если в желудке H. pylori отсутствует, то 13 С-мочевина в неизмененном виде всасывается в кровь и выделяется из организма почками через несколько часов. Таким образом, по появлению в выдыхаемом воздухе 13 С мы с высокой точностью можем определить инфицирован ли пациент H. pylori, а по величине соотношения 13 С/ 12 С можно дать оценку степени инфицированности.
Процедура проведения теста (Рисунок 7). Исходно проводится сбор выдыхаемого пациентом воздуха в специальный герметичный пакет №1. Затем пациент выпивает 200 мл тестового раствора, состоящего из лимонного сока (также может использоваться апельсиновый, грейпрутовый сок) и раствора мочевины меченной изотопом углерода 13 С. Сам раствор мочевины без вкуса и запаха, его прием не сопровождается никакими неприятными ощущениями, аллергических реакций не вызывает. Затем в течение получаса следует находиться в спокойном состоянии, чтобы на результаты исследования не повлиял углекислый газ, выделяющийся при физической нагрузке. Через 30 минут производится забор второй пробы воздуха в пакет №2, который также герметично закрывается. Затем пробы воздуха анализируют на инфракрасном спектрометре, который определяет изотопное соотношение 13 С/ 12 С. Если пациент инфицирован H. pylori, то во второй пробе воздуха появится увеличенное количество 13 СО2 по сравнению с его содержанием в первой (контрольной) пробе.
Прирост меченного CO2 выражается как дельта по сравнению с исходным значением (DOB). Обычно в качестве критерия присутствия инфекции H. pylori используют DOB 2,0‰ более. Было показано, что значение DOB положительно коррелируют с бактериальной нагрузкой H. pylori [ 56 ]. Чувствительность 13 C-УДТ составляет 96%, специфичность - 93%
Были описаны множество вариаций УДТ, в которых была изменена доза, время, состав субстрата, использование адъювантов, тестовые приемы пищи, тип детектора разных производителей и было показано, что все методики эффективны [ 58 ].
Ложноположительные результаты редки, но могут наблюдаться после выполнения ЭГДС с биопсией непосредственно перед тестом, у больных, перенесших резекцию желудка, а также при значительном снижении секреции желудка. Ложноположительные тесты чаще всего вызывают гидролиз мочевины бактериями в ротовой полости или бактериями, содержащими уреазу в желудке [ 60 ]. Это особенно вероятно в присутствии ахлоргидрии или гипохлоргидрии. Небольшое количество ложноотрицательных может быть связано с нарушением методики взятия и хранения проб выдыхаемого воздуха, физической нагрузкой накануне и в процессе выполнения теста. Как и при большинстве других тестов, достоверный результат УДТ может быть получен после 2-недельной отмены ИПП и не ранее, чем через 4 недели после прекращения приема антибиотиков и препаратов висмута. Консенсус Маастрихт V оценивает УДТ с меченой мочевиной как лучший способ диагностики H. pylori с высокой чувствительностью и специфичностью, и отличной производительностью, как для первичной диагностики инфекции, так и для оценки эффективности эрадикации.
Определение антигена Helicobacter pylori в кале
Анализ кала на антиген H. pylori (Helicobacter pylori stool antigen – HpSA-test) - это другой неинвазивный метод диагностики с высокой чувствительностью (94%) и специфичностью (97%) [22]. Для проведения этого исследования необходима небольшая порция стула, причем пробы могут храниться при температуре -20°С неограниченно долго. Существует два варианта исследования: иммуноферментный анализ (ИФА) и иммунохроматографический анализ (ИХА) с использованием поликлональных антител (ПА) или моноклональных антител (МА).
В 1997 году появился первый анализ кала на антиген с поликлональными антителами. В настоящее время для анализа используются моноклональные антитела. Тесты на основе МА более точны, а ИФА обеспечивают более надежные результаты, чем ИХА [ 63 ]. Наряду с 13 С-УДТ моноклональный тест на основе ИФА рекомендован как для первичной диагностики H. pylori, так и для контроля эрадикации [4]. Моноклональный антиген в кале является удобным и эффективным тестом для диагностики H. pylori у детей [ 64 ]. Кроме того, исследование антигена H. pylori можно применять для эпидемиологических исследований и программ скрининга в виду относительно невысокой стоимости исследования и оборудования [29].
Причинами ложноотрицательных результатов могут являться неравномерное распределение антигена в каловых массах, разрушение антигена при замедлении эвакуации каловых масс (запоры), желудочно- кишечное кровотечение. Ложноотрицательные результатов могут быть вызваны низкой колонизацией бактерий в желудке, что приводит к низкой концентрации антигенов H. pylori в фекалиях и неспособности реагировать в тесте [ 65 ].
Диагностическая точность HpSA-теста, особенно чувствительность, снижается при кровотечении из верхних отделов желудочно-кишечного тракта, приеме ингибиторов протонной помпы в течение 2-х недель, антибактериальных препаратов в течение последнего месяца, наличия атрофии и метаплазии желудочного эпителия, а отрицательный результат теста должен подтверждаться дальнейшими диагностическими методами [ 66 ].
Helicobacter pylori
4.1. Методы, рекомендованные для первичной диагностики инфекции Helicobacter pylori
Основными задачами, стоящими перед врачом, являются диагностика
H. pylori, подбор эффективной схемы терапии и, в дальнейшем, оценка эффективности проведенного лечения. При выборе метода тестирования H. pylori необходимо, в первую очередь, учитывать его чувствительность и специфичность. Каждый из этих тестов, если он правильно выполнен, гарантирует высокую точность диагностики, и положительный результат в каждом из этих тестов является показанием к эрадикационной терапии.
БУТ обеспечивает быстрый результат с возможностью начать лечение без задержки; гистологическое обследование обеспечивает оценку состояния слизистой оболочки желудка, которую можно динамически контролировать.
Культуральный метод имеет самую высокую специфичность, но чувствительность метода снижается в виду того что требуется особая осторожность при обращении с образцом слизистой оболочки желудка. Культуральный метод является методом выбора для тестирования чувствительности H. pylori к антибиотикам и имеет решающее значение для выбора адекватной эрадикационной терапии, учитывая высокую устойчивость H. pylori к антибиотикам в настоящее время.
Диагностическая точность серологического метода с определением антител IgG к H. pylori, при правильном проведении, сопоставима с гистологическим методом, неинвазивными тестами, но не позволяет заключить, является ли инфекция H. pylori текущей в настоящее время или была в прошлом.
Все тесты, используемые для обнаружения H. pylori, должны рассматриваться индивидуально, учитывая их преимущества и недостатки в различных клинических ситуациях и их выполнение должно проводиться соответствующим образом. При выборе метода исследования и интерпретации полученных результатов должны учитываться особые состояния, такие как кровотечение при язвенной болезни, атрофический гастрит с или без кишечной метаплазии, влияние лекарств, таких как ИПП, антибиотики и соли висмута.
Прием ИПП ограничивает точность диагностических методов в связи со снижением уреазной активности H. pylori, а также уменьшением количества вегетативных (спиралевидных) форм бактерии. Однако, в одном исследовании сравнивалось подавляющее действие ИПП на H. pylori и было показано, что пантопразол не ингибирует рост и уреазу H. pylori в отличие от омепразола и лансопразола и использование пантопразола в течение 14 дней не влияет на диагностическую точность методов диагностики H. pylori.
Пятидневный прием ИПП в высокой дозе оказывают значительное влияние на активность уреазы (при выполнении БУТ и 13C-УДТ), поэтому необходимо тщательно рассмотреть прием ИПП и его продолжительность. Прием менее пяти дней высокодозных ИПП (например, омепразол 80 мг) не оказывают существенного влияния на активность уреазы, при поведении БУТ или 13C-УДТ[ 67 ].
Каждый из применяемых сегодня методов имеет свои недостатки, и поэтому ограничиваться в практической деятельности только одним из них не желательно.
ЭГДС с биопсией
· Быстрый уреазный тест*
· Антитела к H. pylori IgG
· 13C-уреазный дыхательный тест*
· 14C-уреазный дыхательный тест*
· Антиген моноклональный в стуле*
Примечание: * тест достоверен, если больной более месяца не принимал по любому поводу антибиотики, препараты висмута, более 2 недель – ИПП, H2- блокаторы.
Контроль эффективности эрадикации H. pylori, независимо от используемых тестов, следует проводить не ранее, чем через 30 дней после завершения приема всех препаратов схемы. Несоблюдение этого правила ведет к ложному заключению об эффективности терапии.
Предпочтение следует отдавать неинвазивным методам: 13 С-УДТ и определению антигена H. pylori в кале. Для контроля эрадикации БУТ не рекомендуется. Исключение могут составлять случаи, требующие проведения повторной ЭГДС, при которой может быть получен биоптат для гистологического, цитологического или бактериологического исследования. Вместе с тем, обычно контрольная ЭГДС у больных с обострением язвенной болезни проводится на фоне продолжающегося приема ИПП, что делает невозможным диагностику H. pylori. Проведение ЭГДС через месяц после завершения лечения только с целью выявления инфекции может быть оправдана только при недоступности и невозможности применения неинвазивных методов. При этом не следует использовать БУТ для исключения инфекции [ 68 ]. Методы, которые можно использовать для контроля эффективности терапии (Таблица 4).
ЭГДС с биопсией
· 13C-уреазный дыхательный тест
· 14C-уреазный дыхательный тест
· Антиген моноклональный в стуле
Примечание: * проводится не ранее, чем через 30 дней после завершения эрадикационой терапии, и не ранее чем через 2 недели после завершения приема ИПП.
В клинической практике нередко наблюдается ситуация, когда обращается пациент с симптомами диспепсии, которому ранее не проводилось лечение H. pylori, но в настоящее время он принимает или недавно принимал ИПП, антибактериальные или висмут содержащие препараты. В таком случае для диагностики H. pylori возможно выполнение иммуноферментного анализа крови на антитела к H. pylori класса IgG, остальные методы диагностики будут малоинформативны. Вместе с тем известно, что 28-дневный прием висмута трикалия дицитрата способен в ряде случаев (до 33%) привести к эрадикации H. pylori [ 71 ], поэтому для принятия решения о лечении инфекции следует в плановом порядке провести неинвазивную диагностику (к примеру, 13 С-УДТ) не ранее, чем через 30 дней после проведенной терапии.
Если ранее пациент лечился от H. pylori, и в настоящее время он принимает или принимал ИПП, антибактериальные или висмут содержащие препараты, то достоверная диагностика H. pylori возможна не ранее, чем через 30 дней после завершения приема антибиотиков и препаратов висмута, и не ранее, чем через 2 недели после прекращения приема ИПП. Может быть использован любой тест, за исключением серологического. Если нет показаний для проведения ЭГДС, предпочтительна неинвазивная диагностика.
Лечение инфекции возможно только после ее выявления. После завершения терапии ее успех должен быть доказан. Диагностическая ценность большинства тестов снижается при низкой бактериальной обсемененности, что наблюдается текущем или предшествующем приеме антисекреторных и антибактериальных препаратов, а также при атрофическом гастрите [ 72 ].
Адекватная интерпретация результатов возможна только при условии отмены ИПП за 2 недели, а антибиотиков и препаратов висмута - за 4 недели до проведения теста. Каждый метод имеет свои преимущества, недостатки и ограничения.
Сводная характеристика методов диагностики H. pylori представлена в Таблице 5.
Алгоритм диагностики Н.pylori приведен на Рисунке 8.
Инвазив- ный метод
Неинвазив- ный метод
антибиоти- ков, ИПП, препаратов висмута
первичной диагности- ки
контроля эрадика- ции
Антитела к H. pylori IgG в
Рис.8. Алгоритм диагностики Н.pylori. Адаптировано Malfertheiner P. et al. Gut 2012;61:646-664. Megraud F., Lehours P. Clin microbiol rev. 2007;20(2):280-322.
Хомерики С.Г., Касьяненко В.И., Лабораторная диагностика инфекции H. pylori. СПб, 2011
4.4. Какой метод диагностики Helicobacter pylori выбрать у пациентов с частичной резекцией желудка
Еще одной проблемой является диагностика H. pylori у пациентов с частичной резекцией желудка, этой проблеме уделяется меньше внимания, поскольку эти пациенты представляют собой очень небольшую часть населения в целом.
В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной резекцией желудка, гистология показала лучшие результаты, на втором месте оказался БУТ, в то время как 13С-УДТ имел низкую диагностическую точность. Чувствительность и специфичность гистологического метода, БУТ и 13С-УДТ составляли 93% и 85%; 79% и 94%; 77% и 89% соответственно. Несмотря на то, что 13 C-УДТ является быстрым, безопасным и надежным методом, который способен точно определить инфекцию H. pylori, у пациентов после частичной резекции желудка метод показывает меньшую чувствительность и специфичность. Возможная причина низкой информативности теста может быть обусловлена ускоренной эвакуацией из культи желудка, в результате чего тестовый раствор мочевины недостаточно задерживается по времени в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori, а также низкой бактериальной нагрузкой. Таким образом, гистологический метод будет более предпочтительным, чем остальные для диагностики инфекции H. pylori после частичной гастрэктомии [ 73 ].
Другим альтернативным и надежным методом для выявления H. pylori у пациентов с дистальной резекцией желудка может быть серологический метод. В одном исследовании оценивалась диагностическая точность серологического метода, у пациентов с дистальной гастрэктомией. Чувствительность и специфичность теста выявления антигена H. pylori в кале (HpSA) были 100%, 90,5% соответственно [ 74 ].
Высокая распространенность и этиопатогенетическая связь H. pylori с наиболее значимыми заболеваниями желудка диктует необходимость оптимизации диагностики этой инфекции с учетом чувствительности и специфичности тестов, а также условий их проведения. До назначения терапии инфекция должна быть выявлена, а после лечения – подтвержден его успех. Важно подчеркнуть, что отсутствие оценки эффективности эрадикации H. pylori, с одной стороны, не позволяет документировать достижения цели у конкретного больного, с другой стороны, лишает врача возможности оценить эффективность назначаемых схем лечения в данном регионе. Последнее принципиально важно для критического переосмысления и улучшения клинической практики. Широкий арсенал диагностических тестов при рациональном их применении позволяет успешно решать эти задачи.
Читайте также:


