Все анализы на хеликобактер сомнительные лечить или нет

Хеликобактер: лечить нельзя оставить
Где поставить правильную запятую, если у пациента диагностирована Helicobacter pylori?
Дыхательный тест
Дыхательный тест – пациент дышит в специальные фольгированные мешки либо экзетейнеры. Перед анализом он выпивает препарат, меченый специальным изотопом . Далее наблюдают за реакцией радиоактивной метки. По количеству изотопного состава углерода в выдыхаемом воздухе, сравнивая ее с пробой до принятия изотопного препарата, врачи выясняют, есть ли в организме бактерия Helicobacter pylori. Это информативный и относительно дешевый тест. При отрицательных показателях считается, что бактерии у человека нет, и дальнейшие исследования не проводятся.
Анализ крови на иммуноглобулины G и M (IgG и IgM)
Если анализ крови на IgG к Helicobacter pylori положителен, то это говорит о том, что инфекция либо когда-то присутствовала в организме человека (т.е., человек лечился от хеликобактера ранее, после чего в крови остались антитела), либо человек является её носителем, то есть, заражён Helicobacter pylori. Положительный результат IgG может быть и на момент лечения. Но этот результат может быть, как ложноположительным, так и ложноотрицательным. Если пациент менее чем за 2 недели до сдачи анализа принимал ингибиторы протонной помпы или препараты висмута, то результат IgG может быть недостоверным. Точность этого исследования колеблется в пределах от 75% до 86%.
Эндоскопия
В отношении революционных методов типа капсульной эндоскопии существует некоторый скепсис. Это популярный и комфортный метод, но капсула с микровидеокамерой, проходя через ЖКТ, может не показать все его отделы. В сложных случаях она может застрять в грыжах, выпячиваниях, дивертикулах. А может их и не заметить. Так же с помощью этой капсулы не возможно взять биоптат на исследование.
Что дальше?
Лечение хеликобактера в любом случае – антибактериальное.
Существуют терапии первой линии и второй линии. Кроме того, бывают тройная терапия, которая назначается, если нет дефекта слизистой, и квадротерапия – если есть дефект слизистой (эрозии или язвы). Тогда врач назначает препараты висмута, они обладают местным ранозаживляющим действием.
Может так случится, что лечение терапией первой линии окажется малорезультативным. Обычно при правильном соблюдении рекомендаций врача эффективность терапии первой линии составляет 70-98%. Однако бывают индивидуальная резистентность, противопоказания или побочные эффекты. Например, довольно высокая резистентность к кларитромицину из первой линии, есть специальные схемы и для таких пациентов. Бывает и плохая переносимость препарата, появляется диарея, рвота, металлический привкус во рту. В таком случае кларитромицин можно заменить на левофлоксаци́н или нифурател. Если первые две линии лечения
окажутся неэффективными, то берется посев на чувствительность бактерии к антибиотикам, а терапия подбирается в соответствии с результатами посева. В таком случае говорят, что мы имеем дело с рефрактерной формой Helicobacter pylori.
Приходите к нам еще!
После того, как завершили курс, надо посмотреть, эффективен ли он. Этого не делают в 90% случаев. Через 2 недели после того, как закончили терапию, надо сдать кал на антиген к Helicobacter pylori. Отрицательный – все отлично! Если положительный результат, то при любой, даже минимальной концентрации надо признать, что терапия оказалась неэффективной и подбирать новую.
Неизлечимость Helicobacter pylori – это врачебный миф. По причине того, что пациенты не сдают контрольный анализ, а затем, к примеру, через год возвращаются с теми же жалобами, и вновь им диагностируют Helicobacter pylori, невозможно понять, повторное это заражение или же неэффективная терапия. Helicobacter pylori – это инфекция, микроорганизм. Нет микроорганизма – нет проблемы.
При этом не нужно упускать момента наличия резистентности, по причине которой первая линия терапии может оказаться неудачной. Проблема устойчивости есть, и в этом случае очень важны верная диагностика и обязательный контрольный визит после лечения.
Долгое время при абсолютных показаниях к лечению полагалось обязательно лечиться. К таким показаниям относились: язва желудка, атрофические изменения его слизистой у пациента, лимфома и рак желудка у кровных родственников. Все остальное считалось относительными показаниями, которые нужно было просто контролировать. Но эту тактику изменил Киотский глобальный консенсус по Helicobacter pylori-ассоциированным состояниям, который состоялся в 2015 году. Эксперты консенсуса признали онкогенность бактерии и теперь, оценивая все возможные риски осложнений от антибактерильной терапии, при обнаружении Helicobacter pylori рекомендуется проводить ее обязательную эрадикацию.
Эта бактерия может долго жить в организме, вызывать не только язвы и эрозии, требующие длительной терапии, но ее также в большой концентрации считают предраковым состоянием, вызывающем сперва атрофические гастриты, а потом и онкологию.
Другое дело, если у человека диагностирована язва, но наличие Helicobacter pylori под вопросом.
Действия врача при выборе терапии должны быть обоснованы. Стандарт при обнаружении язвы – противоязвенная терапия плюс определить, есть ли у пациента Helicobacter pylori.
В качестве врачебной ошибки и последствий бесконтрольного лечения антибиотиками можно привести пример, когда по телевизору активно рекламировался один из препаратов висмута.
У этого препарата нет прямого противомикробного действия, его назначали при язвах, гастритах, как ранозаживляющее. Но были исследования, подтверждающие, что в 3% он убивает Helicobacter pylori. И его стали рекламировать с такой точки зрения. Пациенты стали верить, что он убивает бактерию, и начали массово, бесконтрольно его применять.
Такая тактика лечения и самолечения и порождает мифы о неизлечимости Helicobacter pylori как таковой.
Самое главное, чтобы пациент не занимался самолечением и самодиагностикой, и при любых симптомах патологии желудочно-кишечного тракта обязательно обращался к специалисту-гастроэнтерологу.
Helicobacter pylori – это бактерия, в норме живущая в желудочно-кишечном тракте у многих людей. При благоприятных условиях колонии хеликобактер пилори увеличиваются, вызывая патологии желудка и кишечника. Перед тем, как назначить курс лечения, врач должен убедиться в наличии патогенных микроорганизмов в ЖКТ, уточнить уровень их концентрации.
Анализ на хеликобактер пилори назначается при болезненных ощущениях и дискомфорте в области желудка перед приемом пищи. Хеликобактериоз провоцирует развитие серьезных поражений слизистых оболочек. Своевременное обнаружение инфекции и её ликвидация позволяют избежать развития серьезнейших раковых образований и других нарушений здоровья.
Данный анализ даёт общее представление о возбудителе инфекции, поскольку на сегодняшний день считается одним из самых точных. Представленные спиралевидные микроорганизмы обитают зачастую в нижнем отделе желудка, а также в двенадцатиперстной кишке. Такие анаэробные микробы мгновенно погибают на воздухе. Зачастую заболевание передается от инфицированного человека к здоровому через слизь и слюну, а также бытовым путем. Попав в новый организм, бактерии спускаются непосредственно в желудок.
Содержащаяся в желудке соляная кислота такой вид микроорганизмов не уничтожает. Бактерии зарываются в слизистые оболочки желудка, без труда нарушая структуру тканей, что приводит к неполноценному функционированию. Такая потенциальная опасность вызывает серьезные воспалительные процессы, эрозии и язвы. Помимо этого хеликобактер пилори способны изменять местную кислотность желудка.
Данные микроорганизмы легко распространяются по всему желудку при ослабленном иммунитете человека и при длительном существовании.
Своевременная диагностика позволяет избежать многих опасных последствий. При любых симптомах желудочного недомогания специалист назначит анализ на хеликобактер пилори. Многие пациенты жалуются на проблемы в системе пищеварения. К ним можно отнести повторяющиеся острые боли в области желудка, появление изжоги, ощущение тяжести и неприятие мясной жирной пищи. Как правило, при хеликобактериозе сильные боли проходят сразу же после приема пищи.
Показания к сдаче анализа

Сложно представить, чтобы человек, не имеющий симптомов заболевания, отправился на полномасштабное обследование без всякой необходимости.
Симптомы, предрасполагающие к сдаче анализов на Helicobacter pylori:
Гастралгия (боль в желудке и кишечнике) различной интенсивности. Появляются во время еды или после нее, вызваны дефицитом ферментов и нарушением переваривания пищи и ее застоем в желудке.
Интенсивная изжога. Возникает из-за обратного заброса агрессивного желудочного сока в не предназначенный для этого пищевод, при частых повторениях является симптомом патологии.
Чувство тяжести, возникающее даже после приема минимальных порций еды. У больного возникает ощущение переполненного желудка.
Частая тошнота, не вызванная объективными причинами (например, токсикозом беременности).
Сочетание боли в желудке с рвотой и отсутствием возможности есть и пить.
Небольшой дискомфорт в проекции желудка, ухудшение аппетита, легкая тяжесть. Часто проявляются на начальной стадии хелиобактериоза.
Наличие слизи в кале.
Любой из этих симптомов – повод для немедленного обращения к врачу для обследования и лечения.
Подготовка к анализу

Для получения объективных показателей нужно тщательно готовиться к сдаче анализов на Helicobacter pylori.
Необходимые подготовительные мероприятия:
Полный отказ от курения за сутки до сдачи анализов. Никотин негативно влияет на слизистую желудка, искажая результаты анализов.
Полный отказ от спиртного. Причина та же.
Запрет на употребление чая и кофе, негативно влияющих на состояние ЖКТ.
Временное ограничение на прием пищи в течение 8 часов до анализа.
Поскольку кровь для анализа на хеликобактер берется из вены на голодный желудок, можно взять с собой в поликлинику немного еды и воду.
Виды анализов и диагностик
Для изучения состояния организма существует несколько методик. Каждая из них имеет свои особенности.
Иммуноферментный анализ назначают, чтобы оценить уровень концентрации антител к хеликобактер пилори в крови пациента. Если в крови имеются антитела к бактерии, значит, иммунитет выработал их не менее 1-2 недель назад. Если реакция организма еще не сформирована, возможен ложноотрицательный результат.
Причины ложноположительных результатов:
ошибка лаборанта, проводившего исследование;
недостаточно времени прошло после эрадикции, так как антитела находятся в крови спустя некоторое время после полного излечения.
Положительный результат ИФА свидетельствует о необходимости полного обследования, изучения результатов расширенного анализа крови, дающего больше информации о состоянии организма.

В организме человека при проникновении в него инфекций или патогенных микроорганизмов вырабатываются иммуноглобулины – белки клеток крови, противостоящие чужеродным вирусам. При заражении хелиобактериозом организм человека вырабатывает иммуноглобулины LgG, LgM, LgA, активно противостоящие Helicobacter pylori. При их обнаружении в крови человека следует делать вывод о том, что он болен хелиобактериозом.
Особенность иммуноглобулинов состоит в том, что в погоне за патогенными клетками они настигают их в любом месте организма человека. Эти белки вырабатываются после освоения бактериями желудочно-кишечного тракта.
Пониженный или отрицательный уровень содержания иммуноглобулина LgG говорит об одном из следующих вариантов: бактерия отсутствует в организме и вероятность развития язвенной болезни низка, или с момента заражения прошло всего 3-4 недели. При болях в ЖКТ нужно через неделю повторить обследование.
Повышенный или положительный уровень иммуноглобулина LgG говорит об одном из двух вариантах: бактерия присутствует в организме, повышая риск развития рака и язвы желудка, или человек совсем недавно вылечился от хелиобактериоза.
Пониженный уровень содержания иммуноглобулина LgM, обычно обнаруживаемый сразу же после инфицирования, или его отсутствие, совершенно точно говорит об отсутствии бактерий, так как этот белок обнаруживается в ранний период после заражения.
Повышение уровня LgM свидетельствует о том, что ЖКТ находится на ранней стадии инфицирования, и он почти не поврежден инфекцией.
Результаты исследования полимеразной цепной реакции могут зафиксировать в крови образцы ДНК Helicobacter pylori, что ставит ПЦР-тест на первое место среди всех методов диагностики. Положительный результат теста доказывает наличие бактерии в организме, отрицательный – ее отсутствие. Единственное, что недоступно при выполнении анализ крови на ПЦР – определение времени внедрения бактерии в организм.
Если перед взятием крови на анализ проводилась антибактериальная терапия, или лечение антисептиками, результаты исследования не будут объективными. Расшифровку анализов крови лучше доверить специалисту, хотя серьезные лаборатории вкладывают в результаты таблицу нормы и отклонений от нее.
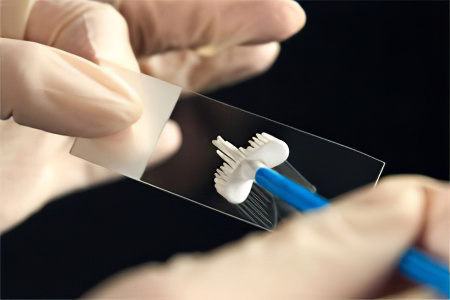
При выполнении этого тестирования во время проведения эндоскопии берут мазки со слизистой антрального отдела желудка. Область взятия мазка – места отека и гиперемии, но не эрозии и не язвы. После взятия отпечатков врач-лаборант высушивает и окрашивает мазки.
При исследовании под микроскопом можно обнаружить Helicobacter pylori в виде спирали или в виде крыльев летящей чайки.
Референсные значения цитологии:
(+) - слабый уровень обсемененности (до 20 микробных тел);
(++) – средний уровень (до 40 микробных тел);
(+++) – высокий уровень (свыше 40 микробных тел при 360-кратном увеличении).
Дополнительно при наличии воспаления выявляют клеточный инфильтрат: (эозинофилия, нейтрофилия, лимфоциты, плазматические клетки). Дополнительно можно обнаружить дисплазию, пролиферацию, метаплазию, злокачественные новообразования.
Исследование выполняется после взятия биоптата слизистой во время эндоскопии. Его помещают в гель-носитель, содержащий мочевину, индикатор pH, бактериостатический агент. Выводы делают на основании перемены цвета биоптата в диапазоне от желтого оттенка до малинового цвета.
Малиновая окраска появилась в первый час – выраженная инфекция (+++);
В первые 2 часа – умеренный уровень инфицирования (++);
К концу суток – незначительный уровень инфекции (+);
В более поздние сроки – норма или отрицательный результат.
При слабом уровне инфицирования может быть зафиксирован ложноотрицательный результат. Для повышения достоверности его сочетают с гистологическим методом.
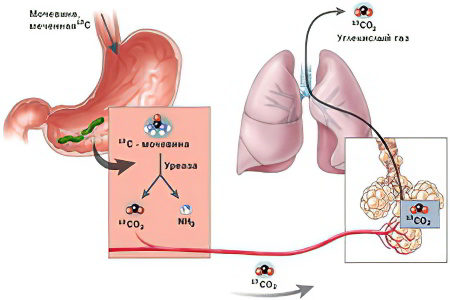
При проведении этого тестирования нужно взять натощак фоновые пробы выдыхаемого воздуха. После легкого завтрака в виде сока или молока обследуемый выпивает водный раствор мочевины, меченой 13C, так называемый тестовый раствор. Затем через каждые 15 минут производят забор 4 финальных проб.
Анализ теста на основании наличия стабилизированного изотопа при использовании масс-спектрометра:
Легкая степень инфицирования – менее 3,5%;
Средняя степень – 3,5-6,4%;
Тяжелая степень – 6,5-9,4%;
Очень тяжелая степень – свыше 9,5%.
Норма Helicobacter pylori при уреазном тесте – 1%.
Анализ основан на определении титра антител – иммуноглобулинов класса G. В норме они при попадании хеликобактер в организм связывают микроорганизмы, останавливая их болезнетворное влияние. Исследование проводится методом иммуноферментного анализа после взятия крови из вены в стерильную пробирку. Перед исследованием нельзя есть на протяжении 8 часов, пить кофе и алкоголь, курить. Для изучения динамики анализ проводят на протяжении всего периода лечения.
Расшифровка результатов анализа

Несмотря на то, что расшифровку показателей нужно доверить врачу, направившему на обследование, все пациенты хотят самостоятельно узнать свои результаты.
Сколько норма хеликобактер пилори? Норма содержания бактерий при тестировании венозной крови:
Антитела IgG к хеликобактер пилори
Метод основан на том, что после попадания в организм бактерии хеликобактер развивается местный и системный ответ. Он заключается в нарастании титра иммуноглобулина IgM, IgG-, IgA-антител в сыворотке крови. В 100% случаев инфицирования обнаруживают IgG-иммуноглобулин, в 65-80% случаев – IgA, в 17-20% - IgM, поэтому точную диагностику проводят путем определения концентрации IgG в сыворотке крови.
Не требует проведения эндоскопии, поэтому метод безопасен;
Используется для профилактики первичного инфицирования.
Метод может быть не точен при определении титра иммуноглобулина у пожилых людей, так как у них понижена выработка антител, а так же у тех пациентов, кто принимает цитостатики. После терапии хелиобактериоза этот метод тоже не эффективен, потому что в крови уровень гормона после лечения антибиотиками еще 6 месяцев остается достаточно высоким.
Показания к использованию:
Жалобы пациента на диспепсию при невозможности провести эндоскопию;
Первичная диагностика хелиобактериоза;
Мониторинг эффективности лечения антибактериальными препаратами.
Референсные значения проведенного обследования: концентрация IgG-иммуноглобулина от 0 до 0,9, результат отрицательный. Это может означать отсутствие инфекции или высокую результативность терапии.
Если хеликобактер пилори положительный - что это значит?
Положительный результат теста доказывает наличие бактерии в организме, отрицательный – ее отсутствие. Не всегда положительные показатели свидетельствует о заболевании хелиобактериозом. Чаще всего – это признак наличия бактерии в организме. Однако сразу же после эрадикции Helicobacter pylori анализ на ее содержание в организме все равно будет положительным, несмотря на отсутствие бактерии – антитела в крови не исчезают быстро. Именно они дают ложноположительный результат, поэтому анализ следует брать не ранее, чем через месяц после лечения.
Это единственное исключение из правила: положительный результат на Helicobacter означает наличие заболевания или носительство бактерии.
Результаты анализа кала на хеликобактер пилори
После изучения материала, предоставленного пациентом, можно абсолютно точно ответить на вопрос, имеется ли Helicobacter pylori в его организме, или нет, то есть, анализ кала относится к качественным.
Определение антигена хеликобактер пилори в кале

Исследование выполняется методом полимеразной цепной реакции (ПЦР). Его точность составляет 95%, определение присутствия бактерии таким способом рекомендуется у детей, у пожилых и тяжелобольных пациентов.
Чтобы результат анализа был объективным, к исследованию нужно подготовиться:
В течение 4 недель до исследования не принимать антибиотики;
За 3 суток до исследования не есть продукты, окрашивающие кал: красное виноградное вино, свекла, виноград, черная смородина;
Перед исследованием за 2-3 дня исключить из меню продукты с грубой клетчаткой: отруби, редис, капусту, морковь, свеклу;
Не использовать лекарственные средства, усиливающие перистальтику жкт.
Для исследования достаточно заполнить на треть стандартный контейнер для сбора анализов. Нельзя брать кал из унитаза, так как он может нести на себе следы моющего средства. Желательно хранить контейнер с биоматериалом не дольше 10-12 часов при температуре от +2 до -8°C.
Helicobacter pylori IgM и IgA — что это?
Иммуноглобулины класса M – это белки крови, ранее других иммунных фракций реагирующие на появление в организме бактерии хеликобактер, их можно зафиксировать в крови на ранней стадии.
Положительный результат анализа на наличие иммуноглобулина IgM возникает при нарастании титра антител при инфицировании хелиобактериозом;
Положительные показатели содержания IgA – показатель активного процесса внедрения бактерии в слизистую оболочку желудка и ее воспаления.
У здорового человека эти показатели отсутствуют или имеются в минимальных количествах.

Проблемы с желудком доставляют огромный дискомфорт и подчас мешают вести привычный образ жизни. Боли в области живота, тошнота, отрыжка, тяжесть в желудке способны разрушить любые планы и надолго выбить из колеи. Ситуация серьезно осложняется, если такие явления обретают хронический характер. В чем может крыться причина желудочных расстройств и как ее устранить? Давайте в этом разберемся.
Что такое хеликобактер пилори и зачем нужен анализ
Очень часто проблемы с желудком вызывает коварная бактерия — хеликобактер пилори ( Helicobacter pylori ). Она имеет спиралевидную форму, является патогенной бактерией-паразитом, производит множество токсинов, поражающих слизистую оболочку желудка и двенадцатиперстной кишки — именно в этих органах она обитает. Хеликобактер пилори приводит к воспалительным процессам, таким как гастрит, язва и ряду других, появление которых еще не так давно объясняли генетической предрасположенностью и нарушением здорового питания. Доказано, что в ряде случаев гастрит и язва вызваны именно инфицированием этой бактерией. То есть этими заболеваниями, оказывается, можно так же легко заразиться, как и гриппом.
Причем если большинство бактерий гибнет в кислой желудочной среде, то хеликобактер пилори в ней очень даже жизнеспособна. Она легко приспосабливается к агрессивной среде и без особого труда передвигается по стенкам внутренних органов благодаря специальным жгутикам на ее поверхности.
В России распространенность бактерии очень велика — в разных регионах инфицировано от 70 до 90% населения, что значительно выше показателей Европы и США. Это объясняется сравнительно низким уровнем жизни большинства россиян, как следствие — пренебрежение правилами гигиены, проживание в антисанитарных условиях. В Москве, как наиболее развитом городе России, количество инфицированных не превышает 60% (речь идет о зарегистрированных гражданах).
Как правило, поводом для назначения анализа на хеликобактер пилори становятся следующие симптомы:
- Боли в желудке после приема пищи.
- Частая отрыжка.
- Повторяющаяся изжога.
- Затруднение во время глотания пищи.
- Метеоризм и урчание в животе.
- Тошнота и рвота.
- Частая диарея и запоры, длящиеся более двух суток.
- Нарушение аппетита и потеря веса без видимой причины.
- Появление крови во время рвоты и дефекации.
Разумеется, перечисленные симптомы вовсе не указывают на инфекцию. Подтвердить или опровергнуть ее присутствие может только лабораторный анализ.
Выявить присутствие коварной бактерии в организме можно разными способами.
Этот анализ является качественным, то есть отвечает на вопрос, есть ли хеликобактер пилори в организме или нет. Исследование проводится в лаборатории методом полимеразной цепной реакции (ПЦР). Анализ отличается высокой точностью — до 95%. Данный анализ является самым простым видом диагностики. Его рекомендуют детям, пожилым людям и тяжелобольным пациентам.
Точность результатов исследования зависит не только от лаборатории, но и от соблюдения ряда простых правил подготовки к анализу.
Кал собирают в специальный контейнер, купленный в аптеке. Если контейнер будет заполнен на 1/3, этого будет достаточно для анализа. Ни в коем случае нельзя брать кал из унитаза — в биоматериал могут попасть дезинфицирующие средства. Доставить материал в лабораторию для анализа нужно как можно быстрее. Максимальное время его хранения — 10–12 часов при температуре +2…-8 градусов Цельсия.
Накануне анализа следует избегать физических и эмоциональных нагрузок, отказаться от алкоголя и жирной пищи. Кровь берут из вены натощак в утренние часы. Сама по себе процедура достаточно безболезненна и длится всего несколько минут. Однако пациенты по-разному ее переносят. Поэтому если организм ослаблен, то сразу после забора крови рекомендуется выпить сладкий чай или съесть кусочек черного шоколада — это поможет избежать головокружения. Чтобы не образовалась гематома на месте ввода иглы, после процедуры руку нужно несколько минут подержать согнутой в локте.
Результаты анализов на хеликобактер пилори может интерпретировать только врач, он же ставит окончательный диагноз и назначает подходящую терапию. Однако некоторые выводы можно сделать и самостоятельно изучив бланк с результатами.
- Иммуноферментный анализ. Результаты анализа на антитела готовятся в течение одного дня, не считая дня сдачи анализа. При необходимости возможна срочная подготовка результатов, она займет всего 2–3 часа. В разных лабораториях могут использоваться разные единицы измерения. Одна из наиболее распространенных — Ед/мл.
Результаты трактуются следующим образом:
>1,1 Ед/мл
Высокий риск развития язвенной болезни или язвенная болезнь; высокий риск развития рака желудка.
0,9–1,1 Ед/мл
Рекомендуется повторный анализ через две недели.
Бактерия хеликобактер пилори — своеобразная темная лошадка, на сегодняшний день мало изученная и тем — более опасная. До сих пор остается множество открытых вопросов: почему некоторые инфицированные люди заболевают язвой или гастритом, а другие — нет; насколько присутствие этой бактерии в организме увеличивает риск развития рака желудка? Очевидна необходимость разработки вакцины для профилактики инфекции, поиск антибиотиков направленного действия, убивающих бактерию, — ведь у некоторых людей развивается резистентность к существующим видам терапии. Единственное, что мы можем наверняка сделать во благо своему здоровью, — сдать профилактический анализ.
В статье представлены результаты бактериологического тестирования 48 штаммов Helicobacter pylori (H. pylori), выделенных от пациентов в Санкт-Петербурге. Антибиотикорезистентность штаммов H. pylori оценивали методом серийных разведений. Среди анализируемы
The article describes the results of bacteriologic testing of 48 Helicobacter pylori (H. pylori) strains taken from the patients in Saint-Petersburg. Antibiotic resistance of H. pylori strains was evaluated by serial breeding method. Among the analysed isolates, 42,5% were resistant to metronidazole, 27,1% — to levofloxacin, 25% — to clarithromycin, 6,3% — to amoxicillin. All the tested strains were sensitive to tetracycline.
Эрадикация H. pylori у инфицированных пациентов, страдающих хроническим гастритом, язвенной болезнью, функциональной диспепсией и другими H. pylori-ассоциированными заболеваниями, является основной стратегией предотвращения развития некардиального рака желудка [1]. В любой клинической ситуации, при которой врач сомневается в необходимости диагностировать инфекцию H. pylori и провести уничтожение микроорганизма, дополнительным и крайне актуальным аргументом в пользу этих мероприятий должен стать профилактический эффект эрадикации относительно возникновения рака желудка, особенно у пациентов с отягощенным наследственным анамнезом [2].
Целью данной работы было получение данных о состоянии первичной антибиотикорезистентности штаммов H. pylori, выделенных от пациентов в Санкт-Петербурге.
Исследование по протоколу SHELF проводилось в Санкт-Петербурге с мая 2013 по июнь 2014 года. Одобрение было получено в центральном и локальном научном этическом комитете в соответствии с принципами Хельсинкской декларации. В исследовании использовались гастробиоптаты пациентов, соответствующих следующим критериям.
Критерии исключения:
1) пациенты, ранее получавшие антимикробную терапию для эрадикации H. pylori;
2) пациенты, получавшие антибиотики из группы макролидов в течение одного года, предшествовавшего данному исследованию;
3) пациенты, участвующие в любых других клинических исследованиях;
4) пациенты, получавшие ингибиторы протонного насоса и препараты висмута в течение двух недель, предшествовавших данному исследованию;
5) больные, принимающие антибактериальную терапию на момент забора материала.
Критерии включения:
1) мужчины и женщины в возрасте от 18 до 65 лет;
2) пациенты с инфекцией H. pylori, подтвержденной быстрым уреазным тестом гастробиоптата, полученного при проведении эзофагогастродуоденоскопии (ЭГДС);
3) решение врача в рамках рутинной клинической практики и диагноза пациента провести ЭГДС с забором биоптата.
В качестве основы питательной среды для выделения и культивирования H. pylori использовался колумбийский агар. Каждый образец биопсии высевался параллельно на две чашки Петри с агаром, содержащим антибиотики в следующих концентрациях: ванкомицин в концентрации 6 мкг/мл, триметоприм, в концентрации 2 мкг/мл (растворяли в спирте) и амфотерицин В (или налидиксовую кислоту) в концентрации 2–10 мкг/мл.
Инкубация посевов осуществлялась в микроаэрофильных условиях при содержании кислорода около 5%. Для этих целей использовались анаэростаты системы GasPac100 c газогенерирующими пакетами типа GasPak (BBL CampyPak Plus Microaerophilic System envelopes with Palladium Catalyst).
На кровяной питательной среде на 5–7 сутки H. pylori формировал мелкие, круглые, гладкие, прозрачные, влажные колонии диаметром около 1 мм. Колонии H. pylori, полученные в результате первичного посева биопсийного материала, использовали для приготовления мазков, окраски их по Граму и постановки уреазного теста.
Решение вопроса о принадлежности выделенной культуры к роду Helicobacter выносили на основании характерной морфологии выделенных колоний, а также набора тестов: морфологии культуры в мазке, окрашенном по Граму, и наличии характерных биохимических свойств (способности к продукции уреазы). Типичные клетки H. pylori при микроскопии имели вид тонких изогнутых нежно-розовых палочек.
Антибиотикорезистентность выделенных штаммов H. pylori изучали, используя метод серийных разведений, который основан на регистрации ингибиции роста микроорганизма на питательном агаре, содержащем определенные концентрации антибиотика. Определяли чувствительность штаммов H. pylori к кларитромицину, амоксициллину, левофлоксацину, метронидазолу и тетрациклину. Рабочие концентрации исследуемых антибактериальных препаратах в агаре были следующими:
- амоксициллин — 0,25; 0,12; 0,06 мкг/мл;
- кларитромицин — 1,0; 0,5; 0,25; 0,12 мкг/мл;
- левофлоксацин — 2,0; 1,0; 0,5 мкг/мл;
- метронидазол — 16; 8; 4 мкг/мл;
- тетрациклин — 2,0; 1,0; 0,5 мкг/мл.
Среды и растворы антибактериальных препаратов готовили непосредственно перед использованием.
На чашки Петри с ростом H. pylori добавляли по 1–2 мл стерильного физиологического раствора и снимали бактериальную массу. Инокулюм наносили бактериологической петлей на поверхность чашки Петри с селективной кровяной средой с определенной концентрацией антибиотика, равномерно распределяя по поверхности. Затем чашки Петри помещали в анаэростат и инкубировали при температуре 37 °С в течение 3–5 суток. После окончания инкубации отмечали чашку с концентрацией антибактериального препарата, вызывающей полное подавление роста микробов. Контроль чистоты роста культуры оценивали по посеву на чашку Петри с селективной кровяной средой без добавления антибиотиков.
Данный метод позволил подразделить штаммы H. pylori на чувствительные и устойчивые [9]. Критерии распределения штаммов по степени чувствительности приведены в табл. 1.
На каждого пациента, гастробиоптат которого использовался в исследовании, заполнялась индивидуальная регистрационная карта (ИРК), которая дублировалась в базе данных Microsoft Access Database и содержала демографические, анамнестические данные, результаты проведенных исследований.
Статистический анализ выполнялся с помощью программного пакета IBM® SPSS® Statistics, версия 21.0.
Демографические и анамнестические показатели анализировались с помощью методов описательной статистики. Для дихотомических показателей резистентности были представлены 95% доверительные интервалы для долей резистентности к тому или иному антибиотику. Подобный статистический анализ проводился в отношении выявления наличия H. pylori и выявления резистентности к антибиотикам.
В исследовании использовались гастробиоптаты 109 пациентов в возрасте от 18 до 64 лет. Возраст, пол и диагноз пациентов представлены в табл. 2.
У пациентов были диагностированы различные заболевания, ассоциированные с H. pylori. Наиболее частой нозологией являлся хронический гастрит — 78,9% (n = 86). Язвенная болезнь двенадцатиперстной кишки (ДПК) диагностирована у 20,2% (n = 22), а язвенная болезнь желудка — у 0,9% (n = 1).
Инфицирование H. pylori было подтверждено у всех пациентов уреазным тестом. Бактериологическим методом микроорганизм выделен лишь у 56 пациентов, что составило 51,4% (95% ДИ: 42,0%, 60,8%). Такой процент отражает технические трудности, связанные с транспортировкой и культивированием микроаэрофильного микроорганизма.
Чувствительность H. pylori к антимикробным препаратам удалось определить у 48 выделенных штаммов. Из-за скудного роста культуры в 8 случаях оценить антибиотикограмму было невозможно.
Таким образом, в анализ резистентности были включены 48 штаммов хеликобактера, выделенных от 48 пациентов. Среди анализируемых изолятов H. pylori штаммов, 17 (42,5%) были резистентны к метронидазолу, 13 (27,1%) — к левофлоксацину, 12 (25%) — к кларитромицину. Кроме того, было выявлено 3 (6,3%) штамма, устойчивых к амоксициллину. Все тестируемые штаммы были чувствительны к тетрациклину. В случаях выявления резистентности к трем и более группам антимикробных препаратов, штамм хеликобактера относили к полирезистентным. В ходе исследования 5 (11,1%) микроорганизмов были полирезистентными (табл. 3).
Двойная резистентность к кларитромицину и метронидазолу обнаружена у 2 (4,4%) изолятов, метронидазолу и левофлоксацину — у 4 (8,3%) микроорганизмов. Все штаммы, резистентные к амоксициллину, были устойчивы к кларитромицину.
Частота встречаемости резистентных штаммов отличалась среди мужчин и женщин, однако данный факт сложно интерпретировать из-за малой выборки (табл. 4).
При анализе частоты резистентности к кларитромицину выявлены различия по нозологиям. Так, у 14 пациентов, страдающих язвенной болезнью, было 5 (35,7%) случаев выделения штаммов H. pylori, резистентных к кларитромицину. В то же время у 34 больных, у которых был диагностирован только хронический гастрит, частота выделения резистентных штаммов к кларитромицину была ниже — 7 (20,6%). Однако этот факт сложно интерпретировать из-за ограниченного числа наблюдений.
Согласно Маастрихтским рекомендациям IV пересмотра, уровень резистентности H. pylori к кларитромицину в популяции является определяющим фактором при выборе схемы эрадикации [10]. Подобно другим патогенам, хеликобактер имеет региональные особенности резистентности. Резистентность напрямую коррелирует с частотой назначения антимикробных препаратов и утвержденными протоколами выбора антибиотиков [11]. Невозможно экстраполировать данные о резистентности, выявленные в одной стране, на другую, в силу значительных региональных различий чувствительности микроорганизмов. Так, резистентность к кларитромицину в Нидерландах составляет всего 5,6%, тогда как резистентность H. pylori к данному антибиотику в Австрии достигает 35,4% [11]. Уровень устойчивости к метронидазолу в Пекине составил 63,9%, а на Юго-Восточном побережье Китая — 95,4% [16, 17]. Для анализа антибиотикорезистентности H. pylori в мире нами были отобраны наиболее масштабные исследования, проводимые с 2000 по 2013 год. Проанализировано 13 исследований, из которых 3 европейских, 5 азиатских, 2 африканских и 3 американских. Более подробно уровень резистентности к антибиотикам H. pylori в различных странах приведен в табл. 5.
При анализе результатов исследований по антибиотикорезистентности H. pylori на территории России обращает на себя внимание рост уровня резистентности H. pylori к кларитромицину. Так, в 1996 г. в г. Москве не было выявлено резистентных штаммов к кларитромицину. Уже в 1999 г. уровень резистентности H. pylori к кларитромицину составил 17,1%, в 2000 г. 16,6%, в 2001 г. 13,8%, а в 2005 г. уже 19,3% [24, 25]. При интерпретации показателей резистентности важно учитывать методику определения чувствительности. Так, при использовании только генотипического метода полимеразной цепной реакции (ПЦР) возможны сложности в интерпретации результатов. Примером могут служить данные, полученные в Санкт-Петербурге — 39–40% резистентных штаммов по данным ПЦР [26, 27]. В то же время резистентность к кларитромицину при оценке дискодиффузионным методом, который тоже имеет определенные ограничения, составила всего 7,7% [28].
Наибольшую информативность представляют данные о резистентности, полученные методом серийных разведений. На основании тестирования 133 штаммов методом серийных разведений сделан вывод о низкой резистентности в Смоленске в 2010 г. [29]. В нашем исследовании, при использовании сходной технологии тестирования, резистентность составила 25%, что еще раз иллюстрирует межрегиональные различия чувствительности микроорганизмов.
Фенотипический метод определения чувствительности к антибиотикам рекомендован Институтом по клиническим и лабораторным стандартам (CLSI), EUCAST, а также Маастрихтским соглашением IV пересмотра в качестве основного метода определения чувствительности H. pylori к кларитромицину [38]. Культуральный метод является высокоспецифичным тестом, однако характеризуется низкой чувствительностью [39]. Определение чувствительности H. pylori к антибиотикам в нашей стране сопряжено с рядом трудностей. Успех бактериологического выделения H. pylori во многом связан с правильностью отбора биопсийных образцов и соблюдением условий транспортировки материала в лабораторию. Хеликобактер является труднокультивируемым микроорганизмом, что требует не только навыков работы с его чистой культурой, но и четкого соблюдения методики разведения рабочих концентраций исследуемых антибактериальных препаратов. Учитывая объективные сложности, описанные выше, становится понятным отсутствие широко представленных данных об истинном состоянии антибиотикорезистентности в различных регионах нашей страны. Большинство исследователей в своих суждениях об антибиотикорезистентности H. pylori опираются на метод ПЦР как единственную доступную альтернативу бактериологическому методу, который позволяет определить генетические мутации H. pylori и прогнозировать фенотипическую резистентность [7].
Такая стратегия была использована нами для лечения пациентов, гастробиоптаты которых использовались в данном исследовании. Применение стандартной тройной терапии с двойной дозой ингибиторов протонного насоса, усиленной препаратом висмута трикалия дицитрата, привело к уничтожению H. pylori у 93,2% пациентов, несмотря на выявленную высокую резистентность к кларитромицину [44].
На основании проведенного бактериологического исследования антибиотикорезистентности штаммов H. pylori можно сделать следующие выводы и рекомендации:
Полученные данные о резистентности H. pylori в Санкт-Петербурге делают актуальным использование всех возможностей для повышения эффективности стандартного подхода: двойные дозы ингибиторов протонного насоса, увеличение длительности с 7 до 10–14 дней, добавление препаратов висмута и пробиотиков, поиск новых стратегий эрадикации.
Литература
За остальным списком литературы ? обращайтесь в редакцию.
В. И. Симаненков* , 1 , доктор медицинских наук, профессор
Н. В. Захарова*, доктор медицинских наук, профессор
А. Б. Жебрун**, доктор медицинских наук, профессор, член-корреспондент РАН
А. В. Сварваль**, кандидат медицинских наук
И. В. Савилова*
Р. С. Ферман**
* ГБОУ ВПО СЗГМУ им. И. И. Мечникова, Санкт-Петербург
** НИИ ЭиМ им. Пастера, Санкт-Петербург
Читайте также:


