Аномальный дренаж легочных вен.
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Корниенко Н.А. 1 Чаплыгина Е.В. 1 Каплунова О.А. 1 Корниенко А.А. 2 Каракозова Е.А. 1 Балышев О.О. 1 Марайкин В.О. 1
2 ГБУ РО «Ростовская областная клиническая больница», отделение хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции»
Знание развития легочных вен облегчает понимание морфофункциональных особенностей пациентов с различными формами транспозиции легочных вен, механизмов формирования обструкции легочного венозного кровотока и нарушения гемодинамики, что актуально для совершенствования лечения и повышения качества жизни пациентов. Цель работы – на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий. На основании изучения данных литературы систематизированы имеющиеся сведения об аномалиях развития легочных вен, уточнены основные этапы развития легочных вен в антенатальном периоде развития. Процесс, в котором недифференцированная спланхническая легочная сеть консолидирует в легочные вены, объясняет большинство их вариантов и аномалий. Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития – от незаращения овального отверстия до сложных пороков развития, включающих аномальный дренаж легочных вен, когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.

1. Чаплыгина Е.В., Корниенко Н.А., Каплунова О.А., Корниенко А.А. Особенности анатомического строения задненижнего отдела правого предсердия у людей различных конституциональных типов // Морфология. 2013. Т. 144. № 6. С. 33-36.
4. Eidem B.W., Cetta F., O′Leary P.W. Echocardiography in Pediatric and Adult Congenital Heart Disease. Philadelphia, 2009. 500 p.
5. Русаков Д.Ю., Вологдина Н.Н., Тулаева О.Н. Развитие исчерченной сердечной мышечной ткани в стенках полых и легочных вен // Журнал анатомии и гистопатологии. 2015. Т. 4. № 3. С. 105-105. DOI: 10.18499/2225-7357-2015-4-3-105-105.
7. Farmer C.G. Evolution of the vertebrate cardio-pulmonary system. Annu Rev Physiol. 1999. Vol. 61. P. 573–592. DOI: 10.1146/annurev.physiol.61.1.573.
8. Van den Berg G., Moorman A.F.M. Development of the Pulmonary Vein and the Systemic Venous Sinus: An Interactive 3D Overview. PLoS One. 2011. Vol. 6. no 7. Р. e22055. DOI: 10.1371/journal.pone.0022055.
9. Ho M.-L., Bhalla S., Bierhals A., Gutierrez F. MDCT of partial anomalous pulmonary venous return (PAPVR) in adults. Journal of Thoracic Imaging. 2009. Vol. 24. no 2. P. 89-95. DOI: 10.1097/RTI.Ob013e318194c942.
10. Kirklin J.W., Barratt-Boyes B.G. Total anomalous pulmonary venous connection. In Kirklin J.W., Barratt-Boyes B.G. (eds). Cardiac Surgery. Fourth Edition. Saunders. 2013. P. 1182-1208.
11. Haghigh Z.O., Sadeghpour A., Alizadehasl A. Isolated right sided anomalous pulmonary venous connection associated with significant right ventricular enlargement and intact interatrial septum. J. Cardiovasc Thorac Res. 2012. Vol. 4. no 4. P. 123-124. DOI: 10.5681/jcvtr.2012.029.
12. Podzolkov V.P., Chiaureli M.R., Kovalev D.V., Zaets S.B. Repair of isolated partial anomalous pulmonary venous connection of the right upper pulmonary veins to the left vertical vein. Interactive CardioVascular and Thoracic Surgery. 2016. Vol. 23. no 3. P. 501-502. DOI: 10.1093/icvts/ivw151.
14. Клинические рекомендации. Тотальный аномальный дренаж легочных вен. МКБ 10: Q26.2. Ассоциация сердечно-сосудистых хирургов России. 2016.
15. Клинические рекомендации: Частичный аномальный дренаж легочных вен (ЧАДЛВ), МКБ 10: Q26.3. Ассоциация сердечно-сосудистых хирургов России. 2016.
16. Schmiady M., Valsangiacomo-Buechel E., Hübler M., Dave H. Significance of preoperative imaging in children with total anomalous pulmonary venous connection. European Heart Journal. 2017. Vol. 38. Is. 26. P. 2040. DOI: 10.1093/eurheart/ehw515.
17. Graig J.M., Darling R.C., Rothney W.B. Total pulmonary venous drainage into the right side of the heart: report of 17 autopsied cases not associated with other major cardiovascular anomalies. Lab. Invest. 1957. Vol. 6 (1). P. 44-64.
18. Купряшов А.А. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен. В кн.: Бокерия Л.А., Шаталов К.В. (ред.). Детская кардиохирургия: руководство для врачей. ФГБУ "НМИЦССХ им. А. Н. Бакулева" МЗ РФ, 2016. С. 294-312.
19. Бокерия Л.А., Беришвили Д.О., Нефедова И.Е., Баринштейн Д.Б., Степаничева О.А. Хирургическая коррекция транспозиции магистральных артерий с тотальным дренажем легочных вен в портальную вену // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2019. Т. 20. № 1. С. 77-80. DOI: 10.24022/1810-0694-2019-20-1-77-80.
20. Абдуллаев Ф.З., Багиров И.М., Казимзаде Н.Дж., Шихиева Л.С., Байрамов Р.Б., Рустамова Я.К., Самедов Р.Р. Коррекция тотального аномального дренажа легочных вен у взрослых больных // Кардиология и сердечно-сосудистая хирургия. 2015. № 6. С. 74-79. DOI: 10.17116/kardio20158674-79.
Известно, что в структуре общей заболеваемости и смертности в мире доминируют сердечно-сосудистые заболевания. Врожденные пороки развития по частоте занимают 4-е место среди причин летальности у детей до 5 лет, составляя при этом 13%. Появление высокотехнологичных диагностических методов, таких как компьютерная и магнитно-резонансная томография, электроанатомическое картирование, расширило возможности не только клиницистов, но и морфологов [1, 2].
Наряду с лечением приобретенных нарушений работы сердечно-сосудистой системы современная кардиология все большее внимание уделяет диагностике и лечению врожденных пороков развития сердца и сосудов. Одним из методов лечения является транспозиция легочных вен, когда легочные вены имеют атипичное расположение и место впадения [3].
Несмотря на единичные работы, посвященные развитию исчерченной сердечной мышечной ткани в стенках легочных вен [4, 5], нет работ, систематизирующих сведения о развитии и аномалиях легочных вен.
Цель работы – на основания изучения данных литературы уточнить основные этапы развития легочных вен, возможные механизмы образования их аномалий.
Известно, что во время раннего эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения, связанного с передними кардинальными и желточно-брыжеечными венами, но не связанного с сердцем (рис. 1) [6].
Выпячивание левого предсердия соединяется с сосудистым руслом легких общей легочной веной. Общая легочная вена, также называемая легочным венозным коллектором, полностью соединяется с нижним отделом левого предсердия в течение первого месяца внутриутробного периода развития. При присоединении легочной вены связи спланхнического сплетения исчезают. Легочная вена, вначале единая, делится на две вены – левую и правую легочные вены. В свою очередь, обе эти вены делятся на две ветви, предназначенные для каждой половины легких, так что потом в левое предсердие впадают четыре самостоятельные легочные вены.
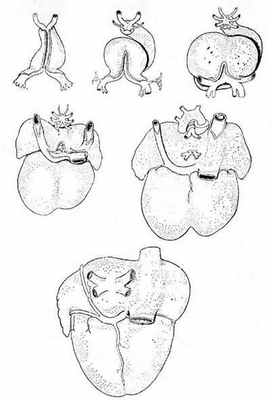
Рис. 1. Шесть стадий развития сердца, отражающих изменение отношений венозного синуса и впадающих в сердце крупных вен; вид сзади [6]
Известны основные принципы развития легочных вен. На ранних эмбриональных стадиях развития имеется сосудистое сплетение, окружающее первичную кишку. Одновременно с образованием дыхательной системы из выпячивания первичной кишки, от общего сосудистого сплетения отделяются отток венозной крови от органов пищеварительной системы и отток от органов дыхательной системы [7].
Филогенетически легочные вены возникают как самостоятельные сосуды, отводящие кровь из зачатков легких [4]. Они сходятся в общий ствол, несущий кровь в левое предсердие с дорзальной стороны. По мере роста сердца этот ствол постепенно врастает в стенку предсердия, а из четырех его притоков образуются легочные вены.
В период эмбриогенеза сосудистое русло легких образуется из спланхнического сплетения [4], которое не имеет связи с сердцем, однако соединяется с передними кардинальными и желточно-брыжеечными венами (рис. 2А).
По данным B.W. Eidem et al. [4], выпячивание левого предсердия соединяется с сосудистым руслом легких легочным венозным коллектором (общей легочной веной), который полностью соединяется с левым предсердием в течение первого месяца внутриутробного периода развития (рис. 2Б). При этом присоединении связи спланхнического сплетения, т.е. кардинальных и желточно-брыжеечных вен, с предсердием исчезают (рис. 2С). Легочная вена, вначале единая, делится на парные легочные вены (рис. 2Д). Эти вены также делятся на две ветви, каждая из них самостоятельно впадает в левое предсердие. Аномалии количества легочных вен проявляются их уменьшением до трех или двух или появлением добавочных легочных вен с нормальным или аномальным дренажом [3].
Исторически предметом дискуссий является связь между легочной веной и системными венозными притоками. Широко обсуждался вопрос: становится ли легочная вена непосредственно связанной с левым предсердием? Выполненные Van den Berg [8] исследования показали, как развивается легочная вена при отделении от большого венозного сплетения, расположенного в мезодерме спланхноплевры и простирающегося от сердца к печени, что предполагает развитие венозного полюса сердца и возникновение клинических проявлений аномального дренажа легочных вен (АДЛВ). Системные венозные притоки, напротив, развиваются латерально на стыке между висцеральной и соматической мезодермой из мезенхимы, окружающей общие кардинальные вены. Концепция Van den Berg [8] формирования легочной вены из этого большого спланхнического сплетения предлагает полезную информацию о развитии венозного полюса сердца, клинических проявлениях аномального легочного венозного возврата и проливает свет на эволюционные аспекты развития сердца.
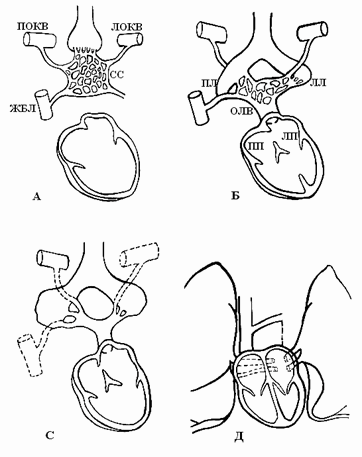
Рис. 2. Развитие легочных вен [4]. ЛОКВ – левая общая кардинальная вена, ПОКВ – правая общая кардинальная вена, ЖБВ – желточно-брыжеечная вена, ОЛВ – общая легочная вена, ЛП – левое предсердие, СС – спланхническое сплетение, ЛЛ, ПЛ – зачатки левого и правого легких
Во время развития легочных вен и их связей с сердцем возникают многие аномалии развития – от незаращения овального отверстия до сложных пороков развития, включающих АДЛВ [9], когда отток крови от легких осуществляется в вены кардинальной системы, а не в левое предсердие.
При формировании АДЛВ левые легочные вены соединяются с левой плечеголовной веной, венечным синусом, развивающимися из левой кардинальной вены [10, 11], а правые – с полыми венами или с правым предсердием. Спланхническое сплетение располагается по центру эмбриона, что объясняет возможность оттока крови от легких слева или справа в систему правой кардинальной вены. Наиболее часто такой аномальный сброс формируется от верхних долей легких [10, 12].
При АДЛВ наблюдаются увеличение легочного кровотока и перегрузка правой половины сердца [13]. АДЛВ может также входить в состав комбинированных пороков сердца [6].
АДЛВ может быть тотальным (ТАДЛВ) или частичным (ЧАДЛВ). При ТАДЛВ все легочные вены впадают в другие вены или в правое предсердие [4, 14, 15]. Развитие ТАДЛВ связано с нехваткой выпячивания легочных вен от задней поверхности левого предсердия для соединения с легочно-венозным сплетением, окружающим легочные ростки. За небольшим исключением обязательным компонентом, позволяющим поддерживать гемодинамику при ТАДЛВ, являются дефект межпредсердной перегородки или открытое овальное окно [13].
Выделяют 4 формы ТАДЛВ [4]: 1) кардиальная форма – легочной венозный коллектор впадает в венечный синус сердца или в правое предсердие (рис. 3-1); 2) подкардиальная форма – легочной венозный коллектор впадает в нижнюю полую вену (рис. 3-2); 3) надкардиальная форма – легочные вены впадают в коллектор, а он – в левую плечеголовную вену (рис. 3-3); 4) смешанная форма – два легочных венозных коллектора впадают в правое предсердие или в полые вены.
Помимо этого, каждая из анатомических форм ТАДЛВ с различной частотой встречаемости может сопровождаться обструкцией легочного венозного возврата, что оказывает решающее влияние на состояние гемодинамики и клинические проявления порока< [15]. ТАДЛВ составляет 1,5–3% случаев в общей структуре аномалий развития сердца [10]. ТАДЛВ редко встречается у людей старше 18–20 лет, что связано с высокой частотой смертности в раннем детстве (50% детей погибают в первые 3 месяца и более 80% – к концу первого года жизни ребенка) [15].
Данный порок формируется посредством атрезии справа или слева крупной ветви общего легочного сплетения [9].
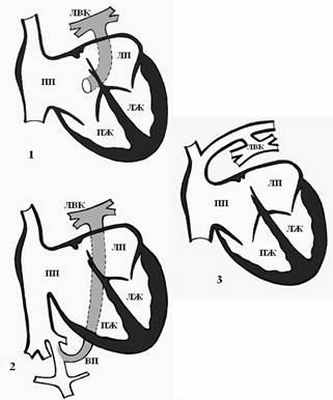
Рис. 3. Формы тотального аномального дренажа легочных вен [4]: 1 – кардиальная форма – в венечный синус, 2 – подкардиальная форма – в нижнюю полую вену, 3 – надкардиальная форма – в левую плечеголовную вену. ЛВК – легочный венозный коллектор, ЛПВ – левая плечеголовная вена, ВПВ – верхняя полая вена, ВП – венозный проток, ПП – правое предсердие, ПЖ – правый желудочек, ЛП – левое предсердие, ЛЖ – левый желудочек
Легочные вены могут впадать в правое предсердие, венечный синус, притоки полых вен [14, 15]. По данным различных исследователей, частота встречаемости ЧАДЛВ колеблется от 0,7% до 9,4% и составляет около 2/3 всех случаев аномального дренажа легочных вен [12, 16]. Половина пациентов с изолированным ЧАДЛВ способны дожить до 30–40 лет [12].
При ЧАДЛВ в функциональном аспекте принципиальны анатомические особенности левой части сердца. Такие изменения, естественно, отражаются на состоянии системной гемодинамики, что вызывает снижение размеров левого предсердия [10, 11].
Наиболее распространенной классификацией ЧАДЛВ является классификация R.S. Darling et al. [17], в основе которой, как и при ТАДЛВ, лежит анатомический принцип уровня впадения легочных вен. Выделяют четыре типа порока:1) супракардиальный, когда легочные вены впадают в левую безымянную, верхнюю полую вены или в одну из их ветвей; 2) кардиальный – дренирование всех или части легочных вен в полость правого предсердия; 3) инфракардиальный – часть легочных вен впадает в венозный сосуд, расположенный ниже сердца; 4) смешанный.
Пациентам с подозрением на ЧАДЛВ показано выполнение МРТ для оценки анатомических особенностей легочных вен, особенно при неубедительных результатах ЭхоКГ [18].
Катетеризация сердца с ангиографией показана при подозрении на легочную гипертензию или для выявления сопутствующих аномалий сердца [18, 19].
Единственным способом устранения ТАДЛВ является ее кардиохирургическая коррекция [19, 20]. Несмотря на современные достижения в области хирургической техники, не существует универсального подхода к выбору оптимальной хирургической коррекции сложных вариантов аномального дренажа легочных вен [3, 13, 19]. Общая хирургическая летальность при изолированном ТАДЛВ достигает 16% [15], летальность при коррекции ЧАДЛВ не превышает 1–2% [3]. Основным осложнением и основной причиной повторной операции в хирургии ТАДЛВ является возникновение легочной венозной обструкции [3].
Заключение. Таким образом, несмотря на значительное количество современной литературы, в которой описаны различные аномалии легочных вен, наблюдаемые в клинической практике, их углубленное изучение сохраняет свою актуальность как с точки зрения понимания процесса их формирования и влияния на гемодинамику, так и с точки зрения своевременной диагностики и возможной коррекции имеющихся нарушений.
Тотальный аномальный дренаж легочных вен
Слово «аномальный» означает «неправильный». При этом пороке легочные вены (а их четыре), которые должны впадать в левое предсердие, в него не впадают, т.е. не соединяются с ним. Вариантов их неправильного впадения достаточно много.
Бывает «частичный» аномальный дренаж – это когда одна или две из четырех вен впадают в правое предсердие (наиболее частый вариант), и в подавляющем большинстве случаев он сочетается с дефектами межпредсердной перегородки, и мы говорили об этом в главе о ДМПП.
Полный или тотальный аномальный дренаж легочных вен (ТАДЛВ) — это совсем другое. При этом пороке все четыре легочные вены от обоих легких соединяются в один широкий сосуд-коллектор. Этот коллектор окисленной в легких артериальной крови не срастается с левым предсердием, как должно быть, а соединяется с венозной системой организма, обычно через большую вену. Артериальная кровь, таким образом, минуя сердце, попадает в большие вены и в правое предсердие. Только здесь, пройдя через дефект межпредсердной перегородки она окажется там, где ей надо быть изначально – в левом предсердии, и дальше совершает обычный путь по большому кругу кровообращения. Представить себе, что такое вообще может быть, трудно. Но дети с этим пороком рождаются доношенными, а сердце некоторое время справляется с такой ситуацией. Однако это время может быть очень коротким.
Во-вторых, в этой левой половине сердца значительная часть крови — просто венозная, т.е. неокисленная, и она снова будет нагнетаться в большой круг. У ребенка, таким образом, в артериях начинает циркулировать частично венозная кровь, и он становится «синим», т.е. цвет кожи, а особенно — кончиков пальцев и слизистых (губ, рта) — синюшный. Это — цианоз, и о его причинах, проявлениях и последствиях позже поговорим особо.
При полном аномальном дренаже цианоз может быть не очень выражен, но он есть, и это, как правило, заметно вскоре после рождения.
В большей части случаев состояние детей с полным аномальным дренажем легочных вен оказывается «критическим» с самого начала жизни. Если ничего не предпринимать, то они погибнут уже через несколько дней или месяцев.
Хирургическое лечение существует, и результаты сегодня вполне обнадеживающие. Операция достаточно сложная, выполняется на открытом сердце и заключается в том, что общий коллектор легочных вен сшивается с левым предсердием, а отверстие в медпредсердной перегородке закрывают заплаткой. Таким образом после операции восстанавливается нормальное кровообращение по двум разделенным кругам .
Иногда допустим и экстренный вариант — расширение дефекта при зондировании в качестве первого, жизнеспасающего этапа, который позволяет несколько отсрочить основное вмешательство.
Мы не станем касаться здесь многих деталей, связанных с различными видами порока и методов его исправления. Но хотим только подчеркнуть, что дети с этим пороком нуждаются в немедленной специализированной помощи, которая сегодня совершенно реальна.
Отдаленные результаты операции достаточно хорошие — ведь основной порок устранен. Однако дети должны быть под наблюдением кардиологов потому, что возможны осложнения в виде нарушений ритма или сужения легочных вен в местах наложения швов (это происходит из-за того, что сердце, перенесшее такую большую операцию, продолжает расти). И снова хотим подчеркнуть: этот ребенок — не инвалид. Он должен вести абсолютно нормальный образ жизни, и чем раньше сделана операция, тем быстрее все забудется.
Красноярские кардиохирурги освоили новые операции у новорожденных детей
Материал опубликован 01 августа 2018 в 18:10.
Обновлён 02 августа 2018 в 18:25.
Одновременно в Федеральный центр сердечно-сосудистой хирургии Красноярска поступили два младенца с одинаковыми критическими пороками сердца. У обоих диагностирован тотальный аномальный дренаж легочных вен, который осложнялся индивидуальными особенностями развития порока. Один ребенок был массой чуть более 2 кг. К каждому из них удалось разработать свой подход, позволяющий минимизировать риск операции и значительно улучшить прогноз.
Тотальный аномальный дренаж легочных вен - порок, при котором отсутствует прямая связь легочных вен с левым предсердием. При данном пороке очень рано развивается сердечная недостаточность, без хирургического лечения большинство детей погибает в течение первых 3 месяцев жизни.
Существует несколько способов хирургической коррекции тотального аномального дренажа в зависимости от места впадения легочных вен. Ранее, в Кардиоцентре детей с таким пороком приходилось охлаждать до 18 0 С, полностью останавливать кровообращение на 40-60 минут, за это время выделять место «сбора» всех легочных вен в один сосуд, вскрывать его, вскрывать левое предсердие и сшивать все вместе. Для таких пациентов требовалось большое количество препаратов крови, выхаживание их было крайне сложным, приходилось оставлять открытой грудную клетку на сутки или двое.
Двое младенцев с диагнозом «тотальный аномальный дренаж легочных вен» поступили в Кардиоцентр практически в одно время. Один из детей был массой чуть более 2 кг. К каждому из них удалось разработать свой подход, позволяющий минимизировать риск операции и значительно улучшить прогноз.
- Ребенку массой чуть больше 2 кг, мы применили операцию Warden. Данный метод, обычно, применяется для пациентов старшей возрастной группы – рассказывает заведующий детским кардиохирургическим отделением Кардиоцентра Павел Теплов. - У этого ребенка, все легочные вены собирались в один коллектор, который впадал в верхнюю полую вену, такой вид порока является очень редким. Примененный нами способ вмешательства в Кардиоцентре выполнялся впервые. Несмотря на исходно тяжелое состояние пациента и его малый вес, все прошло успешно, ребенок меньшее время, чем обычно при таком пороке, провел в отделении реанимации, его восстановительный период прошел значительно быстрее.
Второй пациент с тотальным аномальным дренажем легочных вен был экстренно госпитализирован с приема детского кардиолога Центра в поликлинике, и взят в операционную по неотложным показаниям. В данном случае, хирурги применили «бесшовную» технику, описанную швейцарскими коллегами, для чего потребовалось остановить кровообращение всего на 8 минут. Эта методика проведения операции позволяет наложить более герметичный шов, не деформировать отделы сердца и значительно сократить время восстановления маленького пациента после серьезного вмешательства. Оба ребенка выписаны домой.
Тотальный аномальный легочный венозный возврат (ТАЛВВ)
При тотальном аномальном легочном венозном возврате легочные вены — кровеносные сосуды, которые в норме переносят обогащенную кислородом кровь из легких в левую часть сердца, вместо этого присоединяются к правым отделам сердца. Затем эта кровь попадает в левую часть сердца через отверстие в перегородке, разделяющей левые и правые сердечные камеры.
У детей с более легкой формой тотального аномального легочного венозного возврата могут быть лишь незначительные проблемы с кормлением и дыханием в младенчестве.
У детей же с более тяжелым тотальным аномальным легочным венозным возвратом могут присутствовать синюшность кожных покровов (цианоз), одышка и утомляемость.
У детей с наиболее тяжелыми формами этой аномалии тяжелое респираторное расстройство и цианоз могут развиться вскоре после рождения.
Для постановки диагноза необходимо выполнение эхокардиографии.
Необходимо проведение хирургического восстановления.
На тотальный аномальный легочный венозный возврат (ТАЛВВ) приходится 1-2 % случаев врожденных пороков сердца.
В норме обогащенная кислородом кровь из легких поступает по легочным венам в левое предсердие. Затем из левого предсердия она течет в левый желудочек, откуда распределяется по всему телу. (См. также Нормальное кровообращение плода Нормальное кровообращение плода Примерно один из 100 младенцев рождается с пороком сердца. Некоторые пороки тяжелые, но многие — нет. Пороки могут быть связаны с аномальным формированием стенок или клапанов сердца или кровеносных. Прочитайте дополнительные сведения ). У новорожденных с тотальным аномальным легочным венозным возвратом легочные вены соединены не с левым предсердием, как в нормальных условиях. Вместо этого они идут неправильно и в конечном итоге соединяются с правым предсердием. Поэтому в правое предсердие, куда обычно поступает только бедная кислородом кровь из организма для закачивания в легкие, поступает смесь оксигенированной и деоксигенированной крови. Дополнительный возврат крови приводит к увеличению нагрузки на правые отделы сердца и к их увеличению. Что еще важнее, кровь из легочных вен поступает в правое предсердие по различным путям — над сердцем, под сердцем или за задней стенкой сердца. Эти пути могут быть суженными или заблокированными, вследствие чего кровь возвращается обратно в легкие и повышает в них давление, препятствуя их нормальной функции. Кровь попадает в левую часть сердца только через отверстие между правым и левым предсердиями (так называемое открытое овальное окно или дефект межпредсердной перегородки Дефекты межпредсердной и межжелудочковой перегородок Дефекты межпредсердной и межжелудочковой перегородок — это отверстия в стенках (перегородках), которые разделяют сердце на левую и правую части. Могут присутствовать отверстия в стенках. Прочитайте дополнительные сведенияТотальный аномальный легочный венозный возврат
Легочные вены не соединены с левым предсердием; вместо этого вся кровь из легочных вен попадает в систему венозного кровообращения по различным путям (в данном случае, это соединяющая вена супракардиального типа, т.е. проходящая над сердцем). Связующие вены могут также проходить под сердцем (инфракардиальные) или за сердцем. Системный кровоток зависит от сброса из правого в левое предсердие.
AO = аорта; НПВ = нижняя полая вена; ЛП = левое предсердие; ЛЖ = левый желудочек; ЛА = легочная артерия; ЛВ = легочные вены; ПП = правое предсердие; ПЖ = правый желудочек; ВПВ = верхняя полая вена.
Аномальный дренаж легочных вен.
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва, Россия
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
Семейная форма частичного аномального дренажа легочных вен
Журнал: Кардиология и сердечно-сосудистая хирургия. 2019;12(1): 53‑59
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви. В данной статье представлен клинический случай семейной формы ЧАДЛВ. Причины возникновения ЧАДЛВ могут быть связаны с хромосомными аномалиями. Отклонения в эмбриогенезе, наличие врожденного порока сердца у ближайших родственников увеличивают вероятность возникновения этой аномалии.
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва, Россия
ФГБУ "Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова" Минздрава России, Москва
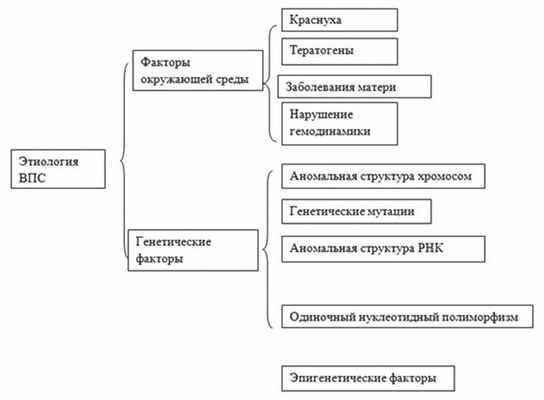
В настоящее время выявлены этиологические факторы многих генетических синдромов и семейных врожденных пороков сердца (ВПС), но генетические основы большинства «спорадических» ВПС до сих пор остаются неизвестными. Ведущие причины развития ВПС представлены на рис. 1. Рис. 1. Этиология ВПС [3].
Определены многие гены, связанные с развитием сердца. Установлено, что ряд отдельных ВПС и генетических синдромов ассоциируется с мутациями в различных единичных генах [1].
Многие гены, кодируемые посредством транскрипционных факторов или сигнальных молекул, в настоящее время ассоциированы с ВПС у человека. Транскрипционные факторы являются белками, которые содержат ДНК-связывающие домены и играют фундаментальную регулирующую роль, контролируя экспрессию генов. Сигнальными молекулами являются белки, которые позволяют клеткам реагировать на их окружение и таким образом участвуют в регуляции многих важных биологических функций.
Фенотипы ВПС варьируют от небольших септальных дефектов, которые могут остаться незамеченными на протяжении всей жизни, до гемодинамически значимых аномалий, которые проявляются клинической симптоматикой. К ним относятся аномалии в диапазоне от персистенции фетального кровообращения (например, открытый артериальный проток) до сложных пороков, таких как транспозиция магистральных сосудов, единый желудочек, синдром гипоплазии левых отделов сердца и другие варианты гетеротаксии. В соответствии с патогенетической классификацией врожденных пороков сердечно-сосудистой системы существуют 6 причинных механизмов: аномалии миграции эктомезенхимальной ткани (аномалии дуги аорты), дефекты внутрисердечного кровотока (септальные дефекты и обструктивные пороки левых или правых отделов сердца), аномалии, связанные с гибелью клеток (септальные дефекты и аномалии клапанов), аномалии экстрацеллюлярного матрикса (дефекты атриовентрикулярного канала), аномальный рост (частичная или полная мальформация легочного венозного возврата и трехпредсердное сердце) и неправильная позиция и перекручивание, что включает нарушение лево-правой асимметрии [2].
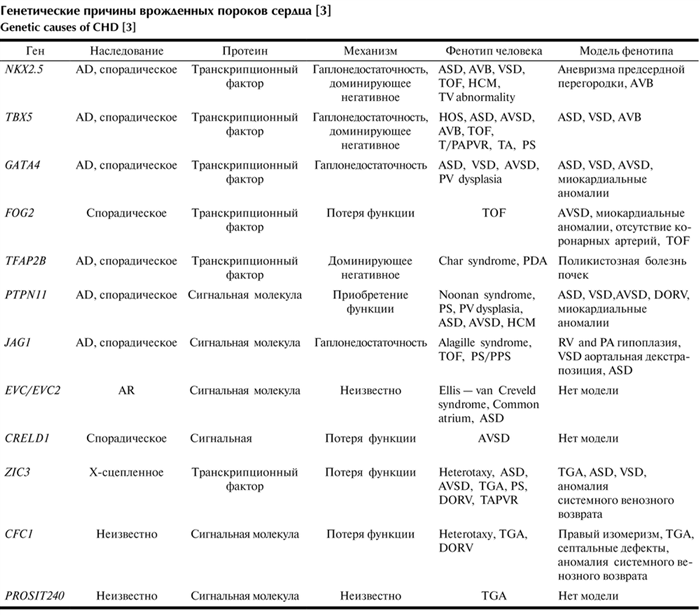
Например, homeobox — содержащие белки, кодируемые генами группы NKX-2,5, играют важную роль в регулировании тканеспецифической экспрессии генов, необходимых для дифференцировки тканей, а также для определения временных и пространственных моделей развития. Исследования показали, что в последнее время несиндромные ВПС могут быть результатом дефекта одного гена. Исходя из этого, можно сделать вывод, что предрасположенность к ВПС является результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий (см. таблицу) Генетические причины врожденных пороков сердца [3] [3].
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви [4].

Существуют четыре анатомические формы ЧАДЛВ, в основу которых положена локализация места впадения легочных вен: супракардиальный, интракардиальный, инфракардиальный и смешанный. Аномальный дренаж правых легочных вен встречается в 2 раза чаще, чем левых. Правые легочные вены могут дренироваться в верхнюю полую вену, что часто сочетается с дефектом венозного синуса (рис. 2, а), Рис. 2. Схема вариантов ЧАДЛВ. а — дренирование правых легочных вен в ВПВ с дефектом венозного синуса; б — в НПВ; в — впадение левых легочных вен в безымянную вену; г — коронарный синус. a — right pulmonary veins drainage into SVC with sinus venosus ASD; b —into IVC; c — connection of left pulmonary veins with innominate vein; d — coronary sinus. или впадать в нижнюю полую вену (см. рис. 2, б) с интактной предсердной перегородкой и бронхолегочной секвестрацией. Левые легочные вены чаще дренируются в безымянную вену (см. рис. 2, в) или в коронарный синус (см. рис. 2, г). Дефект межпредсердной перегородки обычно сопровождается аномальным дренажем левых легочных вен [5].
Впервые порок был описан Winslow в 1739 г. При патологоанатомическом исследовании был обнаружен аномальный дренаж вены верхней доли правого легкого в верхнюю полую вену. Наиболее полно анатомию и клинику этого порока изучил Brody (1942 г.). Систематизировали анатомические варианты (типы) порока R. Darling и соавт. [4] в 1957 г.
Первая успешная операция коррекции частичного аномального дренажа с использованием закрытого метода «атриосептопексии» была выполнена W. Neptune в 1953 г. В 1956 г. J. Kirklin и соавт. [4] сообщили о 5 успешных операциях коррекции порока по полуоткрытому методу Гросса.
Конкретные причины возникновения ЧАДЛВ неизвестны. Они могут быть связаны с хромосомными аномалиями, выявляемыми при кариотипировании более чем у 1/3 больных с ВПС. Чаще всего это трисомия по 21, 18 и 13-й парам хромосом. Помимо болезни Дауна, существует около 20 наследственных синдромов, в большинстве случаев сопровождающихся различными ВПС. В общей сложности синдромальная патология обнаруживается у 6—36% больных. Моногенная природа ВПС доказана в 8% наблюдений; около 90% наследуются многофакторно, т. е. являются результатом сочетания генетической предрасположенности и воздействия факторов окружающей среды. Последние выступают в качестве провоцирующих, выявляющих наследственную предрасположенность при превышении порога их совместного действия [6, 7].
По данным различных исследований [8—10], частота встречаемости ЧАДЛВ среди всех врожденных пороков сердца находится в пределах от 0,7 до 9,4%. Из всех случаев аномального дренажа легочных вен около 2/3 из них приходится на ЧАДЛВ. Чаще в процесс вовлечены правые легочные вены. Верхняя полая вена является наиболее частым местом впадения аномальных правых легочных вен (35—57% от всех случаев ЧАДЛВ). Реже легочные вены впадают в непарную вену, крайне редкий вариант — впадение одной или всех легочных вен в безымянную или добавочную левую вену.
Второе место по частоте занимает интракардиальный тип правостороннего ЧАДЛВ. Аномальный дренаж левых легочных вен встречается крайне редко, при этом легочные вены впадают в коронарный синус или непосредственно в правое предсердие.
При инфракардиальном типе порока вены (чаще средней и нижней долей правого легкого) впадают в нижнюю полую вену (НПВ) сразу под диафрагмой [11].
ЧАДЛВ может также входить в состав более сложных ВПС. Около 20% пациентов с ЧАДЛВ имеют сопутствующие пороки сердца, например, тетраду Фалло, дефект межпредсердной (ДМПП) или межжелудочковой перегородки (ДМЖП), единый (общий) желудочек, общее предсердие, транспозицию магистральных сосудов и синдром гипоплазии левых отделов сердца [12]. Однако чаще всего ЧАДЛВ встречается в комплексе с ДМПП (более 50% случаев) [9].
Между 4-й и 5-й неделями эмбриогенеза в дорсальном мезокарде начинают формироваться легочные вены, исходящие из среднеглоточного эндотелиального стебля [13]. Формирование ЧАДЛВ происходит в результате атрезии крупной ветви общей легочной вены. Как только правая или левая часть общей легочной вены становится атрезированной, то персистенция легочно-системной венозной связи на этой стороне создает этиологическую основу для ЧАДЛВ [12].
Факторами риска развития ЧАДЛВ являются возраст матери выше 40 лет, токсикоз и угроза прерывания беременности в I триместре, наличие мертворождения в анамнезе, наличие детей с врожденными пороками развития у родителей и ближайших родственников [14].
Следует отметить, что у ближайших родственников пациента с аномалиями сердца частота ВПС в 2—5 раз выше [14]. Однако в доступной нам литературе семейной формы ЧАДЛВ описано не было.
Гемодинамика и клинические признаки при ЧАДЛВ соответствуют таковым при ДМПП. При рентгенологическом обследовании можно выявить расширение тени верхней полой вены (ВПВ) и корня правого легкого при аномальном дренаже в ВПВ. При впадении легочных вен в ВПВ в переднезадней проекции на фоне нижней доли правого легкого выявляется тень аномально идущего сосуда в виде «турецкой сабли» (С. Dolter, 1949). Увеличение сосудистого пучка влево позволяет заподозрить аномальное впадение левых легочных вен в левую безымянную вену [15].
В настоящее время эхокардиография (ЭхоКГ) является основным диагностическим методом исследования у пациентов с ЧАДЛВ, однако только компьютерная томография (КТ) с внутривенным контрастированием позволяет установить окончательный диагноз, уточнить анатомию врожденного порока и определить дальнейшую хирургическую тактику [16, 17].
Существует несколько описанных техник коррекции частичного правого аномального дренажа легочных вен: простая туннелизация (переключение легочных вен в левое предсердие заплатой), туннелизация с расширением ВПВ заплаткой, туннелизация с иссечением ВПВ и ее перемещением в правое предсердие (как правило, в ушко предсердия) [18].
Различий в результатах трех техник нет. Выбор техники оперативного вмешательства зависит от типа аномального дренажа и клиники порока [18].
Представляем клиническое наблюдение пациентки А., 18 лет, поступившей в кардиохирургическое отделение с диагнозом: ВПС, ДМПП. Частичный аномальный дренаж правых верхних легочных вен в верхнюю полую вену. Легочная гипертензия I ст. Недостаточность кровообращения IIa степени, II функциональный класс.
На момент осмотра пациентка предъявляла жалобы на одышку и слабость при умеренных физических нагрузках. Из анамнеза известно, что диагноз ДМПП установлен в ноябре 2017 г. в возрасте 17 лет по данным ЭхоКГ. В январе 2018 г. выполнена мультиспиральная КТ (СКТ) сердца с в/в контрастированием, выявлены вторичный ДМПП без верхнего края, частичный аномальный дренаж правых легочных вен в ВПВ, расширение правых камер сердца.
По данным СКТ, три вены от верхней, средней и частично нижней правых легочных вен единым коллектором (диаметром 17 и 11 мм) от средней доли впадают в нижнюю треть ВПВ (рис. 3, 4). Рис. 3. Пациентка А., 18 лет. СКТ с в/в контрастированием. 1 — ДМПП. CT-scan. 1 — atrial septal defect. Рис. 4. Пациентка А., 18 лет. СКТ. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). CT-scan. Partial anomalous pulmonary venous return into SVC (arrow). Расстояние от верхнего края коллектора до уровня впадения ВПВ в правое предсердие составило 17 мм. Также вена от средней доли правого легкого диаметром 5,5 мм впадала в зону ДМПП. Определялся ДМПП без верхнего края размером 25×18 мм. Правая нижняя легочная вена, а также левые легочные вены впадают в левое предсердие.
Состояние пациентки при осмотре средней степени тяжести. АД 110/70 мм рт.ст., ЧСС 70 уд/мин. Тоны сердца ясные, ритмичные. Во втором межреберье слева выслушивается систолический шум. На ЭКГ отмечалась атриовентрикулярная блокада 1-й степени (интервал PQ 0,22 с), а также неполная блокада правой ножки пучка Гиса.
По данным ЭхоКГ, отмечались увеличение правых отделов сердца, дискинезия межжелудочковой перегородки, легочная гипертензия до 40 мм рт.ст. В области верхней трети МПП определялся сброс слева направо диаметром 12—13 мм.
Поступившая в наше отделение пациентка была оперирована. Интраоперационно: сердце увеличено в размерах за счет правых отделов. Экстраперикардиально визуализирован коллектор из трех легочных вен от верхней и средней долей правого легкого диаметром 4, 6 и 7 мм (рис. 5), Рис. 5. Интраоперационное фото. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). Partial anomalous pulmonary venous return into SVC (arrow). впадающий в ВПВ на расстоянии 17 мм от ее устья, высота коллектора 14 мм. Вена от нижней доли правого легкого впадает в левое предсердие. Левые легочные вены также впадают в левое предсердие. При ревизии МПП отмечались дефект без верхнего края 2,5×1,8 см и открытое овальное окно. Нижний край дефекта соединен с открытым овальным окном с образованием ДМПП 3,5×2 см (рис. 6). Рис. 6. Интраоперационное фото. 1 — ДМПП без верхнего края; 2 — открытое овальное окно. 1 — secundum atrial septal defect; 2 — primum atrial septal defect.

Была выполнена пластика дефекта туннелевидной заплатой из ксеноперикарда (рис. 7). Рис. 7. Туннелевидная заплата из ксеноперикарда на ДМПП с перемещением устьев правых легочных вен в ЛП. МПП герметична. IAS is sealed.
Из анамнеза известно, что у отца пациентки в возрасте 15 лет также были выявлены ЧАДЛВ и ДМПП. Он был оперирован, и интраоперационно обнаружено аномальное впадение верхней правой легочной вены в устье ВПВ. Пациенту была выполнена пластика ДМПП с перемещением легочной вены от верхней доли правого легкого в левое предсердие.
Кроме того, двоюродная сестра пациентки была прооперирована в возрасте 8 мес по поводу ВПС. Были выявлены центральный дефект межпредсердной перегородки диаметром 15 мм и аномальный дренаж верхней правой легочной вены в правое предсердие, дефект закрыт заплатой из ксеноперикарда с перемещением устья легочной вены в левое предсердие.
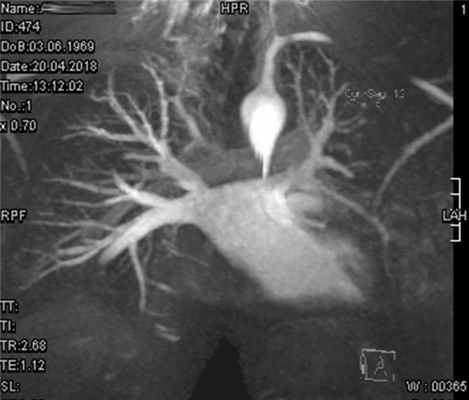
В нашем центре им было выполнено МРТ сердца для визуализации анатомического строения и контроля отдаленных результатов операционного лечения пациентов (рис. 8), Рис. 8. Пациент А. (отец пациентки). МРТ сердца. Верхние легочные вены, впадающие в левое предсердие у устья ВПВ (указаны стрелкой). MRI. Partial anomalous pulmonary venous return (arrow). по результатам которой у отца пациентки визуализирован коллектор правых легочных вен, впадающий в левое предсердие. Данных за реканализацию ДМПП, другие дополнительные патологические сбросы или обструкцию кровотока по легочным венам не выявлено в обоих случаях. Особенностью этих операций является наличие нижнепредсердного ритма с адекватной частотой, что связано с наложением швов в проекции синусового узла.
Предрасположенность к ВПС обусловливается результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий. Конкретные причины возникновения ЧАДЛВ неизвестны. Отклонения в эмбриогенезе и наличие ВПС у ближайших родственников увеличивают вероятность возникновения аномалии в развитии сердца. В приведенном выше клиническом наблюдении отмечено наличие ЧАДЛВ у отца пациентки и у двоюродной сестры. ЧАДЛВ чаще встречается в комбинации с ДМПП и зачастую представлен одной или несколькими аномально впадающими правыми легочными венами. По данным отдаленных результатов, оперативное вмешательство в виде туннелизации (перемещения устьев легочных вен в левое предсердие заплатой) является надежным и эффективным методом лечения ЧАДЛВ. В доступной литературе мы не встретили описания семейной формы ЧАДЛВ.
Читайте также:
