Антиэстрогены - тамоксифен. Ингибиторы ароматазы
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Определение рецепторов эстрогена (РЭ) и прогестерона (РП) в опухолях молочной железы позволяет достоверно высказаться о предполагаемой чувствительности к гормонотерапии. Присутствие обоих видов рецепторов характеризует наивысшую эффективность этого метода, достигающего 80%. Ответ на гормонотерапию при наличии рецепторов одного вида снижается до 40%, но даже при наличии рецепторотрицательных опухолей эндокринотерапия может быть успешной в 10% случаев.
При отсутствии информации о рецепторном статусе опухоли можно ориентироваться на косвенные признаки: постменопаузальный возраст, длительный свободный от болезни интервал между операциями и метастатическими проявлениями, преимущественное поражение мягких тканей, л/узлов, костной системы, неагрессивное течение болезни.
Женщины в постменопаузе с рецепторположительными опухолями составляют большую демографическую группу среди больных раком молочной железы.
С 70–х годов прошлого века антиэстрогены считались «золотым стандартом» лечения в этой подгруппе больных. Тамоксифен применялся в первой линии метастатического рака молочной желеы, неоадьювантной и адьювантной гормонотерапии.
Новые достижения и перспективы в эндокринотерапии рака молочной железы связаны с появлением ароматазных ингибиторов третьего поколения. Основным источником образования эстрогенов у женщин в менопаузе является андростендион и тестостерон. Их превращение происходит в жировой и мышечной тканях, печени, надпочечниках и в самой опухолевой ткани за счет фермента ароматазы, причем в синтез глюкокортикоидов и минералкортикоидов ароматаза не вовлечена.
Ароматазная реакция включает в себя множественное гидроксилирование андрогенных предшественников при участии специфичесого цитохрома Р–450 ароматазы. Ингибирование энзима может быть достигнуто двумя основными путями: конкуренция с природным субстратом в месте связывания андростендиона (1 тип ингибиции) или взаимодействие с атомом железа в порфирине цитохрома Р–450 (2 тип ингибиции).
Ингибиторы 1 типа являются аналогами стероидов–андрогенов. Они метаболизируются ароматазой в неактивные промежуточные субстанции, их связь с молекулой ароматазы необратима и для восстановления синтеза эстрогенов необходим синтез новой молекулы энзима. Поэтому стероидные ингибиторы в настоящее время обозначают, как инактиваторы ароматазы или суицидные ингибиторы.
В противоположность инактиваторам ароматазы воздействие нестероидных ингибиторов обычно обратимо и зависит от продолжающегося присутствия препарата. Синтез эстрогенов может возобновиться после прекращения действия этих ингибиторов. Более того, препараты 2 типа, направленные против атомов железа цитохрома Р–450, а также других стероидных гидроксилаз, являются недостаточно специфичными. Это особенно характерно для первой генерации ароматазных ингибиторов, таких как аминоглютетимид. Разработанные в последнее время новые препараты из группы ингибиторов ароматазы (анастрозол (Аримидекс) и др.) имеют избирательность к цитохрому Р–450, а значит, селективно игибируют энзим.
Итак, основная задача для антиэстрогенов и ароматазных ингибиторов – подавление эстрогенных влияний на опухолевый рост. Однако антиэстрогены конкурируют с эстрогенами за рецепторы, комплекс с которыми реагирует с ДНК, откуда идут транскрипционные сигналы опухолям. Ароматазные ингибиторы препятствуют синтезу базового эстрогена – эстрона, и в результате их применения «некому» вступать во взаимодействие с рецепторами.
Первым нестероидным ингибитором считается аминоглютетимид, который в двух сравнительных исследованиях с тамоксифеном не выявил преимуществ в лечебной эффективности, а учитывая его худшую переносимость по сравнению с тамоксифеном и прогестинами занял в гормонотерапии распространенного рака молочной железы третью позицию [6,15].
Вторая генерация антиароматазных препаратов (форместан, фадрозол) в рандомизированных исследованиях с тамоксифеном также не показала достоверных преимуществ в лечебной эффективности и переносимости [13,16].
Третье поколение нестероидных ароматазных игибиторов (анастрозол (Аримидекс), летрозол) уже в первых сравнительных исследованиях с мегестрол ацетатом (II линия гормонотерапии) продемонстрировало большую эффективность и лучший спектр побочных эффектов. При последующем изучении в сравнении с тамоксифеном (I линия эндокринотерапии) отмечены преимущества во времени до прогрессирования и снижение частоты побочных эффектов, характерных для тамоксифена.
Последние исследования в адьювантной гормонотерапии рака молочной железы показали, что ароматазные ингибиторы готовы занять лидирующее место, потеснив стандарт адьювантной терапии – тамоксифен.
Одним из широко используемых в клинической практике ароматазных ингибиторов является анастрозол (Аримидекс).
Анастрозол (АримидексЄ, фармацевтическая компания АстраЗенека) является нестероидным селективным ингибитором ароматазы третьего поколения. Препарат представляет собой триазольное производное 2,2 бис (2 – метилпропион – нитрил). Аримидекс назначают перорально 1 раз в сутки в дозе 1 мг; при этой дозе подавляется ароматизация на 96,7%, плазменный уровень эстрадиола уменьшается на 86%, эстрона – на 87% и эстрон–сульфата на 93%.
Фармокинетика препарата тщательно изучена. Аримидекс быстро и полностью всасывается из желудочно–кишечного тракта, максимум концентрации отмечается через 2 часа, плато достигается на 7–й день лечения. Препарат метаболизируется в печени, период полувыведения составляет 30–60 часов. С мочой выводится лишь 10% неизмененного препарата и 70% метаболитов. Нет необходимости в коррекции дозы препарата при печеночной или почечной недостаточности.
Аримидекс переносится хорошо и редко приводит к возниковению ощущения приливов и сухости слизистой влагалища; кроме того, могут возникать нарушения со стороны желудочно–кишечного тракта, сонливость, астения, головные боли. Однако случаи отмены препарата из–за побочных явлений не превышают 3%. Препарат не противопоказан больным с наличием тромбоэмболических осложнений в анамнезе и гипертонической болезни.
Ароматазные ингибиторы во второй линии гормонотерапии распространенного рака молочной железы при прогрессировании
после тамоксифена
Представлены результаты двух многоцентровых исследований в США и Европе по сравнению эффективности и токсичности Аримидекса в дозах 1 и 10 мг в сутки и мегестрол ацетата в дозе 160 мг в сутки при проведении гормонотерапии 2 линии (после прогрессирования на тамоксифене) у 746 больных распространенным раком молочной железы. Различий в обьективном эффекте лечения в трех группах (12,6%, 12,5% и 12,2% соответственно) не отмечалось. Однако в группе, получавшей Аримидекс в дозе 1 мг в сутки, отмечена достоверно большая продолжительность жизни по сравнению с мегестрол ацетатом (26,7 мес. против 22,5 мес.). Двухлетняя выживаемость при терапии Аримидексом составила 56,1% и 46,3% при лечении мегестрол ацетатом.
При использовании Аримидекса в дозе 1 мг в сутки не было выявлено статистически значимой разницы в показателях 2–летней выживаемости у больных, достигших полной и частичной регрессии или только стабилизации (85% против 86%). Доза в 10 мг не улучшала результаты лечения Аримидексом.
Более яркий результат получен в подгруппе больных с печеночными метастазами. Клиническое улучшение (полная + частичная регрессия + стабилизация) при терапии Аримидексом 1 мг в сутки отмечено у 26% больных (n=46) и у 17% (n=41) с мегестрол ацетатом. Продолжительность клинического улучшения составила соответственно по группам 17,9 мес. и 9,9 мес.
Различалась и токсичность в группе с ароматазным ингибитором и мегестролом: увеличение веса соответственно в 1,5% и 11,9%; отеки 7,3% и 13,8%; тромбоэмболические осложнения 3,4% и 4,7%; тошнота, рвота, диарея 29,4% и 21,3% ;приливы 12,6% и 13,8%; сухость слизистой влагалища 1,9% и 0,8%.
Таким образом, новые ингибиторы ароматазы, в частности, Аримидекс, твердо заняли позицию прогестинов во второй линии гормонотерапии после антиэстрогенов при распространенном раке молочной железы не только благодаря большей эффективности, но и меньшей токсичности. На сегодня считается неоправданным назначение прогестинов после неэффективного лечения антиэстрогенами.
Ингибиторы ароматазы в первой линии гормонотерапии распространенного рака
молочной железы
Были проведены два рандомизированных исследования по III фазе, сравнивших Аримидекс 1 мг в сутки и тамоксифен 40 мг в сутки в первой линии гормонотерапии при лечении 1021 женщины с местнораспространенным или метастатическим раком молочной железы. Включались больные в менопаузе с ЭР+ и/или ПР+ опухолями, а также с неизвестным рецепторным статусом. Результаты приведены в таблице 1 [3,4,11,12].
В исследовании № 0030 Аримидекс превосходил тамоксифен по времени до прогрессирования (11,1 мес. против 5,6 мес., p=0,005) и в отношении объективного эффекта (59,1% и 45,6%).
Второе исследование не выявило существенных различий в лечебном эффекте между группами.
При анализе материала выяснилось, что в одном исследовании рецептороположительные опухоли встречались у 89% больных, а в другом – только у 45%. При объединении данных этих исследований в группе с рецептороположительными опухолями отмечена достоверная разница по времени до прогрессирования в пользу Аримидекса (10,7 мес. против 6,4 мес., p=0,022).
Терапия антиароматазным препаратом у больных, достигших клинического улучшении (полная и частичная регрессия + стабилизация > 6 месяцев), значительно увеличила время до прогрессирования в сравнении с тамоксифеном (18 мес. против 7 мес.): Токсичность Аримидекса оказалась меньше, особенно в отношении тромбоэмболических осложнений (3,6% и 6,5%, р тамоксифен; тамоксифен => ингибиторы ароматазы) с монотерапией ароматазными ингибиторами. В исследовании приняли участие 8028 больных раком молочной железы в менопаузе, в 2003 году включение в программу закрыто. Полученные данные послужат дополнительной информацией для разработки стандартов использования антиароматазных препаратов в адьювантном лечении.
Результаты приведенных выше исследований с высокой степенью достоверности (1–й уровень) выявили преимущество ингибиторов ароматазы перед тамоксифеном в адьювантном лечении больных раком молочной железы в менопаузе в отношении местного рецидива, метастазирования, рака другой молочной железы и длительности безрецидивного периода.
Однако остается ряд нерешенных проблем. К примеру, показано четкое преимущество антиароматазных препаратов перед тамоксифеном по частоте тромбоэмболических осложнений, маточных кровотечений и развитию рака эндометрия, но, с другой стороны, длительное снижение уровня эстрадиола на фоне ингибиторов ароматазы привело к более частому выявлению у этих больных болей в костях, остеопорозу, переломов.
Не определена оптимальная длительность адьювантного лечения ингибиторами ароматазы и их последовательность с тамоксифеном, не охарактеризованы подгруппы больных, где было показано неоспоримое преимущество от внедрения ингибиторов ароматазы, не проведены сравнительные исследования анастрозола (Аримидекса), летрозола и экземестана.
Существует различие в механизме действия двух видов терапии: антиэстрогенов и ингибиторов ароматазы. Большая лечебная эффективность ароматазных ингибиторов предполагает наличие группы больных, избирательно чувствительных к этим лекарствам. В сравнительном исследовании летрозола и тамоксифена были проанализированы объективные эффекты лечения, рецепторный статус опухоли, экспрессия рецепторов эпидермального фактора роста. Ингибиторы ароматазы оказались высокоэффективными при лечении ЭР+ опухоли, независимо от экспрессии HER1 или HER2. При лечении ЭР+ опухоли тамоксифеном объективный эффект при экспрессии HER1 и HER2 был минимален (табл. 3).
В адьювантном исследовании ATAС проанализирован свободный от болезни период при лечении Аримидексом и тамоксифеном. Анализ проведен для рецепторположительных опухолей ЭР+ ПР+ (74% больных) и ЭР+ ПР– (17% больных). В обеих группах Аримидекс опережал тамоксифен по свободному от болезни периоду, но наибольшее различие в пользу ароматазного ингибитора отмечено при ЭР+ ПР– опухолях [1,2,12]. Известно,что частота выявления экспрессии HER1 или HER2 в РЭ+РП–опухолях выше, чем при статусе РЭ+РП+. Предполагают, что большая эффективность ароматазных ингибиторов связана с возможностью получить лечебный эффект при экспрессии опухолью рецепторов эпидермального фактора роста и низком уровне рецепторов эстрогена.
В заключение следует отметить, что активное внедрение в клиническую практику ингибиторов ароматазы расширяет возможности онкологов при лечении больных в постменопаузе как при ранних, так и поздних стадиях рака молочной железы.
Литература
1. Гарин А.М.: Принципы и возможности современной эндокринной терапии опухолей. М: Просвещение 2000 – 208 с.
2. Baum M.Cuzick J, Forbes J, Houghton J.Howell A (The ATAC Trialists Group): Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early stage breast cancer. Results of the ATAC (Arimidex, Tamoxifen Alone or in Combination) trial efficacy and safety update analyses. Cancer 2003, 98:1802–1810.
3. Boccardo F, Rubagooi J, Amoroso D, Mesiti M, Masoobrio M, Porpiglia M, Rinaldini M, Paladini G, Distante V, Franchi R, et al.: Anastrozole appears to be superior to tamoxifen in women already receiving tamoxifen treatment [abstract]. Breast Cancer Res Treat 2003, Suppl 1 :S6.
4. Bonneterre J, Thurlimann B, Robertson JF, Krzakowski M, Mauriac L, Koralewski P, Vergote I, Webster A, Steinberg M, vonEuler M: Anastrozole versus tamoxifen as first line therapy for advanced breast cancer in 668 postmenopausal women: results of the Tamoxifen or Arimidex Randomized Group Efficacy and Tolerability Study. J Clin Oncol 2000, 18:3748–3757.
5. Dixon JM, Love CDB, Renshaw L, Bellamy C, Cameron DA, Miller WR, Leonard RCF: Lessons from the use of aromatase inhibitors in the neoadjuvant setting. Endocr Relat Cancer 1999, 6:227–230.
6. Gale KE, Anderson JW, Tormey DC: Hormonal treatment for metastatic breast cancer. An Eastern Cooperative Group phase III trial comparing aminoglutethimide to tamoxifen. Cancer 1994,12:1630–1638.
7. Geisler J, Haynes B, Anker G, Dowsett M, Lonning PE. Influence of letrozole and anastrozole on total body aromatization and plasma estrogen levels in postmenopausal breast cancer
patients evaluated in a randomised, cross–over study. J Clin Oncol 2002, 20:751–757.
8. Gershanovich M, Chaudri HA.Campos D: Randomised trial comparing 2.5mg daily, 0.5mg daily and aminoglutethimide in postmenopausal women with advanced breast cancer. Letrozole International Control Group (AR/BC3). Ann Oncol 1998, 9:639–645.
9. Howell A., Dowsett M. Aromotase inhibitors versus antioestrogens. Breast Cancer Research, 2004, 6: 269–274.
10. Long BJ, Jelovac D, Thiantnawat A, Brodie AM: Effect of second line antiestrogen therapy on breast tumour growth following first line treatment with the aromatase inhibitor letrozole: long term studies using the intratumoural aromatase model. Clin Cancer Res 2002, 8:2738–2388.
11. Milla–Santos A, Milla L, Portella J, Rallo L, Pons M, Rodes E, Casanovas J, Puig–Gali M: Anastrozole versus tamoxifen as first–line therapy in postmenopausal patients with hormone–dependent advanced breast cancer. Am J Clin Oncol 2003, 26: 317–322.
12. Nabholtz JM, Buzdar A, Pollak M: Anastrozole is superior to tamoxifen as first–line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. Arimidex Study Group. J Clin Oncol 2000, 18:3758–3776.
13. Perez Carrion R, Alberola Candel V, Calabresi F: Comparison of the selective aromatase inhibitor formestane with tamoxifen as first–line hormonal therapy in postmenopausal women with advanced breast cancer. Ann Oncol 1994, Suppl 7:19–24.
14. Rose C, Vtoraya O, Pluzanska A, Davidson N, Gershanovich M, Thomas R, Johnson S, Caicedo JJ, Gervasio H, Manikhas G, et a/.: An open randomised trial of second–line endocrine therapy in advanced breast cancer: comparison of the aromatase inhibitors letrozole and anastrozole. Eur J Cancer 2003, 39: 2318–2327.
15. Smith IE, Harris AL, Morgan M: Tamoxifen versus aminoglutethimide versus combined tamoxifen and aminoglutethimide in the treatment of advanced breast carcinoma. Cancer Res 1982, Suppl:3430s–3433s.
16. Thurlimann B, Beretta K, Bacchi M: First–line fadrozole HCI (CGS–16949A) versus tamoxifen in postmenopausal women with advanced breast cancer. Prospective randomised trial of the Swiss Group for Clinical Cancer Research SAKK 20/88. Ann Oncol 1996, 7:471–479.
17. D’Hondt V., Piccart M.: Controversies in the adjuvant treatment of breast cancer: new adjuvant endocrine treatment strategies. Annals of Oncology 2004, 4: 23–29.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Ингибиторы ароматазы более эффективны, чем тамоксифен
Британские ученые из Института исследований рака (ICR) полагают, что женщинам при раке молочной железы следует принимать гормональные препараты под названием ингибиторы ароматазы, а не тамоксифен. Так у них продолжительность жизни будет дольше. Об этом говорится в статье, которая недавно была опубликована в журнале The Lancet.
Рак молочной железы (РМЖ) является одним из самых опасных заболеваний у женщин. Ежегодно от этой болезни умирают десятки тысяч женщин. Так, например, в 2015 году в Великобритании, согласно прогнозу, диагноз РМЖ будет поставлен примерно 232 000 женщинам, и более 40 000 женщин умрут от этого заболевания.
Эстроген-рецептор положительный (ER-положительный) рак молочной железы занимает примерно 70% всех случаев этого заболевания. При таком виде злокачественной опухоли клетки рака молочной железы содержат рецепторы эстрогена. Когда гормон контактирует с этими рецепторами, то это может стимулировать рост раковых клеток молочной железы.
Обычно в лечении ER-положительного рака молочной железы используют лекарства, направленные на изолирование рецептора эстрогена или воздействия на снижения выработки эстрогена в организме. К этим медпрепаратам как раз относятся тамоксифен и ингибиторы ароматазы (ИА).
Тамоксифен мешает эстрогену входить в контакт с рецепторами в клетках рака молочной железы. Его назначают, прежде всего, женщинам на ранней стадии РМЖ, которые подверглись хирургической операции, лучевой терапии или химиотерапии. Он должен помочь предотвратить рецидив рака.
По словам Митча Доусетта из Института исследований рака, употребление на протяжении пяти лет тамоксифена на 30% уменьшает смертность от рака молочной железы. Однако, использование ингибиторов ароматазы, по мнению британских ученых, может быть еще более эффективным.
Ингибиторы ароматазы активно мешают работе ферментов под названием ароматазы (их можно найти, например, в печени). Эти ферменты помогают гормонам превращаться в эстроген, часто виновный в развитии некоторых видов рака. Благодаря ИА меньше эстрогена связывается с рецепторами в клетках рака молочной железы.
Врачи используют ИА для лечения женщин в постменопаузе на ранней стадии РМЖ, которые на протяжении 2-3 лет получали тамоксифен.
Ранее ученые уже пришли к выводу, что ИА более эффективны для снижения риска рецидива рака молочной железы, чем тамоксифен. Однако, было неизвестно как эти вещества влияют на выживание.
Команда британских ученых во главе с Митчем Доусеттом утверждает, что ИА снижают смертность от рака молочной железы на 40%. Такой вывод был сделан после анализа 9 клинических исследований, в которых приняли участие почти 32 000 женщин в постменопаузе с эстроген-рецептор положительным РМЖ на ранней стадии. Участницы исследований не получали гормональную терапию или употребляли в течение по крайней мере пяти лет тамоксифен или ингибиторы ароматазы.
При употреблении ингибиторов ароматазы шансы умереть от РМЖ в течение 10 лет после начала лечения снижены на 40% по сравнению с женщинами, не имевшими гормональную терапию. У женщин, лечившихся при помощи тамоксифена, эта цифра составляет 30%.
Британские ученые отмечают, что использование ИА может иметь некоторые побочные эффекты, включая, например, боль в груди, затрудненное дыхание, боли в мышцах и суставах, плохое настроение.
Послеоперационная (адъювантная) эндокринотерапия постменопаузальных больных раком молочной железы
Рак молочной железы (РМЖ) — наиболее частая опухоль у женщин, ежегодно в мире регистрируется 1 млн 150 тыс. новых случаев инвазивного РМЖ, а 450 тыс. женщин погибают от этого заболевания (В.В. Семиглазов, 2009; Parkin DM, 2005). Лечение больных гормоночувствительным операбельным РМЖ обычно начинается с хирургического вмешательства, дополняемого при необходимости лучевой терапией с последующей многолетней эндокринотерапией. Уже доказано, что применение послеоперационной (адъювантной) эндокринотерапии препаратом тамоксифен снижает риск рецидива заболевания, увеличивая показатели общей выживаемости. Дополнительно к эндокринотерапии адъювантное лечение может включать первичную химиотерапию, которая также может улучшить отдаленные результаты.
Среди многообразия факторов, вовлеченных в канцерогенез и определяющих терапевтические мишени при этих опухолях, эстрогены и рецепторы к ним (ЭР) можно отнести к наиболее подходящим признакам, имеющим прогностическое и предсказывающее значение. Доказано, что длительная экспозиция к эстрогенам и высокие уровни плазменных эстрогенов коррелируют с нарастающим риском возникновения РМЖ. Точно так же выявлено увеличение экспрессии ЭР при сравнении нормального эпителия протоков молочной железы, гиперплазии эпителия и протоковой карциномы in situ.
Наличие рецепторов эстрогенов является предсказывающим признаком благоприятного эффекта от планируемой эндокринной терапии. Значение информации о рецепторах прогестерона менее очевидно, но все же и она может быть использована для определения степени эндокринной чувствительности при низких уровнях ЭР.
Поэтому традиционно стратегия эндокринотерапии РМЖ строится на попытках лишить опухолевые клетки стимулирующего влияния эстрогенов. Это может быть достигнуто несколькими путями: 1) конкурирующим захватом рецепторов эстрогенов антиэстрогенами, например тамоксифеном; 2) снижением уровня эстрогенов в крови и в самой опухоли с помощью ингибиторов ароматазы в постменопаузе и овариэктомии или супрессии яичников агонистами ЛГРГ в пременопаузе; 3) разрушением рецепторов эстрогенов с помощью «чистых» антиэстрогенов, например, с помощью фулвестранта.
Задолго до открытия гормонов и рецепторов к ним, 110 лет назад шотландский хирург Beatson обнаружил, что овариэктомия вызывает иногда регрессию распространенного РМЖ. С этого времени основные терапевтические исследования стали фокусироваться на попытках устранения или максимального подавления периферических эстрогенов или на целенаправленном воздействии на рецепторы эстрогенов и прогестерона (ER/PR) как основную мишень гормонозависимого РМЖ.
В течение почти четырех десятилетий селективный модулятор рецепторов эстрогенов тамоксифен являлся основным препаратом эндокринотерапии ЭР-положительного РМЖ. Оксфордский обзор группы по изучению ранних стадий РМЖ (Early Breast Cancer Trialists’ Collaborative Group — EBCTCG), в состав которой входит и НИИ онкологии им. Н.Н.Петрова, продемонстрировал, что тамоксифен улучшает показатели безрецидивной и общей выживаемости у больных с потенциально гормональночувствительными (т.е. ER+ и/или PR+) опухолями. В противоположность этому больные с ЭР-отрицательными опухолями или низким уровнем экспрессии рецепторов стероидных гормонов не имели пользы от гормональных воздействий.
Тамоксифен в целом хорошо переносится больными, но иногда способен вызывать опасные, угрожающие жизни побочные эффекты из-за его частичной активности в качестве агониста эстрогенов. С этим связано развитие рака эндометрия, тромбоэмболических осложнений, частота которых увеличивается при многолетнем применении препарата.
Это привело к поиску новых гормональных препаратов с более безопасными терапевтическими параметрами. Среди них оказались ингибиторы ароматазы. Первое поколение ингибиторов ароматазы, использовавшееся для лечения метастатических форм РМЖ, не достигло адъювантного применения из-за неблагоприятного «терапевтического индекса» («польза—вред») по сравнению с тамоксифеном.
Ингибиторы ароматазы блокируют цитохром Р450 — фермент ароматазы, отвечающий за превращение андрогенов в эстрогены, тем самым снижая уровень эстрогенов. В постменопаузе эстрогены синтезируются в надпочечниках, коже, мышцах и в жировой ткани (Miller WR, 2002). Кроме того, большинство опухолей молочной железы обладает ароматазной активностью, являясь источником локальных эстрогенов для опухолевых клеток (Bolufer P., 1992).
В противоположность этому у пременопаузальных женщин ингибиторы ароматазы индуцируют секрецию гонадотропных гормонов гипофиза через механизм обратной связи, приводя к овариальной стимуляции и развитию овариальных кист. Поэтому применение ингибиторов ароматазы у женщин с сохраненной менструальной функцией противопоказано.
Существуют два типа ингибиторов ароматазы. Ингибиторы I типа являются аналогами андрогенов, необратимо инактивируют ароматазу, вступая в ковалентную связь с энзимным протеином. По этой причине их называют инактиваторами ароматазы, или стероидными ингибиторами ароматазы. Среди них препарат эксеместан (Аромазин®) является наиболее изученным в клинической практике средством.
Ингибиторы II типа — это нестероидные агенты с обратимой связью с активным сайтом ароматазы. Среди них в клинической практике применяются анастрозол (Аримидекс®) и летрозол (Фемара®).
Все используемые ингибиторы ароматазы назначаются перорально и ежедневно. Время, необходимое для достижения максимального подавления эстрадиола (Е2), варьируют от 2 до 7 дней. Период полувыведения колеблется от 27 до 41 час для анастрозола и эксеместана и намного продолжительнее для летрозола (96 час). Необходимо не менее 7 дней для достижения устойчивого уровня препарата в плазме для анастрозола и эксеместана и 69 дней — для летрозола (Buzdar AU, 2002).
Установлено, что риск рецидива заболевания при ЭР+ опухолях является высоким на протяжении первых 5 лет после установления диагноза РМЖ, и особенно высокий риск падает на 2—3-й годы независимо от статуса лимфатических узлов. Именно риск ранних рецидивов, по мнению ряда авторов, оправдывает раннее (up-front) назначение ингибиторов ароматазы.
В то же время при ЭР+ опухолях показатели смертности от РМЖ схожи во временных отрезках «0—4 года» и «5—14 лет» с кумуляцией 2/3 смертельных исходов между 5-м и 15-м годами. Это наблюдение свидетельствует о потенциальной пользе «продолженной» адъювантной эндокринотерапии свыше 5 лет.
Кроме того, для более полной оценки реального вклада адъювантного эндокринного лечения необходимо изучение и показателей общей выживаемости после длительного периода наблюдения, порядка от 8 до 15 лет.
Предложены четыре стратегии изучения ингибиторов ароматазы III поколения в адъювантном лечении РМЖ (табл. 1).
Первичная (up-front) стратегия
Представляется чрезвычайно важным, чтобы женщины получили наиболее эффективную адъювантную терапию с целью минимизировать ранний риск рецидива РМЖ. Несколько клинических испытаний сравнили ингибиторы ароматазы с тамоксифеном, назначаемые на 5 лет (анастрозол в испытание АТАС, летрозол — в BIG 1-98). Эксеместан исследовался в испытании TEAM (результаты еще не представлены).
Данные испытания показали преимущество адьювантной терапии РМЖ с использованием ингибиторов ароматазы в сравнении с терапией тамоксифеном: было продемонстрировано увеличение безрецидивной выживаемости, увеличение времени до прогрессирования, снижение риска развития контралатерального РМЖ (Trialists Group, 2002, 2003, 2005; Coates A., 2007).
«Переключающая» (switch) стратегия
Переключение на ингибиторы ароматазы после 2—3-х лет лечения тамоксифеном у больных, которым был запланирован 5-летний прием тамоксифена, оценено для эксеместана (Intergroup Exemestane Study — IES), для анастрозола (Итальянское испытание — ITA), а также в Австрийском испытании (Аримидекс/Нольвадекс — ABCSG8/ARNO-95).
«Переключающую» стратегию нередко путают с «последовательной» стратегией. Отличие между двумя подходами заключается в том, что «переключающие» испытания цензурируют (исключают) пациентов с рецидивом опухоли в первые 2—3 года терапии тамоксифеном, отбирая субпопуляцию пациентов с более высокой эндокринной чувствительностью (пациенты с ранним рецидивом должны быть менее чувствительны к гормонотерапии). «Последовательные» испытания включают всех пациентов от начала адъювантной терапии, включая больных с рецидивом на тамоксифене в первые 2—3 года лечения. Поэтому представляется обманчивым использовать данные и результаты «переключающих» (switch) испытаний с целью достичь определенного заключения о последовательной стратегии адъювантной эндокринотерапии.
В рандомизированном двойном слепом многоцентровом исследовании IES (Intergroup Exemestane Study) действие эксеместана исследовали после 2—3-х лет проведения терапии тамоксифеном по сравнению с группой пациенток, продолжающих лечение тамоксифеном (до 5 лет) у женщин в постменопаузе, страдающих гормоночувствительным РМЖ ранних стадий (n=4742).
Общая продолжительность гормонотерапии была одинаковой в обеих группах (5 лет), а среднее время лечения тамоксифеном до рандомизации равнялось 2,4 года. После среднего периода наблюдения за 4724 больными опубликован анализ этого испытания. Полученные результаты свидетельствуют о преимуществе режима переключения на эк семестан в сравнении с режимом 5-летней терапии тамоксифеном по всем основным показателям. В группе эксеместана было продемонстрировано увеличение общей выживаемости (НR=0,83; р=0,05), безрецидивной выживаемости на 24% (р=0,00015), снижение риска развития рецидива заболевания на 26% (р=0,0001, HR 0,74), снижение риска развития отдаленных метастазов на 17% (Сoombs RC, 2007). Кроме того, на 44% снижалась частота контралатерального РМЖ в группе эксеместана по сравнению с терапией тамоксифеном (НR=0,56; p=0,04).
Испытание ITA — открытое исследование III фазы, сравнивающее 5-летнее лечение тамоксифеном с 2—3-летним лечением также тамоксифеном с переключением на анастрозол на 2—3 года (общая продолжительность лечения в обеих группах 5 лет). После включения в исследование 448 больных выявлено значительное преимущество анастрозола над тамоксифеном в показателях выживаемости без «событий» (event-free) (НR=0,42; p=0,0001). Однако многообещающие результаты этого испытания нуждаются в подтверждении в более крупных испытаниях, таких как Австрийское исследование ABCSG8/ARNO 95.
Результаты комбинированного Австрийского исследования АBCSG8/ARNO 95 были представлены после включения 3224 больных при среднем периоде наблюдения 28 месяцев. Оказалось, что переключение на анастрозол пролонгирует и увеличивает «бессобытийную» выживаемость по сравнению с продолжающимся до 5 лет лечением тамоксифеном (НR=0,60; р=0,0009); безметастатическая выживаемость также улучшалась с переключением на анастрозол (НR=0,60; р=0,0067); улучшалась и общая выживаемость (HR=0,71; p=0,038).
Побочные эффекты эндокринотерапии
Известно, что тамоксифен обладает эстрогенным воздействием на здоровый эндометрий, что приводит к его пролиферации и гиперплазии. Длительное применение тамоксифена ассоциируется с нарастанием риска развития полипов, вагинальными кровотечениями, увеличением частоты развития рака эндометрия. В отличие от этого ингибиторы ароматазы индуцируют маточную атрофию и могут уменьшить патологические изменения, вызванные приемом тамоксифена. По данным исследования IES, при использовании эксеместана в адъювантной терапии (switch-off) риск развития гиперплазии эндометрия уменьшается в 6 раз в сравнении с терапией тамоксифеном. Также было показано, что при терапии Аромазином® в сравнении с терапией тамоксифеном почти на 50% уменьшается риск возникновения вагинальных кровотечений и существенно, почти в 3 раза, снижается частота образований полипов матки.
Хорошо известен тот факт, что у больных РМЖ могут развиваться тромбоэмболические осложнения. При этом тамоксифен ассоциируется с умеренным, но достоверным увеличением риска развития венозных тромбоэмболий, особенно при комбинации его с предшествующей химиотерапией. В то же время в исследованиях с применением ИА сообщается о достоверном снижении риска развития тромбоэмболий при сравнении с тамоксифеном (IES: 1,9% vs. 3,1%). У женщин в постменопаузе наблюдается снижение минеральной плотности костной ткани, нередко приводящее к развитию остеопороза и возникновению переломов. Длительное снижение уровня эстрогенов, возникающее при лечении ингибиторами ароматазы, может спровоцировать уменьшение плотности костной ткани. Тамоксифен оказывает положительный эффект на костную минеральную плотность (BMD) у постменопаузальных больных РМЖ (Powles TJ, 2006). У больных, получавших лечение ингибиторами ароматазы, увеличивается частота мышечно-скелетных нарушений в испытаниях, сравнивающих ингибиторы ароматазы с тамоксифеном.
В испытании ATAC анастрозол индуцировал достоверно больше переломов в сравнении с тамоксифеном (11,0% против 7,7%; р=0,0001). Следует отметить, что частота переломов резко нарастала на фоне применения анастрозола в первые 2 года терапии, а затем относительный риск переломов оставался постоянным на протяжении всего периода лечения (ATAC Trialists Group, 2006). И при завершении терапии частота переломов резко снижалась до низких показателей, наблюдаемых при лечении тамоксифеном.
Летрозол также увеличивает риск возникновения переломов при прямом сравнении с тамоксифеном (8,6% против 5,8%; р=0,001) (Coates A,, 2007).
Не существует «скелетных» противопоказаний к использованию ингибиторов ароматазы в адъювантном лечении. Однако строго рекомендуется, особенно у больных с наличием факторов риска остеопороза, определять костно-минеральную плотность (BMD) и фосфор-кальциевый метаболизм до начала терапии ингибиторами ароматазы (Winer EP, 2005). В случаях изначально нормального BMD-статуса рекомендуется выполнить повторный тест при завершении терапии ингибиторами ароматазы. Если с самого начала терапии имеется остеопения, повторное определение BMD рекомендуется через 1—2 года терапии ингибиторами ароматазы. При выявлении исходного остеопороза рекомендуется применение бисфосфонатов одновременно с ингибиторами ароматазы (табл. 2)( Gnant M., 2004).
В клинической практике главными симптоматическими признаками, связанными с лечением ингибиторами ароматазы, остаются артралгии и фибромиалгии, для которых нет ясных физиопатологических объяснений.
Реже всего развитие данных побочных эффектов наблюдалось при назначении Аромазина® (эксеместана): 18,6% vs. 11,8% в группе тамоксифена (р=0,0001). В испытании АТАС достоверно больше пациенток, получающих анастрозол, жаловались на артралгии в сравнении с тамоксифеном (35,6% против 29,4%; р=0,0001). Более 90% больных с описанными жалобами принимали нестероидные противовоспалительные препараты в комбинации с более мягкими анальгетиками. В испытании BIG 1-98 летрозол индуцировал больше артралгий, чем тамоксифен (22,0% против 13,5%; р=0,001).
При изучении ингибиторов ароматазы при распространенных формах РМЖ не было идентифицировано серьезных осложнений сердечной деятельности. Однако продолжительность лечения была относительно короткой (Nabholtz JM, 2006).
В исследовании IES частота ишемического сердечно-сосудистого заболевания несколько снижалась (эксеместан: 3,0% против тамоксифена: 6,9%; р=0,17). По данным исследования BIG 1-98, частота кардиальных «событий» 3—5-й степеней была почти в 2 раза выше при назначении летрозола в сравнении с тамоксифеном (74 случая против 35; р=0,05). Эти «события» были представлены ишемией миокарда (42 случая против 21, соответственно; р
Материалы конгрессов и конференций
В последние годы целый ряд новых гормональных агентов для лечения рака молочной железы (чистые антиэстрогены, ингибиторы ароматазы и агонисты гонадотропин-рилизинг-гормонов) интенсивно изучаются у женщин с гормонозависимыми опухолями. Эти препараты сравниваются с "золотым" стандартом тамоксифеном, а также друг с другом в больших клинических исследованиях.
Тамоксифен vs Анастрозол при диссеминированном раке молочной железы.
Сравнение эффективности ингибитора ароматазы анастрозола с тамоксифеном в качестве гормонотерапии первой линии проведено в двух больших мультицентровых исследованиях, имевших сходный дизайн: Европейском и Северо-Американском. [1,2]. Эти исследования продемонстрировали небольшое повышение эффективности анастрозола по сравнению с тамоксифеном, а также увеличение времени до прогрессирования, особенно у больных с положительными рецепторами к эстрогену.
Аналогичные результаты получены также в исследовании испанских авторов, в котором анастрозол сравнивался с тамоксифеном при проведении гормонотерапии первой линии у больных с положительными рецепторами к эстрогену [3] (табл.4).
Таблица 4.
Анастрозол vs Тамоксифен: Барселонское исследование.
В этом сравнительно небольшом исследовании поучено увеличение продолжительности безрецидивного интервала и повышение непосредственной эффективности при использовании тамоксифена по сравнению с анастрозолом. Спектр токсичности был сходным с незначительным преобладанием частоты вагинальных кровотечений и ощущения приливов у больных, получавших такмоксифен.
Эффективность тамоксифена и анастрозола при перекрестном назначении (cross-over). Частью Европеского и Северо-Американского исследований была оценка эффективности перекрестного (cross-over) назначения анастрозола и тамоксифена в случае прогрессирования (больным, получавшим тамоксифен, при прогрессировании назначался анастрозол и наоборот) (табл.5) [4].
Таблица 5.
Результаты перекрестного назначения тамоксифена/анастрозола.
Полученные данные свидетельствуют о существенной активности анастрозола у больных с прогрессированием на фоне приема тамоксифена и наоборот. Это несомненно является обнадеживающим для больных с гормоночувствительными опухолями молочной железы. Однако, проведение перекреста не позволяет сделать вывод о том, какой же из двух препаратов обеспечил улучшение выживаемости в этих исследованиях.
При среднем сроке наблюдения 2 года никаких существенных изменений содержания холестерина, липопротеидов низкой и высокой плотности, а также триглицеридов не было отмечено ни среди больных, принимавших тамоксифен, ни в группе пациенток, принимавших анастрозол [5].
Летрозол в сравнении с Тамоксифеном при лечении распространенного и раннего рака молочной железы.
Второй ингибитор ароматазы летрозол также является объектом пристального внимания исследователей. Результаты двух больших исследований представлены компанией Новартис. В первом (двойном слепом, перекрестном) сравнивалась эффективность летрозола и тамоксифена при проведении гормонотерапии первой линии у больных в менопаузе с положительными или неизвестными рецепторами [6]. Полученные результаты представлены в табл. 6.
Таблица 6.
Летрозол в сравнении с тамоксифеном при распространенном раке молочной железы.
В этом исследовании летрозол обеспечивал лучшую непосредственную эффективность и более продолжительное время до прогрессирования по сравнению с тамоксифеном. Данные относительно выживаемости отсутствуют. Оба вида лечения переносились больными сравнительно хорошо. Летрозол оценен в сравнении с тамоксифеном также у больных в менопаузе с ранним раком молочной железы [7]. В исследование включались больные, которым планировалось органосохраняющее лечение, с гормонозависимыми опухолями. Продолжительность неоадъювантной гормонотерапии составляла 4 мес., после чего больные подвергались хирургическому лечению. Полученные результаты представлены в табл. 7.
Таблица 7.
Летрозол в сравнении с тамоксифеном в качестве предоперационной гормонотерапии рака молочной железы.
Полученные данные показали, что летрозол был более эффективным по сравнению с тамоксифеном при проведении неоадъювантной гормонотерапии и позволил выполнить большее число органосохраняющих операций. В исследовании были проанализированы также некоторые маркеры клинического эффекта. С этих позиций, гиперэкспрессия HER2 была ассоциирована с резистентностью к тамоксифену, но не летрозолу. Биологические основы этого явления пока не ясны.
Чистые антиэстрогены в сравнении с ингибиторами ароматазы.
Тамоксифен и препараты ему подобные, например, ралоксифен, являются селективными модуляторами рецепторов эстрогенов и обладают свойствами как эстрогенов, так и антиэстрогенов. Одним из перспективных направлений развития гормонотерапии представляется использование "чистых" антиэстрогенов, обладающих исключительно антиэстрогенной активностью и ассоциирующихся с деградацией рецепторов эстрогенов в опухолевых клетках. Целый ряд доклинических исследований свидетельствуют о том, что "чистые" антиэстрогены могут быть полезны в резистентных к тамоксифену случаях рака молочной железы. Эти слова в полной мере могут быть отнесены к "чистому" антиэстрогену фулвестранту (Фазлодекс, ICI 182780), которому посвящены два крупных рандомизированных исследования (Европейское и Северо-Американское), в которых препарат сравнивался с анастрозолом у резистентных к тамоксифену больных в менопаузе [8,9]. Все пациентки, включенные в исследование, имели положительные РЭ и/или РП, а в случае неизвестного рецепторного статуса ранее отвечали на гормонотерапию. Два дозовых режима фулвестранта (125 и 250 мг/сут.) сравнивались с анастрозолом в дозе 1 мг/сут. Характеристика пациенток и предварительные результаты приведены в табл. 8.
Таблица 8.
Фулвестрант vs анастрозол при резистентном к тамоксифену раке молочной железы.
В целом не было выявлено каких-либо существенных различий в частоте объективных эффектов или времени до прогрессирования между фулвестрантом и анастрозолом. Небольшое различие в длительности эффекта было отмечено в Северо-Американском исследовании.
Экземестан в сравнении с Тамоксифеном в качестве первой линии терапии диссеминированного рака молочной железы.
Экземестан в отличие от анастрозола и летрозола имеет стероидную структуру и необратимо блокирует ароматазу. Сравнение эффективности экземестана и тамоксифена проведено в рамках рандомизированного исследования, в котором приняли участие больные диссеминированным раком молочной железы в менопаузе с положительными РЭ и/или РП [10]. Основные результаты исследования приведены в табл. 9.
Таблица 9.
Экземестан vs Тамоксифен при диссеминированном раке молочной железы.
В этом исследовании экземестан продемонстрировал лучшие непосредственные результаты лечения по сравнению с тамоксифеном.
Экземестан в неоадъювантной терапии местно-распространенного рака молочной железы. Роль экземестана в предоперационной терапии рака молочной железы оценена в небольшом исследовании II фазы [11], в которое включены 13 больных постменопаузального возраста с РЭ+. Участницы исследования получали экземестан в суточной дозе 25 мг в течение 3 месяцев перед хирургическим лечением. В среднем отмечено уменьшение опухолевой массы на 85%, и 83% больных ответили на лечение. В результате изучения биоптатов молочных желез было показано, что экземестан снижает циркуляцию периферических и синтез внутриопухолевых эстрогенов.
Итак, несколько рандомизированных исследований были посвящены сравнению тамоксифена и ингибиторов ароматазы в первой линии гормонотерапии диссеминированного рака молочной железы у больных в менопаузе. В целом, ингибиторы ароматазы отличались более благоприятным спектром токсичности по сравнению с тамоксифеном. В большинстве исследований ингибиторы ароматазы продемонстрировали сравнимую с тамоксифеном, а иногда и превосходящую его эффективность. Полученные результаты свидетельствуют о том, что ингибиторы ароматазы могут рассматриваться, наряду с тамоксифеном, как препараты выбора для лечения больных постменопаузального возраста с РЭ+, правда пока нет четких данных об улучшении выживаемости при использовании ингибиторов ароматазы. Нерешенным остается и вопрос об оптимальной последовательности назначения ингибиторов ароматазы и тамоксифена.
Выключение функции яичников или химиотерапия в качестве адъювантного лечения.
Возрождается интерес к проблеме аменореи/овариоэктомии у женщин пременопаузального возраста с гормонозависимой болезнью. Полагают, что эффект адъювантной химиотерапии частично реализуется через индуцируемую аменорею; исследования по изучению этой проблемы признаны сегодня приоритетными [12]. В частности, в исследовании ZEBRA с участием пациенток пременопаузального (
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Ингибиторы ароматазы
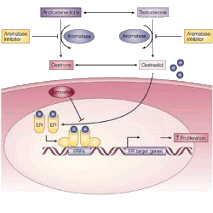
В многочисленных исследованиях было доказано, что рост некоторых опухолей, возникающих у женщин, может зависеть от наличия в организме женских половых гормонов – эстрогенов. К таким опухолям относится рак молочной железы, рак тела матки (эндометрия), а также рак яичников. Лишив опухолевые клетки «подпитки» этими гормонами, можно остановить их рост и даже добиться полного или частичного исчезновения опухоли. Для выяснения, является ли конкретная опухоль зависимой от эстрогенов, проводится специальное исследование, направленное на выявление рецепторов этих гормонов в опухолевых клетках (подробнее – здесь).
Внимание! Ингибиторы ароматазы эффективны для лечения только тех опухолей, которые вырабатывают рецепторы эстрогена.
Основными источниками эстрогенов в организме женщин до наступления менопаузы являются яичники. После наступления менопаузы выработка эстрогенов в яичниках резко сокращается и их уровень в организме резко снижается. Тем не менее, небольшое их количество непрерывно вырабатывается в других органах, большая часть – в жировой ткани. Для стимуляции роста опухолевых клеток может оказаться достаточно минимального количества эстрогенов. Образование эстрогенов в ней происходит за счет работы особого фермента (белка) – ароматазы. Таким образом, в случае отсутствия образования эстрогенов в яичниках, подавление активности ароматазы приводит к прекращению их образования в организме [1].
Ингибиторы ароматазы – класс лекарственных препаратов, подавляющих активность этого фермента и, следовательно, снижающих уровень эстрогенов в организме. При применении ингибиторов ароматазы опухолевые клетки лишаются «подпитки» эстрогенами, их рост замедляется или останавливается. Это останавливает процесс прогрессирования опухоли, снижает риск развития рецидива. Важно отметить, что ингибиторы ароматазы не влияют на процессы образования эстрогенов в яичниках. По этой причине их применение у пациенток, не достигших менопаузы (т.е., во время продолжающихся менструаций), не эффективно. Ингибиторы ароматазы назначаются только пациенткам в постменопаузальном возрасте.
В настоящее время существует три препарата, относящихся к этому классу:
Все ингибиторы ароматазы выпускаются в форме таблеток и принимаются внутрь по 1 таблетке в день. Эксеместан предпочтительно принимать после приема пищи, летрозол и анастрозол можно принимать как до, так и после приема пищи. Вышеуказанные препараты выпускаются под многими торговыми названиями. В многочисленных исследованиях было показано, что применение ингибиторов ароматазы является одним из лучших вариантов для первоначальной эндокринотерапии рака молочной железы. Этот вид лечения может проводиться как после хирургического лечения, лучевой терапии и химиотерапии для снижения риска развития рецидива болезни (адъювантная терапия) , так и в качестве самостоятельного метода лечения в тех случаях, когда проведение других методов не показано. Наиболее часто пациентки принимают ингибиторы ароматазы в течение долгого времени, например, в течение 5 или более лет.
Лечение ингибиторами ароматазы, как правило, хорошо переносится пациентками, однако, на его фоне возможно развитие ряда побочных эффектов. Наиболее часто отмечается снижение минеральной плотности костей (остеопороз), что проявляется снижением их прочности и повышением риска развития переломов. С целью предотвращения развития осложнений в процессе лечения ингибиторами ароматазы периодически проводятся специальные исследования, направленные на оценку состояния костной системы (денситометрия) и, при необходимости, назначаются специальные препараты, направленные на поддержание прочности костей. Также у некоторых пациентов отмечается появление чувства «скованности» в суставах или болей в них, также может отмечаться развитие побочных эффектов со стороны сердца и сосудов и других нежелательных явлений.
Если в процессе лечения у Вас отмечается развитие этих или других побочных эффектов обсудите это с Вашим лечащим врачом. Ваш лечащий врач может предложить вам способы устранения или облегчения этих побочных эффектов или, в случае неудовлетворительной переносимости лечения, заменить препарат на альтернативный. В целом, риск развития побочных эффектов при применении ингибиторов ароматазы ниже, чем на фоне лечения тамоксифеном.
Как было сказано выше, ингибиторы ароматазы способны подавить процессы образования эстрогенов только у пациенток после менопаузы. Для лечения пациенток более молодого возраста чаще используется тамоксифен, препарат, блокирующий связывание эстрогена с его рецепторами за счет их «захвата». Тем не менее, так как эффективность ингибиторов ароматазы может быть выше, чем эффективность тамоксифена. По этой причине разработана методика, предусматривающая «выключение» функции яичников на период лечения ингибиторами ароматазы.
Необходимо отдельно отметить, что в некоторых ситуациях выяснить, действительно ли пациентка достигла менопаузы бывает непросто: не всегда прекращение менструаций (аменорея) означает менопаузу. Существуют и другие причины аменореи, включая недавно проведенную химиотерапию, выраженное снижение массы тела и т.д. Разработаны специальные критерии определения менопаузы [2]:
- Отсутствие менструаций в течение 12 месяцев или более при отсутствии ранее проведенной химиотерапии, эндокринотерапии, а также проведения других видов лечения, способствующих подавлению функции яичников;
- Ранее проведенная операция по удалению яичников (придатков матки);
- Возраст старше 60 лет;
- Концентрация ФСГ и эстрадиола в плазме крови, гормонов, отражающих функцию яичников, соответствующая постменопаузе.
Если пациентка не соответствует этим критериям, факт наступления менопаузы может быть сомнительным. В этом случая следует обсудить вопрос о подавлении функции яичников (медикаментозном, при помощи препаратов-аналогов ГНРГ или хирургическом) либо обсудить другие методы лечения.
Читайте также:
