Белки плазматической мембраны
Добавил пользователь Alex Обновлено: 29.01.2026
Ростовский НИИ акушерства и педиатрии
Ростовский НИИ акушерства и педиатрии
Ростовский НИИ акушерства и педиатрии
ФГБУ «Ростовский научно-исследовательский институт акушерства и педиатрии» Минздрава России, Ростов-на-Дону, Россия
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Роль нарушения белково-липидного состава плазматических мембран плаценты и модификации мембранотранспортных процессов в развитии осложненной беременности
Журнал: Проблемы репродукции. 2017;23(5): 42‑47
Ростовский НИИ акушерства и педиатрии
Цель исследования — изучить особенности белкового и липидного спектра мембран микроворсин синцитиотрофобласта и характер мембранотранспортных процессов при плацентарной недостаточности (ПН). Материал и методы. В исследование вошли 46 женщин: у 25 — доношенная беременность осложнилась ПН (основная группа), у 21 — беременность протекала без осложнений (контрольная группа). Мембраны выделяли методом дифференциального ультрацентрифугирования. Фракционный состав липидов мембран определяли путем гель-хроматографии. Мембранные белки, солюбилизированные детергентами, разделяли методом электрофореза в полиакриламидном геле. Для суждения о состоянии мембранотранспортных процессов оценивали продукцию белков, регулирующих эти процессы, с помощью двухмерного электрофореза и времяпролетной масс-спектрометрии. Результаты. При ПН значительно увеличивается мембранный коэффициент холестерин/фосфолипиды, снижается количество фосфатидилэтаноламина, фосфатидилинозита, фосфатидилхолина. Обратная направленность изменений обнаружена для лизофосфатидилхолина, сфингомиелина, фосфатидилсерина и фосфатидилглицерина. Для белковых молекул мембран характерно изменение их солюбилизации различными детергентами, а также перераспределение содержания белков во фракциях с разной электрофоретической подвижностью, что свидетельствует о модификации гидрофобных взаимодействий в белок-липидных компонентах, а также деградации белковых ассоциатов мембран. При ПН нарушена продукция белков, регулирующих активный транспорт: мембраносвязанного фермента Na, К-АТФазы, аннексинов А и А, виментина. Выводы. Развитие ПН происходит на фоне изменений в липидном и белковом компонентах мембран микроворсин синцитиотрофобласта, модификации продукции белков, участвующих в мембранном транспорте. Выявленные изменения могут быть важными звеньями в цепи молекулярных повреждений при ПН.
Ростовский НИИ акушерства и педиатрии
Ростовский НИИ акушерства и педиатрии
Ростовский НИИ акушерства и педиатрии
ФГБУ «Ростовский научно-исследовательский институт акушерства и педиатрии» Минздрава России, Ростов-на-Дону, Россия
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Среди факторов, осложняющих беременность, важное место занимает плацентарная недостаточность (ПН), частота которой до настоящего времени остается достаточно высокой [1, 2]. Это обосновывает актуальность дальнейшего исследования клеточно-молекулярных механизмов формирования данной акушерской патологии. Развитие П.Н. может быть связано с изменением физико-химических свойств плазматических мембран плаценты.
Мембранные структуры являются той универсальной формой организации клетки, которая обусловливает все ее разнообразные свойства. В плазматических мембранах локализован ряд важнейших механизмов, обеспечивающих жизнедеятельность клетки: активный транспорт, контактные взаимодействия, рецепция различных биоактивных соединений и сигнальных молекул, ответственных за обеспечение внутри- и межклеточной регуляции, и многие другие. Значительное число процессов, контролируемых мембранами, убедительно свидетельствует о возможности нарушения клеточного метаболизма и чувствительности клетки к внешним воздействиям в результате изменения структуры и свойств мембран [3, 4]. Нарушение функциональной активности плазматических мембран плаценты может ухудшать не только метаболизм в самом органе, но и в целом фетоплацентарный обмен, снабжение плода необходимыми для его роста и развития пластическими веществами [5, 6].
В настоящее время данные о биохимическом составе плазматических мембран микроворсин синцитиотрофобласта, обеспечивающего основной обмен между организмами матери и плода, немногочисленны и касаются лишь отдельных компонентов [7—10]. Ранее неизвестные сведения о составе и свойствах мембран плаценты позволяют углубить современные представления о механизмах развития ПН.
Цель работы — изучение белкового и липидного спектров мембран микроворсин синцитиотрофобласта, а также характера мембранотранспортных процессов в плаценте при физиологической беременности и осложненной ПН.
Материал и методы
В проспективное исследование включены 46 женщин в возрасте 24—33 лет: у 21 — беременность протекала без осложнений и закончилась своевременными родами (контрольная группа), у 25 — доношенная беременность осложнилась ПН (основная группа), верифицированной после родов. Диагноз П.Н. поставлен на основании комплексного клинико-лабораторного обследования, включающего оценку биофизического профиля плода, результатов кардиотокографии, определения интенсивности фето- и маточно-плацентарного кровотока, сывороточной активности специфических плацентарных изоферментов [11]. В исследование не были включены пациентки с декомпенсированными формами соматических заболеваний, аутоиммунной патологией, многоплодной беременностью, инфекционными заболеваниями, а также не давшие информированное согласие на расширенный алгоритм исследования.
В контрольной группе было 9 первобеременных и первородящих женщин. У 10 повторнобеременных и повторнородящих имели место два и более прерывания беременности по желанию женщины. У 4 пациенток в анамнезе наблюдались воспалительные заболевания органов малого таза. В основной группе было 11 первобеременных и первородящих женщин. У 12 повторнобеременных и повторнородящих имели место два и более прерывания беременности по желанию женщины. У 6 пациенток основной группы в анамнезе отмечались воспалительные заболевания органов малого таза. Женщины контрольной и основной групп были сопоставимы по возрасту, паритету беременности и родов, соматическому и акушерско-гинекологическому анамнезу.
Материалом исследования служила плацента, взятая сразу после родов в сроке 39—40 нед при соблюдении холодового режима (4 °С). Микроскопические исследования выявили в плаценте женщин основной группы наличие небольших участков кальциноза, фиброза, мелкие межворсинчатые кровоизлияния. В плацентах пациенток контрольной группы видимых изменений материнской и плодной поверхностей не обнаружено, но в ряде случаев отмечались небольшие участки фибриноидных масс, умеренная гиповаскуляризация децидуальной ткани.
Для исследования брали участки из центральной части плодной стороны плаценты диаметром 5×5 см. Из гомогенатов этих участков плаценты методом дифференциального ультрацентрифугирования, разработанным для плацентарной ткани, выделяли мембраны микроворсин синцитиотрофобласта [12]. Чистота выделенной фракции подтверждалась определением маркерных ферментов биомембран: 5’-нуклеотидазы (КФ3.1.3.5) и Na + , К + -АТФазы (КФ3.6.1.3), активность которых в среднем в 10 раз превышала таковую в гомогенатах плаценты. Активность ферментов оценивали с помощью коммерческих наборов фирмы «Randox» (Германия).
Содержание общих фосфолипидов, составляющих основной липидный компонент мембран микроворсин, и холестерина определяли с помощью наборов вышеуказанной фирмы на анализаторе Sapphire 400 (Япония). Фракционирование фосфолипидов осуществляли хроматографией в системе хлороформ—метанол—вода на пластинах с закрепленным слоем силикагеля [13]. Фосфолипиды идентифицировали с помощью стандартных свидетелей («Sigma», США) и оценивали их количество во фракциях денситометрически (Camag TLC Scanner, Швейцария).
Мембранные белки после последовательной солюбилизации детергентами тритоном Х-100 и додецилсульфатом натрия разделяли методом электрофореза в полиакриламидном геле (приборы Protein I EF Cell и Protein II Xi Multi-Cell, «Bio-Rad», США). Количественную оценку электрофореграмм после окрашивания кумасси бриллиантовым голубым R-250 проводили на денситометре Camag TLC Scanner II (Швейцария) с интегратором фирмы «Hewlett Packard» (США).
Для суждения о состоянии мембранотранспортных процессов определяли интенсивность продукции белков, регулирующих эти процессы: (аннексины А2 и А4, виментин, Na + , К + -АТФаза). Идентификацию белков после электрофоретического разделения и процедуры трипсинолиза проводили методом времяпролетной масс-спектрометрии (MALDI-TOF-MS) на масс-спектрометре Autoflex II («Bruker», Германия) с использованием программы Mascot MS Search («Matrix Science», Великобритания) и баз данных NCBI и Swiss-Prot.
Статистическую обработку данных осуществляли с использованием лицензионного пакета программ Statistica (версия 6.0. фирмы «StatSoft. Inc.»). Однородность дисперсий проверяли по критерию Фишера. Достоверность различий между сравниваемыми показателями определяли по t-критерию Стьюдента. Результаты оценивали как статистически значимые при p
Результаты и обсуждение
Полученные данные свидетельствуют о значительных изменениях в биохимическом составе мембран микроворсин плаценты при осложненной беременности по сравнению с физиологическими показателями. Прежде всего это относится к липидному компоненту (см. таблицу; рис. 1).

Содержание липидных компонентов мембран микроворсин синцитиотрофобласта при физиологической беременности и плацентарной недостаточности (M±m)Примечание. Достоверность различий относительно контрольных величин: * — p
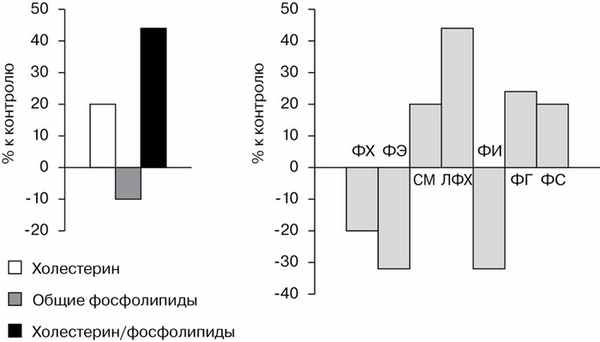
Рис. 1. Изменение содержания липидных компонентов мембран микроворсин синцитиотрофобласта (% к контролю) при ПН.
Уровень общих фосфолипидов в плацентарных мембранах при ПН снижен на 17% на фоне гиперхолистериноза, что сопровождается значительным повышением (на 46%) коэффициента холестерин/фосфолипиды относительно аналогичной величины при неосложненной беременности. Следствием повышения этого коэффициента является изменение таких свойств мембранного бислоя, как увеличение его вязкости, изменение поверхностного потенциала, характера проницаемости и модификация транспортных процессов в плаценте.
Среди отдельных фосфолипидных фракций наиболее сниженным было содержание легкоокисляемых фосфатидилэтаноламина (ФЭ) — в 1,4 раза и фосфатидилинозина (ФИ) — в 1,5 раза. Известно, что ФИ участвует в обеспечении активного транспорта и процессов рецепции [14]. Фосфоинозидная рецепторная система играет важную роль в регуляции действия половых стероидов, и снижение уровня этого фосфолипида будет нарушать реализацию гормональных эффектов. Что касается ФЭ, то, кроме общих функций поддержания структуры и свойств мембран, он влияет на скорость АТФазной реакции, участвуя тем самым в обеспечении энергетического баланса плаценты, который, несомненно, будет нарушаться при уменьшении содержания ФЭ [10].
Количество фосфатидилхолина (ФХ), сфингомиелина (СМ), достаточно насыщенных по жирно-кислотному составу, также снижается при ПН, хотя и в меньшей степени — в среднем на 20%. Важно отметить, что ФХ рассматривается как основной поставщик арахидоновой кислоты плоду [13, 16]. В связи с этим уменьшение его содержания может негативно влиять не только на плацентарный обмен, но и на развитие плода. Снижение количества ФЭ и ФХ в определенной мере связано с угнетением реацилирования лизофосфатидилхолина (ЛФХ), что подтверждается повышением уровня последнего (на 45%). Увеличение содержания ЛФХ усиливает его мембранолитическое действие [16] и приводит к повреждению нативной структуры мембран.
Аналогичная направленность изменения характерна для содержания фосфатидилсерина (ФС) и фосфатидилглицерина (ФГ). Поскольку Ф.С. является весьма кислым компонентом липидного спектра, то повышение его количества (на 21%), по-видимому, нарушает ионное состояние липидной фазы бислоя мембран.
Различия обнаружены и в содержании белков отдельных фракций, а также в электрофоретической (ЭФ) подвижности некоторых из них (рис. 2). Уровень высокомолекулярных белков тритонового экстракта (относительная молекулярная масса 250 кД и выше) с наименьшей ЭФ-подвижностью снижается на 25%, количество белков с наибольшей анодной подвижностью (относительная молекулярная масса 25—30 кД), напротив, в 1,5—2 раза увеличивается по сравнению с контрольными величинами. Кроме того, наблюдается отсутствие одной фракции в зоне белков с молекулярной массой 150—160 кД. Для спектра белков, экстрагированных додецилсульфатом натрия, также имеют место более чем двукратное повышение содержания низкомолекулярных фракций и уменьшение количества стартовых белков на 30%. ЭФ-подвижность одной из фракций увеличивается с 0,12±0,01 (в норме) до 0,15±0,07 (при ПН).
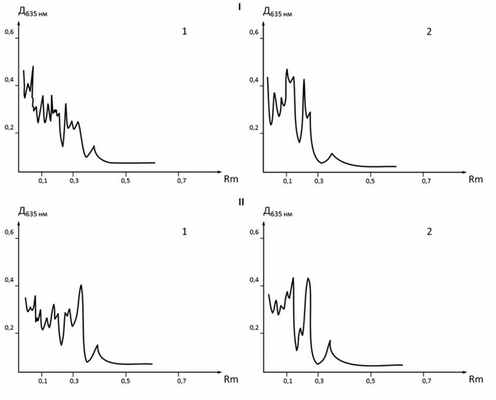
Рис. 2. Денситограммы белков мембран микроворсин синцитиотрофобласта, экстрагированных тритоном Х-100 (1) и додецилсульфатом натрия (2), при физиологической беременности (I) и ПН (II).
Изменение степени солюбилизации белков различными детергентами, в том числе относительное повышение солюбилизации более легким детергентом тритоном Х-100, свидетельствует о модификации гидрофобных взаимодействий в белок-липидных компонентах мембран. Уменьшение содержания белков в медленно мигрирующих высокомолекулярных фракциях и соответствующее возрастание в «быстрых» фракциях, очевидно, объясняются дезагрегацией белковых ассоциатов мембранных структур. Сдвиги в белковом составе мембран плаценты могут быть вызваны различными причинами, в том числе усилением атакуемости белков пептид-гидролазами, которое имеет место при осложненной беременности [17].
Обнаруженные изменения в содержании основных компонентов мембран, по-видимому, являются молекулярной основой нарушения транспортных функций плаценты при ее недостаточности, особенно активного транспорта, сопряженного с функционированием специфических белков, участвующих в обеспечении этого транспорта. Как показали наши исследования, при ПН уменьшается количество мембраносвязанного фермента Na + , К + -АТФазы. Na + , К + -зависимая транспортная система, функционирующая в плазматических мембранах синцитиотрофобласта, зависит от уровня и активности этого фермента. Данная система контролирует значительный объем внутри- и межклеточного перехода различных веществ, прежде всего аминокислот, необходимых плоду для обеспечения трофических процессов [18, 19].
К числу белков, способных влиять на трансмембранные процессы, относится локализованный на поверхности синцитиотрофобласта аннексин А4 [20], продукция которого в мембранах значительно снижена, что сопровождается нарушением его функций. Для еще одного белка с аналогичным влиянием на клеточный обмен — аннексина А2 [21], представленного на плазматической мембране, также установлено уменьшение экспрессии. Однонаправленные изменения содержания аннексинов А2 и А4 усиливают метаболические повреждения, связанные с проницаемостью плазматических мембран. Нарушение синтеза характерно и для виментина — белка, хотя и не локализованного на мембране, но влияющего на взаимосвязи и взаимодействия различных систем клетки и регулирующего мембранный транспорт [22].
Приведенные данные свидетельствуют о том, что наряду со структурными перестройками в мембранах плаценты изменяется и интенсивность продукции ряда белков, в том числе и ферментов, участвующих в обеспечении трансмембранных реакций. Кроме того, важно отметить, что нарушение состава и свойств мембран, очевидно, может сопровождаться изменением характера рецепции, в частности, чувствительности мембранных рецепторов на уровне узнавания и связывания различных биорегуляторов межклеточных процессов.
Резюмируя полученные результаты, можно заключить, что развитие ПН происходит на фоне глубоких нарушений в белковом и липидном составе мембран микроворсин синцитиотрофобласта, в том числе на фоне снижения продукции белков, регулирующих мембранотранспортные процессы. Выявленные изменения в мембранах плаценты, учитывая их многочисленные функции, могут быть важными звеньями в общей цепи молекулярно-биохимических повреждений при ПН.
Белки плазматической мембраны
Организация клетки. Биомембраны
Биомембраны: структура и функции
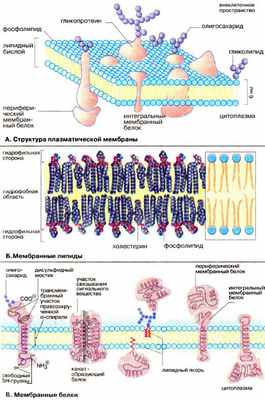
А. Структура плазматической мембраны
Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6 нм, в которые встроены белки . Некоторые мембраны содержат, кроме того, углеводы , связанные с липидами и белками. Соотношение липиды : белки : углеводы является характерным для клетки или мембраны и существенно варьирует в зависимости от типа клеток или мембран (см. с. 218).
Компоненты мембран удерживаются нековалентными связями (см. с. 12), вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть мембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру.
В то время как «дрейф» в плоскости мембраны происходит достаточно легко, переход белков с внешней стороны мембраны на внутреннюю («флип-флоп») невозможен, а переход липидов происходит крайне редко. Для «перескока» липидов необходимы специальные белки транслокаторы. Исключение составляет холестерин, который может легко переходить с одной стороны мембраны на другую.
Б. Мембранные липиды
На рисунке схематически изображена биомембрана. В мембранах содержатся липиды трех классов: фосфолипиды, холестерин и гликолипиды. Наиболее важная группа, фосфолипиды, включает фосфатидилхолин (лецитин), фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит и сфингомиелин (см. с. 56). Холестерин присутствует во внутриклеточных мембранах животных клеток (за исключением внутренней мембраны митохондрий). Гликолипиды входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводные функциональные группы (см. с. 92), которые ориентируются в водную фазу.
Липиды мембран представляют собой амфифильные молекулы с полярной гидрофильной головкой (голубого цвета) и неполярным липофильным хвостом (желтого цвета). В водной среде они агрегируют за счет гидрофобных взаимодействий и вандерваальсовых сил (см. сс. 12, 34).
В. Мембранные белки
Протеины могут связываться с мембраной различным путем.
Интегральные мембранные белки имеют трансмембранные спирализованные участки (домены), которые однократно или многократно пересекают липидный бислой. Такие белки прочно связаны с липидным окружением.
Периферические мембранные белки удерживаются на мембране с помощью липидного «якоря» (см. с. 230) и связаны с другими компонентами мембраны; например, они часто бывают ассоциированы с интегральными мембранными белками.
У интегральных мембранных белков фрагмент пептидной цепи, пересекающий липидный бислой, обычно состоит из 21-25 преимущественно гидрофобных аминокислот, которые образуют правую α-спираль с 6 или 7 витками (трансмембранная спираль).
Белки клеточной поверхности и некоторые липидные молекулы несут ковалентно связанные углеводные компоненты, экспонированные на наружной стороне мембраны. Эти гликопротеины и гликолипиды вместе с дополнительными несвязанными гликопротеинами и полисахаридами образуют клеточную оболочку (гликокаликс) (см. с. 50).
Функции, значение и строение плазматической мембраны
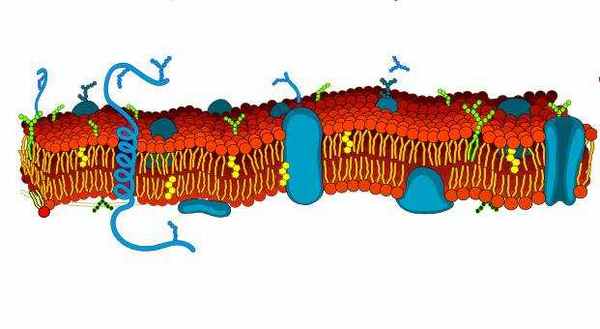
Клеточная мембрана (плазматическая мембрана) представляет собой тонкую полупроницаемую оболочку, которая окружает цитоплазму клетки.
Функция и роль клеточной мембраны
Ее функция заключается в том, чтобы защитить целостность внутренней части клетки, впуская некоторые необходимые вещества в клетку, и не позволяя проникать другим.
Он также служит основой привязанности к цитоскелету у одних организмов и к клеточной стенке у других. Таким образом, плазматическая мембрана также обеспечивает форму клетки. Еще одна функция мембраны заключается в регулировании роста клеток через баланс эндоцитоза и экзоцитоза.
При эндоцитозе липиды и белки удаляются из клеточной мембраны по мере усвоения веществ. При экзоцитозе везикулы, содержащие липиды и белки, сливаются с клеточной мембраной, увеличивая размер клеток. Животные, растительные и грибковые клетки имеют плазматические мембраны. Внутренние органеллы, например, ядро, также заключены в защитные мембраны.
Структура клеточной мембраны
Плазматическая мембрана в основном состоит из смеси белков и липидов. В зависимости от расположения и роли мембраны в организме, липиды могут составлять от 20 до 80 процентов мембраны, а остальная часть приходится на белки. В то время как липиды помогают придать мембране гибкость, белки контролируют и поддерживают химический состав клетки, а также помогают в переносе молекул сквозь мембрану.
Липиды мембран
Фосфолипиды являются основным компонентом плазматических мембран. Они образуют липидный бислой, в котором гидрофильные (притянутые к воде) участки “головы” спонтанно организуются, чтобы противостоять водному цитозолю и внеклеточной жидкости, тогда как гидрофобные (отталкиваемые водой) участки “хвоста” обращены от цитозоля и внеклеточной жидкости. Липидный бислой является полупроницаемым, позволяя только некоторым молекулам диффундировать через мембрану.
Холестерин является еще одним липидным компонентом мембран животных клеток. Молекулы холестерина избирательно диспергированы между мембранными фосфолипидами. Это помогает сохранить жесткость клеточных мембран, предотвращая слишком плотное расположение фосфолипидов. Холестерин отсутствует в мембранах растительных клеток .
Гликолипиды расположены с наружной поверхности клеточных мембран и соединяются с ними углеводной цепью. Они помогают клетке распознавать другие клетки организма.
Белки мембран
Клеточная мембрана содержит два типа ассоциированных белков. Белки периферической мембраны являются внешними и связаны с ней путем взаимодействия с другими белками. Интегральные мембранные белки вводятся в мембрану, и большинство проходит сквозь нее. Части этих трансмембранных белков расположены по обе ее стороны.
Белки плазматической мембраны имеют ряд различных функций. Структурные белки обеспечивают поддержку и форму клеток. Белки рецептора мембраны помогают клеткам контактировать со своей внешней средой с помощью гормонов, нейротрансмиттеров и других сигнальных молекул. Транспортные белки, такие как глобулярные белки, переносят молекулы через клеточные мембраны посредством облегченной диффузии. Гликопротеины имеют прикрепленную к ним углеводную цепь. Они встроены в клеточную мембрану, помогая в обмене и переносе молекул.
Мембраны органелл
Некоторые клеточные органеллы также окружены защитными мембранами. Ядро, эндоплазматический ретикулум, вакуоль, лизосома и аппарат Гольджи являются примерами окруженных мембраной органелл. Митохондрии и хлоропласты покрыты двойной мембраной. Мембраны различных органелл различаются по молекулярному составу и хорошо подходят для выполнения своей роли. Они важны для нескольких жизненно важных функций клеток, включая синтез белка, производство липидов и клеточное дыхание.
Биологические мембраны
Клеточная мембрана - это неотъемлемый компонент любой клетки. Ее роль в первую очередь состоит в том, чтобы отграничить внутреннее пространство клетки от внешней среды, а у эукариот, кроме того, разделить внутреннюю часть клетки на функционально значимые отсеки: ядро и митохонодрии. Во внешней клеточной мембране (цитолеме) функционируют транспортные белки, рецепторы. Структурной основой всех мембран являются липиды, в частности фосфолипиды, представленные двумя соединениями фосфодиацилглициринами и сфингомиелинами.
Фосфотидилглицерин - наиболее распространенный представитель фосфолипидов он присутствует в мембранах всех живых организмов и является производным фосфатидной кислоты . В основном это кислоты с длиной углеродной цепи 12-24 атома, либо полностью насыщенные либо имеющие одну или несколько несопряженных двойных связей. В структуре фосфолипидов заложена важная функциональная особенность: содержание длинной гидрофобной цепи и гидрофильной "головки" из фосфатидной кислоты.
Сфингомиелины являются производными аминоспирта сфингозина . Они характерны только для мембран животных клеток.
Наряду с этими компонентами мембраны содержат белки и связанные с ними углеводы.
Мембраны представляют собой плоские образования толщиной в несколько молекул (60-100 Å). Основу составляет липидный бислой, где гидрофильные головки обращены к воде внутри и снаружи клетки, а гидрофобные хвосты из жирных кислот как бы выталкиваются из воды и сливаются между собой внутри мембраны (рис. 4.7.1.). Отдельные участки мембраны, липиды которых содержат больше насыщенных ЖК находятся в жестком состоянии, другие, где содержится больше ненасыщенных ЖК, в более расплавленном. Между ацилными цепями липидного бислоя содержится холестерол , он препятствует их кристаллизации, т.е. поддерживает состояние текучести.
Мембрана не статическое образование, а благодаря жидкокристаллической структуре она является двухслойным раствором, в котором липиды способны диффундировать как параллельно поверхности мембраны, так и из одного монослоя в другой.
В структуру мембран обязательно входят белки и их состав варьирует в зависимости от функции той или иной мембраны. В зависимости от прочности связи с мембраной различают периферические и интегральные белки. Интегральные белки располагаются между липидами монослоя или пронизывают весь бислой, часто возвышаясь над поверхностью мембраны. Периферические белки связаны с мембранами электростатическими и водородными связями и часто взаимодействуют таким образом с интегральными белками (рис. 4.7.1.).
Белки выполняют следующие функции :
1) транспорт (трансмембранный перенос веществ);
2) преобразование энергии (ферменты дыхательной цепи);
3) коммуникативную (рецепторные белки связывают клетку с окружающей средой);
4) и ряд специфических функций.
Трансмембранный транспорт веществ
Липидный бислой практически непроницаем для ионов и большинства полярных молекул. Исключение составляет вода. Перенос веществ через клеточную мембрану осуществляется одним из трех путей: простой диффузией, облегченным и активным транспортом.
Простая диффузия осуществляется за счет теплового движения молекул из зоны с большей концентрацией в зону с меньшей концентрацией. Разность концентраций по обе стороны мембраны называется градиентом концентраций. При переносе заряженных частиц важную роль играет разница потенциалов. Обычно внутри клетки накапливаются отрицательно заряженные частицы. Таким путем транспортируются: Н2О, СО2, О2. Перенос веществ простой диффузией прекращается когда концентрация вещества с одной и с другой стороны мембраны выравнивается.
Облегченная диффузия более распространенный способ транспорта веществ через мембрану. Здесь принимают участие специальные белки-переносчики. К ним относятся ферменты транслоказы и пермиазы. Они связывают своим активным центром вещество с одной стороны мембраны и переносят его сквозь гидрофобный слой мембраны на ее другую поверхность. Еще один вариант такой диффузии: после присоединения транспортируемого вещества меняется конформация белка-переносчика и в мембране открывается специальный гидрофильный канал, по которому и проникает вещество.
Активный транспорт - это транспорт против градиента концентраций и происходит при затрате энергии. Если источник энергии АТФ, то это первично-активный транспорт, если энергия получается за счет переноса в этот момент другого вещества по градиенту концентраций - это вторично-активный транспорт.
Типичный первично-активный транспорт это калий-нартиевый насос. Он локализован в плазматической мембране практически всех клеток и переносит ионы калия и натрия против градиента концентраций с использованием энергии АТФ (рис. 4.7.2.).
Собственно насос это фермент Na + - K + -АТФ-аза, интегральный белок пронизывающий липидный бислой мембраны насквозь. Внутри клетки к активному центру этого фермента присоединяется 3 иона N а + , при этом фермент активируется и расщепляет АТФ на АДФ и остаток фосфорной кислоты. Этот остаток присоединяется к самому ферменту и изменяет его пространственную конформацию. При этом с внутренней стороны мембраны закрывается ионный канал, но открывается на наружной поверхности. Ионы Na + отсоединяются от фермента, но в это же время к другому активному центру фермента присоединяются 2 иона К + . Это вновь изменяет его пространственную конформацию, отщепляется остаток фосфорной кислоты и открывается канал для проникновения К + внутрь клетки. Далее цикл повторяется. Т.о. при выносе из клетки 3 ионов Na + в нее проникает 2 иона К + . Это ведет к появлению электрического потенциала, который называется трансмембранным электрохимическим потенциалом. Если насос прекратит работу, то ионы Na + и К + начнут перемещаться в обратном направлении. По такому же механизму транспротируются ионы Са 2+ (фермент Са 2+ -АТФ-аза).
Перекисное окисление липидов мембран
Перекисное окисление липидов является свободнорадикальным процессом, инициация которого происходит под действием активных форм кислорода. К ним относятся супероксид-ион О2 - , пероксид-ион О2 2- (из Н2О2), гидроксильный радикал НО*, гидропероксидный радикал НО O * .Они образуются в результате процессов окисления протекающих в клетке при участии железо-содержащих ферментов (цитохромов).
Свободные радикалы это частицы с неспаренными электронами на внешних орбиталях

Механизм инициации ПОЛ
1) R - C H - … + OH * = R - C * - или ( R * ) свободный радикал высшей жирной кислоты (ВЖК);
2) R * + O 2 = R - O - O * пероксидный ион ВЖК;
3) R - O - O * + R -С H = R - O - OH (гидроперкеись ВЖК) + R *.
Реакции 2 и 3 теперь могут идти без активных форм кислорода они превращаются в цепные.
Продукты перекисного окисления липидов:
R * свободный радикал ВЖК,
R -О-О* пероксидион ВЖК,
R -О-О H гидроперекись ВЖК,
Активация процессов ПОЛ, независимо от факторов индукции, может вести к деструктивным изменениям в клетках, что связано с накоплением продуктов, способных инактивировать мембранные ферменты, нарушать белок-липидные взаимодействия в мембранах, образовывать межмолекулярные сшивки, изменять вязкость липидной фракции, что препятствует образованию фермент-субстратного комплекса.
Но, несмотря на вышеперечисленные патологические процессы, важно отметить, что ПОЛ это физиологический процесс и он имеет важное значение для организма. Уровень продукции ПОЛ в норме контролируется рядом антиоксидантных веществ и ферментов. К ним относятся витамины: Е , С , бета-каротин, убихинон ( коэнзим Q ) и антиоксидантные гем-содержащие ферменты супероксиддисмутаза (СОД), каталаза , глутатионпероксидаза, глутатионредуктаза. Высокая активность ПОЛ может привести к подавлению активности антиоксидантных ферментов. В этом случае в клетках развиваются вышеописанные процессы, которые с клеточных мембран переходят на цитоплазматические структуры. Это приводит к денатурации клеточных белков, снижению активности ряда ключевых метаболических ферментов и повреждению клеточного генома. Такое явления носит название окислительный стресс. Все это заканчивается гибелью клетки по пути некроза (разрушения клеточных структур) или апоптоза (запрограммированного суицида).
ЛИТЕРАТУРА К ГЛАВЕ IV .7.
1. Бышевский А. Ш., Терсенов О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С. Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Ленинджер А. Биохимия. Молекулярные основы структуры и функций клетки // М.: Мир, 1974, 956 с.;
4. Пустовалова Л.М. Практикум по биохимии // Ростов-на Дону: Феникс, 1999, 540 с;
5. Gutteridge J.V.C., Halliwell B. The measurement and mechanism of lipid peroxidation in biological systems // Trends in Biochem. Sci., 1990, р. 129-135.
Биологические мембраны
Биологи́ческие мембра́ны — тонкие (не более 10 нм толщиной) липопротеидные пленки, состоящие из двойного слоя липидных молекул, в который включены молекулы разнообразных белков. Расположены на поверхности клеток (плазматическая мембрана) и внутриклеточных частиц (ядра, митохондрий и др.). В весовом отношении в зависимости от типа мембраны на долю липидов приходится 25-60%, а на долю белков — 40-75%. В состав многих мембран входят углеводы, количество которых может достигать 2-10%.
Липиды мембран
Состав липидов биологических мембран очень разнообразен. Характерными представителями липидов клеточных мембран являются фосфолипиды, сфингомиелины и холестерин (стероидный липид). Характерной особенностью мембранных липидов является разделение их молекулы на две функционально различные части: не полярные, не несущие зарядов хвосты, состоящие из жирных кислот, и заряженные полярные головки. Полярные головки несут на себе отрицательные заряды или могут быть нейтральными. Наличие неполярных хвостов объясняет хорошую растворимость липидов в жирах и органических растворителях. В эксперименте, смешивая с водой выделенные из мембран липиды можно получить бимолекулярные слои или мембраны толщиной около 7, 5 нм, где периферические зоны слоя — это гидрофильные полярные головки, а центральная зона — незаряженные хвосты молекул липидов. Такое же строение имеют все естественные клеточные мембраны. Клеточные мембраны сильно отличаются друг от друга по составу липидов. Например, плазматические мембраны клеток животных богаты холестерином (до 30%), и в них мало лецитина, в то время как мембраны митохондрий богаты фосфолипидами и бедны холестерином. Липидные молекулы могут перемещаться вдоль липидного слоя, могут вращаться вокруг своей оси, а также переходить из слоя в слой. Белки, плавающие в «липидном озере», тоже обладают некоторой латеральной подвижностью. Состав липидов по обе стороны мембраны различен, что определяет асимметричность в строении билипидного слоя.
Мембранные белки
Белковые молекулы, которые значительно тяжелее и крупнее молекул липидов, как бы вкраплены в билипидный слой мембраны. Большая часть молекул белков частично погружена в мембрану и связана с липидами путем гидрофобных взаимодействий. Это так называемые интегральные белки. Другие белки связаны только с полярными «концами» молекул липидов и находятся на поверхности билипидного слоя, третьи пронизывают мембрану насквозь. Асимметрия в строении мембран ярче всего проявляется в отношении интегральных белков. Они строго ориентированы: их N-концы смотрят в полость вакуолей или во внеклеточную среду.
Мембраны сильно различаются по составу белков, которые собственно и определяют их функциональные свойства. Все мембранные белки можно разделить на три группы: ферменты, рецепторные белки и структурные белки.
В разных мембранах существует характерный набор ферментов. Например, в плазматической мембране локализуется К-Nа-зависимая АТФ-аза, участвующая в транспорте ионов. Рецепторные белки специфически связываются с теми или иными веществами и как бы «узнают» их: это белки-рецепторы для гормонов, для узнавания поверхности соседних клеток, вирусов и т. д. Структурные белки обеспечивают прочность мембраны и связаны с разнообразными белковыми структурами цитоплазмы. Например, в эпителиальных клетках специальные белки плазматической мембраны связываются с элементами цитоскелета и участвуют в образовании целого ряда межклеточных соединений, таких как десмосомы, адгезивные контакты и др.
Углеводы мембран
С мембранами связаны главным образом гликопротеины — молекулы белков, ковалентно связанных с цепочками углеводов. Как правило, молекулы углеводов расположены в наружных слоях мембран. Чаще всего это короткие линейные или разветвленные цепочки, в состав которых входят галактоза, манноза, фруктоза, сахароза, N-ацетилглюкозамин, арабиноза, ксилоза и др.
Синтез клеточных мембран
Строятся все клеточные мембраны (кроме мембран митохондрий и пластид) в гранулярном эндоплазматическом ретикулюме. От него отщепляются мелкие мембранные вакуоли, которые сливаются с мембранами аппарата Гольджи. Мембранные везикулы, продуцируемые, в свою очередь, аппаратом Гольджи, идут на построение плазматической мембраны, секреторных вакуолей и всех других мембранных компонентов клетки.
Читайте также:
