Бифуркация аорты. Подвздошные артерии. Топография подвздошной артерии.
Добавил пользователь Владимир З. Обновлено: 27.01.2026
IV. Базилярная артерия, ее формирование, топография, конечные ветви и области кровоснабжения.
V. Образование артериального (вилизиева) круга большого мозга, его расположение и клиническое значение.
VI. Внутренняя грудная артерия, ее топография, конечные ветви, анастомозы и области кровоснабжения.
VII. Подмышечная артерия,
1. ее расположение в з-х треугольниках подмышечной ямки
2. ветви, их топография и области кровоснабжения
VIII. Содержимое трех- и четырехсторонних отверстий.
IX. Анастомозы подмышечной артерии
1. молочной железы
2. плечевого сустава и суставов пояса верхней конечности
3. мышц груди и диафрагмы
4. мышц пояса верхней конечности
5. органов грудной полости и шеи
В процессе занятия студент должен уметь и обладать следующими навыками:
- Показать на планшетах и трупе, треугольники через, которые идет подмышечная артерия отделы, области.
- Показать на планшетах и трупе предлестничное, межлестничые и постлесничное пространства через, которые идет подключичная артерия.
- Показать ветви подмышечной и подключичной артерии на трупе.
- Показать большой артериальный круг мозга на муляже и объяснить его расположение на черепе.
- Нарисовать схему Велизиева круга.
Тема №21: Артерии верхних конечностей. Кровоснабжение суставов.
Приступая к занятию, студент должен знать:
I. Плечевая артерия:
2) ветви, их расположение и анастомозы;
3) области кровоснабжения;
II. Кровоснабжение мышц плеча.
III. Локтевая артерия:
2) ветви, их расположение и анастомозы
3) области кровоснабжения
IV. Лучевая артерия:
2) ветви, их расположение и анастомозы
3) области кровоснабжения
V. Кровоснабжение мышц предплечья.
VI. Ладонные дуги кисти, их формирование, расположение, ветви и анастомозы:
VII. Кровоснабжение мышц кисти.
VIII. Тыльная сеть запястья, ее анастомозы с глубокой ладонной дугой, области кровоснабжения
IX. Кровоснабжение суставов:
3) Суставов кисти
В процессе занятия студент должен уметь и обладать следующими навыками:
1. Показать плечевую, лучевую и локтевую артерии на трупе и муляже.
2. Показать ладонные дуги, их ветви на трупе и отдельном препарате.
Тема№22: Брюшная аорта и внутренняя подвздошная артерия.
Приступая к занятию, студент должен знать:
I. Брюшная аорта:
2) особенность строения аортального отверстия диафрагмы
3) скелетотопия бифуркации аорты
II. Ветви брюшной аорты:
§ верхняя и нижняя брыжеечные.
Кишечника: тонкого и толстого
IV. Внутренняя подвздошная артерия :
3) области кровоснабжения
V . Кровоснабжение органов и стенок таза.
VI. Роль в коллатеральном кровообращении анастомозов, образованных между ветвями чревного ствола и верхней брыжеечной артерии.
В процессе занятия студент должен уметь и обладать следующими навыками:
1. Показать брюшную аорту и ее ветви на трупе.
2. Показать внутреннюю подвздошную артерию и ее ветви на трупе.
3. Показать брюшную аорту и внутреннюю подвздошную артерию на муляже.
4. Показать места на уровне которых отходят основные ветви брюшной аорты и место её бифуркации на скелете.
Тема№23: Наружная подвздошная артерия. Артерии нижних конечностей. Кровоснабжение суставов и стопы.
Приступая к занятию, студент должен знать:
I. Общая подвздошная артерия, ее топография, деление на наружную и внутреннюю подвздошные артерии.
II. Наружная подвздошная артерия:
3) области кровоснабжения
5) Бедренняя артерия, ее топография сосудистой лакуне и на бедре, ветви, области кровоснабжения
III. Кровоснабжение тазобедренного сустава и мышц бедра.
IV. Подколенная артерия
3) области кровоснабжения
V. Кровоснабжение коленного сустава.
VI. Задняя большеберцовая артерия, ее топография, ветви, области кровоснабжения.
VII. Передняя большеберцовая артерия, ее топография (особенность прохождения на переднюю поверхность голени), ветви, области кровоснабжения.
VIII. Кровоснабжение мышц голени и стопы, голеностопного сустава.
IX. Конечные ветви задней и передней большеберцовых артерий, их топография, ветви, области кровоснабжения, анастомозы.
X. Кровоснабжение мышц и суставов стопы.
XI. Топография и места проекции магистральных артерий нижней конечности на наружные покровы.
XII. Формирование короны смерти (corona mortis)
В процессе занятия студент должен уметь и обладать следующими навыками:
- Показать на планшетах ход наружной подвздошной и бедренной артерий.
- Показать сосудистую лакуну и ее сосуды.
- Показать подколенную артерию в подколенной ямке и ее ветви на трупе и муляже.
- Показать артерии голени и стопы на трупе и муляже.
Примеры тестов по артериям
1. Укажите висцеральные ветви грудной части аорты:
1) бронхиальные ветви (rr. bronchiales)
2) пищеводные ветви (rr. esophagei)
3) перикардиальные ветви (rr. pericardiaci)
4) медиастинальные ветви (rr. mediastinales)
2. Укажите части нисходящей аорты:
1. луковица аорты (bulbus aortae)
2. шейная часть (pars cervicalis)
3. грудная часть (pars thoracica)
4. брюшная часть (pars abdominalis)
3. Укажите позвонок, на уровне которого располагается бифуркация аорты:
1. III-й поясничный
2. IY-й поясничный
3. Y-й поясничный
4. I-й поясничный
4. Укажите место расположения артериальной (боталловой) связки:
1. между правой и левой легочными артериями
2. между аортой и верхней полой веной
3. между нисходящей аортой и левой легочной веной
4. между аортой и бифуркацией легочного ствола
5. Какие кровеносные сосуды кровоснабжают стенки глотки:
1. ветви нижней щитовидной артерии
2. ветви верхнечелюстной артерии
3. ветви язычной артерии
4. ветви лицевой артерии
6. Укажите передние ветви наружной сонной артерии:
1. лицевая артерия (a. facialis)
2. язычная артерия (a. lingualis)
3. верхнечелюстная артерия (a. maxillaris)
4. верхняя щитовидная артерия (a. thyroidea sup.)
7. Укажите, какие анатомические области кровоснабжает задняя ушная артерия:
1. костный и перепончатый лабиринты
2. кожа ушной раковины
3. слизистая оболочка барабанной полости
4. ячейки сосцевидного отростка
8. Укажите конечные ветви наружной сонной артерии:
1. поверхностная височная артерия (a. temporalis superficialis)
2. верхнечелюстная артерия (a. maxillaris)
3. надглазничная артерия (a. supraorbitalis)
4. подглазничная артерия (a. infraorbitalis)
9. Укажите, от какой артерии отходит средняя менингеальная артерия:
1. подглазничная артерия (a. infraorbitalis)
2. внутренняя сонная артерия (a. carotis interna)
3. верхнечелюстная артерия (a. maxillaris)
4. затылочная артерия (a. occipitalis)
10. Укажите ветви верхнечелюстной артерии в ее втором (крыловидном) отделе
1. жевательная артерия (a. masseterica)
2. крыловидные ветви (rr. pterygoidei)
3. глубокая височная артерия (a. temporalis profunda)
4. щечная артерия (a.buccalis)
11. Укажите ветви верхнечелюстной артерии в ее третьем (крыловидно-небном) отделе:
1. клиновидно-небная артерия (a. sphenopalatina)
2. средняя менингеальная артерия (a. meningea media)
3. нисходящая небная артерия (a. palatina descendens)
4. подглазничная артерия (a. infraorbitalis)
Синдром Лериша
Аорта - самая крупная артерия нашего тела, примерно на уровне пупка, разделяется на подвздошные артерии. Подвздошные артерии проходят через малый таз в ноги и разделяются на множество артерии. У пациентов с заболеваниями артерий нижних конечностей, препятствующие кровотоку атеросклеротические бляшки обычно образуются в инфраренальном отделе аорты и подвздошных артериях. Подобные состояния называют аорто - подвздошными окклюзионными (облитерирующими) заболеваниями.
Причины аорто-подвздошных окклюзионных заболеваний
Атеросклероз является наиболее распространенной причиной формирования окклюзионных атеросклеротических бляшек в брюшном отделе аорты и подвздошных артерий. Основными факторами риска, которые приводят к возникновению атеросклеротических бляшек, в аорто-подвздошном сегменте, являются: курение, гиперхолестеринемия и сахарный диабет.
Кроме того, причиной аорто-подвздошных окклюзионных заболеваний может быть болезнь Такаясу (неспецифический артериит), который может привести к обструкции брюшной аорты и ее ветвей. Этиология болезни Такаясу до настоящего времени не известна.
Атеросклероз является чрезвычайно сложным дегенеративным заболеванием. Сегодня ученые не знают основную причину возникновения атеросклероза, однако, известны многие составляющие, которые способствуют развитию атеросклеротических поражений. Одна из наиболее популярных теорий утверждает, что атеросклероз возникает как ответ на травму артериальной стенки. Факторы, которые, как известно, способствуют травме артериальной стенки, включают в себя механические факторы, такие как гипертония и низкая эластичность стенки, а также химические факторы, таких как никотин, гиперлипидемия, гипергликемия, и гомоцистеин.
Накопление липидов начинается в гладкомышечных клетках сосудистой стенки и макрофагах в результате воспалительной реакции на травму. Отложения липидов состоят из различных композиций: холестерина, эфиров холестерина и триглицеридов. Некоторые атеросклеротические бляшки являются нестабильными, что приводит к образованию на их поверхности микротрещин. Циркулирующие тромбоциты оседают на микротрещинах и связываются с внутренними элементами бляшки. Тромбоциты связываться с фибрином посредством активации гликопротеина (GP) IIb / IIIa рецепторов тромбоцитов, и свежий кровяной сгусток формируется в области микротрещины. Подобные нестабильные атеросклеротические бляшки во многих случаях приводят к эмболии и / или распространению сгустка, который в конечном итоге может закрыть просвет артерии.
Если атеросклеротическая бляшка увеличивается в размере настолько, что перекрывает более 50% от просвета артерии, объем кровотока к нижней конечности значительно уменьшается. В состоянии покоя потребность нижних конечностей в кислороде достаточно невелика, поэтому даже при умеренных проксимальных стенозах, у пациентов может не быть никаких симптомов. В то же время во время физической нагрузки потребность тканей в кислороде возрастает и у пациентов со значимыми стенозами появляются симптомы заболевания, основным из которых является перемежающая хромота. В более запущенных случаях, происходит критическая ишемия тканей, и нейропатической боли возникают даже в состоянии покоя.
Синдром Лериша - одно из наиболее частых окклюзирующих аорто-подвздошных заболеваний артериальной системы, которое проявляется триадой симптомов:
1. Перемежающая хромота
2. Отсутствие пульсации на артериях нижних конечностей
3. Эректильная дисфункция (импотенция)
Синдром Лериша назван в честь хирурга, который впервые описал эту триаду симптомов в 1923 году. Синдром Лериша возникает при выраженном стенозе или полной окклюзии инфраренального отдела аорты обычно в результате тяжелого атеросклероза.
Синдрома Лериша может развиться в результате таких заболеваний как:
— врожденная гипоплазия или аплазия аорты;
Чаще синдром Лериша встречается при облитерирующем атеросклерозе (94%), облитерирующем эндартериите и неспецифическом аортоартериите.
Окклюзирующие поражения аорты и подвздошных артерий делят на стеноз и окклюзию. Причем могут наблюдаться не, только стеноз или окклюзия, но и их различная комбинация: стеноз брюшной аорты с односторонней окклюзией подвздошной артерии, стеноз бифуркации и обеих подвздошных артерий. Кроме того, при окклюзирующем поражении аорто-подвздошного сегмента следует оценивать состояние внутренних подвздошных, бедренных и берцовых артерий. Сочетанное поражение бедренно-подколенного сегмента встречается более чем у половины пациентов с синдромом Лериша.
Клинические проявления при синдроме Лериша зависят от степени стеноза и появляются уже при сужении артерий на 6О-7О%.
Основные симптомы синдрома Лериша
1. Боль в нижних конечностях, обусловленная хронической ишемией. При окклюзии аорты возникает, так называемая, высокая перемежающаяся хромота, которая проявляется болями в области ягодиц, пояснице и мышцах бедра. В зависимости от степени недостаточности артериального кровоснабжения условно выделяют четыре стадии ишемии (нарушения кровообращения).
Первая стадия (функциональной компенсации)
Пациенты отмечают зябкость, судороги и парестезии (ощущение покалывания, онемения, ползания мурашек) в ногах, в некоторых случаях повышенную утомляемость. При прохождении дистанции 500-1000 метров со скоростью 4-5 км/ч у пациентов возникает, так называемая «перемежающаяся хромота». Под этим термином подразумевается появление у больного болей в икроножных мышцах, которые заставляют его останавливаться для их исчезновения.
Вторая стадия (субкомпенсации)
При второй стадии перемежающаяся хромота возникает при прохождении дистанции в 200-250 метров. Кожа на стопах и голенях становится менее эластичной, сухой, шелушащейся. Нарушается рост волос на пораженной конечности, волосы выпадают, могут появиться участки облысения. В связи с нарушением кровообращения нарушается и рост ногтей, повышается ломкость, изменяется их цвет, становясь матовым, тусклым или бурым. На этой стадии начинает развиваться атрофия подкожной жировой клетчатки и мелких мышц стопы.
Третья стадия (декомпенсации)
На третьей стадии боли в конечности возникают в покое, ходьба становится возможной лишь на расстоянии 25-50 м. Характерно изменение окраски кожи в зависимости от положения пораженной конечности. Возвышенное положение конечности сопровождается ее побледнением, а опускание - покраснением кожи. При этом кожа истончается и становится легкоранимой. Незначительные травмы вследствие царапин, мозолей и ушибов приводят к образованию трещин и поверхностных язв. На этой стадии прогрессирует атрофия мышц голени и стопы.
Четвертая стадия (деструктивных изменений)
Болезненность в стопе и пальцах становятся постоянными и невыносимыми. Характерны плохо заживающие язвы, которые обычно располагаются в дистальных отделах конечностей (стопе, пальцах). Края и дно этих язв покрыты грязно-серым налетом, вокруг язв имеется воспалительная инфильтрация (покраснение). Нарастает отек стопы и голени пораженной конечности, что в конечном итоге при отсутствии медицинской помощи приводит к гангрене.
2. Вторым симптом характерным для синдрома Лериша, как уже указывалось выше, является импотенция, которая обусловлена не только ишемией тазовых органов, но и спинного мозга. Некоторые пациенты могут испытывать боль в животе сжимающего характера, возникающие при ходьбе.
3. И третий основной симптом при синдроме Лериша отсутствие пульса на бедренных артериях или его ослабление. В последнем случае врач выслушивает характерный систолический шум.
Исследование подвздошной артерии
Брюшная аорта на уровне IV-V поясничного позвонка делится на две общие подвздошные артерии,которые расходятся под углом, направляясь вниз и наружу. Через 5-7 см от бифуркации, что соответствует уровню сакоилеального сочленения, каждая общая подвздошная артерия делится на две ветви - наружную и внутреннюю подвздошную артерию.Внутренняя подвздошная артерия физическому исследованию недоступна, исследуются лишь общая и наружная артерии.
Наружная подвздошная артериязабрюшинно направляется по медиальному краю большой поясничной мышцы вперед и вниз и доходит до паховой складки. Выйдя на бедро, артерия продолжается в бедренную артерию.
Внешними ориентирами проекции подвдошной артерии являются(рис. 366):
- пупок - место бифуркации аорты;
- паховая складка на границе средней и нижней ее трети - место выхода артерии на бедро;
- средина расстояния от пупка до паховой складки (5-7 см от пупка) - место разделения общей подвздошной артерии на наружную и внутреннюю.
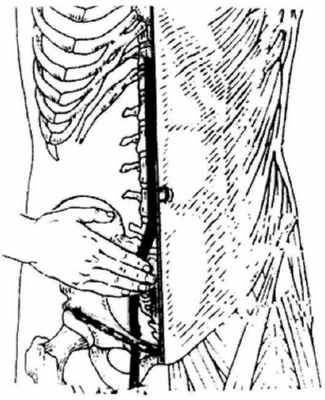
Рис. 366.Топография подвздошной артерии. Ее пальпация проводится от пупка до пупартовой связки.
Подвздошные артерии из-за глубины расположения осмотру недоступны, поэтому при осмотре необходимо использовать косвенные признаки функционального состояния этих сосудов,особенно у пожилых людей: цвет кожи нижних конечностей, состояние трофики кожи и ногтей, состояние волосяного покрова, трофики мышц, двигательной функции нижних конечностей.
У здорового человекаокраска кожных покровов нижних конечностей слева и справа одинаковая и не отличается от окраски кожи других участков тела. Внешние признаки структуры кожи, волосяной покров сохранены, ногти имеют нормальный цвет и строение, блестящие, мышцы нормотрофичны, двигательная функция нижних конечностей без отклонений.
При нарушении проходимости подвздошной артериис одной или двух сторон (тромбоэмболия, атероматоз, фиброзно-мышечная дисплазия, артериит, сдавление артерии опухолью, рубцами) отмечается бледность или мраморность кожи, нижних конечностей, ее истончение, отсутствие волос, ломкость и истончение ногтей, субатрофия мышц, язвы стоп, гангрена пальцев или стопы, а также нарушение двигательной функции нижних конечностей.
Перед непосредственной пальпацией подвздошных артерий необходимо исследовать температуру кожи нижних конечностей и сравнить ее с другими участками тела, определить тургор кожи, тонус мышц, оценить двигательную функцию и силу мышц нижних конечностей. У здорового человекатемпература кожных покровов, тургор кожи и тонус мышц не отличается от состояния кожи и мышц других участков тела, двигательная функция нижних конечностей, сила мышц нормальная. Очень важно пальпаторно оценить выраженность пульсации дистальных артерий - бедренной, подколенной, артерии тыла стопы.При хорошей проходимости подвздош-
ных артерий пульсация дистальных артерий хорошая, одинаковая с обеих сторон.
Пальпацияподвздошных артерий проводится поочередно с двух сторон в горизонтальном положении пациента, врач находится справа. Рука врача плоско устанавливается на брюшную стенку перпендикулярно линии проекции сосуда на поверхность живота. Конечные фаланги II, III, IV пальцев слегка согнуты так, чтобы их край находился на линии проекции сосуда. Как и при любой пальпации живота, дальнейшие пальпаторные действия проводятся с учетом дыхания пациента, то есть движения брюшной стенки: на выдохе пальцы осторожно погружаются в брюшную полость, на вдохе движения руки приостанавливаются, но не возвращаются в первоначальное положение. На очередном выдохе пальцы вновь погружаются в глубину брюшной полости. Обычно на втором или третьем погружении удается достичь задней брюшной стенки и сосуда.Коснувшись сосуда, оценивается выраженность его пульсации, диаметр, эластичность сосудистой стенки. Можно сделать скользящее движение поперек сосуда, что позволит лучше определить его свойства.Сосуд ощупывается от места бифуркации аорты до пупартовой связки.
Пропальпировать подвздошную артерию у здоровых удается редко и преимущественно у пациентов с пониженным питанием со слабой брюшной стенкой, и только в пределах 6-7 см от пупка, то есть в пределах общей подвздошной артерии. Но и в этих случаях чаще можно судить лишь о выраженности пульсации, более полно охарактеризовать сосуд не удается. Важно сопоставить степень пульсации с обеих сторон.
Более выраженную пульсацию подвздошных артерий можно выявить у человека после физической нагрузки.
Значительная пульсация брюшной аорты и общих подвздошных артерий легко выявляется при аортальной недостаточности, а пульсация с одной стороны на ограниченном участке - при аневризме,которая для подвздошных артерий редкое явление.
Снижение пульсацииподвздошных артерий с одной или сразу с двух сторон выявить пальпаторно удается не всегда, так как и в норме артерии прощупать трудно. Предположить нарушение их проходимости можно лишь по разнице пульсации на одной из сторон,или, что более надежно, по выраженности пульсации дистальных артериальных сосудов.
Аускультацияподвздошных артерий проводится по линии проекции их на брюшную стенку. Техника аускультации аналогична той, что описана в разделе аускультации аорты. Критерии оценки аускультативной картины аналогичны. При правильном наложении фонендоскопа на подвздошных артериях здорового человека тонов и шумов не слышно.
При стенозирующем процессеподвздошной артерии можно услышать негромкий систолический шум, но шумможет быть и проводным с аорты.
Как и при поражении аорты диагностировать нарушение проходимости одной или обеих подвздошных артерий можно по показателям артериального давления на руках и на ногах с обязательным измерением на каждой конечности.
Нарушение проходимости подвздошной артерии приводит к снижению уровня артериального давления на заинтересованной стороне.
Математическое моделирование оптимального мини-доступа для реконструкции артерий аортобедренного сегмента Текст научной статьи по специальности «Клиническая медицина»
Аннотация научной статьи по клинической медицине, автор научной работы — Максимов Александр Владимирович, Маянская Светлана Дмитриевна, Плотников Михаил Викторович, Гайсина Элина Анваровна
Похожие темы научных работ по клинической медицине , автор научной работы — Максимов Александр Владимирович, Маянская Светлана Дмитриевна, Плотников Михаил Викторович, Гайсина Элина Анваровна
Применение компьютерной томографии для клинико-анатомического обоснования срединного трансперитонеального минидоступа к инфраренальной аорте
Хирургия аневризмы брюшного отдела аорты у больных пожилого возраста с применением миниинвазивной технологии
Отдаленные результаты реконструкции нижней брыжеечной и внутренних подвздошных артерий при резекции аневризмы инфраренального сегмента аорты
Способы сохранения проходимости внутренних подвздошных артерий при резекции аневризмы инфраренального сегмента аорты
MATHEMATICAL MODELING OF AN OPTIMAL MINI-ACCESS FOR RECONSTRUCTION OF ARTERIES OF THE AORTOFEMORAL SEGMENT
Текст научной работы на тему «Математическое моделирование оптимального мини-доступа для реконструкции артерий аортобедренного сегмента»
ред. Е.Л. Насонова, В.А. Насоновой. — М.: ГЭОТАР-Ме-диа, 2008. — 714 с.
11. Российские клинические рекомендации по диагностике и лечению хронических заболеваний вен нижних конечностей // Флебология. — 2009. — №3. — С. 4-48.
12. Салихов И.Г., Лапшина С.А., Мясоутова Л.И. и др. Остеоартроз и заболевания периферических вен нижних конечностей: особенности сочетанной патоло-
13. Щеглов Э.А., Алонцева Н.Н., Карцова И.В. и др. Оценка качества жизни у пациентов с сочетанными поражениями венозной системы нижних конечностей и опорно-двигательного аппарата // Флебология. — 2010. — Т. 4, №2. — С. 106.
14. Яблоков Е.Г., Кириенко А.И., Богачёв В.Ю. Хроническая венозная недостаточность — М.: Берег, 1999. — 126 с.
УДК 616.13.002.2-004.6-007.64-089.166-089.168 [616.132+616.137.83] Т12
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ОПТИМАЛЬНОГО МИНИ-ДОСТУПА ДЛЯ РЕКОНСТРУКЦИИ АРТЕРИЙ АОРТОБЕДРЕННОГО СЕГМЕНТА
Александр Владимирович Максимов1-2*, Светлана Дмитриевна Маянская2,3,
Михаил Викторович Плотников1,2, Элина Анваровна Гайсина2
‘Республиканская клиническая больница, г. Казань,
Казанская государственная медицинская академия,
3Казанский государственный медицинский университет
Цель. Определить оптимальный размер и локализацию мини-лапаротомного доступа для реконструкции артерий аортобедренного сегмента.
Методы. Применён метод математического моделирования. Параметры мини-доступа вычислены в зависимости от пола пациента, а также для различных клинических ситуаций (операция по поводу окклюзирующего заболевания, при аневризме брюшной аорты, в том числе с распространением аневризматического расширения на подвздошные артерии). Топография аорты и подвздошных артерий была определена на основании компьютерных томограмм 155 больных (из них 61 с аневризмой инфраренального отдела аорты).
Вывод. Математическое моделирование оптимального мини-доступа позволяет оптимизировать применение мини-лапаротомии в различных клинических ситуациях.
Ключевые слова: аортобедренная реконструкция, мини-лапаротомия, параметры оперативного доступа.
Проблема оптимального оперативного доступа к объекту оперативного воздействия всегда находилась в центре внимания хирургии, поскольку от него зависит не только выполнимость оперативного приёма, но и безопасность манипуляции.
Долгое время эту проблему решали в соответствии с известным тезисом «большой
хирург — большой разрез». Однако повышающиеся требования к качеству лечения и стремление снизить хирургическую инвазию заставляют искать новые пути снижения травматичности операций.
Возьмём на себя смелость утверждать, что классическая монография А.Ю. Созон-Ярошевича до сих пор служит наиболее полным руководством для анализа параметров хирургического доступа [2]. Критерии
хирургического доступа, разработанные автором, с незначительными модификациями до сих пор применяются исследователями для характеристики доступности объекта операционного воздействия, а следовательно, выполнимости оперативного приёма. В сочетании с современным математическим аппаратом эти критерии могут достаточно полно характеризовать выполнимость оперативного приёма, в том числе в зависимости от конституциональных особенностей больного и характеристики патологического процесса [1].
Целью работы стало определение оптимального размера и локализации мини-лапаротомии для выполнения реконструкции артерий аортобедренного сегмента.
На первом этапе исследования мы изучили топографию инфраренального отдела аорты на основании данных компьютерных томограмм 155 пациентов. Больные с патологией, которая могла потенциально изменить топографоанатомические взаимоотношения в брюшной полости (объёмные образования, хирургические операции в анамнезе) были исключены. Из них 94 больных не имели патологии аорты (первая группа). Вторую группу составили больные с аневризмой инфраренального отдела аорты (61 томограмма). Эта группа была выделена для того, чтобы изучить изменения топографии артерий аортобедрен-612
ного сегмента при патологии аорты. Кроме того, первая группа была разделена на две подгруппы (1А — 73 мужчины, 1Б — 21 женщина) для выявления гендерных различий в топографии.
В реальных клинических условиях краниальной границей хирургической манипуляции при аортобедренной реконструкции является левая почечная вена (ЛПВ). Этот сосуд пересекает брюшную часть аорты спереди на уровне или чуть ниже устьев почечных артерий. Мобилизация и смещение ЛПВ в определённых пределах возможны, но, учитывая лёгкую ранимость почечных вен, именно ЛПВ ограничивает уровень наложения проксимального зажима на аорту. Хотя стандартный лапаротом-ный доступ позволяет при необходимости выполнить даже пережатие супрареналь-ной аорты (например, при юкстареналь-ной локализации аневризмы), подобные манипуляции при использовании минидоступа неоправданно снижают безопасность операции. В этих случаях минидоступ не может служить методом выбора. По этой причине мы, изучая хирургическую анатомию инфраренальной аорты, принимали за проксимальную границу сегмента аорты, подлежащего реконструкции из мини-лапаротомного доступа, именно ЛПВ.
Каудальной границей оперативного воздействия при бифуркационных аор-
Сравнительный анализ антропометрических параметров мужчин и женщин (но данным компьютерной томографии)
Показатель Мужчины, п=73 Женщины, п=21 Р
Бифуркация - пупок (М,), см 2,7±0,2 0,1±0,3 0
Бифуркация - ЛПВ (N1), см 9,3±0,2 8,8±0,4 0,222
Пупок - ЛПВ (№,), см 8,8±0,2 8,5±0,3 0,462
Глубина до аорты на уровне ЛПВ (Н3), см 12,4±0,4 12,2±0,6 0,806
Глубина до аорты на уровне пупка (Н2), см 9,9±0,4 9,3±0,6 0,462
Глубина до аорты на уровне БифА (Н,), см 9,9±0,4 10,0±0,7 0,905
Лобок - БифА, см 15,6±0,49 16,1±0,8 0,622
Мечевидный отросток - БифА, см 20,1±0,36 18,5±0,7 0,04
Примечание: ЛПВ — левая почечная вена; БифА — бифуркация брюшной части аорты.
тобедренных реконструкциях чаще всего бывает бифуркация брюшной части аорты (БифА). В некоторых клинических ситуациях (например, при распространении аневризматического расширения на подвздошные артерии) дистальной границей реконструкции становится бифуркация подвздошной артерии (устье внутренней подвздошной артерии — ВПА).
Определяли линейные расстояния между этими ключевыми точками, глубину их расположения от передней брюшной стенки, а также их взаимоотношения с основными внешними ориентирами — средней линией живота, мечевидным отростком, пупочным кольцом и лобковым симфизом.
Величина угла оперативного действия, при которой манипуляции в ране возможны, определённая теоретически, должна составлять не менее 25-30° [2], поэтому расчёты параметров раны были произведены при заданной величине этого угла на «ключевые точки» оперативного воздействия (ЛПВ, БифА или устье ВПА) а=30°. В реальных клинических условиях, учитывая растяжимость тканей и коррекцию доступа ранорасширителями, этот показатель будет возрастать.
Схема сагиттального сечения, проходящего через срединную линию живота и брюшную часть аорты, представлена на рис. 1.
Н, и Н2 — соответственно глубина от передней брюшной стенки до БифА (или ВПА) и до ЛПВ;
N — расстояние от БифА до ЛПВ;
N1 — расстояние от БифА (или устья ВПА) до проекции пупка на аорту;
N — расстояние от проекции пупка на аорту' до ЛПВ (К,=^^).
«Выходные» (вычисляемые) параметры:
длина разреза (Ц);
длина сегмента разреза, расположенного ниже пупка (Ц^ и выше пупка (Ц2), то есть расположение разреза по отношению к пупку (Ц=ЦХ+Ц2).
В первой группе средняя длина инфра-ренального сегмента брюшной аорты составила 9,1±0,3 см (от 5,5 до 12,2 см). Бифуркация подвздошных артерий (устье ВПА) располагается на 5,6±0,42 см ниже БифА, на 2,9±0,1 см латеральнее средней линии живота, одинаково — справа и слева.
Расстояние от передней брюшной стенки до аорты на уровне ЛПВ составило 12,3±0,31 см (6,3-21,6 см), на уровне БифА — 10,0±0,33 см (3,7-19,5 см). Устье ВПА располагается на глубине 10,7±0,4 см в сагиттальной плоскости.
Гендерные различия топографии артерий аортобедренного сегмента были выражены слабо. В основном они касались расположения БифА по отношению к пупочному кольцу. У мужчин (подгруппа ІА) БифА локализуется в среднем на 2-3 см ниже пупка (2,7±0,2 см), у женщин (подгруппа ІБ) — на уровне пупка (0,1±0,3 см), р
Основные изменения при аневризматическом расширении аорты проявились в увеличении продольных размеров инфраре-нальной аорты — расстояние от БифА до ЛПВ оказалось достоверно больше на 15,4%. Синтопия БифА по отношению к пупку осталась прежней (табл. 2).
Топография бифуркации подвздошных артерий изменялась более значительно. Деформация БифА и подвздошных артерий приводила к тому, что устье ВПА смеща-
Антропометрические параметры у пациентов с аневризмой аорты и без неё
Показатель Первая группа, п=94 Вторая группа, п=61 Р
Пол (мужчины/женщины) 73/21 50/11 0,657
Бифуркация - пупок ), см 2,2±2,0 1,9±0,29 0,865
Бифуркация - ЛПВ (Щ см 9,1±0,14 10,5±0,20 0
Глубина до аорты на уровне ЛПВ (Н3), см 12,3±0,31 13,2±0,39 0,084
Глубина до аорты на уровне пупка (Н2), см 9,4±0,37 10,6±0,39 0,029
Глубина до аорты на уровне БифА (Н,), см 10,0±0,33 10,5±0,40 0,318
Пупок - ЛПВ (№,), см 8,5±0,21 8,6±0,26 0,772
Пупок - устье ВПА, см Справа 6,7±0,3 6,2±0,3 0,156
Слева 6,2±0,3 0,156
БифА - устье ВПА, см Справа 5,6±0,3 4,3±0,2 0
Лобок - устье ВПА, см Справа 9,5±0,4 10,3±0,2 0,046
Слева 10,3±0,3 0,046
Средняя линия - ВПА, см Справа 2,9±0,2 2,5±0,2 0,051
Примечание: ЛПВ — левая почечная вена; БифА — бифуркация брюшной части аорты; ВПА — внутренняя подвздошная артерия.
лось вверх. При этом увеличивалось расстояние от бифуркации подвздошных артерий до лобка и уменьшалось — до БифА. Кроме того, происходило смещение устья ВПА в поперечном направлении, причём устье правой ВПА смещалось медиально, а левой — латерально, по-видимому, за счёт девиации аорты влево при аневризматической трансформации (см. табл. 2).
Таким образом, на основании данных компьютерной томографии мы получили усреднённые цифровые данные по топографии инфраренального отдела аорты и подвздошных артерий для расчёта оптимального размера и локализации мини-ла-паротомии. Вычисления были произведе-
Параметры мини-лапаротомии п
и формирование дистального анастомоза необходимо проводить на уровне бифуркации подвздошных артерий, каудальным локусом хирургической манипуляции становится устье ВПА. По этой причине в данном случае в формулах переменную N (расстояние от ЛПВ до БифА) заменяли на N (расстояние от ЛПВ до устья ВПА), а Н, (глубина от передней брюшной стенки до БифА) — на Н,1 (глубина до устья ВПА). Результаты вычислений приведены в табл. 3 и на рис. 2.
В качестве трансперитонеального мини-доступа наиболее часто применяют срединную параумбиликальную лапарото-мию. Её длина, приводимая в клиничес-
различных вариантах патологии
Показатель Первая группа Вторая группа
ІА (мужчины) ІБ (женщины) Аневризма аорты Аневризма аорты и ОПА
Длина раны (Ц), см 7,0±1,9 6,8±0,3 7,6±0,18 8,5±0,2
Длина раны ниже пупка (Ц,), см 0,6±0,2 1,5±0,9 1,4±0,23 4,1±0,26
Примечание: ОПА — общие подвздошные артерии.
ны раздельно для подгрупп (1А, 1Б) первой группы и второй группы пациентов. Также был смоделирован мини-доступ при варианте аневризмы аорты с распространением на общие подвздошные артерии. Так как в последнем случае временное пережатие 614
ких отчётах, варьирует от 3 до 10-15 см, в среднем составляя 6-8 см [3, 4].
Локализацию и длину мини-доступа N. Kawahaгada и соавт. рекомендуют уточнять дооперационно на основании компьютерной томографии или ультразву-
Рис. 2. Локализация и размер мини-лапаротомии: А — окклюзирующая патология (мужчины); Б — окклюзирую-щая патология (женщины); В — аневризма брюшной аорты без распространения на подвздошные артерии; Г — аневризма брюшной аорты с распространением на подвздошные артерии.
кового исследования [6]. Feaгn SJ. и соавт. предлагают определять локализацию доступа при резекции аневризмы аорты как проекцию её границ по данным компьютерной томографии на переднюю брюшную стенку с добавлением по 2 см проксималь-нее и дистальнее границ аневризматического расширения [5].
W.D. Tuгnipseed рекомендует производить лапаротомию выше пупка в случае аневризмы и ниже пупка — при окклюзионных поражениях, с чем вряд ли можно согласиться, поскольку это накладывает ограничения при выборе места наложения проксимального анастомоза [8]. При операциях по поводу аневризмы М. Matsumoto и соавт. начинают разрез на 3 см выше шейки аневризмы, продолжая его вниз до трети расстояния от шейки до бифуркации
(при локализации дистального анастомоза на уровне общих подвздошных артерий) или до уровня БифА (при дистальных анастомозах с наружными подвздошными артериями) [7]. При таком подходе средняя длина лапаротомии составляет 8,4 см (6,5-11,2 см).
В нашей работе мы применили методику математического моделирования для определения оптимальной локализации мини-лапаротомии. Использование компьютерной томографии в отличие от посмертных секционных исследований позволило не только оперировать более значительным клиническим материалом, но и определять топографоанатомические параметры в зависимости от половых, антропометрических различий и наличия патологии аорты.
Математическое моделирование оптимального мини-доступа позволяет оптимизировать применение мини-лапаротомии в различных клинических ситуациях.
1. Сергийко С.В. Оптимизация тактики и совершенствование способов малоинвазивной хирургии надпочечников // Омск. науч. вестн. — 2004. — №1. — C. 107-113.
2. Созон-Ярошевич А.Ю. Анатомо-клинические обоснования хирургических доступов к внутренним органам. — М.: Медгиз, 1954. — 180 с.
3. Acikel U, Karabay O., Silistreli E. et al. A new minimally invasive method of aortofemoral revascularization // J. Vasc. Surg. — 2001. — Vol. 35. — P. 175-179.
4. Brustia P., Porta C. Left sub costal minilaparotomy in aortic surgery // Minerva Cardioangiol. — 2001. — Vol. 49. — P. 91-97.
5. Fearn S.J., Thaveau F, Kolvenbach R., Dion Y.M. Minilaparotomy for aortoiliac aneurysmal disease: experience and review of the literature // Surg. Laparosc. Endosc. Percutan. Tech. — 2005. — Vol. 15, N 4. — P. 220-225.
6. Kawaharada N, Morishita K., Fukada J. et al. Minilaparotomy abdominal aortic aneurysm repair versus the retroperitoneal approach and standard open surgery // Surg. Today. — 2004. — Vol. 34, N 10. — P. 837-841.
7. Matsumoto M, Hata T, Tsushima Y. et al. Minimally invasive vascular surgery f or repair of infrarenal abdominal aortic aneurysm with iliac involvement // J. Vasc. Surg. — 2002. — Vol. 35, N 4. — P. 654-660.
8. Turnipseed W.D. A less-invasive minilaparotomy technique for repair of aortic aneurysm and occlusive disease // J. Vasc. Surg. — 2001. — Vol. 33, N 2. — P. 431-434.
РИСКИ РАЗВИТИЯ ПЕРВИЧНО-МНОЖЕСТВЕННЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ПОРАЖЕНИЕМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Зинаида Александровна Афанасьева1-2, Сергей Фёдорович Бакунин2*
1Республиканский клинический онкологический диспансер, г. Казань,
2Казанская государственная медицинская академия
Цель. Определение относительных рисков развития других злокачественных опухолей у больных раком щитовидной железы и рака щитовидной железы у больных с другими злокачественными новообразованиями.
Методы. Проведён ретроспективный анализ данных 116 больных полинеоплазиями с поражением щитовидной железы за период с 1973 по 2010 гг. Для оценки относительного риска развития полинеоплазий с поражением щитовидной железы использовали формулу: ге^^е ]^к = [а / (а + Ь)] / [с / (с + (1)], где а — количество больных раком щитовидной железы со вторым злокачественным новообразованием; Ь — количество больных раком щитовидной железы без второй злокачественной опухоли; с — количество больных в популяции, поражённых таким же злокачественным заболеванием, как и больные в группе а; 1 — количество людей в популяции, не заболевших раком.
Результаты. У больных карциномами щитовидной железы более высокий, чем в популяции, относительный риск метахронного развития лимфом (41,8 у мужчин, 31,7 у женщин), рака почки (55,6 у мужчин, 18,5 у женщин), предстательной железы (35,7), лёгких и бронхов (18,8 у женщин), меланомы (17,1 у женщин), рака ободочной кишки (16,7 у женщин), шейки матки (15,8), тела матки (11,8), молочной железы (11,5 у женщин), кожи (9,5 у женщин) и синхронного развития рака почки (33,8 у мужчин, 46,3 у женщин), предстательной железы (24,4), меланомы (20,6 у женщин), рака пищевода (19,4 у мужчин, 17,8 у женщин), прямой кишки (19,0 у мужчин), лимфом (12,8 у мужчин), рака шейки матки (11,3), молочной железы (11,0 у женщин), кожи (8,5 у женщин). Относительный риск развития метахронного рака щитовидной железы более высокий, чем в популяции, у больных меланомой (108,0 у мужчин, 50,4 у женщин), со злокачественными новообразованиями лимфоидной ткани (40,2 у мужчин, 40,8 у женщин), раком тела матки (11,8), кожи (8,7 у женщин), молочной железы (8,0 у женщин).
Вывод. При диспансеризации больных раком щитовидной железы необходимо учитывать относительный риск возникновения последующих опухолей для ранней диагностики полинеоплазий.
Ключевые слова: первично-множественные злокачественные опухоли, щитовидная железа, рак, относительный риск.
Бифуркация аорты. Подвздошные артерии. Топография подвздошной артерии.
Проведено исследование по изучению вариантной анатомии бассейна внутренней подвздошной артерии с последующей трехмерной визуализацией выявленных типов ветвления. В специализированных литературных источниках приводятся противоречивые данные о вариантах отхождения магистральных сосудов из бассейна внутренней подвздошной артерии. Отсутствуют исследования, где анатомия вариантов отхождения ветвей от артериального ствола изучалась бы посредством построения трёхмерных моделей. Изучение вариантной и клинической анатомии ветвей внутренних подвздошных артерий включало в себя три раздела: морфологический, клинический и метод математического моделирования и виртуализации. Были изучены крайние формы индивидуальной изменчивости отхождения ветвей внутренней подвздошной артерии. Оценивалось направление отхождения и пространственное расположение сосудов бассейна внутренней подвздошной артерии. Выявлены основные типы ветвления внутренней подвздошной артерии по классификации Adaci, на основе которых построены трехмерные модели. Трехмерные модели позволят оценить клиническое и хирургическое значение выявленных закономерностей в вариантной анатомии ветвей внутренней подвздошной артерии.
1. Гуленко И.Е. Система видеозахвата и анализа движения – распознавание трансформаций и движения объекта // Новые информационные технологии: труды конференции (Судак, Крым, 15–25 мая 2004 г.). – С. 141–142.
3. Привес М.Г. Анатомия человека / М.Г. Привес, Н.К. Лысенков, В.П. Бушкович. – СПб.: Гиппократ, 2003 – 683 с.
5. Синельников Р.Д. Атлас анатомии человека / Р.Д. Синельников, Я.Р. Синельников. – М.: Медицина, 1996. – Т.2. – 263 с.
6. Тимофеев А.В. Интеллектуальное и мультиагентное управление робототехническими системами с использованием моделей виртуальной реальности // Мехатроника. – 2000. – № 3. – С. 26–31.
7. A Multi-Agent-System Architecture for Man-Machine- Interaction in Computer Aided Surgery / C. Burghart, O. Schorr, S. Yigit, N. Hata, K. Chinzei, A. Timofeev, R. Kikinis, H. Wörn, U. Rembold // Proceedings of the 16th IAR Annual Meeting IAR/ICD Workshop (November 22–23, 2001, Strasbourg, France). – Р. 117–122.
8. Clemente, L.A., Davison, A.J., Reid, I.D., Neira, J., Tardos, J.D.: Mapping large loops with a single hand-held camera. In: Robotics Science and Systems. (2007).
9. Davison, A.J.: Real-time simultaneous localisation and mapping with a single camera. In: International Conference on Computer Vision. (2003).
10. Garcia, O., Civera, J., Guemes, A., Munoz, V., J.M.M., M.: Real-time 3d modeling from endoscope image sequences. In: Workshop on Advanced Sensing and Sensor Integration in Medical Robotics (ICRA2009).
11. Pai M.M., Krishnamurthy A., PrabhuL.V., Pai M.V. Variability in the origin of the obturator artery. Basic Resrarch 2009; 64 (9): 897–901.
12. Wu, C., Sun, Y., Chang, C.: Three-dimensional modeling from endoscopic video using geometric constraints via feature poisitioning. IEEE Trans. on Biomedical engineering54(7) (2007).
Изучение вариантной анатомии человека является актуальным направлением современной морфологии. В настоящее время вмешательства на артериях широко осуществляются в диагностических и в лечебных целях. Увеличение числа оперативных вмешательств, в том числе эндоскопических, на органах малого таза и нижних конечностях предъявляет повышенные требования к знанию вариантов строения ветвей внутренней подвздошной артерии и ее коллатералей.
Внутренняя подвздошная артерия поставляет большую часть крови для внутренних органов таза, а именно, прямой кишки, мочевого пузыря, предстательной железы и семенных пузырьков у мужчин, матки у женщин, костно-мышечной части таза. Также она отдает ветви в ягодичную область, медиальную область бедра и промежность [4]. Изучение анатомии внутренней подвздошной артерии важно не только для анатомов, но и для хирургов, акушеров-гинекологов, урологов, сосудистых хирургов и радиологов. Двусторонняя перевязка внутренней подвздошной артерии является наиболее эффективным способом остановки маточного кровотечения, позволяющим избежать гистерэктомии. Трудноразрешимые кровотечения при трансуретральной резекции простаты можно контролировать с помощью перевязки внутренней подвздошной артерии, когда невозможно определить кровоточащий сосуд. Эндоваскулярная артериальная эмболизация опухолей таза является эффективным методом остановки кровотечения, получившим на сегодняшний день широкое применение, так как является минимально инвазивной техникой.
Тяжелым и часто летальным осложнением при травмах таза является артериальное кровотечение из ветвей внутренней подвздошной артерии, а именно: латеральных крестцовых, подвздошно-поясничной, запирательной, артерии мочевого пузыря и нижней ягодичной артерии [3]. Хирурги должны быть готовы к неожиданному кровотечению, источником которого является аберрантная запирательная артерия, во время операций по поводу паховых или бедренной грыж и принять соответствующие меры предосторожности, чтобы избежать повреждения этих сосудов.
В специализированных литературных источниках приводятся противоречивые данные о вариантах отхождения магистральных сосудов из бассейна внутренней подвздошной артерии [2]. Отсутствие точных сведений о вариантной анатомии артерий таза затрудняет поиск последних во время оперативных вмешательств с целью их перевязки для остановки кровотечений, возникающих при ранениях и травмах различной этиологии, при восстановительных, органосохраняющих операциях, а также при пересадке почки. Следует отметить, что в литературе описание большинства внутритазовых артериальных анастомозов ограничивается только констатацией наличия того или иного соустья, например, «корона смерти» – анастомоз между запирательной артерией и нижней надчревной артерией [5, 12]. При этом не указывается частота, с которой встречаются эти анастомозы, и не предоставляются их морфометрические характеристики. Среди тех, кто занимался изучением внутренней подвздошной артерии, следует отметить таких исследователей, как Quain, 1908, Kosinski, 1929, Testut,1948, Adachi, 1928, Roberts и Krishinger, 1967. В своих работах они изучали как морфометрию, так и типы ветвления внутренней подвздошной артерии.
Целью данной работы является расширить знания об особенностях строения ветвей внутренней подвздошной артерии, их топографии, вариантной и возрастной анатомии с позиций виртуальных технологий в медицине, тем самым способствовать улучшению результатов оперативных вмешательств на органах малого таза.
Материалы и методы исследования
Изучение вариантной и клинической анатомии ветвей внутренних подвздошных артерий включало в себя три раздела: морфологический, клинический и метод математического моделирования и виртуализации.
Морфологические методы исследования
Морфологические методы исследования проводились в несколько этапов: анатомическая препаровка, полимерное бальзамирование и морфометрия анатомического материала ветвей внутренних подвздошных артерий.
Основным назначением данного этапа являлось:
- Изучить топографо-анатомические особенности, строение и расположение ветвей внутренней подвздошной артерии.
- Выявить вариантную и возрастную закономерность морфометрических данных бассейна подвздошных артерий.
- Определить оптимальный метод для разработки методологии компьютерного моделирования бассейна подвздошных артерий.
Методика анатомической препаровки
Исследовали 50 трупов людей. Магистральные артерии и их анастомозы выделяли справа и слева, что составляло 100 случаев. Трупов мужчин было 32, женщин – 18. Возраст умерших варьировался от 30 до 75 лет. Исследования проводили на базе кафедры оперативной хирургии и клинической анатомии с курсом инновационных технологий и Самарского областного бюро судебно-медицинской экспертизы. Во всех случаях изучались протоколы патолого-анатомического исследования трупа для отбора материала по причинам смерти, не оказывающим прямого воздействия на сосудистое русло бассейна внутренней подвздошной артерии.
Полимерная бальзамация анатомического препарата
Для изучения архитектоники ветвей внутренней подвздошной артерии на базе Научно-образовательного центра «Полимерное бальзамирование в медицине» СамГМУ изготавливали препараты с помощью полимерного бальзамирования по методике, разработанной И.В. Гайворонским, С.П. Григоряном (2000 г.). Данная методика заключается в замещении воды и липидов из биологических тканей силиконовым полимером, придающим органам уникальные свойства, а именно, сохранение естественной формы, размеров и топографо-анатомических взаимоотношений сосудисто-нервных структур.
Морфометрия анатомического препарата с использованием инъекционного метода
Методика морфометрии анатомического препарата включала в себя непосредственное измерение длины и диаметра сосудов бассейна внутренней подвздошной артерии во время анатомической препаровки, а также инъекция артериального русла окрашенной двухкомпонентной отвердевающей силиконовой массой для последующего препарирования. Готовая инъекционная смесь вводилась с помощью шприца в катетеризованную внутреннюю подвздошную артерию. Для улучшения полимеризации силиконовой смеси в кровеносном русле препарат помещался на 12 часов в воду, температура которой была 40–50 °С. После застывания силиконовой композиции осуществлялось препарирование сосудов малого таза.
Морфометрические исследования, проведенные на препаратах, инъецированных силиконовой смесью, не давали усадки. При этом полученные морфометрические данные соответствовали внутреннему диаметру артерий.
Клинические методы исследования
Клиническое исследование основывалось на анализе результатов различных видов исследований сосудов, таких как рентгеноконтрастная ангиография, ультразвуковое дуплексное сканирование с цветным картированием и мультиспиральная компьютерная томография.
Для исследования отбирались пациенты в возрасте от 20 до 50 лет без патологий, оказывающих прямое воздействие на сосудистое русло бассейна внутренней подвздошной артерии. Больные исследовались на базе Клиник Самарского государственного медицинского университета и Самарской областной клинической больницы.
Метод математического моделирования и виртуализации
Для математического моделирования и создания трехмерной модели сосудистого русла бассейна внутренней подвздошной артерии применялось сканирование отпрепарированных тазовых областей 3D-сканером Solutionix Regscan III с последующей обработкой отсканированных объектов с помощью 3D-редакторов Autodesk 3dsMax и Autodesk Maya.
3D-сканер Solutionix Rexcan III – это оптическая 3D измерительная система с высоким разрешением (до 5 Мп) и точностью (0,007 мм), с низкими показателями зашумления. Rexcan III использует двойные камеры и технику фазового сдвига, широко применяемую в высокотехнологичных сканерах класса high-end, для получения результата лучшего качества на более высокой скорости [9].
На отпрепарированный биологический материал и область вокруг него устанавливались метки совмещения, регистрируя которые 3D-сканер формирует единую систему координат и таким образом может производить оцифровку объекта. Фиксированное расположение маркеров, создающих единую систему координат, позволяет оператору перемещать сканер во время процедуры регистрации поверхности сложной формы, что дает возможность получения полных трехмерных копий без дополнительной сборки-сшивки отдельных элементов.
При сканировании однородных поверхностей данный прибор дает хорошее качество сетки трехмерной модели. Настройка производится в программном обеспечении устройства за счет изменения объема виртуального куба, в котором происходит регистрация трехмерных координат поверхности объекта. Точность лазерного сканера составляет 100 микрон. С целью получения точных электронных копий отпрепарированных сосудов бассейна внутренней подвздошной артерии мы воспользовались общим алгоритмом работы с бесконтактным оптическим 3D-сканером и разработали методику сборки и обработки данных 3D-сканирования сосудов человека. Производилась регистрация маркеров 3D-сканером, после чего задавались в программном обеспечении величины разрешения сканирования в соответствии с характеристиками сканируемой поверхности сосудов.
Затем проводился процесс непосредственного сканирования поверхностей сосудов, в результате чего было получено необходимое количество сканов. В дальнейшем элементы сессии сканирования были экспортированы в программу для ЭВМ ezScan 7, что позволило перейти к обработке полученного материала.
Для того чтобы получить единые электронные копии объектов сложной формы (в данном случае, сосудистое русло бассейна внутренней подвздошной артерии), была необходима и проводилась сборка «сырого» материала, т.е. совмещались воедино набранные количества сканов ветвей внутренней подвздошной артерии в программном обеспечении ezScan7 с последующей обработкой моделей в редакторах Autodesk 3ds Max и Autodesk Maya.
В области компьютерной графики одной из наиболее важных задач является получение реалистичного и правдоподобного конечного изображения. Основным критерием фотореалистичности и правдоподобности трехмерного изображения является точное отображение освещения, теней, отражающих и поглощающих свойств материалов объектов. Визуализация является заключительным этапом работы над моделируемой сценой. На этом этапе компьютер превращает математическую модель сцены в форму, доступную для визуального восприятия.
Результаты исследования и их обсуждение
Первая попытка сгруппировать варианты отхождения пристеночных ветвей внутренней подвздошной артерии в определенные типы была предпринята Jastschinski (1891). Он обнаружил, что только сосуды одной группы отличаются достаточно регулярным ветвлением, чтобы объединить их в типы, которых он выделял четыре.
Adachi (1928) внес некоторые изменения в данный метод, добавив пятый тип и определенные подтипы, изучая внутреннюю подвздошную артерию и ее ветви у японцев. Его схема выглядит следующим образом (рис. 1).
Рис. 1. Типы Adachi. Н – внутренняя подвздошная артерия, I.G. – нижняя ягодичная артерия, P – внутренняя половая артерия, S.G. – верхняя ягодичная артерия, UMB – пупочная артерия
Тип I: Верхняя ягодичная артерия отходит отдельно от внутренней подвздошной артерии и отходящих общим стволом нижней ягодичной и внутренней половой артерий.
Если общий ствол нижней ягодичной и внутренней половой артерии делится в пределах таза – это тип Ia, если бифуркация ниже тазового дна, соответственно тип Ib.
Тип II: Верхняя и нижняя ягодичные артерии отходят общим стволом, а внутренняя половая артерия отдельно. В данном типе также выделяют два подтипа. Тип IIa – общий ствол двух ягодичных артерий делится в пределах таза, IIb – разделение происходит за пределами таза.
Тип III: Три ветви возникают отдельно от внутренней подвздошной артерии.
Тип IV: Три артерии возникают общим стволом. Книзу верхняя ягодичная и внутренняя половая артерии отделяются от общего ствола. В типе Iva первой отходит верхняя ягодичная артерия, а затем выделяют бифуркацию нижней ягодичной и внутренней половой артерий. В типе IVb внутренняя половая артерия является первым сосудом, отходящим от общего ствола, который затем делится на верхнюю и нижнюю ягодичные артерии.
Тип V: Внутренняя половая и верхняя ягодичная артерии отходят общим стволом, а нижняя ягодичная отдельно.
В данном исследовании мы ориентировались на классификацию Adachi. В результате исследований распределение типов было следующим: тип I – 42 %, тип II – 10 %, тип III – 38 %, тип IV – 8 %, тип V – 2 %.
Были построены виртуальные модели наиболее часто встречаемых типов ветвления внутренней подвздошной артерии (рис. 2, 3).
Рис. 2. Виртуальное моделирование бассейна внутренней подвздошной артерии
Рис. 3. Виртуальная модель внутренней подвздошной артерии
Трехмерные модели позволят оценить клиническое и хирургическое значение выявленных закономерностей в вариантной анатомии ветвей внутренней подвздошной артерии [11].
Данная работа легла в основу принципов компьютерного моделирования органных структур при реализации проекта «Создание аппаратно-программного комплекса «Виртуальный хирург» для 3D моделирования операционного процесса и учебно-методических модулей для системного обучения врача-хирурга методикам открытой хирургии с небольшим размером операционного поля, методикам эндоваскулярной хирургии и эндоскопической хирургии на этапах додипломного и последипломного образования», проект реализуется при финансовой поддержке Министерства образования и науки Российской Федерации.
Знание анатомии, топографии, ориентации и синтопии ветвей внутренней подвздошной артерии могут помочь в остановке кровотечения, а также избежать таких серьезных осложнений, как пересечение подвздошных вен и лигирование наружной подвздошной артерии (Naveen N.S. и соавт., 2011). Эти исследования помогут в практической работе хирургам общего профиля, сосудистым хирургам, а также радиологам при эндоваскулярной катетеризации для внутриартериальной химиотерапии и эмболизации опухолей малого таза.
Рецензенты:
Суворова Г.Н., д.б.н., профессор, заведующая кафедрой анатомии человека, ГБОУ ВПО «Самарский государственный медицинский университет Минздрава России», г. Самара;
Волова Л.Т., д.м.н., профессор, директор НИИ «Институт экспериментальной медицины и биотехнологий», ГБОУ ВПО «Самарский государственный медицинский университет Минздрава России», г. Самара.
Читайте также:
