Чувствительность опухолей к радиации и рентгеновскому излучению
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова
филиал ГБУЗ ГКБ №24 Департамента здравоохранения Москвы «Перинатальный центр», Москва, Россия
Кафедра акушерства и гинекологии лечебного факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Влияние ионизирующего излучения на плод
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова
Цель исследования — провести систематический анализ данных, имеющихся в современной литературе, относительно рисков развития патологии плода в результате воздействия ионизирующего излучения в ходе диагностических или лечебных процедур. Материал и методы. В обзор включены данные статей по выбранной теме, опубликованные в Pubmed за последние 10 лет. Результаты. Внутриутробная радиочувствительность зависит от гестационного возраста, максимальна она в период органогенеза. Анализ данных показал, что при использовании ионизирующего излучения, доза которого не превышает 100 мГр, риск негативного влияния на плод минимален. Заключение. При беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова
филиал ГБУЗ ГКБ №24 Департамента здравоохранения Москвы «Перинатальный центр», Москва, Россия
Кафедра акушерства и гинекологии лечебного факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Воздействие ионизирующего излучения сопровождается увеличением риска спонтанных абортов, развития микроцефалии, задержки умственного развития и, возможно, развития онкологических заболеваний в течение жизни [1]. В связи с этим абсолютно логичным кажется, что согласно Федеральному закону «О радиационной безопасности населения» № 3-ФЗ от 09.01.96: «На период беременности и грудного вскармливания ребенка женщины должны переводиться на работу, не связанную с источниками ионизирующего излучения».
До момента нидации влияние радиации, как и других факторов, происходит по принципу «все или ничего», т. е. эмбрион или погибает, или формируется нормально. Существуют убедительные доказательства увеличения риска гибели эмбриона в предымплантационный период под действием облучения, причем при дозах менее 100 мГр частота летальных эффектов ионизирующего излучения очень мала.
Результаты многих исследований свидетельствуют о том, что внутриутробная радиочувствительность зависит от гестационного возраста с максимальной чувствительностью в период органогенеза. На основе данных, полученных на лабораторных животных, сделан вывод о наличии пороговой дозы облучения для индукции мальформаций, равной 100 мГр. Чаще всего аномалии связаны с центральной нервной системой. Суммарный риск нарушений развития плода и возникновения онкологических заболеваний в детском и юношеском возрасте при экспозиции радиации в дозе 0,1 Гр составляет приблизительно 3% (что сопоставимо с популяционными значениями). Поэтому воздействие радиации в дозе менее 0,1 Гр не может быть показанием к прерыванию беременности [2].
При анализе данных по исследованию выживших после атомных бомбардировок в отношении формирования тяжелой умственной отсталости у детей, подвергшихся внутриутробному облучению в наиболее чувствительный период внутриутробного развития (10—17 нед беременности), было показано, что порог дозы для развития такого повреждения находится на уровне как минимум 300 мГр. Облучение в дозе менее 100 мГр на уровень IQ и частоту мальформаций у ребенка однозначно не влияет [3].
Лучевая диагностика
Существовало мнение, что ионизирующее излучение уже при дозах 10 мГр может вызывать нарушение органогенеза у плода, а также увеличивать риск развития онкологических заболеваний у ребенка после рождения вплоть до подросткового возраста. Однако по результатам систематического обзора, проведенного в 2008 г., не было выявлено статистически значимой связи между пренатальным воздействием рентгеновских лучей и развитием онкологических заболеваний у ребенка (отношение рисков 0,99; 95% доверительный интервал 0,78—1,13) [4]. В Швеции в 2007 г. было проведено крупное исследование, в ходе которого были обследованы 652 ребенка, рожденных у матерей, подвергавшихся во время беременности диагностической рентгенографии. Частота лейкозов у этих детей не отличалась от таковой в контрольной группе [5].
В ходе крупного долгосрочного исследования J. Ray и соавт. [6] оценивали риск развития онкологических заболеваний у детей, подвергшихся внутриутробному воздействию ионизирующего излучения при проведении матери компьютерной томографии или радионуклидной диагностики. Статистически значимой связи между лучевой экспозицией и риском онкологических заболеваний у детей (ОШ (отношение рисков) 0,69; 95% ДИ (доверительный интервал) — 0,26—1,82) выявлено не было.
По данным Международной комиссии по радиологической защите, риск развития злокачественных новообразований равняется приблизительно одному случаю на 500 плодов, подвергшихся излучению в дозе 30 мГр. При этом пожизненный риск развития рака после внутриутробного облучения будет таким же, как и после облучения в раннем детском возрасте, т. е., по крайней мере, в 3 раза выше, чем у населения в целом [7].
Таким образом, в зависимости от возможного воздействия на плод, дозы ионизирующего излучения можно разделить следующим образом:
— до 100 мГр — безопасная для плода;
— 100—300 мГр — возможно повреждающее действие на плод;
— более 300 мГр — высока вероятность пороков развития, задержки роста и гибели плода, поэтому после воздействия такой дозы радиации в I триместре беременности следует поставить вопрос об искусственном прерывании беременности.
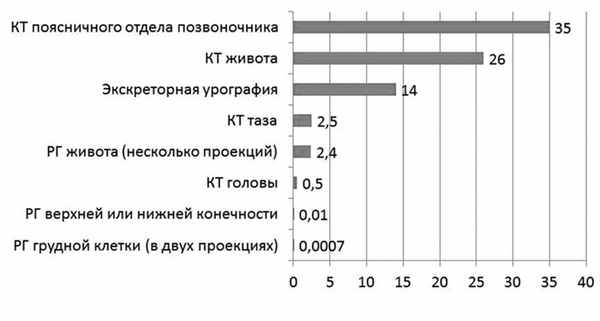
Большинство диагностических процедур, основанных на воздействии ионизирующего излучения (рентгенологическое обследование, флюорография), характеризуются дозировкой излучения менее 50 мГр (см. рисунок) Поглощаемая плодом доза ионизирующего излучения при проведении рентгенологических исследований (мГр) [8]. (например, доза для плода при рентгенографии грудной клетки составляет менее 1 мкГр, при флюорографии — 1,5 мкГр), поэтому даже при проведении нескольких рентгенологических исследований подряд вероятность неблагоприятного воздействия на плод крайне низка. Так, компьютерная томография (КТ) характеризуется довольно высокой дозой излучения (поскольку проводится серия рентгеновских снимков, излучение, сопровождающее каждый из них, суммируется). Поэтому К.Т. во время беременности должно выполняться по строгим показаниям, хотя риск для плода также невысок. Согласно современным рекомендациям, этот метод исследования имеет свою нишу при беременности. КТ рекомендуют проводить при сомнении в диагнозе острый аппендицит, подозрении на тромбоэмболию легочной артерии, при серьезных травмах, а в некоторых случаях и при необходимости уточнения строения и формы таза. При этом во всех случаях перед проведением этой процедуры с пациенткой необходимо провести беседу и информировать ее о потенциальных рисках для плода, получив с нее информированное согласие на манипуляцию [8].
Американская коллегия радиологов даже опубликовала меморандум о том, что ни одна диагностическая процедура, основанная на рентгеновском облучении, не угрожает здоровью и развитию эмбриона и плода. Несмотря на это, флюорография и рентгеновское исследование во время беременности должны проводиться только при наличии строгих показаний.
Лучевая терапия
Лучевую терапию, учитывая риск формирования пороков развития у плода, во время беременности используют редко. Дозы облучения, применяемые при лучевой терапии, составляет 30—70 Гр, что в 100—1000 раз выше, чем при диагностических процедурах. Соответственно, при невозможности отложить лучевую терапию нужно использовать методы экранирования плода. Кроме того, роль играет расстояние между зоной облучения и дном матки. Если это расстояние превышает 30 см, периферическая доза облучения для плода составит 0,04—0,2 Гр. При высоком стоянии дна матки (III триместр беременности, многоплодная беременность и т. д.) периферическая доза облучения для плода может превысить 2 Гр [11, 12].
В связи с этим риск для плода минимален при облучении опухолей, локализующихся выше диафрагмы (опухоли головы и шеи, рак молочной железы), а при раке шейки матки лучевая терапия несовместима с жизнеспособностью плода [2, 12].
В 2009 г. S. Luis и соавт. [13] провели анализ 109 случаев лучевой терапии при беременности. Средний период наблюдения за детьми составил 37 мес. Было зафиксировано 13 наблюдений неблагоприятного завершения беременности (2 самопроизвольных аборта, 6 наблюдений перинатальной гибели, 1 случай нейросенсорной тугоухости, случай затруднения в обучении и сколиоза, 1 наблюдение сочетания крипторхизма и дефекта межжелудочковой перегородки, 1 наблюдение гипоспадии, а также случай нарушения психомоторного развития).
Радиоизотопная терапия
Радиоактивные вещества даже при их однократном поступлении в организм беременной могут надолго задерживаться в нем, переходить через плацентарный барьер и быть источником облучения плода. Особенно значимо поражаются у беременной гормональная, иммунная и репродуктивная системы. Влияние на эти системы обусловлено тем, что в период гестации в организме беременной происходят значительные изменения в эндокринной системе, за счет угнетения адаптивного иммунитета смещается иммунное равновесие, а в репродуктивной системе (в матке) развивается плодное яйцо, элементы которого с различной интенсивностью и специфичностью накапливают отдельные радионуклиды.
Такие радиоактивные элементы, как 131 I, 32 P, 134 Cs излучают α-, β-, γ-лучи, обладающие различной проникающей способностью. Существуют следующие пути передачи радионуклидов: 1) гематогенный ( 131 I, 32 P, 134 Cs); 2) накопление радионуклидов в тканях плаценты с последующим воздействием на плод (трансурановые элементы); 3) параплацентарный переход через плодные оболочки и околоплодные воды (радиоактивный плутоний).
Беременность является противопоказанием к терапии радиоизотопами, за исключением случаев, когда без проведения терапии существует риск для жизни пациентки.
Некоторые радиоизотопы, включая 131 I в виде иодида и 32 Р в виде фосфата, быстро проходят через плаценту, поэтому перед проведением терапии радиоактивными препаратами следует исключить беременность. На практике, так как рак щитовидной железы обладает относительно низкой агрессивностью течения, и хирургическое, и радиоизотопное лечение можно отсрочить до родов.
На ранних сроках беременности наиболее опасным для плода является γ-излучение радиоактивного йода, скапливающегося в мочевом пузыре. Доза, которая действует на плод при радиоизотопной терапии при беременности, составляет приблизительно 50—100 мкГр на 1 МБк от введенного препарата. Дозу можно снизить, рекомендовав пациентке обильное питье и частое мочеиспускание.
В сроке более 10 нед щитовидная железа может накапливать йод, что может приводить как к аблации щитовидной железы плода, так и к индукции в дальнейшем у него рака щитовидной железы [14].
Таким образом, при беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Ионизирующее излучение, последствия для здоровья и защитные меры
Ионизирующее излучение — это вид энергии, высвобождаемой атомами в форме электромагнитных волн (гамма- или рентгеновское излучение) или частиц (нейтроны, бета или альфа). Спонтанный распад атомов называется радиоактивностью, а избыток возникающей при этом энергии является формой ионизирующего излучения. Нестабильные элементы, образующиеся при распаде и испускающие ионизирующее излучение, называются радионуклидами.
Все радионуклиды уникальным образом идентифицируются по виду испускаемого ими излучения, энергии излучения и периоду полураспада.
Активность, используемая в качестве показателя количества присутствующего радионуклида, выражается в единицах, называемых беккерелями (Бк): один беккерель — это один акт распада в секунду. Период полураспада — это время, необходимое для того, чтобы активность радионуклида в результате распада уменьшилась наполовину от его первоначальной величины. Период полураспада радиоактивного элемента — это время, в течение которого происходит распад половины его атомов. Оно может находиться в диапазоне от долей секунды до миллионов лет (например, период полураспада йода-131 составляет 8 дней, а период полураспада углерода-14 — 5730 лет).
Источники излучения
Люди каждый день подвергаются воздействию естественного и искусственного излучения. Естественное излучение происходит из многочисленных источников, включая более 60 естественным образом возникающих радиоактивных веществ в почве, воде и воздухе. Радон, естественным образом возникающий газ, образуется из горных пород, почвы и является главным источником естественного излучения. Ежедневно люди вдыхают и поглощают радионуклиды из воздуха, пищи и воды.
Люди подвергаются также воздействию естественного излучения из космических лучей, особенно на большой высоте. В среднем 80% ежегодной дозы, которую человек получает от фонового излучения, это естественно возникающие наземные и космические источники излучения. Уровни такого излучения варьируются в разных реогрфических зонах, и в некоторых районах уровень может быть в 200 раз выше, чем глобальная средняя величина.
На человека воздействует также излучение из искусственных источников — от производства ядерной энергии до медицинского использования радиационной диагностики или лечения. Сегодня самыми распространенными искусственными источниками ионизирующего излучения являются медицинские аппараты, как рентгеновские аппараты, и другие медицинские устройства.
Воздействие ионизирующего излучения
Воздействие излучения может быть внутренним или внешним и может происходить различными путями.
Внутренне воздействие ионизирующего излучения происходит, когда радионуклиды вдыхаются, поглощаются или иным образом попадают в кровообращение (например, в результате инъекции, ранения). Внутреннее воздействие прекращается, когда радионуклид выводится из организма либо самопроизвольно (с экскрементами), либо в результате лечения.
Внешнее радиоактивное заражение может возникнуть, когда радиоактивный материал в воздухе (пыль, жидкость, аэрозоли) оседает на кожу или одежду. Такой радиоактивный материал часто можно удалить с тела простым мытьем.
Воздействие ионизирующего излучения может также произойти в результате внешнего излучения из соответствующего внешнего источника (например, такое как воздействие радиации, излучаемой медицинским рентгеновским оборудованием). Внешнее облучение прекращается в том случае, когда источник излучения закрыт, или когда человек выходит за пределы поля излучения.
Люди могут подвергаться воздействию ионизирующего излучения в различных обстоятельствах: дома или в общественных местах (облучение в общественных местах), на своих рабочих местах (облучение на рабочем месте) или в медицинских учреждениях (пациенты, лица, осуществляющие уход, и добровольцы).
Воздействие ионизирующего излучения можно классифицировать по трем случаям воздействия.
Первый случай — это запланированное воздействие, которое обусловлено преднамеренным использованием и работой источников излучения в конкретных целях, например, в случае медицинского использования излучения для диагностики или лечения пациентов, или использование излучения в промышленности или в целях научных исследований.
Второй случай — это существующие источники воздействия, когда воздействие излучения уже существует и в случае которого необходимо принять соответствующие меры контроля, например, воздействие радона в жилых домах или на рабочих местах или воздействие фонового естественного излучения в условиях окружающей среды.
Последний случай — это воздействие в чрезвычайных ситуациях, обусловленных неожиданными событиями, предполагающими принятие оперативных мер, например, в случае ядерных происшествий или злоумышленных действий.
На медицинское использование излучения приходится 98% всей дозы облучения из всех искусственных источников; оно составляет 20% от общего воздействия на население. Ежегодно в мире проводится 3 600 миллионов радиологических обследований в целях диагностики, 37 миллионов процедур с использованием ядерных материалов и 7,5 миллиона процедур радиотерапии в лечебных целях.
Последствия ионизирующего излучения для здоровья
Радиационное повреждение тканей и/или органов зависит от полученной дозы облучения или поглощенной дозы, которая выражается в грэях (Гр).
Эффективная доза используется для измерения ионизирующего излучения с точки зрения его потенциала причинить вред. Зиверт (Зв) — единица эффективной дозы, в которой учитывается вид излучения и чувствительность ткани и органов. Она дает возможность измерить ионизирующее излучение с точки зрения потенциала нанесения вреда. Зв учитывает вид радиации и чувствительность органов и тканей.
Зв является очень большой единицей, поэтому более практично использовать меньшие единицы, такие как миллизиверт (мЗв) или микрозиверт (мкЗв). В одном мЗв содержится тысяча мкЗв, а тысяча мЗв составляют один Зв. Помимо количества радиации (дозы), часто полезно показать скорость выделения этой дозы, например мкЗв/час или мЗв/год.
Выше определенных пороговых значений облучение может нарушить функционирование тканей и/или органов и может вызвать острые реакции, такие как покраснение кожи, выпадение волос, радиационные ожоги или острый лучевой синдром. Эти реакции являются более сильными при более высоких дозах и более высокой мощности дозы. Например, пороговая доза острого лучевого синдрома составляет приблизительно 1 Зв (1000 мЗв).
Если доза является низкой и/или воздействует длительный период времени (низкая мощность дозы), обусловленный этим риск существенно снижается, поскольку в этом случае увеличивается вероятность восстановления поврежденных тканей. Тем не менее риск долгосрочных последствий, таких как рак, который может проявиться через годы и даже десятилетия, существует. Воздействия этого типа проявляются не всегда, однако их вероятность пропорциональна дозе облучения. Этот риск выше в случае детей и подростков, так как они намного более чувствительны к воздействию радиации, чем взрослые.
Эпидемиологические исследования в группах населения, подвергшихся облучению, например людей, выживших после взрыва атомной бомбы, или пациентов радиотерапии, показали значительное увеличение вероятности рака при дозах выше 100 мЗв. В ряде случаев более поздние эпидемиологические исследования на людях, которые подвергались воздействию в детском возрасте в медицинских целях (КТ в детском возрасте), позволяют сделать вывод о том, что вероятность рака может повышаться даже при более низких дозах (в диапазоне 50-100 мЗв).
Дородовое воздействие ионизирующего излучения может вызвать повреждение мозга плода при сильной дозе, превышающей 100 мЗв между 8 и 15 неделей беременности и 200 мЗв между 16 и 25 неделей беременности. Исследования на людях показали, что до 8 недели или после 25 недели беременности связанный с облучением риск для развития мозга плода отсутствует. Эпидемиологические исследования свидетельствуют о том, что риск развития рака у плода после воздействия облучения аналогичен риску после воздействия облучения в раннем детском возрасте.
Деятельность ВОЗ
ВОЗ разработала радиационную программу защиты пациентов, работников и общественности от опасности воздействия радиации на здоровье в планируемых, существующих и чрезвычайных случаях воздействия. Эта программа, которая сосредоточена на аспектах общественного здравоохранения, охватывает деятельность, связанную с оценкой риска облучения, его устранением и информированием о нем.
В соответствии с основной функцией, касающейся "установления норм и стандартов, содействия в их соблюдении и соответствующего контроля" ВОЗ сотрудничает с 7 другими международными организациями в целях пересмотра и обновления международных стандартов базовой безопасности, связанной с радиацией (СББ). ВОЗ приняла новые международные СББ в 2012 году и в настоящее время проводит работу по оказанию поддержки в осуществлении СББ в своих государствах-членах.
Чувствительность опухолей к радиации и рентгеновскому излучению
Чувствительность опухолей к радиации и рентгеновскому излучению
Еще с самого начала XX века многие медицинские исследователи посвящали себя изучению загадочных процессов, которые происходят в живой ткани под действием ионизирующей радиации. Уже известно, что радиационное поражение может приводить к смерти за счет гибели клеток, а может быть сублетальным, если пораженные клетки полностью или частично восстанавливаются.
Применительно к онкологии можно сказать, что степень радиочувствительности каждой конкретной опухоли (определяемой врожденной чувствительностью к радиации) будет зависеть не только от непосредственного поражения клеток, но и от способности ткани опухоли к репарации. Хотя при планировании радиотерапевтического лечения в основном руководствуются радиочувствительностью клеток опухоли, на исход лечения может влиять также целый ряд других факторов. Таким образом, собственно радиочувствительность опухоли не является достаточным условием для успешного лечения.
Например, острый лимфобластный лейкоз (ОЛЛ) высоко радиочувствителен, так как его злокачественные малые лимфобласты обладают крайне высокой чувствительностью даже к малым дозам ионизирующей радиации. В то же время, из-за своей распространенности в организме, когда он поражает практически весь костный мозг и многие питаемые кровотоком органы, до недавнего времени было невозможно проводить эффективную радиотерапию этого заболевания без фатальной передозировки всего организма.
Только разработка современной методики аллогенной костномозговой трансплантации (КМТ) позволила проводить тотальное облучение организма достаточно высокими дозами, вызывающими гибель основной массы злокачественных клеток. В данном случае трансплантация оказывает не терапевтический эффект, а позволяет применять повышенные дозы облучения, летальные для лейкозных клеток.
До сих пор еще нет ясного понимания, какие физико-химические процессы начинают происходить в клетке в результате облучения. Хотя не вызывает сомнений, что радиацией в первую очередь поражается ядерная ДНК, повреждения не исчерпываются только «прямым воздействием» пучка излучения на эти молекулы: в этом случае повреждения состоят в необратимом расщеплении нитей ДНК.
Основной же эффект воздействия ионизирующего излучения состоит в образовании нестабильных высоко реакционноспособных молекул свободных радикалов. Эти свободные радикалы в свою очередь реагируют с молекулами ДНК, вызывая их деструкцию. Вероятность гибели клетки от действия излучения зависит не только от количества энергии, поглощенной тканью (которая в свою очередь зависит от мощности источника облучения), но и от интенсивности пучка и типа радиоактивного излучения: y - излучение, электроны, нейтроны или другие частицы.
Эти различия легли в основу концепции линейной поглощенной дозы (ЛПД), которая характеризуется как количество поглощенной тканью энергии на единичном отрезке пробега конкретного пучка. В общих чертах, киловольтный пучок рентгеновского излучения имеет более высокий коэффициент ЛПД, чем мегавольтный пучок, а пучок нейтронов обладает гораздо более высоким коэффициентом ЛПД, чем рентгеновское излучение или у-излучение. Таким образом, если мы применяем нейтронную терапию, необходимо вводить соответствующие поправки интенсивности облучения по сравнению с обычными источниками.
Еще одним существенным моментом является то, что гипоксия, присущая опухолевым тканям, может оказывать радиопротекторное воздействие, особенно при использовании пучков с низким коэффициентом ЛПД. Именно поэтому нейтронное облучение, да еще в сочетании с оксигенацией опухолевых тканей, уже давно считается эффективным способом борьбы со злокачественными опухолями.
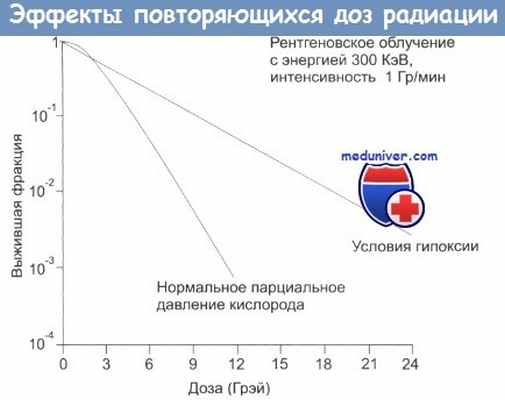
Фракционирование: эффект последовательно повторяющихся доз радиации.
Фракционирование увеличивает разницу в реакции на облучение между здоровыми и злокачественными тканями.
Экспериментальные исследования показывают, что человеческие опухолевые клетки значительно отличаются друг от друга по радиочувствительности. Современный уровень знаний позволяет постулировать два типа клеточной гибели: так называемую а-компоненту, которая является линейно-логарифмической (экспоненциальной) и на графиках дозо-зависимой гибели будет представлена прямой линией, и b-компоненту, которая отражает гибель клеток при краткосрочном облучении малыми дозами.
Наиболее существенные различия в радиочувствительности клеток отмечаются именно в этом низкодозном диапазоне (который одновременно имеет наибольшее значение для клинической практики) при облучении дозами до 2 Гр (200 рад). Более того, облучение низкими дозами, по-видимому, увеличивает разброс в чувствительности клеток. С другой стороны, облучение низкими дозами радиации приводит к тому, что некоторые клетки становятся более устойчивыми к действию радиации. Все эти факты позволяют многим выступать за необходимость применения высоких доз облучения для низкочувствительных опухолей.
В построении линейно-квадратических математических моделей с использованием а-компонентов как линейной дозово-зависимой функции и b-компонентов как квадратичной функции выживание клеток используется для анализа конечных результатов. Фракционированный подход в облучении чаще применяют к поздне-реагирующим опухолевым тканям, чем к быстро-реагирующим опухолям.
В ряде клинических случаев неудача при использовании радиотерапии происходит потому, что часто даже после относительно успешного сеанса облучения тем ни менее происходит развитие рецидивов заболевания. Довольно часто это случается, например, при лечении плоскоклеточной карциномы бронхов, когда даже точная рентгенография грудной клетки и бронхоскопия фиксируют удовлетворительный эффект проведенного лечения. Как мы можем объяснить возникновение рецидива через 1-2 года после завершения первичного лечения? Одна из наиболее распространенных точек зрения, которая к тому же согласуется с экспериментальными данными, состоит в том, что в момент проведения первичного лечения в организме присутствуют клетки с различной чувствительностью к излучению.
Этот факт, а также различия в степени оксигенации клеточных субпопуляций являются ключевыми факторами, влияющими на эффективность лечения. Таким феноменам посвящено множество радиобиологических исследований, и почти во всех экспериментах (как на экспериментальных животных, так и в клеточных культурах in vitro) четко показано, что повышение окигенации клеток значительно увеличивает их радиочувствительность по сравнению с клетками, находящимися в состоянии аноксии.
Различие в чувствительности клеток может быть таково, что для эффективного воздействия на клетки в состоянии аноксии требуется применять в два-три раза более мощные дозы облучения. Эта проблема имеет большое клиническое значение, так как если клетки лишаются хорошего артериального кровоснабжения, они неизбежно начинают страдать аноксией.
Предполагается, что в крупных опухолях со сравнительно быстрым ростом и обширными некротическими областями с низкой насыщенностью кровеносными сосудами аноксия может стать основным фактором, определяющим радиорезистентность опухолевой ткани. Эксперименты с использованием микроэлектродов для замеров парциального содержания кислорода подтверждают эти теоретические предположения.
Клетки-предшественники тоже могут иметь различную радиочувствительность, но эти различия не связаны с кислородным эффектом. Рецидивы, возникающие после успешно проведенного курса радиотерапии, в этом случае могут быть обусловлены регенерацией радиорезистентных стволовых клеток опухоли. Причем регенерация может происходить как после окончания полного курса радиотерапии, так и очень быстро, буквально в промежутках между сеансами облучения. Существует ряд наблюдений, показывающих, что возобновление популяции стволовых клеток нормальной ткани после облучения происходит несколько более быстро, чем у опухолевой ткани.
Этот факт может лечь в основу лечения, так как регенеративные способности нормальной ткани позволяют использовать такие дозы облучения, которые при слабом на нее воздействии окажут эффективное поражающее действие на опухоль. В некотором смысле этот эффект аналогичен воздействию химиотерапевтических препаратов, которые тоже воздействуют на все клетки — как нормальные, так и опухолевые — но в разной степени. Признание важности эффектов восстановления популяции опухолевых клеток и клеточной гипоксии ведет к росту числа исследований в данной области.
Среди множества попыток найти эффективное лечение следует отметить разработки методов гиперфракциональной радиотерапии и попытки повысить кислородное снабжение опухолевой ткани, чтобы добиться максимальной локальной эффективности при облучении внешними источниками радиации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биологическое действие ионизирующего излучения.
На ранней стадии существования материи она была в значительной степени радиоактивной. Однако по истечении времени большинство ядер природных радиоактивных веществ подверглись радиоактивному распаду и стали устойчивыми. Но некоторые вещества всё ещё радиоактивны и являются источниками ионизирующего излучения. Наряду с этим, излучения Космоса и Солнца постоянно воздействуют на организм и окружающую среду. Таким образом, вся жизнь на земле развивается в среде, которая является естественной - радиоактивной.
Ионизирующее излучение было открыто в 1895 году Вильгельмом Конрадом Рентгеном в Германии, который зафиксировал неизвестные ранее лучи, которые проникали сквозь тело человека. Эти лучи, однако, не были связаны с естественной радиоактивностью. Рентген получил их в электронной лампе, разгоняя поток электронов от одного электрода к другому. Это открытие вдохновило других учёных искать таинственные лучи, и в 1896 году было сделано следующее открытие: французский физик Анри Беккерель изучал минеральный образец урана и обнаружил, что он испускал лучи того же самого типа, что и лучи Рентгена. Беккерель обнаружил явление естественной радиоактивности.
Теперь поиск химических элементов, испускающих радиацию, стал более целенаправленным. В 1898 году учёные Мария и Пьер Кюри выделили два радиоактивных элемента: полоний и радий. Радий, который является высоко радиоактивным химическим элементом, скоро оказался полезным в медицине. А в то время об опасности вредного воздействия излучения на организм не было известно.
Многие из первопроходцев в области медицины и научных исследований были облучены, и в течение первых десятилетий прошлого столетия некоторые из них погибли от лучевой болезни.
В 1928 году на Международном Конгрессе по радиологии в Стокгольме была основана международная организация – сегодня известная, как Международная Комиссия по Радиационной Защите (МКРЗ). МКРЗ собирает информацию о воздействии радиации на здоровье и выпускает рекомендации по радиационной защите.
Воздействие ионизирующего излучения на вещество.
Любое вещество, поглощая энергию солнечного излучения, нагревается. Воздействие солнечного излучения на биологическую ткань приводит к биологическим эффектам (например, загар на теле человека). Так же и ионизирующее излучение воздействует различным образом на живую и неживую материю.
Тело человека поглощает энергию и находится под биологическим воздействием ионизирующего излучения. Чтобы понять, как ионизирующее излучение воздействует на нашу биологическую ткань, исследуем процесс на уровне элементов, составляющих ткань, то есть на уровне клетки.
Клетка и молекула ДНК живого организма.
Человеческое тело состоит приблизительно из 10 14 клеток. Клетка - самая маленькая частица организма, которая обладает способностью к жизнедеятельности и размножению. Она поглощает питательные вещества и кислород из крови и преобразует их в энергию. Компьютером, управляющим всеми программами, по которым работают все наши клетки, является генетический материал, содержащийся в ядре каждой клетки. Генетический материал содержит не только информацию о задачах клетки, но также и полный сборочный чертёж всего человеческого тела, включая все его индивидуальные характеристики.
Генетический материал человека состоит из 46 хромосом, составляющих 23 пары. Внутри хромосом находится молекула ДНК, которая является сложнейшей макро-молекулой. Молекула ДНК состоит их двух цепочек в форме двойной спирали, растянув которые можно получить нить длинной около 1,5 метра
Четыре базы, названные А, С, G, Т, связывают обе спирали вместе очень оригинальным способом. А в одной спирали всегда соединяется с Т в другой спирали, С всегда соединяется с G. В случае, если одна спираль повреждена, другая служит моделью для восстановления.
Деление клетки в организме.
Клетки могут разрушиться или быть повреждены вследствие каких-либо причин. Чтобы позволить тканям тела и органам поддерживать свои функции, клетка делится с образованием двух нормальных, здоровых дочерних клеток, идентичной материнской клетке, которые заменяют повреждённую клетку.
Когда клетка делится, обе цепочки каждой молекулы ДНК разделяются, каждая затем становится частью новой спирали ДНК и в результате – мы имеем две новые клетки.
Полный процесс деления занимает от двух минут до двух часов – это очень чувствительный период в жизни клетки. Повреждение ДНК во время этого процесса может привести к различным последствиям. Однако, способность клетки к восстановлению исправит большинство дефектов прежде, чем закончится образование новой клетки.
Повреждение ДНК происходит случайно, или в результате воздействия на неё ядовитых веществ, вирусов, ультрафиолетового или ионизирующего излучения.
Воздействии ионизирующего излучения на ДНК.
Некоторые клетки являются наиболее чувствительными к ионизирующему излучению, но все они чувствительны в период деления. Это означает, что растущая ткань или ткань, которая имеет высокую скорость деления клеток, более чувствительна к ионизирующему излучению, чем другие ткани. Вот почему дети, а особенно плод беременной женщины более чувствительны к излучению, чем взрослые. По той же причине клетки раковой опухоли более чувствительны к излучению, чем здоровая ткань, так как раковая опухоль растёт очень быстро за счёт частого деления раковых клеток. Эта особенность опухоли используется для лечения рака при помощи облучения раковых клеток.
Прямые и косвенные эффекты облучения.
Ионизирующее излучение может воздействовать на ДНК непосредственно или косвенно. Наши клетки состоят на 65-75% из воды. Поэтому, наиболее вероятная молекула, которая подвергается воздействию ионизирующего излучения молекула воды. Излучение ионизирует молекулы воды, приводя к образованию различных химических активных веществ. Эти вещества, которые называются свободными радикалами, могут воздействовать на молекулу ДНК. Прямое воздействие имеет менее важное значение, поскольку оно менее вероятно. Чтобы вызвать прямой эффект, ионизирующее излучение должно разрушить молекулу ДНК.
Бета- и гамма-излучения вызывают низкую плотность ионизации, поэтому вероятность повреждения обеих цепочек спирали ДНК относительно небольшая. Обычно ущерб наносится только одной цепочке или одной базе, и это повреждение может быть восстановлено относительно эффективными функциями восстановления организма. Альфа-излучение вызывает высокую плотность ионизации. При этом возникает большая вероятность разрушения обеих цепочек ДНК. Поскольку генетическая модель клетки, таким образом, разрушается, вероятна ошибка в процессе восстановления клетки, что может даже привести к гибели клетки.
Действие радиации на организм человека.
Существуют различия между последствиями радиационного воздействия, которые возникают вскоре после облучения – острые последствия – и последствиями, которые будут наблюдаться намного позже – хронические последствия.
Острые последствия облучения.
Острые последствия обусловлены большой дозой облучения тела или органа человека за короткий срок, и в большинстве случаев приводят к гибели клеток организма. При превышении порогового значения повреждения неизбежны, и они увеличиваются с увеличением дозы. Индивидуальное пороговое значение может быть разным, и это может изменить степень повреждения каждого индивидуума. Острая лучевая болезнь и повреждение плода у беременных – примеры острых повреждений организма в результате воздействия ионизирующего излучения.
Острая лучевая болезнь.
Клетки, которые являются наиболее чувствительными к воздействию радиации – клетки с высокой частотой деления. Поэтому в первую очередь ионизирующее излучение будет воздействовать на кроветворные органы (красный костный мозг), особенно чувствительные к ионизирующему излучению. Кратковременная доза облучения на всё тело более, чем 1000 мЗв (100 бэр) приведёт к острой лучевой болезни. Множество клеток и, следовательно, большие части живой ткани будут повреждены или погибнут. Функции облучённого органа будут нарушены. Последствия интенсивного облучения организма в дозах, превышающих пороговое значение, иногда проявляются уже через час или два: человек начнёт чувствовать слабость и начнётся рвота. Эти признаки обычно уменьшаются после двух дней, и в течение двух-трёх недель – самочувствие человека улучшается. Однако, за это время число белых кровяных клеток существенно уменьшится, уменьшится и сопротивление организма заразным болезням. Это может привести к воспалительным болезням с высокой температурой, диарее и кровотечениям. Если человек поправляется от острого облучения, то останется риск хронических последствий облучения.
Незамедлительное и целенаправленное квалифицированное лечение увеличивает процент выживания.
Генетические нарушения в организме.
Различают следующие виды воздействия на клетки организма вследствие облучения в зависимости от поглощённой дозы облучения и радиоустойчивости клетки:
- Без изменений – облучение не влияет на клетку
- Клетка восстанавливает молекулу ДНК
Молекула ДНК получает ложную информацию, ведущую к мутации клетки. Мутации не обязательно отрицательные, но они могут также привести к генетическим нарушениям и раковым заболеваниям.
Хронические последствия облучения.
Рак и наследственные болезни расцениваются как хронические последствия действия радиационного облучения.
Пороговое значение дозы облучения для хронических последствий отсутствует. Чем больше доза облучения, тем выше вероятность заболевания.
Клетка, у которой генетический код был изменён, может развиться в раковую клетку. Рак – болезнь, вызванная бесконтрольным делением мутирующих клеток. Примерно 20% всех смертных случаев в мире – от раковых болезней. Признаки лейкемии, вызванной ионизирующим излучением, обнаруживаются через 3-7 лет после облучения. Другие виды раковых болезней развиваются более длительное время.
Наследственные изменения в потомстве.
ДНК в половых клетках, также могут быть повреждены ионизирующим излучением. Эти повреждения могут быть переданы следующему поколению. Но для того, чтобы это случилось, дефект клеток должен быть унаследован от обоих родителей. Необходимые условия передачи генетических изменений следующему поколению:
- Хромосома в половой клетке повреждена.
- Повреждены одинаковые хромосомы в клетках отца и матери.
- Эмбрион должен развиться. Шансы эмбриона выжить уменьшаются, если клетки повреждены.
Эти условия объясняют, почему наследственные последствия нанесения вреда организму настолько трудно оценить. Вероятность каждого условия мала. Вероятность того, что все три условия выполняются одновременно – чрезвычайно мала.
Рентгенотерапия
Рентгенотерапия — это медицинская дисциплина, изучающая теорию и практику применения рентгеновского излучения с лечебной целью.
Является частным разделом лучевой терапии, при котором с лечебной целью используется рентгеновское излучение с энергией от 10 до 250 кВ. С увеличением напряжения на рентгеновской трубке увеличивается энергия излучения и вместе с этим его проникающая способность в тканях возрастает от нескольких миллиметров до 8—10 см.
Использование рентгенотерапии началось в 1897 г., однако научные основы рентгенотерапия получила только с развитием физики, дозиметрии, радиобиологии и накоплением клинического опыта. Рентгенотерапия при напряжении от 160 до 250 кв до 50-х годов нашего столетия была единственным методом дистанционного облучения глубоко расположенных патологических процессов как воспалительного и дистрофического характера, так и злокачественных опухолей. Однако, при раке внутренних органов, характеризующемся малой радиочувствительностью и требующем для своего разрушения больших доз излучения (в пределах 60—70 Гр), рентгенотерапия оказалась малоэффективной.
Различают рентгенотерапию глубокую или ортовольтную (расстояние фокус — кожа 30 см и больше) и близкофокусную (расстояние фокус — кожа 7,5-20 см).
Рентгеновское излучение, генерируемое в рентгеновских трубках при помощи высоковольтных электрических аппаратов, при воздействии на ткани и органы тела человека вызывает подавление функций отдельных клеток, угнетение их роста, а в ряде случаев и их деструкцию. Эти явления оказываются следствием поглощения и рассеяния— первичных физических процессов взаимодействия рентгеновского излучения с биологической средой. За первичными физическими следуют физико-химические и биохимические процессы, определяющие развитие терапевтического эффекта. Особенностью рентгеновского излучения является его непрерывный энергетический спектр, в котором присутствуют кванты излучения с любыми энергиями, вплоть до максимального значения, соответствующего наибольшему напряжению генерирования. Последнее в настоящее время в рентгенотерапии обычно не превышает 250 кВ.

Для получения однородного пучка используют фильтры, поглощающие мягкие лучи. Для излучений малой энергии применяют фильтры из легких металлов (алюминий, латунь толщиной 0,5—6 мм). Для излучений больших энергий (180—200 кВ) однородность излучения достигается применением фильтров из тяжелых металлов (цинк, медь толщиной 0,5—2 мм).
Для ограничения поля облучения и удобства центрации при рентгенотерапии применяют цилиндрические или прямоугольные тубусы, обеспечивающие необходимое для каждого конкретного больного кожно-фокусное расстояние. Выходное окно тубусов аппаратов для короткофокусной рентгенотерапии имеет диаметр до 10 см и для глубокой площадь 16—400 см2.
Лечебный эффект рентгенотерапии связан с поглощенной дозой излучения в области патологического очага. Величина оптимальной поглощенной дозы, ее дробление, ритм облучения обусловлены в каждом случае характером патологического процесса. На степень сопутствующих реакций окружающих патологический очаг здоровых тканей и органов, а также реакций всего организма влияет величина интегральных доз в этих отдельных анатомических структурах и во всем теле больного.
Эффекты воздействия рентгенотерапии не однозначны для разных гистологических структур, что связано с различной чувствительностью последних к ионизирующему излучению.
Однако чувствительность облучаемых тканей в организме человека зависит и от ряда других многочисленных факторов — возраста, пола, температуры тела и облучаемого участка, локализации последнего, его гидрофильности, кровоснабжения, кислородного насыщения, его функциональной активности, интенсивности обменных процессов и мн. др., в том числе и от исходного состояния, а также реактивности организма. На биологические эффекты рентгенотерапии влияет характер распределения дозы облучения во времени. Дробное облучение по сравнению с однократным оказывается менее повреждающим. В этом случае лучше выявляется дифференциальная чувствительность тканей и так называемый терапевтический интервал — разница в чувствительности нормальных и патологических гистоструктур.
Рентгенотерапия может вызывать различные эффекты. В зависимости от величины поглощенной дозы излучения, ритма облучения, объекта воздействия, характера и стадии заболевания и, наконец, реактивности организма больного могут иметь место противовоспалительные, десенсибилизирующие, деструктивные, анальгезирующие и другие эффекты. В связи с расширением возможностей использования высокоэнергетических источников излучения рентгенотерапии применяется преимущественно при сравнительно неглубоком расположении патологического очага и при возможности применения небольших доз излучения.
Рентгенотерапия является эффективным методом лучевого лечения в различных областях медицины: онкологии, дерматологии и косметологии, травматологии и ортопедии.
Для лечения поверхностных злокачественных новообразований базальноклеточного и плоскоклеточного рака кожи, начальных стадий рака губы и рака вульвы близкофокусная рентгенотерапия является методом выбора и имеет ряд преимуществ перед хирургическими методами лечения. При большем распространении процесса ренгенотерапия сочетается с дистанционными методами лучевой терапии.
Близкофокусная рентгенотерапия является самостоятельным радикальным методом лечения предраковых заболеваний (старческая кератома, болезнь Боуэна, кожный рог, лейкоплакия и т.д.), ряда дегенеративных воспалительных и гипертрофических заболеваний кожи (синдром Дюпюитрена, подошвенный фиброматоз, келоидные рубцы, бородавки и кондиломы, дерматологические заболевания, в том числе псориаз, грибовидные микозы, экземы, нейродермиты).
Рентгенотерапия применяется при лечении гинекомастии, послеоперационной лимфореи, является высокоэффективным методом лечения дегенеративных и воспалительных заболеваний (невралгии и невриты лицевого нерва, плечевого сплетения, пояснично-крестцовый радикулит, артрозы).
Рентгенотерапия может применяться также при некоторых неспецифических дегенеративно-дистрофических и воспалительных процессах костно-суставного аппарата, сопровождающиеся реактивным воспалением мягких тканей и выраженным болевым синдромом.
Хороший результат получают при рентгенотерапии острых воспалительных процессов, при использовании малых разовых доз порядка 0,1—0,15 Гр и суммарной дозы не превышающей 1 Гр - рекомендуется только в ранних стадиях острых воспалительных заболеваний и в случаях отсутствия других равноценных способов лечения или при неэффективности последних у лиц старше 40 лет. При неопухолевых заболеваниях у детей рентгенотерапию применять не следует.
Рентгенотерапия должна применяться только при наличии научно обоснованных показаний к такому лечению и только у больных с безупречно доказанным заболеванием.
Возможность применения различных режимов фракцирования дозы облучения делает этот метод применимым для лечения даже очень пожилых пациентов.
Возможно применение 1-2 сеансов облучения с интервалом в несколько недель или 5-10 сеансов через день в течение 3 недель, а также иные варианты.
В радиотерапевтическом отделении ГБУЗ ТОКОД с 2 июня 2015 года рентгенотерапия проводится на современной рентгено-терапевтической установке XTRAHL 200 (Великобритания).
Система XTRAHL 200 идеально подходит как для близкофокусной рентгенотерапии поверхностных кожных новообразований, так и для ортовольтной терапии вторичных поражений, в том числе и костных метастазов.
Показания для рентгенотерапии:
- плоскоклеточный или базально-клеточный рак кожи I-II стадии либо 2 этапом после ДГТ
- рак вульвы в составе сочетанно-лучевой терапии
- рак нижней губы I-II стадии либо 2 этапом после ДГТ
- рецидивы рака молочной железы (в рубце, мягких тканях, коже)
- внутрикостные МТС в ребра (единичные очаги)
- неопухолевые заболевания (пяточные шпоры, остеоартрозы коленных суставов, келоидные рубцы, послеоперационная лимфорея)
Противопоказания к рентгенотерапии могут быть абсолютными и относительными.
- общее тяжелое состояние больного
- выраженная кахексия
- наличие сопутствующих заболеваний других органов (сердца, легких, печени, почек) в стадии декомпенсации.
- лейкопения и тромбоцитопения, анемия.
- лучевая болезнь или лучевые повреждения, даже перенесенные в прошлом.
В большинстве случаев рентгенотерапия не вызывает системных последствий. Большая часть побочных эффектов обусловлена реакцией кожи, которая проявляется в виде эпидермита. Сначала во время каждого сеанса возникает отек, покраснение, зуд. По мере продолжения лечения симптомы становятся более выраженными и достигают максимума к третьей неделе терапии и проходят через 1 – 1,5 месяца после ее окончания.
На пораженном участке кожи образуются пузырьки, заполненные экссудатом. Они лопаются, открывая воспаленный эпидермис ярко-красного цвета. Это служит воротами для патогенной флоры, и при несоблюдении рекомендаций врача присутствует развития бактериальной инфекции. Также отмечают появление ранок, покрытых корками.
Чувствительность кожи к излучению зависит от множества факторов.
Это: локализация опухоли, передняя поверхность шеи более восприимчива к радиационному воздействию, чем кожа крыльев носа и других участков лица, затылка; температура воздуха, в жаркую погоду кровоснабжение эпидермиса улучшается, что повышает риск развития последствий лечения, в холода такая вероятность снижается; лишний вес, было доказано, что кожа тучных людей в большей степени восприимчива к действию излучения; трещины, царапины увеличивают проницаемость эпидермиса; возрастные изменения.
Опасным последствием такого лечения служит лучевая язва. Под воздействием радиоактивных изотопов нарушается микроциркуляция в кровеносных сосудах, расположенных под кожей. Риск осложнений возрастает пропорционально глубине проникновения патологического процесса и силе облучения.
О начале язвенных изменений в коже свидетельствуют такие симптомы: сухость и шелушение; исчезновение поверхностного рисунка эпидермиса; появление сосудистых «звездочек»; нарушение пигментации.
Если опухоль расположена возле слизистых оболочек носа или рта, может возникнуть их воспаление – мукозит. Для него характерны сухость эпителия, появление жжения и болезненности при касании. Однако такие последствия встречаются нечасто. При лучевом лечении опухоли в области глаз отмечают рецидивирующий конъюнктивит.
Долгосрочные осложнения лучевой терапии
Со временем кожа, попавшая под воздействие излучения, становится тоньше, под ней заметна сосудистая сетка. Через год – полтора после окончания лечения возможно появление более светлых или, наоборот, темных участков эпидермиса. Выраженность этих признаков зависит от продолжительности лечения, полученной в итоге терапии дозы облучения, площади воздействия. Стоит отметить, что лучевая язва, о которой шла речь выше, может также появиться спустя несколько месяцев после окончания курса лечения.
Самым опасным последствием является высокий риск развития более тяжелой, злокачественной формы рака кожи – плоскоклеточного. По этой причине облучение нежелательно для пациентов моложе 50 лет. Также из-за риска возникновения осложнений подобный метод лечения не применяется при рецидивах базалиомы. После воздействия радиационного излучения на волосистую область отмечают выпадение волос. Со временем они отрастают, но становятся ломкими, тусклыми, их окраска более блеклая.
При лечении опухолей, расположенных на коже лица вблизи глаз, может возникнуть катаракта. Насколько высок риск подобного заболевания неизвестно, так как на сегодняшний день пороговая доза облучения хрусталика не установлена. Из-за рубцевания тканей после разрушения клеток новообразования ограничивается их подвижность, что оказывает влияние на мимику. Также происходят изменения в работе сальных и потовых желез в области воздействия излучения.
Профилактика осложнений
Больного предупреждают, что перед началом курса лечения (также и во время него) следует беречь кожу от повреждений. Кроме того, рекомендуется придерживаться таких правил:
защищаться от прямых солнечных лучей, не посещать солярий, выходить на улицу в одежде с длинным рукавом, лицо закрывать широкополой шляпой, открытые участки кожи мазать специальным кремом;
нельзя растирать кожу, попавшую под облучение, массировать, ставить банки, прикладывать горчичники, обрабатывать антисептиками и спиртовыми растворами (йодом, зеленкой, перекисью) без назначения доктора;
гигиенические процедуры следует проводить с осторожностью, чтобы не смыть нанесенные врачом отметки, определяющие область лучевого воздействия;
запрещено делать компрессы, ставить грелку;
перед применением ароматизированного мыла или геля для душа, пены для ванн, дезодоранта, крема следует в обязательном порядке проконсультироваться с врачом, средства декоративной косметики (если они разрешены) необходимо смывать за 4 часа до сеанса лучевого лечения базалиомы;
для профилактики бактериальной инфекции стоит ограничить посещение таких общественных мест, как бассейны или бани.
Лучевая терапия – это серьезная нагрузка на организм. Поэтому при появлении любых беспокоящих симптомах необходимо обратиться за консультацией к своему лечащему врачу или медсестре. Также лучше согласовывать с ними изменения в питании, климате. Стоит помнить, что опасность последствий лучевого лечения и рентгенотерапии сохраняется всю оставшуюся жизнь.
Читайте также:
