Цитокины в химиотерапии острых нелимфобластных лейкозов - эффективность
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Вам поставили диагноз: острый лейкоз?
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний.
Филиалы и отделения, где лечат острый лейкоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения опухолей
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
тел: 8 (494) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения злокачественных новообразований
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
тел: 8 (484) 399 – 31-30
Предлагаем Вашему вниманию краткий, но очень подробный обзор острого лейкоза
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Острые лейкозы
– обширная гетерогенная группа опухолевых заболеваний системы крови, возникающие в результате мутаций (поломок) в генах, отвечающих за пролиферацию, дифференцировку и созревание нормальных кроветворных клеток. В результате этих событий в костном мозге происходит накопление лейкемических (бластных) клеток, что вызывает «вытеснение» нормального кроветворения опухолевым. В результате нарушается выработка форменных элементов крови и развивается цитопения. При развитии тромбоцитопении часто наблюдаются кровотечения; при снижении числа гранулоцитов – инфекции, эритроцитов - анемия.
Острые лейкозы распространены повсеместно, заболеваемость в разных странах составляет от 2 до 4 случаев на 100 000 населения в год. У взрослых 75-80% всех острых лейкозов составляют ОМЛ, 20-25% приходятся на долю ОЛЛ. Заболеваемость ОМЛ увеличивается с возрастом. Медиана возраста больных ОЛЛ - 14 лет, 60% заболевших моложе 14 лет, 24% - старше 45 лет. Мужчины и женщины заболевают с равной частотой.
Выделяют две большие принципиально различающиеся группы острых лейкозов: острые миелоидные лейкозы (ОМЛ) и острые лимфобластные лейкозы (ОЛЛ).
Диагноз острого лейкоза устанавливается только на основании обнаружения в периферической крови и костном мозге (иногда только в костном мозге) бластных (опухолевых) клеток. Пункцию костного мозга необходимо выполнять во всех случаях, независимо от процентного содержания бластных клеток в крови. При этом обязательными в диагностике является комплексное исследование костномозгового кроветворения: морфоцитохимическое, иммунофенотипическое, цитогенетическое. Такой комплекс диагностических исследований позволяет установить точный диагноз и определить вариант лейкоза. Это имеет принципиальное значение, поскольку различаются не только программы лечения ОЛЛ и ОМЛ, но и есть существенные, а иногда принципиальные отличия в терапии разных подвариантов как ОЛЛ, так и ОМЛ.
Острые лейкозы – являются потенциально излечимым заболеванием. Современная терапия позволяет получить полные ремиссии у 65-75% больных ОМЛ и у 75-90% больных ОЛЛ, но лишь в том случае, если лечение начато непосредственно после установления диагноза и проводится по программе, которая в настоящее время признается оптимальной для данного варианта лейкоза. При правильном лечении в среднем от 25 до 45% взрослых больных, у которых достигнуты полные ремиссии, остаются в этом статусе 5 лет и более, что для большинства случаев может расцениваться как выздоровление. Кроме того, острые лейкозы остаются основным показанием для выполнения аллогенной трансплантации гемопоэтических стволовых клеток, являющейся в большинстве случаев самым эффективным методом их лечения.
Основным методом лечения острых лейкозов является химиотерапия. При этом при ОМЛ используются короткие импульсные интенсифицированные 5-7 дневные курсы химиотерапии; при ОЛЛ - основной принцип лечения заключаются в его непрерывности, длительности программной терапии не менее 2-3 лет, а также многокомпонентности терапии, на каждом этапе которой используются и чередуются несколько противоопухолевых препаратов с различным механизмом действия. Лечение ОЛ после достижения полной ремиссии (консолидирующая терапия) носит риск-адаптированный характер (т.е. интенсивность лечения зависит от прогноза заболевания). В основе разделения больных на группы прогноза лежит ряд признаков: цитогенетические и молекулярно-генетические особенности опухолевых клеток, ответ на начальную противоопухолевую терапию и т.д. Определение группы риска определяет лечебную тактику, особенно - необходимость планирования и выполнения аллогенной трансплантации гемопоэтических стволовых клеток.
Филиалы и отделения Центра, в которых лечат острые лейкозы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
ЦИТОКИНЫ ПРИ ОСТРЫХ МИЕЛОИДНЫХ ЛЕЙКОЗАХ
Цитокины являются неотъемлемой частью нормального кроветворения и оказывают влияние практически на все его этапы, вызывая и регулируя процессы клеточной пролиферации, дифференцировки и апоптоза. Благодаря исследованиям последних лет удалось показать, что цитокины являются также медиаторами сложных взаимоотношений между кроветворной, иммунной системами и растущей опухолью. С одной стороны, цитокины принимают участие в активации противоопухолевого иммунитета, направленного на элиминацию злокачественных клеток, с другой стороны, синтезируются опухолевыми клетками и участвуют в прогрессии и метастазировании опухолей. В статье обобщены данные современной литературы, касающиеся особенностей изменения цитокинового профиля у больных острыми миелоидными лейкозами (ОМЛ). Показана роль цитокинов в лейкемогенезе: в активации путей передачи сигнала, взаимодействии с костномозговым микроокружением, осуществлении противоопухолевого иммунитета и поддержании персистирования клона бластных клеток. Освещена связь отдельных цитокинов с результатами лечения и прогнозом заболевания, в том числе в зависимости от наличия в генотипе пациента различных аллельных вариантов генов цитокинов, кодирующих высокую или низкую продукцию данных факторов. Приведенные в обзоре данные об участии цитокинов в становлении, развитии и элиминации опухолевых клеток при гемобластозах подчас противоречивы, однако эти противоречия может объяснить концепция иммуноредактирования опухолей, согласно которой клетки иммунной системы в процессе канцерогенеза могут трансформироваться опухолью и начать активно содействовать ее росту. В статье использовано 69 источников литературы, в том числе 9 отечественных и 60 зарубежных, представленных в следующих информационных системах: PubMed, Scopus, Web of Science, РИНЦ.
Ключевые слова
Об авторах
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства»
Россия
Глазанова Татьяна Валентиновна, д. м. н., гл. н. с. лаборатории иммуногематологии,
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства»
Россия
Розанова Ольга Егоровна, д. б. н., в. н. с. лаборатории иммуногематологии
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства»
Россия
Павлова Ирина Евгеньевна, д. м. н., в. н. с. лаборатории иммуногематологии
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства»
Россия
Бубнова Людмила Николаевна, д. м. н., проф., руководитель лаборатории иммуногематологии
Список литературы
1. Кадагидзе ЗГ. Цитокины. Практическая онкология. 2003;4:131—9.
2. Кетлинский СА, Симбирцев АС. Цитокины. Фолиант. СПб; 2008.
3. Чечина ОЕ, Биктасова АК, Сазонова ЕВ, Жукова ОБ, Прохоренко ТС, Крат ИВ и др. Роль цитокинов в редокс-зависимой регуляции апоптоза. Бюллетень сибирской медицины. 2009;8:67—72.
4. Лысенко ОВ, Занько СН. Цитокины и sFAS-лиганд при гиперпластических процессах и полипах эндометрия. Проблемы репродукции. 2010;5:31—5.
5. Симбирцев АС. Цитокины: классификация и биологические функции. Цитокины и воспаление. 2004;3:16—22.
6. Фрейдлин ИС, Тотолян АА. Клетки иммунной системы III—IV. Наука. СПб.; 2001.
7. Примак СВ, Матлан ВЛ, Барилка ВА, Шалай ОА, Логинский ВЕ. Фактор некроза опухолей при остром лейкозе. Онкология. 2015;17:17—21.
8. Азнабаева ЛФ, Плотникова СВ, Сафуанова ГШ. Предикторы системного воспаления у больных острым лейкозом. Российский иммунологический журнал. 2014;8:499—502.
9. Лубкова ОН, Цветаева НВ, Момотюк КС, Белкин ВМ, Манакова ТЕ. Экспрессия VCAM-1 на стромальных клетках из костного мозга больных миелодиспластическими синдромами. Бюл. эксп. биол. мед. 2011;151:17—20.
10. Остальные источники см. в References.
12. Carswell E, Old L, Kassel R. An endotoxin-induced serum factor that causes necrosis of tumors. Proc Nat Acad Sci USA. 1975;72:3666—70.
14. Kadagidze ZG. Cytokines. Prakticheskaja Оnkologija. 2003;4:131—9 (in Russian).
15. Ketlinskiy SA, Simbirtsev AS. Cytokines. Foliant. St.Petersburg; 2008 (in Russian).
16. Chechina OYe, Biktasova AK, Sazonova YeV, Zhukova OB, Prokhorenko TS, Krat IV et al. The role of cytokines in redox-dependent regulation of apoptosis. Bjulleten’ Sibirskoj Meditsiny. 2009;8:67—72 (in Russian).
17. Neuhoff S, Moers J, Rieks M, Grunwald T, Jensen A, Dermietzel R et al. Proliferation, differentiation and cytokine secretion of human umbilical cord blood-derived mononuclear cells in vitro. Exp Hematol. 2007;35:1119—31.
18. Lysenko OV, Zan’ko SN. Cytokines and sFas-ligand in endometrial hyperplasia and endometrial polyps. Problemy Reproduktsii. 2010;5:31—5 (in Russian).
19. Simbirtsev AS. Cytokines — classification and biologic functions. Citokiny i Vospalenie. 2004;3:16—22 (in Russian).
20. Hebenstreit D, Horejs-Hoeck J, Duschl A. JAK/STAT-dependent gene regulations by cytokines. Drug News Perspect. 2005;18:243—9. DOI:10.1358/dnp.2005.18.4.908658
21. Freydlin IS, Totolyan AA. Cells of the immune system III—IV. Nauka. St. Petersburg; 2001 (in Russian).
22. Kupsa T, Horacek J, Jebavy L. The role of cytokines in acute myeloid leukemia: a systematic review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2012;156:291—301.
23. Zeh H, Winikoff S, Landsittel D, Gorelik E, Marrangoni A, Velikokhatnaya L. Multianalyte profiling of serum cytokines for detection of pancreatic cancer. Cancer Biomark. 2005;1:259—69.
24. Kornblau S, Tibes R, Qiu Y, Chen W, Kantarjian H, Andreeff M et al. Functional proteomic profiling of AML predicts response and survival. Blood. 2009;113:154—64.
25. Brenner A, Tvedt T, Nepstad I, Rye K, Hagen K, Reikvam H et al. Patients with acute myeloid leukemia can be subclassified based on the constitutive cytokine release of the leukemic cells; the possible clinical relevance and the importance of cellular iron metabolism. Exp Opin Ther Targets. 2017;21:357—69.
26. Van Etten R, Baker S, Rane S, Reddy E. Aberrant cytokine signaling in leukemia. Oncogene. 2007;26:6738—49.
27. Birkenkamp K, Esselink M, Kruijer W, Vellenga E. Differential effects of interleukin-3 and interleukin-1 on the proliferation and interleukin-6 protein secretion of acute myeloid leukemic cells; the involvement of ERK, p38 and STAT5. Eur Cytokine Netw. 1999;10:479—90.
28. Carey A, Edwards D, Eide C, Newell L, Traer E, Medeiros B et al. Identification of interleukin-1 by functional screening as a key mediator of cellular expansion and disease progression in acute myeloid leukemia. Cell Reports. 2017;18:3204—18. doi:10.1016/j.celrep.2017.03.018
29. Meyers C, Albitar M, Estey E. Cognitive impairment, fatigue, and cytokine levels in patients with acute myelogenous leukemia or myelodysplastic syndrome. Cancer. 2005;104:788—93.
30. Kupsa T, Vasatova M, Karesova I, Zak P, Horacek JM. Baseline serum levels of multiple cytokines and adhesion molecules in patients with acute myeloid leukemia: results of a pivotal trial. Exp Oncol. 2014;36:252—7.
31. Hsu H, Lee Y, Tsai W, Jiang M, Ho CH, Ho CK et al. Circulating levels of thrombopoietic and inflammatory cytokines in patients with acute myeloblastic leukemia and myelodysplastic syndrome. Oncology. 2002;63:64—9.
32. Primak SV, Matlan VL, Barilka VA, Shalay OA, Loginskiy VE. The tumor necrosis factor in acute leukemia. Oncology (Onkologija). 2015;17:17—21 (in Russian).
33. Panteli K, Hatzimichael E, Bouranta P, Katsaraki A, Seferiadis K, Stebbing J et al. Serum interleukin (IL)-1, IL-2, sIL-2Ra, IL-6 and thrombopoietin levels in patients with chronic myeloproliferative diseases. Br J Haematol. 2005;130:709—15.
34. Aguayo A, Kantarjian H, Estey E, Giles F, Verstovsek S, Manshouri T et al. Plasma vascular endothelial growth factor levels have prognostic significance in patients with acute myeloid leukemia but not in patients with myelodysplastic syndromes. Cancer. 2002;95:1923—30.
35. Kornblau S, McCue D, Singh N, Chen W, Estrov Z, Coombes K. Recurrent expression signatures of cytokines and chemokines are present and are independently prognostic in acute myelogenous leukemia and myelodysplasia. Blood. 2010;116:4251—61. doi: 10.1182/ blood-2010-01-262071
36. Aznabaeva LF, Plotnikova SV, Safuanova GS. Predictors of systemic inflammation in patients with acute leukemia. Russian Journal of Immunology (Rossijskij Immunologicheskij Zhurnal). 2014;17:499—502 (in Russian).
37. Bettelli E, Korn T, Oukka M, Kuchroo VK. Induction and effector functions of Th17 cells. Nature. 2008;453:1051—7.
38. Abousamra N, Salah El-Din M, Helal R. Prognostic value of Th17 cells in acute leukemia. Med Oncol. 2013;30:732. doi: 10.1007/s12032-013- 0732-3
39. Zhu B, Zhang J, Wang X, Chen J, Li C. Correlation between acute myeloid leukemia and IL-17A, IL-17F, and IL-23R gene polymorphism. Int J Clin Exp Pathol. 2015;8:5739—43.
40. Wu C, Wang S, Wang F, Chen Q, Peng S, Zhang Y. Increased frequencies of T helper type 17 cells in the peripheral blood of patients with acute myeloid leukaemia. Clin Exp Immunol. 2009;158:199—204.
41. Tian T, Yu S, Wang M, Yuan C, Zhang H, Ji C et al. Aberrant T helper 17 cells and related cytokines in bone marrow microenvironment of patients with acute myeloid leukemia. Clin Dev Immunol. 2013;2013:915873.
42. Ersvaer E, Liseth K, Skavland J, Gjertsen BT, Bruserud О. Intensive chemotherapy for acute myeloid leukemia differentially affects circulating TC1, TH1, TH17, and Treg cells. BMC Immunol. 2010;11:38. doi:10.1186/1471-2172-11-38
43. Fukada T, Ohtani T, Yoshida Y, Shirogane T, Nishida K, Nakajima K et al. STAT3 orchestrates contradictory signals in cytokine induced G1 to S cell-cycle transition. EMBO J. 1998;17:6670—7.
44. Chaudhari S, Desai J, Adam A, Mishra P. Jak/Stat as a novel target for treatment of leukemia. Int J Pharm Pharm Sci. 2014;6:1—7.
45. Tsapogas P, Mooney C, Brown G, Rolink A. The cytokine Flt3-ligand in normal and malignant hematopoiesis. Int J Mol Sci. 2017;18:1115. doi:10.3390/ijms18061115
46. Estrov Z, Black R, Sleath P, Harris D, Van Q, LaPushin R et al. Effect of interleukin-1 beta converting enzyme inhibitor on acute myelogenous leukemia progenitor proliferation. Blood. 1995;86:4594—602.
48. Malek T. The biology of interleukin-2. Annu Rev Immunol. 2008;26:453— 79. doi:10.1146/annurev.immunol.26.021607.090357
49. Derolf A, Laane E, Bjorklund E, Saft L, Bjorkholm M. Dendritic cells in bone marrow at diagnosis and after chemotherapy in adult patients with acute myeloid leukemia. Scand J Immunol. 2014;80:424—31. doi/10.1111/ sji.12223/pdf
50. Nakase K, Kita K, Kyo T, Tsuji K, Katayama N. High serum levels of soluble interleukin-2 receptor in acute myeloid leukemia: correlation with poor prognosis and CD4 expression on blast cells. Cancer Epidemiol. 2012;36:e306—9. doi: 10.1016/j.canep.2012.03.011
51. Yang Z-Z, Grote D, Ziesmer S, Manske M, Witzig T. Soluble IL-2Rα facilitates IL-2-mediated immune responses and predicts reduced survival in follicular B-cell non-Hodgkin lymphoma. Blood. 2011;118:2809—20. doi: 10.1182/blood-2011-03-340885
52. Bruserud O, Foss B, Petersen H. Hematopoietic growth factors in patients receiving intensive chemotherapy for malignant disorders: Studies of granulocyte-colony stimulating factor (G-CSF), granulocyte-macrophage colony stimulating factor (GM-CSF), interleukin-3 (IL-3) and Flt-3 ligand (Flt3L). Eur Cytokine Netw. 2001;12:231—8.
53. Tajima N, Fukui K, Uesato N. JTE-607, a multiple cytokine production inhibitor, induces apoptosis accompanied by an increase in p21waf1/cip1 in acute myelogenous leukemia cells. Cancer Sci. 2010;101:774—81.
54. Tsimberidou A, Estey E, Wen S, Pierce S, Kantarjian H, Albitar M et al. The prognostic significance of cytokine levels in newly diagnosed acute myeloid leukemia and high-risk myelodysplastic syndromes. Cancer. 2008;113:1605—13.
55. Konopleva M, Jordan C. Leukemia stem cells and microenvironment: biology and therapeutic targeting. Clin Oncol. 2011;29:591—9.
56. Kupsa T, Vanek J, Zak P, Jebavy L, Horacek J. Serum levels of soluble adhesion molecules in newly diagnosed acute myeloid leukemia and in complete remission suggest endothelial cell activation by myeloblasts. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2017;161:92— 9. doi: 10.5507/bp.2016.054
57. Lubkova ON, Tzvetaeva NV, Momotyuk KS, Belkin VM, Manakova TE. VCAM-1 expression on bone marrow stromal cells from patients with myelodysplastic syndromes. Bull Exp Biol Med. 2011;151:17—20 (in Russian).
58. Lopes MR, Pereira JK, de Melo Campos P, Machado-Neto JA, Traina F, Saad ST et al. De novo AML exhibits greater microenvironment dysregulation compared to AML with myelodysplasia-related changes. Sci Rep. 2017;7:40707. doi:10.1038/srep40707
59. Skaik Y, Vahlsing S, Goudeva L, Eiz-Vesper B, Battermann A, Blasczyk R et al. Secreted beta3-integrin enhances natural killer cell activity against acute myeloid leukemia cells. PLoS ONE. 2014;9:e98936.
60. Johansen S, Brenner A, Bartaula-Brevik S, Reikvam H, Bruserud О. The possible importance of β3 integrins for leukemogenesis and chemoresistance in acute myeloid leukemia. Int J Mol Sci. 2018;19:251. doi:10.3390/ ijms19010251
62. Reikvam H, Fredly H, Kittang A, Bruserud O. The possible diagnostic and prognostic use of systemic chemokine profiles in clinical medicine — the experience in acute myeloid leukemia from disease development and diagnosis via conventional chemotherapy to allogeneic stem cell transplantation. Toxins (Basel). 2013;5:336—62. doi:10.3390/toxins5020336
63. Bruserud O, Ryningen A, Olsnes AM. Subclassification of patients with acute myelogenous leukemia based on chemokine responsiveness and constitutive chemokine release by their leukemic cells. Haematologica. 2007;92:332—41.
64. Fredly H, Reikvam H, Gjertsen B, Bruserud O. Disease-stabilizing treatment with all-trans retinoic acid and valproic acid in acute myeloid leukemia: Serum hsp70 and hsp90 levels and serum cytokine profiles are determined by the disease, patient age, and anti-leukemic treatment. Am J Hematol. 2012;87:368—76. doi: 10.1002/ajh.23116
65. Clarke C, Smyth M. Calreticulin exposure increases cancer immunogenicity. Nat Biotechnol. 2007;25:192—3. doi:10.1038/ nbt0207-192
66. Tilton B, Ho L, Oberlin E, Loetscher P, Baleux F, Clark-Lewis I et al. Signal transduction by CXC chemokine receptor 4. Stromal cell derived factor 1 stimulates prolonged protein kinase B and extracellular signal-regulated kinase 2 activation in T lymphocytes. J Exp Med. 2000;192:313—24.
67. Konoplev S, Rassidakis G, Estey E, Kantarijan H, Liakou C, Juany X et al. Overexpression of CXCR4 predicts adverse overall and event-free survival in patients with unmutated FLT3 acute myeloid leukemia with normal karyotype. Cancer. 2007;109:1152—6.
68. Rombouts E, Pavic B, Lowenberg B, Ploemacher R. Relation between CXCR-4 expression, Flt3 mutations, and unfavorable prognosis of adult acute myeloid leukemia. Blood. 2004;104:550—7.
69. Niedermeier M, Hennessy B, Knight Z, Henneberg M, Hu J, Kurtova A et al. Isoform-selective phosphoinositide 3´-kinase inhibitors inhibit CXCR4 signaling and overcome stromal cell-mediated drug resistance in chronic lymphocytic leukemia: a novel therapeutic approach. Blood. 2009;113:5549—57.
70. Zheng Q, Shuai X, Ye Y, Jin Y, Jiang N, Chen X et al. The role of polymorphisms of stromal-derived factor-1 and CXC receptor 4 in acute myeloid leukemia and leukemia cell dissemination. Gene. 2016;588:103—8.
71. El-Ghany H, El-Saadany Z, Bahaa N, Ibrahim N, Hussien S. Stromal cell derived factor-1 (CXCL12) chemokine gene variant in myeloid leukemias. Clin Lab. 2014;60:735—41.
72. Wang H, Hua M, Wang S, Yu J, Chen C, Zhao X et al. Genetic polymorphisms of IL-18 rs1946518 and IL-1β rs16944 are associated with prognosis and survival of acute myeloid leukemia. Inflamm Res. 2017;66:249—58.
73. Sung L, Dix D, Cellot S, Gillmeister B, Ethier MC, Roslin NM et al. Single nucleotide polymorphism in IL-1B is associated with infection risk in paediatric acute myeloid leukaemia. Clin Microbiol Infect. 2016;22:563. e9—17.
74. Fei C, Yao XM, Sun Y, Gu XZ, Yu LQ, Lai X. Interleukin-10 polymorphisms associated with susceptibility to acute myeloid leukemia. Genet Mol Res. 2015;14:925—30.
75. Kazamatsu T, Saitoh T, Minato Yu, Shimizu H, Yokohama A, Tsukamoto N et al. Polymorphisms of IL-10 affect the severity and prognosis of myelodysplastic syndrome. Eur J Hematol. 2016;96:245—51.
76. Kim M, Kim J, Kim JR, Han E, Park J, Lim J et al. FLT3 expression and IL-10 promoter polymorphism in acute myeloid leukemia with RUNX1-RUNX1T1. Mol Biol Rep. 2015;42:451—6.
77. Wrobel T, Gebura K, Wysoczanska B, Jazwiec B, Dobrzynska O, Mazur G et al. IL-17F gene polymorphism is associated with susceptibility to acute myeloid leukemia. J Cancer Res Clin Oncol. 2014;140:1551—5. doi:10.1007/s00432-014-1674-7
78. Dunn G, Ikeda H, Bruce A, Koebel C, Uppaluri R, Bui J et al. Interferon gamma and cancer immunoediting. Immunol Res. 2005;32:231—45.
80. Biswas SK, Mantovani A. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm. Nature Immunol. 2010;11:889— 96. doi:10.1038/ni.1937
Цитокины в химиотерапии острых нелимфобластных лейкозов - эффективность
Высокая результативность
Одним из приоритетных промотируемых препаратов онкологическогопортфеля российской компании-дистрибьютора ЗАО «Фирма ЕВРОСЕРВИС» является препарат «Неостим» (МНН:Молграмостим)
Эффективность химиотерапии в большой степени зависит от интенсивности ее проведения. Однако интенсивность, наряду с прочими факторами, зачастую ограничена миелотоксичностью или повреждением костного мозга. Традиционным подходом для борьбы с миелотоксичностью химиотерапии является применение миелоцитокинов – полипептидов, ускоряющих пролиферацию и дифференцировку предшественников гемопоэза после их лекарственного повреждения, что позволяет сократить период нейтропении. Наибольшее распространение в практике получили миелоидные колониестимулирующие факторы (Г-КСФ и ГМ-КСФ). Причем в отличие от Г-КСФ ГМ-КСФ обладает выраженным поливалентным стимулирующим действием на различные ростки кроветворения.
К основным показаниям для применения ГМ-КСФ в гематологической и онкологической клинике следует отнести следующие:
· Первичная профилактика нейтропении и связанной с ней инфекции.
Исследования ГМ-КСФ по первичной профилактике показали его высокую эффективность в снижении числа эпизодов нейтропенической лихорадки. Большой интерес представляют результаты рандомизированного исследования по применению ГМ-КСФ при проведении жесткой индукционной химиотерапии и в последующем периоде цитопении у 118 пожилых больных с острым нелимфобластным лейкозом. В этом исследовании было выявлено значительное сокращение общей смертности и смертности от инфекции в группе цитокина.
· Вторичная профилактика нейтропении и инфекции. В случае когда уже первый цитостатический курс лечения сопровождался нейтропенией и повышением температуры, вероятность инфекционных осложнений при последующем лечении очень велика. В таких случаях показано назначение ГМ-КСФ после второго и последующих курсов химиотерапии.
Также целесообразно назначение миелоцитокинов пациентам с миелодиспластическим синдромом, имевшим в анамнезе нейтропенические инфекционные осложнения. В контролируемом исследовании, где ГМ-КСФ назначался после второго курса химиотерапии у пациентов, имевших фебрильную нейтропению после первого курса, отмечено 3–5-кратное снижение частоты этого осложнения.
Применение ГМ-КСФ при развившейся нейтропении и нейтропенической инфекции
Нейтрофилы играют важную роль в защите организма от инфекции. Учитывая способность миелоцитокинов увеличивать количество нейтрофилов и макрофагов, а также усиливать их противоинфекционные свойства (хемотаксис и фагоцитоз), ГМ-КСФ целесообразно использовать при уже развившейся нейтропении и инфекции совместно с антибиотиками. Проведенные контролируемые исследования по применению миелоцитокинов у больных с уже развившейся нейтропенией и инфекцией показали, что при глубоком падении нейтрофилов (менее 100 клеток) применение ГМ-КСФ вместе с антибиотиками показало значительно лучший эффект антибиотикотерапии в группе цитокина при лечении тканевой верифицированной инфекции (100% эффективности против 59% в группе плацебо). Потребность в проведении противогрибковой терапии снижалась с 11 до 6% (5). Последний факт достаточно важен, если принять во внимание токсичность некоторых противогрибковых препаратов.
Получение клеток-предшественников гемопоэза для трансплантации
Во многих случаях клетки – предшественники гемопоэза необходимо вывести из-под токсического воздействия химиопрепаратов путем их выделения и заморозки на время химиотерапии либо заместить их донорскими (трансплантация). Таким образом, они не подвергаются воздействию цитостатиков и способны полностью восстанавливать нормальное кроветворение в течение 2–4 недель после реинфузии. Данная методика позволяет увеличить разовые дозы для некоторых химиопрепаратов в 2–10 раз.
ГМ-КСФ способен увеличивать миграцию клеток – предшественников гемопоэза из костного мозга в периферическую кровь. При помощи ГМ-КСФ можно получить кроветворные клетки из периферической крови в значительно большем количестве, чем из костного мозга, что приводит к более быстрому восстановлению гемопоэза после сверхвысокодозной химиотерапии.
Повышение эффективности индукционной химиотерапии острых нелимфобластных лейкозов
Многие химиопрепараты действуют циклоспецифически, другими словами, их разрушающий эффект значительно более выражен в клетках, находящихся в активной фазе деления. Как уже было сказано, ГМ-КСФ способен переводить нормальные клетки гемопоэтической системы в активную фазу пролиферации. Этот же эффект он вызывает в опухолевых клетках, относящихся к системе гемопоэза, например в лейкемических бластах. Данное свойство цитокинов легло в основу их включения в схемы цитостатической терапии острых нелимфобластных лейкозов.
Таким образом, проведенный анализ эффективности клинического применения ГМ-КСФ показывает, что при первичной профилактике нейтропений, развившейся нейтропении и нейтропенической инфекции, а также для получения клеток для последующей трансплантации применение ГМ-КСФ наиболее эффективно. Также применение ГМ-КСФ позволяет достичь более высоких результатов в процессе индукционной терапии острых нелимфобластных лейкозов.
Цитокины в химиотерапии острых нелимфобластных лейкозов - эффективность
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Аллергология и иммунология, клинические рекомендации для педиатров / Под ред. А.А. Баранова и Р.М. Хаитова. – М.: М-Студио, 2008. – 248 с.
2. Гематология / Рукавицын О.А., Павлов А.Д., Морщакова Е.Ф. и др. Под ред. О.А. Рукавицына. – Изд-во СПб.: ООО «Д.П.», 2007. – 912 с.
3. Гематологический атлас. С.А. Луговская, М.Е. Почтарь. 3–е издание. – Москва – Тверь. ООО «Изд–во Триада», 2011. – 368 с.
4. Жаворонок Т.В. Участие системы глютатиона в поддержании функционального состояния нейтрофилов при остром воспалении // Бюллетень сибир. медицины. – 2010. – № 5. – С. 28–32.
5. Зайчик АШ. Механизмы развития болезней и синдромов // А.Ш. Зайчик, Л.П. Чурилов. – СПб.: ЭЛБИ, 2002. – Т. 3. – 507 с.
7. Коротина О.Л., Генералов И.И. Нейтрофильные внеклеточные ловушки: механизмы образования, функции // Иммунология, аллергология, инфектология. – 2012. – № 4. – С. 23–32.
10. Патофизиология: учебник / под ред. В.В. Новицкого, Е.Д. Гольдберга, О.И. Уразовой. – 4-е изд. – М.: ГЭОТАР – Медиа, 2010. – 848 с.
12. Тотолян А.А. Клетки иммунной системы / А.А. Тотолян, И.С. Фрейдлин. – СПб.: Наука, 2000. – 231 с.
14. Abbas A.K. Diseases of immunity / Robbins and Cotran pathologic basis of disease. – 7th ed. / Editet by V. Kumar, A.K. Abbas, N. Fausto. – Philadelphia, Pennsylvania. – Elserier, 2005. – P. 193–267.
15. Behkendt J.H., Ruiz A., Zahner H., Taubert A., Hermosilla C. Neutrophil extracellular trap formation as innate immune reactions against the apicomplexan parasite Eimeria bovis // Veterinary Immunology and Immunopathology. – 2010. – V. 133 (1). – Р. 1–8.
Различают острые и хронические лейкозы, в основе которых лежат мутации недифференцированных клеток-предшественниц. Однако характер мутации различен при указанных формах патологии. При острых лейкозах мутации незрелых гемопоэтических клеток обуславливают блокаду процессов дифференцировки, что приводит к быстрой замене нормальных элементов костного мозга незрелыми бластами.
При хронических лейкозах дифференцировка гемопоэтических клеток до зрелых элементов сохранена, но значительно затруднена.
К группе острых лейкозов относят острый миелобластный лейкоз (ОМЛ) и острый лимфобластный лейкоз (ОЛЛ). При острых лейкозах бластные клетки быстро вытеснят нормальные элементы костного мозга, что ведет к развитию панцитопении: эритропении, тромбоцитопении, нейтропении.
Острый миелобластный лейкоз включает группу болезней, характеризующуюся пролиферацией злокачественных клеток миелоидного ряда – потомков общей миелоидной стволовой клетки: миелобластов, промиелоцитов, монобластов, эритробластов, мегакариобластов.
В настоящее время используют франко-американско-британскую (FAB) классификацию ОМЛ. Последняя включает следующие варианты заболевания:
М0: Острый недифференцированный лейкоз
М1: Острый миелобластный лейкоз без дифференцировки
М2: Острый миелолейкоз с формированием ряда гранул в цитоплазме
М3: Острый промиелобластный лейкоз (промиелоцитарный)
М4: Острый миеломоноцитарный лейкоз (миеломонобластный)
М5: Острый моноцитарный лейкоз (монобластный)
М7: Мегакариобластный лейкоз
Нет четких представлений относительно этиологии и патогенеза ОМЛ. Однако достоверным лейкозогенным фактором является ионизирующая радиация. Среди факторов риска развития ОМЛ выделяют воздействие ряда химиотерпевтических агентов, таких как алкилирующие вещества, ингибиторы моноизомеразы 11, а также наличие в анамнезе истинной полицитемии, миелоидной метаплазии, пароксизмальной ночной гемоглобинурии, миелодисплазии.
Развитие ОМЛ ассоциировано с определенными хромосомными аномалиями. Так, при остром промиелоцитарном лейкозе (М3) всегда обнаруживают транслокацию – t(15:17). Делеция длинного плеча хромосом 5 и 7 – маркеры неблагоприятного прогноза для М3.
При М0, М1, М2 хромосомные мутации также носят характер транслокации (t 8:21), при М4 и М5 лейкозах отмечена inv 16. Хромосомные мутации при ОМЛ обусловливают и изменение иммунофенотипа. Так, при ОМЛ М1, М2, М3, М4, М5, М6, М7 отмечена экспрессия CD13, CD33.
При ОМЛ-М0 дополнительно экспрессируются CD34; при М4, М5 экспрессируются CD11b, CD14
Острый лимфобластный лейкоз (ОЛЛ) может быть пре-B и T-клеточного типов.
Примерно у 70 % пациентов с ОЛЛ выявляют лимфобласты пре-B-клеточного типа, которые экспрессируют ранний B-клеточный антиген (CD19) и имеют мутации генов иммуноглобулинов.
У 30 % пациентов с ОЛЛ онкогенной трансформации подвергаются T-лимфобласты, у которых обнаруживаются ранние антигены Т-клеток (CD5, CD8) и аномальные гены Т-клеточного рецептора.
В соответствии с ФАБ-классификацией (1976) выделяют три морфологических варианта ОЛЛ:
L1-вариант – ОЛЛ с микроформами бластов (пре В-клеточный тип)
L2-вариант – ОЛЛ с гетерогенными бластами (Т-клеточный тип)
L3-вариант – ОЛЛ с беркитоподобными бластами (В-клеточный тип)
С ОЛЛ ассоциирована хромосомная аномалия (t 9:22), известная как филадельфийская хромосома, свойственная для хронического миелолейкоза. Для филадельфийской хромосомы характерна транслокация гена abl из хромосомы 9 в точку разрыва (bcr) хромосомы 22. В результате комбинации bcr-abl синтезируются аномальная протеинкиназа p210 или p190. Причем, тип p210 характерен для хронического миелолейкоза, а тип p190 отмечен при ОЛЛ. Такие аномалии бластов имеет место у 5 % детей больных ОЛЛ, и у 30 % взрослых с аналогичной патологией. Наличие подобной хромосомной мутации при ОЛЛ свидетельствует о неблагоприятном прогнозе заболевания.
Основные проявления ОЛЛ, как и ОМЛ, это развитие панцитопении: эритропении, тромбоцитопении, нейтропении.
Отмечены лейкемические, алейкемические и лейкопенические формы лейкоза. Неспецифические симптомы: бледность, усталость, тахикардия, тахипное, вторичные по отношению к анемии.
У детей с ОЛЛ, чьи бластные клетки не содержат филадельфийской хромосомы, при проведении адекватной комплексной терапии полная ремиссия достигается в 90–95 %
Для взрослых людей больных ОЛЛ терапия, проводимая у детей, не эффективна требуется значительно более интенсивное лечение. При этом только у 35–50 % пациентов отмечено излечение. Взрослые больные с Т-клеточным ОЛЛ имеют несколько лучший прогноз, чем при В-клеточном ОЛЛ.
В зависимости от количества лейкоцитов в периферической крови различают следующие формы лейкозов:
● лейкемические – количество лейкоцитов больше 50 000 в 1 мкл крови;
● сублейкемические – количество лейкоцитов от 10 до 50 000 в 1 мкл;
● алейкемические – количество лейкоцитов в 1 мкл соответствует норме;
● лейкопенические – количество лейкоцитов менее 5 000 в 1 мкл.
Под алейкемическим понимают такую форму лейкоза, которая характеризуется низким или нормальным содержанием лейкоцитов в периферической крови и отсутствием сдвига в лейкограмме до незрелых патологических клеток, в то время как в костном мозге имеются клеточные изменения, типичные для лейкоза.
В течении острых лейкозов выделяют следующие стадии:
1. Начальная стадия, характеризующаяся значительным полиморфизмом клинических симптомов. Со стороны красной крови существенных изменений не отмечается, реже встречается анемия. Со стороны белой крови могут наблюдаться лейкопения или лейкоцитоз; небольшой процент незрелых форм в лейкограмме, а в некоторых случаях – тенденция к снижению числа тромбоцитов.
Более важное диагностическое значение на ранних этапах развития лейкоза имеет исследование костномозгового пунктата, так как в нем обнаруживается повышенное содержание бластных клеток.
2. Период полного развития лейкоза характеризуется угнетением нормального кроветворения, высоким бластозом костного мозга и появлением в периферической крови незрелых патологических форм.
3. После острого периода болезни может наступить полная или неполная ремиссия. Полная ремиссия на протяжении 5 лет и более расценивается как выздоровление. В большинстве случаев острого лейкоза после ремиссии следует рецидив заболевания. Каждый последующий рецидив прогностически более тяжел, чем предыдущий, и требует новой комбинации цитостатических средств.
4. Терминальный период острого лейкоза характеризуется полным угнетением нормальных ростков кроветворения: нарастает гранулоцитопения, анемия, тромбоцитопения. На первый план выступают симптомы, связанные с глубокими, необратимыми изменениями в жизненно важных органах, с утратой иммунологических свойств организма. Применение различных комбинаций цитостатиков на терминальной стадии болезни малоэффективно.
Опухолевый клон вытесняет нормальные клетки кроветворения, что приводит к анемии, тромбоцитопении, гранулоцитопении. Это проявляется рядом синдромов, которые ,как правило, сочетаются, но возможны и моносиндромные манифестации заболевания. Для острых лейкозов характерны следующие синдромы:
1. Анемический синдром связан с угнетением эритроцитарного ростка или геморрагиями, проявляется общей слабостью, тахикардией, одышкой.
2. Геморрагический синдром, или ДВС-синдром, обусловленные тромбоцитопенией. Последние проявляются кровотечениями по гематомному или петехиальному типу в кожу, слизистые оболочки, а также носовыми кровотечениями, желудочно-кишечными и легочными кровотечениями и кровоизлияниями в головной мозг.
3 Синдром инфекционных осложнений проявляется в виде пневмоний, тонзиллитов, стоматитов, пиелонефритов, обусловленных развитием иммунодефицитного состояния.
4. Синдром опухолевой интоксикации, проявляющийся развитием лейкоцитоза, лихорадки, цитолиза.
5. Лейкемическая инфильтрация внутренних органов и тканей приводит к нарушению их структур и функции.
6. Гиперлейкоцитоз (> 100–300×109/л) приводит к лейкостазу, нарушению микроциркуляции в ЦНС, в органах зрения.
Основные проявления ОЛЛ, как и ОМЛ, развитие панцитопении: эритропении, тромбоцитопении, нейтропении. Отмечены лейкемические, алейкемические и лейкопенические формы лейкоза. Неспецифические симптомы: бледность, усталость, тахикардия, тахипноэ, вторичные по отношению к анемии.
У детей с ОЛЛ, чьи бластные клетки не содержат филадельфийской хромосомы, при проведении адекватной комплексной терапии полная ремиссия достигается в 90-95 % случаев.
Для взрослых людей больных ОЛЛ терапия проводимая у детей не эффективна требуется значительно более интенсивное лечение. При этом только у 35–50 % пациентов отмечено излечение. Взрослые больные с Т-клеточным ОЛЛ имеют несколько лучший прогноз, чем при В-клеточном ОЛЛ.
Особенности развития и течения лейкозов у детей
Лейкозы у детей составляют значительную часть злокачественных новообразований. Наиболее часто в детском возрасте встречаются острые лейкозы, хронические – очень редко.
Среди острых лейкозов наиболее распространенной формой является острый лимфобластный лейкоз (85 % всех острых лейкозов). Менее распространены следующие формы острых лейкозов у детей – миелобластные, промиелоцитарные, миеломонобластные, монобластные и другие формы.
Цитологические варианты лейкозов у детей, а также стадийность их развития идентичны соответствующим формам патологии у взрослых людей.
Характерной особенностью развернутого периода болезни острого лейкоза у детей, независимо от цитологического варианта лейкоза, является боль в костях. Наиболее часто поражаются трубчатые кости, особенно бедренная и большеберцовая.
К ранним проявлениям острого лейкоза у детей относится увеличение всех групп лимфоузлов – шейных, подчелюстных, подмышечных, паховых и др., иногда развивается симптомокомплекс Микулича – появление лейкозной инфильтрации в ткани слюнных и слезных желез.
Особенностью острых лейкозов у детей является некротическое поражение кожи и слизистых оболочек, обусловленное их лейкозной инфильтрацией и последующим присоединением инфекции. Одновременно лейкозная инфильтрация обнаруживается в сердечной мышце, легких, кишечнике.
Как отмечается в последнее время, на фоне острых лейкозов у детей значительно возросла частота поражения лейкозными клетками мозговых оболочек, вещества мозга, корешков периферических нервов (частота нейролейкемии у детей достигает 78–83 %). Метастазирование в центральную нервную систему отмечается уже на самых ранних этапах болезни, особенно у детей моложе 15 лет.
В начальном периоде заболевания количество бластов в костном мозге достигает 20–30 % при сохранности эритронормобластического и мегакариоцитарного ростков. Количество лейкоцитов, тромбоцитов, эритроцитов в периферической крови может быть не изменено или умеренно уменьшено.
В развернутой стадии заболевания бластные клетки в костномозговом пунктате достигают 70–100 % на фоне значительного снижения эритронормобластов, мегакариобластов и клеток гранулоцитарного ряда. Одновременно в периферической крови обнаруживается высокий процент бластных форм (до 90–100 %), количество лейкоцитов варьирует от низких цифр (лейкопеническая форма острого лейкоза) и до высоких цифр – 20 000–100 000 в 1 мкл (сублейкемическая и лейкемическая формы острых лейкозов). Отмечаются различной степени выраженности анемия и тромбоцитопения, с которыми связаны проявления анемического и геморрагического синдромов.
Хронические лейкозы в детском возрасте встречаются крайне редко. Так, частота хронического миелолейкоза у детей составляет 1,5–3 % всех хронических лейкозов и протекает у детей моложе 3 лет в инфантильной форме, а после 5 лет преобладает ювенильная форма хронического миелолейкоза. Инфантильная форма лейкоза характеризуется анемией, тромбоцитопенией, увеличением миелобластов в крови и отсутствием филадельфийской хромосомы. Характерной особенностью этого лейкоза является значительное повышение содержания фетального гемоглобина в эритроцитах (уровень фетального гемоглобина может достигать 100 % при норме менее 2 %).
Ювенильная форма лейкоза у детей протекает также, как и у взрослых, и характеризуется наличием филадельфийской хромосомы в миелоидных клетках.
Острые лейкозы быстро развиваются и без лечения приводят к гибели больного, как правило, в течение 1–3 месяцев, что связано с высокой пролиферативной активностью опухолевых клеток, быстрым нарастанием опухолевой массы и развитием осложнений.
Среди этиологических факторов острых лейкозов отмечена роль ионизирующей радиации, используемой, в том числе и для лечебных целей. Использование цитостатиков (циклофосфамида, хлорамбуцила, мельфолана, мустаргена) увеличивает в сотни раз частоту развития лейкозов среди этого контингента больных.
Острые лейкозы могут возникнуть на фоне длительной химиотерапии лимфомы Ходжкина и неходжкинских лимфом, хронического лимфолейкоза, множественной миеломы. В ряде случаев развитие острого лейкоза связывают с наличием генетических аномалий (болезнь Дауна), вирусных инфекций.
Острый лимфобластный лейкоз

Острый лимфобластный лейкоз – это злокачественная патология костного мозга и крови, которая заключается в продуцировании кроветворным органом бластных (незрелых) лейкоцитов. Эти клетки неспособны выполнять свою функцию и постепенно вытесняют нормальные клетки, что приводит к катастрофическому падению иммунитета, анемии, инфекционным воспалительным процессам, кровотечениям и другим нарушениям нормальной жизнедеятельности организма. Заболевание развивается очень быстро и при отсутствии квалифицированной медицинской помощи в течение нескольких месяцев приводит к летальному исходу.
Общепринятая классификация острых лимфобластных лейкозов (ОЛЛ) подразделяет их на две группы, в зависимости от типа пораженных лейкоцитов.
- В-клеточный (до 85% всех случаев) наиболее характерен для детского возраста, причем пик заболеваемости приходится на 3-й год жизни. Взрослые заболевают крайне редко. Вторая группа риска – это люди старше 60 лет, но среди пожилых людей заболеваемость в 5-6 раз ниже, чем у детей
- Т-клеточный (15-20% случаев) характеризуется более тяжелым течением и высокой агрессивностью. Наибольшее количество заболевших приходится на 15-летний возраст.
Патологическая мутация В-лейкоцитов и Т-лейкоцитов может происходить на разных этапах созревания. Если в крови появляются недозрелые клетки, мутировавшие на начальных этапах, то к названию формы лейкоза добавляют приставку «пре». Это отличает лимфоцитарные онкопатологии от острого нелимфобластного лейкоза, при котором такого разделения нет.
Симптомы
Первые проявления острого лимфоидного лейкоза неспецифичны и характерны для многих заболеваний:
- бледность кожных покровов из-за развивающейся анемии;
- вялость, упадок сил, сонливость;
- частые инфекционные заболевания из-за снижения иммунитета;
- повышенная температура тела.
С развитием болезни, увеличением в крови количества бластных лимфоцитов и недостатком здоровых клеток появляются более выраженные симптомы:
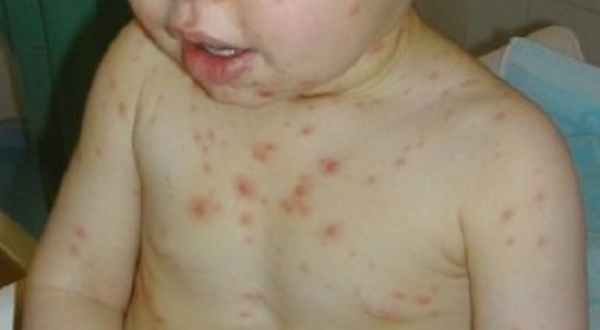
- кровоточивость слизистых оболочек;
- синяки, точечные кожные кровоизлияния;
- длительное заживление даже небольших царапин и ранок, сопровождающееся инфицированием, воспалениями, нагноениями;
- боли в конечностях, вызванные ростом опухоли костного мозга;
- увеличение размеров печени, селезенки, лимфоузлов, приводящие к болям в животе;
- затрудненное дыхание, одышка;
- паралич лицевого нерва, ухудшение зрения, рвота из-за поражения мозговых оболочек.
В каждом отдельном случае формируется индивидуальный симптомокомплекс, в который перечисленные признаки могут входить частично или полностью.
Причины и факторы риска
Непосредственной причиной заболевания всегда становится злокачественная мутация клеток кроветворной системы, из-за которой они становятся способны к быстрому бесконтрольному размножению. Существует предположение, что изменение генома происходит еще во время внутриутробного развития, но до определенного момента процесс остается незавершенным. «Спусковым крючком» нередко становятся внешние обстоятельства:
- радиоактивное излучение любой природы, в том числе во время лечения других форм рака;
- некоторые химические соединения – бензол, определенные препараты химиотерапии;
- вирусные инфекции (Эпштейна-Барр, HTLV);
- унаследованная предрасположенность.
Острый лимфоцитарный лейкоз часто развивается у детей, реже – у людей старше 60 лет, совсем редко – у взрослых. Представители белой расы заболевают чаще темнокожих, мужчины – несколько чаще женщин.
Стадии
Поскольку при онкозаболеваниях крови опухоль, как таковая, не развивается, то общие критерии стадийности для оценки их течения не подходят. Начальной стадией острого лимфобластного лейкоза считают период от появления злокачественного клона до появления выраженных симптомов. Далее выделяют следующие этапы.
- Первая атака, или дебют. В это время заболевание стремительно развивается, пациент обращается к врачу, его помещают в гематологический стационар и проводят индукционную терапию.
- Ремиссия. Она может быть полной, со снижением уровня бластных лейкоцитов менее 5% и наличием в миелограмме всех здоровых ростков кроветворения, и частичной, при которой улучшение показателей крови является временным и через определенный период прекращается.
- Рецидив. Состояние наступает после ремиссии и характеризуется возвратом признаков заболевания с повышением уровня бластоза выше 5%. Выделяют ранний (с ремиссией менее года) и поздний (с ремиссией дольше года) рецидив острого лимфобластного лейкоза.
Иногда после нескольких ремиссий и рецидивов у пациента наступает терминальная стадия, при которой проводимая терапия не дает никаких результатов. После этого неизбежно наступает летальный исход. У большинства больных результаты лечения оказываются более благоприятными, и после ремиссии, как правило, происходит выздоровление.
Диагностика
Чтобы диагностировать острый лимфоцитарный лейкоз, необходим ряд лабораторных анализов и инструментальных исследований.
Общий анализ крови обязательно проводят с подсчетом лейкоцитарной формулы, чтобы выявить первичные признаки болезни.
Биохимический анализ крови проводят для уточнения состояния внутренних органов, в частности – печени и почек.
Биопсия костного мозга из подвздошной кости предоставляет материал для основных исследований.
Рентген грудной клетки необходим для выявления увеличенных лимфоузлов, а также для определения воспалительного процесса в легких.
В процессе лечения может появиться необходимость в дальнейших диагностических и мониторинговых исследованиях.
Вы можете бесплатно получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (высокотехнологичной медицинской помощи).
Лечение
Стратегию лечения острого лимфобластного лейкоза разрабатывает и утверждает консилиум, в который входят медики нескольких специализаций: онколог общего профиля, химиотерапевт, радиолог, гематолог, другие специалисты. Как правило, пациенту назначают комплекс мероприятий, включающий наиболее эффективные методики.
Химиотерапия является ключевым методом при онкозаболеваниях крови и костного мозга. Современные препараты эффективно уничтожают злокачественные клетки либо угнетают их рост и деление. В зависимости от показаний, каждому пациенту разрабатывают индивидуальный курс с несколькими разными химиопрепаратами. Если они не оказывают желаемого эффекта, назначения корректируют с учетом новых данных.
Лучевая терапия используется в качестве вспомогательного метода при лечении некоторых подвидов заболевания. Наиболее часто она предшествует хирургической операции по пересадке костного мозга, когда требуется тотальное уничтожение опухолевых клеток.
Лечение состоит из нескольких этапов:
- подготовительного, необходимого для снижения количества лейкозных клеток в крови;
- индукции ремиссии – интенсивного курса, целью которого является максимально возможное уничтожение опухоли;
- консолидации, направленной на закрепление результата и уничтожение остаточных очагов;
- реиндукции, или повторении индукции, чтобы полностью исключить вероятность рецидива;
- поддерживающей терапии, которая при успешном лечении продолжается около двух лет и состоит из небольших доз цитостатиков.
Между этапами делаются перерывы, необходимые для восстановления организма после воздействия тяжелых препаратов.
Прогнозы
При остром лимфобластном лейкозе прогноз зависит, в первую очередь, от возраста пациента. У детей выздоровление наступает в 80-90% случаев. Для взрослых этот показатель в настоящее время составляет 40-45%, причем у более молодых пациентов шансы существенно выше, чем у людей старше 60 лет. Не следует забывать, что за последние годы онкологи добились существенных успехов в лечении заболеваний крови. Ежегодно появляются новые, все более эффективные и безопасные химиопрепараты направленного действия.
Профилактика
Специальных мер для предупреждения острого лимфоидного лейкоза не существует. Чтобы снизить риски заболевания, необходимо придерживаться здорового образа жизни, укреплять естественный иммунитет, избегать радиационных и канцерогенных воздействий.
Реабилитация
В течение реабилитационного периода пациент нуждается в полном восстановлении функций организма, для чего необходимо:
- поддерживать и укреплять иммунную систему;
- восстанавливать кишечную микрофлору;
- выводить из организма токсины, образовавшиеся после распада патогенных клеток;
- укреплять нервную систему, бороться со стрессами и депрессивными состояниями.
Диагностика и лечение острого лимфобластного лейкоза в Москве
Если у вас или члена вашей семьи обнаружены признаки острого лимфобластного лейкоза, обратитесь в клинику «Медицина». Мы предлагаем своим пациентам:
- лечение у онкологов, химиотерапевтов, гематологов высокой квалификации;
- диагностику с использованием новейшего медицинского оборудования;
- пребывание в комфортабельной палате стационара под круглосуточным наблюдением;
- медицинский сервис в соответствии с жесткими стандартами мировой медицины.
Позвоните нам, чтобы выяснить интересующие вас подробности и записаться на консультацию.
Вопросы и ответы
Сколько живут при остром лимфобластном лейкозе?
Заболевание отличается стремительным течением, поэтому без медицинской помощи летальный исход наступает в течение нескольких месяцев. При своевременно начатом лечении шансы прожить более 7 лет имеются у 80-90% детей и около 40% взрослых.
Сколько времени продолжается лечение острого лимфобластного лейкоза?
- Подготовительный этап лечения продолжается 1-2 недели.
- Индукция – до 8 недель.
- Консолидация – до 4 месяцев.
- Реиндукция – несколько месяцев.
- Поддерживающая терапия – до полутора лет.
Общая продолжительность лечения составляет примерно два или два с половиной года.
Как понять, что у тебя острый лимфобластный лейкоз?
Если у вас появились:
- симптомы общего недомогания – вялость, слабость, повышенная температура;
- кровотечения из носа, десен, других слизистых оболочек;
- плохо заживающие ранки на коже;
- сильная потливость по ночам –
необходимо как можно скорее обратиться к онкологу или гематологу и сделать анализы. Перечисленные симптомы далеко не всегда свидетельствуют о начале острого лимфобластного лейкоза, однако это заболевание развивается стремительно и агрессивно. Для успеха лечения дорог буквально каждый день.
Читайте также:
