Цитоскелет. Цитоплазма. Микротрубочки. Актиновые филаменты. Промежуточные филаменты.
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
11.5.1. Промежуточные филаменты образуются из фибриллярных полипептидов четырех типов [51, 52]
В отличие от мономеров актина и тубулина, которые представляют собой глобулярные белки, субъединицы ПФ имеют вытянутую, фибриллярную форму. Они объединяются в продольные пучки, где перекрываются по длине, так что образуют длинные нити с высокой механической прочностью. В латеральных взаимодействиях, за счет которых строятся ПФ, нередко участвует лишь часть молекулы белковой субъединицы ПФ, поэтому структура остальной ее части может значительно варьировать, не изменяя общего строения нити. В связи с этим ПФ в отличие от актиновых филаментов и микротрубочек построены из полипептидов с весьма различной молекулярной массой - от 40 до 130 тыс. в зависимости от типа клеток.
Промежуточные филаменты по их первичной структуре делят на четыре большие группы (табл. 11-5). Белки ПФ типа I наиболее характерны для эпителиальных клеток и включают два подсемейства кератинов: кислые кератины и нейтральные или основные кератины. Кератиновые филаменты - всегда гетерополимеры, образованные поровну субъединицами каждого из этих двух подсемейств. Вообще кератины - самая обширная группа белков ПФ; известно уже не менее 19 различных форм в составе эпителиев человека и еще 8 в волосах и ногтях. Многие типы эпителиев, различающихся морфологически и функционально, синтезируют также разные формы кератинов.
Таблица 11-5. Главные типы белков промежуточных филаментов
Образующий полипептид (мол. масса)
Кислые кератины (40000-70000)
Нейтральные и основные кератины (40 000-70 000)
Эпителиальные клетки и производные эпидермиса (волосы, ногти и т.п.)
Многие клетки мезенхимного происхождения; часто экспрессируется клетками в культуре Мышечные клетки
Глиальный фибриллярный кислый белок (45000)
Глиальные клетки (астроциты и некоторые шванновские клетки)
Белки нейрофиламентов (около 130000 1) , 100000 1) и 60000)
Ядерные ламины А, В и С (65000 -75000)
Ядерная ламина во всех клетках
1) Из-за того, что эти белки при электрофорезе в гелях с додецилсульфатом натрия мигрируют аномально медленно, раньше их молекулярную массу считали большей.
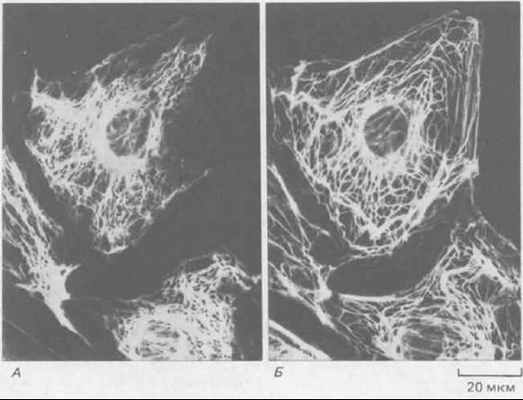
Рис. 11-73. Иммунофлуоресцентная микрофотография эпителиальных клеток кенгуровой крысы (PtK2) в интерфазе. Клетки окрашены одновременно антителами к виментину (А) и к кератину (Б). Обратите внимание, что содержащиеся в клетке системы виментиновых и кератиновых филаментов существуют раздельно, хотя и имеют сходное распределение. (С любезного разрешения Магу Osborn.)
К белкам ПФ типа II относятся 1) виментин, 2) десмин и 3) глиальный фибриллярный кислый белок. Виментин широко распространен в клетках мезенхимного происхождения, включая фибробласты, клетки эндотелия кровеносных сосудов и лейкоциты; он часто образуется в культивируемых клетках и временно появляется в различных клетках в ходе онтогенеза. Десмин содержится в клетках мышц, как гладких, так и поперечнополосатых, а глиальный фибриллярный кислый белок образует глиальные филаменты в определенного рода клетках глии (астроцитах и некоторых шванновских клетках) в нервной системе. Все эти белки способны in vitro к самосборке с образованием гомополимеров, а также к образованию гетерополимеров с другими белками типа II. Последняя способность проявляется и in vivo: в клетках некоторых типов были обнаружены сополимеры виментина с десмином и виментина с глиальным фибриллярным кислым белком.
Из белков ПФ типа III построены нейрофиламенты - важный компонент цитоскелета в аксонах и дендритах нервных клеток. У позвоночных три таких белка, их называют «нейрофиламентным триплетом». И наконец, белки ПФ типа lV-это ядерные ламины (разд. 11.5.5); они сходны с другими белками ПФ по аминокислотной последовательности, но имеют несколько характерных отличий. Наиболее примечательно то, что они образуют высокоупорядоченные двумерные сети из филаментов, подвергающиеся быстрой разборке и сборке на определенных стадиях митоза.
Все клетки эукариот синтезируют ядерные ламины и по крайней мере один тип цитоплазматических белков ПФ. В некоторых клетках есть цитоплазматические ПФ двух типов, образующие раздельные структуры. Таковы, например, некоторые эпителиальные клетки, содержащие отдельные системы кератиновых и виментиновых филаментов (рис, 11-73). 11-28
11.5.2. Промежуточные филаменты образуются из димерных субъединиц со стержневидным срединным доменом [53]
Несмотря на значительную разницу в размерах, все белки ПФ цитоплазмы кодируются генами одного мультигенного семейства. У всех этих белков в первичной структуре полипептида есть гомологичный срединный участок примерно из 310 аминокислот, образующий протяженную а-спираль с тремя короткими не-а-спиральными вставками (рис. 11-74). Кроме того, большие отрезки этой срединной области имеют последовательность, характерную для полипептидов, способных к образованию спирали из двух спиралей (см. разд. 11.1.6). Подобно тропомиозину или хвосту мышечного миозина, эта двухцепочечная спираль представляет собой димер из двух одинаковых полипептидов ПФ. Эти две цепи в гомодимере ПФ уложены параллельно друг другу, причем к срединному стержневидному домену примыкают на обоих концах глобулярные домены. При сборке ПФ стержневидные домены взаимодействуют друг с другом и формируют однородную сердцевину филамента, а глобулярные, величина которых сильно варьирует у разных белков ПФ, выступают с поверхности филамента наружу. Одна из моделей сборки ПФ из димерных субъединиц показана на рис. 11-75.
11.5.3. Промежуточные филаменты простираются от ядерной оболочки до периферии клетки [54]
Если окрасить культивируемые клетки антителами к одному из цитоплазматических белков ПФ (например, виментину), то обычно будет видна ажурная сеть нитей, окружающая ядро и охватывающая всю, цитоплазму (см. рис. 11-73). По структуре эта сеть отлична от других компонентов цитоскелета, хотя местами ее нити, по-видимому, идут параллельно микротрубочкам цитоплазмы. Вероятно, организация цитоплазматических ПФ зависит от взаимодействия с микротрубочками, так как деполимеризация микротрубочек при обработке веществами типа колхицина ведет к «осаждению» всей сети ПФ в виде околоядерной «шапки». Можно думать, что многие ПФ цитоплазмы связаны с ядерной оболочкой и в норме оттягиваются от нее к периферии клетки микротрубочками, с которыми они соединены.
Организация ПФ в цитоплазме может также определяться их взаимодействием с плазматической мембраной. В эритроцитах птиц (которые в отличие от эритроцитов млекопитающих имеют ядро и ПФ) виментин, как полагают, связан с плазматической мембраной через анкирин (разд. 6.2,4). В эпителиальных клетках кератиновые ПФ присоединены к плазматической мембране в десмосомах - специализированных межклеточных соединениях, помогающих удерживать соседние клетки вместе (разд. 14.1.4). Так как кератиновые филаменты каждой клетки через десмосомы соединены с такими же филаментами соседних клеток, они образуют непрерывную сеть, охватывающую весь эпителий.
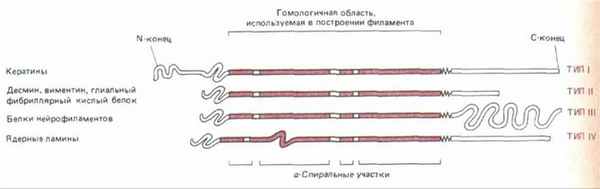
Рис. 11-74. У всех белков промежуточных филаментов имеется гомологичная центральная область (около 310 аминокислотных остатков), формирующая протяженную а-спираль с тремя короткими участками иной структуры. N-концевой и С-концевой домены не состоят из а-спирали и сильно варьируют по размерам и последовательности аминокислот у белков разных промежуточных филаментов.
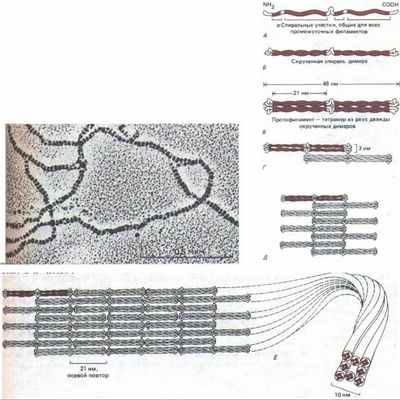
Рис. 11-75. Одна из современных моделей сборки промежуточных филаментов (ПФ). Мономер (А) объединяется с таким же мономером, образуя димер (Б), в котором консервативные а-спиральные участки лежат параллельно, обвиваясь друг около друга. Затем два таких димера укладываются бок о бок, образуя протофиламент длиной 48 нм и толщиной 3 нм, который состоит из четырех полипептидных цепей (В). Такие протофиламенты затем образуют все более крупные структуры, укладываясь с продольным сдвигом (Г и Д). Окончательная структура промежуточного филамента толщиной 10 нм состоит из восьми рядов протофиламентов (32 полипептидных цепей), соединенных в длинный тяж, похожий на канат (Е). Вверху представлена электронная микрофотография такого «окончательного» филамента. Неизвестно, являются ли ПФ полярными структурами, как актин и тубулин, или неполярными, как двойная спираль ДНК (или, что то же самое, лежат ли две скрученные спирали в составе протофиламента в параллельной ориентации или же в антипараллельной. (Микрофотография любезно предоставлена N. Geisler и К. Weber.)
11.5.4. Сборка промежуточных филаментов может контролироваться с помощью фосфорилирования [55]
Изолированные промежуточные филаменты (ПФ) в ионной среде, соответствующей цитоплазме, чрезвычайно стабильны; более того, сколько-нибудь значительного пула неполимеризованных белков ПФ (какой имеется в случае актина и тубулина) в клетке нет. И все же клетка явно может регулировать число, длину и расположение своих промежуточных филаментов, что указывает на ее способность контролировать их сборку и разборку. Важный фактор этого контроля-фосфорилирование определенных остатков в белках ПФ. Виментин, например, существует как в нефосфорилированной, так и в фосфорилированной форме. Если фосфорилировать изолированные виментиновые нити с помощью протеинкиназы, они распадаются на меньшие фрагменты. Однако самый впечатляющий пример того, насколько важную роль играет в контроле разборки ПФ фосфорилирование, - это ядерные ламины, которые подвергаются деполимеризации всякий раз, когда клетка вступает в митоз,
11.5.5. Ядерная ламина образована особым классом промежуточных филаментов [56]
Ядерная ламина - это белковая сеть (обычно толщиной от 10 до 20 нм), подстилающая изнутри поверхность внутренней ядерной мембраны (см. рис. 9-1). Она представляет собой прямоугольную решетку из промежуточных филаментов (рис. 11-76, Д), построенных у млекопитающих из трех белков ПФ типа Vl-ламинов А, В и С (см. рис. 11-74 и табл. 11-3), Ламины образуют димеры, у которых имеется стержневидный домен и две глобулярные головки на одном из концов (рис. 11-76, Б). При подходящих рН и ионной силе димеры самопроизвольно ассоциируют, образуя филаменты, которые по толщине и повторяющейся структуре сходны с цитоплазматическими ПФ.
Однако по ряду признаков ядерные ламины отличаются от белков ПФ цитоплазмы. Наиболее очевидное отличие-это организация образуемых филаментов в прямоугольную решетку (рис. 11-76, А), хотя для такой организации, видимо, необходимо объединение их с другими белками. Кроме того, ядерная ламина - структура очень динамичная. Когда клетки млекопитающих вступают в митоз, кратковременное фосфорилирование нескольких остатков серина в ламинах вызывает обратимую диссоциацию ядерной ламины на тетрамеры гиперфосфорилированных ламинов А и С и связанного с мембраной ламина В. При возвращении клетки в интерфазу ламины дефосфорилируются, и вокруг разошедшихся хромосом вновь образуется цельная ядерная оболочка (разд. 13.5.11).
11.5.6. Кератиновые филаменты удивительно разнообразны [52]
Из всех типов промежуточных филаментов наиболее стабильные и долгоживущие - кератиновые, они же и самые разнообразные. Эпителии с примитивной организацией, например в развивающемся эмбрионе, а также некоторые зрелые ткани (такие, как печень) содержат кератины двух типов - один кислый и один нейтральный. В эпителиях других органов (например, языка, мочевого пузыря, потовых желез) имеются шесть или больше различных кератинов, причем их конкретный спектр зависит от анатомической локализации. Кератиновые филаменты ввиду их многообразия и стабильности могут служить своего рода «отпечатками пальцев», позволяющими уточнить происхождение некоторых опухолей эпителиальной природы. Еще разнообразнее кератины в эпидермисе, который представляет собой плотный многослойный эпителий (разд. 17.4.2). В клетках разных слоев эпидермиса экспрессируются разные наборы кератинов. Кератиновые филаменты в них постепенно сшиваются поперечными ковалентными связями друг с другом и с ассоциированными белками, и по мере гибели клеток в самых наружных слоях эпидермиса поперечносшитый кератиновый скелет становится важнейшим защитным барьером на поверхности тела. Специализированные эпителиальные клетки, образующие такие поверхностные структуры, как волосы, когти и перья, обеспечивают дополнительные локальные вариации в наборе кератинов. Таким образом, промежуточные филаменты защищают животное от потери тепла и воды, предоставляют ему «оружие» и средства камуфляжа или, наоборот, привлечения партнера (окраска).
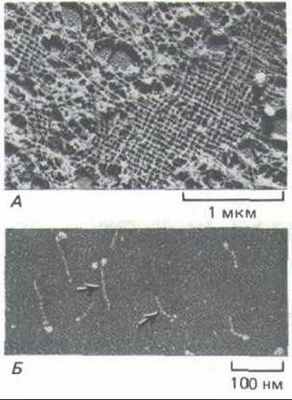
Рис. 11-76. А. Электронная микрофотография участка ядерной ламины в ооците Xenopus (препарат получен методом лиофилизации и напыления металлом). Ламину образует высокоупорядоченная прямоугольная сеть из промежуточных филаментов, состоящих из ядерных ламинов. Б. Изолированные димеры ламина (L) (электронная микрофотография, напыление металлом). По форме они напоминают мышечный миозин (М): у них есть стержневидный хвост и две глобулярные головки, но они гораздо меньше. Глобулярные головки образованы двумя большими С-концевыми доменами. (С любезного разрешения Ueli Aebi.)
11.5.7. Какова функция промежуточных филаментов?
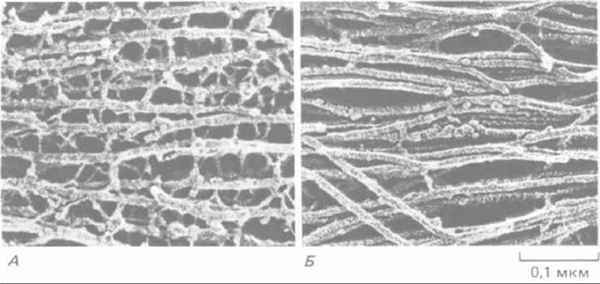
Рис. 11-77. Электронная микрофотография промежуточных филаментов двух типов, встречающихся в нервной ткани (препарат после быстрого замораживания и глубокого травления). А. Нейрофиламенты в аксоне соединены многочисленными поперечными белковыми сшивками; как полагают, такая организация придает этому длинному клеточному отростку большую прочность на разрыв. По-видимому, сшивки образованы длинными неспиральными участками С-концевой части наиболее крупного белка нейрофиламентов (см. рис. 11-74). Б. Промежуточные филаменты (называемые глиальными филаментами) в астроците. Они подвергаются меньшим механическим нагрузкам. Их поверхность довольно гладкая, и поперечных сшивок между ними мало. (С любезного разрешения N. Hirokawa.)
Различные потенции к связыванию других белков могут обеспечиваться вариабельными участками белков промежуточных филаментов, Влияя на свойства филамента, эти вариабельные участки определяют не только его способность к самосборке, но и то, как он будет взаимодействовать с другими компонентами клетки (например, с микротрубочками и плазматической мембраной). Это совершенно иная стратегии чем в случае двух других важнейших элементов цитоскелета - актиновных филаментов и микротрубочек; как мы уже знаем, эти полимеры в основном инвариантны по структуре, а к выполнению различных функций они приспосабливаются с помощью разных наборов актин-связывающих белков и белков, ассоциированных с микротрубочками. Таким образом, роль вариабельных участков в белках промежуточных филаментов та же, что и у вспомогательных белков актиновых филаментов и микро-трубочек, - разница лишь в том, что одни ковалентно связаны с субъединицами филамента, а другие представляют собой отдельные молекулы.
Промежуточные филаменты (ПФ) - это полимеры, по структуре подобные канатам, собранным из нитевидных полипептидов. По- видимому, они поддерживают структуру клеток или противостоят растягивающим нагрузкам. Существует много тканеспецифических форм ПФ, построенных из различных полипептидов: кератиновые филаменты эпителиальных клеток, нейрофиламенты нейронов, глиальные филаменты астроцитов и шванновских клеток, десминовые филаменты мышечных волокон и виментиновые филаменты фибробластов и клеток многих других типов. Отдельное семейство белков ПФ составляют ядерные ламины, из которых построена волокнистая пленка (ламина), выстилающая изнутри оболочку ядра; они имеются во всех эукариотических клетках.
Полипептиды, входящие в состав промежуточных филаментов различных типов, различаются по аминокислотной последовательности, а также - и очень сильно - по молекулярной массе. Однако у всех имеется гомологичный центральный домен, который при димеризации белка образует жесткую структуру из обвивающих друг друга спиралей. Такие димерные субъединицы складываются в большие пучки «внахлест», формируя промежуточные филаменты. Стержневидные домены субъединиц при этом создают структурную сердцевину ПФ, а глобулярные домены на обоих концах выступают наружу и обусловливают разнообразие свойств ПФ. Именно благодаря этой вариабельности механические свойства ПФ и взаимодействия их с другими клеточными компонентами приспособлены к специфическим нуждам клеток того или иного типа.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Цитоскелет. Цитоплазма. Микротрубочки. Актиновые филаменты. Промежуточные филаменты.
Организация клетки. Цитоскелет
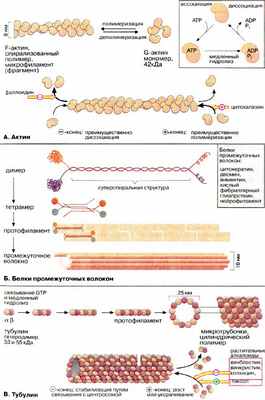
Цитоплазма эукариотических клеток пронизана трехмерной сеткой из белковых нитей (филаментов), называемой цитоскелетом. В зависимости от диаметра филаменты разделяются на три группы: микрофиламенты (6-8 нм), промежуточные волокна (около 10 нм) и микротрубочки (около 25 нм). Все эти волокна представляют собой полимеры, состоящие из субъединиц особых глобулярных белков.
Микрофиламенты (актиновые нити) состоят из актина — белка, наиболее распространенного в эукариотических клетках. Актин может существовать в виде мономера ( G-актин , «глобулярный актин») или полимера ( F-актин , «фибриллярный актин»). G-актин — асимметричный глобулярный белок (42 кДа), состоящий из двух доменов. По мере повышения ионной силы G-актин обратимо агрегирует, образуя линейный скрученный в спираль полимер, F-актин. Молекула G-актина несет прочно связанную молекулу АТФ (АТР), которая при переходе в F-актин, медленно гидролизуется до АДФ (ADP), т.е. F-актин проявляет свойства АТФ-азы.
При полимеризации G-актина в F-актин ориентация всех мономеров одинакова, поэтому F-актин обладает полярностью . Волокна F-актина имеют два разноименно заряженных конца — (+) и (-), которые полимеризуются с различной скоростью. Эти концы не стабилизированы специальными белками (как, например, в мышечных клетках), и при критической концентрации G-актина (+)-конец будет удлиняться, а (-)-конец укорачиваться. В условиях эксперимента этот процесс может быть ингибирован токсинами грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-концом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к (+)-концу, блокируя полимеризацию.
Актинассоциированные белки. В цитоплазме клеток имеются более 50 различных типов белков, которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции: регулируют объем G-актинового пула (профилин), оказывают влияние на скорость полимеризации G-актина (виллин), стабилизируют концы нитей F-актина (фрагин, β-актинин) , сшивают филаменты друг с другом или с другими компонентами (как, например, виллин, α-актинин, спектрин, MARCKS) или разрушают двойную спираль F-актина (гельзолин) . Активность этих белков регулируется ионами Са 2+ и протеинкиназами.
Б. Белки промежуточных волокон
Структурными элементами промежуточных волокон являются белки, принадлежащие к пяти родственным семействам и проявляющие высокую степень клеточной специфичности. Типичными представителями этих белков являются цитокератины, десмин, виментин, кислый фибриллярный глиапротеин [КФГП (GFAP)] и нейрофиламент . Все эти белки имеют в центральной части базовую стержневую структуру, которая носит название суперспирализованной α-спирали (см. кератин, с. 76). Такие димеры ассоциируют антипараллельно, образуя тетрамер. Агрегация тетрамеров по принципу "голова к голове" дает протофиламент . Восемь протофиламентов образуют промежуточное волокно.
В отличие от микрофиламентов и микротрубочек свободные мономеры промежуточных волокон едва ли встречаются в цитоплазме. Их полимеризация ведет к образованию устойчивых неполярных полимерных молекул.
Микротрубочки построены из глобулярного белка тубулина , представляющего собой димер α- и β-субъединиц (53 и 55 кДа). α, β- Гетеродимеры образуют линейные цепочки, называемые протофиламентами. 13 протофиламентов образуют циклический комплекс. Затем кольца полимеризуются в длинную трубку. Как и микрофиламенты, микротрубочки представляют собой динамические полярные структуры с (+)- и (-)-концами. (-)-Конец стабилизирован за счет связывания с центросомой (центр организации микротрубочек), в то время как для (+)-конца характерна динамическая нестабильность. Он может либо медленно расти, либо быстро укорачиваться. Тубулиновые мономеры связывают ГТФ (GTP), который медленно гидролизуется и ГДФ (GTP). С микротрубочками ассоциируют два вида белков: структурные белки (MAP от англ. microtubuls-associated proteins) и белки-транслокаторы.
Цитоскелет. Цитоплазма. Микротрубочки. Актиновые филаменты. Промежуточные филаменты.
«МЕХАНИЗМЫ КЛЕТОЧНОЙ ПОДВИЖНОСТИ»
преподаватель - д.б.н., профессор Е.А. Смирнова
Цитоскелет. Компоненты цитоскелета – микротрубочки, актиновые филаменты (микрофиламенты), промежуточные филаменты. Общие принципы формирования и функции.
Микротрубочки. Мономеры α и β тубулина. Гетеродимер α и β тубулина как субъединица для сборки полимера. Изоформы тубулина. Посттрансляционные модификации тубулина. Разнообразие семейства тубулинов. Строение микротрубочки, образование протофиламентов, листков и цилиндрических структур. Полярность микротрубочек. Динамическое равновесие между тубулином и микротрубочками. Динамика полимеризации тубулина, участие ГТФ в этом процессе. Регуляция динамического состояния микротрубочек in vitro и in vivo. Динамическая нестабильность и тредмиллинг. Взаимодействие тубулина с антимикротрубочковыми веществами (колхицином, нокодазолом, винбластином и паклитакселем/таксолом). Локализация микротрубочек в различных типах клеток (фибробласты, эпителий, нервные клетки, мышечные клетки). Белки, ассоциированные с микротрубочками (MAP). Структурные/поверхностные МАР, белки связанные с концами микротрубочек (катастрофины, +TIP белки, -TIP белки), разрезающие белки, моторные белки микротрубочек. Стабилизирующие и дестабилизирующие белки семейства МАР. Роль белков семейства MAP в регуляции динамического состояния и функциях микротрубочек. Моторные белки микротрубочек. Белки семейства кинезинов. Разнообразие суперсемейства кинезинов. Строение молекулы классического кинезина. Структурные и функциональные домены тяжелых цепей кинезина. Направленность кинезин-зависимого транспорта. Плюс и минус-конец ориентированные кинезины. Механохимический цикл кинезина, активация его АТФ-азной активности микротрубочками. Понятие процессивности кинезин-зависимого транспорта. Роль кинезинов во внутриклеточном транспорте. Белки семейства динеинов. Флагеллярный и цитоплазматический динеин, строение динеинового комплекса. Структурные и функциональные домены динеина. Роль динеина в движении ресничек и жгутиков. Цитоплазматический динеин, прикрепление к микротрубочкам и карго, механохимический цикл динеина. Строение динактинового комплекса, его взаимодействие с динеином. Локализация динеина и динактинового комплекса в клетках. Внутриклеточный транспорт, зависимый от динеина.
Центросома и ЦОМТ, типы ЦОМТ. Строение центросомы в клетках животных, ее динамика в клеточном цикле. Роль центросомы в инициации сборки микротрубочек и организации микротрубочек в цитоплазме. γ тубулин, γ-TURC, γ-TUSC, их роль в инициации сборки микротрубочек. Рекрутирование γ-TURC в центросому, механизмы и белковые комплексы, участвующие в этом процессе. Заякоривание микротрубочек в центросоме. Другие белки-нуклеаторы микротрубочек. Заякоривание микротрубочек в центросоме. Строение центросомы: центриоли и перицентриолярный материал. Структура и белковый состав центриолей. Материнская и дочерняя центриоли: сходства, отличия, функции. Образование центриолей – матричная модель и формирование de novo. Механизмы формирования процетриолей, контроль роста и удлинения. Белки перицентриолярного материала и их функции. Центриолярный и центросомный циклы. Цикл дупликации центросомы. Поведение центросомы при изменении формы клеток и при движении клеток. Центриоль как базальное тело жгутика и реснички. Роль в формировании аксонемы. Строение и функции аксонемы реснички и жгутика. Нецентросомные центры организации микротрубочек. Роль центросомы и центриолей в клетке. Патология митоза, связанные с нарушением центросомального/центриолярного циклов. Аппарат Гольджи как ЦОМТ.
Актиновые микрофиламенты. Строение молекулы/мономера актина. Изоформы актина, их экспрессия в различных типах клеток. Полимеризация актина in vitro, G- и F-актин. Строение актинового филамента, полярность и ее определение с помощью декорирования миозиновыми головками. Динамика полимеризации актина, динамическое равновесие G- и F-актина, участие АТФ в этом процессе. Взаимодействие актина с фаллоидином, цитохалазинами и латрункулином и применение этих веществ в экспериментальных исследованиях. Нуклеация актиновых филаментов в клетках. Белки-нуклеаторы Arp2/3, формины, spire и другие. Формирование сети микрофиламентов при участии Arp2/3 и пучков микрофиламентов при участии форминов. Классы актин-связывающих белков, их роль в регуляции динамики микрофиламентов. Белки, связывающиеся с G-актином – тимозин, профилин. Белки, связывающиеся с F-актином. ADF/кофилин как универсальный регулятор деполимеризации актина, его роль в обеспечении клеточной подвижности. Кэпирующие белки и их влияние на полимеризацию актина. Разрезающие белки и их взаимодействие с актином. Белки образующие поперечные связи между актиновыми филаментами (пучкующие и образующие сети) - филамин, фимбрин, α– актинин, спектрин.
Актин в клеточном морфогенезе. Локализация актина в культивируемых клетках и в клетках организма in situ: стресс-фибриллы и клеточный кортекс. Функции кортикальной сети актина и стресс-фибрилл. Ламелоподии, филоподии. Расположение актиновых филаментов и регуляция их полимеризации на переднем крае движущихся по субстрату фибробластов и кератоцитов. Роль Arp2/3 и кофилина. Роль белков семейства RhoGTP в формировании пучков и сетей актиновых филаментов. Расположение актиновых филаментов в микроворсинках, роль виллина, фимбрина и белка CapZ в образовании микроворсинок. Взаимодействие актиновых филаментов с плазмалеммой. Фокальный контакт, его строение. Специфические белки фокальных контактов: винкулин, таллин и другие. Опосредованное интегринами взаимодействие пучков актиновых филаментов и межклеточного матрикса в зоне фокального контакта. Взаимодействие стресс - фибрилл с межклеточными контактами эпителиоцитов. Суперсемейство миозинов. Разнообразие и общие свойства миозинов. Сходства и отличия с кинезинами и динеинами. Структура разных молекул миозина и миозина II. Структурные и функциональные домены тяжелых цепей миозина. Механохимический цикл миозина. Скорость движения различных миозинов по актину. Локализация различных типов миозинов в немышечных клетках. Миозин I, его взаимодействие с мембранами и роль в образовании микроворсинок. Миозин V и его роль в движении клеточных органелл. Образование биполярных пучков миозина II in vitro и в немышечных клетках in vivo, строение этих пучков. Роль миозина II в движении клеток по субстрату. Расположение миозина II в стресс - фибриллах и функции стресс-фибрилл. Перестройки актомиозиновой системы при распластывании клеток по субстрату, движении и при делении клеток.
Промежуточные филаменты. Свойства промежуточных филаментов, их отличия от микротрубочек и актиновых филаментов. Экспрессия разных белков промежуточных филаментов в клетках и тканях. Молекулярная организация промежуточных филаментов. Структура палочковидного мономера промежуточных филаментов. Механизм сборки промежуточных филаментов из октамерных субъединиц (ULF). Динамика промежуточных филаментов в клетках. Классы промежуточных филаментов. Кератины I и II типа, группа белков III типа (виментин, GFAP, десмин), IV типа (нейрофиламенты), белки ламины. Строение ядерной ламины. Заболевания, связанные с нарушением структуры ламинов (ламинопатии). Нестандартный тип промежуточных филаментов. Белки промежуточных филаментов как маркеры типа клеток. Локализация промежуточных филаментов в клетках. Взаимодействие различных белков промежуточных филаментов при их совместной экспрессии в клетках. Белки IFAP (белки связанные с промежуточными филаментами) и их роль в организации сети промежуточных филаментов, и связи с другими элементами цитоскелета. Заболевания, связанные с дефектами промежуточных филаментов. Система промежуточных филаментов как интегратор клеточной и тканевой архитектуры.
Элементы цитоскелета: строение и функции
Представим себе какой-нибудь привычный организм, да хоть себя любимого. Опору и поддержку нашему телу обеспечивает скелет – совокупность твердых элементов. К нему же крепятся все наши внутренние органы. Подвижность всей этой системы обеспечивают сократимые волокна – мышцы. Таким образом, скелет выполняет опорную функцию, а мышцы – локомоторную. Обе эти функции необходимы живой системе. А как с эти дела обстоят у отдельно взятых клеток? Сейчас разберемся.
Для начала, стоит оговориться, что мы будем касаться только клеток эукариотических. У них опорные и локомоторные функции выполняет один и тот же комплекс органоидов. Называется он цитоскелетом. Что же в нем есть и с чем его есть?
Общие сведения
Цитоскелет включает в себя три типа элементов: микрофиламенты («филамент» - нить), промежуточные филаменты и микротрубочки (рис. 1). В наших дальнейших рассуждениях упор будет сделан на три основных аспекта: из чего обсуждаемое образование состоит, как устроено и как работает. Сразу стоит сказать, что все элементы цитоскелета состоят из белка. А вот из какого (вернее, каких) – другой вопрос. Итак, поехали.
Микрофиламенты
Это самые тонкие из элементов цитоскелета. Состоят они из белка актина и представляют собою сеть из двух переплетенных спиралей. Это только звучит страшно, честное слово! Посмотрим на то, как они строятся. Актин изначально существует в виде отдельных белковых глобул, это так называемый G-актин (он же глобулярный). При связывании с АТФ такие глобулы начинают активно полимеризовываться, образуя нити F-актина (фибриллярного). Потом две такие нити переплетаются, а из получившихся филаментов строится сеть (рис. 2). Такая сеть пронизывает всю цитоплазму клетки и служит выполняет ряд важных функций.
Но прежде чем начать разговор про них, следует сказать, что микрофиламенты динамически нестабильны. Это значит, что с обоих концов они одновременно и растут, и разрушаются – т.е. глобулы актина как встраиваются в филамент, так и выходят из него. Скорость сборки/разборки регулируется множеством белков, садящихся на концы, но одна закономерность прослеживается четко: у актинового филамента всегда есть растущий конец (т.е. обычно туда глобул встраивается больше, чем уходит) – его называют плюс-концом; и конец , на котором все происходит наоборот (то есть обычно больше глобу уходит) – он называется минус-концом. Такое состояние динамической нестабильности (микрофиламент как бы передвигается, т.к. растет с одного конца и разбирается с другой) элементов цитоскелета биологи зовут тредмиллингом (рис. 3).
Теперь наконец поговорим о функциях микрофиламентов. Прежде всего, они выполняют функцию опорную, участвуют в поддержании формы клетки. Не будь их, любая достаточно крупная клетка неизбежно бы растекалась в «кляксу». Кроме того, микрофиламенты осуществляют золь-гель переход цитоплазмы.
Золь и гель – это коллоидные растворы. Чтобы не вдаваться в химию: представьте себе кисель и желе. Вот первое – золь, а второе – гель. Золь жидкий, гель твердый. Для простоты запоминания предлагаю стишок из прошлого века: «Ах бедный, бедный наш кисель! Ты перешел из золя в гель! Вчера ты был гомогенат, сегодня ты коагулянт…» Мы с Вами тех киселей уже, слава Богу, не застали…
Но вернемся к нашим микрофиламентам. Следующая важная их функция – это участие в движении органоидов, везикул и прочего внутри клетки. Происходит оно следующим образом: молекулярные моторы (белки, способные изменять свою конформацию в результате связывания и гидролиза нуклеотид-три-фосфатов, в случае микрофиламентов — миозины) «тащат» свою ношу по филаменту как по рельсам (рис.4). На движении же, кстати, миозина вдоль актиновых филаментов работает мышечное сокращение.
И, наконец, микрофиламенты участвуют из изменении формы клеток (происходит это за счет перестройки актиновой сети) и, как крайнее его проявление, в образовании ложноножек.
Подводя итог, можно сказать, что микрофиламенты есть практически в любой эукариотической клетке, и без них клетка быть не может. Поэтому «в среднем по больнице» актин является самым частовстречаемым в клетке белком.
Промежуточные филаменты
С ними все гораздо менее интересно и разнообразно. Промежуточные филаменты – это жесткие фибриллярные белки с небольшими вставками глобулярных. Функция у них одна-единственная: обеспечение механической прочности. Эти ребята свою форму практически не меняют, именно они образуют жесткий «каркас» в клетке. Однако, что интересно, в разных типах тканей животных промежуточные филаменты построены из разных белков. В эпителиях это кератины, в соединительной ткани виментины, в мышцах десмин, а в нервной ткани – белки нейрофиламентов. К тому же промежуточные филаменты выстилают ядра клеток изнутри, образуя ядерную ламину – они построены из белков ламинов.
Тут закономерность просто и понятна: чем жестче должен быть клеточный слой, тем больше в клетках промежуточных филаментов. Крайним вариантом тут можно считать ороговеващий эпидермис, клетки верхних слоев которого полностью забиты кератином (они, разумеется, уже мертвые). Кроме того, интересно отметить, что у Высших растений промежуточных филаментов, как таковых, нет вообще.
Микротрубочки
Микротрубочки – это самые толстые и, пожалуй, самые сложноустроенные из элементов цитоскелета. Состоят они из белка тубулина. Тубулин, как и актин, изначально глобулярный. Один мономер тубулина состоит из двух частей: альфа- и бета-субъединиц. При построении микротрубочки к каждой из этих субъединиц присоединяется ГТФ (сравните с актином, когда используется АТФ), и мономеры полимеризуются, образуя цепочку. Ее называют протофиламентом. Потом 13 таких цепочек выстраиваются параллельно и получившийся пласт белка замыкается в трубочку (рис. 6).
Микротрубочки, как и микрофиламенты, характеризуются динамической нестабильностью. Они так же обладают плюс- и минус-концами, но, в отличие от актиновых филаментов, не образуют сети. Микротрубочки всегда нуклеируются (начинают расти) от какой-либо жесткой опоры: от внутренних мембран (у Высших растений) или от центриолей (у Животных и многих других организмов), но никогда и от других микротрубочек. Соответственно, минус-конец прикреплен к опоре (тем самым он стабилизируется и перестает разбираться), а плюс-конец смотрит в цитоплазму (рис. 7).
Микротрубочки – это основные «мышцы» клеток. Именно они обеспечивают движение крупных органоидов, хромосом при делении клеток (рис. 8) и т.д. Микротрубочки также обеспечивают биение жгутиков и ресничек. Всем движением вдоль микротрубочек заведуют два семейства молекулярных моторов: динеины (всегда движутся в сторону минус-конца) и кинезины (обычно «идут» к плюс-концу, но есть исключения) (рис. 9).
Итак, мы рассмотрели цитоскелет – совокупность структур, которые у клеток являются аналогом скелета и мышц животных. Именно они выполняют две основных функции: опорную и локомоторную, и именно их возникновению эукариоты обязаны свои расцветом.
Цитоскелет. Цитоплазма. Микротрубочки. Актиновые филаменты. Промежуточные филаменты.
Цитоплазма эукариотических клеток пронизана трехмерной сеткой из белковых нитей (филаментов), называемой цитоскелетом. В зависимости от диаметра филаменты разделяются на три группы: микрофиламенты (6-8 нм), промежуточные волокна (около 10 нм) и микротрубочки (около 25 нм). Все эти волокна представляют собой полимеры, состоящие из субъединиц особых глобулярных белков.
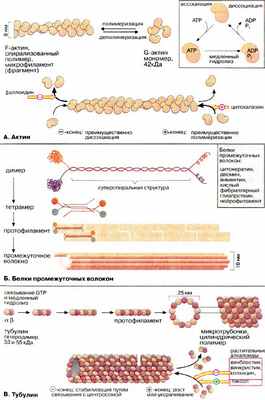
Микрофиламенты (актиновые нити) состоят из актина — белка, наиболее распространенного в эукариотических клетках. Актин может существовать в виде мономера ( G-актин , «глобулярный актин») или полимера ( F-актин , «фибриллярный актин»). G-актин — асимметричный глобулярный белок (42 кДа), состоящий из двух доменов. По мере повышения ионной силы G-актин обратимо агрегирует, образуя линейный скрученный в спираль полимер, F-актин. Молекула G-актина несет прочно связанную молекулу АТФ (АТР), которая при переходе в F-актин, медленно гидролизуется до АДФ (ADP), т.е. F-актин проявляет свойства АТФ-азы.
При полимеризации G-актина в F-актин ориентация всех мономеров одинакова, поэтому F-актин обладает полярностью. Волокна F-актина имеют два разноименно заряженных конца — (+) и (-), которые полимеризуются с различной скоростью. Эти концы не стабилизированы специальными белками (как, например, в мышечных клетках), и при критической концентрации G-актина (+)-конец будет удлиняться, а (-)-конец укорачиваться. В условиях эксперимента этот процесс может быть ингибирован токсинами грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-концом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к (+)-концу, блокируя полимеризацию.
Актинассоциированные белки. В цитоплазме клеток имеются более 50 различных типов белков, которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции: регулируют объем G-актинового пула (профилин), оказывают влияние на скорость полимеризации G-актина (виллин), стабилизируют концы нитей F-актина (фрагин, β-актинин), сшивают филаменты друг с другом или с другими компонентами (как, например, виллин, α-актинин, спектрин, MARCKS) или разрушают двойную спираль F-актина (гельзолин). Активность этих белков регулируется ионами Са 2+ и протеинкиназами.
Б. Белки промежуточных волокон
Структурными элементами промежуточных волокон являются белки, принадлежащие к пяти родственным семействам и проявляющие высокую степень клеточной специфичности. Типичными представителями этих белков являются цитокератины, десмин, виментин, кислый фибриллярный глиапротеин [КФГП (GFAP)] и нейрофиламент. Все эти белки имеют в центральной части базовую стержневую структуру, которая носит название суперспирализованной α-спирали (см. кератин, с. 76). Такие димеры ассоциируют антипараллельно, образуя тетрамер. Агрегация тетрамеров по принципу "голова к голове" дает протофиламент . Восемь протофиламентов образуют промежуточное волокно.
В отличие от микрофиламентов и микротрубочек свободные мономеры промежуточных волокон едва ли встречаются в цитоплазме. Их полимеризация ведет к образованию устойчивых неполярных полимерных молекул.
Микротрубочки построены из глобулярного белка тубулина , представляющего собой димер α- и β-субъединиц (53 и 55 кДа). α, β- Гетеродимеры образуют линейные цепочки, называемые протофиламентами. 13 протофиламентов образуют циклический комплекс. Затем кольца полимеризуются в длинную трубку. Как и микрофиламенты, микротрубочки представляют собой динамические полярные структуры с (+)- и (-)-концами. (-)-Конец стабилизирован за счет связывания с центросомой (центр организации микротрубочек), в то время как для (+)-конца характерна динамическая нестабильность. Он может либо медленно расти, либо быстро укорачиваться. Тубулиновые мономеры связывают ГТФ (GTP), который медленно гидролизуется и ГДФ (GTP). С микротрубочками ассоциируют два вида белков: структурные белки (MAP от англ. microtubuls-associated proteins) и белки-транслокаторы.
Читайте также:
