Хромосомные аномалии при эритремии - прогноз
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Материал опубликован 13 апреля 2015 в 15:13.
Обновлён 07 декабря 2015 в 19:12.
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 607н "Об утверждении стандарта специализированной медицинской помощи при раке кожи I - IV стадии (лучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 611н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях шейки матки 0-IA1 стадии (внутриполостная лучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 623н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях кожи IV стадии (хирургическое лечение)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 626н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях мочевого пузыря I G-3, II-IV стадии (хирургическое лечение)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 633н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях шейки матки IB - II стадии (самостоятельная сочетанная лучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 641н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях соединительной и мягких тканей I - IV стадии (предоперационная, послеоперационная лучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 643н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях тела матки IAG1-3, IBG1-2 стадии при наличии противопоказаний к хирургическому лечению (внутриполостная лучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 644н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях шейки матки IV стадии при наличии метастазов в парааортальных лимфатических узлах (паллиативная химиолучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 661н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях молочной железы I - IV стадии при наличии внутрикожного метастаза (фотодинамическая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 665н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях кожи 0, I, II стадии (хирургическое лечение)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 673н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях тела матки IIА, BG3, IIIA-CG (любая), IV стадии (химиотерапевтическое лечение)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 676н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях тела матки IIIС стадии (послеоперационная сочетанная лучевая терапия малого таза и парааортальной области)"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 678н "Об утверждении стандарта специализированной медицинской помощи при остром вирусном гепатите С тяжелой степени тяжести"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 679н "Об утверждении стандарта специализированной медицинской помощи при остром вирусном гепатите А легкой степени тяжести"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 682н "Об утверждении стандарта специализированной медицинской помощи при остром вирусном гепатите В средне-тяжелой степени тяжести"
Приказ Министерства здравоохранения Российской Федерации от 7 ноября 2012 г. № 685н "Об утверждении стандарта специализированной медицинской помощи при хроническом вирусном гепатите С"
Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. № 695н "Об утверждении стандарта специализированной медицинской помощи при немелкоклеточном раке легкого II - III стадии (послеоперационная лучевая терапия), мелкоклеточном раке легкого IA - IIIВ стадии (лучевая терапия по радикальной программе)"
Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. № 709н "Об утверждении стандарта специализированной медицинской помощи при немелкоклеточном раке легкого II-III стадии (предоперационное лучевое лечение)"
Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. № 715н "Об утверждении стандарта специализированной медицинской помощи при новообразованиях головного мозга и мозговых оболочек"
Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. № 716н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях костей I - IV стадии (самостоятельная лучевая терапия)"
Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. № 717н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях шейки матки IA2-III стадии (предоперационная химиолучевая терапия)"
Категория возрастная: взрослые
Пол: любой
Фаза: первичный процесс
Стадия: I-IV (Т любая N любая М1)
Осложнения: без осложнений
Вид медицинской помощи: специализированная медицинская помощь
Условия оказания медицинской помощи: стационарно
Форма оказания медицинской помощи: плановая
Средние сроки лечения (количество дней): 18
Код по МКБ X *(1)
Нозологические единицы
С43 Злокачественная меланома кожи
С79.2 Вторичное злокачественное новообразование кожи
Приказ Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. № 1099н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях тела матки IBG3, ICG (любая) стадии (послеоперационная сочетанная лучевая терапия после
Приказ Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. № 1128н "Об утверждении стандарта специализированной медицинской помощи детям при хронических вирусных гепатитах (в дневном стационаре)"
Приказ Министерства здравоохранения Российской Федерации от 29 декабря 2012 г. № 1660н "Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях костей I-IV
Категории: приказ стандарты МКБ Х.
Обзор хромосомных аномалий (Overview of Chromosomal Anomalies)
Хромосомные аномалии являются причиной различных расстройств. Аномалии, которые затрагивают аутосомы (22 парные хромосомы, одинаковые у мужчин и женщин), встречаются чаще, чем вовлекающие половые хромосомы (X и Y).
Хромосомные аномалии подпадают под различные категории, но в широком смысле могут рассматриваться как численные или структурные.
Численные аномалии включают в себя:
Трисомию (дополнительная хромосома)
Моносомию (отсутствие хромосомы)
Структурные аномалии включают в себя:
Транслокации (аномалии, при которых целая хромосома или сегменты хромосом неправильно объединяются с другими хромосомами)
Делеции и дупликации различных частей хромосом;
Терминология
Для описания хромосомных аномалий важны некоторые специфические термины из области генетики:
Анеуплоидия: наиболее распространенная хромосомная аномалия, вызвана дополнительной или недостающей хромосомой.
Кариотип: Полный набор хромосом в клетках человека.
Генотип: Генетическая конституция, определяемая кариотипом.
Диагностика хромосомных аномалий
Хромосомный анализ (кариотипирование)
Дифференциальное окрашивание хромосом
Флуоресцентная гибридизация in situ (FISH)
Хромосомный микроматричный анализ (матричная сравнительная геномная гибридизация)
Для хромосомного анализа обычно используют лимфоциты, за исключением пренатального исследования, при котором используют амниоциты или клетки плацентарных ворсинок хориона (см. Амниоцентез Амниоцентез Генетическая оценка является частью рутинного пренатального наблюдения, в идеале выполняется до зачатия. Объем исследований, включенных в генетическую оценку, зависит от того, как женщина оценивает. Прочитайте дополнительные сведенияНекоторые методы используют для более четкой характеризации хромосом
При классическом бэндинге (например, G [Гимзе]-, Q [флуоресцентном]- и C-бэндинге) краситель используют для окрашивания полос на хромосомах.
При хромосомном анализе высокого разрешения используют специальные культуральные методы, чтобы получить высокий процент клеток в профазе и прометафазе. Хромосомы при этом менее конденсированы, чем при рутинном анализе метафазы, и число выявляемых полос увеличивается, что позволяет проводить более чувствительный кариотипический анализ.
При спектральном кариотипическом анализе (также называется хромосомой живописи) используют методы хромосом-специфичной многоцветной флуоресцентной гибридизации (FISH), которые улучшают выявление определенных дефектов, включая транслокации и инверсии.
Хромосомный микроматричный анализ (ХМА), или матриксная сравнительная геномная гибридизация (aCGH) является одноэтапным методом, позволяющим просканировать весь геном на наличие хромосомных количественных аномалий, включая увеличение (дупликацию) или уменьшение (делецию) хромосом, что может указывать на несбалансированную транслокацию. Микроматричный анализ однонуклеотидного полиморфизма (ОНП) обладает дополнительной способностью определять области гомозиготности, которая может наблюдаться в случаях, когда родители происходят от общих предков (кровное родство), а также тогда, когда имеется однородительская дисомия Однородительская дисомия Некоторые ситуации представляют аберрантное наследование, часто из-за изменения генов или хромосом. Однако, некоторые из этих изменений, такие как мозаичность, очень распространены, другие. Прочитайте дополнительные сведения (например, обе копии хромосом унаследованы от одного родителя вместо того, чтобы 1 копия - от матери и 1 копия - от отца). Важно отметить, что ХMA не обнаруживает сбалансированных перестроек (например, транслокаций, инверсий), которые не связаны с делециями или дупликациями.
Скрининг
В настоящее время доступны методы неинвазивного пренатального скрининга (НИПС). При НИПС свободные от клеток плода ДНК-последовательности, полученные из образца материнской крови, используются, главным образом, для пренатального скрининга трисомии 21 ( синдром Дауна Синдром Дауна (трисомия 21) Синдром Дауна является аномалией 21-й хромосомы, может проявляться нарушением умственного развития, микроцефалией, небольшим ростом и характерным внешним видом. Диагноз предполагают на основании. Прочитайте дополнительные сведения , а также, трисомии 18 Трисомия по 18 хромосоме Трисомия по 18 хромосоме вызывается дополнительной 18 хромосомой и, как правило, связана с умственной отсталостью, малым весом при рождении, а также различными врожденными аномалиями развития. Прочитайте дополнительные сведенияАвторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Острые лейкозы
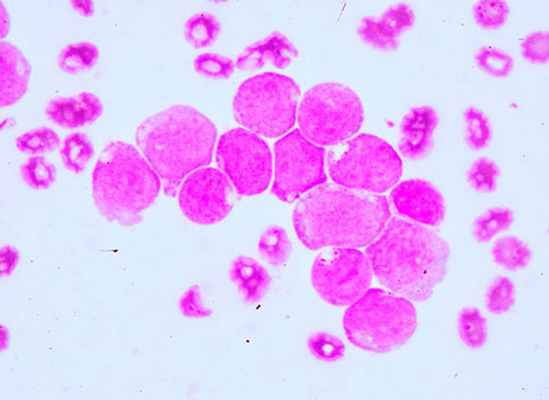
Лейкозы острые — это гетерогенная группа опухолевых заболеваний кроветворной системы, которые начинаются в костном мозге и характеризуются накоплением недифференцированных (бластных) клеток и подавлением нормальных ростков кроветворения. Заболеваемость острыми лейкозами — в среднем 3—5 первичных случаев на 100 000 человек в год. Острые лейкозы распространены повсеместно в разных странах, встречаются во всех возрастных группах, но у детей их удельный вес наибольший среди всех гемобластозов. Мужчины и женщины заболевают с равной частотой.
Классификация
Острые лейкозы классифицируют в зависимости от цитохимических и иммунофенотипических особенностей опухолевых клеток, выделяют:
-острые лимфобластные
-острые нелимфобластные лейкозы.
Современная классификация острых лейкозов предложена группой французских, американских и британских гематологов - FAB-классификация.
Предлейкоз — это доклиническая стадия острого лейкоза, при которой ограниченное количество бластов еще не вызывает явных клинических расстройств (МДС - миелодиспластические синдромы).
Клиника
Клиника развернутой стадии острого лейкоза: характерны нарастающая «беспричинная» слабость, недомогание, повышение Т°. Довольно часто геморрагический синдром: кровоточивость слизистых оболочек (десневые, носовые, маточные, кишечные кровотечения), петехиальная сыпь на коже, в первую очередь голеней, реже наблюдается гематурия и еще реже — кровоизлияние в мозг. Геморрагический синдром - нередко самое раннее проявление острого лейкоза.
При острых миеломнобластных лейкозах характерна гиперплазия десен, из-за которой больные часто впервые обращаются к стоматологу. Весьма характерны язвенно-некротические поражения слизистых оболочек ротовой полости (стоматит), глотки (ангина) и кишечника - некротическая энтеропатия, парапроктит и др.. что объясняется снижением уровня гранулоцитов крови. Начальные симптомы некротической энтеропатии - плеск и урчание при пальпации илеоцекальной зоны, кашицеобразный стул, легкое вздутие живота. В крови в большинстве случаев выявляются бластные клетки - уродливые, с деформированными нуклеолами, двухядерные; обычно много митозов. В костном мозге содержание бластов достигает иногда 95-99%. За счет бластов общий лейкоцитоз в крови иногда очень высок, изредка он в норме; известны и лейкопенические варианты дебюта острого лейкоза. При кариологическом исследовании в бластных клетках обнаруживаются хромосомные аномалии необычное число хромосом, аберрации и т.д.). Анемия при остром лейкозе нередко наступает позднее, чем тромбоцитопения и агранулоцитоз, она объясняется как кровотечениями, так и бластозом в костном мозге. Симптомы анемии весьма типичны для острого лейкоза; обычно малокровие носит нормохромный или гипохромный характер.
Первыми проявлениями острого лейкоза может быть также «беспричинный» субфебрилитет, изолированное увеличение лимфоузла, увеличение селезенки, лейкопения, тромбоцитопения, упорные боли в суставах и др. Увеличение лимфоузлов, печени и селезенки в начале развернутой стадии встречается не всегда, но с течением времени развивается у многих больных острым лейкозом. Болезненность костей выявляется лишь при большой массе лейкозных клеток, т.е. в уже запущенных случаях острого лейкоза. Опыт показывает, что даже при высоком бластозе в крови и костном мозге у пациента может сохраняться достаточный уровень гемоглобина, тромбоцитов и нейтрофилов, и общее состояние остается удовлетворительным (пациент даже отказывается от дальнейшего обследования, утверждая, что он чувствует себя нормально). Обычно это наблюдается при остром лимфобластном лейкозе (изменения в крови выявляются при периодическом осмотре, диспансеризации и т.д.). Задача врача в этих случаях — убедить пациента и его родственников в неотложной необходимости обследования. В других случаях даже небольшой бластоз вызывает выраженную слабость, глубокую тромбоцитопению, анемию и гранулоцитопению. что сразу влечет клинические осложнения. При всех вариантах острого лейкоза наблюдаются те или иные нарушения в свертывающей системе крови, вплоть до ДВС-синдрома, особенно при большом содержании бластов, тем более атипичных промиелоцитов в крови.
ДВС-синдром влечет за собой кровоточивость, нередко летальную.
Острый лимфобластный лейкоз
Острый лимфобластный лейкоз (ОЛЛ) - злокачественная опухоль крови, возникающая в результате мутации на уровне клетки-предшественницы лимфопоэза. Этот тип лейкоза является самым частым онкогематологическим заболеванием у детей (они составляют около 85% всех случаев острых лейкозов). У взрослых острый лимфобластный лейкоз наблюдается в 25% случаев всех острых лейкозов. Учашение заболеваемости острыми лимфобластными лейкозами отмечается у детей в возрасте 2—4 года, затем у лиц в возрасте 50—60 лет.
Классификация: на основе светооптических характеристик лейкозных клеток выделяют три основных варианта ОЛЛ: LI, L2 и L3. У детей чаше наблюдается вариант LI, у взрослых - форма L2.
При иммунофенотипировании различают четыре варианта опухоли:
- пре-В-клеточный вариант,
- ранний пре-В-клеточный,
- Т-клеточный (около 15% всех случаев),
- зрелый В-клеточный (весьма редкий).
После уточнения варианта ОЛЛ, применяют наиболее подходящую лечебную схему и оценивают прогноз для жизни. Так, у детей с ранним пре-В-клеточным вариантом ОЛЛ прогноз достоверно лучше; зрелые В-клеточные острые лимфобластные лейкозы менее благоприятны прогностически, особенно у взрослых. Цитогенетические исследования обнаруживают хромосомные аберрации более чем у половины больных острыми лимфобластными лейкозами. Наиболее серьезный риск-фактор - наличие «филадельфийской» хромосомы. У детей с острым лимфобластным лейкозом эта транслокация встречается в 7% случаев, у взрослых — в 30% случаев. Ухудшает прогноз наличие высокого уровня сывороточной лактатдегидрогеназы в момент выявления ОЛЛ. Один из ведущих риск-факторов — это высокий лейкоцитоз. Отметим, что у больных старше 50 лет ремиссии ОЛЛ удается добиться реже, чем у пациентов более молодого возраста.
Клиническая симптоматика при острых лимфобластных лейкозах: в начале заболевания обычно жалоб нет, или они весьма скудные — умеренная слабость и утомляемость, иногда бледность кожных покровов. В развернутой стадии ОЛЛ может наблюдаться лихорадка, геморрагические явления, малокровие и др. Однако анемизация и геморрагический диатез выражены значительно менее, чем при острых нелимфобластных лейкозах. При острых лимфобластных лейкозах увеличение печени наблюдается не всегда. У молодых больных острыми лимфобластными лейкозами возможна умеренная диффузная лимфоаденопатия. Первыми проявлениями острого лейкоза может быть также «беспричинный» субфебрилитет, бледность кожи и слизистых оболочек, кровоточивость десен, обильные менструации, изолированное увеличение лимфоузла, упорные боли в суставах и др. Почти всегда наблюдается слабость, утомляемость, потливость. Нередко отмечаются рецидивирующие ЛОР-инфекции, герпес. Болезненность костей выявляется лишь при большой массе лейкозных клеток, т.е. в уже запущенных случаях острого лейкоза. Даже при высоком бластозе в крови и костном мозге у пациента может сохраняться достаточный уровень гемоглобина, тромбоцитов и нейтрофилов. и общее состояние остается удовлетворительным.
Диагностика: поскольку специфичных симптомов при острых лейкозах не существует, диагноз устанавливают только после морфологического исследования крови и костного мозга. Появление даже единичных бластных клеток в периферической крови (гемограмма) требует безотлагательного исследования костного мозга (стернальная пункция).
Принципы лечения: госпитализация в гематологический стационар.
Химиотерапия, поспешно начатая в амбулаторных условиях, полностью исключает возможность последующего излечения пациента даже в условиях гематологического центра. Не рекомендуется начинать цитостатическое лечение в амбулаторных условиях, иногда однократное введение цитостатиков или глюкокортикостероидов до неузнаваемости меняет клиническую и гематологическую картину, и в дальнейшем не позволяет поставить правильный диагноз.
Лечение острых лейкозов предполагает:
- индукцию ремиссии,
- консолидацию полученной ремиссии,
- поддерживающую терапию,
- а также профилактику нейролейкемии.
Применяют патогенетическое лечение острого лейкоза с целью достижения полной клинико-гематологической ремиссии. В настоящее время общепринят метод интенсивной комбинированной длительной цитостатической терапии острого лейкоза (тотальная терапия).
Нелимфобластные острые лейкозы
Нелимфобластные острые лейкозы - эти варианты лейкозов возникают в результате мутации одной из миелоидных клеток-предшественников. Преобладают среди лейкозов взрослых.
В группе острых миелоидных лейкозов выделяют следующие формы заболевания:
МО-острый миелобластный лейкоз, при котором бластные клетки имеют минимальные признаки дифференцировки;
M1-2—острый миелобластный лейкоз с наличием клеток разной степени зрелости;
МЗ—острый промиелоцитарный лейкоз;
М4- острый миеломонобластный лейкоз;
М5—острый монобластный лейкоз;
М6—острый эритролейкоз;
М7- острый мегакариобластный лейкоз.
Острый миелобластный (ОМЛ) и миеломонобластный лейкозы (ОММЛ) встречаются чаще всего: среди нелимфобластных острых лейкозов взрослых эти формы составляют ок. 80%. Возрастные пики острого миелобластного и миеломонобластного лейкоза наблюдаются в возрасте до 1-2 лет, затем - в 38 лет (ОМЛ) и в 50 лет (ОММЛ). Клиника: характерно острое начало болезни с высокой лихорадкой, некрозами в горле (при глубокой первичной гранулоцитопении); часто бывают боли в костях, малокровие, геморрагические явления, которые обусловлены не только тромбоцитопенией, но и ДВС-синдромом. Наблюдается кровоточивость слизистых оболочек (десневые, носовые, маточные, кишечные кровотечения), петехиальная сыпь на коже, в первую очередь голеней, реже наблюдается гематурия и еще реже — кровоизлияние в мозг. Геморрагический синдром - нередко самое раннее проявление острого нелимфобластного лейкоза. Увеличение селезенки при остром миелобластном и миеломонобластном лейкозе умеренное. Весьма характерны язвенно-некротические поражения слизистых оболочек ротовой полости (стоматит, гиперпластический гингивит с кровоточивостью), глотки (ангина) и кишечника - некротическая энтеропатия, парапроктит и др., что объясняется снижением уровня гранулоцитов крови. Начальные симптомы некротической энтеропатии: плеск и урчание при пальпации илеоцекальной зоны, кашицеобразный стул, легкое вздутие живота, высокая лихорадка. Прогноз: средняя частота первых ремиссий при остром миелобластном и миеломонобластном лейкозах при современной терапии достигает 60%. Продолжительность первой ремиссии превышает 2 года. Онкологическое выздоровление наблюдается у 10% больных всех возрастов.
Редкие формы острых лейкозов
Макрофагальный острый лейкоз - важнейший и постоянный его клинический признак - высокая асептическая лихорадка, иногда с ознобами. Часто наблюдается гепатоспленомегалия. Бластная инфильтрация печени часто осложняется желтухой.
Мегакариобластный острый лейкоз - клиническая картина сходна с другими острыми лейкозами, в крови и костном мозге наряду с недифференцируемыми бластными клетками присутствуют и мегакариобласты.
Миелодиспластические синдромы (МДС) — гетерогенная группа гемопатий, куда входят разнообразные заболевания неодинаковой природы, сопровождающиеся как значительными изменениями костного мозга, так и его функциональными нарушениями, часто трансформирующиеся в высокобластные острые лейкозы. Разнообразные гемопатии, объединенные экспертами ВОЗ в группу под общим названием МДС, имеют общую причину - повреждение клеток на уровне, близком к стволовой кроветворной клетке. В отличие от других гемобластозов, при МДС клеточный апоптоз сохранен или усилен, что и формирует периферическую би/пан/цитопению на фоне гиперплазии костного мозга.
Преобладающим симптомом является малокровие. Часть гемопатий. входящих в этот «сборник», иногда называют предлейкозом. Современные данные показывают, что предлейкоз - это доклиническая стадия острого лейкоза, при которой ограниченное количество бластов еще не вызывает явных клинических расстройств. Гематологическими признаками формирующегося острого лейкоза являются: нарастающая анемия без ретикулоцитоза; «необъяснимые» гранулоцитопении; «беспричинный» моноцитоз без явной гиперплазии костного мозга в трепанате; хронический нерезко выраженный аутоиммунный гемолиз, немногочисленные очаги гиперплазии в трепанате костного мозга (через несколько лет возможна трансформация в острый лейкоз). Варианты МДС отмечаются в основном у лиц пожилого возраста (старше 60 лет). Характерна слабость, потливость, утомляемость, одышка. Умеренное увеличение печени и селезенки наблюдается только при варианте ХММЛ: лимфоузлы как правило в норме. Лейкозы, развившиеся из миелодиспластических синдромов, отличаются меньшей чувствительностью к терапии, чем первичные острые нелимфобластные лейкозы.
Монобластный острый лейкоз наблюдается весьма редко. Клиническая картина этой формы лейкоза напоминает острый миелобластный лейкоз, однако, в этой форме значительнее выражены интоксикация и гипертермия, чаще наблюдаются некротические изменения слизистой оболочки рта и глотки. Весьма характерна лейкемическая инфильтрация десен, ведущая к гипертрофии сосочков («лейкемический гингивит»). Нередко развивается инфильтрация миндалин и десен, а на поздних этапах прогрессии возникают опухолевые пролифераты во всех внутренних органах, лейкемиды кожи и т.д.
Плазмобластный острый лейкоз отмечается во всех возрастах, в т.ч. у молодых лиц и у детей, характерно острое клиническое течение. Наблюдается увеличение лимфоузлов, селезенки, печени. В сыворотке крови выявляется М-градиент - моноклональный иммуноглобулин (парапротеин).
Промиелоцитарный острый лейкоз - довольно редко встречается - не более 7% всех острых лейкозов. Прежде это заболевание отличалось тяжелейшим прогнозом (массивная кровопотеря или геморрагический инсульт уже в первые недели от момента диагностики), а теперь - это одна из наиболее курабельных форм, при которой наблюдается «онкологическое» излечение на фоне дозревания лейкозных бластов до нормальных форм.
Эритромиелоз острый, эритробластный острый лейкоз, болезнь Ди Гульельмо - редкая форма острого лейкоза. В анамнезе больных острым эритромиелозом часто встречается лучевая или химиотерапия; нередко выявляется как вторичный лейкоз у лиц, пролеченных по поводу лимфогранулематоза, миеломной болезни, эритремии.
Острый миелобластный лейкоз
Под ред.: Киргизова К.И., Заместителя директора (НИИ ДОиГ ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России) по научной и образовательной работе, врач-детский онколог, ведущий научный сотрудник, к.м.н.
Острый миелоидный лейкоз (ОМЛ) у детей занимает 2-е место среди всех детских лейкемий. Что представляет собой и как проявляется миелобластный лейкоз? Как он лечится и какие могут быть прогнозы? Разбираемся подробно.
Что такое ОМЛ?
ОМЛ – это рак крови, злокачественная трансформация миелоидного ростка крови, которая ведет к быстрому размножению измененных белых кровяных клеток. ОМЛ у детей составляет около 20 % всех случаев острых лейкозов и около 6 % всех детских онкологических заболеваний.
Этиология и патогенез (механизмы возникновения и развития) миелоидного лейкоза связаны с многоэтапными мутациями так называемых гемопоэтических клеток-предшественниц. Это клетки системы кроветворения, из которых потом получаются все остальные виды клеток крови – в том числе, эритроциты, тромбоциты и лейкоциты.
При ОМЛ мутировавшие клетки быстро размножаются и вытесняют собой здоровые, вызывая симптомы миелоидной лейкемии.
Формы ОМЛ
Диагноз «миелобластный лейкоз» у детей устанавливается при обнаружении в костном мозге или в периферической крови более 20 % бластных (незрелых) клеток. Существует несколько разновидностей классификации ОМЛ – в зависимости от типов нарушений, генетических мутаций или степени созревания миелобластов.
- ОМЛ с устойчиво выявляемыми генетическими аномалиями;
- ОМЛ с изменениями, связанными с миелодисплазией;
- Миелоидные неоплазии, связанные с предшествующей химиотерапией;
- ОМЛ, по-другому не специфицированные (NOS);
- Миелоидная саркома (экстрамедуллярная миелоидная опухоль; гранулоцитарная);
- Саркома, хлорома;
- Миелоидные опухоли, связанные с синдромом Дауна;
- Опухоль из плазмацитоидных дендритных клеток;
- Острые лейкозы неопределенной линии дифференцировки.
- C92.0 ОМЛ.
- C92.3 Миелоидная саркома (хлорома, гранулоцитарная саркома).
- C92.4 Острый промиелоцитарный лейкоз.
- C92.5 Острый миеломоноцитарный лейкоз.
- С92.6 Острый миелоидный лейкоз с 11q23-аномалией.
- C92.7 Другой миелоидный лейкоз.
- С92.8 Острая миелоидная лейкемия с мультилинейной дисплазией.
- C92.9 Миелоидный лейкоз неуточненный.
- С93.0 Острый моноцитарный лейкоз.
- C94.0 Острая эритремия и эритролейкоз.
- C94.2 Острый мегакариобластный лейкоз.
Симптомы ОМЛ у детей
Клинические проявления миелогенной лейкемии достаточно неспецифичны, их можно спутать с рядом других болезней. Поэтому очень важно проводить дифференциальную диагностику ОМЛ с заболеваниями кроветворной и иммунной систем, другими видами лейкоза.
- анемия (частая/постоянная усталость, вялость, бледность);
- кожный геморрагический синдром («беспричинные» синяки, лопнувшие капилляры и т. д.);
- регулярно возникающая интоксикация и лихорадка, частые инфекционные заболевания;
- увеличение печени, селезенки и лимфатических узлов.
Факторы риска для ОМЛ
Точные причины возникновения и развития ОМЛ до сих пор не установлены, однако можно дать осторожный прогноз относительно того, какие дети находятся в зоне риска:
- врожденная агаммаглобулинемия (болезнь Брутона);
- атаксия-телеангиоэктазия (синдром Луи-Бар);
- анемия Даймонда–Блекфана;
- анемия Фанкони;
- синдром Дауна;
- синдром Ли-Фраумени;
- синдромы репарации неспаренных оснований;
- нейрофиброматоз 1-го типа;
- синдром Нунан;
- синдром Блума;
- синдром Швахмана–Даймонда.
Диагностика ОМЛ
Непосредственно диагноз ОМЛ устанавливается и подтверждается с помощью различных исследований лейкемических клеток крови и других методов диагностики. Далее мы расскажем о них подробнее.
Обследование при ОМЛ
- признаки анемии;
- наличие жара и лихорадки;
- проявления геморрагического синдрома на коже и слизистых;
- лейкемическую инфильтрацию (уплотнения) кожи;
- неврологический статус.
Анализы крови при ОМЛ
Одним из базовых исследований, необходимых для диагностики ОМЛа, является общий клинический анализ крови. При его выполнении необходимо исследовать уровень гемоглобина, количество эритроцитов, тромбоцитов и лейкоцитов. Лейкоцитарная формула при таком анализе обязательно должна быть подсчитана вручную, автоматического подсчета недостаточно.
Дополнительно могут быть назначены биохимический анализ крови и коагулограмма. Показатели этих анализов крови позволят оценить степень распространения ОМЛ, сопутствующие патологии и тактику лечения.
Аспирация (пункция) костного мозга
Забор пункции костного мозга – это рутинная процедура, без которой невозможно представить полную диагностику ОМЛ. Она производится, как правило, под общей анестезией и позволяет получить достаточное количество препаратов (образцов) костного мозга.
На основе данных после аспирации костного мозга будет проводиться большинство дальнейших исследований.
Цитологическое исследование
Миелограмма или цитологическое исследование мазка костного мозга – это лабораторное исследование, при котором оценивают морфологическую структуру клеточных элементов. Именно на этом этапе подсчитывают количество бластных (незрелых) клеток в мазке. Если их более 20 %, то ставят диагноз ОМЛ.
Также выполняются цитологическое и цитохимическое исследования костного мозга. Цитохимия позволяет подтвердить факт ОМЛ и определить его клеточную дифференцировку (подтип).
Иммунофенотипирование
Это исследование позволяет определить принадлежность бластных клеток и, соответственно, подтвердить диагноз ОМЛ. Оно также выполняется на клетках костного мозга с помощью специальной системы флуоресцентных меток, присоединенных к антигенам клеток.
Цитогенетическое и молекулярно-генетическое исследования
Они выполняются при первичной диагностике ОМЛ, а также при подтвержденном рецидиве заболевания.
Цитогенетическое (кариотип) и молекулярно-генетическое исследования позволяют выявить хромосомные аномалии и уточнить подгруппу ОМЛ.
Это особенно важно, так как ученые доказали прямую связь между количеством и типом хромосомных аномалий и прогнозом выживаемости у пациентов с ОМЛ.
Существует также молекулярно-цитогенетическое (FISH-метод) исследование, которое дает возможность подтвердить эту информацию и подобрать максимально точную терапию. В ряде случаев на основе этих исследований может быть подобран препарат для таргетной терапии.
Спинномозговая пункция
Спинномозговая (люмбальная) пункция – это забор спинномозговой жидкости, который осуществляется путем прокола оболочки спинного мозга специальной иглой в области поясницы.
Анализ этой жидкости позволяет оценить степень вовлечения центральной нервной системы – диагностировать нейролекемию или ее отсутствие.
В целом при ОМЛ центральная нервная система оказывается затронутой менее чем в 5 % случаев. Однако в клинических рекомендациях данная процедура является обязательной в том случае, если ее позволяет осуществить уровень тромбоцитов и лейкоцитов у пациента.
Компьютерная томография, магнитно-резонансная томография и ультразвуковое исследование
Данные процедуры выполняются как до начала терапии, так и в ходе лечения. Компьютерная и магнитно-резонансная томографии головного мозга и грудной клетки позволяют определить изменения в структурах мозга, легочной ткани и расположенных рядом органах. Ультразвуковое исследование органов брюшной полости, малого таза, а также яичек (у мальчиков) помогает оценить размеры соответствующих органов, печени, селезенки и лимфатических узлов.
Лечение ОМЛ
В основе лечения ОМЛ у детей лежит метод интенсивной полихимиотерапии – комбинированное сочетание различных препаратов. При необходимости химиотерапию дополняют трансплантацией гемопоэтических стволовых клеток. Ниже мы раскроем суть этих методов.
Химиотерапия при ОМЛ
Эффективность химиотерапии при лечении ОМЛ зависит от 2 важнейших факторов: специфичности (точности подбора) препаратов и адекватности сопроводительного лечения.
Обычно при ОМЛ применяется комбинация цитостатических препаратов, которые вводятся внутривенно или интратекально (в спинномозговой канал).
Действие цитостатиков направлено на подавление роста, развития и распространения злокачественных клеток крови. Для лечения ОМЛ эффективно применяется сравнительно небольшое количество препаратов, поэтому в настоящее время в медицине идут активные поиски средств для таргетной терапии.
Таргетная терапия
В целом суть таргетной терапии заключается в прицельном воздействии на раковые клетки. В отличие от традиционной химиотерапии, которая «бьет» широким кругом по всем клеткам крови, таргетная терапия здоровые клетки не затрагивает. Она действует точечно, разрушая именно лейкозные клетки конкретного типа и подгруппы.
В случае с ОМЛ таргетная терапия пока носит скорее экспериментальный характер, и в широкой практике для большинства типов ОМЛ не применяется. Однако именно с этим методом и его дальнейшим развитием специалисты связывают большие надежды на критическое улучшение средних прогнозов выживаемости при ОМЛ.
Трансплантация гемопоэтических стволовых клеток
Трансплантация гемопоэтических клеток (ТГСК), также известная как трансплантация костного мозга, это замена злокачественных лейкозных клеток пациента здоровыми кроветворными клетками донора. Она проводится для пациентов группы высокого риска при достижении первой ремиссии. Для такой трансплантации подходят HLA-совместимые родственные или неродственные доноры.
Пациентам из группы промежуточного риска ТГСК назначают в индивидуальном порядке, обычно при наличии HLA-геноидентичного сиблинга (брата или сестры с нужными параметрами генов)
Также ТГСК показана детям с рецидивами ОМЛ и рефрактерным (не отвечающим на химиотерапию) течением болезни.
Лучевая терапия
При лечении ОМЛ у детей к лучевой терапии прибегают достаточно редко. Согласно российским клиническим рекомендациям краниальную лучевую терапию (т. е., облучение головного мозга) назначают детям старше 3 лет, у которых диагностировано первичное поражение центральной нервной системы, не отвечающее на лечение с помощью химических препаратов.
Этапы лечения ОМЛ
Базовые этапы лечения ОМЛ включают в себя 2 основные фазы: индукцию и консолидацию.
Индукция
Курс индукции заключается в применении базовой комбинации препаратов, эффективных в отношении ОМЛ. Он направлен на достижение ремиссии и восстановление гемопоэза – процесса нормального образования, развития и созревания здоровых клеток крови.
Дозировка препаратов и продолжительность курса подбираются индивидуально при соблюдении основного принципа лечения острых лейкозов: максимум эффективности при минимуме токсичности.
Консолидация
Консолидирующая терапия – это короткая (не более 3 курсов) фаза, в ходе которой специалисты стремятся уничтожить оставшиеся после этапа индукции раковые клетки. Это необходимо для достижения стойкой ремиссии и уменьшения рисков возникновения рецидива. Как раз после завершения фазы консолидации при необходимости проводят ТГСК.
Поддерживающая терапия
Необходимость этого этапа при лечении ОМЛ в данный момент является предметом дискуссий в медицинской среде. В настоящее время назначение поддерживающей терапии при ОМЛ обсуждают в каждом случае индивидуально, взвешивая пользу и риски для конкретного пациента.
Прогноз при ОМЛ у детей
Важно понимать, что в онкологии понятие «прогноз» отличается от привычного для обычной аудитории понятия «продолжительность жизни». Задача медицины – не отвечать на вопрос «Сколько живут люди с данным диагнозом?», а давать прогностические риски, от которых будут зависеть, в том числе, выбор терапии и тактика ведения пациента.
Так, в зависимости от результатов исследования кариотипа и установления точных хромосомных аномалий всех детей с ОМЛ делят на 3 основные группы: благоприятного, промежуточного и неблагоприятного прогноза. От того, в какую группу попадет пациент, зависит тактика лечения, подбор дозировок химиотерапии, возможность применения таргетной терапии и необходимость проведения ТГСК.
Выживаемость детей с острым промиелоцитарным лейкозом доходит до 80–90 %. При этом ученые проводят клинические исследования и разрабатывают новые методы лечения ОМЛ.
Вероятность рецидива ОМЛ
Под рецидивом ОМЛ понимают нахождение не менее 10 % лейкемических бластов в костном мозге или любые новообразования в области спинного мозга не менее чем через 1 месяц после установления первой полной ремиссии. К сожалению, рецидив ОМЛ случается у 40 % пациентов.
При терапии рецидивов прибегают к интенсивной высокодозной полихимиотерапии и ТГСК. Прогностические риски рассчитываются для каждого пациента индивидуально.Методов профилактики рецидива ОМЛ также не существует. Однако каждому пациенту, достигшему ремиссии, рекомендовано регулярное диспансерное наблюдение для контроля состояния и, в том числе, для ранней диагностики возможного рецидива болезни.
Последствия ОМЛ
- рецидив ОМЛ;
- рак, возникший в результате лечения ОМЛ;
- заболевания костей и желудочно-кишечного тракта;
- нарушения в работе сердечно-сосудистой и легочной систем;
- эндокринные заболевания;
- психологические и неврологические проблемы, включая нарушения сна, депрессию, сложности с планированием своих действий и др.
Читайте реальные истории детей, родителей и врачей, ведущих борьбу с лейкозом.
Источники
1. Национальное общество детских гематологов и онкологов. Клинические рекомендации «Острые миелоидные лейкозы», 2020.
Программа La Fondation La Roche-Posay (Ля Фондейшн Ля Рош Позэ) и CCI (Международная Ассоциация по борьбе с детским раком) прилагают все усилия, чтобы гарантировать, что предоставленная информация является точной и актуальной на момент публикации. Мы не несем ответственность за информацию, предоставленную третьими лицами, в т.ч. теми, на которых ссылаемся или выделили в данной публикации. Информацию в данной публикации следует использовать как дополнение к соответствующим профессиональным консультациям в ваших конкретных обстоятельствах.
Эритремия (болезнь Вакеза-ослера)
Истинная и относительная форма эритремии. Распространенность заболевания, этиология и основные признаки болезни. Лабораторные данные, течение и прогноз. Гематологические изменения при истинной эритремии. Причины возникновения вторичной эритремии, лечение.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 05.12.2010 |
| Размер файла | 15,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Содержание
Введение
1. Классификация полицитемий
4. Клинические проявления
5. Лабораторные данные
6. Течение и прогноз
Введение
Эритремия (Полицитемия Истинная, Полицитемия Красная Истинная, Болезнь Вакеза-ослера) впервые описанная в начале XIX столетия, характеризуется увеличением числа эритроцитов, уровня гемоглобина и общего объема эритроцитов (ООЭ).
Существует две основные формы эритремии -- истинная и относительная. Масса эритроцитов увеличивается только при истинных эритремиях.
Это явление наблюдается в двух ситуациях: при первичной истинной эритремии и при вторичной эритремии. Последняя обычно возникает в результате повышения активности эритропоэтина, что может быть следствием как соответствующей физиологической реакции на сниженное насыщение крови кислородом, так и неадекватной продукции гормонов.
При относительной эритремии масса эритроцитов не превышает нормальный уровень, а увеличение ООЭ является следствием аномального снижения объема плазмы или же увеличения числа эритроцитов и снижения объема плазмы в пределах нормальных значений этих параметров.
1. Классификация полицитемий
- хроническое заболевание легких;
- заболевание почек -- например, опухоли, кисты (единичные или множественные), гидронефроз;
- опухоли -- например, гемангиома мозжечка, фиброма матки;
- другие причины -- например, подъем на высоту, аномальные гемоглобины, курение.
Относительная эритремия (называется также ложной, стрессовой, эритремией, синдромом Гайсбека).
Истинная полицитемия. Истинная эритремия -- хроническое прогрессирующее миелопролиферативное заболевание, которое характеризуется абсолютным увеличением массы эритроцитов; у 2/3 больных наблюдается также увеличение числа лейкоцитов и тромбоцитов.
2. Этиология
эритремия заболевание гематологический
Заболевание возникает в результате мутации полипотентной стволовой клетки. Исследования костного мозга in vitro, а также изучение вариантов глюкозо-6-фосфатдегидрогеназы у женщин, больных истинной эритремией, указывают на присутствие при этом заболевании двух популяций эритроидных клеток-предшественников.
Клетки одной из популяций автономны и пролиферируют даже в отсутствие эритропоэтина, тогда как другая популяция ведет себя нормально, оставаясь эритропоэтинзависимой. Таким образом, первая популяция скорее всего представляет собой автономный мутантный клон [Adamson, 1970; Golde, 1977].
Уровни эритропоэтина в моче и плазме больных истинной полицитемией колеблются от нормальных величин до нуля, увеличиваясь соответствующим образом после кровопускания.
Низкие уровни эритропоэтина обусловлены ингибицией его выработки по типу обратной связи вследствие увеличения эритроцитарной массы.
3. Распространенность
Истинная полицитемия -- редкое заболевание. Американские исследователи показали, что ежегодно регистрируется 4-5 новых случаев на 1 млн. населения.
Болезнь поражает людей среднего и пожилого возраста, пик заболеваемости приходится на возрастную группу 50-60 лет. Средний возраст впервые заболевших постепенно увеличился с 44 лет в 1912 г. до 60 лет в 1964 г. Мужчины болеют несколько чаще, чем женщины (1,5: 1).
Влияние расовых факторов спорно. Modan (1965) обнаружил, что среди евреев заболеваемость выше ожидаемой, а среди негров ниже, однако эти наблюдения не были подтверждены.
4. Клинические проявления
Симптомы этой болезни обусловлены отчасти избыточной продукцией эритроцитов и тромбоцитов, что приводит к увеличению вязкости крови и сосудистым тромбозам, а отчасти увеличением объема циркулирующей крови, которое приводит к повышению кровенаполнения различных органов.
Болезнь развивается исподволь, причем настолько медленно, что диагноз может быть поставлен случайно при обследовании пациента по поводу совсем другой болезни.
Симптомы часто неспецифичны, например головная боль, головокружения, шум в ушах, рассеянность, раздражительность, ухудшение зрения, их легко можно объяснить преклонным возрастом или другими, чаще встречающимися у пожилых заболеваниями.
Однако эритремия может быть заподозрена по внешнему виду пациента -- красный цвет кожи и слизистых оболочек с цианотичным оттенком в холодную погоду, телеангиэктазии на лице, гиперемия склер и сетчатки. Селезенка в большинстве случаев умеренно увеличена, печень, как правило, увеличена незначительно. Иногда отмечается болезненность в области грудины.
Основные признаки болезни проявляются при возникновении тромбозов или, что бывает реже, кровотечений. Чаще всего поражаются сосуды центральной нервной системы, что приводит к возникновению транзиторных ишемических нарушений, цереброваскулярных катастроф и нарушений зрения в виде скотомы, диплопии и временной слепоты.
В результате поражения сердечно-сосудистой системы могут возникать одышка при физической нагрузке, стенокардия и инфаркт миокарда. Поражения периферических сосудов проявляются эритромелалгией, артериальными и венозными тромбозами, феноменом Рейно и даже гангреной.
При нарушении кровоснабжения желудочно-кишечного тракта возникают изменения пищеварения, метеоризм, а у 1 из 10 больных -- пептические язвы. Тромбоз системы портальных вен приводит к портальной гипертензии и кровотечениям из варикозных вен пищевода.
Примерно у 1 из 10 больных, обычно мужчин, обнаруживаются клинические признаки подагры, тогда как гиперурикемия наблюдается у 1/3 всех больных и обусловлена усиленным синтезом и разрушением нуклеопротеидов.
Частота этих осложнений возрастает по мере увеличения длительности заболевания. В почках могут образовываться камни, а в суставах -- подагрические отложения. В семейном анамнезе таких больных подагра отмечается редко.
Примерно 2/3 больных страдают генерализованным зудом, который возникает, по-видимому, в результате выделения гистамина из базофильных гранулоцитов. Особенно мучителен зуд кистей рук и стоп, он усиливается после мытья и в теплой постели.
5. Лабораторные данные
Число эритроцитов увеличено до 6,5-7,5·1012/л. Уровень гемоглобина повышен до 180-240 г/л. ООЭ обычно выше 0,52. Поскольку на основании измерения гемоглобина, ООЭ и числа эритроцитов точно рассчитать массу эритроцитов невозможно, ее следует измерять прямым способом с применением радионуклидной метки.
Масса эритроцитов, превышающая 36 мл/кг у мужчин и 32 мл/кг у женщин указывает на наличие полицитемии.
В мазке периферической крови эритроциты имеют нормальную морфологию, однако из-за часто встречающегося дефицита железа, обусловленного повторными кровопусканиями или кровоточивостью, может наблюдаться микроцитоз. Число лейкоцитов увеличено до 12-30·109/л примерно у 2/3 больных, более высокий лейкоцитоз встречается на поздних стадиях болезни.
Иногда наблюдается незначительный сдвиг лейкоцитарной формулы влево, изредка в периферической крови обнаруживаются метамиелоциты, миелоциты или даже клетки более ранних стадий.
Активность щелочной фосфатазы лейкоцитов (ЩФЛ) увеличена. У 70-90 % больных активность ЩФЛ достигает 100-350, однако в некоторых случаях, особенно на ранних стадиях болезни, она остается в пределах нормы.
Содержание тромбоцитов в момент постановки диагноза повышено у 65 % больных и достигает 400-800·109/л. Очень редко наблюдаются и гораздо более высокие величины.
Иногда обнаруживаются морфологические и функциональные аномалии. Тромбоциты могут быть увеличены в размерах и иметь причудливую форму; иногда наблюдаются фрагменты мегакариоцитов.
Функциональные нарушения тромбоцитов, вероятно, являются основной причиной геморрагических осложнений, встречающихся при этой болезни.
Содержание витамина Bj2 в сыворотке и ее способность связывать этот витамин часто повышены.
Костный мозг гиперплазирован. Эритропоэз нормобластный. Края нормобластов могут быть зазубрены, а цитоплазма вакуолизирована, что особенно часто встречается у пациентов, леченных кровопусканиями, и свидетельствует о дефиците железа.
Выявляемое методами окраски свободное железо может совершенно отсутствовать.
Иногда обнаруживается гиперплазия и предшественников гранулоцитарного ряда, а также увеличение числа мегакариоцитов. Основные гематологические признаки истинной полицитемии суммированы в табл. 1.
Таблица 1 - Гематологические изменения при истинной эритремии
У больных истинной эритремией описаны хромосомные аномалии, которые, однако, встречаются нечасто.
Кроме того, многие пациенты получают миелодепрессивную терапию, и поэтому трудно определить, в какой мере эти аномалии обусловлены лечением и в какой -- самой болезнью.
6. Течение и прогноз
В течении заболевания различают три фазы. В начальной фазе, длящейся несколько лет, симптомы отсутствуют или выражены слабо.
В следующей эритремической фазе развиваются классические симптомы и основные осложнения. Именно в этой фазе, которая также может продолжаться несколько лет, умирает большая часть больных.
Затем наступает третья фаза, характеризующаяся возникновением миелосклероза или реже -- лейкоза. Частота лейкозов выше среди больных, получавших алкилирующие препараты, и, возможно, также у леченных радиоактивным фосфором.
Срок выживаемости при адекватном лечении значительно удлинился, особенно это касается молодых пациентов.
Средняя продолжительность жизни от момента постановки диагноза составляет 13 лет. Основной причиной смерти остаются сосудистые осложнения.
Независимо от вида терапии прогноз наиболее неблагоприятен у больных пожилого возраста, а также в случаях возникновения тяжелых осложнений.
7. Лечение
Целью лечения является уменьшение вероятности возникновения сосудистых осложнений путем снижения ООЭ и поддержания его на оптимальном уровне, а также борьбы с сопутствующим тромбоцитозом. Существующие способы достижения этой цели противоречивы и будут оставаться таковыми до тех пор, пока не удастся решить вопрос о том, что в картине заболеваний обусловлено самим его течением, а что является следствием ранее проводившегося лечения.
Быстрое симптоматическое улучшение достигается в результате кровопускания. Эту процедуру у больных пожилого возраста следует проводить с большой осторожностью, помня о том, что такие больные часто страдают цереброваскулярными и сердечно-сосудистыми болезнями. Рекомендуется дважды в неделю удалять по 200-300 мл крови до тех пор, пока ООЭ не снизится до желаемого уровня.
Поскольку риск возникновения сосудистых поражений сохраняется и при незначительном увеличении ООЭ, следует добиваться снижения этого показателя до 0,45. В тех случаях, когда уменьшение объема крови представляется опасным, вместо удаленной крови можно ввести равный объем высокомолекулярного декстрана.
Проведя начальный курс лечения, необходимо наблюдать за скоростью роста ООЭ. Если она невелика, и больной лишь изредка нуждается в кровопусканиях, то вплоть до возникновения проблем, связанных с тромбоцитемией, никакого иного лечения не требуется.
Следует иметь в виду, что кровопускания приводят к развитию железодефицитной анемии, которая сама по себе сопровождается соответствующими симптомами и увеличением содержания тромбоцитов.
Поддерживать на необходимом уровне количество эритроцитов с помощью кровопусканий удается не всегда, поскольку они не подавляют продукцию этих клеток в костном мозге. В таких случаях приходится прибегать к миелодепрессивной терапии.
К сожалению, проведение лекарственной терапии у пожилых может быть связано со значительными трудностями практического порядка, а также с проблемами, касающимися соблюдения больными назначенного лечения. В связи с этим желательно начинать лечение с внутривенного введения 32Р в дозе 185-259 МБк. Для достижения максимального эффекта такого лечения требуется от 2 до 3 мес., поэтому в этот промежуточный период необходимо бывает делать кровопускания. Иногда для достижения полной ремиссии спустя 3 мес. приходится вводить вторую, меньшую, дозу 32Р. Лечение с помощью 32P позволяет удовлетворительно контролировать состояние более чем 75 % больных, а ремиссия может продолжаться 2 года или даже дольше.
Применение радиоактивного фосфора является методом выбора при лечении пожилых пациентов, однако больных, длительно находящихся в лечебных учреждениях закрытого типа, можно лечить и алкилирующими препаратами; в этих условиях проще решать проблемы, связанные с соблюдением назначенного лечения и наблюдением за состоянием больного.
Используют разные препараты, в том числе миелосан, хлорбутин и циклофосфан, причем препаратом выбора является хлорбутин, поскольку он вызывает меньше побочных эффектов.
Миелосан способен снижать уровень тромбоцитов, благодаря чему его целесообразно применять у больных с выраженным тромбоцитозом. Его вводят в дозах 4-6 мг/сут до тех пор, пока содержание лейкоцитов и (или) тромбоцитов не снизится на 50 %. После этого дозу уменьшают вдвое, а затем, при падении числа тромбоцитов до 250-109/л или лейкоцитов до 10·109/л, миелосан вообще отменяют.
ООЭ снижается медленнее, поэтому в начале курса химиотерапии необходимо проводить регулярные кровопускания. Миелосан может вызывать необратимые повреждения стволовых клеток и как следствие этого -- стойкую тяжелую нейтропению и тромбоцитопению, поэтому его следует применять с большой осторожностью.
Лечение миелосаном сопровождается большой смертностью. Достигнутая ремиссия может длиться несколько месяцев и даже лет. Курс миелосана не должен быть слишком длительным, иначе могут возникнуть необратимые панцитопения, кожная пигментация и пневмофиброз. Мельфалан в первые 5 дней назначают в дозе 4-8 мг, затем дозу снижают до 2 мг трижды в неделю в течение 4 нед. Если спустя 1 мес. от начала лечения уровни лейкоцитов и тромбоцитов остаются высокими, месячный курс повторяют, и такую терапию продолжают до нормализации уровней тромбоцитов и лейкоцитов.
При лечении мельфаланом рецидив часто возникает в течение 5-6 мес, т. е. гораздо быстрее, чем после лечения миелосаном. Хлорбутин используют в дозе 2-4 мг/сут, продолжая курс до нормализации содержания клеток крови. Больным с симптомами гиперурикемии назначают аллопуринол в дозе 300 мг/сут. Его следует также назначить с профилактической целью после лечения 32Р или химиотерапии. Острый приступ подагры следует лечить нестероидными противовоспалительными препаратами.
Особенно сложна борьба с зудом. Обычно он стихает, когда удается взять под контроль полицитемию. Антигистаминные вещества не очень эффективны, а ответ на другие препараты, например холестирамин и циметидин, непостоянен и скорее неудовлетворителен. Однако при мучительном зуде имеет смысл прибегнуть к этим лекарствам. Больным с зудом рекомендуется избегать воздействий, усиливающих его, например высоких температур.
Как только удается поставить полицитемию под контроль, транзиторные симптомы поражений периферических сосудов быстро стихают, что позволяет избежать хирургических вмешательств. Необходимость в операции возникает при стойком характере симптомов, даже если достигнут надежный контроль гематологических параметров.
Вторичная эритремия. Вторичные полицитемии обычно являются следствием повышения активности эритропоэтина, что в свою очередь обусловлено либо соответствующей реакцией на сниженное насыщение крови кислородом, либо неадекватно высокой продукцией этого гормона. Причины этих явлений довольно многочисленны (табл. 2), однако большинство из них очень редко встречается у пожилых.
Наиболее частой причиной возникновения вторичной эритремии у лиц старших возрастных групп является хроническое заболевание легких. Однако полицитемия возникает не во всех случаях хронической гипоксии. У многих больных с заболеванием легких и снижением парциального давления кислорода в артериальной крови ООЭ находится в пределах нормы, причем у большинства из них повышен уровень эритропоэтина. Удовлетворительного объяснения этому факту нет. Высказывалось предположение, что эритропоэз может быть снижен вследствие хронической инфекции. Спленомегалия отсутствует. Показано, что кровопускание способствует улучшению состояния больных с хроническим легочным заболеванием, имеющих чрезвычайно высокий ООЭ (выше 0,70). Вместе с тем лечение должно определяться причиной, обусловившей развитие вторичной полицитемии. Семейная эритремия встречается редко и обычно обусловлена присутствием аномального гемоглобина с высоким аффинитетом к кислороду. Нормальная величина Р5о составляет 3,3-3,6 кПа. Для аномальных гемоглобинов этот показатель равняется примерно 1,6 кПа.
Таблица 2 - Типичные признаки истинной полицитемии, вторичной полицитемии при гипоксии и относительной эритремии
Читайте также:
