Диастолические шумы сердца. Пороки с усиленным легочным кровотоком
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
В рожденные пороки сердца (ВПС) — достаточно распространенная патология среди заболеваний сердечно-сосудистой системы, которая является основной причиной смерти детей первого года жизни. Частота ВПС составляет 30% от всех пороков развития. Лечение врожденных сердечных аномалий возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих уcловиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Основными причинами рождения детей с ВПС являются: хромосомные нарушения - 5%; мутация 1-го гена - 2–3%; влияние внешних факторов (алкоголизм родителей, прием лекарственных препаратов, перенесенные вирусные инфекции во время беременности и т.д.) - 1–2% ;полигенно-мультифокальное наследование - 90%.
Классификация
Встречается более 90 вариантов ВПС и множество их сочетаний. В Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН СССР была разработана классификация, основанная на распределении ВПС с учетом анатомических особенностей порока и гемодинамических нарушений.
Для практикующих врачей-кардиологов удобнее пользоваться более упрощенным делением ВПС на 3 группы:
1. ВПС бледного типа с артериовенозным шунтом: дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП); открытый атриовентрикулярный канал (АВК).
2. ВПС синего типа с веноартериальным шунтом: транспозиция магистральных сосудов (ТМС), тетрада Фалло (ТФ), триада Фалло, атрезия трикуспидального клапана (АТК) и т.д.
3. ВПС без сброса, но с препятствием на пути кровотока из желудочков (стенозы легочной артерии и аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
Нарушение гемодинамики при врожденных пороках сердца
Не случайно во всех предложенных классификациях большое внимание уделено оценке нарушений гемодинамики при ВПС, так как степень этих нарушений тесно связана с анатомической тяжестью порока, от них зависит тактика медикаментозного лечения и сроки выполнения операции.
ВПС вызывает ряд изменений компенсаторного характера, которые заставляют перестраиваться весь организм ребенка, но при длительном существовании порока процессы компенсации ведут к выраженным деструктивным изменениям органов и систем, что приводит к гибели больного.
В зависимости от состояния малого круга кровообращения в организме больного с ВПС наблюдаются следующие патологические изменения:
• при наличии увеличенного кровотока в легких (пороки бледного типа с артериовенозным шунтом) развивается гиперволемия и гипертензия малого круга кровообращения;
• при наличии обедненного кровотока в легких (пороки синего типа с веноартериальным шунтом) у больного развивается гипоксемия;
• при увеличении кровотока в малом круге кровообращения развивается гиперволемия и легочная гипертензия.
Примерно 50% детей первого года жизни с большим сбросом крови в малый круг кровообращения без хирургической помощи погибают при явлениях сердечной недостаточности. Если ребенок переживает этот критический период, то к году в результате спазма легочных артериол уменьшается сброс крови в малый круг и состояние ребенка стабилизируется, однако это улучшение касается только самочувствия больного, так как одновременно начинают развиваться склеротические процессы в сосудах легких. Существует много классификаций легочной гипертензии. Для практики наиболее удобной является классификация, разработанная в ИССХ им. А. Н. Бакулева АМН СССР (В.И. Бураковский и соавт., 1975). Она основана на величине давления в легочной артерии, степени сброса крови и соотношении общелегочного сопротивления к показателям большого круга кровообращения (табл. 1).
Согласно этой классификации, больные делятся на 4 группы, где I и III стадия разделены на подгруппы А и Б. Больные IА группы имеют небольшие нарушения гемодинамики и нуждаются в наблюдении кардиолога. У больных IБ и II группы ставится вопрос об операции. Легочная гипертензия в этих группах носит функциональный характер.
У больных III группы при большом сбросе крови в малый круг изменения в легочных сосудах значительно более выражены. При IIIА гемодинамической группе возможна радикальная коррекция порока, и давление после операции снижается. В IIIБ и IV группе хирургическое лечение не показано. Дифференциальный диагноз между IIIА и Б группами сложен, и нередко для решения вопроса об операбельности порока необходимо выполнить внутрисосудистое ультразвуковое исследование и/или биопсию легкого для изучения морфологических изменений в легочных сосудах. Для оценки этих изменений наиболее часто используется классификация, предложенная Д. Хитом и Дж. Эдвардсом в 1958 г. (табл. 2).
При цианотических формах ВПС наличие сброса венозной крови в артериальную или смешение крови ведут к увеличению объема крови в большом круге кровообращения и уменьшению в малом, что приводит к снижению насыщения крови кислородом (гипоксемии) и к появлению цианоза кожи и слизистых. Для улучшения доставки кислорода к органам и повышения эффективности вентиляции происходит развитие коллатерального кровообращения между сосудами большого и малого круга кровообращения. Перестройка коллатеральной сети кровообращения происходит в сосудах всех органов. Особенно это выражено в сосудах сердца, легких и головного мозга.
Благодаря компенсаторным механизмам состояние больного с цианотическими формами ВПС, несмотря на тяжелые нарушения гемодинамики, может быть длительно удовлетворительным, но постепенно компенсаторные механизмы истощаются, длительная гиперфункция миокарда приводит к развитию тяжелых необратимых дистрофических изменений в сердечной мышце. Поэтому оперативное вмешательство при цианотических пороках (радикальное или паллиативное) показано в самом раннем детском возрасте.
Диагностика
Первичная диагностика ВПС основывается на данных неинвазивных методов исследования. Большое значение для диагностики имеет целенаправленный сбор анамнеза у родителей ребенка. При бледных пороках сердца необходимо выяснить, часто ли болеет ребенок респираторными инфекциями, были ли у него пневмонии, так как это говорит о большом сбросе крови слева-направо. С другой стороны, прекращение респираторных инфекций у больного с большим сбросом крови в малый круг говорит о начале развития легочной гипертензии. Это должно быть поводом для направления больного к кардиохирургу. Естественное течение ВПС может осложниться развитием инфекционного эндокардита, поэтому необходимо выяснить, бывают ли у ребенка подъемы температуры тела без признаков респираторной инфекции. Следует также выяснить, не было ли у больного синкопальных состояний, судорожного синдрома, которые могут быть следствием аритмий сердца.
При осмотре ребенка с подозрением на ВПС необходимо отметить цвет кожных покровов и слизистых. Цианоз может быть периферическим и генерализованным. Важно отметить наличие или отсутствие цианоза на всех 4 конечностях, так как при некоторых ВПС наблюдается дифференцированный цианоз (предуктальная коарктация аорты, транспозиции магистральных сосудов в сочетании с перерывом дуги аорты). При осмотре грудной клетки необходимо отметить деформацию грудной клетки в области сердца — появление так называемого сердечного горба (по величине и локализации которого можно косвенно судить о сложности ВПС и/или развитии легочной гипертензии).
При пальпации грудной клетки у больного с ВПС можно отметить смещение верхушечного толчка, изменение его площади, наличие “дрожания” над областью сердца. Пальпация позволяет оценить размеры печени и селезенки. Методом перкуссии определяют размеры сердца, печени и селезенки.
Аускультация является наиболее информативным методом физикального обследования больных с ВПС. При аускультации можно отметить изменение тонов сердца (усиление, ослабление или расщепление), появление шумов, а также их локализацию, иррадиацию и место максимального выслушивания. Интенсивность шума не всегда коррелирует с тяжестью порока, например, при ВПС с легочной гипертензией и синих пороках со стенозом легочной артерии эта зависимость носит обратный характер. При аускультации легких можно выявмть признаки застоя в малом круге.
Физикальное исследование дополняется проведением неинвазивного инструментального обследования, которое включает электрокардиографию (ЭКГ), фонокардиографию (ФКГ) и рентгенографию органов грудной клетки.
ЭКГ позволяет судить о гипертрофии различных отделов сердца, патологических отклонениях электрической оси, наличии нарушений ритма и проводимости. Изменения на ЭКГ не являются специфичными для какого-либо порока, но в сочетании с данными, полученными при клиническом обследовании и с помощью других неинвазивных методов, позволяют судить о тяжести порока. Разновидностью метода ЭКГ является холтеровское суточное ЭКГ-мониторирование, которое помогает выявить скрытые нарушения ритма и проводимости.
Следующим неинвазивным методом обследования кардиологических больных является ФКГ, которая воспроизводит данные аускультации сердца и позволяет более детально и количественно оценить характер, продолжительность и локализацию сердечных тонов и шумов.
Рентгенография органов грудной клетки дополняет предыдущие методы и позволяет оценить: состояние малого круга кровообращения (наличие артериального или венозного застоя, снижение наполнения сосудов легких); расположение, форму, размеры сердца и его отдельных камер; изменения со стороны других органов и систем (легкие, плевра, позвоночник, а также расположение внутренних органов).
Сочетание ЭКГ, ФКГ и рентгенография органов грудной клетки позволяет диагностировать большинство изолированных пороков и предположить наличие сложных ВПС.
Наиболее высокоинформативным неинвазивным методом исследования является эхокардиография (ЭХОКГ). С появлением данной методики, особенно двухмерной ЭХОКГ, значительно расширились возможности диагностики ВПС. Этот метод позволяет провести анатомически точную диагностику дефектов перегородок сердца, поражения атриовентрикулярных и полулунных клапанов, размеры и расположение камер сердца и магистральных сосудов, а также оценить сократительную способность миокарда. При определенных пороках (неосложненные ДМПП, ДМЖП, ОАП, частично открытый АВК, коарктация аорты) можно выполнить операцию без проведения катетеризации сердца. Однако в ряде случаев при сложных ВПС и сопутствующей легочной гипертензии необходимо провести катетеризацию сердца и ангиокардиографию, так как эти методы позволяют провести точную анатомическую и гемодинамическую диагностику ВПС. Проведение катетеризации сердца возможно только в условиях специализированной кардиохирургической клиники. В настоящее время при проведении катетеризации сердца в случае необходимости выполняется электрофизиологическое исследование для уточнения механизма аритмий сердца, оценки функции синусового и атриовентрикулярного узлов, а также проводятся различные эндоваскулярные операции: баллонная ангиопластика при стенозах легочной артерии и аорты; эмболизация небольших ОАП, коронаросердечных фистул, аортолегочных коллатералей; баллонная атриосептостомия при простой ТМС и стентирование легочных сосудов при периферических стенозах.
Тактика хирургического лечения
Тактика оказания помощи больным с ВПС строится с учетом течения порока, эффективности консервативного лечения, возможности и риска проведения хирургического лечения. После установления диагноза необходимо решить:
1. Как лечить больного (медикаментозно или хирургически)?
2. Определить сроки выполнения операции.
Ответить на эти вопросы помогает классификация, предложенная J. Kirklin и соавт. (1984).
0-я группа – больные с ВПС, с незначительными нарушениями гемодинамики, которые не нуждаются в операции.
1-я группа – больные, состояние которых позволяет провести операцию в плановом порядке ( через год и более).
2-я группа – больные, которым операция показана в ближайшие 3–6 мес.
3-я группа – больные с тяжелыми проявлениями ВПС, которых необходимо оперировать в течение нескольких недель.
4-я группа – больные, нуждающиеся в экстренной операции (в течение 48 ч после госпитализации).
Наиболее сложная проблема в кардиохирургии – операция у детей первого года жизни с ВПС. Хирургическая летальность в последние годы значительно снижена и отличается от высокой естественной смертности при ВПС. Операция у детей первого года жизни выполняется в том случае, если консервативными методами не удается достичь стабилизации состояния. Большинство неотложных операций выполняются у детей с цианотическими ВПС.
Если у новорожденного с ВПС отсутствуют признаки сердечной недостаточности, цианоз выражен умеренно, то консультация кардиохирурга может быть проведена позднее. Наблюдение за такими детьми осуществляет кардиолог по месту жительства. Такая тактика позволяет провести обследование больного в более благоприятных условиях, снизить риск проведения инвазивных методов исследования и оперативного вмешательства.
В более поздней возрастной группе хирургическая тактика при ВПС зависит от тяжести патологии, предполагаемого прогноза, возраста и массы тела больного. K.Turley и соавт. в 1980 г. предложили разделить ВПС на 3 группы, в зависимости от вида возможной операции.
К 1-й группе относятся такие наиболее часто встречающиеся пороки, как ОАП, ДМЖП, ДМПП, частично открытый АВК, коарктация аорты, стеноз и недостаточность митрального и аортального клапанов. При установлении данных пороков единственным выбором может быть операция. Она может быть отложена, если нарушения гемодинамики нерезко выражены, а возраст ребенка и масса тела слишком малы (более поздний возраст и достаточная масса тела снижают риск выполнения кардиохирургических вмешательств).
Во 2-ю группу входят сложные цианотические пороки, такие, как тетрада Фалло, стеноз легочной артерии, атрезия легочной артерии 1-го типа, транспозиция магистральных сосудов и др. Выбор между радикальной и паллиативной операцией зависит от анатомической тяжести порока, степени гипоксемии и массы тела ребенка.
К 3-й группе относятся ВПС, при которых возможна только паллиативная или гемодинамическая коррекция порока. К ней относятся различные варианты сложных пороков: атрезия трикуспидального и митрального клапанов, двухкамерное сердце, синдром гипоплазии правого и левого сердца, единственный желудочек сердца и др.
Радикальная коррекция простых неосложненных пороков не представляет технических трудностей для специализированной кардиохирургической клиники. При ДМЖП и ДМПП выполняется ушивание или пластика дефектов заплатой, при ОАП - перевязка или пересечение протока. При выраженной гипоксемии первым этапом у больного с ВПС проводится паллиативная операция - наложение различных межсистемных анастомозов. После проведения операции улучшается насыщение крови кислородом, что позволяет ребенку развиваться в более благоприятных условиях. Выполнение двухэтапных операций, по данным различных авторов, не только не увеличивает риск вмешательства, но уменьшает летальность при радикальной коррекции.
При некоторых анатомически сложных ВПС, когда отсутствуют или недоразвиты различные отделы сердца (атрезия трикуспидального и митрального клапанов, единственный желудочек сердца, двухкамерное сердце и т.д.) выполнение радикальной операции не представляется возможным и единственной операцией может быть гемодинамическая коррекция внутрисердечной гемодинамики, которая позволяет разделить артериальные и венозные потоки крови, не устраняя полностью анатомические пороки. К ним относятся различные модификации гемодинамической коррекции по методу Фонтена, Мастарда и Сенинга.
1. Бураковский В.И., Бухарин В.А. Константинов С.А. и др. Врожденные пороки сердца. В кн. Частная хирургия болезней сердца и сосудов / Под ред. В.И. Бураковского и С.А.Колесникова. М.: Медицина, 1967; 315—23.
2. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. М. Медицина, 1975; 247.
3. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. Киев: Здоровье, 1983; 33—96.
4. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. Руководство для врачей. В 2 томах. — М. Медицина, 1987; 918.
5. Бураковский В.А., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца. В кн. Сердечно-сосудистая хирургия / Под ред. В.И. Бураковского, Л.А. Бокерия. М. Медицина, 1989; 345—82.
6. Иваницкий А.В., Роль рентгенологического исследования в диагностике пороков сердца у детей. Педиатрия. 1985; 8 (7) 55—7.
7. Н.А.Белоконь, В.П. Подзолков. Врожденные пороки сердца. М. Медицина, 1991; 352.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Диастолические шумы сердца. Пороки с усиленным легочным кровотоком
Оценка шумов сердца при врожденном пороке. I тон сердца на фонокардиограмме
У больных с врожденными пороками сердца при характеристике шумов сердца учитывается время появления и окончания, продолжительность, интенсивность, форма, локализация шума, его эпицентр и направление распространения, а также основная его частота. Характеристика шумов: убывающего; нарастающего; постоянной интенсивности, нарастающего к средине систолы и убывающего к ее концу («ромбовидный») позволяет решать вопрос их возникновения и проведения. Шумы одинаковой формы, но неодинаковой интенсивности в различных точках указывают на их проводной характер в точках меньшей интенсивности.
Точка наибольшей интенсивности шума — эпицентр считается местом его возникновения. Появление шума разной формы в двух-трех точках свидетельствует о нескольких его источниках.
В дифференциальной диагностике врожденных пороков сердца особое внимание уделяется выявлению эпицентра шума в определенной сердечной точке и степени его распространения в другие точки. Максимум интенсивности шума в разное время сердечного цикла имеет большое значение в определении степени гемодинамических нарушений при целом ряде врожденных пороков сердца.
Продолжительность шума, интенсивность и его частотный состав определяются по тем же признакам, что и тоны сердца. Особенно ценным в диагностическом отношении является анализ регистрации начала и конца шумов по отношению к тонам сердца. Именно по тому, когда начинается систолический шум — одновременно ли с I тоном или через определенный интервал, заканчивается ли он перед II тоном или покрывает его и переходит в диастолу,— можно распознать шумы выброса и пансистолические шумы.
Иногда правильная трактовка тонов и шумов затрудняется техническими дефектами. Графическую запись могут искажать наводка, мышечная дрожь, толчки аппарата, неполное прилегание микрофона к грудной клетке. В этих случаях кривая имеет вид неправильных колебаний, непостоянной и малой амплитуды, которые, накладываясь на тоны и шумы, удлиняют ее. При анализе фонокардиограмм внесердечные колебания исключаются как непериодически возникающие, имеющие непостоянную амплитуду и несвязанные с циклом сердечной деятельности.
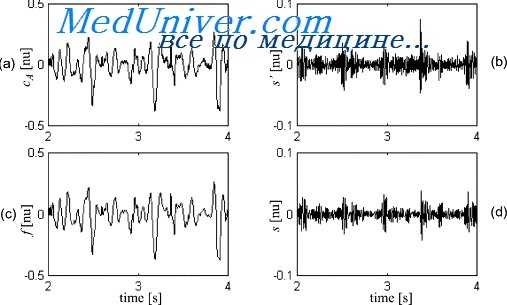
I тон сердца на фонокардиограмме
Графическая запись звуков сердца может регистрировать от двух до пяти тонов. Существование V тона сомнительно. Вопрос о механизме происхождения тонов сердца нельзя считать окончательно решенным.
I тон сложен и регистрируется на фснокардиограмме в виде группы неравномерных колебаний, которые начинаются спустя 0,02—0,06 сек после начала зубца Q' электрокардиограммы.
Теоретически колебания, относящиеся к I тону, подразделяют на 5 частей (Луизада и Араванис, 1957). Первая часть I тона, предсердная, обусловлена систолой предсердий, представлена 1—2 низкоамплитудными, низкочастотными осцилляциями. Начало предсердной части I тона совпадает с зубцом Q электрокардиограммы или отстает от него на 0,05 сек. Вторая часть I тона—основная, ее звуковые колебания образуются в результате' захлопывания атриовентрикулярных клапанов и представлены при записи 1—2 высокими и широкими осцилляциями. Третья часть возникает за счет колебаний миокарда или грудной стенки.
На фонокардиограмме она регистрируется в виде 2—3 осцилляции низкой амплитуды и частоты. Четвертая часть, состоит из 1—2 высоких и широких осцилляции, которые образуются за счет открытия полулунных клапанов аорты и легочной артерии. Пятая часть I тона представлена 2—3 непостоянными низкоамплитудными осцилляциями, возникающими за счет движения и растяжения больших сосудов в момент выброса в них крови.
Практическое значение имеют три части I тона: первая, вторая и четвертая. Начальная и конечная части 1 тона по своей частоте (15—50 гц) близки к III и IV тонам. Центральная часть I тона, в свою очередь, состоит из 4 колебаний, которые соответствуют движению четырех клапанов в следующем порядке: закрытию митрального, трикуспидального и открытию клапанов легочной артерии и аорты.
Общая продолжительность I тона, по данным разных авторов, различна и зависит от возраста и изменения интервалов между компонентами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В отличие от систолических шумов, диастолические шумы при врожденных пороках сердца относятся к функциональным.
Луизада и Араванис (1957) все диастолические шумы любой этиологии, кроме шума при стенозе атриовентрикулярного отверстия, включили в группу функциональных. Авторы выделяют следующие признаки функциональных диастолических шумов: они появляются в средине или в конце диастолы, имеют высокую амплитуду, выслушиваются на большом расстоянии из-за расширенного и прилегающего к грудной клетке левого желудочка, часто сочетаются с III сердечным тоном, при них отсутствует щелчок открытия митрального клапана, нормальный интервал Q — I тон регистрируются преимущественно при стетоскопической (среднечастотной) записи.
Функциональные диастолические шумы изменяют свою интенсивность и характер при перемене положения тела и фазы дыхания. Они без органического поражения клапанов могут фиксироваться на верхушке и у основания сердца.
Димон с соавторами (1959), Эйзенберг с соавторами (1959), Гришман с соавторами (1960) указывают, что при дефектах межпредсердной и межжелудочковой перегородок ранние диастолические шумы (протодиастолические) на нижнем крае грудины и на верхушке сердца так же, как срединнодиастолические (мезодиастолические) шумы, вызваны повышением кровотока через трехстворчатый клапан во время быстрого наполнения правого желудочка.
Путем внутрисердечной фонокардиографии было доказано, что срединнодиастолические шумы возникают на уровне трехстворчатого клапана (Луизада и Тестелли, 1958; Луизада, Лин, 1958; Лин и Джаконо, 1958).
Причиной диастолических шумов во втором межреберье слева и во втором межреберье справа является относительная недостаточность клапана легочной артерии или аорты при расширении и перегрузке их. Луизада и Араванис (1957) характеризуют их как протодиастолические шумы decrescendo в виде удлинения II тона, зависящие от гипертензии в малом или большом круге кровообращения.
Авторы отмечают, что эти шумы начинаются тотчас же за II тоном и постепенно стихают к средине диастолы, реже они имеют характер crescendo-decrescendo с максимальной амплитудой в фазе быстрого наполнения желудочка.
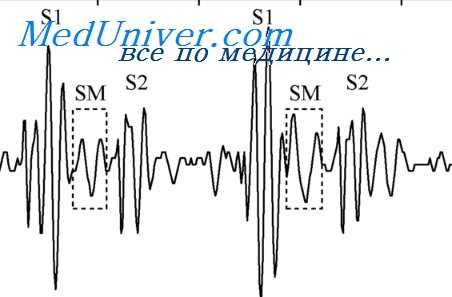
Пороки с усиленным легочным кровотоком
Известно, что количество самых разнообразных врожденных пороков сердца велико. Мы остановимся на десяти видах, которые наиболее часто встречаются и подлежат оперативному лечению.
Все больные с врожденными кардиопатиями в зависимости от характера легочного кровотока могут быть разделены на три группы: с увеличенным, нормальным и уменьшенным.
К первой группе мы относим больных с дефектом межпредсердной перегородки, дефектом межжелудочковой перегородки, незаращением артериального протока, дефектом аорто-легочной перегородки, коарктацией аорты II типа.
Во вторую группу вошли больные с коарктацией аорты I типа и со стенозом устья аорты.
В третью группу включили больных с изолированным стенозом легочной артерии, тетрадой, триадой и пентадой Фалло.
- Вернуться в оглавление раздела "Кардиология."
1. Тон открытия левого предсердно-желудочкового клапана. Функциональные сердечные шумы
2. Парастернальный шум. Органические сердечные шумы
3. Органические диастолические шумы. Фонокардиография при приобретенных пороках сердца
4. Щелчок открытия митрального клапана. Шумы сердца после митральной комиссуротомии
5. Диастолический шум после комиссуротомии. Фонокардиографическая картина рецидива митрального стеноза
6. Систолический шум при недостаточности трехстворчатого клапана. Стеноз правого предсердно-желудочкового отверстия
7. Фонокардиография при стенозе правого предсердно-желудочкового отверстия. Недостаточность клапана аорты
8. Стеноз устья аорты. Аортально-митральная недостаточность
9. Стеноз аортального отверстия и митральная недостаточность. Митрально-аортально-трикуспидальная недостаточность
10. Митрально-аортально-трехстворчатый стеноз. Интенсивность II тона при тройном стенозе
Звуки сердца в норме и при патологии
Формирование шумов сердца
Шумы сердца при патологии
Влияние эмоций на тоны и шумы сердца
Функциональные сердечные шумы и тоны
Влияние положения тела на шумы сердца
Изменчивость сердечных шумов
Диагностическое значение сердечных шумов
Функциональные и миокардиопатические шумы сердца
Органические шумы сердца
2. Принципы регистрации фонокардиограммы. Техника фонокардиографии
3. Элементы ФКГ в норме и при патологии. Тоны на фонокардиограмме в норме
4. Четвертый тон сердца. Патология I тона сердца
5. Патология II тона сердца. Расщепление второго тона сердца
2. II тон сердца. Зависимость второго тона сердца от фаз дыхания
3. Нормальные изменения II тона сердца. Характеристика III (третьего) тона сердца
4. Характеристика IV и V тонов сердца. Фазы систолы и диастолы сердца
5. Функциональный систолический шум у детей. Происхождение функционального систолического шума
6. Признаки функционального систолического шума сердца. ФКГ при врожденных пороках сердца
7. Тоны сердца при открытом артериальном протоке. Шумы сердца при ОАП
8. Систолический шум при открытом артериальном протоке. Дифференциация шумов сердца при ОАП
9. Варианты открытого артериального протока. Шум Грехэм-Стила
10. Частота шума Грехэм Стила при открытом артериальном протоке. Шумовые признаки легочной гипертензии
ФКГ при дефекте перегородок сердца
Тоны и шумы сердца при врожденных пороках сердца
Легочное сердце: диагностика и лечение
Для цитирования: Верткин А.Л., Тополянский А.В. Легочное сердце: диагностика и лечение. РМЖ. 2005;19:1272.
Легочное сердце — увеличение правого желудочка сердца при заболеваниях, нарушающих структуру и (или) функцию легких (за исключением случаев первичного поражения левых отделов сердца, врожденных пороков сердца).
К его развитию приводят следующие заболевания:
– первично влияющие на прохождение воздуха в легких и альвеолах (хронический бронхит, бронхиальная астма, эмфизема легких, туберкулез, пневмокониозы, бронхоэктатическая болезнь, саркоидоз и др.);
– первично влияющие на подвижность грудной клетки (кифосколиоз и другие деформации грудной клетки, нервно–мышечные заболевания – например, полиомиелит, ожирение – синдром Пиквика, апноэ во сне);
– первично поражающие сосуды легких (первичная легочная гипертензия, артерииты, тромбозы и эмболии сосудов легких, сдавление ствола легочной артерии и легочных вен опухолью, аневризмой и др.).
В патогенезе легочного сердца основную роль играет уменьшение суммарного поперечного сечения сосудов легких. При заболеваниях, первично влияющих на прохождение воздуха в легких и на подвижность грудной клетки, к спазму мелких легочных артерий приводит альвеолярная гипоксия; при заболеваниях, поражающих сосуды легких, повышение сопротивления кровотоку обусловлено сужением или закупоркой просвета легочных артерий. Повышение давления в малом круге кровообращения приводит к гипертрофии гладких мышц легочных артерий, которые становятся более ригидными. Перегрузка правого желудочка давлением обусловливает его гипертрофию, дилатацию, в дальнейшем – правожелудочковую сердечную недостаточность.
Острое легочное сердце развивается при тромбоэмболии легочных артерий, спонтанном пневмотораксе, тяжелом приступе бронхиальной астмы, тяжелой пневмонии за несколько часов или дней. Проявляется внезапно возникающей давящей болью за грудиной, резкой одышкой, цианозом, артериальной гипотензией, тахикардией, усилением и акцентом II тона сердца над легочным стволом; отклонением электрической оси сердца вправо и электрокардиографическими признаками перегрузки правого предсердия; быстро нарастающими признаками правожелудочковой недостаточности – набуханием шейных вен, увеличением и болезненностью печени.
Хроническое легочное сердце формируется в течение ряда лет при хронических обструктивных болезнях легких, кифосколиозе, ожирении, рецидивирующей тромбоэмболии легочных артерий, первичной легочной гипертензии. В его развитии выделяют три стадии: I (доклиническая) – диагностируется только при инструментальном исследовании; II – при развитии гипертрофии правого желудочка и легочной гипертензии без признаков сердечной недостаточности; III (декомпенсированное легочное сердце) – при появлении симптомов правожелудочковой недостаточности.
Клинические признаки хронического легочного сердца – одышка, усиливающаяся при физической нагрузке, быстрая утомляемость, приступы сердцебиения, боли в грудной клетке, обмороки. При сдавлении возвратного нерва расширенным стволом легочной артерии возникает охриплость голоса. При осмотре могут быть обнаружены объективные признаки легочной гипертензии – акцент II тона на легочной артерии, диастолический шум Грехема–Стилла (шум относительной недостаточности клапанов легочной артерии). Об увеличении правого желудочка могут свидетельствовать пульсация за мечевидным отростком, усиливающаяся на вдохе, расширение границ относительной тупости сердца вправо. При значительной дилатации правого желудочка развивается относительная трикуспидальная недостаточность, проявляющаяся систолическим шумом у основания мечевидного отростка, пульсацией шейных вен и печени. В стадии декомпенсации появляются признаки правожелудочковой недостаточности: увеличение печени, периферические отеки.
На ЭКГ выявляют гипертрофию правого предсердия (остроконечные высокие зубцы Р в отведениях II, III, aVF) и правого желудочка (отклонение электрической оси сердца вправо, увеличение амплитуды зубца R в правых грудных отведениях, блокада правой ножки пучка Гиса, появление глубокого зубца S в I и зубца Q в III стандартных отведениях).
Рентгенологически острое и подострое легочное сердце проявляется увеличением правого желудочка, расширением дуги легочной артерии, расширением корня легкого; хроническое легочное сердце – гипертрофией правого желудочка, признаками гипертензии в малом круге кровообращения, расширением верхней полой вены.
При эхокардиографии могут быть обнаружены гипертрофия стенки правого желудочка, дилатация правых камер сердца, расширение легочной артерии и верхней полой вены, легочная гипертензия и трикуспидальная недостаточность.
В анализе крови у больных с хроническим легочным сердцем обычно выявляют полицитемию.
При развитии острого легочного сердца показано лечение основного заболевания (ликвидация пневмоторакса; гепаринотерапия, тромболизис или хирургическое вмешательство при тромбоэмболии легочных артерий; адекватная терапия бронхиальной астмы и т.д.).
Лечение собственно легочного сердца направлено главным образом на уменьшение легочной гипертензии, а при развитии декомпенсации включает коррекцию сердечной недостаточности (табл. 1). Легочная гипертензия уменьшается при использовании антагонистов кальция – нифедипина в дозе 40–180 мг в сутки (предпочтительно использование длительно действующих форм препарата), дилтиазема в дозе 120–360 мг в сутки [Чазова И.Е., 2000], а также амлодипина (Амловас) в дозе 10 мг в сутки [Franz I.W. et al., 2002, Sajkov D. et al., 1997, Woodmansey P.A. et al., 1996]. Так, по данным Franz I.W. и соавт. (2002), на фоне терапии амлодипином в дозе 10 мг в сутки в течение 18 дней у 20 больных ХОБЛ с легочной гипертензией отмечено существенное снижение резистентности легочных сосудов и давления в легочной артерии, при этом изменений параметров газообмена в легких не отмечено. Согласно результатам перекрестного рандомизированного исследования, проведенного Sajkov D. и соавт. (1997), амлодипин и фелодипин в эквивалентных дозах в равной мере снижали давление в легочной артерии, однако побочные эффекты (головная боль и отечный синдром) реже развивались на фоне терапии амлодипином.
Эффект от терапии антагонистами кальция проявляется обычно через 3–4 недели. Показано, что снижение легочного давления на фоне терапии антагонистами кальция значительно улучшает прогноз этих больных [Groechenig E., 1999], однако только треть пациентов отвечает на терапию антагонистами кальция подобным образом [Fisnman A.P., 1998]. Пациенты с тяжелой правожелудочковой недостаточностью обычно плохо реагируют на терапию антагонистами кальция.
В клинической практике у больных с признаками легочного сердца широко используют препараты теофиллина (внутривенно капельно, пролонгированные препараты для приема внутрь), снижающие легочное сосудистое сопротивление, повышающие сердечный выброс и улучшающие самочувствие этих пациентов. В то же время доказательной базы для применения препаратов теофиллина при легочной гипертензии, по–видимому, не существует.
Эффективно снижает давление в легочной артерии внутривенная инфузия простациклина (PGI2), обладающего антипролиферативным и антиагрегантным действием; препарат увеличивает толерантность к физическим нагрузкам, повышает качество жизни и снижает летальность этих больных. К недостаткам его относят нередко развивающиеся побочные эффекты (головокружение, артериальная гипотензия, кардиалгии, тошнота, абдоминалгии, диарея, сыпь, боль в конечностях), необходимость постоянных (многолетних) внутривенных инфузий, а также высокую стоимость лечения. Проводится изучение эффективности и безопасности применения аналогов простациклина – илопроста, используемого в виде ингаляций и берапроста, применяемого внутрь, а также трепростинила, вводимого как внутривенно, так и подкожно.
Изучается возможность применения антагониста рецепторов эндотелина босентана, эффективно снижающего давление в легочной артерии, однако выраженные побочных системных эффектов ограничивает внутривенное применение этой группы препаратов.
Ингаляция оксида азота (NO) в течение нескольких недель также позволяет уменьшить легочную гипертензию, однако подобная терапия доступна далеко не всем лечебным учреждениям. В последние годы предпринимаются попытки использовать при легочной гипертензии ингибиторы ФДЭ5, в частности – силденафила цитрат. Charan N.B. в 2001 году описал двух пациентов, отметивших улучшение течения ХОБЛ на фоне приема силденафила, который они принимали по поводу эректильной дисфункции. Сегодня бронходилатирующее, противовоспалительное действие силденафила и его способность снижать давление в легочной артерии показано как в экспериментальных [Sebkhi A. et al., 2003, Toward T.J. et al., 2004], так и в клинических исследованиях [Bharani A. et al., 2003, Sastry B.K. et al., 2004, Watanabe H. et al., 2002]. Согласно полученным данным ингибиторы ФДЭ5 при легочной гипертензии значительно улучшают толерантность к физической нагрузке, повышают сердечный индекс, улучшают качество жизни больных с легочной гипертонией, в том числе первичной. Для окончательного решения вопроса об эффективности этого класса препаратов при ХОБЛ необходимы длительные многоцентровые исследования. Кроме того, широкому внедрению этих препаратов в клиническую практику безусловно мешает высокая стоимость лечения.
При формировании хронического легочного сердца у больных хроническими обструктивными болезнями легких (бронхиальной астмой, хроническим бронхитом, эмфиземой легких) с целью коррекции гипоксии показана длительная кислородотерапия. При полицитемии (в случае повышения гематокрита выше 65–70%) применяют кровопускание (обычно – однократное), позволяющее снизить давление в легочной артерии, повысить толерантность больного к физической нагрузке и улучшить его самочувствие. Количество удаляемой крови – 200–300 мл (в зависимости от уровня АД и самочувствия больного).
При развитии правожелудочковой недостаточности показаны диуретики, в т.ч. спиронолактон; следует учитывать, что при легочной гипертензии мочегонные средства не всегда способствуют уменьшению одышки. Используют также ингибиторы АПФ (каптоприл, эналаприл и др.). Применение дигоксина при отсутствии левожелудочковой недостаточности малоэффективно и небезопасно, поскольку гипоксемия и развивающаяся на фоне диуретической терапии гипокалиемия увеличивают риск развития гликозидной интоксикации.
Учитывая высокую вероятность тромбоэмболических осложнений при сердечной недостаточности и необходимости активной диуретической терапии, длительном постельном режиме, появлении признаков флеботромбоза показана профилактическая антикоагулянтная терапия (обычно – подкожное введение гепарина по 5000 ЕД 2 раза в сутки или низкомолекулярного гепарина 1 раз в сутки). У пациентов с первичной легочной гипертензией применяют непрямые антикоагулянты (варфарин) под контролем МНО. Варфарин увеличивает выживаемость больных, однако не влияет на их общее состояние.
Таким образом, в современной клинической практике медикаментозное лечение легочного сердца сводится к терапии сердечной недостаточности (диуретики, ингибиторы АПФ), а также к применению антагонистов кальция и препаратов теофиллина для снижения легочной гипертензии. Хороший эффект на терапию антагонистами кальция значительно улучшает прогноз этих пациентов, а отсутствие эффекта требует применения препаратов других классов, что ограничено сложностью их использования, высокой вероятностью развития побочных эффектов, высокой стоимостью лечения, а в ряде случаев – недостаточной изученностью вопроса.
Читайте также:
