Допплеровское исследование ригидности миокарда. Факторы влияющие на ригидность миокарда
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Систолическая жесткость сосудов и миокарда. Дисфункция предсердий и перегрузка объемом
Учитывая, что сердечная недостаточность с нормальной фракцией выброса (СНнФВ) развивается в популяции пожилых с широким спектром ССЗ, существуют очевидные различия сердечного фенотипа сердечной недостаточностью с нормальной фракцией выброса (СНнФВ) в разных регионах и этнических группах, а эпизоды острой декомпенсации при сердечной недостаточностью с нормальной фракцией выброса (СНнФВ) связаны с различными провоцирующими факторами. Вполне вероятно, что кроме диастолической функции ЛЖ существуют другие факторы, вносящие свой вклад в патофизиологию и клиническую картину сердечной недостаточностью с нормальной фракцией выброса (СНнФВ) у некоторых пациентов.
В исследованиях с использованием различных индексов установлено, что систолическая сосудистая и желудочковая ригидность с возрастом увеличивается и чаще наблюдается у женщин. Хронические изменения систолической ригидности ЛЖ в сочетании с изменениями сосудистой жесткости могут представлять собой сердечно-сосудистую адаптацию для поддержания оптимальных условий желудочко-сосудистого взаимодействия и, следовательно, оптимальной работы сердца.
Хотя желудочко-сосудистое взаимодействие помогает поддерживать УО и механическую эффективность, увеличение конечной систолической эластичности может иметь неблагоприятные последствия. Это увеличение указывает на повышение чувствительности систолического давления к изменениям объема (о чем свидетельствует более крутой наклон кривой отношения КСД/КСО). Таким образом, объем перегрузки у таких лиц может быть связан с большим увеличением систолического артериального давления.
Увеличение систолической артериальной и желудочковой ригидности приводит к нарушениям релаксации ЛЖ. Таким образом, возрастные изменения систолической желудочковой и сосудистой ригидности могут способствовать увеличению САД ЛЖ, диастолического давления ЛЖ при ФН и предрасполагать к СНнФВ, особенно в сочетании с сопутствующими изменениями в релаксации и диастолической жесткости. Тем не менее систолическая желудочковая и сосудистая ригидность объясняет симптомы СНнФВ, вызванные ФН или другими стресс-тестами, у пациентов с ненарушенной диастолической функцией в покос.
Следует отметить, что функция предсердий играет важную роль в патогенезе сердечной недостаточности с нормальной фракцией выброса (СНнФВ). Начальное и среднсдиастолическое давление в ЛЖ (и соответственно, ЛП), а также систолическое давление в предсердиях (предсердная V-волна) вносят существенный вклад в среднее давление в ЛП, что позволяет преодолеть сопротивление, с которым сталкивается венозная система легких. При сердечной недостаточности с нормальной фракцией выброса (СНнФВ)объем ЛП увеличивается, а систолическая и диастолическая функции нарушаются.
В повседневной работе часто забывают, что гемодинамическим признаком рестриктивной КМП является наличие больших V-волн в кривой давления в ЛП при отсутствии митральной регургитации, что свидетельствует о снижении податливости ЛП. Это снижение сильно влияет на развитие ЛАГ при заболеваниях МК и, вероятно, может играть аналогичную роль при сердечной недостаточности с нормальной фракцией выброса (СНнФВ). Снижение систолической функции ЛЖ приводит к ограничению наполнения ЛЖ в условиях нарушенной релаксации и требует более высокого среднего давления в ЛП для увеличения раннего диастолического наполнения. Таким образом, увеличение предсердий и нарушение их функции может способствовать развитию СНнФВ.
Нейрогуморальная активация играет ведущую роль в прогрессировании СН у больных с СНсФВ. Активация СНС и системы НУП происходит при СН независимо от величины ФВ. Активация других регуляторпых гормонов, таких как ренин, AT II, альдостерон и ЭТ, у больных с СНнФВ возможна, но требует уточнения.
У пациентов с СНнФВ ФВ остается в норме, однако некоторые исследования выявили, что другие доиилерографические параметры сократимости у пациентов с доклинической диастолической дисфункцией или СНнФВ уменьшаются, несмотря на нормальную ФВ. В других работах, изучавших эти и другие показатели сократительной функции миокарда, не были обнаружены нарушения систолической функции у пациентов с СНнФВ. Даже если незначительные изменения систолической функции действительно происходят, их роль и патогенезе СНнФВ остается неясной. Более важен вопрос — возможен ли переход СНнФВ в СНсФВ, как это часто предполагают, однако на настоящее время отсутствуют доказательства этого перехода.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Допплеровское исследование ригидности миокарда. Факторы влияющие на ригидность миокарда
Результаты допплеровского исследования могут дать косвенную информацию о ригидности ЛЖ. Если существуют допплерографические признаки увеличенного давления наполнения (повышенное отношение Е/е', инверсия Е/А при пробе Valsalva или снижение скорости легочного венозного кровотока во время систолы) и нормальный размер или объем ЛЖ, можно предположить повышенную ригидность ЛЖ. Если время замедления ранней диастолической скорости трансмитрального потока укорочено, несмотря на доказанные нарушения релаксации (снижение ранней диастолической скорости митрального кольца, оцененной с помощью TDI), можно предположить быстрое выравнивание давления в ЛП и ЛЖ во время раннего диастолического наполнения и увеличенную диастолическую жесткость.
Поскольку эти параметры допплеровского исследования оценивают во время одного цикла, на них распространяются те же ограничения, как и на инвазивные методы с использованием одного сердечного цикла, т.е. они отражают рабочую ригидность при конкретном диастолическом объеме и находятся под влиянием внешних сил.
Как отмечено в некоторых исследованиях, диастолическая жесткость зависит от ряда факторов, которые влияют на внеклеточный матрикс сердца, клеточные процессы на уровне КМЦ и собственно миофибрилл.
Внеклеточный матрикс состоит из фибриллярных белков, таких как коллаген типа I (преобладающая форма в миокарде) и типа III, эластина и протеогликанов, и белков базальных мембран, таких как коллаген типа IV, ламинин и фибронектин, Миокардиальная сеть коллагеновых волокон включает эндомизиальные волокна, окружающие отдельные КМЦ и капилляры, перимизиальные волокна, которые вплетаются в мышечные пучки, и эпимизиальные волокна, которые образуют матрицу, прилегающую к поверхностям эпикарда и эндокарда.
Внеклеточный матрикс динамичен и регулируется многими физическими, гуморальными и воспалительными медиаторами, которые модулируют продукцию и распад коллагена. Внеклеточный матрикс увеличивается при состояниях, связанных с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ), например при гипертоническом сердце и КБС. Экспериментальные исследования выявили, что разрушение перимизиальных волокон при введении коллагеназы приводит к снижению жесткости ЛЖ.
Модели на животных демонстрируют, что воздействия, связанные с увеличением или уменьшением фиброза миокарда, характеризуются увеличением или уменьшением диастолической ригидности ЛЖ соответственно. Таким образом, доказано, что внеклеточный матрикс способствует диастолической дисфункции, увеличивая диастолическую жесткость или ухудшая релаксацию путем изменения региональной нагрузки или однородности, поэтому рекомендуется лечение фиброза в качестве цели терапии СНнФВ. Как упоминалось ранее, посттрансляционная модификация коллагеновых волокон путем формирования коллагена неферментативным сшиванием (усовершенствованными конечными продуктами гликозилирования) показала увеличение диастолической жесткости.
Гигантские молекулы титина также вносят свой вклад в диастолическое напряжение миокарда. Ряд факторов, в т.ч. усеченные изоформы титина (менее совместимые изоформы N2B), состояние фосфорилированного титина, взаимодействие титина с кальцием и с другими сигнальными молекулами и ионными каналами, может способствовать влиянию титина на диастолическую жесткость. Считают, что титин может изменяться при взаимодействии с внеклеточным матриксом, но это взаимодействие хорошо не изучено.
К сожалению, наши знания о роли изменения титина и его взаимодействий у пациентов с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ) крайне ограничены, и многое еще предстоит уточнить.
Установлено, что релаксация чувствительна к изменениям в энергоснабжении, поэтому ее расценивают как активный процесс, а диастолическую жесткость характеризуют как пассивный процесс. Эта оценка, вероятно, неточна, т.к. уменьшение энергоснабжения (как при ишемии) может привести к снижению диастолической растяжимости, а процесс фосфорилирования титина может протекать остро (как и у факторов, ведущих к формированию стойких соединений).
При патологических состояниях, связанных с гипертрофией, могут происходить и другие структурные изменения в КМЦ, например изменение плотности Т-трубочек, которое влияет па диастолическую жесткость.
Трудности, возникающие при описании диастолической ригидности ЛЖ, связаны с малым количеством исследований, посвященных изучению диастолической жесткости у пациентов с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ). Большинство исследователей выявили наличие диастолической жесткости у пациентов с СНнФВ по сравнению с группой контроля того же возраста, но с другими заболеваниями, без СН.
Факторы влияющие на релаксацию миокарда. Признаки нарушения релаксации миокарда
Сокращение и расслабление регулируются сложным взаимодействием актина, тропомиозина, миозина и регуляторными белками ТрТ, TpI и ТрС с кальцием и фосфорилирующей протеинкиназой, а также АТФ и АДФ. В то время как связывающий кальций ТрС освобождает его от ингибиро-вания TpI, тем самым способствуя актин-миозиновым взаимодействиям, фосфорилирование TpI восстанавливает его ингибирующую роль и ускоряет релаксацию.
Как отмечалось ранее, TpI и его фосфорилирование, по всей видимости, регулирует индуцированные нагрузкой изменения релаксации. В связи с тем что при СН существуют некоторые признаки уменьшения фосфорилирования TpI, возможны более важные терапевтические последствия; именно поэтому методы повышения фосфорилирования TpI могут стать терапевтической стратегией, т.к. индуцированные нагрузкой нарушения релаксации могут способствовать повышению давления наполнения и появлению симптомов при СНнФВ.
Энергетическая поддержка (потребление АТФ) может влиять на релаксацию путем регулирования обратного захвата кальция Са2+-АТФазой СР, влияя на актин-миозиновые мостики в области головки миозина, где челночный механизм обмена фосфокреатина обеспечивает доставку АТФ из митохондрий и удаление АДФ и неорганического фосфата из области актин-миозиновых мостиков. Недостаточное количество АТФ и повышение уровня АДФ нарушает и разрушает актин-миозиновые мостики и замедляет релаксацию.
Острая ишемия вызывает нарушение и неполную релаксацию через снижение уровня АТФ и уменьшение внутриклеточного рН. Нарушенная релаксация является первым функциональным изменением при острой ишемии; также описан одновременный сдвиг диастолического отношения давление/объем вверх (сниженная растяжимость) наряду с ухудшением релаксации и тахикардией, которая усиливает действие релаксации на давление наполнения и вносит спой вклад в повышение давления наполнения при ишемии. Гипертрофированное сердце более чувствительно к ишемии, поскольку в результате ишемии происходим большее увеличение давления наполнения.
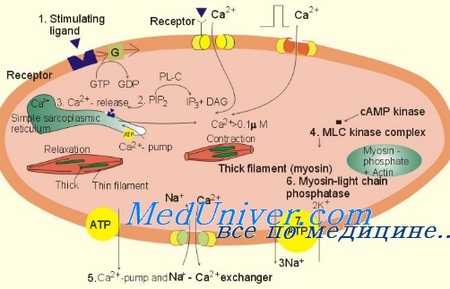
Следует признать, что диастолическая релаксация связана с систолической функцией эффектом восстановления. Когда сократимость ЛЖ ниже критического объема, потенциальная энергия сохраняется, что ускоряет релаксацию во время последующей диастолы. Этот процесс называют эластической отдачей, и факторы, которые влияют на силу систолы, могут влиять на скорость и степень релаксации.
Признаки нарушения релаксации миокарда
Результаты исследований с участием пациентов с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ), на старых собаках с АГ и с помощью математических моделированных систем поддерживают концепцию, что нарушение релаксации может способствовать повышению среднего диастолического давления в ЛЖ при СНнФВ и увеличении ЧСС. Более того, любой другой фактор, который укорачивает период диастолического наполнения (замедленное сокращение или длинный интервал PR), будет усиливать воздействие нарушенной релаксации ЛЖ на диастолическое давление во время наполнения и таким образом влиять на среднее давление в ЛП, необходимое для наполнения ЛЖ.
В исследованиях у пациентов с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ) отмечено среднее значение т=60 мсек (при ЧСС ~ 70 уд/мин) с увеличением значений до 86 мсек при ФН. Можно ли использовать терапию для улучшения релаксации непосредственно, а также может ли такая терапия облегчать симптомы — эти вопросы требуют активного изучения.
Пациенты с нарушенной релаксацией и повышенной зависимостью от сокращения предсердий имеют риск развития СН при возникновении пароксизма ФП. Острое уменьшение наполнения, связанное с потерей систолической активности предсердий, ассоциировано с увеличением ЧСС и приводит к острому повышению давления в ЛП для поддержания его наполнения. В противоположность этому у здоровых людей с нормальными релаксацией и ранним диастол и ческим наполнением зависимость от потока медленного наполнения желудочков и предсердного наполнения минимальна, поэтому менее вероятно, что острое возникновение ФП может вызвать острый отек легких.
Диастолическая ригидность (жесткость) левого желудочка. Оценка диастолической ригидности миокарда
Ригидность (жесткость) и эластичность определяются как соотношение между изменением напряжения и результирующим растяжением. На уровне сердечной камеры эластичность ЛЖ меняется в зависимости от сердечного цикла (эластичность, меняющаяся во времени), а конечная систолическая эластичность и конечная диастолическая эластичность определяются как изменения систолического и диастолического давлений, связанных с изменением конечного систолического объема и конечного диастолического объема.
Увеличение диастолической ригидности будет приводить к повышению давления в ЛП для поддержания наполнения, тем самым способствуя высокому легочному венозному давлению и застою в легких (если давление в ЛП повышено) или сниженному СВ (если давление в ЛП не повышено).
При остром изменении преднагрузки измерение диастолической жесткости ЛЖ требует одновременной оценки давления и объема для определения отношения КДД/КДО при определенной преднагрузке за несколько сердечных циклов. Кроме того, давление и объем можно измерить в течение одного сердечного сокращения, а измерение стационарной и диастолической части кривой объем-давление можно использовать для оценки жесткости. Однако этот способ имеет три существенных ограничения.
Во-первых, отношение КДД/КДО является криволинейным, и жесткость, измеренная при высоком рабочем объеме (действующая жесткость), будет выше, чем при сокращении с низким рабочим объемом. Второе ограничение связано с влиянием нарушенной релаксации на контур диастолического отношения давление/объем в течение одного сердечного сокращении. При здоровом желудочке релаксация в норме, и минимальное давление в ЛЖ возникает в начале диастолы, экспоненциально возрастая в середине и в конце нее. Таким образом, на отношение давление/объем в середине и конце диастолы влияет только пассивная жесткость желудочка, а значения давления и объема, измеренные в течение одного сердечного цикла, будут соответствовать экспоненциальной зависимости, что позволяет рассчитать константу жесткости: Р = а х ebv, где В — константа жесткости, а — константа угла наклона.
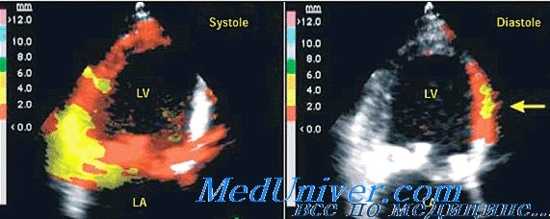
Однако при значительном снижении релаксации она может продолжаться дольше середины диастолы, тогда длительность релаксации определяется степенью недостаточности релаксации, ЧСС и продолжительностью сокращения. Таким образом, минимальное давление в ЛЖ развивается в конце диастолы позднее, а диастолическое отношение давление/объем за одно сокращение зависит от расслабления и пассивной ригидности. Это ограничение лучше избегать, используя для определения КДД/КДО снижение преднагрузки и исключая измерения в другие периоды диастолы, которые могут повлиять на релаксацию. Иногда используют математические методы для коррекции влияния релаксации на диастолическое давление, определяемое за одно сокращение. Но метод оценки одного сокращения не может исключить влияние внешних сил (констрикция перикарда, межжелудочковое взаимодействие) на диастолическое давление ЛЖ.
Другое важное ограничение методов оценки диастолической ригидности (как за одно сокращение, так и за несколько) возникает, если нужно выразить позицию и контур экспоненциального КДД/КДО как единое значение для сравнения этого параметра между группами (с сердечной недостаточностью с нормальной фракцией выброса и контрольной). При использовании оценки отношения КДД/КДО за несколько сокращений выражают с помощью одного из двух часто используемых экспоненциальных уравнений:
В этих уравнениях коэффициент угла наклона (а) и коэффициент жесткости (р) рассчитывают, а константу жесткости используют для характеристики ригидности желудочка. Во втором уравнении давление смещения также рассчитано (Р0), что позволяет количественно оценить изменения в КДД/КДО. Однако, поскольку показатели КДД и КДО, полученные в эксперименте, не являются совершенно моноэкспоненциальными, данные, подготовленные для этих уравнений, могут часто давать очень разные значения а и b, даже если кривые выглядят одинаково. Например, если В не увеличился, но а был увеличен, нельзя считать, что ригидность оставалась нормальной.
Кроме того, такое положение может привести к значительной изменчивости для средних а и В, что затрудняет выявление различий между малыми группами. Это ограничение можно преодолеть путем преобразования экспоненциальной зависимости КДД и КДО линейным построением натурального логарифма (ln) КДД от КДО: ln КДД = In a + В(КДО).
Отклонение этого отношения (В) можно сравнивать, контролируя сопутствующие изменения ln а и для групп пациентов с помощью множественного линейного регрессионного анализа. Кроме того, измерения а и В можно использовать для расчета КДО при установленном КДД (например, КДД = 20 мм рт. ст.), а объем (КДО ~ 20 мм рт. ст.) можно сравнить между группами с меньшим объемом при общем КДД, отражающем увеличение диастолической жесткости. Совсем недавно был описан теоретический метод оценки КДД/КДО по единичным данным КДД и КДО, который позволяет оценивать диастолическую жесткость за одно сердечное сокращение с использованием инвазивных или неинвазивных показателей.
Последнее ограничение для любого инвазивного метола, характеризующего диастолическую жесткость через КДД/КДО, — значительные технические трудности при мгновенном измерении КДО и КДД, поскольку результаты могут быть неточными, особенно в клинических исследованиях. Использование катетера с просветом позволяет немедленно измерить давление и объем. Кроме того, в клинических исследованиях проводят инвазивное измерение давления в ЛЖ одновременно с ЭхоКГ, контрастной вентрикулографией и радионуклидной ангиографией.
Значение миокардиального рабочего индекса в диагностике гипертрофии миокарда левого желудочка (данные тканевого допплеровского исследования)
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Миокардиальный рабочий индекс (МРИ) - один из наиболее информативных показателей «глобальной» сократимости миокарда [1, 2]. Он описан A. Stoylen и соавт. как «. индекс суммарной работы миокарда (MRI)» и рассчитывается методом допплер-эхокардиографии (Д-ЭхоКГ) по графику допплеровского спектра трансмитрального потока: MRI = (ИВС+ИВР)/ПИКлж, где (ИВС+ИВР) - суммарное изометрическое состояние миокарда, ПИКлж - период изгнания крови из ЛЖ [3]. Этот индекс по сути характеризует соотношение потенциальной (суммарное изометрическое состояние) и кинетической (период динамического изгнания крови из ЛЖ) энергии миокарда ЛЖ. Использование данного индекса ограничено при правожелудочковой дисфункции у больных с сопутствующей легочной патологией и с легочной гипертензией.
В 1995 г. С. Tei и соавт. [4] впервые предложили рассчитывать МРИ (Tei индекс) по допплеровскому спектру трансмитрального и трансаортального потоков при Д-ЭхоКГ. Представляются важными изучение и сравнение значений МРИ, полученных в режиме импульсно-волновой тканевой допплерографии (ТД) и при постобработке тканевого допплеровского изображения (ТДИ).
Цель работы - с помощью методик тканевого допплеровского исследования миокарда (ТД и ТДИ) изучить значимость миокардиального рабочего индекса «Tei» (tМРИ) при гипертрофии ЛЖ у больных с артериальной гипертензией (АГ).
Материал и методы
Для решения поставленной задачи были обследованы 110 человек, из них 80 больных с АГ со стабильным превышением нормативов систолического (САД) и диастолического (ДАД) АД на фоне гипотензивной терапии (критерии ЕОАГ-ЕОК) и с превышением индекса массы миокарда ЛЖ (ИММЛЖ), по данным ЭхоКГ, выше нормативов и 30 здоровых добровольцев, составивших контрольную группу. Все больные были разделены на 2 группы. Степени АГ устанавливались в соответствии с классификацией ЕОАГ-ЕОК. Обследованные пациенты с АГ были разделены на 2 группы по выраженности гипертрофии миокарда ЛЖ с учетом значения ИММЛЖ, рассчитанных в В-режиме ЭхоКГ по программе A-L, с критериями гипертрофии по ИММЛЖ. Наличие гипертрофии определялось по критерию Helak (1981), выраженность гипертрофии миокарда ЛЖ - по значению ИММЛЖ (рекомендации ASE 2005). К 1-й группе были отнесены 40 больных с АГ 1-й (36, или 90%) и 2-й (4, или 10%) степени и с 30-40% гипертрофией ЛЖ, которую расценивали как незначительную или умеренную. Среди больных этой группы были 22 (55%) мужчины и 18 (45%) женщин. Значение ИММЛЖ в контроле составило 74,9±8,0 г/м² (р<0,0001), у больных 2-й группы оно было наибольшим и составило 151,8±32,0 г/м² (при р2-1,к<0,0001), в то время как в 1-й группе - соответственно 102,9±14,3 г/м². Средний возраст пациентов 1-й группы составил 54,7±13,8 года. Во 2-ю группу вошли 40 больных с АГ 2-й (2, или 5%) и 3-й степени (38, или 95%) с более чем 200% гипертрофией ЛЖ, которую расценивали как выраженную. В этой группе были 18 (45%) мужчин и 22 (55%) женщины (средний возраст 56,0±11,1 года). В контрольную группу из 30 человек с нормальными значениями ИММЛЖ вошли 18 (60%) мужчин и 12 (40%) женщин (средний возраст 52,0±12,9 года).
Методика импульсно-волновой ТД
Анализ продольного движения миокарда проводился в верхушечном 4-камерном срезе сердца с синхронной записью мониторного отведения ЭКГ при задержке дыхания пациента в течение 5-10 сердечных циклов (рис. 1). Контрольный объем (5x8 мм) ТД размещался в латеральной и медиальной частях фиброзного кольца митрального клапана (МФК). Точкой начала отсчета временных фаз считали зубец R ЭКГ. Проводился анализ параметров ТД от латеральной (МФКл) и медиальной (МФКм) частей фиброзного кольца митрального клапана: ТМРИ вычислялся по ТД в медиальной и латеральной частях МФК по графикам максимальной скорости движения МФК как отношение разницы временного интервала между началом положительной волны ИВС до начала «Еm» (a’) и временем систолической волны Sm (b’), по формуле:
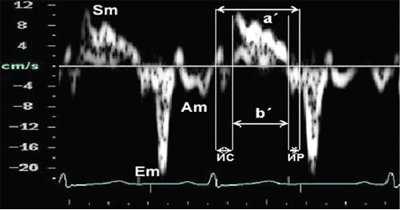
Рис. 1. Принцип расчета ТМРИ по ТД фиброзного кольца митрального клапана.
Читайте также:
- Капиллярная телеангиэктазия головного мозга на МРТ
- Слои поднижнечелюстного треугольника. Нижнечелюстная слюнная железа. Топография нижнечелюстной слюной железы. Лицевая артерия. Лицевая вена.
- Опрос при эпилепсии. Анамнез при эпилепсии
- Лечение интрамедуллярной опухоли спинного мозга
- Симптомы и лечение ишиаса - что это за болезнь?
