ЭхоКГ кальциноза митрального клапана
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Идиопатический кальциноз кольца митрального клапана (КМК) часто диагностируется при эхокардиографическом (эхоКГ) исследовании или компьютерной томографии (КТ) сердца у взрослых. Результаты Фремингемского исследования, выявившие умеренную связь КМК с комбинированным исходом, включающим инфаркт миокарда, нестабильную стенокардию, застойную сердечную недостаточность и негеморрагический инсульт, привлекли внимание к КМК как к вероятному фактору риска или маркеру неблагоприятных сердечно-сосудистых событий [1]. Ассоциация КМК с повышенным риском смерти от сосудистых заболеваний была подтверждена и при длительном наблюдении большой когорты больных разных этнических групп в недавнем исследовании Northern Manhattan Study [2]. Однако клиническое значение КМК остается недостаточно ясным, и обычно КМК расценивается кардиологами просто как случайная находка инструментального исследования [3].
Частота КМК у взрослых колеблется от 6,1 до 15% в популяционных исследованиях [4–6], до 35% у больных с тяжелой ишемической болезнью сердца (ИБС) [7]. КМК чаще отмечается у больных пожилого возраста, приводятся данные о выявлении КМК почти у трети людей в возрасте старше 75 лет [8–10] и почти у всех долгожителей [11]. Соответственно, наблюдается повышение заболеваемости КМК на фоне постарения населения. В любых возрастных группах очевидна высокая вероятность возникновения КМК у женщин [1, 5, 12, 13].
По данным патоморфологических исследований, кальцинаты локализуются в фиброзной части митрального кольца, чаще всего в местах прикрепления задней створки митрального клапана (МК), при этом возможны деформация и предсердное смещение створки, изредка в участке кальциноза возникает казеозный некроз или изъязвление [12, 13]. Размеры кальцинатов могут варьировать от микроскопических, которые рассматриваются как начальная стадия процесса [12], до массивного поражения всего клапанного кольца. Гистологически в фиброзном кольце наблюдаются очаги кальцинированных и некротических тканей, иногда возможно формирование участков хрящевой ткани и зрелой ламеллярной кости; в окружающих тканях наблюдается пролиферация мелких сосудов и инфильтрация клетками воспаления [12, 13]. Кальцинаты могут распространяться вдоль митральной створки, врастать в прилежащий миокард левого желудочка (ЛЖ) или выступать между стенкой желудочка и створкой клапана.
Патогенез и механизмы развития КМК изучены недостаточно. Ультраструктурные исследования ткани фиброзного КМК, которые показали, что кальций откладывается в интерстиции на продуктах деградации миофибробластов, позволили Р. Arounlangsy и соавторам [12] предположить ведущую роль в индукции КМК апоптоза или некроза интерстициальных клеток (как и при кальцинозе аортального клапана и медии аорты). Дегенерация интерстициальных клеток может быть связана со старением, повышенной гемодинамической нагрузкой на МК [14], локальным неспецифическим воспалением [15] и, возможно, с наличием так называемых кальцинирующих нанобактерий [16]. КМК может осложнять первичные дегенеративные заболевания МК (болезнь Барлоу, фиброэластический дефицит, синдром Марфана, синдром Элерса — Данлоса) [17]. Хондро- и остеогенез в КМК происходит с участием остеобластоподобных клеток и нарушением нормального баланса между стимуляцией и ингибированием кальцификации и имеет много общего с механизмами формирования кальциноза сосудов при атеросклерозе [18]. Клинические и патоморфологические исследования также указывают на связь КМК с атеросклеротическим кальцинозом артерий, которая может быть обусловлена как генетической предрасположенностью пациентов к эктопической кальцификации, так и общностью факторов риска этих патологических состояний [19].
Еще в исследованиях 60–90-х годов XX в. было замечено частое сочетание идиопатического КМК с артериальной гипертензией (АГ), ИБС, ишемическим инсультом и сахарным диабетом (СД), которые относятся к факторам риска атеросклероза либо являются проявлениями атеросклероза [13, 20–22]. В настоящее время имеются многочисленные доказательства ассоциации КМК с гиперлипидемией и дислипидемией [1, 2, 23, 24]; описана достоверная связь гиперхолестеринемии и КМК с относительным риском (ОР) 2,86 (р = 0,02) [23]; связь КМК с гиперлипидемией не нашла подтверждения только в единичных исследованиях [22]. Связь КМК и АГ оценивается не столь однозначно, хотя правдоподобно предположение, что большая нагрузка на МК при АГ способствует изменениям движения створок и может ускорять дегенеративный процесс в КМК, приводя к отложению кальция [25]. В крупном исследовании MESA (Multi-Ethnic Study of Atherosclerosis) [6] артериальное давление было сравнительно выше у больных с КМК, но при многофакторном регрессионном анализе с учетом возраста значимой связи КМК с АГ установлено не было. С другой стороны, M.A. Allison и соавторы в исследовании, целью которого было определить существует ли независимая от традиционных факторов риска связь атеросклеротической кальцификации сосудов с КМК, констатировали, что возраст и анамнез АГ были единственными традиционными факторами риска, общими для атеросклероза и КМК [19]. АГ имела значимую связь с развитием КМК у лиц в возрасте моложе 65 лет, по данным H. Chu и соавторов [26], и у лиц в возрасте моложе 60 лет, по данным C.K. Nair и соавторов [22]. В отдельных исследованиях, проведенных для проверки предположения о том, что в патогенезе КМК может иметь значение воспаление, у больных с КМК наблюдался сравнительно более высокий уровень С-реактивного белка и других маркеров системного воспаления [27, 28]. В исследовании MESA наряду с такими характеристиками, как возраст и женский пол, КМК был связан с повышенным индексом массы тела (р = 0,03) и курением в анамнезе (р < 0,008) [6]. Многими исследованиями была доказана сильная связь КМК с СД [22, 23]. Получены данные, позволяющие предполагать отличие механизмов кальциноза сосудов и структур сердца у пациентов с СД и без этого заболевания [29, 30]. Ключ для понимания связи КМК и факторов сердечно-сосудистого риска дают результаты недавно опубликованного самого продолжительного из существующих, 25-летнего проспективного наблюдения в популяции Фремингемского исследования, согласно которому начало воздействия комбинации факторов риска атеросклероза в молодом и среднем возрасте ассоциировано с развитием КМК через 25–30 лет [27].
Для поддержания гипотезы о том, что КМК разделяет общие факторы риска и механизмы развития атеросклероза или даже является формой атеросклероза, многими исследованиями была продемонстрирована значимая связь выраженности КМК с большей распространенностью атером аорты, частотой стеноза сонной и коронарной артерий, стенозов периферических артерий [7, 31–34]. M.A. Allison и соавторы при многофакторном анализе с учетом возраста, пола и факторов риска сердечно-сосудистой патологии выявили, что наиболее высокий риск КМК характерен для пациентов с кальцинозом брюшного отдела аорты (отношение шансов (ОШ) 5,1; р = 0,01) [19]. Недавно было показано, что КМК, диагностированный при КТ, имел независимую от других факторов риска связь с наличием (ОШ 9,36; р = 0,015) и распространенностью всех атеросклеротических бляшек в коронарных артериях, распространенностью кальцинированных бляшек, а также характеристиками нестабильности бляшек [35]. Предлагается использовать полуколичественную оценку кальциноза МК или общей кальцификации сердца по данным КТ или эхоКГ в качестве маркера субклинического атеросклероза и предиктора выраженности кальциноза коронарных артерий [36]. Как уже было отмечено, существуют многочисленные доказательства повышения риска инфаркта миокарда, ИБС, а также других сердечно-сосудистых событий в прямой зависимости от выраженности КМК [1, 2, 26, 32, 35, 36]. Ряд недавно опубликованных крупных проспективных исследований [2, 7, 19, 31, 37] и метаанализ [38] подтверждают взаимосвязь КМК и атеросклероза сосудов различной локализации у людей разных этнических и возрастных групп с разными категориями риска сердечно-сосудистых заболеваний, однако оценка причинно-следственных взаимоотношений КМК и атеросклероза остается неоднозначной. Атеросклероз коронарных артерий имеет такую же зависимость от возраста, как и КМК [39], и не исключено, что, разделяя некоторые другие общие факторы риска и патогенетические механизмы, КМК является маркером, не имеющим прямой причинно-следственной связи с атеросклерозом коронарных артерий [2].
Влияние КМК на риск ишемических инсультов у пожилых больных изучалось в крупных эпидемиологических исследованиях и оценивается противоречиво. Во Фремингемском исследовании у больных пожилого возраста с КМК независимо от наличия фибрилляции предсердий (ФП) риск инсультов был повышен примерно в 2 раза [21], а в исследовании SPAF (Stroke Prevention in Atrial Fibrillation) после исключения из анализа больных с ФП КМК не был связан с повышением риска инсультов [40]. В проспективном исследовании Cardiovascular Health Study не наблюдалось достоверного влияния КМК на частоту инсультов у больных пожилого возраста [41], а в исследовании The Northern Manhattan Study достоверное повышение риска инсультов было связано только с КМК толщиной > 4 мм [2]. Недавно были опубликованы данные о более частом выявлении при магнитно-резонансной томографии у больных пожилого возраста с КМК перенесенных латентных инсультов [42]. Остается неясным, насколько влияние КМК на риск ишемических инсультов реализуется непосредственно за счет тромбообразования на кальцинатах [43], через предрасполагающие к тромбозу ушка левого предсердия (ЛП) состояния, такие как ФП [5] и увеличение ЛП [4], или происходят эмболии фрагментами кальцината [44].
Некоторые особенности клинической картины и структурные изменения сердца, ассоциированные с кольцом митрального клапана
Помимо ассоциации КМК с факторами риска и проявлениями атеросклероза, клинические и эхоКГ-исследования позволяют выделить ряд особенностей клинической картины и ремоделирования сердца, характерных для пациентов с КМК. У больных с КМК достоверно чаще возникают кардиомегалия, застойная сердечная недостаточность, нарушения атриовентрикулярной и внутрижелудочковой проводимости и ФП, типичен систолический шум на верхушке сердца [1, 20, 45]. Часто наблюдается дисфункция МК: митральная регургитация (МР), пролапс МК [4], в редких случаях при идиопатическом КМК описываются эхоКГ-признаки стеноза левого атриовентрикулярного отверстия [46]. В ряде исследований у больных с КМК показаны увеличение размеров и дисфункция ЛП, увеличение индекса массы ЛЖ, диастолическая дисфункция ЛЖ [4, 11, 45, 47] и в отдельных исследованиях — сравнительное снижение фракции выброса [11]. В самом крупном ретроспективном исследовании 24 380 эхокардиограмм, проведенном М. Movahed и соавторами [4] для оценки связи КМК с другими патологическими изменениями эхоКГ-параметров, было показано, что КМК независимо связан с такими структурными изменениями сердца, как увеличение ЛП (ОР 1,3), гипертрофия ЛЖ (ОР 1,9), митральная регургитация (ОР 2,0), трикуспидальная регургитация (ОР 3,8) и аортальный стеноз (ОР 1,4). Эти авторы предположили, что утолщение и ригидность МК при кальцификации может вызывать МР, влияя на закрытие митральных створок [4], хотя не исключается и обратная зависимость: повышение механической нагрузки на КМК при МР может способствовать дегенеративным изменениям и развитию кальциноза. КМК часто сочетается с кальцинозом и дисфункцией аортального клапана, что может отражать предрасположенность больных к генерализованному отложению кальция в сердце, сосудах и внесердечных тканях больных; а с другой стороны, указывать на участие повышенной нагрузки на МК и аортальный клапан, например при АГ в патогенезе КМК [4,26]. Причины и клиническое значение гипертрофии ЛЖ, характерной для больных с идиопатическим КМК [4, 25] не уточнены, а влияние на индекс массы миокарда таких факторов риска гипертрофии ЛЖ, как МР-уровень артериального давления, продолжительность анамнеза АГ, СД, пол, возраст и индекс массы тела [49] изучено недостаточно. В связи с этим обращает внимание повышенная частота КМК у пациентов пожилого возраста с гипертрофической кардиомиопатией [48].
В редких случаях при КМК на поверхности кальцинатов возможно образование небактериального тромбоэндокардита или присоединение инфекционного эндокардита [50, 51].
Вероятность развития идиопатического кальциноза КМК повышается с возрастом. У больных с КМК достоверно чаще выявляются МР-увеличение размеров ЛП, кальциноз и кальцинирующий стеноз аортального клапана, а также гипертрофия и диастолическая дисфункция ЛЖ. К клиническим особенностям, связанным с КМК, относятся систолический шум на верхушке сердца, более частое нарушение атриовентрикулярной и внутрижелудочковой проводимости, а также повышение риска кардиогенных эмболий (особенно в случаях с присоединением ФП или инфекционного эндокардита). КМК чаще наблюдается у больных с гиперлипидемией, умеренно выраженной или тяжелой АГ, выраженным атеросклерозом периферических артерий и ИБС, но, по-видимому, не имеет непосредственной причинно-следственной связи с этими заболеваниями. КМК является маркером неблагоприятных сердечно-сосудистых событий и, вероятно, может способствовать дальнейшему ухудшению функции сердца у пациентов с сердечно-сосудистыми заболеваниями. Этиология и патогенез КМК, а также тактика ведения больных с КМК изучены недостаточно.
Статья печатается в сокращении.
Впервые опубликована в журнале «Рациональная фармакотерапия в кардиологии», 2011, № 7 (4): 483–486.
КАЛЬЦИНОЗ КОЛЬЦА МИТРАЛЬНОГО КЛАПАНА У ПОЖИЛЫХ БОЛЬНЫХ. КЛИНИКО-ЭХОКАРДИОГРАФИЧЕСКАЯ ХАРАКТЕРИСТИКА
Актуальность. Клиническое значение идиопатического кальциноза кольца митрального клапана (КМК), часто диагностируемого при эхокардиографическом исследовании (ЭхоКГ) у пожилых больных, изучено недостаточно. Цель. Изучить клинические и эхокардиографические характеристики состояния сердечно-сосудистой системы у больных c КМК в возрасте от 65 лет и старше без сахарного диабета и почечной недостаточности. Материал и методы. В исследование были включены 100 больных с КМК, последовательно выявленных при трансторакальном 2ДЭхо-КГ исследовании, проведенном в связи с симптомами сердечно-сосудистых заболеваний среди 910 амбулаторных больных в возрасте от 65 лет и старше; 65 из последовательно обследованных больных, у которых не было выявлено КМК, составили группу сравнения. Результаты. Больные с КМК были старше больных без КМК (72,4±5,4 года в сравнении с 70,2±4,3; p<0,05); у них чаще, чем у больных без КМК, наблюдали артериальную гипертензию средней и тяжелой степени (99,0% по сравнению с 90,8%; р<0,05); у них была выше частота перенесенного инфаркта миокарда (стандартизованное отношение заболеваемости [СОЗ] 1,72; 95% доверительный интервал [ДИ] 1,12-2,55; р<0,05) и нарушений внутрисердечной проводимости (СОЗ 3,25; 95%ДИ 2,45-4,30; р<0,05). В то же время частота ишемической болезни сердца (СОЗ 1,12; 95%ДИ 0,9-1,39; р>0,05) и фибрилляции предсердий (СОЗ 0,94; 95%ДИ 0,52-1,56; р>0,05) после стандартизации по возрасту у больных с КМК и без КМК достоверно не отличались. При многофакторном анализе с учетом возраста и уровня общего холестерина получена достоверная связь наличия КМК с клинически выраженным атеросклерозом периферических артерий (р
Ключевые слова
Об авторах
к.м.н., доцент кафедры факультетской терапии
зав. поликлиническим отделением
д.м.н., профессор, зав. кафедрой факультетской терапии
к.м.н., доцент кафедры медицинской кибернетики и информатики
врач функциональной диагностики
Список литературы
1. Movahed M., Saito Y., Ahmadi-Kashani M., Ebrahimi R. Mitral annulus calcification is associated with valvular and cardiac structural abnormalities. Cardiovasc Ultrasound 2007;5:14
2. Fox C.S., Parise H., Vasan R.S. et al. Mitral annular calcification is a predictor for incident atrial fibrillation. Atherosclerosis 2004;173:291-294
4. Koster N.K., Reddy Y.M., Schima S.M., Almeida N.J. Gender-specific echocardiographic findings in nonagenarians with cardiovascular disease. Am J Cardiol 2010;105(2):273-6.
5. Sugiura M., Uchiyama S., Kuwako K. et al. A clinicopathological study on mitral ring calcification. Jpn Heart J 1977;18:154-63.
6. Zhang Y., Safar M.E., Iaria P. et al. Cardiac and arterial calcifications and all-cause mortality in the elderly: the PROTEGER Study. Atherosclerosis 2010;213(2):622-6.
7. Ki Woo Seo, Eun Young Kim, Jeong Eun Kim et al. The Impact of Mitral Annular Calcification on Left Ventricular Function in Nonagenarians. Korean Circ J 2010; 40(6): 260–265.
8. Arounlangsy P., Sawabe M., Izumiyama N., Koike M. Histopathogenesis of Early-stage Mitral Annular Calcification. J Med Dent Sci 2004; 51:35-44.
9. Pomerance A. Pathological and clinical study of calcification of the mitral valve ring. J Clin Path 1970;23: 354-36.
10. Johnson R.C., Leopold J.A., Loscalzo J. Vascular calcification: pathobiological mechanisms and clinical implications. Circ Res 2006;99(10):1044-59.
11. Sell S., Scully R.E. Aging changes in aortic and mitral valves. Histologic and histochemical studies, with observations on the pathogenesis of calcific aortic stenosis and calcification of the mitral annulus. Am J Pathol 1965;46:345-65.
13. Chu H., Chen J., Guo R. The association between cardiac calcification and coronary artery disease. Acta Cardiol 2009;64(4):531-5.
14. Atar S., Jeon D.S., Luo H., Siegel R.J. Mitral annular calcification: a marker of severe coronary artery disease in patients under 65 years old. Heart 2003;89:161-164.
15. Fox C.S., Vasan R.S., Parise H. et al. Mitral annular calcification predicts cardiovascular morbidity and mortality: the Framingham Heart Study. Circulation 2003;107:1492-6.
16. Kohsaka S., Jin Z., Rundek T. et al. Impact of mitral annular calcification on cardiovascular events in a multiethnic community. The Northern Manhattern Study. JACC Cardiovasc Imaging 2008;1(5): 617-23.
17. Chipigina N.S., Urvacheva G.M., Shostak N.A. Clinical importance of idiopathic mitral annular calcification. Rational Pharmacother Card 2011;7(4):483-486. Russian (Чипигина Н.С., Урвачева Г.М., Шостак Н.А. Клиническое значение кальциноза кольца митрального клапана. Рациональная фармакотерапия в Кардиологии 2011; 4:483-485).
18. Gorokhova S.G., Arakeliants A.A. Calcinosis of the heart valves — a chance finding or serious diagnosis? Ter Arkh 2005;77(4):87-90. Russian (Горохова С.Г., Аракелянц А.А. Кальциноз клапанов сердца — случайная находка или серьезный диагноз? Терапевтический архив 2005; 4: 87-90).
20. Adler Y., Fink N., Spector D. et al. Mitral annulus calcification – a window to diffuse atherosclerosis of the vascular system. Atherosclerosis 2001;155(1):1-8.
21. Pressman G.S., Crudu V., Parameswaran-Chandrika A. Can total cardiac calcium predict the coronary calcium score? Int J Cardiol 2011;146(2):202-6.
22. Utsunomiya H., Yamamoto H., Kunita E. et al. Combined presence of aortic valve calcification and mi-tral annular calcification as a marker of the extent and vulnerable characteristics of coronary artery plaque assessed by 64-multidetector computed tomography. Atherosclerosis 2010;213(1):166-72.
23. Bischof T., Schneider J. Degenerative calcification of mitral and aortic valves. Schweiz Rundsch Med Prax 1992;81(19):626-31.
24. Allison M.A., Cheung P., Criqui M.H., Langer R.D., Wright C.M. Mitral and aortic annular calcification are highly associated with systemic calcified atherosclerosis. Circulation 2006; 113: 861–866.
25. Adler Y., Levinger U., Koren A. et al. Association between mitral annulus calcification and peripheral arterial atherosclerotic disease. Angiology 2000;51(8):639-46.
26. Benjamin E.J., Plehn J.F., D’Agostino R.B. et al. Mitral annular calcification and the risk of stroke in an elderly cohort. N Engl J Med 1992;327:374-9
27. Predictors of thromboembolism in atrial fibrillation: II. Echocardiographic features of patients at risk. The Stroke Prevention in Atrial Fibrillation Investigators. Ann Intern Med 1992;116:6–12.
28. Gardin J.M., McClelland R., Kitzman D. et al. M-mode echocardiographic predictors of six- to seven-year incidence of coronary heart disease, stroke, congestive heart failure, and mortality in an elderly cohort (The Cardiovascular Health Study). Am J Cardiol 2001; 87: 1051–1057.
29. Rodriguez C.J., Bartz T.M., Longstreth W.T. et al. Association of Annular Calcification and Aortic Valve Sclerosis With Brain Findings on Magnetic Resonance Imaging in Community Dwelling Older Adults. The Cardiovascular Health Study. J Am Coll Cardiol 2011; 57:2172-2180.
30. Mellino M., Salcedo E.E., Lever H.M. et al. Echographic-quantified severity of mitral anulus calcification: prognostic correlation to related hemodynamic, valvular, rhythm, and conduction abnormalities. Am Heart J 1982;103(2):222-5.;
31. Ariyarajah V., Apiyasawat S., Barac I., Spodick D.H. Is the presence of mitral annular calcification associated with poor left atrial function? Echocardiography 2009;26(8):877-84.
32. Sahasakul Y., Edwards W.D., Naessens J.M., Tajik A.J. Age-related changes in aortic and mitral valve thickness: implications for two-dimensional echocardiography based on an autopsy study of 200 normal human hearts. Am J Cardiol 1988;62(7):424-30.
33. Fulkerson P.K., Beaver B.M., Auseon J.C., Graber H.L. Calcification of the mitral annulus: etiology, clinical associations and therapy. Am J Med 1979; 66(6):967-977.
34. Foppa M., Duncan B.B., Rohde L. Echocardiography-based left ventricular mass estimation. How should we define hypertrophy? Cardiovascular Ultrasound 2005; (3):17.
ФАКТОРЫ, СВЯЗАННЫЕ С КАЛЬЦИНАЦИЕЙ КЛАПАННОГО АППАРАТА СЕРДЦА У ПАЦИЕНТОВ НА ХРОНИЧЕСКОМ ГЕМОДИАЛИЗЕ
ЦЕЛЬ ИССЛЕДОВАНИЯ: определить распространенность и влияние кальцинации митрального (МК) и аортального (АК) клапанов сердца на его функцию в обследованной группе диализных пациентов и установить факторы, связанные с кальцинозом МК и АК, а также наличие связей кальциноза клапанов с уремической остеодистрофией. ПАЦИЕНТЫ И МЕТОДЫ. Обследован 131 пациент с выполненной доплер-эхокардиографией (доплер-ЭхоКГ), мужчин – 75, женщин – 55, в возрасте 51,7+12,6 лет, получавших гемодиализ (ГД) в среднем 77,7±75,6 мес. ИБС выявлена у 55,6% пациентов, сердечная недостаточность (СН) у 50,0% пациентов. Всем больным кроме обычных исследований определяли интактный паратиреоидный гормон (ПТГ), биохимические маркеры воспаления (фибриноген и С-реактивный белок). Состояние АК и МК клапанов по данным доплер-ЭхоКГ оценивали как норму, уплотнение, кальциноз (клапанного кольца или створок). Определяли также наличие стеноза, регургитации АК и МК. Измеряли толщину комплекса интима-медия (КИМ) сонных артерий. У 88 пациентов выполнено суточное мониторирование артериального давления (АД) и у 100 – мониторирование ЭКГ. У 63 пациентов определена минеральная плотность костей (МПК) трех отделов скелета (поясничных позвонков, проксимального отдела бедра и предплечья) методом двухэнергетической рентгеновской абсорбциометрии (ДЭРА) с оценкой по Т-критерию и Z-критерию. Значения МПК более -1 считались нормальными, от -1 до -2,5 – остеопенией (умеренное снижение МПК), менее -2,5 – остеопорозом (значительное снижение МПК). РЕЗУЛЬТАТЫ. Кальциноз клапанов выявлен у 38,9% пациентов: изолированный кальциноз АК – у 3,8%, МК – у 13,0%, обоих клапанов – у 22,1% пациентов. У пациентов с кальцинозом АК чаще наблюдался стеноз этого клапана (χ2=19,8; p<0,001) и была более выражена регургитация (t=3,16; p=0,003). Кальциноз МК также способствовал стенозированию (χ2=17,27; p<,0001) и регургитации (t=2,11; p=0,038). При сравнении групп пациентов, различающихся по наличию кальциноза клапанов, обнаружено, что у пациентов с кальцинозом клапанов был старше возраст (Z=4,02; p<0,001), больше длительность диализного лечения (Z=2,93; p=0,0034), чаще присутствовала ИБС (χ2=6,02; p=0,014), СН (χ2=3,85; p=0,05), были выше уровни ПТГ (Z=2,09;p=0,037) и щелочной фосфатазы (Z=2,93; p=0,0034), больше толщина КИМ (Z=2,45; p=0,014), ниже значения МПК предплечья (Z=1,98; p=0,048), выше значения С-реактивного белка (Z=2,50; p=0,016). Кроме того, у пациентов с кальцинацией клапанов был больше размер левого предсердия (Z=3,67; p=0,001), выше скорость потоков через МК (Z=4,24; p<0,001) и АК (Z=3,79; p<0,001). ЗАКЛЮЧЕНИЕ. Кальциноз АК и МК сердца выявлен у трети обследованных пациентов. Преобладает сочетанная кальцинация этих клапанов. Кальцинация клапанов чаще наблюдалась у пациентов старшего возраста, с более продолжительным лечением на ГД, более выраженным гиперпаратиреозом, воспалительными изменениями, атеросклерозом. Впервые обнаружена связь между кальцинозом клапанов и снижением МПК. Кальцинация клапанов сочеталась с большей частотой ИБС, СН, дилатацией левого предсердия и ускорением потоков через МК и АК.
Ключевые слова
Об авторах
Научно-исследовательский институт нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова
Россия
кафедра пропедевтики внутренних болезней
Научно-исследовательский институт нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова
Россия
кафедра пропедевтики внутренних болезней
Научно-исследовательский институт нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова
Россия
кафедра пропедевтики внутренних болезней
Список литературы
1. Foley RN, Parfrey PS, Harnett JD et al. Clinical and echocardiographic disease in end-stage renal disease: prevalence, associations and prognosis. Kidney Int 1995; 47: 186-192
2. Levey AS, Beto JA, Coronado BE et al. Controlling the epidemic of cardiovascular disease in chronic renal disease: What do we know? What do we need to learn? Where do we go from here? Am J Kid Dis 1998; 32: 853-906
3. Ventura JE, Tavella N, Romero C et al. Aortic valve calcification is an independent factor of left ventricular hypertrophy in patients on maintenance haemodialysis. Nephrol Dial Transplant 2002;17(10): 1795-1801
5. Huting J. Mitral valve calcification as an index of left ventricular dysfunction in patients with end-stage renal disease on peritoneal dialysis. Chest 1994;105(2):383-388
6. Волгина ГВ, Перепеченых ЮВ, Бикбов БТ. Кальцификация клапанов сердца у больных с терминальной хронической почечной недостаточностью. Нефрология и диализ 2001; 3(1)
7. Volgina G, Tomilina N, Lebedev S et al. Cardiac valve calcification in dialysis patients. Nephrol Dial Transpl 2006; 21 [suppl 4]: iv 405
9. Ribeiro S, Ramos A, Brandao A et al. Cardiac valve calcification in haemodialysis patients: role of calciumphosphate metabolism. Nephrol Dial Transplant 1998; 13(8): 2037-2040
10. Jeren-Strujic B, Raos V, Jeren T, Horvatin-Godler S. Comparative study of mitral annular calcification (MAC) with cardiac arrhythmias in dialysis patients. Coll Antropol 1997; 21(1):167-174
11. Umana E, Ahmed W, Alpert MA. Valvular and perivalvular abnormalities in end-stage renal disease. Am J Med Sci 2003; 325(4): 237-242
13. Wang AY, Wang M, Woo J et al. Cardiac valve calcification as an important predictor for all-cause mortality and cardiovascular mortality in long-term peritoneal dialysis patients: a prospective study. J Am Soc Nephrol 2003;14(1): 159-168
14. Rufino M, Garcia S, Jimenez A et al. Heart valve calcification and calcium x phosphorus product in hemodialysis patients: analysis of optimum values for its prevention. Kidney Int 2003; 85 [Suppl]: S115-118
15. Wang AY, Woo J, Wang M et al. Association of inflammation and malnutrition with cardiac valve calcification in continuous ambulatory peritoneal dialysis patients. J Am Soc Nephrol 2001;12(9): 1927-1936
16. Raos V, Jeren-Strujic B, Antos M, Horvatin-Godler S. Frequency of mitral annular calcification in patients on hemodialysis estimated by 2-dimensional echocardiography. Acta Med Croatica 1996; 50(4-5): 179-183
17. Lang RM, Bierig M, Devereux RB et al. Recommendations for Chamber Quantification: A Report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, Developed in Conjunction with the European Association of Echocardiography, a Branch of the European Society of Cardiology. J Am Soc Echocardiogr 2005; 18: 1440-1463
18. Garcia MJ, Thomas JD, Klein AL. New Doppler echocardiographic applications for the study of diastolic function. J Am Coll Cardiol 1998; 32(4): 865-875
20. Bijak K, Matuszkiewicz-Rowinska J, Niemczyk S et al. Valvular and vascular calcifications in patients with chronic kidney disease: the role of dyslipidemia. Nephrol Dial Transpl 2006; 21 [suppl 4]: iv 404
21. Raggi P, Bommer J, Chertow GM. Valvular calcification in hemodialysis patients randomized to calcium-based phosphorus binders or sevelamer. J Heart Valve Dis 2004; 13(1): 134-141
22. Malergue MC, Urena P, Prieur P et al. Incidence and development of aortic stenosis in chronic hemodialysis. An ultrasonographic and biological study of 112 patients. Arch Mal Coeur Vaiss 1997; 90(12): 1595-1601
23. Moe SM, Chen NX. Pathophysiology of vascular calcification in chronic kidney dis. Circul Res 2004; 95: 560
24. Moe SM. Vascular calcification: Hardening of the evidence. Kidney Int 2006; 70(9): 1535-1537
25. Ferramosca E, Bellas A, Muntner P et al. Aortic valve calcification as a marker of coronary artery disease in prevalent hemodialysis patients. Nephrol Dial Transpl 2006; 21 (suppl 4): iv 438
26. Joki N, Hase H, Kishi N et al. Calcaneal osteopenia is a strong predictor for cardiovascular events independent of malnutrition inflammation status in chronic hemodialysis patients. Nephrol Dial Transpl 2005; 20 [suppl 5]: 102
ЭхоКГ кальциноза митрального клапана
Аортальный стеноз, сопровождаемый выраженным кальцинозом, является одним из наиболее часто встречающихся заболеваний аортального клапана в развитых странах [1, 5]. Особенно часто выраженный кальциноз аортального клапана бывает у больных старше 65 лет. Как правило, кальциноз распространяется на прилегающие к аортальному клапану структуры, такие как стенка аорты, межжелудочковая перегородка и передняя створка митрального клапана (МК). Это в значительной степени осложняет протезирование аортального клапана, особенно если кальций переходит на МК и встает вопрос о его коррекции. Протезирование второго клапана увеличивает послеоперационную летальность (от 5 до 12,5%), а также риск развития послеоперационных осложнений [4, 6]. Мы рассмотрим возможность сохранения нормальной функции митрального клапана при его декальцинации.
Цель нашего исследования - оценка непосредственных и отдаленных результатов декальцинации передней створки МК при протезировании аортального клапана.
Материал и методы
В исследование включены 108 больных аортальным пороком, осложненным выраженным кальцинозом, переходящим на переднюю створку МК, находившихся на лечении в отделении хирургии приобретенных пороков сердца РНЦХ им. акад. Б.В. Петровского с 1996 по 2009 г. Средний возраст больных 53,5±10,8 года (от 25 до 88 лет). Лиц мужского пола среди оперированных было 73 (67,6%), женского - 35 (32,4%). Все пациенты относились к III-IV функциональному классу по классификации NYHA.
Этиология аортального порока: ревматизм - в 37,9% (41) наблюдений, двустворчатый аортальный клапан - в 34,3% (37), атеросклероз и дегенеративный порок - в 24,1% (26), инфекционный эндокардит - в 3,7% (4) наблюдений. В рамках предоперационного обследования всем пациентам выполняли ЭКГ, ФКГ, ЭхоКГ, рентгенологическое исследование, лабораторные исследования. Интраоперационно во всех наблюдениях выполняли чреспищеводную эхокардиографию, являющуюся наиболее значимым исследованием для определения показаний к операции и разработки хирургической тактики. Динамику полученных показателей оценивали после операции.
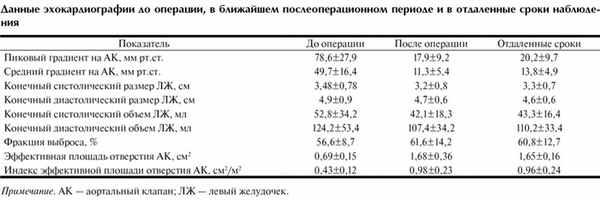
Во всех наблюдениях отмечался выраженный кальциноз аортального клапана (АК), который распространялся на фиброзное кольцо АК и переднюю створку МК. В 22,4% наблюдений кальциноз распространялся на стенку аорты, в 28,2% - на межжелудочковую перегородку или миокард левого желудочка. Пиковый градиент на АК колебался от 46 до 162 мм рт.ст. и в среднем составил 78,6±27,9 мм рт.ст., средний градиент был равен 49,7±16,4 мм рт.ст. (от 35 до 94 мм рт.ст.). Митральная регургитация отмечалась у 89 (82,4%) больных. Регургитация III степени на МК была выявлена у 12 (11,1%) пациентов, II степени - у 53 (49,1%) и I степени - у 24 (22,2%). Показатели предоперационной ЭхоКГ представлены в таблице.
Всем больным были выполнены протезирование АК и декальцинация передней створки МК.
10 больным - дополнительно аортокоронарное шунтирование (наложено от 1 до 5 шунтов, в среднем 1,9). Доступ к сердцу осуществляли через срединную продольную стернотомию. Операции производили в условиях искусственного кровообращения и фармакохолодовой или кровяной кардиоплегии. После аортотомии иссекали и декальцинировали окружающие структуры и переднюю створку МК. В своей практике мы используем метод прецизионной декальцинации с применением увеличительной техники, который позволяет удалять кальций с минимальным повреждением окружающих структур и практически без фрагментации кальцинатов. Используя эту методику также при декальцинации передней створки МК, как правило, удается сохранить клапан. У 2 пациентов отмечалась перфорация передней створки МК после декальцинации в связи с глубоким проникновением кальция. Перфорации ликвидировали с помощью наложения одиночных швов. После декальцинации имплантировали искусственный клапан сердца. В местах, где проводилась декальцинация фиброзного кольца АК, как правило, использовали швы на прокладках (см. рис. 1 на цв. вклейке). Рисунок 1. Интраоперационные фотографии декальцинации митрального клапана. 1 – кальцинированный АК. Рисунок 1. Интраоперационные фотографии декальцинации митрального клапана. 2 – АК иссечен, выраженный кальциноз передней створки МК. Рисунок 1. Интраоперационные фотографии декальцинации митрального клапана. 3 – вид передней створки МК после декальцинации. Рисунок 1. Интраоперационные фотографии декальцинации митрального клапана. 4 - швы на прокладках в области декальцинации митрально-аортального контакта.
В большинстве наблюдений (97) использовали механические аортальные протезы (89,8%), среди них было 19 (19,6%) дисковых и 78 (80,4%) двустворчатых клапанов. В 11 (10,2%) наблюдениях имплантировали биологические клапаны.
Результаты и обсуждение
Всем больным удалось выполнить декальцинацию передней створки МК без замены его на искусственный протез. Госпитальной летальности не было. Среди нелетальных осложнений большинство составляли нарушения ритма и проводимости, потребовавшие проведения временной электрокардиостимуляции (от 1 до 5 дней). Такие осложнения отмечались у 23 (21,3%) пациентов. В 1 (0,9%) наблюдении по поводу полной поперечной блокады был имплантирован постоянный водитель ритма. Эмболия в сосуды головного мозга отмечена у 1 (0,9%) пациента.
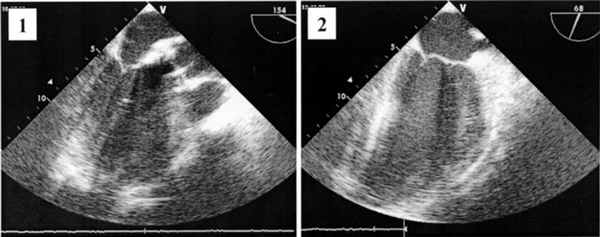
В послеоперационном периоде всем больным выполняли эхокардиографическое исследование. Отмечали достоверное снижение пикового и среднего градиентов давления на АК, что свидетельствует об эффективности хирургической коррекции порока. Пиковый транспротезный градиент после операции равнялся в среднем 17,9±9,2 мм рт.ст. (от 10 до 34 мм рт.ст.). Функция МК признана удовлетворительной у всех больных. Улучшилась подвижность передней створки МК (рис. 2). Рисунок 2. Эхокардиограммы. 1 - до операции; 2 - после операции. Регургитация на МК не превышала I-II степени. У 14 (12,9%) пациентов отмечалась регургитация II степени, у 51 (47,2%) - I степени. Длительность искусственного кровообращения составила в среднем 105,4±27,7 мин (от 54 до 225 мин), продолжительность пережатия аорты - 81,4±24,5 мин (от 39 до 183 мин). Динамика эхокардиографических показателей представлена в таблице.
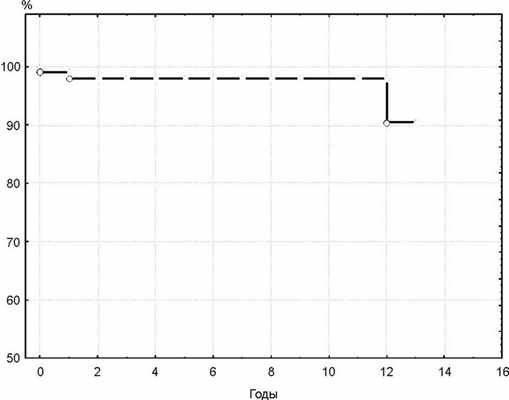
Отдаленные результаты прослежены у 91 (84,3%) больного. Максимальный срок наблюдения 13 лет. В отдаленные сроки умерли 3 больных (через 2 мес, 18 мес и 12 лет после операции). Причиной смерти 2 больных в отдаленном периоде наблюдения был тромбоэндокардит протеза, причина смерти 1 пациента не известна. Общая выживаемость с учетом госпитальной летальности к 1, 6 и 13 годам наблюдения составила 98, 98 и 90% соответственно. Кривая выживаемости больных, построенная с помощью метода Каплана-Мейера, представлена на рис. 3. Рисунок 3. Выживаемость больных с учетом госпитальной летальности.
Отчетливое улучшение состояния в отдаленные сроки наблюдения отмечено у 83 (94,3%) выживших больных. Состояние этих пациентов относится к I-II функциональному классу по NYHA. К III функциональному классу по NYHA относится состояние 5 (5,7%) пациентов.
Повторных операций в связи с дисфункцией протеза или дисфункцией МК в отдаленные сроки наблюдения не было. Хорошие показатели на МК сохранялись и в отдаленном периоде наблюдения. Митральная регургитация I степени отмечается у 43 (48,9%) пациентов, II степени - у 16 (18,2%). При сравнении эхокардиографических данных до- и послеоперационного периода не было отмечено достоверного изменения размеров и объемов левого желудочка, а также изменения показателей его систолической функции. Констатировано достоверное снижение пикового и среднего градиентов давления на АК после операции. По сравнению с данными послеоперационного периода в отдаленные сроки наблюдения не было достоверного изменения таких показателей, как эффективная площадь и индекс эффективной площади отверстия аортального клапана (p>0,5).
Итак, используемая нами техника прецизионной декальцинации практически во всех наблюдениях позволяет сохранить митральный клапан без замены его на искусственный протез. Эта методика дает возможность удалять кальций с минимальным повреждением окружающих структур и практически без фрагментации кальцинатов, что помогает также избежать кальциевых эмболий. В редких наблюдениях кальций проникал на всю толщину створки, в этих ситуациях удалось выполнить ушивание перфорации, образовавшейся после декальцинации. По данным литературы, регургитация на МК выявляется у 67% больных с аортальным стенозом [2]. В нашем исследовании митральная регургитация II-III степени до операции была выявлена у 61,2% пациентов. После декальцинации на основании данных эхокардиографии отмечено улучшение функции МК, что выражалось в улучшении подвижности передней створки митрального клапана и уменьшении митральной регургитации, которая не превышала I-II степени. Хорошие данные эхокардиографического исследования, полученные после операции, сохранялись и в отдаленном периоде наблюдения. Выживаемость больных и отсутствие необходимости повторной операции в отдаленные сроки наблюдения сопоставимы с данными мировой литературы [3].
Таким образом, выраженный кальциноз значительно осложняет протезирование аортального клапана, особенно если он переходит на переднюю створку митрального клапана. Наш опыт операций показывает, что практически во всех наблюдениях удается выполнить декальцинацию митрального клапана без замены его искусственным протезом. Анализ результатов позволяет говорить о хорошей функции митрального клапана как в ближайшем, так и в отдаленном периодах наблюдения.
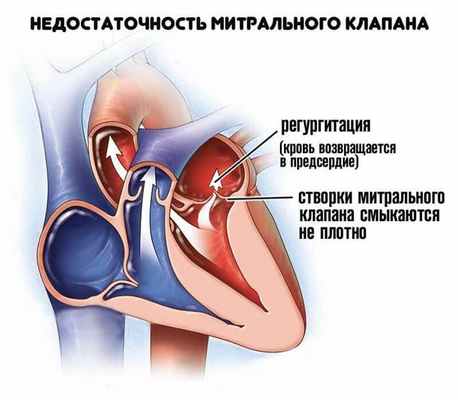
Митральная недостаточность
Митральная недостаточность - несостоятельность клапана, при которой возникает обратное движение крови из левого желудочка в левое предсердие во время сокращения желудочков сердца вследствие неполного смыкания створок клапана.
Этиология митральной недостаточности:
- Врожденная патология: расщепление клапана, пролапс и другое.
- Ишемическая дисфункция митрального клапана при ИБС.
- Дегенеративные процессы: миксоматозная дегенерация, синдромы Марфана и Элерса - Данло, кальциноз митрального кольца.
- Воспалительные поражения: ревматизм, системная красная волчанка, системная склеродермия, аортоартериит.
- Инфекция: инфекционный эндокардит.
- Травма.
По течению митральная недостаточность подразделяется на хроническую и острую и соответственно требует разного подхода при определении показаний срочности оперативного вмешательства. Коррекцию хронической митральной недостаточности необходимо провести прежде, чем разовьется декомпенсация левого желудочка, с учетом ЭХОКГ критериев для оценки тяжести митральной регургитации.
Развитие острой митральной недостаточности, рефрактерной к медикаментозной терапии, является показанием к экстренному хирургическому вмешательству.
Проявления клинических симптомов митральной недостаточности обусловлено тяжестью недостаточности митрального клапана и функционального состояния левого желудочка.
Симптомы
Наиболее типичная жалоба – это одышка, которая возникает при умеренной и тяжелой хронической митральной недостаточности и клиника острой левожелудочковой недостаточности при острой митральной недостаточности. Наличие фибрилляции предсердий до операции является независимым предиктором снижения отдаленной выживаемости после операции на митральном клапане по поводу хронической митральной недостаточности.
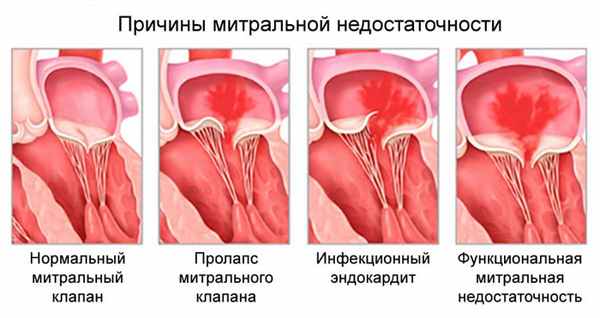
Диагностика митральной недостаточности
Эхокардиография (ЭХОКГ) занимает ведущее место в диагностике недостаточности митрального клапана и определения показаний по тактике ведения больного. При недостаточной информативности трансторакальной ЭХОКГ и уточнения возможности реконструктивной операции на митральном клапане должна быть выполнена чрезпищеводная ЭХОКГ.
ЭХОКГ позволяет определить этиологию митральной недостаточности, ее тяжесть –компенсаторные возможности левого желудочка, наличие осложнений (левожелудочковая недостаточность, легочная гипертензия, правожелудочковая недостаточность), выявить другие пороки сердца.
ЭХОКГ исследование позволяет оценить степень недостаточности митрального клапана по отношению площади потока регургитации к площади левого предсердия:
- Незначительная недостаточность митрального клапана менее 20%
- Умеренная недостаточность 20-40%
- Тяжелая недостаточность 40%
Если ИБС не является причиной митральной недостаточности и нет данных за сопутствующую ИБС показания к операции могут быть определены без катетеризации сердца.
Применение инвазивных методов обследования показано пациентам с ишемической дисфункцией митрального клапана:
Коронароангиография позволяет уточнить наличие стенозирующего поражения коронарных артерий и определить показания к реваскуляризации миокарда в сочетании с хирургической коррекцией митральной недостаточности.
Показания к оперативному лечению митральной недостаточности
Классификация рекомендаций и уровни достоверности в формате АКК/ААС:
- Класс I: Состояния, при которых есть доказательства и/или общее согласие, что процедура или метод лечения является благоприятным, полезным и эффективным.
- Класс II: Состояния, при которых есть противоречивые доказательства и/или расхождение во мнениях о полезности/эффективности процедуры или метода лечения.
- Класс IIА: Вес достоверность/мнение в пользу полезности/эффективности.
- Класс IIБ: Польза/эффективность менее хорошо установлены достоверностью/мнением.
- Класс III: Состояния, при которых есть доказательства и/или общее мнение, что процедура/метод лечения не полезны, не эффективны, а в некоторых случаях могут быть вредны.
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
- Уровень достоверности А: Данные получены из многочисленных рандомизированных клинических испытаний.
- Уровень достоверности В: Данные получены из единичных рандомизированных исследований или нерандомизированных испытаний.
- Уровень достоверности С: Только единодушное согласие экспертов, отдельные исследования случаев и стандарты лечения.
Хирургическое лечение недостаточности митрального клапана
1. Пациенты с острой тяжелой митральной недостаточностью (Уровень достоверности: B)
2. Пациенты с хронической тяжелой недостаточностью митрального клапана и СН II, III, IV ФК по NYHA, при отсутствии тяжелой дисфункции ЛЖ (тяжелая дисфункция ЛЖ определяется как фракция выброса меньше 30%) и/или КСР больше 55 мм. (Уровень достоверности: B)
3. Асимптомные пациенты с хронической тяжелой митральной недостаточностью и легкой, умеренной дисфункцией ЛЖ, фракция выброса 30-60% и/или КСР больше или равно 40 мм. (Уровень достоверности: B)
4. Более показана пластика, чем протезирование митрального клапана у большинства пациентов с тяжелой хронической митральной недостаточностью, которым необходима операция, и пациенты должны быть направлены в хирургические центры с большим опытом по восстановлению МК. (Уровень достоверности: C)
КЛАСС IIА
1. Показана пластика МК у асимптомных пациентов с тяжелой хронической митральной недостаточностью и нормальной функцией ЛЖ (фракция выброса больше 60% и КСР меньше 40 мм), у которых вероятность хороших результатов пластики клапана больше 90 %. (Уровень достоверности: B)
2. Показано вмешательство на МК у асимптомных пациентов с тяжелой хронической митральной недостаточностью с нормальной функцией ЛЖ и пароксизмом фибрилляции предсердий. (Уровень достоверности: C)
3. Показано вмешательство на МК у асимптомных пациентов с тяжелой хронической митральной недостаточностью с сохраненной функцией ЛЖ и легочной гипертензией (систолическое давление ЛА больше 50 мм рт.ст. в покое или больше 60 мм рт.ст. при нагрузке). (Уровень достоверности: C)
4. Показано вмешательство на МК у пациентов с тяжелой хронической МР*, развившейся в результате первичной патологии митральных структур, симптомами III-IV ФК по NYHA и тяжелой дисфункцией ЛЖ (фракция выброса мене 30% или КСР больше 55 мм), которым больше подходит восстановление МК. (Уровень достоверности: C)
КЛАСС IIБ
- Возможна пластика митрального клапана у пациентов с хронической тяжелой недостаточностью митрального клапана, вследствие тяжелой дисфункции ЛЖ (фракция выброса менее 30%), у кого, несмотря на оптимальную терапию СН, включая бивентрикулярный кардиостимулятор, присутствуют симптомы III-IV ФК по NYHA. (Уровень достоверности: C)
КЛАСС III
1. Вмешательство на митральный клапан не показано асимптомным пациентам с митральной недостаточностью и нормальной функцией ЛЖ (фракция выброса более 60% и КСР менее 40 мм), у которых есть существенные сомнения о возможности пластики МК. (Уровень достоверности: C)
2. Изолированная операция МК не показана пациентам с легкой или умеренной митральной недостаточностью. (Уровень достоверности: C)
Во многих случаях, тип операции - пластика или протезирование МК важна в выборе времени операции. Хотя тип оперативного вмешательства до операции фактически никогда не определяется, во многих случаях выбор оперативного вмешательства может быть определен заранее. Летальность при плановых операциях по поводу митральной недостаточности после протезирования митрального клапана составляет 2 – 7%, после пластики митрального клапана 1 – 4%. В настоящее время используют три основных метода коррекции митральной недостаточности: пластика клапана, протезирование митрального клапана с частичным или полным сохранением хордального аппарата и протезирование митрального клапана без сохранения хордального аппарата. В большинстве случаев пластика клапана является операцией выбора и должна выполняться всегда, когда это возможно.
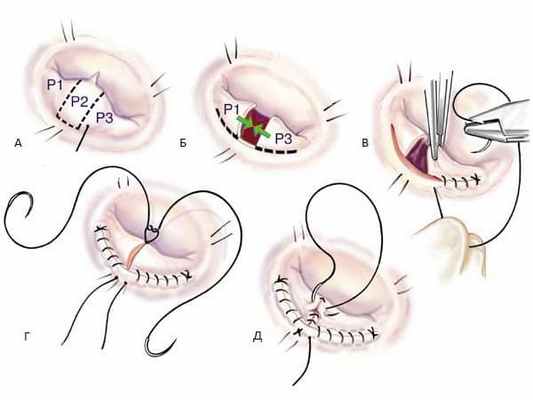
Своевременность оперативного вмешательства позволяет добиться хороших результатов хирургической коррекции пороков сердца, уменьшает степень оперативного риска и улучшает отдаленные результаты хирургического лечения.
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Читайте также:
