Эпидемиология гемобластозов - динамика заболеваемости
Добавил пользователь Morpheus Обновлено: 27.01.2026
1 ГБОУ ВПО «Ростовский государственный медицинский университет» Минздравсоцразвития РФ, Ростов-на-Дону
Проведено ретроспективное эпидемиологическое исследование по изучению заболеваемости острыми лимфобластными (ОЛЛ) и острыми нелимфобластными лейкозами (ОНЛЛ) детей в возрасте от 0 до 14 лет, проживающих на территории Ростовской области. Период наблюдения составил 20 лет − с 1991 по 2010 гг. За период наблюдения у детей, проживающих на территории Ростовской области, было выявлено 566 случаев острого лейкоза. Заболеваемость острым лимфобластным лейкозом составила 3,69, а ОНЛЛ – 3,06 на 100 000 детского населения. В статье приведены данные погодовой заболеваемости ОЛ детей, проживающих в городах Ростовской области, сельской местности, а также в областном центре − г. Ростове-на-Дону. Полученные данные свидетельствуют о том, что показатель заболеваемости ОЛ детей, проживающих на территории Ростовской области, за 20-летний период с 1991 года является средним и сопоставимым с аналогичными данными большинства регионов РФ.
1. Гематология детского возраста: Руководство для врачей / под. ред. Н.А. Алексеева. – СПб.: Гиппократ, 1998. – 554 с.: ил.
2. Карачунский А.И. Стратегия терапии острых лимфобластных лейкозов у детей: автореф. дис. . д-ра мед. наук. – М., 1999. – 54 с.
3. Румянцев А.Г. Птушкин В.В., Семочкин С.В. Пути улучшения результатов лечения злокачественных опухолей у подростков и молодых взрослых // Онкогематология. – 2011. – №1. – 2007. – Т. 6, №1. – С. 5–10.
4. Заболеваемость острыми лейкозами детей Беларуси: дескриптивный анализ данных периода 1990–2004 гг. / Н.Н. Савва, О.И. Быданов, И.П. Ромашевская, О.В. Алейникова // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. – 2007. – Т. 6, №1. – С. 5–10.
5. Тарасова И.С., Чернов В.М., Румянцев А.Г. Эпидемиология болезней крови и онкологических заболеваний у детей и подростков: практическое руководство по детским болезням. Т.4. Гематология/онкология детского возраста /под ред. В.Ф. Коколина, А.Г. Румянцев. – М.: Медпрактика-М, 2004. – С. 10–29.
Проблема онкологической заболеваемости остается одной из ведущих во всех странах мира. При этом нозологическая структура онкологической заболеваемости характеризуется возрастной динамикой и может меняться у детей и взрослых коренным образом. С возрастом изменяются результативность лечения разных форм заболеваний, а также терапевтические подходы [3]. Лейкозы являются самыми распространенными онкологическими заболеваниями в детском возрасте, их доля составляет 1/3 от всех новых случаев опухолевых заболеваний, возникающих ежегодно у детей [1]. Оснащение детских гематологических и онкологических отделений необходимым оборудованием, специализированная подготовка врачебных и сестринских кадров, переход на современные протоколы лечения гемобластозов позволили получить в ряде регионов такие же результаты лечения острых лейкозов (ОЛ), как и в ведущих клиниках зарубежом [2]. Изучение эпидемиологии ОЛ у детей является весьма актуальным, так как данная группа болезней сохраняет лидирующие позиции в структуре заболеваемости злокачественными новообразованиями в детском возрасте, а их диагностика и лечение в системе здравоохранения относятся к высокозатратным разделам [4]. Лейкозы наблюдают с частотой 4-5 случаев на 100 000 детей. В детском возрасте ОЛ диагностируют чаще, чем другие онкологические заболевания. Пик заболеваемости лейкозом у детей приходится на возраст 2-4 года [5].
Цель настоящего исследование - изучение заболеваемости ОЛ детей, проживающих в Ростовской области, в период с1991 по 2010 гг.
Материалы и методы исследования
Проведено ретроспективное эпидемиологическое исследование заболеваемости ОЛ у детей в возрасте от 0 до 14 лет, проживающих на территории Ростовской области за 20-летний период (с 01.01.1991 по 31.12.10 гг.). Территория Ростовской области составляет - 100967 км2. Среднегодовая численность детского населения в возрасте от 0 до 14 лет за изучаемый период составила 66264,15 ± 107828,85 человека. При изучении заболеваемости учитывали следующие нозологические формы ОЛ, соответствующие кодам Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра - МКБ-10: острый лимфобластный лейкоз - ОЛЛ (С91.0), острые нелимфобластные лейкозы - ОНЛЛ (С 92.0, С92.4, С92.5, С92.7, С92.9, С93.0, С93.3, С94.2).
Для получения сведений о случаях заболеваний анализировали медицинскую документацию.
Расчет показателя заболеваемости проводили по формуле
где Z - показатель первичной заболеваемости на 100 населения соответствующего возраста за год; n - число впервые выявленных случаев заболевания за год; N - среднегодовая численность населения исследуемой возрастной группы.
Математическая обработка данных проведена с использованием пакетов прикладных программ Statistica 6.0 (StatSoft, USA). Все величины представлены как средние величины ± ошибки средней арифметической (М ± m).
Результаты исследования и их обсуждение
Распределение числа случаев и первичная заболеваемость ОЛ (на 100 000 детского населения) детей Ростовской области за период с 1991 по 2010 гг.
Эпидемиология гемобластозов - динамика заболеваемости
Эпидемиология гемобластозов - динамика заболеваемости
Динамика частоты гемобластозов. Формы гемобластозов можно разделить на встречаемые повсеместно (убиквитарные) и в географически очерченных очагах распространения (эндемические). Спорадические случаи последних лишь изредка наблюдаются вне очагов. «Большая» статистика имеет дело в основном с убиквитарными формами.
И заболеваемость, и смертность равно можно принять как меру риска заболевания в популяции, хотя надежность этих показателей неодинакова: смертность дает заниженные оценки, поскольку не учитывает случаи выздоровления пациента или его смерти от другой причины. На рисунке приведена динамика смертности от лейкозов в детском возрасте в США.
После введения интенсивной химиотерапии в начале 60-х годов в течение 15 лет показатели снизились более чем на четверть, при этом возрастная кривая заметно деформировалась. Известно, что заболеваемость в этот период возрастала за счет увеличения частоты лейкозов в некоторых группах населения. Еще более заметно, на 75 %, снизилась смертность от лимфомы Ходжкина в 1960—1990 гг. в странах Западной Европы, США, Японии. В странах Восточной Европы это снижение было менее выраженным — на 40 %, и пока нет признаков дальнейшего сокращения смертности от лимфомы Ходжкина.
Во многих странах, где заболеваемость не регистрируется, сведения о распространении гемобластозов основаны исключительно на регистрации причин смерти. Столетнюю динамику частоты заболеваний приходится оценивать именно по показателям смертности. Для этого надежнее всего опираться на данные США, поскольку этой страны не коснулись социальные и военные потрясения новейшей истории с не поддающимися учету всплесками насильственной смерти и «провалами» регистрации смерти от естественных причин.
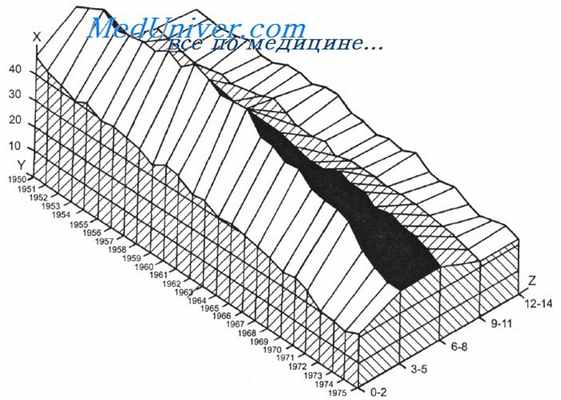
Трехмерный график изменения смертности от лейкозов детей США в 30—70-х годах XX в. [Miller R.].
На оси X — число умерших на 1 млн детей данной возрастной группы; по оси Y — годы наблюдения; по оси Z — возрастные группы (1—2, 3—5, 6—8, 9—11 и 12—14 исполнившихся лет).
До середины 60-х годов в структуре смертности от естественных причин в США общая онкологическая смертность росла теми же темпами, какими снижалась общая инфекционная смертность, а также смертность от туберкулеза и пневмонии. С одной стороны, в этом соотношении кроется причинная связь: все большее число лиц, избежавших ранней смерти от инфекции, получали возможность дожить до смерти от новообразования.
С другой стороны, слабоконтролируемая инфекционная смертность «обкрадывает» смертность от новообразований за счет того, что латентный (скрытый) период канцерогенеза, длящийся годами, часто сопровождается депрессией иммунитета и высоким риском инфицирования.
На рисунках приведена динамика смертности среди мужчин и женщин в США после 1930 г. от девяти ведущих по частоте локализаций новообразований. Использована логарифмическая шкала ординаты как более удобная при большом различии показателей. График смертности от лейкозов, как и от ряда других новообразований, в 60-х годах стабилизировался. Активной оставалась динамика смертности от тех опухолей, для которых показана этиологическая роль поведенческих факторов.
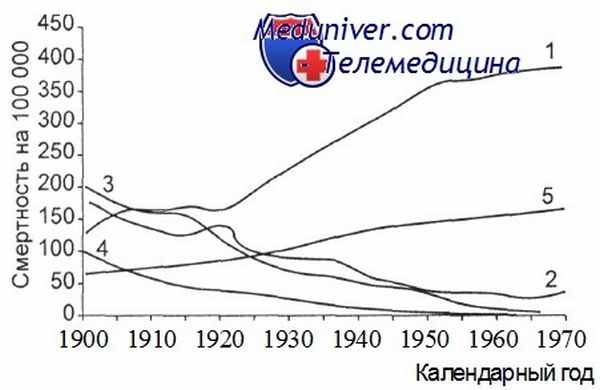
Тенденции изменения смертности от естественных причин жителей США с начала XX в. [Silverberg B. S., Holleb A. I.].
1 — болезни сердца; 2 —пневмония; 3 — туберкулез; 4 — другие инфекции; 5 — злокачественные образования.
Снижается смертность от рака желудка и печени у мужчин, и рака тела и шейки матки, толстой и прямой кишки у женщин. Выражен прирост смертности от рака легкого у мужчин. Для женщин этот показатель несколько десятилетий был стабильным, а начало его подъема совпало с победой эмансипации и широким распространением среди женщин курения. Частота этой формы рака у мужчин США с 90-х годов снижается, а в самые последние годы добавилась тенденция снижения и у женщин; эти процессы, в частности, связывают со значительным сокращением доли курящих в популяции.
С 1975 по 1990 г. общая онкозаболеваемость детей в США выросла с 12,8 до 14,1 на 100 тыс., однако изменения заболеваемости лейкозами незначительны.
Тенденция стабильной заболеваемости детей острыми лейкозами характерна для последних трех десятилетий в большинстве экономически развитых стран. В США ежегодно заболевает опухолями около 8000 детей до 14 лет, при этом лейкозы составляют 30 %, т. е. 2400 случаев. За 60 лет (1932 - 1991) в США частота острых лейкозов (ОЛ) у детей и подростков росла до 1971 г. и затем стабилизировалась на уровне 3,1 на 100 тыс.. Стабильная заболеваемость лейкозами представляла собой сбалансированный процесс: в группе моложе 20 лет происходил небольшой прирост частоты (+ 0,5 % в год), в группе старше 65 лет —снижение (—0,3 %). Несколько снижалась частота ХЛЛ и ХМЛ.
Баланс заболеваемости лейкозами в СССР, по данным выборочного исследования, включал тенденцию роста частоты ОЛ в группе 20—30 лет, снижения частоты ХМЛ после 50 лет и рост ХЛЛ после 60 лет. Для ЛХ, НХЛ, ММ отмечено некоторое увеличение заболеваемости. Официальная российская статистика в последние годы XX в. регистрировала незначительный рост заболеваемости гемобластозами.
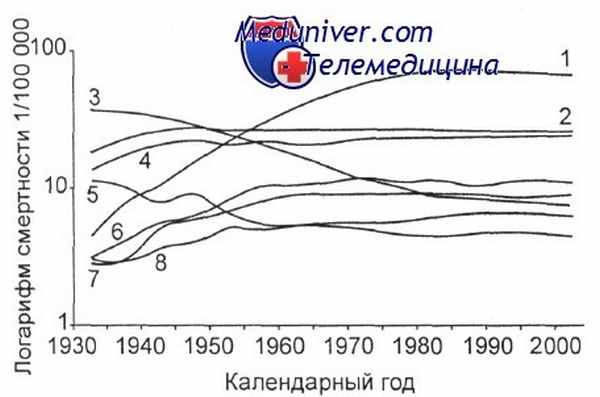
Динамика смертности мужчин от наиболее распространенных новообразований, США [Silverberg B. S.].
1 — легкое; 2 — толстая и прямая кишка; 3 — желудок; 4 — простата; 5 — печень; 6 — поджелудочная железа; 7 — лейкозы; 8 — пищевод.
Так, в 1993 г. этот показатель на 100 тыс. составил для мужчин и женщин соответственно 12,44 и 10,79;
в 1994 г. - 12, 70 и 11,12;
в 1995 г. - 12,72 и 11,4;
в 1996 г. - 13,02 и 12,0;
в 1997 г. - 12,90 и 11,92;
в 1998 г. - 12,81 и 12,23;
в 1999 г. - 13,00 и 12,34;
в 2000 г. - 13,20 и 12,7;
в 2001 г. - 13,00 и 12,88;
в 2002 г. - 13,66 и 13,49.
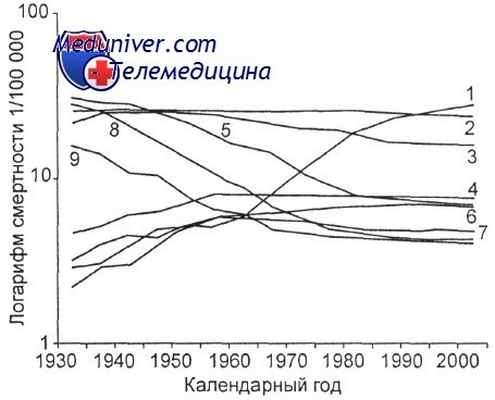
Динамика смертности женщин от наиболее распространенных новообразований, США [Silverberg B. S.].
1 — легкое; 2 — молочная железа; 3 — толстая и прямая кишка; 4 — яичник; 5 — тело и шейка матки; 6 — поджелудочная железа; 7 — лейкозы; 8 — желудок; 9 — печень.
Среднегодовой прирост показателя составил соответственно 2,02 % и 2,26 %. Некоторое увеличение регистрируемой заболеваемости обусловлено нозологическими формами, более характерными для старшего возраста: НХЛ, ММ и ХЛ. Отчасти играет роль рост полноты регистрации заболеваний.
Частота неходжкиновских лимфом (НХЛ) (исключая эндемические формы) растет в большинстве экономически развитых стран Европы, в США, Канаде, Австралии. Регистры в Лидсе, Дижоне, Куопио, Оденсе, Флоренции, Эйндховене и Рагуссе определяют среднегодовой прирост частоты НХЛ в Европе 3 %. Комплексный анализ тенденций заболеваемости НХЛ дает ожидание среднегодового прироста около 5 % и прогнозирует удвоение числа заболевших в течение 15 лет. Результаты кооперированного исследования позволили сделать вывод, что возрастание частоты НХЛ (в год на 4,8 % у мужчин и 3,4 % у женщин) обусловлено некими объективными причинами, а не только улучшением диагностики.
Какую-то долю ответственности за рост частоты неходжкиновских лимфом (НХЛ) возлагают на улучшение методов диагностики, приведшее к пересмотру атрибутики части случаев заболевания, относимых ранее к ЛХ. Это же обстоятельство лежит в основе снижения в последние годы частоты ЛХ в старшей возрастной группе.
Некоторый вклад в прирост частоты неходжкиновских лимфом (НХЛ) может вносить улучшение диагностики хронического лимфолейкоза. Для 65 % больных диагноз ХЛЛ устанавливается без затруднений, однако в остальных случаях его необходимо надежно дифференцировать от других лимфопролиферативных заболеваний, относящихся к НХЛ: фолликулярного типа, краевой зоны, клеток мантийной зоны, которые способны рано диссеминировать в костный мозг.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лейкозы (С91-С95)
Заболеваемость лейкозами высока в развитых странах, в частности, среди белого населения США (мужчины – 11, женщины – 7), на Гавайских островах (мужчины – 11, женщины – 7), Австралии (Квинсленд: мужчины – 12, женщины – 8), Европе (Италия, Варезе: мужчины – 10, женщины – 6), среди евреев Израиля (мужчины – 9, женщины – 6) и низка в большинстве стран Азии (Китай, Шанхай: мужчины – 5, женщины – 4) и Африки (Зимбабве: мужчины – 3, женщины – 3). В России заболеваемость лейкозом достаточно высока (Санкт-Петербург: мужчины – 9, женщины – 5)
Высокая смертность от лейкозов отмечается в Восточной Европе, в частности, в Венгрии (мужчины – 8, женщины – 5), Чехии (мужчины – 7, женщины – 4), Словакии (мужчины – 7, женщины – 4), США (мужнины – 7, женщины – 4), Израиле (мужчины – 7, женщины – 5), В России смертность от лейкозов равна 5 и 4 среди мужчин и женщин соответственна. Показатели смертности ниже в Китае (мужчины - 3, женщины - 2), Японии (мужчины - 4, женщины - 3)
Заболеваемость лейкозами за последние годы стабилизировалась, в некоторых же странах наблюдается ее небольшой рост. Выраженное снижение смертности отмечается для детских лейкозов. Смертность от лейкозов снижается и у взрослых, однако эта тенденция снижения среди взрослых значительно скромнее, чем у детей. Смертность от лейкозов растет среди пожилых людей. Лимфоидный лейкоз составляет около 50%, а миелоидные – 43% всех форм лейкозов. Около 2% составляют моноцитарный и волосатоклеточный лейкоз
Лимфоидным лейкозом (С91) чаще болеют в развитых странах, в Канаде (мужчины – 6, женщины – 4), США (белое население: мужчины – 6, женщины – 3), Израиле (евреи: мужчины – 6, женщины – 2). В Италии и Испании заболеваемость среди мужчин варьирует в пределах 5-9, а среди женщин между 2 и 6. Высокая заболеваемость регистрируется и в других европейских странах, и в Австралии. Заболеваемость низка в Африке (Зимбабве: мужчины – 1, женщины – 1) и Азии (Китай, Шанхай: мужчины – 2, женщины – 1)
Острый, лимфоидный лейкоз (ALL/ОЛЛ) занимает первое место в структуре злокачественных опухолей у детей (30-40%) и составляет не более 5% всех лейкозов у взрослых. Пика заболеваемость ALL достигает у детей в возрасте 2-4 лет. Чаще болеют мальчики, чем девочки. Самая низкая заболеваемость отмечается с 25 до 59 лет. Второй, менее выраженный пик заболеваемости наблюдается в пожилом возрасте
Смертность от ALL среди детей снижается практически во всех развитых странах. Это снижение происходит на фоне роста заболеваемости и объясняется значительным успехом в лечении ALL
Хронический лимфоидный лейкоз (CLL) чаще встречается у пожилых людей в США, Канаде и других развитых странах и редко – в Японии и Китае, а также в Африке. Разницу в заболеваемости CLL (более чем в 30 раз), скорее всего, можно объяснить проблемами, связанными с дифференциальной диагностикой и, соответственно, с недоучетом этой патологии в развивающихся странах. CLL редко встречается до 30. лет. Однако после этого возраста наблюдается рост заболеваемости, которая достигает максимума в 70-80 лет. Мужчины болеют чаще, чем женщины
После выраженного роста заболеваемости CLL в течение первых двух десятилетий второй половины прошлого века заболеваемость и смертность стали снижаться, и эта тенденция продолжается и сейчас
Миелоидным лейкозом (С92-С94) чаще болеют в развитых странах. Высокая заболеваемость отмечается среди белого (мужчины – 5, женщины – 3) и чернокожего населения (мужчины – 4, женщины – 3) США, в Канаде (мужчины – 4, женщины '– 3), в странах Западной Европы – в Италии (Варезе: мужчины – 5,.женщины – 3), Франции (Изер: мужчины – 4, женщины – 3); Австралии (Квинсленд: мужчины – 6, женщины – 4). Заболеваемость миелоидным лейкозом низка в Африке (Зимбабве: мужчины – 1, женщины – 2) и Азии (Китай, Шанхай: мужчины – 2, женщины – 2)
Острый миелоидный лейкоз (AML) составляет 15-25% всех лейкозов у детей и 20-40%.у детей в возрасте до 4 лет. Разницу в заболеваемости AML в разных странах трудно оценить ввиду проблем, связанных с дифференциальной диагностикой и, соответственно, возможным недоучетом этого заболевания. Небольшой пик заболеваемости AML достигается в 5 лет, после чего наблюдается ее снижение. После 10 Лет частота AML начинает расти и достигает максимума в возрасте 70-80 лет. Среди пожилых людей (старше 60 лет) AML чаще болеют мужчины, чем женщины. В раннем возрасте заболеваемость AML среди мужчин и женщин примерно одинаковая
В течение первых двух десятилетий второй половины прошлого века наблюдался рост заболеваемости и смертности од AML. Однако с начала 70-х гг. показатели заболеваемости и смертности стабилизировались
Хронический миелоидный лейкоз (CML) встречается практически с одинаковой частотой в разных частях света. Он составляет не более 1-3% всех лейкозов у детей. С увеличением возраста заболеваемость растет и достигает максимума у пожилых людей. CLL чаще болеют мужчины, чем женщины. Заболеваемость и смертность от CML остается без изменений в большинстве регионов мира
В США 5-летняя выживаемость для всех форм лейкозов равна 39 и 38% среди белых мужчин и женщин и 30 и 31% среди черных мужчин и женщин соответственно. В Западной Европе 5 лет выживают 27%, а в развивающихся, странах – около 15% больных лейкозом. Выживаемость значительно улучшилась у детей, больных ALL. В начале 60-х годов прошлого века в США 5-летняя выживаемость составляла не более 4%. К концу 80-х гг. 5-летняя выживаемость детей, больных ALL, составила 72%. За тот же период 5-летняя выживаемость детей, больных AML, выросла с 3 до 31%. Однако выживаемость среди взрослых, больных AML, остается без изменений. 5-летняя выживаемость CLL остается без изменений и составляет 30-70%, в зависимости от стадии заболевания
Основными доказанными факторами риска лейкозов, которые классифицированы МАИР как канцерогенные для человека, являются ионизирующее излучение, контакт на производстве с бензолом и другими растворителями и курение
Кроме того, риск возникновения лейкозов достоверно повышен у рабочих, занятых на производстве резины и обуви. Резиновая и обувная промышленность отнесена МАИР к 1 группе факторов, канцерогенность которых для человека доказана. Важную роль в этиологии лейкозов, скорее всего, играют онкогенные вирусы
В начале XX в. был отмечен рост заболеваемости лейкозами у врачей-рентгенологов. Однако в последующих когортах рентгенологов рост смертности от лейкозов не был выявлен. Наблюдение за 93000 жителей Хиросимы и Нагасаки, которые пережили атомную бомбардировку, выявило повышение риска лейкозов, связанное с дозой радиации 0,4 Гр и выше. Максимума риск достигал у получивших 3–4 Гр. Повышение риска было отмечено для всех форм лейкозов, кроме CLL. Результаты эпидемиологического изучения заболеваемости и смертности от лейкозов в результате наземных испытаний атомного оружия в штате Невада (США) противоречивы. Противоречивые результаты получены и в отношении участников испытаний ядерного оружия. Не отмечено и повышения заболеваемости и смертности от лейкозов в связи с аварией на Чернобыльской АЭС. В некоторых эпидемиологических исследованиях было выявлено повышение смертности от лейкозов (кроме CLL) у работников ядерных предприятий. Однако эти результаты не были подтверждены в большинстве других исследований. Кроме того, риск лейкозов не был повышен среди работников урановых рудников, испытывающих воздействие больших доз радона. Лучевая терапия некоторых заболеваний и, в первую очередь, злокачественных опухолей также повышает риск развития лейкоза. У больных, получавших лучевую терапию по поводу рака шейки матки, молочной железы и лимфогранулематоза, заболеваемость острым миелобластным лейкозом выше ожидаемой
У больных, которые получали противоопухолевую терапию алкилирующими препаратами, также повышен риск острого миелобластного лейкоза. ОР повышен в 10-300 раз у больных, которые получали алкилирующие препараты по поводу различных лимфопролиферативных заболеваний, лимфом, лимфогранулематоза. Риск развития лейкоза повышен и у больных с солидными опухолями, которые получали алкилирующие препараты. Однако показатели ОР риска у них значительно ниже
Контакт на рабочем месте с бензолом у работников обувной, резиновой, кожевенной, химической, нефтеперерабатывающей промышленности, среди маляров и профессиональных водителей связан с достоверным 3-6-кратным повышением смертности от острого лейкоза и более чем 10-кратным повышением риска развития острого миелоидного лейкоза. Риск лейкозов повышен у фермеров, ветеринаров, работников птицеферм и боен, т.е. представителей профессий, которые имеют контакт с пестицидами, гербицидами, минеральными удобрениями, а также, возможно, с вирусами. Выброс в окружающую среду диоксина в итальянском городе Севесо привел к повышению заболеваемости и смертности от миелоидного лейкоза среди мужского населения. Несколько эпидемиологических исследований указывают на повышенный риск лейкозов у рабочих, занятых на производстве стирола и бутадиена
Большое количество работ указывают на связь между профессией родителей и риском развития лейкозов у детей. Повышенный риск лейкозов, особенно ALL, был выявлен у детей, родители которых работают в химической, резиновой, металлургической, текстильной промышленности или экспонированы на рабочем месте ПАУ, бензолу, растворителям и радиации
Риск острого миелоидного лейкоза повышен до 2 раз у рабочих, экспонированных на рабочем месте к электромагнитному излучению. На основании нескольких эпидемиологических исследований можно заключить, что близость места жительства к высоковольтным линиям приводит к небольшому увеличению риска лейкоза у детей, но это относится лишь к линиям большой мощности
В большинстве эпидемиологических исследований, изучавших роль курения в этиологии лейкозов, показано, что курение повышает риск развития острого миелоидного лейкоза, и это заболевание пополнило длинный список злокачественных опухолей, связанных с курением. На основании оценки риска американские ученые заключили, что 31% всех случаев острого миелоидного лейкоза в США вызваны курением
В литературе описаны семейные формы лейкозов. Заболевание лейкозом в детском возрасте – один из компонентов синдрома семейного рака Ли – Фраумени. Описаны семьи, в которых лейкозами (чаще хроническим лимфоидным) болеют братья и сестры, реже – родители и дети. Острым лимфобластным лейкозом часто болеют однояйцовые близнецы, причем, они заболевают в возрасте до 1 года. Риск развития острого лейкоза в 20-30 раз Повышен у детей с синдромом Дауна. Повышенный риск заболеть лейкозом также связан с наличием таких редких генетических синдромов, как синдром Клайнфелътера (XXY), атаксия-телангиэктазия, анемия Фанкони, синдром Блюма и нейрофиброматоз. Повышенный риск лейкозов связан с терминальными нарушениями в хромосомах. Например, риск хронического миелоидного лейкоза связан с наличием филадельфийской хромосомы
Т-клеточный лейкоз взрослых. В эпидемических по инфицированности HTLV-1 регионах отмечается высокая заболеваемость Т-клеточным лейкозом взрослых (Adult T-cell leukaemia/lymphoma – ATLL). Дескриптивные эпидемиологические исследования выявили кластеры с высокой заболеваемостью ATLL в Японии, Экваториальной Африке и Центральной Америке, которые совпадали с районами, эндемическими по HTLV-I. Сероэпидемиологические исследования показали, что 90% больных ATLL серопозитивны к HTLV-1
В Японии ATLL заболевают 0,6-1,5 на 1000 HTLV-1-инфицированных в возрасте 40-59 лет. Кумулятивный риск заболеть ATLL в течение жизни у HTLV-I-носителей равен 1-5%
Роль HTLV-I в этиологии ATLL подтверждена в аналитических эпидемиологических исследованиях. Когортные исследования HTLV-1-но-сителей, проведенные в Японии, показали, что смертность от ATLL среди HTLV-I-положительных мужчин равна 68,1, а среди женщин – 35,8 на 100 тыс. населения, в то время как ожидаемая смертность среди HTLV-I-отрицательных крайне низка
Исследования методом "случай-контроль", проведенные в Японии, Ямайке, Бразилии, Тринидаде и Тобаго, показали, что в эпидемических районах до 100% всех больных ATLL HTLV-I серопозитивны. Процент серопозитивных больных ATLL также очень высок (>90%) в неэндемических регионах, в то время как частота HTLV-I носительства среди контрольной популяции не превышает в неэндемических районах 1%, а в эндемических регионах – 8%. Процент HTLV-I положительных больных значительно ниже и при других формах Т-клеточных лимфом (3-52%) и других лимфомах (3-25%)
Инфицированность HTLV-I в младенческом и детском возрасте, при которой вирус, скорее всего, передается с молоком матери, по-видимому, играет важную роль в патогенезе ATLL. Серологическое обследование матерей, имеющих детей, больных ATLL и другими формами лимфом, проведенное в Японии, на Ямайке и в Тринидаде, показало, что все без исключения матери больных ATLL HTLV-1-положительны, в то время как среди матерей больных другими формами лимфом HTLV-1-инфи-цированности не выявлялось
Динамика заболеваемости гемобластозами населения Иркутской обл. Капорская, Татьяна Семеновна

Актуальность темы. В России, как и в большинстве развитых стран мира, отмечается тенденция к росту заболеваемости злокачественными новообразованиями. При этом в структуре смертности они вышли на второе-третье место после сердечно-сосудистой патологии. (Якубовская Р.И., 2000).
По данным В.В. Двойрина и соавт., (2006), число больных с впервые в жизни установленным диагнозом злокачественного новообразования составило в 2004 году 468 029 человек, из них гемобластозы диагностированы у 21 808. Заболеваемость гемобластозами в среднем по России составляет 15,2 на 100 тысяч населения со значительным разбросом в различных регионах. Так, отмечен рост заболеваемости в Новосибирской области (Сосенко Е.В, 1998), Омской (Баркина В.К., 1987), Ленинградской областях (Розовой М.В., 1979), в то же время, данные о заболеваемости гемобластозами за последние 20-30 лет в Иркутской области отсутствуют.
Большинство исследователей (Демин А.К., 1994; Кравец Б.Б., 1994; Осе-чинский И.В., 1995, Козинец Г.И., 2007 и др.) связывают высокие показатели заболеваемости и смертности от онкологических болезней с неблагоприятной экологической обстановкой окружающей среды. Другие считают, что здоровье популяции, его уровень и динамика определяются комплексом взаимодействующих факторов, из которых немаловажное значение принадлежит экологическим условиям территории (Буштуева К.А., 1976). В этой связи огромное значение приобретает адекватная оценка влияния измененной среды обитания на состояние здоровья населения (Суржиков В.Д., 1990).
Среди злокачественных новообразований гемобластозы (ГМБ) занимают особое место, что связано с высокой чувствительностью системы крови к различным воздействиям окружающей среды, в связи с чем онкогематологические заболевания считаются индикаторными болезнями экологического неблагополучия (Воробьев А.И., 2002). Иркутская область - крупный промышленный центр, производственный профиль которого определяют предприятия теплоэнергетики, нефтехимии, машиностроения, производства строительных материалов, легкой, пищевой промышленности. Многие предприятия размещены непосредственно на территории городов, что оказывает существенное негативное воздействие на состояние окружающей среды городов области.
Изучение экологических и антропогенных факторов в развитии злокачественных новообразований, в том числе ГМБ, в Иркутской области имеет большое социально-экономическое значение, так как связано с профилактикой канцерогенеза и снижением онкологической заболеваемости.
Управление социально-важными болезнями, к которым относятся болезни крови, невозможно без тщательной эпидемиологической проработки конкретных регионов проживания, определения прогноза как основы социально-медицинских программ по борьбе с онкологическими заболеваниями, что имеет стратегическое значение для развития в регионе приоритетных медицинских направлений, планирования и перераспределения экономических затрат на их решение.
Указанное делает изучение и прогнозирование эпидемиологической ситуации в Иркутской области актуальной задачей современной медицины и может позволить рационально планировать специализированную помощь населению, а также определить эколого-гигиенические мероприятия, направленные на предотвращение действия вредных факторов среды. Это и определило цель данного исследования.
Цель исследования: Дать анализ заболеваемости гемобластозами населения различных кл и мато географических зон Иркутской области, выявить возможную связь ее с уровнем загрязнения воздуха, и на этой основе разработать модель предполагаемого уровня заболеваемости гемобластозами на ближайшие 10 лет. Задачи исследования:
1. Изучить динамику заболеваемости гемобластозами населения Иркутской области в целом и в отдельных климатогеографических зонах за последние 20 лет.
2. Провести анализ мониторинга воздушной среды за 20 лет и оценить уровень загрязнения воздуха в различных климатогеографических зонах Иркутской области.
3. Проанализировать роль аэрогенного токсического фактора в этиопатогене-зе гемобластозов у населения урбанизированных территорий Иркутской области.
4. Обосновать прогноз заболеваемости гемобластозами на территориях риска на ближайшие 10 лет.
Научная новизна работы: Впервые на основе изучения динамики заболеваемости за период 1986-2005 гг., выявлен рост заболеваемости гемобластозами в 4,4 раза. Наибольшая заболеваемость отмечается в последние 5 лет (2001 -2005гг.), при этом в структуре ее хронические лейкозы преобладают над острыми.
Выявлено, что высокая заболеваемость гемобластозами регистрируется в наиболее урбанизированных районах с высоким уровнем загрязнения атмосферного воздуха: г.Иркутск, Иркутский, Шелеховский, Ангарский, Братский районы.
Впервые установлено наличие территорий риска по уровню техногенного загрязнения атмосферного воздуха в отношении развития гемобластозов. Выявлена закономерность связей аэрогенного фактора риска и роста заболеваемости населения лейкозами и лимфомами. Территории в Иркутской области ранжированы по уровню роста заболеваемости населения гемобластозами.
Доказано, что приоритетным фактором аэрогенного риска в этиопатоге-незе гемобластозов является комплексное загрязнение приземного слоя атмосферного воздуха. На основе полученных данных сделан прогноз заболеваемости населения гемобластозами как в целом, так и в различных районах Иркутской области на ближайшие 10 лет, что может явиться основанием для разработки мер первичной профилактики гематологических заболеваний в системе социально-гигиенического мониторинга.
Практическая значимость работы: Представленные данные о распространенности гематологических заболеваний на территориях с различной аэрогенной и токсической нагрузкой являются основой для первичной профилактики гемобластозов в Иркутской области. Учет особенностей эпидемиологии гемо-бластозов у населения в различных районах области с перспективой 10-летнего прогноза позволит практическому здравоохранению в рамках социально-гигиенического мониторинга дифференцированно решать организационные вопросы, проблемы клинико-гигиенической профилактики гемобластозов у населения.
Полученные данные о динамике заболеваемости населения гемобластозами и связь этих показателей с суммарным уровнем загрязнения приземного слоя атмосферного воздуха могут явиться основой для разработки целевой программы по оздоровлению экологической обстановки в Иркутской области.
Материалы исследования включены в систему социально-гигиенического мониторинга окружающей среды и здоровья населения Иркутской области и могут быть использованы в других регионах Сибири.
Положения, выносимые на защиту:
1. Динамика заболеваемости населения гемобластозами в Иркутской области за период с 1986 по 2005гг. характеризуется ростом показателей более, чем в 4 раза. В структуре заболеваемости лиц в возрасте до 60 лет преобладают острые лейкозы. Самые высокие показатели заболеваемости гемобластозами наблюдаются в субпопуляциях населения старше 60 лет, при этом в структуре лидирующее положение занимает хронический лимфолейкоз. 2. Высокий уровень заболеваемости населения гемобластозами коррелирует с суммарным показателем загрязнения атмосферы веществами, способствующими формированию заболеваний крови (г 0,7; р 0,05). Климатогео-графические и промышленные особенности районов области определили неравномерность распределения в атмосферном воздухе этих веществ, что позволило выделить зоны с высокой и низкой степенью гематологического риска.
3. Прогноз динамики заболеваемости населения гемобластозами с учетом уровня загрязнения окружающей среды предполагает рост заболеваемости к 2017 году на 37,6%, что составит 16,2 на 100 тыс. населения по сравнению с 11,99 - в 2003 году.
Заболеваемость лейкозами и вопросы диспансеризации больных гемобластозами в Удмуртской АССР

В Удмуртской АССР эпидемиологические исследования гемобластозов не проводились.
Ключевые слова
Полный текст
В Удмуртской АССР эпидемиологические исследования гемобластозов не проводились. Нами была изучена частота лейкозов в динамике среди городского, и сельского населения с учетом пола, возраста и структуры указанной патологии. Анализ распространенности гемобластозов осуществлялся по данным обращаемости населения в лечебные учреждения. Основными местами концентрации этих больных являлись гематологические кабинеты поликлиник и специализированные отделения республиканских больниц. Источником статистической информации служили истории болезни, карты выбывших из стационара, амбулаторные карты, статистические талоны, журналы госпитализации и протоколы вскрытия умерших. Динамическое изучение этих материалов проводилось на протяжении 8 лет (1975— 1982 гг.).
В структуре заболеваемости доминируют острые лейкозы (35,5%), высока частота хронических лимфолейкозов (32,2%), далее следуют миелофиброзы, хронические миелолейкозы, миелома, эритремия, хронический моноцитарный лейкоз.
Уровень заболеваемости хроническими лейкозами в целом выше, чем острыми формами (соответственно 2,93 и 1,67), в основном за счет хронического лимфолейкоза fl,57).
Анализ распространенности гемобластозов в зависимости от возраста показал, что
Возраст (в годах)
Хронический димер олейкоз
Хронический моноцитарный лейкоз
Всего хронических лейкозов . .
в детском и юношеском возрасте наблюдаются преимущественно острые формы лейкозов, причем чаще болеют дети первых 4 лет жизни, особенно мальчики (среднегодовые показатели в этом возрасте составляют соответственно 6,25 и 4,30). Возрастная заболеваемость острым лейкозом среди мужчин и женщин имеет 2 пика: до 14 лет и после 60 лет.
В среднем и пожилом возрасте частота хронических форм лейкозов выше, чем острых, и чаще встречается у лиц старше 45 лет, но наиболее высока она после 60 лет. У лиц старше 45 лет, особенно у мужчин, чаще диагностируются хронические лимфолейкозы (табл.).
Показатели заболеваемости лейкозами
Среднегодовой показатель заболеваемости в г. Устинове выше, чем в целом по республике (6,01 против .4,70), в Сарапуле он составил 5,40, Можге — 4,84, Воткинске— 4,50, Глазове — 2,41, а в отдельных районах колебался от 2,63 до 8,45 (по городскому и сельскому населению). Наиболее. высока первичная заболеваемость в тех районах, в которых административными центрами являются города республиканского подчинения, поэтому одной из причин различной частоты лейкозов в республике мы считаем качество их выявляемости.
При изучении анамнеза у ряда больных обнаруживается наличие лейкозогенных факторов. Так, у одного больного острым и 10 больных хроническим лейкозом, длительно (более 16 лет) работавших шоферами и трактористами, возможной причиной страдания мог быть контакт с горюче-смазочными материалами. У 5 больных острым лейкозом болезнь могла развиться в результате воздействия ионизирующего излучения.
Изучение распространенности гемобластозов, как и других заболеваний, тесно связано с организацией диспансеризации, которая включает в себя этапы выявления и регистрации больных, а также диспансерного наблюдения с применением различных лечебно-оздоровительных мероприятий. Диспансеризация больных гемобластозами в нашей республике осуществляется гематологической службой, представленной двумя специализированными отделениями (для взрослого и детского населения) и тремя гематологическими кабинетами (в г. Устинове) по общепринятым организационным принципам [1, 3, 5, 6].
В плане улучшения выявления и амбулаторного ведения гематологических больных в республике необходимо открыть межрайонные гематологические кабинеты, подготовить кадры специалистов-гематологов, лаборантов, что позволит приблизить квалифицированную гематологическую помощь к населению.
Читайте также:
