Эритропоэз. Эритробластические островки. Анемия. Эритроцитоз.
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Анемия (снижение количества эритроцитов, содержания гемоглобина или гематокрита) может быть результатом сниженой продукции эритроцитов Продукция эритроцитов Продукция эритроцитов (эритропоэз) осуществляется в костном мозге под контролем гормона эритропоэтина . В ответ на сниженную доставку кислорода (как при анемии и гипоксии) юкстагломерулярные. Прочитайте дополнительные сведения (эритропоэза), их усиленного разрушения, кровопотери или сочетания этих факторов. (См. также Подходы к лечению пациентов с анемией (Approach to the Patient with Anemia) Оценка анемии Анемия возникает при снижении числа эритроцитов (эритроциты измеряются количеством, гематокритом или содержанием гемоглобина в эритроцитах). У мужчин анемия определяется как уровень гемоглобина. Прочитайте дополнительные сведения
Анемии, обусловленные снижением эритропоэза (так называемые гипопролиферативные анемии), диагностируются по количеству ретикулоцитов, неадекватно низкому для данной степени анемии.
Эритроцитарные индексы Обследование Анемия возникает при снижении числа эритроцитов (эритроциты измеряются количеством, гематокритом или содержанием гемоглобина в эритроцитах). У мужчин анемия определяется как уровень гемоглобина. Прочитайте дополнительные сведенияМикроцитарные анемии являются результатом недостаточного или дефектного синтеза гема или глобина. Микроцитарные анемии включают:
Железо-утилизирующие анемии (включая некоторые сидеробластные анемии Сидеробластные анемии Сидеробластные анемии представляют собой разнородную группу анемий, которые характеризуются увеличением сывороточного железа, ферритина и насыщения трансферрина также, как и наличием кольцевидных. Прочитайте дополнительные сведения При наличии у пациента микроцитарной анемии, как правило, необходимо оценить содержание железа в организме Обследование Анемия возникает при снижении числа эритроцитов (эритроциты измеряются количеством, гематокритом или содержанием гемоглобина в эритроцитах). У мужчин анемия определяется как уровень гемоглобина. Прочитайте дополнительные сведенияНормоцитарные анемии характеризуются нормальным показателем распределения эритроцитов по объему (RDW) и нормохромными эритроцитарными индексами. Двумя самыми частыми причинами являются:
Приобретенные первичные патологии костного мозга, такие как апластическая анемия Апластическая анемия Апластическая анемия является патологией гемопоэтических стволовых клеток, которая приводит к потере предшественников гемопоэза, гипоплазии или аплазии костного мозга и цитопениям 2 или более. Прочитайте дополнительные сведенияМакроцитарная анемия может быть вызвана нарушением синтеза ДНК, которое приводит к возникновению мегалобластоза, как при
недостаточности витамина B12 или фолиевой кислоты (см. Мегалобластическая макроцитарная анемия Мегалобластные макроцитарные анемии Мегалобластные анемии чаще всего являются следствием дефицита витамина B12 и фолата. Неэффективный гемопоэз оказывает влияние на все клеточные ростки, но в особенности на эритроидный. Диагностика. Прочитайте дополнительные сведенияДругие причины макроцитарной анемии включают:
Лекарственные препараты (например, зидовудин, азатиоприн, метотрексат, гидроксимочевина, иматиниб)
Гемолиз с ретикулоцитозом
Некоторые пациенты с гипотиреозом имеют макроцитарные показатели эритроцитов, в том числе те, у которых отсутствует анемия.
Анемии могут сопровождаться различными изменениями в мазке переферической крови Мазок периферической крови Анемия возникает при снижении числа эритроцитов (эритроциты измеряются количеством, гематокритом или содержанием гемоглобина в эритроцитах). У мужчин анемия определяется как уровень гемоглобина. Прочитайте дополнительные сведения ) или дефицита микроэлементов (например, дефицит меди Приобретенный дефицит Медь – компонент многих белков организма; почти вся медь организма связана с белками. Дефицит меди может быть приобретенным или наследственным. (См. также Обзор недостаточности и избытка минеральных. Прочитайте дополнительные сведения или дефицит цинка Дефицит цинка Цинк (Zn) содержится в основном в костях, зубах, волосах, коже, печени, мышцах, лейкоцитах и яичках. Цинк является компонентом нескольких сотен ферментов, включая никотинамидадениндинуклеотид. Прочитайте дополнительные сведения ) могут иметь различные проявления, включая как нормоцитарную так и макроцитарную анемию.
Лечение недостаточного производства эритроцитов зависит от этиологии заболевания.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Влияние растительных полисахаридов на кровь и кроветворение в норме и при патологии Текст научной статьи по специальности «Фундаментальная медицина»
РАСТИТЕЛЬНЫЕ ПОЛИСАХАРИДЫ / PLANT POLYSACCHARIDES / ГЕМОПОЭЗ / ЭРИТРОЦИТЫ / ERYTHROCYTES / ГЕМОГЛОБИН / HEMOGLOBIN / ЭРИТРОБЛАСТИЧЕСКИЕ ОСТРОВКИ / ERYTHROBLASTIC ISLANDS / КОСТНЫЙ МОЗГ / BONE MARROW / АНЕМИЯ / ANEMIA / HEMOGENESIS
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Ерзылева Т.В.
Полисахариды лекарственных растений Донника желтого, Крапивы двудомной, Пижмы обыкновенной стимулируют гемопоэз при введении в организм животных в норме и при анемии , увеличивая количество эритробластических островков костного мозга и эритроцитов и гемоглобина в крови. У крыс с анемией под влиянием полисахаридов возрастает количество островков и нормализуется численность эритроцитов и гемоглобина на 5-7 сутки опыта.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Ерзылева Т.В.
Влияние водорастворимого полисахаридного комплекса ирги обыкновенной на морфофизиологические и биохимические показатели организма лабораторных крыс
Действие полисахарида крапивы двудомной на физическую работоспособность животных, процессы фагоцитоза и резистентность мембран эритроцитов
The influence of botanical polysaccarides on blood and blood formation in health and disease
Injection of such medical plants’ polysaccharides as Yellow Melilot, Stinging Nettle and Common Tansy stimulates hemopoesis, increases the number of bone marrow erythroblastic islands , erythrocytes and hemoglobin in the blood of healthy animals and ones of with anemia . On the 5-7 day of the experiment under the influence of polysaccharides the number of islands in the organism of rats with anemia and the amount of erythrocytes stabilizes.
Текст научной работы на тему «Влияние растительных полисахаридов на кровь и кроветворение в норме и при патологии»
© Ерзылева Т.В., 2015 УДК 615.322:547.458].015.45
ВЛИЯНИЕ РАСТИТЕЛЬНЫХ ПОЛИСАХАРИДОВ НА КРОВЬ И КРОВЕТВОРЕНИЕ В НОРМЕ И ПРИ ПАТОЛОГИИ
Рязанский государственный медицинский университет им. акад. И.П. Павлова, г. Рязань
THE INFLUENCE OF BOTANICAL POLYSACCARIDES ON BLOOD AND BLOOD FORMATION IN HEALTH AND DISEASE
Ryazan State Medical University, Ryazan
Полисахариды лекарственных растений Донника желтого, Крапивы двудомной, Пижмы обыкновенной стимулируют гемопоэз при введении в организм животных в норме и при анемии, увеличивая количество эритробластических островков костного мозга и эритроцитов и гемоглобина в крови. У крыс с анемией под влиянием полисахаридов возрастает количество островков и нормализуется численность эритроцитов и гемоглобина на 5-7 сутки опыта.
Ключевые слова: растительные полисахариды, гемопоэз, эритроциты, гемоглобин, эритробластические островки, костный мозг, анемия.
Injection of such medical plants' polysaccharides as Yellow Melilot, Stinging Nettle and Common Tansy stimulates hemopoesis, increases the number of bone marrow erythroblastic islands, erythrocytes and hemoglobin in the blood of healthy animals and ones of with anemia. On the 5-7 day of the experiment under the influence of polysaccharides the number of islands in the organism of rats with anemia and the amount of erythrocytes stabilizes.
Keywords: plant polysaccharides, hemogenesis, erythrocytes, hemoglobin, erythroblastic islands, bone marrow, anemia.
Введение дении в организм животных проявляют вы-
Полисахариды растений обладают вы- раженное противовоспа-лительное, раноза-сокой биологической активностью и при вве- живляющее, антиоксидантное и противора-
диоционное воздействие, стимулируют процессы кроветворения, активируют функции иммунной системы при введении в организм как здоровых животных, так и животных с различными видами патологии [8, 9, 10, 11].
Растительные полисахариды не обладают токсичностью, аллергенностью, пиро-генностью - все это открывает широкие возможности использования их в практической медицине [1, 5, 6].
Изучить действие растительных полисахаридов на состав крови и процессы кроветворения (состояние костного мозга; количество и качество кроветворных эритробластических островков; численность эритроцитов и гемоглобина):
- у нормальных животных;
- у животных со свинцовой уксуснокислой анемией.
Полисахариды растений по составу и строению очень похожи на протеогликаны и гликозаминогликаны клеток иммунной системы и крови, и в растениях выполняют сходные функции, являясь регуляторами роста и функциональной активности клеток [6, 7]. Попадая в организм высших животных такие молекулы способны стимулировать процессы кроветворения [1, 2, 5].
Материалы и методы
В экспериментах использовали 50 крыс породы 'М81аг, и 25 крыс породы 8рга§ие-Ба'^еу. Подопытным животным вводили пе-рорально в дозе 0,1 г/кг массы тела 5% водные растворы полисахаридов. Контрольные крысы получали в то время такой же объем дистиллированной воды. Все животные содержались в стандартных условиях вивария.
Экспериментальную анемию вызывали введением подопытным животным 10% раствора уксуснокислого свинца, в дозе 0,1 г/кг массы тела в течение 5 суток.
Для исследований у контрольных и подопытных животных на 1, 3, 5, 7, 10-11 сутки брали кровь и 2 бедренные кости.
В крови определяли количество эритроцитов и гемоглобина определяли на ге-моанализаторе.
В костном мозге определяли количество эритробластических островков различных классов по методике Захарова и др. [3, 4].
Результаты и их обсуждение
При введении полисахаридов Донника желтого, Крапивы двудомной, Пижмы обыкновенной относящихся к классу пектиновых веществ в организм здоровых животных происходит стимуляция процессов гемопоэза, которая проявляется в увеличении количества эритроцитов и гемоглобина в периферической крови подопытных крыс максимально на 5 сутки эксперимента. При этом количество эритроцитов и гемоглобина под влиянием полисахаридов Донника желтого возрастает на 32% и 36%, Крапивы двудомной на 33% и 22%, а Пижмы обыкновенной на 7 сутки эксперимента на 17% и 33% соответственно.
Увеличение количества эритроцитов в периферической крови подопытных крыс соответствует увеличению уровня гемоглобина. Возрастание количества эритроцитов и гемоглобина связано с изменением численности эритробластических островков в костном мозге и ускорением процессов созревания эритроцитов у экспериментальных животных.
Нами установлено, что под влиянием полисахаридов растений Донника желтого, Крапивы двудомной, Пижмы обыкновенной происходит максимальное увеличение общего количества эритробластических островков на 5-7 сутки эксперимента. В структуре костного мозга различают эритробла-стические островки различного класса зрелости I, II, III и инволюционирующие. Все
Контроль 5 сутки 10 сутки
tri Коапива В Донник U Пижма
Рис. 1. Изменение числа эритроцитов у здоровых животных под действием растительных полисахаридов
Контроль 5 сутки 10 сутки
У Крапива У Донник — Пижма
Рис. 2. Изменение количества гемоглобина у здоровых животных под действием растительных полисахаридов
Изменение количества эритробластических островков костного мозга крыс по классам под действием полисахарида Крапивы двудомной
Класс Э.О. Контроль 3 сутки 5 сутки 10 сутки
I класс 23 45 50
II класс 39 15 20
III класс 9 16 25 10
Общее кол-во 76 78 88 80
А 253,33х103 256,55х103 293,33х103 264,44Х103
классы островков отличаются по количеству клеток и по строению [3]. Общее количество эритробластических островков в структуре костного мозга становиться максимальным
на 5 сутки введения полисахаридов Донника желтого и Крапивы двудонной и превышает контроль в среднем на 16%. При этом количество островков III класса становится мак-
симальным и на 77% под действием полисахарида крапивы превосходит контрольна 7 сутки опыта при введении полисахарида Пижмы обыкновенной общее количество
островков увеличилось на 31,6%, по сравнению с контролем, в основном за счет островков I и III классов зрелости.
Изменение общего количества эритробластических островков под действием растительных полисахаридов
Полисахарид растения Контроль 3 сутки 5 сутки 7-10 сутки
Донник желтый 246,67±1,54 х103 259,21±2,03 х103 278,16±1,17 х103 244,27±0,97 х103
Крапива двудомная 253,33х103 256,55х103 293,33х103 264,44х103
Пижма обыкновенная 79,3 х103 104,4 х103*
общее количество эритробластических островков на 7 сутки введения полисахарида Пижмы обыкновенной
Начиная со 2-3 суток опыта происходит увеличение количества эритробласти-ческих островков 3 класса.
На 7-10 сутки введения полисахарида количество эритробластических островков 1 и 2 классов повышено, а 3 класса снижается до нормы.
В периферической крови животных с экспериментальной анемией количество эритроцитов и гемоглобина уменьшается по сравнению с нормой на 38% и на 33% соответственно, а численность эритробла-стических островков снижается на 29,5%.
Если на 1 сутки опыта у крыс с анемией количество эритроцитов и гемоглоби-
на в среднем на 34,2% и 32,9% ниже, чем у нормальных животных, то в контроле количество эритроцитов на 39%, гемоглобина на 32,96% снижено по сравнению с нормой. Количество эритроцитов и гемоглобина у животных получавших растительные полисахариды возрастает незначительно, в среднем на 7,8% и на 6,1% соответственно.
На 3 день эксперимента количество эритроцитов и гемоглобина в крови подопытных крыс превышает контроль, в среднем, на 16,3% и на 11,9%, но остается ниже, чем у нормальных животных на 19,75% и на 23,14% соответственно.
Действие полисахаридов Донника желтого и Крапивы двудомной на изменение количества эритроцитов и гемоглобина у животных с анемией
Исследуемые показатели (интакт. животные) 1 сутки (анемия) 3 сутки 5 сутки 7 сутки 11 сутки
Норма (п=6) Контроль (п=6) Опыт (п=6) Контроль (п=6) Опыт (п=6) Контроль (п=6) Опыт (п=6) Контроль (п=6) Опыт (п=6) Контроль (п=6) Опыт (п=6)
Эритроциты, 1012/л 6,23±0,52 3,8± 0,48 4,1± 0,41 4,3± 0,38 5,0± 0,36 5,1± 0,43 6,17± 0,5 5,9± 0,47 8,3± 0,51 6,2± 0,54 8,6± 0,61
Гемоглобин, г/дл 12,23±0,87 8,2± 0,75 8,7± 0,81 8,4± 0,72 9,4± 0,75 9,1± 0,81 12,0± 0,85 11,8± 0,79 13,8± 0,68 12,18 ±0,7 14,5± 0,83
На 5 сутки введения полисахаридов Донника желтого и Крапивы двудомной количество эритроцитов и гемоглобина у подопытных животных возвращается к норме, а у контрольных крыс количество эритроцитов на 18,1%, а гемоглобина на 25,6% ниже нормы.
На 7 сутки опыта количество эритроцитов экспериментальных животных превышает норму на 33,23%, гемоглобин на
12,84% (под действием полисахаридов Донника и Крапивы), а в контроле количество эритроцитов на 5,3%, уровень гемоглобина 3,6% ниже нормы.
К 11 суткам эксперимента, все показатели у контрольных животных возвращаются к норме, а под влиянием полисахаридов Донника и Крапивы количество гемоглобина на 18,56%, а эритроцитов на 38% больше нормы.
Действие полисахаридов Донника желтого и Крапивы двудомной на изменение количества эритробластических островков у животных с анемией
Исследуемые показатели (интакт. животные) 1 сутки (анемия) 3 сутки 5 сутки 7 сутки 11 сутки
Норма (П=6) Контроль (П=6) Опыт (П=6) контроль (П=6) Опыт (П=6) контроль (П=6) опыт (П=6) контроль (П=6) Опыт (П=6) Контроль (П=6) Опыт (П=6)
Число ЭО (А) 246,67±0 ,32 х103 173,3 ±0,26 х103 196,6 7±0,3 х103 180,00 ±0,24 х103 203,33 ±0,34 х103 203,33 ±0,28 х103 266,67 ±0,31 х103 276,67 ±0,28 х103 320,00 ±0,21 х103 280,00 ±0,31 х103 346,6 ±0,27 х103
На 1 сутки опыта общее количество островков увеличилось на 13,29%, по сравнению с контролем, но ниже нормы на 24,01%.
Количество эритробластических островков на 3 сутки опыта под влиянием полисахаридов Донника и Крапивы увеличилось в среднем на 12,78% по сравнению с контролем,но ниже нормы на 17,48%
На 5 сутки эксперимента при действии полисахаридов Донника и Крапивы общее количество эритробластических островков увеличивается, в среднем, на 31,03%, и превышает норму на 8,02%.
К 7 суткам опыта при введении полисахаридов общее количество островков превышает норму 30,08%, а контроль на 15,94% в среднем.
На 10-11 сутки под влиянием полисахаридов Крапивы и Донника общая численность эритробластических островков на 40,65% превышает норму, и выше чем в контроле на 23,57%.
Количество эритроцитов и гемоглобина, у здоровых животных, под действием полисахаридов растений максимально увеличивается на 5-7 сутки эксперимента, а на 10 сутки снижается, но превышает контроль
Численность эритробластических островков достигает максимума у здоровых животных под влиянием полисахарида крапивы и донника на 5 день опыта, а при действии полисахарида пижмы на 7 сутки эксперимента
У крыс с анемией уровень эритроцитов и гемоглобина нормализуется под влиянием полисахарида крапивы и донника на 5-7 сутки эксперимента, а на 10 сутки снижается, но превышает норму
Количество эритробластических островков, у животных с анемией, под действием растительных полисахаридов крапивы и донника доходит до нормы на 5-7 день опыта, а максимально возрастает на 10
день эксперимента превышая норму на 36% и 10,5% соответственно.
1. Бочков А.Ф. Углеводы / А.Ф. Бочков, В.А. Афанасьев, Г.Е. Зайков. - М.: Наука, 1980. -238 с.
2. Бычков С.М. Протеогликаны и клетки / С.М. Бычков, С.А. Кузьмина // Бюллетень экспериментальной биологии и медицины. - 1996. - №2. - С. 124-127.
3. Изучение гепатопротекторной активности полисахаридного комплекса цветков пижмы обыкновенной / Е.Е. Енгалычева [и др.] // Рос. медико-биол. вестн. им. акад. И.П. Павлова. - 2015. - № 2. - С. 50-55.
4. Захаров Ю.М. Эритробластический островок / Ю.М. Захаров, А.Г. Рассохин. -М.: Медицина, 2002. - 280 с.
5. Калинкина О.В. Изменение количества эритробластических островков костного мозга крыс под действием полисахарида крапивы двудомной: / О.В. Калинкина // Всероссийская конференция университета с Международным участием, посвященная 70-летию основания Рязанского университета им. акад. И.П. Павлова. - Рязань: РИО РязГМУ, 2013.
6. Комарова Н.С. Плавающие лекарственные формы, характеристика, особенности состава и технологии / Н.С. Комарова,
A.Н. Николашкин // Наука молодых (БгиёШо 1иуепшш). - 2013. - № 3. - С. 80-85.
7. Лаксаева Е.А. Влияние водорастворимого полисахаридного комплекса ирги обыкновенной на морфофизиологиче-ские и биохимические показатели организма лабораторных крыс / Е.А. Лаксаева, И.А. Сычёв // Рос. медико-биол. вестн. им. акад. И.П. Павлова. - 2015. - № 2. - С. 56-62.
8. Порядин Г.В. Действие полисахаридов на систему крови крыс / Г.В. Порядин,
B.М. Смирнов, И.А. Сычев // Бюл. эксперим. биологии и медицины. - 2006. - №5.
9. Порядин Г.В. Действие полисахаридов на процессы кроветворения в норме и при различных видах патологии / Г.В. Порядин, В.М. Смирнов, И.А. Сычев // Рязанский областной институт развития образования. - 2008. - 88 с.
10. Селезенев Н.Г. Хроматоспектро-фотометрический метод определения арбутина в листьях брусники / Н.Г. Селезенев,
C.В. Добина // Наука молодых (БгиёШо ■Гиуешиш). - 2013. - № 1. - С. 31-35.
11. Филоненко Е.С. Перспективы использования плюрипотентных стволовых клеток человека для получения компонентов крови: эритропоэз // Научно-информационный и аналитический журнал КТТИ. - 2013. - Т. 7, №2. - С. 6-14.
СВЕДЕНИЯ ОБ АВТОРАХ
Ерзылева Т.В. - студентка 4 курса фармацевтического факультета ГБОУ ВПО РязГМУ Минздрава России, г. Рязань.
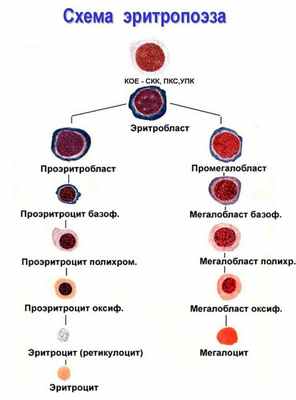
Эритропоэз
Эритропоэз — процесс образования эритроцитов в костном мозге. Первой клеткой эритроидного ряда, образующейся из колониеобразующей клетки эритроцитарной (КОК-Э) — клетки-предшественницы эритроидного ряда, является проэритробласт, из которого в ходе 4—5 последующих удвоений и созревания образуется 16—32 зрелых эритроцита.
Схема процесса: 1 проэритробласт (удвоение) -» два базофильных эритробласта I порядка -» 4 базофильных эритробласта II порядка -» 8 полихроматофильных эритро- бластов I порядка -» 16 полихроматофильных эритробластов II порядка -gt; 32 полихроматофильных нормобласта -» 32 оксифильных нормобла-
Рис. 7.4. Эритробластический островок костного мозга человека. 1 — эритробласт, 2 — цитоплазма макрофага.
ста -gt; денуклеация нормобластов -gt; 32 ретикулоцита -gt; 32 эритроцита. Эритропоэз до формирования ретикулоцита занимает 5 дней.
Эритропоэз у человека и животных (от проэритробласта до ретикулоцита) протекает в эритробластических островках костного мозга, которых в норме содержится до 137 на 1 мг ткани костного мозга (рис. 7.4). Макрофаги эритроцитарных островков играют основную роль в физиологии эритроидных клеток, влияя на их пролиферацию и созревание. Макрофаги фагоцитируют вытолкнутые из нормобластов ядра, обеспечивают эритро- бласты ферритином и пластическими веществами, секретируют эритропоэтин и гликозаминогликаны, последние повышают концентрацию ростковых факторов в островках. Эти благоприятные условия для развития эрит- робластов макрофаги создают благодаря наличию рецепторов к эритроид- ным клеткам-предшественницам.
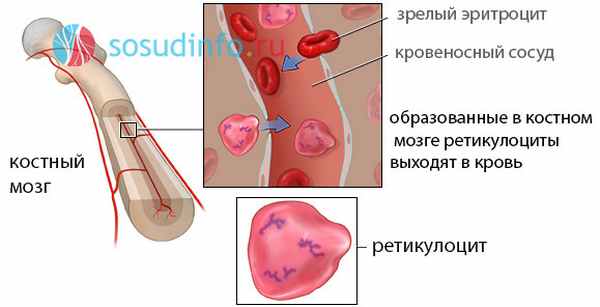
Из костного мозга ретикулоциты выходят в кровь и в течение суток созревают в эритроциты. По количеству ретикулоцитов в крови судят об эритроцитарной продукции костного мозга и интенсивности эритропоэза.
У человека их количество составляет 5—10 96о. За сутки в 1 мкл крови поступает 60—80 тыс. эритроцитов. В 1 мкл крови у мужчин содержится 5,21 (4,52—5,9) млн, а у женщин — 4,6 (4,1—5,1) млн эритроцитов. Уменьшение количества эритроцитов в единице объема крови называется анемией, увеличение — эритроцитозом. Последний может носить физиологический, приспособленный для организма человека характер (например, при подъеме человека в горы, на высоту более 3000 м над уровнем моря). Регуляция эритропоэза
Эритропоэтин, секретируемый тубулярными и перитубулярными клетками почек, является гуморальным регулятором эритропоэза. Небольшое количество гормона (10—15 %) вырабатывается в макрофагах костного мозга, купферовских клетках и гепатоцитах. В почках синтез и секреция эритропоэтина определяются уровнем обеспечения кислородом их тканей. К уровню кислорода в почечной ткани чувствителен гемсодержащий белок- цитохром b , входящий составной частью в НАДФ-зависимую окси- дазу пери- и тубулярных клеток. При нормальном уровне р02 в ткани почки радикалы кислорода, продукцируемые оксидазой, прежде всего перекись водорода, препятствуют формированию в почечной ткани «индуцируемого гипоксией фактора-1 (ИГФ-1)», стимулирующего транскрипцию эритропоэтиновой иРНК и синтез эритропоэтина. При снижении кислородного обеспечения ткани почек (р02 до 20—40 мм рт. ст.) продукция оксидазой перекиси водорода уменьшается. Нарастает активация ИГФ-1 в цитозоле и его перемещение в ядро клетки, где ИГФ-1 специфически связывается с ДНК, вызывая экспрессию гена эритропоэтина. Гипоксия почечных структур активирует также ферменты (фосфолипаза А2), ответственные за синтез простагландинов (Е! и Е2), которые через систему «аде- нилатциклаза—цАМФ» также усиливают синтез эритропоэтина в пери- и тубулярных клетках почек. Адреналин и норадреналин через ^-адренорецепторы синтезирующих эритропоэтин клеток почек и систему вторичных посредников в них — цАМФ и цГМФ — вызывают усиление синтеза и секреции эритропоэтина в кровь.
При гипоксии почечной ткани количество эритропоэтина возрастает в 1000 раз и более при норме 0,01—0,08 ME (международных единиц)/мл плазмы. При гематокрите, равном 40—45, количество эритропоэтина составляет 5—80 мМЕ/мл, а при гематокрите, равном 10—20 (его уменьшение может быть вызвано острой кровопотерей, ге-
молизом эритроцитов),— 1—8 МЕ/мл плазмы. Эритропоэтин тормозит апоптоз, регулирует пролиферацию и дифференциацию КОК-Э, про- и эритробластов, ускоряет синтез гемоглобина в эритроидных клетках и ре- тикулоцитах, «запускает» в чувствительных к нему клетках синтез эритропоэтиновой иРНК и энзимов, участвующих в формировании гема и глобина, цитоскелета эритроцитов, увеличивает кровоток в эритропоэтической ткани костного мозга и выход в кровь ретикулоцитов. Наконец, катехоламины через (5-адренорецепторы КОК-Э также усиливают пролиферацию эритроидных клеток-предшественниц. Продукция эритропоэтина почками угнетается при повышенном образовании в организме человека опухоль- некротизирующего фактора а, интерлейкинов-1а и 1(3, интерферонов а, (3 и у, что имеет место, например, у больных с хроническими паразитарной и бактериальной инфекциями, при ревматоидном артрите, так как перечисленные вещества тормозят синтез эритропоэтина в клетках почек. В результате у больных развивается анемия вследствие сниженной продукции почками эритропоэтина.
Половые гормоны и эритропоэз. Андрогены, а точнее продукты их 5-(3-ре- дуктазного превращения — 5-(3-Н-метаболиты, увеличивают чувствительность клеток-предшественниц эритроидного ряда к эритропоэтину, что делает эритропоэз более интенсивным. Эстрогены обладают противоположным действием на эритропоэз, снижая его интенсивность. Поэтому после полового созревания у мужчин устанавливаются более высокие значения эритроцитов и гемоглобина, чем у женщин.
Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 6, стр. 780-789
Проблема загрязнения окружающей среды соединениями тяжелых металлов является актуальной и требует углубленного исследования процессов воздействия этих соединений на организм человека и животных. Изучение металлиндуцированной анемии и возможных путей ее коррекции является чрезвычайно важным для Республики Башкортостан, которая занимает второе место в Уральском регионе по промышленному потенциалу и является крупнейшим индустриальным центром России. В рудах медно-цинково-колчеданных месторождений обнаружено более 80 минералов, представленных пиритом, халькопиритом, сфарелитом, хлоритом, серицитом и другими. Кроме основных компонентов (медь, цинк, сера и добываемые попутно золото и серебро), руда содержит свинец, селен, теллур, кадмий, никель, кобальт, мышьяк, сурьму, таллий и барий. Известно, что такие металлы, как железо, медь, цинк, молибден, кобальт, марганец необходимы для жизнедеятельности организма. Однако тяжелые металлы и их соединения, оседая на коже, ногтях и волосах, проникая в организм через воздух, воду, пищу, накапливаются в нем и оказывают токсическое воздействие на устойчивость мембран клеток крови, иммунной, эндокринной и центральной нервной систем [1–4]. По данным ранее проведенных исследований, кадмию и свинцу отводится одно из лидирующих мест среди наиболее опасных металлов-загрязнителей [5]. В патогенезе свинец-индуцированной анемии наблюдается снижение образования эритропоэтина в почках, повреждение стволовых клеток красного костного мозга, нарушение синтеза гемоглобина, снижение осмотической резистентности эритроцитов [6]. Кадмий накапливается в почках (30–60%) и печени (20–25%), что приводит к нарушению клеточной адгезии и активации перекисного окисления липидов (ПОЛ), этот элемент связывает карбоксильные, амино- и сульфгидрильные группы, вызывая некроз и апоптоз клеток [7].
Изучение количественного и качественного состава эритробластических островков (ЭО) костного мозга – клеточных ассоциаций, состоящих из центрально расположенного макрофага с “короной” эритроидных клеток разной степени зрелости, позволяет изучить особенности взаимодействия между клетками и охарактеризовать результаты воздействия различных токсических веществ на эритропоэз. Морфологический анализ ЭО дает возможность определить в единице объема костного мозга количество колониеобразующих единиц эритроцитарных (КОЕэ), вступивших в дифференцировку, оценить синхронность волн амплификации, а также изучить характер межклеточных взаимодействий в ЭО при различной экспериментальной патологии [8–10].
Целью данного исследования было определение особенностей воздействия соединений тяжелых металлов в составе медно-цинковой колчеданной руды на центральное и периферическое звено эритрона в условиях in vivo.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 70 белых беспородных крысах-самцах возраста 3–4 мес. массой 200.8 ± 10.5 г. Данное исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями о соблюдении биоэтических норм биоэтического совета ФГБОУ ВО “Башкирский государственный медицинский университет” Минздрава России. Животные содержались в стандартных клетках (n = 6) в условиях свободного доступа к питью и еде при температуре воздуха в виварии 24 ± 2°С в соответствии с правилами СП 2.2.1.3218 [11] и с Директивой 2010/63/EU по охране животных, используемых в научных целях [12]. Все болезненные манипуляции с животными при взятии периферической крови и эвтаназию путем декапитации проводили под эфирным наркозом в отдельном от вивария помещении.
Образец исследуемой руды был предоставлен ОАО “Учалинский горно-обогатительный комбинат” (г. Учалы, Республика Башкортостан). Руду дробили и измельчали до порошкообразного состояния. Для создания экспериментальной модели хронической интоксикации медно-цинковой колчеданной рудой опытной группе животных (n = 50) ежедневно за час до стандартного кормления перорально в течение двух месяцев вводили водную суспензию порошка медно-цинковой колчеданной руды [13]. Компонентный анализ образца руды определяли методом атомно-абсорбционной спектрометрии (табл. 1). Вводимую дозу руды для опытной группы крыс рассчитывали по минимальной предельно допустимой концентрации (ПДК) свинца и кадмия в медно-цинковой колчеданной руде – 300 мкг/кг и 600 мг/кг соответственно [14].
Таблица 1.
Компонентный состав медно-цинковой колчеданной руды ОАО “Учалинский горно-обогатительный комбинат”
| Элементный состав медно-цинковой колчеданной руды | Доля вещества в пробе, % | ПДК вещества в хлебе, мг/кг | Доля вещества во вводимой дозе руды, мг/кг |
|---|---|---|---|
| Медь | 2.258 | 25.0 | 0.60 |
| Цинк | 0.098 | 5.0 | 13.56 |
| Мышьяк | 0.063 | 0.1 | 0.38 |
| Свинец | 0.060 | 0.3 | 0.36 |
| Кадмий | 0.009 | 0.05 | 0.06 |
Пересчет дозы руды корректировали после очередного взвешивания животного (через каждые 14–15 дней). В контрольную группу вошли 20 крыс, которые не подвергались воздействию руды.
В качестве материала исследования брали периферическую кровь, костный мозг и почки контрольных и подопытных крыс. Забор крови и костного мозга осуществляли на 10-е, 20-е, 30-е, 45-е и 60-е сутки эксперимента. Кровь из хвостовой вены собирали в микропробирки с ЭДТА, далее на ветеринарном полуавтоматическом гематологическом анализаторе Vet Exigo 19 (Швеция) определяли количество эритроцитов и концентрацию гемоглобина. Кровь для подсчета ретикулоцитов окрашивали в пробирке готовым раствором бриллиантового крезилового синего (ЗАО “ЭКОлаб”, Россия). Подсчет ретикулоцитов осуществляли с помощью комплекса автоматической микроскопии МЕКОС-Ц2 Софт (Россия) на микроскопе AXIO Lab.A1 (ZEISS, Германия) при увеличении ×900, используя масляную иммерсию. Содержание эритропоэтина в сыворотке крови определяли методом твердофазного иммуноферментного анализа с помощью набора реагентов “Эритропоэтин-ИФА-БЕСТ” (АО “Вектор-БЕСТ”, Россия) на биохимическом анализаторе Stat Fax 2100 (США). Для морфологического исследования на 60-е сутки эксперимента у контрольных и подопытных крыс были взяты кусочки почек размером 0.5 × 0.5 см. Ткани фиксировали в 10%-ном забуференном растворе формалина и после стандартной гистологической проводки готовили срезы толщиной 7 мкм, после чего окрашивали их гематоксилином-эозином.
Костный мозг для исследования получали из бедренных костей. Общее количество ЭО подсчитывали в камере Горяева, предварительно окрасив клетки 0.1%-ным раствором красителя нейтрального красного. Полученные препараты ЭО фиксировали по Май-Грюнвальду красителем-фиксатором “эозин–метиленовый синий” (ООО “МиниМед”, Россия), затем окрашивали по Паппенгейму красителем Гимза (ООО НПП “ПанЭко”, Россия). Подсчет ЭО производился методом световой микроскопии при увеличении ×900 с использованием масляной иммерсии. ЭО разделяли на 5 классов зрелости [15]. “Корона” ЭО 1-го класса была представлена проэритробластами и базофильными эритробластами с числом клеток от 2 до 8; “корона” ЭО 2-го класса – базофильными и ранними полихроматофильными эритробластами с числом клеток от 9 до 16. В “короне” ЭО 3-го класса зрелости содержались полихроматофильные эритробласты, оксифильные нормобласты и ретикулоциты с числом клеток от 17 до 32; “корона” инволюцирующих островков (ЭОинв) была представлена поздними полихроматофильными эритробластами, оксифильными нормобластами и ретикулоцитами с числом ядросодержащих клеток менее 16. К реконструирующимся островкам (ЭОрек) относили инволюцирующие ЭО, имевшие в составе “короны” молодые эритроидные клетки (проэритробласты и/или базофильные эритробласты), т.е. формирование данных островков являлось результатом дифференцировки присоединившегося к макрофагу инволюцирующего островка колониеобразующей единицы эритроцитарной (КОЕэ). Кроме того, в этих же препаратах подсчитывали на 100 ЭО количество свободных отдельно лежащих макрофагов и число ЭО, “корона” которых состояла только из ретикулоцитов. Для оценки темпа развития ЭО рассчитывали следующие показатели:
А1 – общее количество КОЕэ, вступивших в дифференцировку (число ЭО всех классов зрелости + ЭОрек);
А2 – показатель интенсивности вовлечения КОЕэ в эритропоэз в ЭО (ЭО1 + ЭОрек), при этом количество ЭО1 характеризовало эритропоэз de novo, число ЭОрек – эритропоэз de repeto;
А3 – показатель созревания эритробластов ((ЭО3 + ЭОинв.)/(ЭО1 + ЭО2 + ЭОрек));
А4 – показатель повторного вовлечения макрофагов в эритропоэз (ЭОрек/ЭОинв) [15].
Статистическую обработку полученных данных проводили в русифицированной лицензионной программе Statistica 10 (StatSoft, США). Для каждого показателя рассчитывали среднее значение (М) и стандартную ошибку среднего значения (m), результаты представлены в виде М ± m. В качестве критерия оценки статистически значимых различий между контрольной и опытными группами животных использовали непараметрический критерий Манна–Уитни. Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При исследовании показателей периферической крови крыс опытной группы было установлено, что к 30-ым суткам количество эритроцитов и гемоглобина в сравнении с группой контроля уменьшилось в 1.2 раза (табл. 2). На 45-е сутки наблюдения эти показатели также были достоверно снижены, на 60-е сутки достоверных различий выявлено не было, хотя в среднем и число эритроцитов, и количество гемоглобина были существенно меньше показателей интактных животных.
Эритропоэз: понятие, физиология, регуляция, схема, патология
Эритропоэз — физиологический процесс образования и дифференцировки красных кровяных клеток – эритроцитов. Данный термин в переводе с древнегреческого языка дословно означает «красный, делать». Эритроциты берут начало от гемопоэтической стволовой клетки — основной единицы кроветворения. Процесс их деления и созревания длится в среднем 3—7 дней. Клетки-предшественники чувствительны к гликопротеину, эритропоэтину и прочим стимулирующим факторам.
Красные кровяные тельца были описаны в 1913 году ученым из Англии Артуром Бойкоттом. Жизненный цикл эритроцитов составляет в среднем сто дней. Для поддержания их стабильного уровня в крови постоянно формируются новые эритроидные клетки. Погибающие клетки захватываются и перевариваются макрофагами. Из кроветворной ткани в кровоток каждую минуту выходит 1,8×10 9 ретикулоцитов. Кровопотеря, гемолиз и прочие факторы максимально стимулируют гемопоэз, который увеличивается в 10-12 раз.
Видео: основное об эритропоэезе и гемопоэзе
Эритроциты
Развитие эритроцитов и создание уникальной структурно-функциональной модели происходит путем дифференцировки. Красные клетки крови созревают у детей первых пяти лет жизни в костном мозге всех костей скелета. Бедренная и берцовые кости перестают участвовать в кроветворении к 24 годам. В позвонках, грудине, ребрах, черепе и прочих плоских костях клетки крови образуются всю жизнь.
Эритроциты выполняют жизненно важные функции:
- дыхательная — транспорт кислорода к тканям и выведение углекислоты из организма;
- трофическая — доставка аминокислот и прочих питательных веществ к внутренним органам, обеспечение регенерации и репарации;
- детоксикационная — адсорбция токсинов и их инактивация;
- метаболическая — содержание большого числа энзимов;
- коагуляционная — наличие на поверхности клеток плазменных факторов свертывания крови;
- буферная — регулирование КОС и водно-минерального обмена;
- депонирующая — хранение воды и микроэлементов;
- иммуномодулирующая – участие в формировании иммунитета.
Особенности физиологии красных телец:
- Эритроциты способны выпадать в осадок. Это свойство напрямую зависит от белкового состава крови – чем больше в плазме содержится грубодисперсных глобулинов, тем выше СОЭ.
- При замедлении системного кровотока и сгущении крови эритроциты начинают объединяться в крупные агрегаты. Они называются ложными, поскольку распадаются на функционально активные клетки, сохраняющие свою структуру.
- Пластичность – обратимая деформация клеток, проходящих через капилляры, артериолы и венулы. Это свойство обусловлено наличием в мембране спектрина – особого белкового соединения.
- К физиологическим свойствам красных кровяных телец также относится осмотическая устойчивость и деструкция после длительной циркуляции в кровотоке.
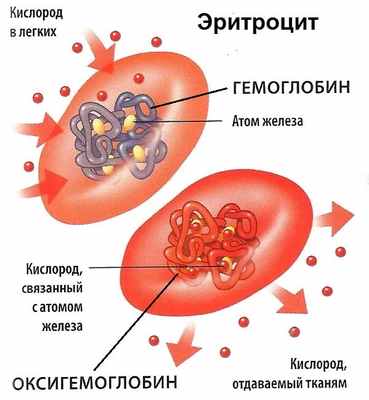
Структура красных кровяных телец максимально адаптирована для реализации жизненно важных функций. Эти узкоспециализированные клетки мобильны. Они обеспечивают диффузию газов, взаимодействуют с гемоглобином, быстро делятся и проникают в системный кровоток. Эритроциты на 50% состоят из протеинов, на 40% из липидов и на 10% из углеводов. Клетки способны деформироваться и циркулировать по сосудам малого калибра. Такая способность обусловлена их гибкостью и пластичность. Эритроциты имеют дисковидную форму с углубленным центром. Эти безъядерные элементы не содержат органелл – их цитоплазма наполнена гемоглобином.
Для изучения формы, структуры и размера эритроцитов проводят микроскопическое исследование мазка крови. Морфологические и тинкториальные свойства клеток помогают поставить диагноз разных видов анемии.
Физиология
Эритропоэз начинается под воздействием стимулирующих факторов. Основным из них является гипоксия тканей — нехватка кислорода и ишемия органа. В ответ на происходящие изменения в организме почки синтезируют гормон эритропоэтин. Именно он запускает процесс образования эритроцитов. Влиянием этого биологически активного вещества обусловлена пролиферация и дифференциация клеток-предшественников. Процесс кроветворения ускоряется, эритроциты массово выходят в системный кровоток. Гормоны оказывают непосредственное воздействием на процесс образования железосодержащего белка — гемоглобина. Они стимулируют синтез рибонуклеиновой кислоты, обеспечивающей секрецию необходимых энзимов. Эритропоэтины улучшают кровоснабжение кроветворной ткани и ускоряют, таким образом, гемопоэз, протекающий в эритробластических островках костного мозга.
- На начальных стадиях развития плода эритропоэз осуществляется в зародышевом органе – желточном мешке.
- С 5 недели эмбрионального развития – в печени.
- С 16 недели беременности эритроциты продуцируются в фетальной селезенке.
- С 20 недели гестации этот процесс осуществляется в костном мозге.
Процесс образования форменных элементов происходит вне синусов костного мозга и называется эктраваскуляторным. Когда ребенок появляется на свет, его кроветворная ткань уже полностью сформирована. Постнатальный гемопоэз обеспечивает физиологическую регенерацию крови – ее обновление.
Факторы, стимулирующие эритропоэз:
- физическое перенапряжение,
- кровопотеря,
- курение,
- подъем в горы,
- кардиоваскулярные патологии,
- хронические бронхолегочные заболевания,
- химиотерапия,
- длительная и интенсивная витаминотерапия.
Результатом повышенной продукции эритроцитов является эритроцитоз. Он бывает физиологическим и патологическим.
Факторы, угнетающие эритропоэз:
- стойкая дисфункция почек,
- гипопротеинемия,
- авитаминозы,
- нехватка железа в организме и прочих микроэлементов,
- хронические патологии в стадии декомпенсации,
- острые инфекции,
- неоплазии недоброкачественного течения,
- тяжелые интоксикации,
- поражение костномозговых структур,
- онкогематологические расстройства — лейкоз.
Нарушение кроветворения приводит к развитию серьезного заболевания крови – анемии.
В крайне редких случаях эритропоэз осуществляется не в костном мозге, а в печеночной ткани и селезенке. Причинами подобного отклонения являются особые состояния, патологические процессы и некоторые обстоятельства.
Схема и стадии
Эритроциты во время своего развития проходят несколько сменяющих друг друга стадий. Гемангиобласт – первичная стволовая клетка, закладывающаяся в онтогенезе. Этот предок всех эндотелиальных и кровеобразующих структур трансформируется в гемоцитобласт – плюрипотентную клетку. Из нее образуется множество различных клеточных элементов, но не целый организм. Мультипотентная стволовая клетка – общий миелоидный предшественник, способный формировать клетки тканей, из которых сам был получен, и превращаться в унипотентную клетку. Она дифференцируется в сторону эритропоэза. Именно с этого звена гемопоэза начинается эритроидная линия.
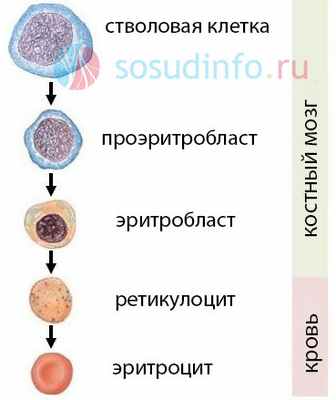
- Колониеобразующая единица эритроцитопоэза — лимфоцитоподобная клетка, не имеющая специальных морфологических характеристик, способная к самообновлению и дифференциации.
- Она непрерывно делится и дает начало базофильным клеткам — проэритробластам. Это первый визуально определяемый элемент эритроцитарного ряда, способный к образованию гемоглобина. Его круглое ядро занимает более половины клетки, окрашивается в темно-фиолетовый цвет и имеет тонкодисперсную структуру хроматина.
- В результате его деления образуются базофильные эритробласты. В отличии от своих предшественников они содержат относительно мелкие ядра, базофильную цитоплазму и много рыхлого гетерохроматина.
- Митотическое деление базофильных эритробластов заканчивается появлением полихроматофильных эритробластов, имеющих в ядре конденсированный хроматин.
- Митозы этих клеток дают начало нормобластам, которые прочным кольцом окружают ретикулярную клетку, охватывают ее своими утолщенными отростками и образуют эритробластические островки. Ортохроматические эритробласты не имеют органелл. В их цитоплазме содержится много гемоглобина, а в ядре – глыбок гетерохроматина.
- После выталкивания ядра из тела клетки образуются ретикулоциты. Они синтезируют и накапливают гемоглобин благодаря работе особого рибосомального аппарата. Ретикулоциты выходят из органа кроветворения и попадают в просвет кровеносных сосудов.
- Непосредственно в кровотоке они трансформируются в зрелые эритроцитарные клетки, не имеющие ядра, органелл и рецепторных белков на поверхности. Эритроциты доставляют кислород к органам и удаляют из низ углекислый газ. Процесс созревания длится 24 часа.
Эритроциты на каждой стадии кроветворения имеют особые морфологические, тинкториальные, микроскопические, биохимические и иммунологические свойства. Во время дифференцировки клеток уменьшается размер ядра. Оно постепенно сморщивается и полностью исчезает. Цитоплазма, наоборот, увеличивается в объеме, изменяет свой цвет, накапливает гемоглобин.
Регуляция
Существуют различные виды регуляция эритропоэза — гуморальная, нервная, с помощью ретикулярных клеток, витаминов и минералов.
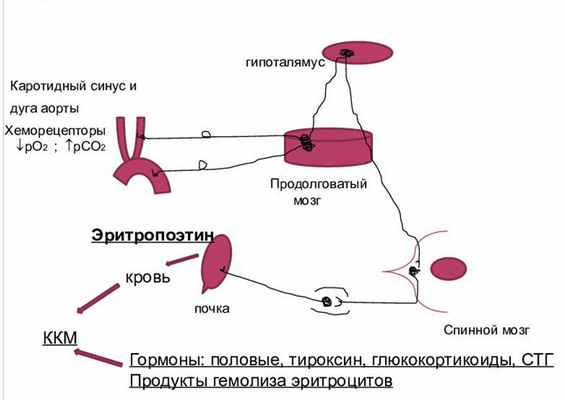
Гуморальная регуляция осуществляется по принципу отрицательной обратной связи. Благодаря гормону эритропоэтину процессы образования юных эритроидных клеток и распада старых, деформированных телец четко сбалансированы и непрерывны. Уровень эритроцитов в крови сохраняется относительно стабильным и обеспечивает полноценное кровоснабжение и оксигенацию тканей. Гипоксия органов, вызванная сосудистым спазмом, малокровием или иной патологией, стимулирует секрецию эритропоэтина, который усиливает продукцию красных телец и повышает их концентрацию в крови. Когда кровоснабжение органов восстанавливается, секреция эритропоэтина понижается.
К другим гормонам, контролирующим эритропоэз, относятся: кортизол, андрогены, глюкокортикоиды, инсулин, соматотропный и тиреоидные гормоны, катехоламины, интерлейкины, плацентарный пролактин. Они увеличивают продукцию эритропоэтина или непосредственно стимулируют гемопоэз. Подавляют эритропоэз эстрогены, кейлоны, глюкагон, ацетилхолин, интерфероны, факторы некроза опухолей.
- Рост и развитие организма человека сопровождаются усилением интенсивности эритропоэза.
- При гипергликемии и гипотиреозе развивается анемия, а при тиреотоксикозе возникает эритроцитоз.
- При сильном стрессе повышается продукция эритроцитов, и улучшается кровоснабжение тканей.
- Гипофункция надпочечников сопровождается эритропенией, а гиперкортицизм — эритроцитозом.
Нервная регуляция происходит следующим образом: симпатическая система активизирует эритропоэз, а парасимпатическая – тормозит.
Ретикулярные клетки влияют на процесс кроветворения двумя способами:
- Фагоцитоз — процесс поглощения и переваривания клеточных оболочек, разрушения зрелых эритроцитов с пороками развития, прекращения метаболизма ядер эритробластов.
- Рофеоцитоз — перенос ферритина, образовавшегося после распада аномальных эритроцитов, молодым ортохроматическим эритробластам.
Макрофаги оказывают непосредственное воздействие на пролиферацию и созревание эритроидных клеток. Они поглощают ядра нормобластов, обеспечивают эритробласты железом и питательными веществами, стимулируют синтез эритропоэтина и гликозаминогликанов, которые повышают концентрацию факторов роста в островках.
Для осуществления эритропоэза критически необходимы некоторые витамины и минералы:
- кобаламин — запускает секрецию глобина,
- фолиевая кислота — принимает участие в образовании ДНК ядерных форм,
- пиридоксин – обеспечивает продукцию гема,
- рибофлавин — формирование липидной оболочки эритроцитов,
- витамин С — ускоряет усвоение железа,
- витамин РР – укрепляет строму из липидов и предотвращает гемолиз,
- медь — позволяет железу быстрее всосаться в кишечнике и включиться в структуру гема,
- никель и кобальт – образование железосодержащего белка крови,
- цинк — входит в состав жизненно необходимых энзимов,
- селен — защита клеток от свободных радикалов.
Нехватка одного из них может вызвать нарушение эритроцитопоэза, а именно дифференцировки и деления стволовых клеток.
Видео: подробные лекции о гемопоэзе
Патология
Под воздействием неблагоприятных эндогенных и экзогенных факторов эритропоэз нарушается. Основные гематологические синдромы обусловлены количественными и качественными изменениями структуры и функций эритроцитов. У больных развиваются тяжелые заболевания, в основе которых лежит эритропения или эритроцитоз.
Анемия — патологический процесс, обусловленный низким уровнем эритроцитов и гемоглобина в крови. Это самое распространенное гематологическое расстройство. Оно бывает самостоятельным — вызванным нарушением гемопоэза, а также вторичным — возникающим при заболеваниях внутренних органов.
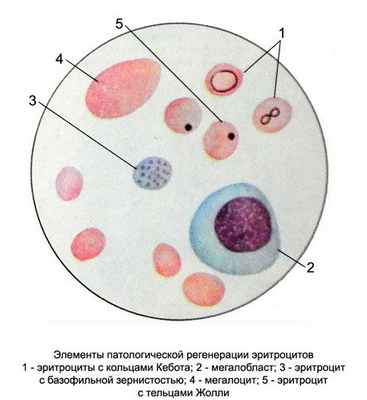
К анемиям, обусловленным нарушением кровообразования относятся:
![]()
нормобластный и мегалобластный типы эритропоэза (при анемии)
- отличается пониженной концентрацией крупных эритроцитов, содержащих много гемоглобина. В происхождении патологии «виноваты» клетки-предшественники – мегалобласты. В клетках костного мозга нарушается синтез ДНК. Вместо нормальных эритроцитов образуются эритробласты. Они являются функционально неактивными – не связывают кислород и не транспортируют его к органам и тканям. Патологический процесс обусловлен дисбалансом между ядром и протоплазмой, нарушением деления клеток и развития хромосом. связана с нехваткой железа в организме и низким уровнем гемоглобина в эритроцитах. Микроэлемент поступает в ЖКТ с пищей, связывается в кишечнике с белком трансферрином, всасывается в кровь и направляется в костный мозг, где встраивается в молекулу гемоглобина. Патология проявляется трофическими расстройствами — шелушением кожи, сухостью слизистых, выпадением волос, ломкостью ногтей. – недостаточность витамина В12, необходимого для дифференциации красных кровяных телец. Данный элемент поступает в организм с пищей, связывается с внутренним фактором Касла и участвует в кроветворении. Он необходим для синтеза ДНК и является катализатором этой реакции. У больных с анемией возникают признаки поражения ЖКТ и нервной системы.
![]()
различные изменения в созревании эритроцитов
К более редким формам анемии, обусловленной нарушением эритропоэза, относятся: метапластическая, фолиеводефицитная, сидеробластная, апластическая. Клинически все виды анемии проявляются признаками астеновегетативного синдрома – бледностью кожи, тахикардией, головокружением, слабостью, бессилием, плохим настроением.
Эритроцитоз — патологическое состояние, при котором увеличивается количество эритроцитов и гемоглобина в крови. Сама жидкость густеет, что затрудняет ее движение по сосудам и нарушает кислородный обмен. Количество эритроцитов и гемоглобина в крови увеличивается под воздействием различных факторов — физиологических и патологических.
При обезвоживании организма, связанном с профузными поносами, рвотой, гипергидрозом, или задержке жидкости, вызванной отеком легких, шоком, кардиоваскулярной недостаточностью, увеличивается концентрация красных телец в крови. Когда количество эритроцитов становится чрезмерным, повышается вязкость крови — она сгущается. Возможна агглютинация, склеивание эритроцитов и увеличение объема циркулирующей крови. У больных поднимается кровяное давление, возникает головная боль, головокружение и багровый цианоз, нарушается зрение, увеличиваются печень и селезенка, развиваются носовые кровотечения, тромбозы, инфаркты, инсульты.
Читайте также: