ФАБ-классификация миелодиспластических синдромов (МДС)
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Миелодиспластический синдром (МДС) – группа гематологических заболеваний, обусловленных нарушением работы костного мозга по воспроизведению одного или более типов клеток крови: тромбоцитов, лейкоцитов, эритроцитов. У людей, страдающих МДС, костный мозг, компенсируя естественный процесс уничтожения клеток крови селезенкой, не в состоянии воспроизвести их в нужном количестве. Это приводит к увеличению риска инфекций, кровоточивости и анемии, которая также проявляется усталостью, одышкой или сердечной недостаточностью. Развитие МДС может носить как спонтанный характер (без видимых причин), так и быть обусловленным использованием химиопрепаратов, облучения. Последний вариант МДС часто называют «вторичным», и хотя встречается он гораздо реже, хуже поддается лечению. Подавляющее большинство случае «первичного» МДС развивается у людей старше 60 лет, в детском возрасте болезнь встречается редко.
Клиническая картина МДС
В подавляющем большинстве пациенты обращаются за помощью с жалобами на усталость, утомляемость, одышку при физической нагрузке, головокружения – симптомами, связанными с развитием анемии. Остальным же пациентам диагноз устанавливается случайно, при лабораторном тестировании анализов крови, сделанных по другим причинам. Реже диагноз устанавливается при лечении инфекции, геморрагического синдрома, тромбоза. Такие признаки, как потеря веса, немотивированная лихорадка, болевой синдром, также могут быть манифестацией МДС.
Диагностика МДС базируется, прежде всего, на лабораторных данных, которые включают:
- полный клинический анализ крови;
- цитологическое и гистологическое исследования костного мозга;
- цитогенетический анализ периферической крови или костного мозга для выявления хромосомных изменений.
Обязательные диагностические мероприятия при МДС
В обязательный перечень диагностических мероприятий входят:
- Каждому пациенту должно быть проведено морфологическое исследование аспирата, взятого из костного мозга. Это требуется, однако, не является необходимым у пожилых пациентов, у которых установление диагноза МДС не изменяет тактику лечения или тяжесть состояния не позволяет провести исследование. Только на основании морфологического исследования диагноз МДС поставить невозможно – минимальные диагностические критерии не всегда ясны. Трудности возникают, потому что множество реактивных нарушений связано с дисплазией кроветворения, а умеренные диспластические изменения часто отмечаются у здоровых людей с нормальной кровью.
- Каждому пациенту должна быть выполнена трепанобиопсия костного мозга. Гистология костного мозга служит дополнением к уже полученной морфологической информации, следовательно, биопсия должна быть выполнена во всех случаях подозрения на МДС.
- У всех пациентов должен быть выполнен цитогенетический анализ.
Хромосомные нарушения подтверждают присутствие патологического клона и являются определяющими при решении вопроса о наличии МДС или реактивных изменений.
Классификация МДС основывается на количестве и типе бластных клеток, а также наличии хромосомных изменений, при этом тип МДС у пациента по мере развития заболевания может изменяться в сторону прогрессирования, вплоть до развития острого миелобластного лейкоза у 10% пациентов. Это система классификации используется ВОЗ.
Возможно, самая полезная система клинической классификации для МДС – Международная Прогностическая Система (IPSS). Эта модель была разработана для оценки таких переменных категорий как возраст, тип бластных клеток, генетические изменения. На основании этих критериев было выявлено 4 группы риска – низкий, промежуточный 1, промежуточный 2 и высокого риска.
Рекомендации по лечению основываются именно на отношении пациента к какой-либо из групп риска. Так пациент с низким уровнем риска может жить много лет прежде, чем потребуется лечение МДС, в то время как человек с промежуточным или высоким риском обычно нуждается в немедленном начале лечения.
Всемирная организация здравоохранения (ВОЗ), основываясь на уровнях доказательности, издала предложения о новой классификации МДС.
- Рефрактерная анемия (РА)
- Рефрактерная цитопения с мультилинейной дисплазией (РЦМД)
- Миелодиспластический синдром с изолированной del (5q)
- Миелодиспластический синдром неклассифицируемый (МДС-Н)
- Рефрактерная анемия с кольцевидными сидеробластами (РАКС)
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС)
- Рефрактерная анемия с избытком бластов-1 (РАИБ-1)
- Рефрактерная анемия с избытком бластов-2 (РАИБ-2)
В настоящее время нет никакого иного способа радикального лечения МДС кроме пересадки костного мозга, хотя существует множество схем для контроля симптомов, осложнений и улучшения качества жизни.
Рекомендации NCCN предлагают, чтобы выбор лечения был основан на возрасте пациента, оценке возможности пациента выполнять нормальные ежедневные задачи и группе риска.
- Высокоинтенсивная терапия требует стационарного лечения и включает интенсивную полихимиотерапию и трансплантацию стволовых клеток.
- Лечение низкой интенсивности включает методы, не требующие длительного стационарного лечения, проводящиеся в амбулаторных условиях или в условиях дневного стационара, – низкодозная химиотерапия, иммунодепрессивная, заместительная терапии.
- Пациенты моложе 61-летнего возраста с минимальными признаками и находящиеся в группе промежуточного риска 2 или высокого риска (ожидаемое выживание 0.3-1.8 года) требуют высокоинтенсивной терапии.
- Пациенты низкой или промежуточной 1 категории (ожидаемое выживание 5-12 лет) лечатся терапией с низкой интенсивностью.
- Пациенты моложе 60-летнего возраста с хорошим статусом и ожидаемым выживанием между 0.4 и 5 годами обычно лечатся схемами низкой интенсивности, хотя могут рассматриваться как кандидаты для высокоинтенсивной терапии, включая трансплантацию.
- Для пациентов с ограниченным сроком жизни рекомендуются поддерживающая и симптоматическая терапии и/или методы лечения низкой интенсивности.
Лечение низкой интенсивности
Поддерживающая терапия является важной частью лечения, и учитывает, как правило, пожилой возраст пациентов, она включает симптоматическую терапию, направленную на поддержание уровня лейкоцитов, тромбоцитов, эритроцитов. Эта терапия призвана улучшить качество жизни и продлить её продолжительность.
- Трансфузия эритроцитарной массы необходима для купирования анемического синдрома. При необходимости неоднократных и массивных трансфузий возникает риск перегрузки железом, что требует использование хелатной терапии.
- Переливание тромбоцитов требуется для профилактики или купирования кровоточивости и, как правило, не ведёт к отдаленным осложнениям.
- Гемопоэтические ростовые факторы – белки, способствующие росту и развитию клеток крови, их использование позволяет сократить потребность в заместительных трансфузиях. Однако много пациентов с МДС не отвечают на ростовые факторы. Гранулоцитарный колониестимулирующий фактор (G-CSF) или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) могут увеличивать количество нейтрофилов, однако терапия только ими одними не рекомендуется. Рекомбинантный эритропоэтин (EPO, Procrit ® , Epogen ® ) способствует увеличению числа эритроцитов и уменьшает зависимость от гемотрансфузий приблизительно у 20% пациентов с МДС.
Комбинированная химиотерапия, используя G-CSF наряду с EPO, может быть более эффективной, чем использование одного только EPO, особенно у людей из низкой группы риска при пониженном фоновом уровне EPO в сыворотке.
Иммунодепрессивные препараты могут быть эффективны у пациентов с гипопластическим типом кроветворения. Некоторые из этих пациентов, особенно молодые с ранней стадией болезни и гипоплазией, отвечают на иммунодепрессивные методы лечения, которые противостоят иммунной атаке на костный мозг. Использование иммунодепрессивной терапии может позволить 50-60% пациентам с HLA DR2 типом ткани прекратить заместительную терапию.
Схемы иммунодепрессивных методов лечения включают антитимоцитарный глобулин (ATG) и циклоспорин. ATG обычно используется в качестве внутривенной инфузии один раз в день в течение 4 дней, в то время как циклоспорин обычно назначает перорально (приём таблеток) на длительное время, до развития тяжелых осложнений или прогрессирования МДС на фоне лечения. Наиболее частыми осложнениями терапии ATG можно считать сывороточную болезнь, купируемую назначение стероидных гормонов.
Производные талидомида – препарата, стимулирующего иммунную систему и его аналоги (Revlimid ® , lenalidomide), – успешно используются в лечении других гемобластозов (лимфомы, множественная миелома).
Lenalidomide особенно эффективен у пациентов с анемией из низкой или промежуточной 1 групп МДС с повреждением 5 хромосомы (синдром 5q минус).
Низкие дозы цитостатиков в монорежиме могут быть рекомендованы для людей с промежуточным или высоким риском, которые не являются кандидатами для высокодозной терапии в силу различных причин.
- Цитарабин – наиболее широко изученный препарат, хотя частота достижения полной ремиссии при его использовании ниже 20%.
- Децитабин (Dacogen ® ) – современный, весьма эффективный препарат, использование которого сопряжено с высоким риском осложнений.
Терапия МДС высокой интенсивности
Пациенты с промежуточным или высоким риском при МДС подлежат терапии режимами химиотерапии аналогично используемым для лечения острого миелобластного лейкоза ОМЛ. Однако это лечение рекомендуется относительно молодым людям (моложе 60 лет), с хорошим жизненным статусом и при отсутствии HLA-идентичного донора. Этот тип лечения лучше не применять у лиц старше 60 лет, а также при низком жизненном статусе или большом числе цитогенетических нарушений, так как сопряжен с тяжелыми осложнениями.
У некоторых пациентов поддерживающая терапия может обеспечить тот же результат, что и химиотерапия, но с более низким риском осложнений или токсичности. Некоторые пациенты добиваются большего успеха при проведении только симптоматической терапии осложнений МДС (анемии, инфекции, кровоточивости), не пытаясь излечить саму болезнь.
Как ранее упоминалось, трансплантация стволовых клеток является единственным видом лечения, который может привести к длительной ремиссии. Однако осложнения терапии могут превалировать над возможным эффектом. В прошлом пациентов старше 50 лет не рассматривали как кандидатов для такого лечения. Достижения последних пятнадцати лет позволили отодвинуть возрастную планку до 60 лет и старше. Однако приблизительно 75% пациентов с МДС на момент установки диагноза уже старше 60 лет, таким образом, обычная трансплантация может быть предложена только малой части пациентов.
Трансплантация рекомендуется для людей с промежуточным 1, промежуточными 2 и высоким риском моложе 60 лет и наличием идентичного донора, но не для пациентов с низкой группой риска. Хотя есть существенный шанс на получение ремиссии у пациентов из группы риска (60%), весьма высоки (более 40%) связанные с пересадкой смертельные случаи и частота рецидивирования в течение 5 лет. Возможно использование неродственных доноров, но в этой ситуации возраст пациента является важным фактором в успехе лечения.
Использование режимов пониженной интенсивности при трансплантации расширяет категории пациентов, которым можно провести это лечение, но долгосрочные результаты еще нуждаются в оценке. Пока создается впечатления о повышенной частоте рецидивов по сравнению со стандартной подготовкой к трансплантации.
У пациентов с МДС средняя продолжительность жизни зависит от категории риска и возраста. Есть значительные вариации течения болезни от пациента к пациенту, особенно в группе низкого риска.
Руководитель отделения гематологии
Медицинского центра Банка России,
кандидат медицинских наук
Колганов Александр Викторович
Миелодиспластические синдромы
Миелодиспластические синдромы (МДС) — группа заболеваний, которые характеризуются нарушениями кроветворения миелоидной линии. В результате этих нарушений возможность выработки зрелых клеток крови частично сохраняется, но наблюдается дефицит тех или иных их видов, а сами клетки при этом изменены и плохо функционируют.
У значительной части больных МДС через некоторый промежуток времени, обычно от нескольких месяцев до нескольких лет, развивается острый миелоидный лейкоз.
МДС в обиходе иногда называют «предлейкемией», ранее применялись также термины «малопроцентный лейкоз», «тлеющий лейкоз» или «дремлющий лейкоз». Это связано с содержанием бластных клеток в костном мозге: если их более 20% (согласно классификации Всемирной организации здравоохранения) или более 30% (согласно франко-американо-британской классификации FAB), то речь уже идет о миелоидном лейкозе, если же их уровень ниже порогового значения, то может быть диагностирован МДС.
Под термином «миелодиспластический синдром» в настоящее время подразумевается целая группа заболеваний, различающихся по частоте встречаемости, клиническим проявлениям, а также по вероятности и ожидаемым срокам трансформации в лейкоз. Специалисты используют две классификации МДС: франко-американо-британскую (FAB) и классификацию Всемирной организации здравоохранения (ВОЗ). Рассмотрим классификацию FAB:
Рефрактерная анемия (РА). Термин «рефрактерная» здесь означает, что анемия не поддается лечению препаратами железа и витаминами. В костном мозге менее 5% миелобластов, аномалии в основном касаются предшественников эритроцитов.
Рефрактерная анемия с кольцевыми сидеробластами (РАКС): миелобластов в костном мозге менее 5%, но не менее 15% предшественников эритроцитов представлены особыми аномальными клетками — так называемыми кольцевыми сидеробластами. Это клетки с кольцеобразными «отложениями» железа, которые не могут обеспечивать эффективный транспорт кислорода.
Рефрактерная анемия с избытком бластов (РАИБ): миелобластов в костном мозге 5–20%. В классификации ВОЗ дополнительно подразделяется на РАИБ-I (5–9% бластов) и РАИБ-II (10-19% бластов).
Рефрактерная анемия с избытком бластов на стадии трансформации (РАИБ-T): миелобластов 21–30% (по классификации ВОЗ это уже острый миелоидный лейкоз).
Хронический миеломоноцитарный лейкоз, ХММЛ (по классификации ВОЗ относится к миелодиспластическим-миелопролиферативным заболеваниям).
Частота встречаемости, факторы риска
Общая частота МДС составляет 3-5 случаев на 100 000 населения. Однако у детей и молодых взрослых это заболевание встречается во много раз реже: более 80% случаев МДС фиксируется после 60 лет, причем несколько чаще у мужчин, чем у женщин.
В большинстве случаев МДС возникает без какой-либо известной причины, но иногда его развитие может быть спровоцировано предшествующей химиотерапией или лучевой терапией по поводу какой-либо опухоли - например, лимфомы Ходжкина или неходжкинской лимфомы. В этих случаях говорят о вторичном МДС.
Частота МДС (как и острого миелоидного лейкоза) повышена у людей с определенными генетическими аномалиями, такими как синдром Дауна, анемия Фанкони, нейрофиброматоз и некоторые другие.
Изучается роль и других факторов в возникновении этого заболевания — например, воздействия некоторых вредных химических веществ. Но у детей и молодых взрослых эти факторы не играют существенной роли.
Признаки и симптомы
Симптомы и степень их выраженности могут различаться в зависимости от разновидности МДС и конкретного случая. Но большинство наблюдаемых проявлений возникает в результате цитопении, то есть дефицита нормальных клеток крови.
Анемия (недостаток эритроцитов, сниженный уровень гемоглобина) характерна для подавляющего большинства случаев МДС; она проявляется бледностью, утомляемостью, плохой переносимостью физических нагрузок; могут также возникнуть одышка, головокружения, боли в груди и т.п.
Примерно у половины больных встречается нейтропения (то есть пониженное содержание зрелых функциональных нейтрофилов) и поэтому снижена сопротивляемость инфекциям. Нередко наблюдается и тромбоцитопения, то есть недостаточное содержание тромбоцитов, что ведет к возникновению кровотечений, синяков, петехий (мелкоточечных подкожных кровоизлияний). Возможны и другие симптомы.
Впрочем, в некоторых случаях пациенты с МДС долгое время не замечают существенного ухудшения самочувствия, и тогда проблемы обнаруживаются только в ходе обычного медосмотра по отклонениям от нормы в клиническом анализе крови.
Диагностика
Как правило, поводом к медицинскому осмотру служат жалобы на симптомы, связанные с анемией, причем эта анемия не поддается обычному лечению препаратами железа и витаминами. В клиническом анализе крови снижено количество эритроцитов, может быть также снижено количество лейкоцитов (нейтрофилов) и/или тромбоцитов. Характерно, что при уменьшении числа эритроцитов их размеры и цветовой показатель крови могут быть увеличены. Полезен также подсчет числа ретикулоцитов — незрелых эритроцитов, так как он дает информацию об интенсивности образования новых красных клеток крови.
Для точной диагностики и определения конкретного варианта МДС необходимо детальное исследование образца костного мозга, взятого в ходе трепанобиопсии: анализируются характер расположения различных клеток («архитектоника» костного мозга), число бластных клеток, содержание кольцевых сидеробластов и других аномальных клеток, степень изменений во всех ростках кроветворения — то есть среди предшественников эритроцитов, гранулоцитов и тромбоцитов, изменения стромы — соединительной ткани костного мозга. Выявленные нарушения могут быть очень разнообразными.
Так как развитие МДС нередко связано с известными хромосомными аномалиями, определенную роль в диагностике и прогнозе играют цитогенетические исследования.
Лечение
Лечение МДС зависит от его конкретной формы. Так, если речь идет об относительно «доброкачественных» разновидностях МДС с небольшим числом бластных клеток, то больные из групп низкого риска могут длительное время сохранять нормальное качество жизни, просто время от времени получая заместительную терапию компонентами крови — эритроцитами и, возможно, тромбоцитами. При перегрузке железом после множественных переливаний необходима соответствующая терапия. Иногда для стимуляции кроветворения используют факторы роста. При инфекционных осложнениях требуется антибактериальная и противогрибковая терапия. В ряде случаев применяют и другие лекарственные средства.
Если же речь идет о формах болезни, связанных с более высоким риском, то вопрос о лечении таких пацентов достаточно сложен. Химиотерапия с использованием обычных цитостатиков (цитарабин и т.п.) малоэффективна и не приводит к долговременной ремиссии. Общепринятых стандартов химиотерапии при МДС практически не существует. Есть и новые лекарства; в частности, обнадеживающие результаты показало применение гипометилирующих препаратов, таких как «Дакоген» (децитабин) и «Вайдаза» (азацитидин). Иногда может применяться иммуносупрессивная терапия и другие методы.
Единственным радикальным методом, позволяющим в случае успеха рассчитывать на полное излечение больных с МДС, является аллогенная трансплантация костного мозга — особенно у молодых пациентов, которые лучше переносят эту процедуру и связанные с ней осложнения. Однако аллогенная трансплантация по поводу МДС, как и по поводу других заболеваний, связана с проблемой поиска совместимого донора и с опасностью жизнеугрожающих осложнений.
При трансформации МДС в острый миелоидный лейкоз проводится химиотерапия этого лейкоза. Однако вторичный лейкоз, развившийся из МДС, обычно плохо поддается терапии. В этой ситуации, как правило, также показано проведение аллогенной трансплантации костного мозга, особенно у молодых больных.
Прогноз
Развитие МДС происходит с разной скоростью в зависимости от конкретной разновидности болезни. Если при некоторых формах МДС пациенты могут, особенно при наличии поддерживающей терапии (переливания компонентов крови и т. д.), жить достаточно долго и полноценно, то при более «активных» и злокачественных разновидностях заболевания средняя продолжительность жизни составляет не более года. Особенно плохой прогноз при вторичном МДС. Пациенты могут погибнуть как от проявлений самого МДС, так и от развившегося на его основе острого миелоидного лейкоза.
При использовании аллогенной трансплантации костного мозга можно добиться нормализации кроветворения и стойкой ремиссии болезни у большинства молодых пациентов. Иными словами, в случае успеха трансплантация приводит к выздоровлению. Однако надо помнить о высокой вероятности жизнеугрожающих осложнений (таких как реакция «трансплантат против хозяина», инфекции и др.) и рецидивов после трансплантации.
ФАБ-классификация миелодиспластических синдромов (МДС)
ФАБ-классификация миелодиспластических синдромов (МДС)
Диагноз «рефрактерная анемия» (РА) базируется на том, что в костном мозге число бластных клеток не превышает 5 %, кольцевых сидеробластов — менее 15%, моноцитов крови—менее 1,0*10 9 /л. В крови имеются признаки дизэритропоэза, иногда в сочетании с чертами дисгранулоцитопоэза. Число ретикулоцитов нормально в процентных показателях и снижено в абсолютных. В части случаев анемия сочетается с нейтро- и/или тромбоцитопенией. Иногда у больных с этим вариантом миелодиспластического синдрома (МДС) может отсутствовать анемия, а выявляется нейтропения и/или тромбоцитопения.
Бластные клетки в крови отсутствуют. Костный мозг нормо или гиперклеточный, реже — гипоклеточный с выраженной эритроидной гиперплазией и/или дизэритропоэзом. Изредка наблюдается эритроидная гипоплазия.
FAB-классификация и критерии диагностики миелодиспластического синдрома (МДС)
| Варианты миелодиспластического синдрома (МДС) | Бласты в периферической крови | Бласты в миелограмме | Кольцевые сидеробласты в миелограмме | Моноциты в периферической крови |
| РА | < 1% | < 5% | < 15% | - |
| РАКС | < 1% | < 5% | > 15% | - |
| РАИБ | < 5% | 5-20% | - | - |
| РАИБ-Т | > 5% | 21-30% | - | - |
| ХММЛ | - | < 20% | - | >1•10 9 /л |
Рефрактерная анемия с кольцевыми сидеробластами (РАКС) характеризуется теми же морфологическими признаками, что и РА, но наличием в костном мозге более 15 % кольцевых сидеробластов среди эритроидных предшественников.
Рефрактерная анемия с избытком бластов (РАИБ) — вариант МДС, основным признаком которого является наличие 5—20 % бластных клеток в костном мозге и менее 5 % в крови. Костный мозг обычно гиперклеточный с двух- или трехростковой дисплазией. Всегда обнаруживаются признаки дифференцировки гранулоцитов до промиелоцитов и более зрелых клеток гранулоцитарного ряда. Могут присутствовать кольцевые сидеробласты.
Сопоставление ФАБ- и ВОЗ-классификаций миелодиспластических синдромов (МДС)
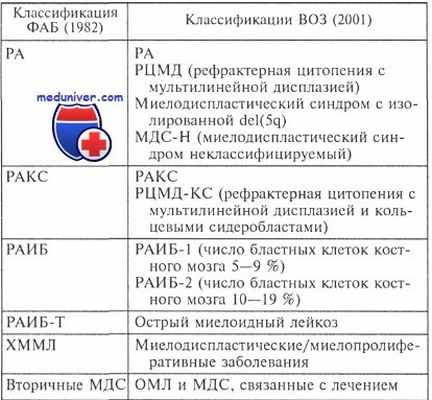
Рефрактерная анемия с избытком бластов в стадии трансформации в острый лейкоз (РАИБ-Т) диагностируется на основании наличия 20—30 % бластных клеток в костном мозге и/или более 5 % в крови. Остальные гематологические признаки такие же, как при РАИБ. Имеется предложение относить к РАИБ-Т все случаи РАИБ с палочками Ауэра в бластных клетках.
Хронический миеломоноцитарный лейкоз (ХММЛ) — вариант МДС, определяющим признаком которого является абсолютный моноцитоз в крови (более 1,0*10 9 /л). В костном мозге увеличено число промоноцитов и моноцитов при числе бластов не более 20 %. Количество бластов в крови — менее 5 %.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Миелодиспластический синдром (МДС)
Миелодиспластический синдром (МДС) представляет собой группу заболеваний, характеризующихся цитопенией в периферической крови, дисплазией гемопоэтических клеток-предшественников, гиперклеточностью или гипоклеточностью костного мозга и высоким риском развития острого миелолейкоза Острый миелолейкоз (ОМЛ) При остром миелолейкозе (ОМЛ) злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долго живущих клеток-предшественниц миелоидного ряда вызывает появление. Прочитайте дополнительные сведенияЕжегодное число людей в Соединенных Штатах с диагнозом миелодиспластический синдром (МДС) неизвестно. Согласно некоторым оценкам, это число составляет около 10 000, в то время как по другим оценкам оно намного выше. МДС чаще всего диагностируется у пациентов в возрасте 70 лет.
Патофизиология МДС
Миелодиспластические синдромы представляют собой группу заболеваний клональных гемопоэтических стволовых клеток, объединенных наличием различных мутаций гематопоэтических стволовых клеток, чаще всего в генах, участвующих в сплайсинге РНК. Миелодиспластические синдромы характеризуются неэффективным и диспластическим гемопоэзом и включают в себя следующее:
Рефрактерная анемия: анемия с ретикулоцитопенией; нормальный или гиперклеточный костный мозг с эритроидной гиперплазией и дизэритропоэзом; содержание бластных клеток составляет ≤ 5% ядросодержащих клеток костного мозга
Рефрактерная анемия с кольцевыми сидеробластами: то же, что и рефрактерная анемия с ретикулоцитопенией, за исключением того, что кольцевые сидеробласты составляют > 15% ядросодержащих клеток костного мозга
Рефрактерная цитопения с мультилинейной дисплазией: цитопения не определяется только эритроцитами;имеет место выраженная дисплазия предшественников лейкоцитов и мегакариоцитов
Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами с наличием кольцевых сидеробластов, которые составляют > 15% ядросодержащих клеток костного мозга
Рефракторная анемия с избытком бластов (РАИБ) (RAEB en.): цитопения ≥ 2 клеточных линий с морфологическими аномалиями гематопоэтических клеток; гиперцеллюлярный костный мозг с дизэритропоэзом и дисгранулопоэзом; разрушает от 5 до 9% (RAEB-I) или от 10 до 19% (RAEB-II) ядросодержащих клеток костного мозга.
Миелодиспластический синдром неклассифицированный: МДС, который не попадает ни в одну из определенных категорий
МДС с изолированной делецией 5q: обычно тяжелая анемия и тромбоцитоз с делецией длинного плеча пятой хромосомы.
Хронический миеломоноцитарный лейкоз (ХММЛ) и ювенильный миеломоноцитарный лейкоз (ЮММЛ): смешанные миелодиспластические/миелопролиферативные новообразования; абсолютный моноцитоз (> 1000/мкл [> 1/л]) крови; значительное увеличение количества предшественников моноцитов в костном мозге
Хронический нейтрофильный лейкоз: характеризуется нейтрофилией, гибридным геном BCR-ABL1 и отсутствием филадельфийской хромосомы.
Этиология миелодиспластического синдрома неизвестна. Риск повышается с возрастом из-за приобретенных соматических мутаций, которые могут способствовть клональной экспансии и доминированию определенных гемопоэтических стволовых клеток, и, возможно, посредством воздействия внешних токсинов, таких как бензин, ионизирующие излучение и химиотерапевтические препараты (особенно продолжительные или интенсивные курсы лечения, а также с использованием алкилирующих агентов, гидроксимочевины или ингибиторов топоизомеразы). Часто присутствуют хромосомные аномалии (например, делеции, дупликации, структурные аномалии).
Костный мозг может быть гиперклеточным или гипоклеточным Неэффективный гемопоэз приводит к анемии (встречается наиболее часто), нейтропении, тромбоцитопении, или к комбинации этих патологий, вплоть до аплазии костного мозга. У пациентов со значительной рефрактерной или хронической анемией в конечном итоге развивается перегрузка железом ввиду переливания крови и/или повышенной абсорбции железа с кишечника.
Нарушение клеточной продукции также сопровождается изменениями морфологии клеток в костном мозге и крови. Иногда развивается экстрамедуллярный гемопоэз, приводящий к гепатомегалии и спленомегалии. Во время МДС может развиваться миелофиброз Первичный Миелофиброз Первичный миелофиброз (ПМФ) – это хроническое миелопролиферативное новообразование, которое характеризуется фиброзом костного мозга, спленомегалией и анемией с наличием ядросодержащих и каплевидных. Прочитайте дополнительные сведения . Классификация основана на данных общего анализа крови и исследований костного мозга, а также учитывается кариотип и мутация. Клон МДС имеет тенденцию к трансформации в острый миелолейкоз Острый миелолейкоз (ОМЛ) При остром миелолейкозе (ОМЛ) злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долго живущих клеток-предшественниц миелоидного ряда вызывает появление. Прочитайте дополнительные сведенияСимптомы и признаки МДС
Симптомы миелодиспластического синдрома зависят от наиболее пораженной клеточной линии и могут включать бледность, слабость и утомляемость (анемия), лихорадку и инфекции (нейтропения), повышенную склонность к кровоизлияниям, петехиям и кровоточивости из слизистых оболочек (тромбоцитопения). Спленомегалия и гепатомегалия не редкость.
Миелодиспластические синдромы (МДС)
Миелодиспластические синдромы (МДС) – это группа злокачественных заболеваний, которые происходят из тканей костного мозга и влияют на рост клеток крови, что приводит к нарушению нормального функционирования организма. Примерно в каждом третьем случае МДС переходит в острый миелоидный лейкоз (ОМЛ) – заболевание, при котором клетки крови начинают бесконтрольно размножаться.
Первоначально миелодиспластические синдромы рассматривались как предлейкозные состояния и были классифицированы как отдельные нарушения только в 1976 году. В общей совокупности населения МДС встречается относительно редко, однако среди пожилых людей старше 60 лет заболеваемость составляет 20-50 случаев на каждые 100000 человек.
Что такое миелодиспластические синдромы?
При миелодиспластических синдромах стволовые клетки крови не развиваются должным образом и не превращаются в здоровые тромбоциты, эритроциты или лейкоциты. Поскольку данные клетки остаются незрелыми, они не могут нормально функционировать и погибают либо в костном мозге, либо вскоре после попадания в кровоток. Вследствие этого в организме пациента развивается нехватка здоровых клеток крови.
Каковы факторы риска развития миелодиспластических синдромов?
Существует несколько известных факторов риска развития миелодиспластических синдромов:
- Пожилой возраст: в большинстве случаев МДС диагностируется у пожилых людей в возрасте от 70 до 80 лет.
- Пол: МДС чаще встречается у мужчин, чем у женщин. Причина этого явления неизвестна.
- Предшествующая химиотерапия онкологического заболевания:лечение рака некоторыми химиотерапевтическими препаратами повышает риск развития МДС.
- Генетические синдромы: пациенты с некоторыми наследственными синдромами имеют более высокий риск развития МДС. С развитием МДС связаны следующие генетические заболевания: анемия Фанкони, синдром Швахмана-Даймонда, анемия Даймонда-Блекфена, семейная тромбоцитопатия с предрасположенностью к развитию миелоидных злокачественных опухолей, тяжелая врожденная нейтропения и врожденный дискератоз.
- Наличие МДС в семейном анамнезе: определенная генетическая мутация, присутствующая в семейном анамнезе, может повышать риск возникновения МДС.
- Курение: канцерогенные вещества, содержащиеся в табачном дыме, всасываются в кровь при ее прохождении через легкие и распространяются по всему организму.
- Воздействие факторов окружающей среды: длительный контакт с химическими веществами, которые используются в резиновой и нефтяной промышленности (бензол и др.), может повышать риск развития МДС. Кроме того, воздействие высоких доз радиации (как, например, при аварии на ядерном реакторе) также повышает риск развития заболевания.
Каковы симптомы миелодиспластических синдромов?
Миелодиспластические синдромы приводят к снижению уровней показателей крови, поэтому ранние симптомы болезни связаны с дефицитом одного или нескольких типов клеток крови.
Симптомы миелодиспластических синдромов включают:
- Анемия (пониженное содержание эритроцитов) может вызвать следующие симптомы:
- Усталость;
- Головокружение;
- Слабость;
- Бледность кожного покрова;
- Одышка;
- Головные боли.
- Лейкопения (пониженное содержание лейкоцитов) может вызвать следующие симптомы:
- Частые или тяжелые инфекционные заболевания.
- Тромбоцитопения (пониженное содержание тромбоцитов) может вызвать следующие симптомы:
- Кровоточивость и/или появление синяков при незначительном воздействии;
- Частые или сильные носовые кровотечения;
- Кровоточивость десен.
Дополнительные симптомы:
- Повышенная температура тела;
- Боли в костях;
- Потеря веса;
- Отсутствие аппетита.
Типы миелодиспластических синдромов
Существует несколько типов МДС, различающихся по степени поражения клеток крови и костного мозга. Согласно системе Всемирной организации здравоохранения (ВОЗ), классификация МДС осуществляется на основе внешнего вида клеток под микроскопом и количества аномальных клеток.
Система классификации ВОЗ выделяет шесть основных типов миелодиспластических синдромов:
- МДС с мультилинейной дисплазией: наблюдается поражение двух или более типов клеток крови.
- МДС с однолинейной дисплазией: поражены преимущественно эритроциты.
- МДС с кольцевыми сидеробластами: эритроциты не могут перерабатывать железо, необходимое для выработки гемоглобина. Вместо этого молекулы железа образуют кольцо вокруг ядер развивающихся эритроцитов.
- МДС с избытком бластов: наблюдается поражение одного или более типов клеток крови с избыточным содержанием бластных клеток в крови и в костном мозге.
- МДС с делецией 5q: наблюдается поражение эритроцитов, вызывающее анемию. В костном мозге и в крови присутствует небольшое количество бластных клеток.
- МДС неклассифицируемый.
МДС также классифицируется на основе клинической картины, относящейся к первопричине болезни. Если причина не установлена, то МДС называется первичным (наиболее распространенный тип). Когда причина заболевания известна – это вторичный МДС. Диагностика типа МДС играет важную роль в выборе оптимального курса лечения.
Что такое МДС?
При миелодиспластических синдромах стволовые клетки крови не развиваются должным образом и не превращаются в здоровые тромбоциты, эритроциты или лейкоциты. Поскольку данные клетки остаются незрелыми, они не могут нормально функционировать и погибают либо в костном мозге, либо вскоре после попадания в кровоток. Вследствие этого в организме пациента развивается нехватка здоровых клеток крови.
Каковы факторы риска развития МДС?
Существует несколько известных факторов риска развития миелодиспластических синдромов.
- Пожилой возраст: в большинстве случаев МДС диагностируется у пожилых людей в возрасте от 70 до 80 лет.
- Пол: МДС чаще встречается у мужчин, чем у женщин. Причина этого явления неизвестна.
- Предшествующая химиотерапия онкологического заболевания: лечение рака некоторыми химиотерапевтическими препаратами повышает риск развития МДС.
- Генетические синдромы: пациенты с некоторыми наследственными синдромами имеют более высокий риск развития МДС. С развитием МДС связаны следующие генетические заболевания: анемия Фанкони, синдром Швахмана-Даймонда, анемия Даймонда-Блекфена, семейная тромбоцитопатия с предрасположенностью к развитию миелоидных злокачественных опухолей, тяжелая врожденная нейтропения и врожденный дискератоз.
- Наличие МДС в семейном анамнезе: определенная генетическая мутация, присутствующая в семейном анамнезе, может повышать риск возникновения МДС.
- Курение: канцерогенные вещества, содержащиеся в табачном дыме, всасываются в кровь при ее прохождении через легкие и распространяются по всему организму.
- Воздействие факторов окружающей среды: длительный контакт с химическими веществами, которые используются в резиновой и нефтяной промышленности (бензол и др.), может повышать риск развития МДС. Кроме того, воздействие высоких доз радиации (как, например, при аварии на ядерном реакторе) также повышает риск развития заболевания.
Каковы симптомы МДС?
Миелодиспластические синдромы приводят к снижению уровней показателей крови, поэтому ранние симптомы болезни связаны с дефицитом одного или нескольких типов клеток крови.
- Анемия (пониженное содержание эритроцитов) может вызвать следующие симптомы:
- Усталость;
- Головокружение;
- Слабость;
- Бледность кожного покрова;
- Одышка;
- Головные боли.
- Частые или тяжелые инфекционные заболевания.
- Кровоточивость и/или появление синяков при незначительном воздействии;
- Частые или сильные носовые кровотечения;
- Кровоточивость десен.
- Повышенная температура тела;
- Боли в костях;
- Потеря веса;
- Отсутствие аппетита.
Типы МДС
Существует несколько типов МДС, различающихся по степени поражения клеток крови и костного мозга. Согласно системе Всемирной организации здравоохранения (ВОЗ), классификация МДС осуществляется на основе внешнего вида клеток под микроскопом и количества аномальных клеток.
Система классификации ВОЗ выделяет шесть основных типов миелодиспластических синдромов:
- МДС с мультилинейной дисплазией: наблюдается поражение двух или более типов клеток крови.
- МДС с однолинейной дисплазией: поражены преимущественно эритроциты.
- МДС с кольцевыми сидеробластами: эритроциты не могут перерабатывать железо, необходимое для выработки гемоглобина. Вместо этого молекулы железа образуют кольцо вокруг ядер развивающихся эритроцитов.
- МДС с избытком бластов: наблюдается поражение одного или более типов клеток крови с избыточным содержанием бластных клеток в крови и в костном мозге.
- МДС с делецией 5q: наблюдается поражение эритроцитов, вызывающее анемию. В костном мозге и в крови присутствует небольшое количество бластных клеток.
- МДС неклассифицируемый.
МДС также классифицируется на основе клинической картины, относящейся к первопричине болезни. Если причина не установлена, то МДС называется первичным (наиболее распространенный тип). Когда причина заболевания известна – это вторичный МДС. Диагностика типа МДС играет важную роль в выборе оптимального курса лечения.
Читайте также:
