Фолликулярный цикл. Эстроген-зависимые заболевания
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему.
В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон, известный также как ГнВГ, и рилизинг-гормон лютеинизирующего гормона (РГЛГ).
Эстрогены и прогестерон , связанные с белками плазмы, циркулируют в кровяном русле. Только свободные эстрогены и прогестерон проявляют биологическую активность. Они стимулируют органы-мишени репродуктивной системы (например, матку, влагалище) и молочные железы. Эти гормоны обычно ингибируют (так называют негативную обратную связь) секрецию гонадотропинов, но в определенных случаях (например, примерно во время овуляции), могут стимулировать ее.
Система ЦНС-гипоталамус-гипофиз-гонады и органы-мишени
Яичниковые гормоны имеют прямое и опосредованное влияние на другие ткани (например, кости, кожу, мышцы).
ФСГ = фолликуло-стимулирующий гормон; ГнВГ = гонадотропин-высвобождающий гормон; ЛГ = лютеинизирующий гормон.
Половая зрелость
Половое созревание – это период последовательного приобретения ребенком физических характеристик взрослого человека, которые определяют состояние зрелости и способность к деторождению. Уровень ЛГ и ФСГ достаточно высок при рождении, затем в течение нескольких месяцев он падает и остается низким вплоть до периода полового созревания. До полового созревания в репродуктивных органах-мишенях происходят незначительные изменения.
Возраст наступления пубертатного периода
Возраст начала пубертатного периода и скорость развития различных его этапов зависят от различных факторов. За последние 150 лет возраст начала полового созревания уменьшился, прежде всего из-за улучшения состояния здоровья и качества пищи, но эта тенденция стабилизировалась. В США средний возраст начала полового созревания составляет 12,5 лет, однако этот показатель варьирует в зависимости от этнической принадлежности ( 1 Справочные материалы по пубертатному периоду Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему. В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон. Прочитайте дополнительные сведения ).
Половая зрелость у девочек с повышенной массой тела наступает раньше среднего, а у девочек со значительным недобором массы тела и при недостаточном питании –позже среднего ( 2 Справочные материалы по пубертатному периоду Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему. В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон. Прочитайте дополнительные сведения ). Согласно этим наблюдениям, для полового созревания необходима критическая масса тела или количество жира.
Множество других факторов влияют на момент начала пубертатного периода и на то, как быстро он развивается. К примеру, существуют некоторые данные, свидетельствующие, что ограничение внутриутробного роста, особенно, с последующим перекармливанием, могут способствовать более раннему началу пубертатного периода и более быстрому его развитию ( 3 Справочные материалы по пубертатному периоду Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему. В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон. Прочитайте дополнительные сведения ). Например, некоторые данные свидетельствуют о том, что у детей, рожденных с низкой для данного гестационного возраста массой, наблюдается более быстрое прогрессирование полового созревания ( 4 Справочные материалы по пубертатному периоду Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему. В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон. Прочитайте дополнительные сведения ).
Физические изменения при половом созревании
В течение подросткового периода последовательно происходят физические изменения (см. рисунок Пубертатный период— когда развиваются женские половые признаки Пубертатный период - период развития женских половых признаков ).
Менархе (первые месячные) наступает примерно через 2-3 года после начала развития молочных желез. Менструальные циклы обычно нерегулярны после менархе, и может пройти до 5 лет, пока они становятся регулярными. Ускорение роста замедляется после начала менархе. конституционные особенности телосложения изменяются, расширяется область таза и бедер. Увеличивается количество подкожного жира и происходит его накопление на бедрах.
Механизмы, инициирующие половое созревание
Механизмы, инициирующие половое созревание, неясны.
Основными факторами, которые влияют на высвобождение ГнВГ есть нейротрансмиттеры и пептиды (например, гамма-аминомасляная кислота [ГАМК], белая фракция протеина). В детстве эти факторы могут тормозить высвобождение гонадотропин-высвобождающего гормона, а затем инициировать его высвобождение, что вызывает преждевременное половое созревание. В раннем пубертате выброс гипотапамического гонадотропин-высвобождающего гормона становится менее чувствительным к торможению эстрогенами и прогестероном . В результате увеличивается выброс гонадотропин-высвобождающего гормона, который стимулирует секрецию ЛГ и ФСГ, которые, в свою очередь, стимулируют выработку половых гормонов, прежде всего эстрогенов . Эстроген стимулирует развитие вторичных половых признаков.
Рост лобковых и подмышечных волос стимулируется надпочечниковыми андрогенами дегидроэпиандростеронами (ДЭА) и сульфатами ДЭА; производство этих андрогенов увеличивается за несколько лет до полового созревания в период, называемый адренархе.
Пубертатный период - период развития женских половых признаков
Показатели отражают нормальный диапазон значений.
Схематическое изображение стадий I-V созревания молочных желез по Таннеру
Из Marshall WA, Tanner JM: Variations in patterns of pubertal changes in girls. Archives of Disease in Childhood44:291–303, 1969; used with permission.
Схематическое изображение стадий I-V созревания молочных желез по Таннеру
Из Marshall WA, Tanner JM: Variations in patterns of pubertal changes in girls. Archives of Disease in Childhood44:291–303, 1969; used with permission.
Справочные материалы по пубертатному периоду
1. Anderson SE, Must A: Interpreting the continued decline in the average age at menarche: results from two nationally representative surveys of U.S. girls studied 10 years apart. J Pediatr 147 (6):753–60 2005.doi: 10.1016/j.jpeds.2005.07.016
3. Darendeliler F: IUGR: Genetic influences, metabolic problems, environmental associations/triggers, current and future management. Best Pract Res Clin Endocrinol Metab 33 (3):101260, 2019. doi: 10.1016/j.beem.2019.01.001 Epub 2019 Jan 22.
4. Veening MA, van Weissenbruch MM, Roord JJ, de Delmemarre-van Waal HA: Pubertal development in children born small for gestational age. J Pediatr Endocrinol Metab 17 (11):1497–505, 2004. doi: 10.1515/jpem.2004.17.11.1497
5. Sørensen S, Brix N, Ernst A, et al: Maternal age at menarche and pubertal development in sons and daughters: A Nationwide Cohort Study. Hum Reprod 33 (11):2043–2050, 2018. doi: 10.1093/humrep/dey287
6. Eckert-Lind C, Busch AS, Petersen JH, et al: Worldwide secular trends in age at pubertal onset assessed by breast development among girls: A systematic review and meta-analysis. J AMA Pediatr 174 (4):e195881, 2020. doi:10.1001/jamapediatrics.2019.5881
7. Marshall WA, Tanner JM: Variations in patterns of pubertal changes in girls. Arch Dis Child 44:291–303, 1969.
Развитие фолликулов в яичнике
Плод женского пола имеет конечное число предшественников яиц (половых клеток). Герминогенные клетки сперва представляют собой примордиальные оогонии, которые мигрируют из эндодермы желточного мешка в экстраэмбриональной области в недифференцированный генитальный гребень и становятся оогониями. Оогонии дифференцируются в первичные ооциты и заметно пролиферируют за счет митоза (однократное деление на две идентичные диплоидные клетки), в результате чего к 5-му месяцу беременности появляется около 7 млн ооцитов. В течение 3-го месяца беременности у некоторых оогоний начинается мейоз и наступает остановка в профазе мейоза I до полового созревания. Мейоз протекает в две фазы; это приводит к делению на четыре гаплоидные клетки. К 7-му месяцу беременности вокруг всех жизнеспособных герминогенных клеток развивается слой гранулезных клеток, формируя примордиальный фолликул. После 4 месяца гестации оогонии (а позже ооциты) начинают спонтанно погибать, в процессе гибнет около 99,9% оогоний.
В период полового созревания ооцит завершает мейоз I с образованием одного вторичного ооцита и одного полярного тельца; эти клетки задерживаются в метафазе мейоза II.
ФСГ индуцирует рост фолликулов в яичниках. В течение каждого менструального цикла отмечается ускоренный рост 3–30 фолликулов. Обычно в каждом цикле достигает овуляции только один фолликул. Такой доминантный фолликул высвобождает ооцит во время овуляции и вызывает артезию других фолликулов. В результате двух мейотических делений образуется одна яйцеклетка – одна непосредственно перед овуляцией, а вторая – при проникновении сперматозоида. При каждом мейотическом делении выделяются полярные тельца, содержащие избыток генетического материала. С увеличением возраста матери ооциты, длительно существующие в профазе мейоза, могут отвечать за генетические аномалии у плода ( 1 Справочные материалы по развитию фолликула в яичнике Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему. В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон. Прочитайте дополнительные сведения ).
Справочные материалы по развитию фолликула в яичнике
1. Jones KT: Meiosis in oocytes: Predisposition to aneuploidy and its increased incidence with age. Hum Reprod Update 14:143–158, 2008.
Менструальный цикл
Менструация – это периодические кровянистые выделения с отторженным эндометрием (общепринятое название – месячные или менструальное кровотечение) из матки через влагалище. Это вызвано быстрым снижением выработки яичниками прогестерона и эстрогена , что имеет место во время каждого цикла при отсутствии беременности. Менструация происходит в течение всей репродуктивной жизни женщины.
Нормальная продолжительность менструаций составляет от 4,5 до 8 дней ( 1 Менструальный цикл. Ссылки Гормональная взаимосвязь между гипоталамусом, передней долей гипофиза и яичниками регулирует женскую репродуктивную систему. В гипоталамусе секретируется короткий пептид, гонадотропин-рилизинг-гормон. Прочитайте дополнительные сведения ). Кровопотеря во время менструации составляет в среднем 30 мл (нормальный диапазон – 5–80 мл) и обычно обильная кровопотеря отмечается на 2-й день. Поскольку пациентки не измеряют объем менструальной крови, чрезмерно тяжелые или легкие менструации определяются на основании их ощущений и количества использованных прокладок или тампонов; пропитанные прокладка или тампон поглощают от 5 до 15 мл крови. Обычная менструальная кровь не сворачивается (если кровотечение не очень сильное), вероятно, потому что фибринолизин и другие факторы ингибируют свертывание.
Средняя продолжительность менструального цикла —;28 дней (нормальный диапазон составляет 24–38 дней). Самые длительные периоды между менструациями наблюдаются сразу после наступления менархе и перед менопаузой, когда овуляция происходит нерегулярно. У человека менструация считается регулярной, когда продолжительность самого короткого и самого длинного циклов варьирует от ± 2–20 дней. Продолжительность менструального цикла рассчитывается как число дней от первого дня менструации в одном цикле до первого дня в следующем цикле.
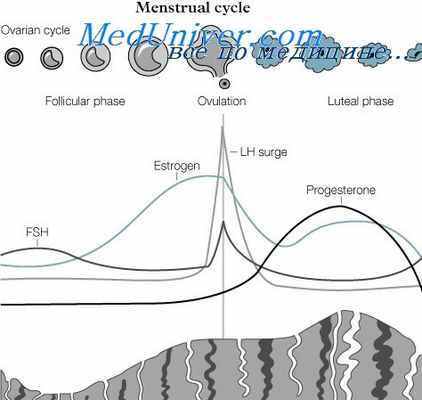
Менструальный цикл можно разделить на фазы. Яичник проходит следующие фазы:
Фолликулярный цикл. Эстроген-зависимые заболевания
Фолликулярный цикл. Эстроген-зависимые заболевания
Фолликулярный цикл. Фолликулы, формирующиеся у эмбриона, состоят из яйца, окруженного двумя или тремя уровнями ячеистых клеток. Эти фолликулы называют зачаточными фолликулами. Каждый день некоторые из этих зачаточных фолликул созревают и начинают формировать теку, которая становится васкуляризированной. Это преантральная стадия, дальнейшее созревание контролируют фолликулостимулирующий гормон (FSH) и лютеинизирующий гормон. Если уровни FSH ниже критической концентрации, преантральные фолликулы погибают. Этот цикл повторяется в течение всей жизни женщины.
В ранней фолликулярной фазе уровни FSH выше критической концентрации), и преантральные фолликулы созревают и переходят в антральную стадию. Но только одна фолликула достигает зрелости и готова овулировать — доминирующая, или граафова, фолликула (фаза выбора). Она является источником 90% яичниковых эстрогенных гормонов. Остальные антральные фолликулы погибают.
У женщин многие заболевания связаны с эстрогенами, но лишь немногие вызваны непосредственными изменениями их синтеза. Такие заболевания, как менструальные нарушения, неоплазия половых органов, рак молочной железы и предрасположенность к аутоиммунным заболеваниям, подвержены влиянию эстрогенов, но не вызываются их избытком или недостатком. Чрезмерная секреция эстрогенов у женщин, подобно избытку тестостерона у мужчин, не сопровождается четкими признаками или симптомами.
Терапию эстрогенами применяют для:
• компенсации уровня гормонов при недостаточности;
• подавления эндогенной выработки гормонов (противозачаточные средства);
• лечения других гормон-зависимых состояний. Эстрогены и агонисты эстрогена. Ежедневный синтез эстрогена (в основном эстрадиола и эстрона) в предменопаузе у женщин меняется в течение менструального цикла от 20 до 100 мг/сут. Эстрогены легко конъюгируются сульфатировани-ем в печени и впоследствии выводятся с желчью и мочой. Печеночный метаболизм ограничивает оральную терапию эстрогеном, поэтому необходимы ежедневные введения синтетического эстрадиола в дозе 1-2 мг для адекватного замещения недостатка гормонов. Некоторые препараты эстрогенов менее восприимчивы к печеночному метаболизму:
• конъюгированные эстрогены (в основном сульфат эстрона), выделенные из мочи беременных кобыл либо синтетические эстрогены, впоследствии гидролизируются и преобразуются в более активные эстрогены в периферических тканях;
• трансдермальные пластыри с эстрогенами поставляют эстрадиол в большой круг кровообращения и увеличивают экспозицию эстрогенов в периферических тканях перед печеночным метаболизмом;
• этинилэстрадиол используют во многих оральных противозачаточных таблетках. Он содержит замену С-17 эстрадиола, уменьшаемую метаболизмом. Препарат дает мощный эстрогенный эффект в дозах 20-50 мг/сут.
Один из самых старых синтетических эстрогенов диэтилстильбэстрол является нестероидным синтетическим эстрогеном. Его использование у беременных в 1970-х гг. для предотвращения невынашивания плода привело к репродуктивным отклонениям у дочерей этих женщин и признанию долгосрочного влияния половых стероидов на плод, поэтому во время беременности противопоказано применение любого эстрогена или антиэстрогена.
Неблагоприятными эффектами эстрогенов могут быть менструальные кровотечения, задержка жидкости, тошнота, увеличение синтеза печенью гормон-связанных глобулинов, повышение уровней триглицеридов, увеличение свертываемости крови и риск возникновения рака молочной железы и матки. Повышенный риск рака матки устраняют одновременной терапией прогестероном.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гипоэстрогенные состояния у женщин репродуктивного, пре- и менопаузального возрастов
Патогенетической терапией лечения ранневременных симптомов гипоэстрогении является заместительная гормональная терапия (ЗГТ). В случае противопоказаний к ЗГТ или отказа от нее, достаточно эффективны альтернативные фитопрепараты, которые в меньшей степени,
К гипоэстрогенным состояниям относятся изменения в организме женщин на фоне снижения или прекращения выработки эстрогенов яичниками.
В первую очередь возникает комплекс вегетативно-сосудистых, нейроэндокринных и нейропсихических симптомов (ранневременные расстройства). Затем появляются урогенитальные и сексуальные нарушения, изменения внешности (средневременные расстройства). В последнюю очередь наступают поздневременные обменные нарушения: остеопороз, ишемическая болезнь сердца, болезнь Альцгеймера [1].
Эти многочисленные симптомы гипоэстрогении связаны с наличием огромного количества рецепторов к эстрогенам в различных органах и системах женщины: половых органах, гипоталамусе и гипофизе, сердечно-сосудистой системе, уретре и мочевом пузыре, коже и волосах, толстом кишечнике, печени [2].
Вышеназванные изменения могут возникать не только естественно в климактерическом периоде, но и при воздействии на организм женщины других факторов: после хирургических операций (удаление или резекция яичников по поводу кист и апоплексии, ампутации матки); при истощении фолликулярного аппарата (синдром истощения яичников) [3, 4]; при извращенной реакции эстрогеновых рецепторов (синдром резистентных яичников); на фоне применения некоторых лекарственных препаратов, в частности агонистов рилизинг-гормонов (АГ-РГ); при лечении эстроген-зависимых заболеваний женской половой системы, а также в длинных протоколах стимуляции суперовуляции программы экстракорпорального оплодотворения (ЭКО) при лечении бесплодия (требует add-back терапии для снятия нейровегетативных симптомов) [5, 6].
Гипоэстрогенные состояния, связанные с незначительным снижением продукции эстрогенов (при щадящей резекции яичников, каутеризации не поликистозных, а мультифолликулярных яичников и др.), имеют свои особые клинические проявления, чаще всего приводящие к нарушению репродуктивной функции (ановуляция, недостаточность лютеиновой фазы; сниженный овариальный резерв, приводящий к бедному ответу яичников в программах ЭКО) [7]. По нашим данным в программах ЭКО такие пациентки встречаются в 22,3% случаев.
Гипоэстрогения в климактерическом периоде может служить моделью для изучения классических клинических проявлений этого состояния, т. к. климактерий это естественный достаточно длительный биологический процесс перехода от периода репродукции к старости, в основе которого лежит постепенное угасание функции яичников и снижение продукции эстрогенов. Наиболее ярко проявляют себя ранневременные расстройства [1]. Комплекс симптомов ранневременных расстройств при определенной степени выраженности принято называть климактерическим синдромом (КС). По нашим данным, полученным совместно с И. В. Бесман [8], КС в перименопаузе встречается в 57,6% случаев, при этом в 65% — в осложненной форме (т. е. на фоне экстрагенитальной патологии). Осложненная форма КС обуславливает максимальную выраженность симптомов КС. В настоящее время ранневременные симптомы гипоэстрогении связывают с дезорганизацией функции лимбико- ретикулярного комплекса. С нарушением функции гипоталамуса связывают такие проявления ранневременных расстройств, как приливы, гипергидроз, сердцебиение, гипертензия. С нарушением функции лимбической системы связывают депрессию, нарушение сна, головные боли, снижение памяти. Все ранневременные нарушения снижают качество жизни женщины, но особенно это касается приливов и расстройств сна. Приливы могут беспокоить женщину 5–10–20 и более раз в сутки. Расстройства сна: удлинение периода засыпания, частое пробуждение ночью, поверхностный сон — не дают ощущения полноценного отдыха. Несомненно, все эти нарушения требуют дифференцированного подхода к лечению в зависимости от причины гипоэстрогении и возраста, в котором они наступают.
Безальтернативной патогенетической терапией ранневременных симптомов гипоэстрогении считается сегодня заместительная гормональная терапия (ЗГТ) [1, 6]. У женщин репродуктивного возраста после оперативного удаления или резекции яичников, с синдромами резистентных и истощенных яичников лечение можно начинать с комбинированных эстроген-гестагенных препаратов [1]. Это могут быть современные трехфазные препараты, например Клайра. У женщин после гистерэктомии терапия проводится с использованием натуральных эстрогенов с последующим добавлением гестагенов [6]. При плохой переносимости пероральных препаратов можно рекомендовать их в виде геля или пластыря для чрезкожного введения (Эстрожель, Дивигель, Климара) с периодическим назначением гестагенов вагинально (например, Утрожестан). Длительность ЗГТ определяется состоянием и самочувствием пациентки.
В климактерическом периоде при лечении ранневременных расстройств важно придерживаться позиции Международного общества по менопаузе (2007 г.):
- ЗГТ назначается по четким показаниям, прежде всего, для купирования менопаузальных симптомов;
- потребность в продолжении лечения и наличие показаний для ЗГТ должны пересматриваться регулярно, особенно при длительном использовании.
Кроме того, должны учитываться современные принципы назначения ЗГТ:
- используются только натуральные эстрогены (17β-эстадиол, эстрадиола валерат);
- используются минимально эффективные дозы гормонов;
- препарат подбирают индивидуально;
- перед терапией проводится специальное обследование, во время терапии — ежедневный контроль;
- начало ЗГТ не должно быть позднее 5 лет от начала менопаузы;
- не следует назначать ЗГТ при наличии противопоказаний.
Противопоказания к ЗГТ:
- кожные поражения;
- эстроген-зависимые опухоли половых органов;
- подозрение на наличие или наличие рака молочной железы;
- венозная тромбоэмболия;
- тяжелые заболевания печени и почек;
- кровотечение из половых путей неясного генеза.
- В перименопаузе — циклические препараты, имитирующие нормальный менструальный цикл (Климонорм, Цикло-Прогинова, Эстрожель, Дивигель + Утрожестан, Дюфастон, Климен, Фемостон 1/10, 2/10 и т. д.).
- В постменопаузе — непрерывная терапия, не дающая кровотечений: Анжелик (1 мг 17β-эстадиол + 2 мг дросперинон), Мирена + Климара, Климадиен (эстрадиол валерат + диеногест), Эстрожель + Утрожестан, Ливиал (тиболон), Фемостон 1/5.
- При отсутствии матки — монотерапия эстрогенами (Климара, Прогинова, Эстрожель, Дивигель).
- При ожирении, метаболическом синдроме, повышенном риске сосудистых эпизодов фазовая терапия трансдермальными и вагинальными формами (Эстрожель, Дивигель, Утрожестан).
- При отказе пациентки от ЗГТ, наличии противопоказаний решать вопрос о применении фитотерапии в виде гомеопатических лекарственных средств и БАД, в состав которых входит эстрогеноподобные вещества. Эти препараты практически не имеют противопоказаний и содержат экстракт цимицифуги, сою, витамины, минералы и т. д. Среди них можно назвать Ременс, Климаксан, Климактоплан, Климадинон, ЦИ-КЛИМ, Менопейс Плюс, Эстровэл, Менорил, Соифем и др.
Интересен по своему составу препарат Менопейс Плюс, в который входят капсулы с витаминами и минералами (21 компонент), а также растительные таблетки, содержащие изофлавоны сои, лигнаны семян льна, шалфей и зеленый чай. Составляющие растительной таблетки превращаются в фитоэстрогены в кишечнике, благоприятно действуют на нервную систему, уменьшают приливы, являются источниками антиоксидантов. Цикл приема этого препарата по одной капсуле и одной растительной таблетке в день составляет 28 дней.
Мы, совместно с И. В. Бесман [9], имеем опыт применения альтернативных ЗГТ растительных средств, при лечении осложненной формы КС в случаях, когда ЗГТ было противопоказано. Наши исследования показали, что качество жизни этих пациенток, определяемое по специальной шкале, несколько хуже, чем у тех, кто принимал ЗГТ; но значительно лучше, чем у тех, кто не принимал вообще никаких препаратов. Кроме того, эти средства дают хороший эффект при купировании вазомоторных симптомов в длинных протоколах с АГ-РГ программ ЭКО.
Все вышесказанное еще раз подтверждает мнение специалистов о том, что дифференцированный подход к лечению ранневременных нарушений при гипоэстрогенных состояниях с применением ЗГТ различных режимов или альтернативных растительных средств дает хороший эффект и значительно улучшает качество жизни женщин.
Литература
- Медицина климактерия / Под ред. В. П. Сметник. Ярославль: ООО «Издательство Литера», 2006. 848 с.
- Кулаков В. И., Прилепская В. Н. Практическая гинекология. Клинические лекции. 3-е изд., доп. М.: МЕДПресс-информ, 2006. 720 с.
- Доброхотова Ю. Э. Гистерэктомия в репродуктивном возрасте (системные изменения в организме женщины и методы их коррекции). Автореф. дис. д-ра мед. наук. М., 2000. 36 с.
- Зайдиева Я. З. Заместительная гормонотерапия. Фармакология и клиническое применение. М.: 2001. 50 с.
- Бесплодный брак. Современные подходы к диагностике и лечению: руководство / Под ред. Г. Т. Сухих, Т. А. Назаренко. 2-е изд., испр. и доп. М.: ГЕОТАР-Медиа, 2010. 784.: ил.
- Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / Под ред. В. И. Кулакова, В. Н. Прилепской, В. Е. Радзинского. М.: ГЭОТАР-Медиа, 2006. 1056 с.
- Назаренко Т. А. Стимуляция функции яичников. 3-е изд., доп. М.: МЕДПресс-информ, 2011. 272 с.: ил.
- Бесман И. В., Рудакова Е. Б. Врачебная тактика при осложненной форме климактерического синдрома у женщин в перименопаузе // Омский научный вестник. 2010. № 1 (94). С. 10–13.
- Рудакова Е. Б., Бесман И. В. Качество жизни как критерий эффективности лечения климактерического синдрома // Омский научный вестник. 2008. № 1 (65). С. 81–84.
Е. Б. Рудакова 1 , доктор медицинских наук, профессор
Т. В. Стрижова, кандидат медицинских наук
Л. Ю. Замаховская
ГБУЗ МО МОПЦ, Балашиха
Abstract. Pathogenetic therapy treatment of early symptoms of hypoestrogenism consists of hormone replacement therapy (HRT). In the case of contraindications to the HRT medication or refusal of a woman, alternative herbal medication is effective less than HRT, but however improves the quality of life.
Рецепторы к эстрогенам и прогестерону (иммуногистохимическое исследование)» в парафиновом блоке
Гистологическое исследование биоптатов слизистой тела матки, биоптатов молочной железы (с окрашиванием гематоксилином-эозином). Иммуногистохимическое исследование экспрессии рецепторов эстрогена и прогестерона с применением моноклональных антител к эстрогенам и прогестерону (пероксидазный и авидин-биотиновый методы).
Комплексное исследование биоптатов. Включает морфологическое описание рецепторов к эстрогенам (ЭР) и прогестерону (ПР) и оценку их экспрессии.
Рецепторы к эстрогенам (ЭР) и прогестерону (ПР) относятся к внутриклеточным рецепторам стероидных гормонов. Они присутствуют в различных тканях-мишенях, в том числе в молочных железах и матке, где участвуют в механизмах гормональной индукции синтеза матричной РНК, белков, высвобождении цитокинов и факторов роста.
ЭР и ПР вовлечены в механизмы развития и метастазирования опухолей. Исследование экспрессии ЭР и ПР входит в стандарт обследования больных раком молочной железы, так как позволяет определить гормональную чувствительность опухоли, уточнить прогноз заболевания и потенциальный эффект гормонального лечения.
Исследование ЭР и ПР также используют в диагностике и прогнозе развития следующих патологических состояний: нарушения женской репродуктивной функции, бесплодие, гиперплазия эндометрия, злокачественные заболевания тела матки.
Рак молочной железы – самое распространенное онкологическое заболевание у женщин (частота встречаемости в течение жизни у женщин в возрасте от 13 до 90 лет – 1:9-1:13). Большинство этих опухолей гормонально зависимы, эстрогены и прогестерон стимулируют их рост и метастазирование. Данные гормоны также способствуют развитию некоторых видов рака молочной железы.
Исследование экспрессии ЭР и ПР в биоптате опухоли в настоящее время рекомендовано проводить всем больным раком молочной железы для определения гормональной чувствительности опухоли, уточнения прогноза заболевания и потенциального эффекта гормонального лечения.
Опухоли с высоким содержанием ЭР и ПР, как правило, высокодифференцированные, с низкой пролиферативной активностью и минимально агрессивным течением, они хорошо отвечают на гормональную терапию и обычно имеют хороший прогноз. Эффективность гормональной терапии составляет около 50% при опухолях, экспрессирующих рецепторы к эстрогенам (ЭР+), и доходит до 75% при опухолях, экспрессирующих рецепторы как к эстрогенам, так и к прогестерону (ЭР+/ПР+).
Если опухолевые клетки экспрессируют мало рецепторов к эстрогенам (ЭР-), гормональная терапия обычно неэффективна. Исключение составляют варианты, когда клетки опухоли экспрессируют рецепторы к прогестерону (ЭР-/ПР+) – гормональная терапия эффективна у 10% таких больных.
Несмотря на то, что изредка резистентность к гормональной терапии наблюдается даже у пациентов с ЭР+/ПР+ опухолями, в настоящее время исследование ЭР и ПР в опухолевой ткани входит в «золотой стандарт диагностики» при раке молочной железы наряду с определением герцепт-статуса (HER-2, рецептор 2-го типа человеческого эпидермального фактора роста) и пролиферативной активности.
- Около 75% всех раковых опухолей молочной железы эстроген-позитивны (ЭР+).
- Около 65% эстроген-позитивных опухолей имеют также рецепторы к прогестерону (ЭР+/ПР+).
- Около 25% всех раковых опухолей молочной железы эстроген-прогестерон-негативны (ЭР-/ПР-), либо их гормональный статус неизвестен.
- Около 10% всех раковых опухолей молочной железы эстроген-позитивны и при этом прогестерон-негативны (ЭР+/ПР-).
- Около 5% всех раковых опухолей молочной железы эстроген-негативны и при этом прогестерон-позитивны (ЭР-/ПР+).
Стероидная рецепция эндометрия при бесплодии существенно меняется. Получены достоверные данные о снижении количества прогестерон-позитивных стромальных клеток, повышенной экспрессии α-эстрогенов в железистых и стромальных клетках как при первичном, так и при вторичном бесплодии. Исследование ЭР и ПР позволяет №525 ИГХ Рецепторы к эстрогенам и прогестерону (иммуногистохимическое исследование) оценить потенциальную способность эндометрия к нидации плодного яйца.
Не менее важна оценка состояния эндометрия перед назначением высоких доз гормональных препаратов в программах ЭКО. С одной стороны, гормональные препараты оказывают существенное влияние на систему рецепторов, с другой – нарушения в рецепторном аппарате могут привести к недостаточной восприимчивости эндометрия к экзогенному гормональному воздействию.
Восприимчивость эндометрия к воздействию эндогенных гормонов и гормональных препаратов можно определить с помощью соответствующих иммуногистохимических маркеров.
Уровень экспрессии ЭР и ПР при простой железистой гиперплазии эндометрия без атипии не зависит ни от возраста женщины, ни от наличия неопухолевой гинекологической патологии (хронического эндометрита, полипов эндометрия, фолликулярных кист яичников). Это позволяет сделать вывод, что женщин постменопаузального возраста следует лечить консервативно.
Вне зависимости от возраста простая железистая гиперплазия эндометрия с кистозными изменениями желез характеризуется снижением экспрессии ЭР в эпителии кист по сравнению с экспрессией ЭР в неизмененных железах.
Эндометриальные карциномы – гетерогенная группа опухолей, состоящая из разных нозологических форм, характеризующихся различным клиническим течением и выживаемостью больных (ВОЗ, Histological Typing Tumors of Female Genital Organs, 2003). Однако даже при одной и той же нозологической форме, например, при наиболее частой разновидности рака тела матки – эндометриоидной аденокарциноме – применяемые методы лечения оказываются неэффективными у каждой пятой больной. Биологическое поведение опухоли, обусловленный им вариант клинического течения и прогноз заболевания остаются недостаточно предсказуемыми даже для больных с одной и той же формой рака тела матки.
Гормонально-рецепторный статус – важнейшая характеристика, определяющая клиническое течение заболевания и выживаемость больных эндометриоидным раком тела матки. Известно, что неопухолевая гинекологическая патология (хронический эндометрит, полип эндометрия, наличие фолликулярных кист яичника) не влияет на рецепторный статус эндометрия.
В опухолях эндометрия экспрессия рецепторов зависит от степени дифференцировки опухолевой ткани. Снижение дифференцировки клеток злокачественных опухолей приводит к снижению экспрессии рецепторов половых стероидов. В низкодифференцированных опухолях количество ЭР+ и ПР+ клеток достоверно меньше, чем в высокодифференцированных опухолях. Та же закономерность существует в отношении ПР+ клеток в опухолях с умеренной степенью дифференцировки по сравнению с высокодифференцированными карциномами.
Литература
Литература
- Рак молочной железы – для оценки гормональной чувствительности опухоли, уточнения прогноза и выбора метода лечения.
- Первичное/вторичное бесплодие – для оценки потенциальной способности эндометрия к нидации (имплантации) плодного яйца.
- Рак тела матки – для оценки гормональной чувствительности опухоли, уточнения прогноза и выбора метода лечения.
- Нарушения менструального цикла, дисфункция яичников, гиперплазия эндометрия – в качестве дополнительного исследования для оценки потенциальной эффективности гормональной терапии.
Литература
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Интерпретация: описательный ответ с указанием процента клеток, в которых определяется экспрессия антител к ЭР и ПР.
Референсные значения: диапазон значений индивидуален, зависит от фазы менструального цикла, анамнеза, проведенного лечения и клинического диагноза.
Проводится морфологическая оценка состояния эндометрия или морфологическая оценка опухоли молочной железы согласно классификации ВОЗ (2012).
Проводится подсчет количества окрашенных ядер клеток желез эндометрия, учитывается процентное соотношение окрашенных/неокрашенных ядер клеток на 100 учтенных клеток в 10 репрезентативных полях зрения при 40-кратном увеличении.
ИГХ Рецепторы к эстрогенам и прогестерону (иммуногистохимическое исследование)
Гистологическое исследование биоптатов слизистой тела матки, биоптатов молочной железы (с окрашиванием гематоксилином-эозином). Иммуногистохимическое исследование экспрессии рецепторов эстрогена и прогестерона с применением моноклональных антител к эстрогенам и прогестерону (пероксидазный и авидин-биотиновый методы).
Комплексное исследование биоптатов. Включает морфологическое описание рецепторов к эстрогенам (ЭР) и прогестерону (ПР) и оценку их экспрессии.
Рецепторы к эстрогенам (ЭР) и прогестерону (ПР) относятся к внутриклеточным рецепторам стероидных гормонов. Они присутствуют в различных тканях-мишенях, в том числе в молочных железах и матке, где участвуют в механизмах гормональной индукции синтеза матричной РНК, белков, высвобождении цитокинов и факторов роста.
ЭР и ПР вовлечены в механизмы развития и метастазирования опухолей. Исследование экспрессии ЭР и ПР входит в стандарт обследования больных раком молочной железы, так как позволяет определить гормональную чувствительность опухоли, уточнить прогноз заболевания и потенциальный эффект гормонального лечения.
Исследование ЭР и ПР также используют в диагностике и прогнозе развития следующих патологических состояний: нарушения женской репродуктивной функции, бесплодие, гиперплазия эндометрия, злокачественные заболевания тела матки.
Рак молочной железы – самое распространенное онкологическое заболевание у женщин (частота встречаемости в течение жизни у женщин в возрасте от 13 до 90 лет – 1:9-1:13). Большинство этих опухолей гормонально зависимы, эстрогены и прогестерон стимулируют их рост и метастазирование. Данные гормоны также способствуют развитию некоторых видов рака молочной железы.
Исследование экспрессии ЭР и ПР в биоптате опухоли в настоящее время рекомендовано проводить всем больным раком молочной железы для определения гормональной чувствительности опухоли, уточнения прогноза заболевания и потенциального эффекта гормонального лечения.
Опухоли с высоким содержанием ЭР и ПР, как правило, высокодифференцированные, с низкой пролиферативной активностью и минимально агрессивным течением, они хорошо отвечают на гормональную терапию и обычно имеют хороший прогноз. Эффективность гормональной терапии составляет около 50% при опухолях, экспрессирующих рецепторы к эстрогенам (ЭР+), и доходит до 75% при опухолях, экспрессирующих рецепторы как к эстрогенам, так и к прогестерону (ЭР+/ПР+).
Если опухолевые клетки экспрессируют мало рецепторов к эстрогенам (ЭР-), гормональная терапия обычно неэффективна. Исключение составляют варианты, когда клетки опухоли экспрессируют рецепторы к прогестерону (ЭР-/ПР+) – гормональная терапия эффективна у 10% таких больных.
Несмотря на то, что изредка резистентность к гормональной терапии наблюдается даже у пациентов с ЭР+/ПР+ опухолями, в настоящее время исследование ЭР и ПР в опухолевой ткани входит в «золотой стандарт диагностики» при раке молочной железы наряду с определением герцепт-статуса (HER-2, рецептор 2-го типа человеческого эпидермального фактора роста) и пролиферативной активности.
- Около 75% всех раковых опухолей молочной железы эстроген-позитивны (ЭР+).
- Около 65% эстроген-позитивных опухолей имеют также рецепторы к прогестерону (ЭР+/ПР+).
- Около 25% всех раковых опухолей молочной железы эстроген-прогестерон-негативны (ЭР-/ПР-), либо их гормональный статус неизвестен.
- Около 10% всех раковых опухолей молочной железы эстроген-позитивны и при этом прогестерон-негативны (ЭР+/ПР-).
- Около 5% всех раковых опухолей молочной железы эстроген-негативны и при этом прогестерон-позитивны (ЭР-/ПР+).
Стероидная рецепция эндометрия при бесплодии существенно меняется. Получены достоверные данные о снижении количества прогестерон-позитивных стромальных клеток, повышенной экспрессии α-эстрогенов в железистых и стромальных клетках как при первичном, так и при вторичном бесплодии. Исследование ЭР и ПР позволяет №525 ИГХ Рецепторы к эстрогенам и прогестерону (иммуногистохимическое исследование) оценить потенциальную способность эндометрия к нидации плодного яйца.
Не менее важна оценка состояния эндометрия перед назначением высоких доз гормональных препаратов в программах ЭКО. С одной стороны, гормональные препараты оказывают существенное влияние на систему рецепторов, с другой – нарушения в рецепторном аппарате могут привести к недостаточной восприимчивости эндометрия к экзогенному гормональному воздействию.
Восприимчивость эндометрия к воздействию эндогенных гормонов и гормональных препаратов можно определить с помощью соответствующих иммуногистохимических маркеров.
Уровень экспрессии ЭР и ПР при простой железистой гиперплазии эндометрия без атипии не зависит ни от возраста женщины, ни от наличия неопухолевой гинекологической патологии (хронического эндометрита, полипов эндометрия, фолликулярных кист яичников). Это позволяет сделать вывод, что женщин постменопаузального возраста следует лечить консервативно.
Вне зависимости от возраста простая железистая гиперплазия эндометрия с кистозными изменениями желез характеризуется снижением экспрессии ЭР в эпителии кист по сравнению с экспрессией ЭР в неизмененных железах.
Эндометриальные карциномы – гетерогенная группа опухолей, состоящая из разных нозологических форм, характеризующихся различным клиническим течением и выживаемостью больных (ВОЗ, Histological Typing Tumors of Female Genital Organs, 2003). Однако даже при одной и той же нозологической форме, например, при наиболее частой разновидности рака тела матки – эндометриоидной аденокарциноме – применяемые методы лечения оказываются неэффективными у каждой пятой больной. Биологическое поведение опухоли, обусловленный им вариант клинического течения и прогноз заболевания остаются недостаточно предсказуемыми даже для больных с одной и той же формой рака тела матки.
Гормонально-рецепторный статус – важнейшая характеристика, определяющая клиническое течение заболевания и выживаемость больных эндометриоидным раком тела матки. Известно, что неопухолевая гинекологическая патология (хронический эндометрит, полип эндометрия, наличие фолликулярных кист яичника) не влияет на рецепторный статус эндометрия.
В опухолях эндометрия экспрессия рецепторов зависит от степени дифференцировки опухолевой ткани. Снижение дифференцировки клеток злокачественных опухолей приводит к снижению экспрессии рецепторов половых стероидов. В низкодифференцированных опухолях количество ЭР+ и ПР+ клеток достоверно меньше, чем в высокодифференцированных опухолях. Та же закономерность существует в отношении ПР+ клеток в опухолях с умеренной степенью дифференцировки по сравнению с высокодифференцированными карциномами.
биоптат слизистой тела матки, биоптат опухоли молочной железы, фиксированный в 10%-м растворе формалина, забуференного по Лилли.
Читайте также:
