Гемоцитометр. Измерение мутности. Неколичественные методы подсчета.
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Анализ выполняется на гематологических анализаторах фирмы SYSMEX.
2. Посчет тромбоцитов (на анализаторе и при микроскопии по Фонио)
Тромбоциты – безъядерные клетки крови дисковидной формы размером 2 – 4 микрометра. Тромбоциты выполняют ангиотрофическую и адгезивно-агрегационную функции и принимают участие в процессах свертывания и фибринолиза, обеспечивают ретракцию (уплотнение) кровяного сгустка. Они способны переносить на своей мембране циркулирующие иммунные комплексы, поддерживать спазм сосудов. При активации тромбоциты приобретают сферическую форму и образуют специальные выросты (псевдоподии), с помощью которых они соединяются между собой (агрегируют) и прилипают к поврежденной стенке сосуда (способность к адгезии). Активированные тромбоциты выбрасывают содержимое своих гранул в кровяное русло: факторы свертывания, пероксидазу, серотонин, ионы кальция, АДФ, фактор Виллебранда, тромбоцитарный фибриноген, фактор роста тромбоцитов, которые участвуют в процессе свертывания.
Анализ включает в себя определение следующих параметров:
PLT -Общее количество тромбоцитов (х10 9 /л)
PDW - Ширина распределения тромбоцитов по объему (%)
MPV - Средний объем тромбоцитов (фл)
P-LCR -Количество гигантских ( ˃12 мкм) тромбоцитов (%)
Тромбоциты по Фонио (х10 9 /л)
Анализ выполняется на гематологических анализаторах фирмы SYSMEX и с помощью микроскопа фирмы OLIMPUS.
Подсчет количества тромбоцитов осуществляется двумя методами:
- на гематологическом анализаторе окрашенных специальным красителем тромбоцитов (оптический метод)
- при световой микроскопии окрашенного мазка крови с использованием иммерсионного масла
* Анализ выполняется совместно с клиническим анализом крови.
ПОКАЗАНИЯ К НАЗНАЧЕНИЮ
ПРИЧИНЫ ТРОМБОЦИТОЗА (увеличение количества тромбоцитов)
Реактивный тромбоцитоз (носит временный характери вызван активацией кроветворения)
- После спленэктомии ( 3 -6 месяцев)
- После острой кровопотери (кровоизлияния, оперативные вмешательства)
- После острого гемолиза
- При злокачественных новобразованиях
- Ревматоидный артрит
- Язвенный колит
- Остеомиелит
- Туберкулез
Опухолевый тромбоцитоз (при миелопролиферативных заболеваниях)
- Миелоидный лейкоз
- Эритремия
- Идиопатическая геморрагическая тромбоцитоемия
ПРИЧИНЫ ТРОМБОЦИТОПЕНИИ (уменьшение количества тромбоцитов)
- Идиопатическая тромбоцитопеническая пурпура
- Гипо- и апластические анемии
- Ауто- и имунные гемолитические анемии
- Лейкозы
- Метастазы рака в костный мозг
- Дефицит витамина В12 и фолиевой кислоты
- Лекарства
- Вирусные инфекции (в т.ч. системная красная волчанка)
- Лимфопролиферативные заболевания
- Протезирование клапанов сердца
- Экстракорпральное кровообращение
- Портальная гипертензия
3. Подсчет ретикулоцитов
Количество ретикулоцитов в периферической крови является показателем активности эритропоэза, то есть отражает эритропоэтическую активность костного мозга.
Анализ включает в себя определение 7 параметров:
RET% - Относительное количество ретикулоцитов (%0)
IRF% - Относительное количество незрелых ретикулоцитов (%)
LFR% - Относительное количество зрелых ретикулоцитов (%)
MFR% - Относительное количество средних ретикулоцитов (%)
HFR% -Относительное количество больших ретикулоцитов (%)
RET – He -Содержание гемоглобина в ретикулоците (пг)
- Анемии (критерий диагностики апластической анемии)
- Диагностика эффективности эритропоэза
- Оценка терапии неэффективного эритропоэза препаратами витамина В12, ЭПО, препаратами железа
- Лейкозы
- Миелодиспластические синдромы
- Оценка состояния после трансплантации костного мозга
ПРИЧИНЫ РЕТИКУЛОЦИТОЗА (повышение количества ретикулоцитов)
- Острая геморрагическая анемия (после острой кровопотери на 3-4 сутки)
- Гемолитическая анемия
- Эффективная терапия следующими препаратами:
витамин В12 (ретикулоцитарный криз на 5 – 8 день терапии)
препараты для лечения эритремии
препараты для лечения паркинсонизма
- Гемолиз
- Гемолитическая анемия
- Талассемия
- Малярия
- Эритролейкозы
- Метастазы в костный мозг
- Успешная трансплантация костного мозга ( увеличение более чем на 20%)
- Употребление допинга спортсменами (прием ЭПО)
- Курение
ПРИЧИНЫ РЕТИКУЛОЦИТОПЕНИИ (снижение количества ретикулоциов)
- Апластическая анемия
- Анемии хронических заболеваний
- Железодефицитная анемия
- Сидеробластная анемия
- В12-дефицитная анемия
- Миелодиспластические синдромы
- Опухолевые процессы в костном мозге
- Нарушения работы щитовидной железы (микседема)
- Тяжелые болезни почек (снижение эритропоэза)
- Тяжелый алкоголизм
- Хронические инфекции
- Прием оральных контацептивов, противосудорожных препапратов
4. Определение СОЭ
Анализ включает в себя определение следующего параметра:
СОЭ -Скорость оседания эритроцитов (мм/ч).
Анализ выполняется по методу Панченкова как на анализаторе ROLLER,так и с помощью ручной методики.
5. Подсчет формулы крови (микроскопия)
Анализ включает в себя следующие параметры:
ПЯ % - Относительное количество палочкоядерных нейтрофилов (%)
СЯ % - Относительное количество сегментоядерных нейтрофилов (%)
ЛФ % -Относительное количество лимфоцитов (%)
МОН % -Относительное количество моноцитов (%)
ЭОЗ% -Относительное количество эозинофильных нейтрофилов (%)
БАЗ % -Относительное количество базофильных нейтрофилов (%)
Анализ выполняется путем подсчета групп лейкоцитов в окрашенном с помощью автоматической системы для окраски HEMATEK мазке крови при помощи световой микроскопии.
6. Определение свободного гемоглобина в плазме
У здоровых лиц в плазме содержится лишь незначительное (1—4 мг%) количество свободного гемоглобина. Это гемоглобин, выделившийся из закончивших свой жизненный цикл эритроцитов. Содержание свободного гемоглобина в плазме меняется в зависимости от интенсивности гемолиза и гемоглобинсвязывающей способности белков плазмы.
Hb св. - Свободный гемоглобин (г/л)
Анализ выполняется на анализаторе HemoCue.
* Для расчета процента гемолиза, помимо определения свободного гемоглобина, нужен клинический анализ крови.
ПРИЧИНЫ ГЕМОГЛОБИНЕМИИ (повышенное содержание свободного гемоглобина в плазме крови)
Как правило, причиной повышения концентрации свободного гемоглобина являются состояния, при которых происходит повышенное разрушение эритроцитов:
- Гемолитические анемии
- Гемолитическая болезнь новорожденных
- Гемоглобинопатии (серповидноклеточная анемия и ее варианты, талассемия, гемоглобиноз С),
- Отравление гемолитическими ядами (чаще всего при укусах змей) с последующим развитием ДВС-синдрома
- Гемолитические кризы в результате тяжелых посттрансфузионных реакций, при групповой или резус-несовместимости
- Инфекционные заболевания (при малярии и как вторичный симптом при сепсисе)
- Массивные ожоги (термические или химические)
- Физиологическая гемоглобинемия (в результате воздействия на эритроидные клетки, расположенные в ткани легких или желудка при курении, гастрите, язвенной болезни).
7. Подсчет шизоцитов
Шизоциты - (шт. на 10000 эритроцитов)
Подсчет шизоцитов (фрагментов эритроцитов) осуществляется при помощи световой микроскопии окрашенного мазка крови с использованием иммерсионного масла.
Гемоцитометр. Измерение мутности. Неколичественные методы подсчета.
Число бактериальных или дрожжевых клеток в жидкой культуре, например в бульоне, можно прямо подсчитать с помощью микроскопа. Этот метод удобен для подсчета дрожжевых клеток, которые гораздо крупнее бактериальных. При подсчете бактерий необходим объектив с иммерсионным маслом.
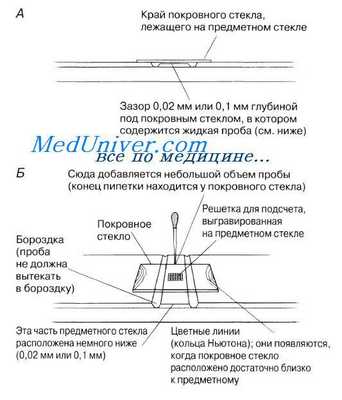
Обычно для подсчета используют особое предметное стекло, называемое гемоцитометром, а сам метод известен как гемоцито-метрия. Чтобы обеспечить прочный контакт между предметным стеклом и покровным стеклом, следует сильно придавить покровное стекло с любой стороны камеры (но так, чтобы не раздавить покровное стекло!). Затем покровное стекло слегка сдвигают до тех пор, пока не покажутся цветные линии. Проба жидкости, наносимая пипеткой, затягивается под покровное стекло за счет капиллярного эффекта. Камеру оставляют на 2—3 мин, чтобы клетки осели — это облегчает подсчет. Микроскоп фокусируют на решетке и подсчитывают число клеток на всей решетке, или на ее репрезентативном участке. Нужно насчитать не менее 600 клеток. Если клетки лежат на границе, их можно отнести к квадрату, ограниченному двумя сторонами (например, верхней и правой границами), и не считать их в квадрате, ограниченном двумя другими сторонами, но не следует пытаться считать половинки клеток. Каждый маленький квадрат имеет известную площадь, а глубина жидкости под покровным стеклом является постоянной (обычно 0,02 или 0,1 мм). Следовательно, можно вычислить объем каждой ячейки, и подсчитать число клеток в данном объеме. Если число клеток в каждом квадрате превышает 30, следует развести пробу. Не забывайте при расчетах сделать поправку на разведение.
На решетке, изображенной на рисунке, каждый маленький квадрат имеет размеры 0,05 мм х 0,05 мм = 0,0025 мм 2 на общей площади решетки 1 мм 2 . Если зазор между покровным стеклом и решеткой составляет 0,02 мм, то общий объем над решеткой равен 1 х 0,02 мм = = 0,02 мм3. Можно, следовательно, подсчитать число клеток в данном объеме пробы. Запомните, что 1000 мм3 = 1 см3, а 1000 см3 = 1 дм3 (1л).
При подсчете клеток дрожжей можно использовать краситель метиленовый синий. При этом в синий цвет окрашиваются только мертвые клетки. Живые клетки активно выводят краситель из клетки. Таким образом, можно подсчитать число жизнеспособных клеток, если учитывать только бесцветные или бледно-голубые клетки.
Измерение мутности
Метод, называемый нефелометрией, в принципе прост. Чем больше клеток в суспензии, темвыше ее мутность, или «затемненность», степень которой можно измерить.
Проще всего использовать набор стандартных пробирок (броуновские пробирки), которые имеются в продаже. Они содержат суспензии сульфата бария в различных концентрациях, от прозрачной (пробирка 1) до непрозрачной (пробирка 10). Образец суспензии исследуемых микроорганизмов помещают в идентичную пробирку и подбирают одну из стандартных пробирок, подходящую по мутности суспензии. К набору стандартных пробирок прилагается таблица, позволяющая по мутности рассчитать концентрации клеток для широкого спектра различных микроорганизмов.
Можно также мутность измерять как долю пропускания света (или оптическую плотность) суспензией с использованием колориметра или спектрофотометра. Клеточная масса прямо пропорциональна оптической плотности. Лучше всего использовать красный свет (красный фильтр), поскольку он не интерферирует с желтоватым цветом многих культуральных сред.
При измерении мутности возможны ошибки, если растущие клетки образуют комки (см. раздел, посвященный подсчету жизнеспособных клеток). Наиболее точные результаты получают в тех случаях, когда плотность популяции не слишком высокая и не слишком низкая. Для получения идеальной плотности клеток иногда требуется разведение проб.
Неколичественные методы
Можно использовать и другие методы измерения роста микроорганизмов. Например, у грибов можно измерять рост как увеличение диаметра мицелия с течением времени. Этот метод был бы удобен при изучении влияния температуры на рост грибов, или при изучении действия ингибиторов в среде. Если гриб выращивают в жидкой среде, то можно отфильтровывать или отцентрифугировать пробы культуры через определенные интервалы времени и измерять массу свежего или высушенного мицелия.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Методика подсчета эритроцитов, лейкоцитов и тромбоцитов с помощью гемоцитометра
Принцип прямого счисления заключается в следующем: разбавить кровь в пипетке Potain (предусмотренной красным шариком для эритроцитов и белым — для лейкоцитов и тромбоцитов), при этом разбавляющая жидкость разная, соответственно виду клеток.
К разбавляющим жидкостям относятся:
а) для эритроцитов:
— хлорид натрия —1 г.
— сульфат натрия — 5 г.
— сублимат — 0,5 г.
— дистилированная вода — 200 мл.
б) для лейкоцитов:
— ледяная укусусная кислота — 2 мл.
— 1% метиленблау — 1 капля
— дистилированная вода — до 100 мл.
в) для тромбоцитов: — щавелевокислый аммоний — 1 г.
— Nа2ЭДТА — 0,01 г.
— дистилированная вода - 100 мл.
Пипетки Potain должны быть чистыми, совершенно сухими и цельными. До потребления пипетку испытать на проницаемость путем вдувания воздуха, после использования ее следует промыть проточной водой, с помощью трубки для вакуума, затем дистилированной водой. Через несколько дневные интервалы держать пипетку по 24 часа в серохроми-стой смеси, затем промывать тщательно проточной и дистилированной водой.
Высушивать в сушильном шкафу, при температуре 180°. Когда требуется срочное высушивание, пипетку промывать спиртом, а затем эфиром.
Разжижение крови. Набрать в пипетку кровь до деления 0,5, затем разбавляющую жидкость до деления 101 — в пипетку с красным шариком (для счисления эритроцитов) и до деления 11 в пипетку с белым шариком (для счисления лейкоцитов и тромбоцитов). Получаются следующие растворы: 1/200 для эритроцитов и 1/20 для лейкоцитов и тромбоцитов.
Счисление проводится в камере Бюркер-Тюрк или Горяева, к которой хорошо прикреплена чистая оригинальная пластинка.

Заполнение камеры для счисления. В течение 2 мин. хорошо встряхивать пипетку, затем отбросив первые 2—3 капли налить в камеру для счисления, на край пластинки, небольшое количество смеси, которое заполнит пространство в силу капиллярности. Нежелателен избыток смеси, поскольку он заполняет канавки гемоцитометра. Подождать выпадение форменных элементов крови (1—2 мин. в случае эритроцитов и лейкоцитов, 10—15 мин. во влажной камере — для тромбоцитов).
Счисление эритроцитов, лейкоцитов и тромбоцитов. Исследование проводить обычным оптическим устройством (объективом 10 х для лейкоцитов и 20 х или 40 х для эритроцитов и тромбоцитов, при этом конденсор располагается в среднем положении). Счисление проводить на следующих площадях;
— для эритроцитов — 5 квадратов (1/25 квадратиков по 1/400), т.е. 1/5 мм 2 ;
— для лейкоцитов — 4 квадрата, расположенные по углам камеры Бюркер-Тюрк, т.е. 4 мм 2 ;
— для тромбоцитов — одинаково с эритроцитами.
Из клеточных элементов, расположенных по линиям, отграничивающим площади счисления, подсчитывать лишь те из них, которые находятся вдоль одной вертикальной отграничивающей линии (напр. левой) и одной горизонтальной (напр. верхней).
Расчет эритроцитов, лейкоцитов и тромбоцитов. В целях определения числа форменных элементов на мм 2 учитывать площадь, вышину, разведение:
№ эритроцитов/мм 3 = № насчитанных эритроцитов х 5 х 10 х х 200 = № эритроцитов х 10 000;
№ лейкоцитов/мм 3 = № насчитанных лейкоцитов х 10 х 20 : 4 = = № насчитанных лейкоцитов х 50;
№ тромбоцитов/мм 3 = № насчитанных тромбоцитов х 5 х 10 х х 20 = число насчитанных тромбоцитов х 1000.
Отбор крови для подсчета тромбоцитов можно проводить также пипеткой Potain для эритроцитов, в таком случае отсасывать кровь до деления 1 а разбавляющую жидкость до деления 101. Получится разведение 1/100. Тромбоциты счислять с 200 квадратиков (1/2 мм2), полученную цифру умножить на 2000.
Поправка числа лейкоцитов в случае эритробластоза. Когда в крови находятся эритробласты число ядерных элементов, полученных при счислении, откоррегировать соответственно результату лейкоцитной формулы, по формуле: № лейкоцитов/мм3 = № ядерных элементов/мм3 х 100 / (100 + № эритробластов/100 лейкоцитов).
Количественное определение кровяных клеток основывается на их счислении на небольшом, предполагаемым однородным образце и обобщением результата на всю массу крови организма. Между полученным результатом и фактическим значением может возникнуть разница (погрешность), которая подвергается математическому расчету для определения степени точности каждого метода в отдельности.
Отклонения от строгого соблюдения технических указаний создают многочисленные причины погрешностей на протяжении всего процесса производимых в камере подсчетов. В том числе:
а) погрешности отбора,
б) ошибки аппаратуры,
в) техники,
г) неоднородного распределения в счислительной камере.
Когда проба отбирается одной пипеткой а счисление производится в одной камере погрешность определения числа эритроцитов составляет ±30%, лейкоцитов +20%, а тромбоцитов +30—40%. В то время как в отношении лейкоцитов и тромбоцитов такая погрешность незначительна, поскольку она меньше биологических колебаний, в отношении эритроцитов точность техники представляется неудовлетворительной.
Тем не менее, счисление эритроцитов в камере остается наиболее сложный и в то же время наименее точный метод, причины, по которой его нельзя рассматривать как метод отбора. Единственным показанием к счислению эритроцитов является определение вида анемии.
При счислении тромбоцитов, независимо от метода, для проверки точности результата делается сопоставление с аспектом тромбоцитов на мазке крови.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Посев на поверхность агара. Проблемы возникающие при подсчете жизнеспособных клеток.
Иногда важно знать число жизнеспособных клеток. Например, можно оценить эффективность гибели определенных бактерий при пастеризации молока, измеряя количество жизнеспособных бактерий до и после пастеризации. В промышленном производстве только живые клетки участвуют в процессе, поэтому и здесь важно знать число живых клеток в культуре. Количество жизнеспособных клеток можно подсчитывать на чашках, где культура распределена по поверхности агара или внесена в агар; число жизнеспособных клеток дрожжей можно подсчитывать, используя метод гемоцитометрии.
Посев на поверхность агара
Посев на поверхность агара был уже описан в нашей статье. Небольшой известный объем культуры наносят на поверхность питательного агара в чашке Петри. Недостатком этого метода является то, что часть культуры остается на поверхности шпателя и в пипетке, поэтому невозможно подсчитать число клеток с высокой точностью. Однако часто это бывает не важно.
Метод основан на том, что каждая бактерия через определенный период времени, например через два дня, даст одиночную колонию. Таким образом, число бактерий в исходной добавленной пробе равно числу колоний, выросших после инкубации. Невооруженным глазом различимы только колонии, состоящие из 100 000 и более клеток. Обычно колонии содержат несколько миллионов бактерий.
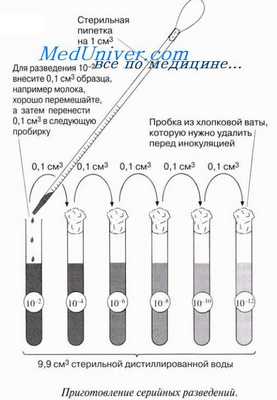
При условии, что проба содержит не слишком много и не слишком мало бактерий, число колоний можно легко подсчитать, причем для предосторожности лучше не открывать крышку чашки Петри при подсчете. Обычно требуется приготовить серии разведений, так чтобы в одной из серий оказалось идеальное число колоний. Серии разведений — это серии последовательных равномерных разбавлений одного образца. Когда найдено подходящее разведение, эксперимент повторяют при данном разведении для повышения точности и воспроизводимости результатов. В эксперименте 12.3 из разд. 12.9.2 число бактерий в пробах молока было установлено с использованием этого метода. Некоторые ограничения метода обсуждаются в конце данного раздела.
Посев заливкой
Посев заливкой уже был описан в нашей статье. Принципиально он не отличается от посева на поверхность агара, но в данном случае пробу смешивают с питательным агаром перед заливкой чашек, так что колонии распределяются по всему объему среды, а не растут только по поверхности.
Дрожжи
Подсчет жизнеспособных клеток дрожжей можно проводить с помощью гемоцитометра и ме-тиленового синего. Этот метод более детально описан в следующем разделе.
Проблемы, возникающие при подсчете жизнеспособных клеток
С подсчетом жизнеспособных клеток связан ряд проблем.
1. Некоторые бактерии образуют цепочки или группы клеток, например, стрептококки и стафилококки. Каждая группа клеток дает начало только одной колонии. Поэтому иногда результаты подсчета жизнеспособных клеток выражаются не как число бактерий, а как число колониеобразующих единиц.
2. Если присутствует несколько типов бактерий, как, например, в пробах почвы, молока или воды, то условия роста будут не в равной степени благоприятны для каждого типа. Поэтому некоторые бактерии растут гораздо быстрее других, и число видимых колоний будет неадекватно числу бактерий в пробе.
Гемоцитометр - Hemocytometer

Гемоцитометр (или гемоцитометр) является счетно-камера устройство первоначально разработан и обычно используется для клеток подсчета крови .
Гемоцитометр был изобретен Луи-Шарлем Малассезом и состоит из толстого предметного стекла микроскопа с прямоугольным углублением, которое создает камеру точного объема. На этой камере выгравирована сетка перпендикулярных линий, нанесенная лазером . Устройство тщательно продумано так, чтобы была известна площадь, ограниченная линиями, и глубина камеры. Таким образом, наблюдая за определенной областью сетки, можно подсчитать количество ячеек или частиц в определенном объеме жидкости и, таким образом, вычислить концентрацию ячеек в жидкости в целом. Хорошо используемый тип гемоцитометра - это счетная камера Нойбауэра .
Для других целей используются другие типы гемоцитометров с другими линейками. Постановления Фукса-Розенталя, обычно используемые для подсчета спинномозговой жидкости, постановления Говарда Молда, используемые для плесени на пищевых продуктах и упаковках пищевых продуктов, постановления Макмастера на слайде для яиц, используемые для подсчета микробных яиц в фекалиях, постановление камеры Наготта для подсчета низких уровней лейкоцитов в белом компоненты тромбоцитов с пониженным содержанием клеток, Palmer Nanoplankton управляет для подсчета меньших планктонов. Счетчик Петрова-Хауссера, использующий улучшенные линейки Нойбауэра, используется для подсчета бактерий и сперматозоидов и предлагается с камерой различной глубины. Клетка Седжвика-Рафтера, управляющая гемоцитометром, в первую очередь предназначена для использования в микроскопии питьевой воды.
СОДЕРЖАНИЕ
Принципы
Область сетки улучшенного гемоцитометра с линейкой Нейбауэра состоит из девяти квадратов 1 x 1 мм (1 мм 2 ). Они подразделяются на три направления; 0,25 x 0,25 мм (0,0625 мм 2 ), 0,25 x 0,20 мм (0,05 мм 2 ) и 0,20 x 0,20 мм (0,04 мм 2 ). Центральный квадрат далее подразделяется на квадраты 0,05 x 0,05 мм (0,0025 мм 2 ). Поднятые края гемоцитометра удерживают покровное стекло на 0,1 мм от размеченной сетки, придавая каждому квадрату определенный объем (см. Рисунок справа).
| Габаритные размеры | Площадь | Объем на глубине 0,1 мм |
|---|---|---|
| 1 х 1 мм | 1 мм 2 | 100 нл |
| 0,25 x 0,25 мм | 0,0625 мм 2 | 6,25 нЛ |
| 0,25 x 0,20 мм | 0,05 мм 2 | 5 нЛ |
| 0,20 x 0,20 мм | 0,04 мм 2 | 4 нЛ |
| 0,05 x 0,05 мм | 0,0025 мм 2 | 0,25 нл |
использование
Чтобы использовать гемоцитометр, сначала убедитесь, что специальное покровное стекло, снабженное счетной камерой, правильно расположено на поверхности счетной камеры. Когда две стеклянные поверхности находятся в надлежащем контакте , можно наблюдать кольца Ньютона . Если это так, суспензию клеток наносят на край покровного стекла, чтобы засосать в пустоту за счет капиллярного действия, которое полностью заполняет камеру образцом. Количество клеток в камере можно определить прямым подсчетом с использованием микроскопа , а визуально различимые клетки можно подсчитать по-разному. Количество клеток в камере используется для расчета концентрации или плотности клеток в смеси, из которой взят образец. Это количество клеток в камере, деленное на объем камеры, который известен с самого начала, с учетом любых разбавлений и быстрых способов подсчета:
где объем разбавленной пробы (после разбавления), деленный на объем исходной смеси в пробе (до разбавления), является коэффициентом разбавления . Например, если объем исходной смеси составлял 20 мкл, и она была разбавлена один раз (путем добавления 20 мкл разбавителя), то второй член в скобках равен 40 мкл / 20 мкл. Объем подсчитываемых квадратов соответствует тому, который указан в таблице вверху, в зависимости от размера (см. Рисунок справа). Подсчитанное количество ячеек - это сумма всех ячеек, подсчитанных по квадратам в одной камере. Пропорция подсчитываемых ячеек применяется, если подсчитываются не все внутренние квадраты в пределах установленного квадрата (т. Е. Если подсчитываются только 4 из 20 в угловом квадрате, тогда этот член будет равен 0,2).
В большинстве случаев используются только четыре больших угловых квадрата. Ячейки, которые находятся на верхней и левой линиях или касаются их, подсчитываются, но те, которые находятся на правой или нижней линиях или касаются их, игнорируются.
Требования

Исходную суспензию необходимо тщательно перемешать перед взятием пробы. Это гарантирует, что образец является репрезентативным, а не просто артефактом конкретной области исходной смеси, из которой он был взят.
Следует использовать соответствующее разбавление смеси с учетом количества подсчитываемых клеток. Если образец недостаточно разбавлен, клетки будут переполнены, и их будет трудно подсчитать. Если он слишком разбавлен, размера пробы будет недостаточно, чтобы сделать строгие выводы о концентрации в исходной смеси.
Результаты можно сравнить, выполнив повторный тест на второй камере. Если они отличаются более чем в 2 раза на ошибку подсчета (квадратный корень из подсчета), метод отбора пробы может быть ненадежным (например, исходная смесь не была тщательно перемешана).
Счетная камера должна заполняться капиллярно после того, как крышка камеры (специальное покровное стекло с сертифицированной толщиной и плоскостностью) была установлена на место. Это позволяет избежать риска осаждения / прилипания клеток к стеклу или испарения некоторого объема до того, как покровное стекло будет помещено сверху, что приведет к завышению концентрации клеток. Седиментация представляет собой меньшую проблему с бактериями, но испарение, которое более распространено в лабораториях с кондиционированным воздухом с низкой влажностью, все же должно быть сведено к минимуму.
Читайте также:
