Гемолитико-уремический синдром - эпидемиология, патогенез
Добавил пользователь Morpheus Обновлено: 27.01.2026
Для цит ирования: Пахольчук ТН, Усачёва ЕВ, Силина ЕА, Кляцкая ЛИ и др. (2020). Гемолитико-уремический синдром как осложнение инфекционной диареи у детей: клинические случаи. Современная педиатрия. Украина. 93—98; doi 10.15574/SP.2020.107.93
Статья поступила в редакцию 17.01.2020 г., принята в печать 04.04.2020 г.
Гемолитико-уремический синдром (ГУС) — это тяжелое осложнение бактериальных и вирусных диарейных заболеваний, которое является одной из причин развития у детей острой почечной недостаточности, а эффективность его лечения и исход прямо зависит от своевременности диагностики.
Цель: продемонстрировать особенности течения ГУС у детей раннего возраста с инфекционной диареей.
Материалы и методы. Проанализированы два случая ГУС, ассоциированного с диарейных синдромом, который был проявлением ротавирусной инфекции у одного больного и проявлением токсикоза у второго больного, а также результаты проведенного обследования, терапии с указанием сложности диагностики и лечения.
Результаты и выводы. В обоих случаях заболевание начиналось с диарейного синдрома с гемоколитом. У ребенка с ротавирусной инфекцией на фоне токсико-эксикоза и гемоколита проявления ГУС развились на 4-е сутки заболевания, а у ребенка с острой кишечной инфекцией неясной этиологии с гемоколитом проявления ГУС развились на 6-й день лечения. В дальнейшем больным проведено обследование и лечение в условиях отделения анастезиологии, интенсивной терапии и хрониодиализа (ОАИТ и ХД), где они получили 17 и 14 сеансов гемодиализа соответственно и были выписаны на 56-й и 51-й день. Для исключения тромботической тромбоцитопенической пурпуры проводились исследования в лаборатории Доктора Рёдгера на выявление ADAMTS-13-антител. Через три и шесть месяцев после выписки из стационара детям было проведено полное контрольное обследование, которое не выявило отклонений от нормы по всем ранее отмеченным показателям. Состояние их стабильное. Результаты катамнестического наблюдения за детьми в течение восьми месяцев свидетельствуют о клинико-лабораторной ремиссии. В течение этого времени они принимают с целью нефропротекции ингибиторы АПФ. Дети остаются под диспансерным наблюдением с периодическим контролем лабораторных показателей в течение последующих пяти лет.
Исследование было выполнено в соответствии с принципами Хельсинкской Декларации. Протокол исследования был одобрен Локальным этическим комитетом учреждения. На проведение исследований было получено информированное согласие родителей детей.
Авторы заявляют об отсутствии конфликта интересов.
Ключевые слова: дети, токсико-эксикоз, кишечная инфекция, гемолитико-уремический синдром.
ЛИТЕРАТУРА
1. Байко СВ, Сукало АВ. (2016). Факторы риска неблагоприятного исхода гемолитико-уремического синдрома у детей. Нефрология и диализ. 18;4: 404—414.
2. Байко СВ, Сукало АВ, Судновская КА. (2016). Гемолитико-уремический синдром у детей: эпидемиология, особенности клинико-лабораторного течения, лечение и исходы (Одноцентровое исследование). Нефрология и диализ. 18;3: 282—299.
3. Делягин ВМ, Плясунова СА. (2015). Гемолитико-уремический синдром. Consilium medicum. Педиатрия. 3: 23—28.
4. Іванов ДД, Корж ОМ. (2014). Нефрологія в практиці сімейного лікаря. 3-є вид., перероб. і доп. Д.: Видавець Заславський ОЮ: 464.
5. Іванов ДД, Кушніренко СВ. (2014). Дитяча нефрологія: навчально-методичний посібник. Дніпропетровськ: Середняк ТК: 157—163.
6. Карпухина ОА, Крамарь ЛВ, Арова АВ, Невинский АБ. (2015). Гемолитико-уремический синдром как осложнение инфекционных заболеваний у детей: принципы диагностики и лечения. Лекарственный вестник. 9;1(57): 10—16.
7. Козловская НЛ, Прокопенко ЕИ, Эмирова ХМ и др. (2015). Клинические рекомендации по диагностике и лечению атипичного гемолитико-уремического синдрома. Нефрология и диализ. 17(3): 242—264.
8. Маковецкая ГА, Мазур ЛИ, Гасилина ЕС и др. (2011). Мониторинг здоровья детей, перенесших гемолитико-уремический синдром, как фактор профилактики развития и прогрессии хронической болезни почек. Педиатрия. 90;3: 6—12.
9. Недельская СН, Zoltán Prohászka, Ярцева ДА и др. (2019). Гемолитико-уремический синдром в педиатрии: клиническое наблюдение. Педиатрия. Восточная Европа. 7;3: 474—486.
10. Самарін ДВ. (2011). Гемолітико-уремічний синдром у дітей. Ліки України. 2(6): 21—22.
11. Эмирова ХМ, Толстова ЕМ, Каган МЮ и др. (2016). Гемолитико-уремический синдром, ассоциированный с шигатоксин-продуцирующей Esherichia Coli. Нефрология. 20(2): 18—32.
12. An update for atypical haemolyticuraemic syndrome: diagnosis and treatment. Aconsensus document. (2013). Nefrologia. 33(1): 27—45.
13. KDIGO Clinical practice guideline for acute kidney injury kidney international supplements Volume 2/issue 1/ March 2016.
14. Niaudet P, Boyer O0G. (2015). Clinical manifestations and diagnosis of Shiga toxin — producing Escherichia coli (STEC) hemolytic uremic syndrome (HUS) in children. UpToDate.
--> --> --> -->Гемолитико-уремический синдром, ассоциированный со Streptococcus pneumoniae
Гемолитико-уремический синдром, ассоциированный со Streptococcus pneumoniae – редкое заболевание, которое встречается в 5–10% от всех случаев гемолитико-уремических синдромов в детском возрасте. Пневмонии и менингиты относятся к основным заболеваниям, которые могут осложняться St. pneumoniae-ассоциированным гемолитико-уремическим синдромом. Широкое внедрение в клиническую практику полимеразной цепной реакции позволило увеличить частоту выявления данной патологии. В статье представлены эпидемиология, клиническая картина, особенности патогенеза, диагностика и лечение St. pneumoniae-ассоциированного гемолитико-уремического синдрома. Описаны 3 клинических случая данного синдрома у детей с пневмониями. У 2 пациентов пневмония протекала с деструкцией легочной ткани, эмпиемой плевры, бактериемией и тяжелой почечной недостаточностью, при которой требовалась терапия, замещающая функцию почек, методом гемофильтрации. Исходы гемолитико-уремического синдрома, ассоциированного со St. pneumoniae, хуже, чем при типичном гемолитико-уремическом синдроме, и связаны с тяжестью основного заболевания (пневмонии, менингита).
Ключевые слова
Об авторах
Байко Сергей Валерьевич – д.м.н., проф. 1-й кафедры детских болезней
220020 Минск, ул. Нарочанская, д. 17
Стрельченя Екатерина Сергеевна – врач отделения анестезиологии и реанимации №2
220018 Минск, ул. Якубовского, д. 53
Реут Светлана Устиновна – зав. отделением анестезиологии и реанимации №2
220018 Минск, ул. Якубовского, д. 53
Список литературы
1. Байко С.В. Гемолитико-уремический синдром: эпидемиология, классификация, клиника, диагностика, лечение (Часть 1). Нефрология и диализ 2007; 9(4): 370–377.
2. Brocklebank V., Wood K.M., Kavanagh D. Thrombotic Microangiopathy and the Kidney. Clin J Am Soc Nephrol 2018; 13(2): 300–317. DOI: 10.2215/CJN.00620117
3. Каган М.Ю. Гемолитико-уремический синдром, ассоциированный с пневмококковой инфекцией. Нефрология и диализ 2013; 15(2): 116–119.
4. Waters A.M., Kerecuk L., Luk D., Haq M.R., Fitzpatrick M.M., Gilbert R.D. et al. Hemolytic uremic syndrome associated with invasive pneumococcal disease: the United Kingdom experience. J Pediatr 2007; 151(2): 140–144. DOI: 10.1016/j.jpeds.2007.03.055
5. Constantinescu A.R., Bitzan M., Weiss L.S., Christen E., Kaplan B.S., Avital Cnaan A. et al. Non-enteropathic hemolytic uremic syndrome: causes and short-term course. Am J Kidney Dis 2004; 43(6): 976–982. DOI: 10.1053/j.ajkd.2004.02.010
6. Veesenmeyer A.F., Edmonson M.B. Trends in US hospital stays for Streptococcus pneumoniae-associated hemolytic uremic syndrome. Pediatr Infect Dis J 2013; 32(7): 731–735. DOI: 10.1097/INF.0b013e31828b31c8
8. Copelovitch L., Kaplan B.S. Streptococcus pneumoniae-associated hemolytic uremic syndrome: classification and the emergence of serotype 19A. Pediatrics 2010; 125(1): 174–182. DOI: 10.1542/peds.2007-2017
9. Lawrence J., Gwee A., Quinlan C. Pneumococcal haemolytic uraemic syndrome in the postvaccine era. Arch Dis Child 2018; 103(10): 957–961. DOI: 10.1136/archdischild-2017-313923
10. Lee C.S., Chen M.J., Chiou Y.H., Shen C.F., Wu C.Y., Chiou Y.Y. Invasive pneumococcal pneumonia is the major cause of paediatric haemolytic-uraemic syndrome in Taiwan. Nephrology (Carlton) 2012; 17(1): 48–52. DOI: 10.1111/j.14401797.2011.01500.x
11. Lee C.F., Liu S.C., Lue K.H., Chen J.P., Sheu J.N. Pneumococcal pneumonia with empyema and hemolytic uremic syndrome in children: report of three cases. J Microbiol Immunol Infect 2006; 39(4): 348–352
12. Joseph A., Cointe A., Mariani Kurkdjian P., Rafat C., Hertig A. Shiga Toxin-Associated Hemolytic Uremic Syndrome: A Narrative Review. Toxins (Basel) 2020; 12(2): 67. DOI: 10.3390/toxins12020067
13. Banerjee R., Hersh A.L., Newland J., Beekmann S.E., Polgreen P.M., Bender J. et al. Streptococcus pneumoniae-associated hemolytic uremic syndrome among children in North America. Pediatr Infect Dis J 2011; 30(9): 736–739. DOI: 10.1097/INF.0b013e3182191c58
14. Meinel C., Spartà G., Dahse H.M., Hörhold F., König R., Westermann M. et al. Streptococcus pneumoniae From Patients With Hemolytic Uremic Syndrome Binds Human Plasminogen via the Surface Protein PspC and Uses Plasmin to Damage Human Endothelial Cells. J Infect Dis 2018; 217(3): 358–370. DOI: 10.1093/infdis/jix305
16. Geary D.F. Hemolytic uremic syndrome and streptococcus pneumoniae: improving our understanding. J Pediatr 2007; 151(2): 113–114. DOI: 10.1016/j.jpeds.2007.04.057
17. Scobell R.R., Kaplan B.S., Copelovitch L. New insights into the pathogenesis of Streptococcus pneumoniae-associated hemolytic uremic syndrome. Pediatr Nephrol 2020; 35(9): 1585–1591. DOI: 10.1007/s00467-019-04342-3
18. Scobell R.R., Kaplan B.S., Copelovitch L. New insights into the pathogenesis of Streptococcus pneumoniae-associated hemolytic uremic syndrome. Pediatr Nephrol 2020; 35(9): 1585–1591. DOI: 10.1007/s00467-019-04342-3
19. Jeantet G., Pernin V., Brunot V., Roccabianca A., Macombe A., Szwarc I. et al. Successful treatment of a Streptococcus pneumoniae-associated haemolytic uraemic syndrome by eculizumab. Clin Kidney J 2019; 12(1): 106–109. DOI: 10.1093/ckj/sfy019
20. Spinale J.M., Ruebner R.L., Kaplan B.S., Copelovitch L. Update on Streptococcus pneumoniae associated hemolytic uremic syndrome. Curr Opin Pediatr 2013; 25(2): 203–208. DOI: 10.1097/MOP.0b013e32835d7f2c
Эпидемиология и патофизиология гемолитико-уремического синдрома, ассоциированного с шига-токсином (обзор литературы)
Гемолитико-уремический синдром (ГУС), ассоциированный с шига-токсином Е. coli(STEC), относится к наиболее частым причинам острого почечного повреждения у детей раннего возраста. Доля STEC-ГУС среди всех вариантов ГУС составляет до 90 %. Не все STEC являются патогенными для человека, а те, которые вызывают заболевание (геморрагический колит, ГУС), относятся к энтерогеморрагическим E. coli(EHEC). К основным патогенам, вызывающим STEC-ГУС, относится серотип E. coli О157:Н7, реже серотипы O26, O80, О103, O121, O145. EHEC присутствуют в виде нормальной микробиоты у крупного рогатого скота, но также может обнаруживаться у коз, овец, свиней, цыплят, собак, крыс. Заражение может произойти при употреблении недостаточно термически обработанного говяжьего фарша, непастеризованного молока, воды, включая водопроводную и из открытых водоемов и бассейнов, от инфицированного человека и при посещении ферм, зоопарков. Эпидемиологический анамнез должен тщательно оцениваться у каждого пациента с ГУС, учитывая ежегодные вспышки данного заболевания в различных регионах мира. В последние годы активно обсуждается вопрос о переносе шига-токсина (Stx) из кишечника в кровь и из крови к органам-мишеням в виде микровезикул, стенкой которых является наружная оболочка E. coliи клеток крови. Это позволяет Stx избежать ответа иммунной системы человека. В статье подробно изложены механизмы заражения и экспрессии генов патогенности EHEC, описано влияния Stx на эндотелиальные клетки, экспрессию молекул адгезии и воспалительных хемокинов, активацию альтернативного пути комплемента, которые обуславливают развитие ГУС.
Ключевые слова
Об авторе
Байко Сергей Валерьевич, д-р мед наук, проф. 1-я кафедра детских болезней
220016, г. Минск, пр. Дзержинского, д. 83.
Тел.: +375 (17) 250-37-61
Список литературы
1. Noris M, Remuzzi G. Hemolytic uremic syndrome. J Am Soc Nephrol2005;16(4):1035–1050. doi:10.1681/ASN.2004100861
2. Brocklebank V, Wood KM, Kavanagh D. Thrombotic Microangiopathy and the Kidney. Clin J Am Soc Nephrol 2018;13(2):300–317. doi:10.2215/CJN.00620117
3. Байко СВ. Гемолитико-уремический синдром: эпидемиология, классификация, клиника, диагностика, лечение (Часть 1). Нефрология и диализ2007;9(4):370–377
5. Joseph A, Cointe A, Mariani Kurkdjian P et al. Shiga ToxinAssociated Hemolytic Uremic Syndrome: A Narrative Review. Toxins (Basel)2020;12(2):67. doi: 10.3390/toxins12020067.
6. Bielaszewska M, Mellmann A, Zhang W et al. Characterisation of the Escherichia coli strain associated with an outbreak of haemolytic uraemic syndrome in Germany, 2011: a microbiological study. Lancet Infect Dis2011;11(9):671–676. doi:10.1016/S1473-3099(11)70165-7
7. Ylinen E, Salmenlinna S, Halkilahti J, et al. Hemolytic uremic syndrome caused by Shiga toxin-producing Escherichia coli in children: incidence, risk factors, and clinical outcome. Pediatr Nephrol 2020;35(9):1749–1759. doi:10.1007/s00467-020-04560-0
8. Bruyand M, Mariani-Kurkdjian P, Le Hello S et al. Paediatric haemolytic uraemic syndrome related to Shiga toxin-producing Escherichia coli, an overview of 10 years of surveillance in France, 2007 to 2016. Euro Surveill2019;24(8):1800068. doi:10.2807/1560-7917.ES.2019.24.8.1800068
10. Gerber A, Karch H, Allerberger F et al. Clinical course and the role of shiga toxin-producing Escherichia coli infection in the hemolytic-uremic syndrome in pediatric patients, 1997–2000, in Germany and Austria: a prospective study. J Infect Dis2002;186(4):493–500. doi:10.1086/341940
12. Byrne L, Jenkins C, Launders N et al. The epidemiology, microbiology and clinical impact of Shiga toxin-producing Escherichia coli in England, 2009–2012. Epidemiol Infect 2015;143(16):3475–3487. doi:10.1017/S0950268815000746
13. Allerberger F, Wagner M, Schweiger P et al. Escherichia coli O157 infections and unpasteurised milk. Euro Surveill 2001;6(10):147–151. doi:10.2807/esm.06.10.00379-en
14. Rangel JM, Sparling PH, Crowe C et al. Epidemiology of Escherichia coli O157:H7 outbreaks, United States, 1982–2002. Emerg Infect Dis2005;11(4):603–609. doi:10.3201/eid1104.040739.
15. Эмирова ХМ, Толстова ЕМ, Каган МЮ и др. Гемолитико-уремический синдром, ассоциированный с шига-токсин-продуцирующей Esherichia соli. Нефрология2016;20(2):18–32
17. Scheutz F, Teel LD, Beutin L et al. Multicenter evaluation of a sequence-based protocol for subtyping Shiga toxins and standardizing Stx nomenclature. J Clin Microbiol2012;50(9):2951–2963. doi:10.1128/JCM.00860-12.
19. Yang X, Bai X, Zhang J et al. Escherichia coli strains producing a novel Shiga toxin 2 subtype circulate in China. Int J Med Microbiol2020;310(1):151377. doi: 10.1016/j.ijmm.2019.151377
20. Orth D, Grif K, Khan AB et al. The Shiga toxin genotype rather than the amount of Shiga toxin or the cytotoxicity of Shiga toxin in vitro correlates with the appearance of the hemolytic uremic syndrome. Diagn Microbiol Infect Dis2007;59(3):235–242. doi: 10.1016/j.diagmicrobio.2007.04.013
22. Tuttle J, Gomez T, Doyle MP et al. Lessons from a large outbreak of Escherichia coli O157:H7 infections: insights into the infectious dose and method of widespread contamination of hamburger patties. Epidemiol Infect1999;122(2):185–192. doi: 10.1017/s0950268898001976
23. Stritt A, Tschumi S, Kottanattu L et al. Neonatal hemolytic uremic syndrome after mother-to-child transmission of a lowpathogenic stx2b harboring shiga toxin-producing Escherichia coli. Clin Infect Dis2013;56(1):114–116. doi: 10.1093/cid/cis851
24. Kintz E, Brainard J, Hooper L, Hunter P. Transmission pathways for sporadic Shiga-toxin producing E. coli infections: A systematic review and meta-analysis. Int J Hyg Environ Health 2017;220(1):57–67. doi:10.1016/j.ijheh.2016.10.011
25. Parker CT, Russell R, Njoroge JW et al. Genetic and Mechanistic Analyses of the Periplasmic Domain of the Enterohemorrhagic Escherichia coli QseC Histidine Sensor Kinase. J Bacteriol2017;199(8):e00861-16. doi:10.1128/JB.00861-16
26. Pradhan S, Karve SS, Weiss AA et al. Tissue Responses to Shiga Toxin in Human Intestinal Organoids. Cell Mol Gastroenterol Hepatol2020;10(1):171–190. doi: 10.1016/j.jcmgh.2020.02.006.
27. Zoja C, Buelli S, Morigi M. Shiga toxin-associated hemolytic uremic syndrome: pathophysiology of endothelial dysfunction. Pediatr Nephrol2010;25(11):2231–2240. doi: 10.1007/s00467-010-1522-1
28. Petruzziello-Pellegrini TN, Moslemi-Naeini M, Marsden PA. New insights into Shiga toxin-mediated endothelial dysfunction in hemolytic uremic syndrome. Virulence2013;4(6):556–563. doi: 10.4161/viru.26143
30. Ferraris JR, Ferraris V, Acquier AB, et al. Activation of the alternative pathway of complement during the acute phase of typical haemolytic uraemic syndrome. Clin Exp Immunol2015;181(1):118–125. doi: 10.1111/cei.12601
31. Ståhl AL, Sartz L, Karpman D. Complement activation on platelet-leukocyte complexes and microparticles in enterohemorrhagic Escherichia coli-induced hemolytic uremic syndrome. Blood 2011;117(20):5503–5513. doi:10.1182/blood-2010-09-309161
32. Arvidsson I, Ståhl AL, Hedström MM et al. Shiga toxininduced complement-mediated hemolysis and release of complement-coated red blood cell-derived microvesicles in hemolytic uremic syndrome. J Immunol2015;194(5):2309–2318. doi: 10.4049/jimmunol.1402470
33. Morigi M, Galbusera M, Gastoldi S et al. Alternative pathway activation of complement by Shiga toxin promotes exuberant C3a formation that triggers microvascular thrombosis. J Immunol 2011;187(1):172–180. doi:10.4049/jimmunol.1100491
Гемолитико-уремический синдром
В 1955 г. C. Gasser с соавторами описали наблюдавшееся ими у 5 детей заболевание, которое представляло собой сочетание острой почечной недостаточности (ОПН) с гемолитической анемией и тромбоцитопенией, развивающимися на фоне инфекционной диареи (E. coli, Sh. dysenteriae, S. pneumoniae), и назвали его гемолитико-уремическим синдромом (ГУС).
Эпидемиология
С данным синдромом должен быть знаком каждый педиатр, ведь ГУС является основной причиной развития ОПН у детей до 3-х лет. Частота возникновения ГУС у детей данного возраста составляет 2–3 случая на 10 тысяч детей. Причем в разных регионах заболеваемость типичным ГУС (тГУС) значительно варьирует (в зависимости от численности сельского населения, особенностей водоснабжения — в Аргентине и Уругвае эшерихиоз эндемичен, поэтому частота достигает 10 случаев на 100 тыс. населения в год; в более холодных регионах заболеваемость также выше — в Шотландии, по сравнению с Англией, в 2 раза выше — 3,4 vs 1,54 на 100 тыс. населения в год). Для тГУС чаще характерны эпидемические подъемы заболеваемости, но могут быть и спорадические случаи (более характерно для атипичного ГУС). Резервуаром инфекции являются фекалии крупного рогатого скота (E. coli O157 длительно выделяют в стуле Shiga like toxin (Stx) 2 типа). Человек заражается при употреблении сырой телятины, непастеризованного молока, загрязненных фруктов и овощей, контаминированной воды из колодца и водоемов, а также при неисправностях водопровода. Прямой контакт детей с животными или их испражнениями и передача от человека к человеку являются не менее важными механизмами передачи этой инфекции.
Классификация
Официальной классификации ГУС нет. По причинам возникновения выделяют инфекционные и неинфекционные формы (рис. 1). К инфекционным формам ГУС относят:
- ГУС, ассоциированный с шига-токсином (Sh. dysenteriae тип 1);
- ГУС, ассоциированный с микроорганизмами, секретирующими нейраминидазу (S. pneumoniae);
- ГУС, ассоциированный с ВИЧ-инфекцией, и др.
К неинфекционным формам относят идиопатический ГУС, наследственный ГУС (связанный с аномалиями ADAMTS-13), лекарственно-индуцированный ГУС (прием ингибиторов mTOR или ингибиторов VEGF) и другие формы.

Рисунок 1 | Классификация ГУС
Помимо вышеописанной классификации, ГУС можно отнести к первичным тромботическим микроангиопатиям (ТМА), этиология и патогенез которых установлены:
- ГУС, индуцированный инфекцией или ассоциированный с диареей (тГУС, ГУС-(D+));
- Атипичный ГУС, обусловленный генетическими нарушениями или изменениями иммунной системы, приводящими к патологии системы комплемента (аГУС, ГУС-(D–));
- Тромботическая тромбоцитопеническая пурпура (ТТП, болезнь Мошковица), связанная с аномалиями фермента ADAMTS-13 (врожденная или приобретенная).
Патогенез
Типичный ГУС
Основным фактором, инициирующим развитие тГУС, который обусловливает до 80 % от общего числа случаев заболевания, является энтерогеморрагическая кишечная палочка (E. coli, EHEC, серотип О157:Н7), синтезирующая шигаподобный токсин (веротоксин 1 и/или 2 типа). Данный штамм обладает высокой патогенностью для человека (для заражения достаточно 10 3 микроорганизмов), однако диарея развивается только в каждом 10-м случае (рис. 2).
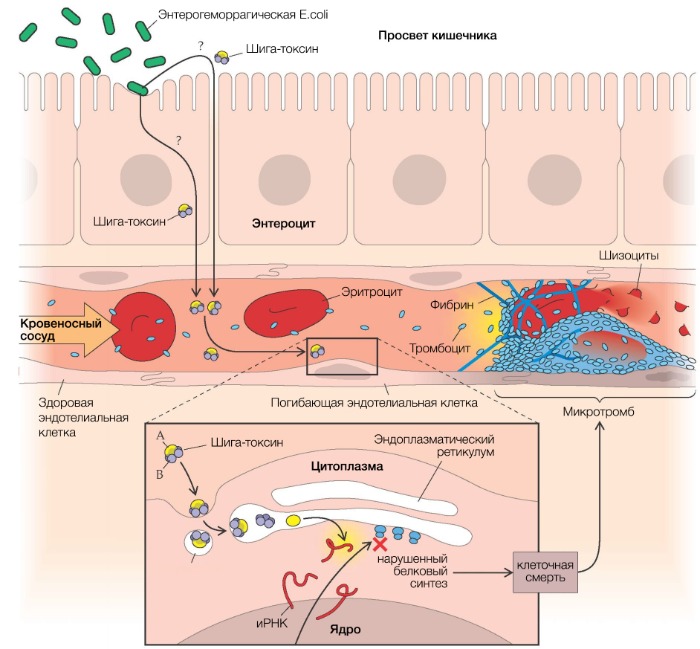
Рисунок 2 | Патогенез тГУС, ассоциированного с EHEC
После попадания E. coli в кишечник она связывается с ворсинками подвздошной кишки и эпителиальными клетками пейеровых бляшек при помощи специального белка, вызывая в конечном итоге гибель клеток с развитием диареи, переходящей в гемоколит (его возникновение связано с веротоксином, который способен повреждать сосуды слизистой оболочки кишечника). Шигаподобный токсин (SLT, Stx), высвобождающийся из кишечника, попадает в печень, где часть его метаболизируется, а другая часть попадает в системный кровоток, вызывая повреждение эндотелия органов-мишеней (легкие, почки, головной мозг).
SLT транспортируется в крови в основном нейтрофилами, но может перемещаться по системному кровотоку и при помощи моноцитов, тромбоцитов и/или их комплексов (липополисахарид кишечной палочки связывается с тромбоцитами, вызывая их активацию и агрегацию). За счет субъединицы В Stx имеет высокое сродство к мембраносвязанным гликосфинголипидам — Gb3/Gb4-рецепторам (в 100 раз выше, чем таковое с нейтрофилами).
В связи с этим повреждение эндотелия ярко выражено в мелких сосудах почек, но не в крупных сосудах других «возможных» органов-мишеней (экспрессия рецепторов Gb на мембранах эндотелиальных клеток почечных клубочков в 50 раз выше, чем в других тканях и органах). Помимо клеток эндотелия почечных клубочков, мезангиальных клеток, подоцитов, Gb-рецепторы в большом количестве синтезируются на мембранах нейронов и глиальных клеток. После проникновения Stx (за счет А субъединицы) внутрь клетки происходит блокирование синтеза белков путем инактивации рибосомальных субъединиц (60S) с последующим апоптозом этих клеток.
Помимо этого, ЛПС, концентрация которого в крови прямо коррелирует с таковой у шига-токсина, обусловливает повышенную продукцию провоспалительных цитокинов — интерлейкинов 1, 6, 8, а также фактора некроза опухоли-альфа (TNF-α). Те, в свою очередь, повышают экспрессию рецепторов на мембранах связывающих их моноцитов, приводя тем самым к более выраженному токсическому эффекту Stx.
Патогенез ГУС, вызванного Shigella dysenteriae 1 типа, схож с таковым у E. coli (рис. 3, 4, 5). Однако этот тип ГУС протекает тяжелее, чем ГУС, ассоциированный с шигаподобным токсином E. coli. Связано это, скорее всего, с липополисахаридным эндотоксином шигелл, который путем сложного взаимодействия с рецепторами TLR4 (на мембранах клеток) и NLR 1, 2 (Nod like receptors, расположены внутриклеточно) вызывает активацию сигнального пути NF-kB, что, в свою очередь, приводит к массивному выделению интерлейкина 8, являющегося мощным хемокином для нейтрофилов, макрофагов и лимфоцитов. Активированные нейтрофилы путем массивного выброса воспалительных цитокинов, помимо повышения секреции специфических рецепторов на мембранах эндотелиоцитов, вызывают активацию перекисного окисления липидов (ПОЛ), приводящего к повреждению не только эндотелия, но и эритроцитов, а также активацию лизосомальных ферментов, например, эластазы или α1-антитрипсина, которые также усугубляют эндотелиальное повреждение.
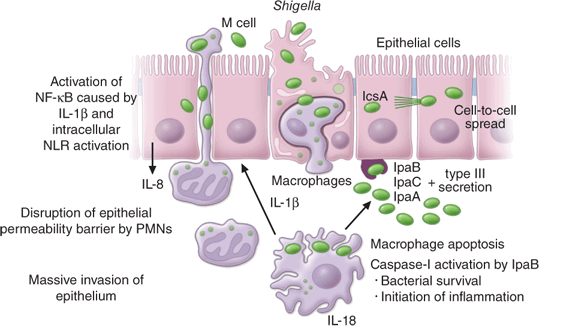
Рисунок 3 | Патогенез тГУС, ассоциированного с Shigella dysenteriae
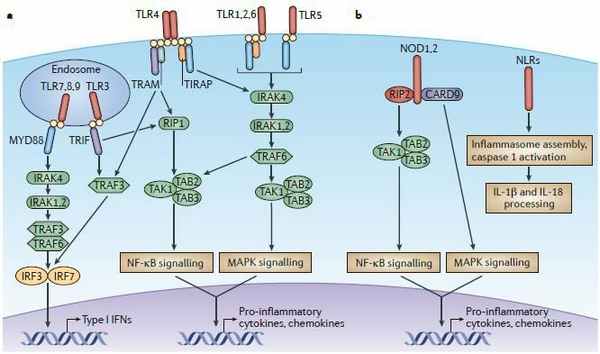
Рисунок 4 | Рецепторы TLR4 и NOD 1-2, через которые Shigella dysenteriae активирует сигнальный путь NF-kB
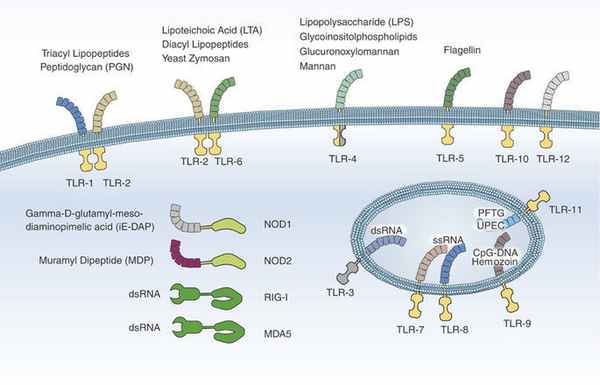
Рисунок 5 | Молекулярная основа патогенеза тГУС, ассоциированного с Shigella dysenteriae
ГУС, ассоциированный со Streptococcus pneumoniae, имеет несколько другой патогенез (рис. 6). Нейраминидаза S. pneumoniae атакует ацетилнейраминовую кислоту поверхности эндотелиальных клеток почечных клубочков, эритроцитов и тромбоцитов, обнажая при этом T-антиген (антиген Томсена-Фриденрайха). После «открытия» этих антигенов происходит усиление продукции Ig класса M, что, в свою очередь, приводит к агглютинации тромбоцитов и эритроцитов. По сути, эндотелий почечных клубочков повреждается как напрямую, так и иммуноопосредованно.
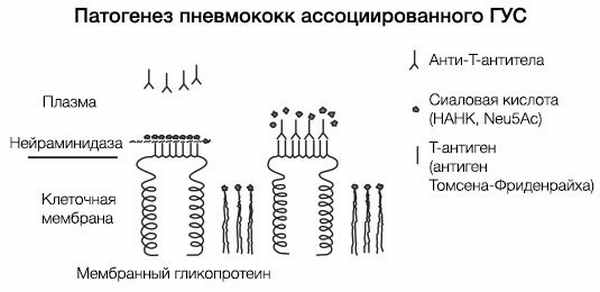
Рисунок 6 | Патогенез тГУС, ассоциированного со Streptococcus pneumoniae
В связи с этим происходит локальное изменение реологических свойств крови. Так называемый «shear stress» (связан с различной скоростью движения слоев крови), возрастающий при повреждении эндотелиальных клеток, помимо увеличения продукции NO (связано с раздражением механорецепторов), активирующего оксидативный стресс и инициирующего апоптоз эндотелиоцитов, также приводит и к агглютинации тромбоцитов. Основным звеном этой агглютинации является фактор Виллебранда (ФВ), который обычно накапливается в альфа-гранулах тромбоцитов и в тельцах Вайбеля-Паладе эндотелиальных клеток. Как говорилось выше, раздражение сосудистой стенки почечных клубочков путем воздействия на их стенку оксида азота, а также возрастающего касательного напряжения («shear stress») приводит к высвобождению ФВ, который способен поддерживать активацию и агрегацию тромбоцитов и тромбообразование в почечных клубочках.
Атипичный ГУС
Патогенез атипичного ГУС (аГУС) разительно отличается от тГУС. В его основе лежат мутации регуляторных белков системы комплемента (чаще всего аГУС ассоциирован с мутацией комплементарного фактора Н (CFH), на втором месте располагается мембранный кофакторный протеин (MCP), тройку замыкает комплементарный фактор I (CFI)).
При активации комплемента образуется C3-конвертаза, расщепляющая C3 на малый (С3а) и большой (C3b) фрагменты, который и опсонизируется на поверхности микробной клетки и формирует мембраноатакующий комплекс (МАК), состоящий из C5b, C6, C7, C8 и C9, что приводит к осмотическому лизису этой клетки. Для того, чтобы активированная система комплемента не уничтожила собственные клетки, на их поверхности расположены белки-регуляторы (DAF и CR1); помимо этого, часть таких белков синтезируется в печени и циркулирует в плазме крови в неактивном состоянии. К таким белкам относят комплементарный фактор H (CFH), фактор I (CFI) и мембранный кофакторный протеин, закрепленный на поверхности клеток (CD46). Фактор I, главный из вышеперечисленных факторов, расщепляет C3b и C4b. Фактор Н и CD46 являются кофакторами фактора комплемента I (рис. 7). Первый из них связывается с гликозаминогликанами собственных клеток организма, отсутствующими на мембранах бактериальных клеток, а также ингибирует активность C3-конвертазы. При мутации данных регуляторных белков происходит утрата защиты эндотелиальных клеток от повреждения конечными продуктами активации альтернативного пути комплемента (рис. 8).
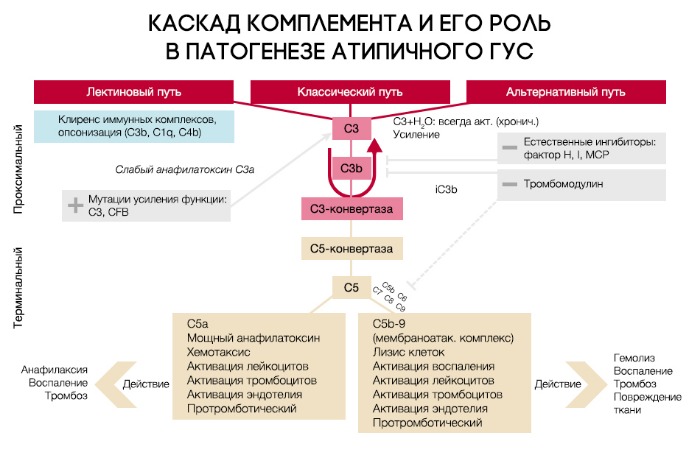
Рисунок 7 | Нормальная регуляция системы комплемента
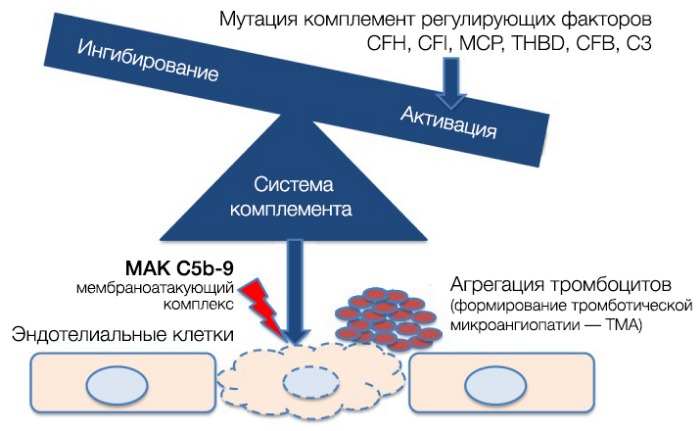
Рисунок 8 | Патогенез аГУС
Клиническая картина
В течении тГУС условно можно выделить 2 периода. Продромальный период характеризуется диареей, в ⅔ случаях диарею может сопровождать рвота. Гемоколит, характерный для тГУС, ассоциированного с шига-токсином, обычно развивается у каждого третьего больного через 2–3 дня после появления диареи.
Развернутая клиническая картина тГУС манифестирует в среднем на 5–6 день от начала диареи. Клиника крайне неспецифична. Бледность кожных покровов, общее недомогание, слабость, кожный геморрагический синдром в виде петехиальной сыпи или пурпуры, изменение цвета и уменьшение количества мочи после «кровавой» диареи должны насторожить врача в отношении тГУС (чаще всего диагностируется олигоанурическая стадия ОПН, требующая немедленного диализа).
Ввиду частой гиподиагностики адекватный контроль регидратации может отсутствовать, поэтому дополнительным признаком тГУС у детей можно считать артериальную гипертензию, которая отличается упорным течением и плохо поддается терапии. После восстановления нормального диуреза может отмечаться второй подъем АД, связанный с избыточной выработкой ренина.
Поражение ЦНС в виде генерализованных судорог, нарушения сознания вплоть до комы развивается в каждом четвертом случае и характеризует тяжесть течения тГУС.
Клиника аГУС имеет ряд особенностей!
Для аГУС характерно очень раннее начало (начиная с 2 месяцев при мутации CFI, c 6 месяцев при мутации CFH). Чаще всего аГУС манифестирует неспецифическими симптомами в виде общей слабости, недомогания без предшествующей этим симптомам диареи (при ее наличии затрудняется дифференциальный диагноз с тГУС). Возможно развитие гриппоподобного синдрома. У взрослых клиника может развиваться стерто, при этом классическая триада ГУС имеет слабую выраженность. Возможно развитие неполной триады без тромбоцитопении. Также для аГУС характерен семейный характер заболевания (в 25 % случаев имеется отягощенный наследственный анамнез). Большинство пациентов имеют выраженный отечный синдром вплоть до анасарки даже при отсутствии нефротического синдрома и ОПН. Также для больных с аГУС характерна АГ, связанная с перегрузкой объемом при манифестирующей ОПН или возникающая вследствие активации РААС, вызванной ишемией почечной ткани, обусловленной тромботической микроангиопатией. В отличие от тГУС, для атипичной формы характерно развитие кардиомиопатии с признаками острой СН. Описаны случаи развития острого панкреатита вплоть до панкреонекроза. В общем и целом клиника аГУС отличается яркой вариабельностью симптомов, что затрудняет ее своевременную диагностику (характерно рецидивирование).
Диагностика
Лабораторная диагностика как типичного, так и атипичного ГУС основана на выявлении признаков тромботической микроангиопатии:
- гемолитическая анемия — уровень гемоглобина ниже 90 г/л, выраженный ретикулоцитоз. Помимо этого, в крови могут появляться остатки эритроцитов — шизоциты (больше 1 %). Разрушение эритроцитов происходит из-за механического повреждения нитями фибрина при их прохождении через тромбированные сосуды почечных клубочков;
- тромбоцитопения ниже 150 тыс/мм 3 ;
- выраженный лейкоцитоз выше 20 х 10 9 /л; характеризует тяжесть ГУС.
Помимо этого, к неспецифическим признакам гемолиза эритроцитов можно отнести повышенный уровень ЛДГ, уменьшение уровня свободного гаптоглобина, гипербилирубинемию (за счет непрямой фракции). При проведении прямой пробы Кумбса результат будет отрицательным как у тГУС, так и аГУС.
Система диагностики ОПН, согласно критериям AKIN, основана на исследовании концентрации креатинина в сыворотке крови, СКФ, рассчитанной по формуле MDRD или CKD-EPI, а также на объеме мочи в течение суток. Для достоверной диагностики анурической стадии ОПН при подозрении на ГУС возможно выявление ранних признаков почечного повреждения (повышение уровня цистатина С, NGAL), а также повышения уровня калия крови выше 6 ммоль/л.
С целью подтверждения ГУС, связанного с шига-токсином, при наличии симптомов со стороны ЖКТ необходимо провести:
- посев кала на среду МакКонки для выявления серотипа E. coli O157:H7;
- определение шига-токсина в кале методом ПЦР или его выявление в сыворотке крови;
- возможно определение антител к липополисахариду эндемичного для данного региона серотипа E. coli.
Для исключения тромботической тромбоцитопенической пурпуры (ТТП) всем больным с характерной для ГУС клинической картиной необходимо определение активности ADAMTS-13 (менее 5 %). Для пациентов с аГУС типично снижение данного показателя, однако он в любом случае будет выше 10 % (в норме составляет 80–110 %).
Если при госпитализации больного в его анамнезе были выявлены предшествующие тромботические микроангиопатии, необходимо исследовать кровь на содержание С3 и С4 компонентов комплемента, а также на аутоантитела к фактору Н (анти-FH-антитела). Помимо этого, необходимо проведение дифференциальной диагностики со системными заболеваниями соединительной ткани (рис. 9). Развитие характерного симптомокомплекса во время беременности требует исключения специфической акушерской патологии.

Рисунок 9 | Дифференциальная диагностика ГУС
Лечение
Относительно специфическое лечение разработано только для атипичной формы ГУС. В настоящее время единственным допущенным до применения ингибитором системы комплемента является экулизумаб (рекомбинантное моноклональное антитело против компонента комплемента С5). Данный препарат блокирует расщепление С5 компонента комплемента (С5а — провоспалительный, C5b — протромботический компонент) и формирование на мембране собственных клеток МАК C5b-9.
Клинические испытания показали, что в профилактике и лечении аГУС экулизумаб оказался более эффективен, чем плазмаферез. Однако наилучшей схемой лечения считается введение препарата на фоне проведения плазмафереза, так как последний удаляет часть препарата из циркуляции, тем самым предотвращая развитие побочных реакций.
Введение свежезамороженной плазмы (СЗП) не предотвращает развитие терминальных стадий ХБП у больных с аГУС. Ее использование оправдано ввиду того, что СЗП является источником нормальных комплементарных факторов CFH и CFI. Как и в ситуации с экулизумабом, введение СЗП лучше сочетать с плазмаферезом (удаляются мутантные комплементарные факторы и анти-CFH антитела; удаление части плазмы предотвращает гиперволемию и следующую за этим острую сердечную недостаточность). Ввиду генетической детерминированности аГУС высок риск развития рецидива. Это, в свою очередь, требует проведение адекватной профилактической терапии, включающей в себя санацию очагов хронической инфекции, а также проведение своевременной вакцинопрофилактики. Трансплантация почки как метод лечения аГУС не имеет на данный момент широкой доказательной базы (описано всего 3 случая пересадки). Риск возврата аГУС сразу после трансплантации чрезвычайно высок, особенно у пациентов с мутацией комплементарного фактора Н.
Консервативное лечение тГУС заключается в проведении корректной регидратационной терапии. Как говорилось выше, неспецифичность клинической картины обусловливает высокий процент гиподиагностики, в связи с чем следующая за этим попытка коррекции водно-электролитного баланса оказывает отрицательный эффект (например, перегрузка объемом приводит в итоге к развитию острой сердечной недостаточности и активации РААС (гиперренинемии) — формируется резистентная к проводимой терапии артериальная гипертензия. Использование петлевых диуретиков, например, фуросемида, не оправдано; предпочтение стоит отдавать гемодиализу (на фоне гиперкалиемии или метаболического ацидоза) ввиду того, что диализ чаще всего начинается в олигоанурической стадии ОПН. При развитии анемии тяжелой степени (Hb ниже 70 г/л) показано переливание эритроцитарной массы. Антибиотики не являются основным компонентом терапии тГУС. Однако раннее назначение цефалоспоринов III поколения или фторхинолонов снижает риск развития тГУС, ассоциированного с S. dysenteriae типа 1.
Гемолитико-уремический синдром (ГУС)
Гемолитико-уремический синдром (ГУС) является острым скоротечным заболеванием, для которого характерна тромбоцитопения, микроангиопатическая гемолитическая анемия и острое поражение почек. ГУС обычно возникает у детей после попадания в организм инфекции, как правило, Шига -токсин-продуцирующих бактерий (например, Escherichia coli O157: H7 Инфекции, вызываемые Escherichia coli O157: H7 и другими энтерогеморрагическими E. coli (EHEC) Грамотрицательные бактерии Escherichia coli O157:H7 и другие энтерогеморрагические E. coli (EHEC), как правило, вызывают острую диарею с кровью, которая может привести к гемолитико-уремическому. Прочитайте дополнительные сведения ), но может встречаться и у взрослых. Для диагностики необходимо выявление характерных отклонений в показателях лабораторных тестов, включающих прямой антиглобулиновый тест, отрицательный на гемолитическую анемию. Лечение – поддерживающее (иногда с применением гемодиализа); в редких случаях используется экулизумаб или равулизумаб.
Патофизиология ГУС
Гемолитическо-уремический синдром, как и тромботическая тромбоцитопеническая пурпура Тромботическая тромбоцитопеническая пурпура (ТТП) Тромботическая пурпура (ТТП) является острым скоротечным заболеванием, для которого характерна тромбоцитопения и микроангиопатическая гемолитическая анемия. Другие проявления могут включать. Прочитайте дополнительные сведения В некоторых органах развиваются умеренные тромбы с участием фактора Виллебранда (ФВ), образующиеся в первую очередь в артериокапиллярных переходах, описанные как тромботическая микроангиопатия. Вероятнее всего, будут затронуты мозг, сердце и особенно почки. Микротромбы не содержат эритроцитов или фибрина (в отличие от тромбов, образующихся при диссеминированном внутрисосудистом свертывании) и не вызывают гранулоцитарной инфильтрации стенки сосуда, характерной для васкулита Обзор васкулита (Overview of Vasculitis) Васкулит представляет собой воспаление кровеносных сосудов, часто с ишемией, некрозом и поражением внутренних органов. Васкулит может распространяться на кровеносные сосуды любого типа: артерии. Прочитайте дополнительные сведенияЭтиология ГУС
Чаще всего наблюдается у детей и причиной является
Незначительная часть случаев связана не с инфекцией, а с
Нарушение регуляции системы комплемента
Дисрегуляция комплемента обычно происходит в связи с мутациями в генах, контролирующих синтез белков или факторов комплемента, но иногда и от приобретенных аутоантител к определенным факторам комплемента. Наследственные нарушения комплемента также повышают риск инфекций сопровождающих гемолитико-уремический синдром (ГУС).
Симптомы и признаки ГУС
Дети с гемолитико-уремическим синдромом (ГУС), связанным с Shiga токсином, обычно имеют продрому в виде рвоты, болей в животе и диареи (часто кровавой) и, согласно анамнезу, часто подвергались инфицированию. Пациенты с пневмококковым ГУС обычно имеют проявления пневмонии, менингита или сепсиса. Лихорадка обычно не встречается. Примерно через неделю продромального периода проявляются симптомы гемолитической анемии, тромбоцитопении и острого повреждения почек Острое повреждение почек (ОПП) Острое повреждение почек представляет собой внезапное снижение функции почек в течение нескольких дней или недель, вызывающее накопление азотистых соединений в крови (азотемия) с или без снижения. Прочитайте дополнительные сведения . Комплемент-опосредованный ГУС обычно не имеет инфекционного продромального периода.
Проявления ишемии развиваются с различной степенью тяжести в нескольких органах. Неврологические проявления встречаются примерно у четверти пациентов и включают слабость, спутанность сознания и судороги. Повреждение почек может привести к гематурии, уменьшенному мочеиспусканию или анурии и/или гипертонии. Несмотря на тромбоцитопению, пурпура и явное кровотечение встречаются редко, хотя ишемия желудочно-кишечного тракта может вызывать выраженный геморрагический колит с болями в животе, тошнотой, рвотой и кровавой диареей. Вовлечение сердца в патологический процесс может стать причиной аритмий.
Диагностика ГУС
Общий анализ крови с определением количества тромбоцитов, мазок крови, прямой антиглобулиновый тест (реакция Кумбса), ЛДГ (лактатдегидрогеназа), ПТВ (протромбиновое время), ЧТВ (частичное тромбопластиновое время), фибриноген
Исключение других тромбоцитопенических заболеваний.
Гемолитико-уремический синдром подозревают у пациентов с характерными симптомами, тромбоцитопенией, микроангиопатической анемией и признаками острого поражения почек. При подозрении на заболевание необходимо провести общий анализ мочи, исследование мазка периферической крови и количества ретикулоцитов, уровня сывороточной лактатдегидрогеназы, оценку функции почек, уровня сывороточного билирубина (прямой и непрямой) и прямой антиглобулиновый тест. Может помочь определение уровня активности фермента ADAMTS13. Этот фермент представляет собой протеиназу плазмы, которая расщепляет фактор Виллебранда; дефицит вызывает тромботическую тромбоцитопеническую пурпуру Тромботическая тромбоцитопеническая пурпура (ТТП) Тромботическая пурпура (ТТП) является острым скоротечным заболеванием, для которого характерна тромбоцитопения и микроангиопатическая гемолитическая анемия. Другие проявления могут включать. Прочитайте дополнительные сведенияНа наличие диагноза указывают следующие показатели:
Тромбоцитопения и анемия
Фрагментированные эритроциты в мазке периферической крови свидетельствуют о микроангиопатическом гемолизе (шизоциты: шлемовидные эритроциты, треугольные эритроциты, деформированные эритроциты)
Наличие признаков гемолиза (снижение уровня гемоглобина, полихромазия, повышенное количество ретикулоцитов, повышенный уровень ЛДГ и билирубина, снижение гаптоглобина)
Отрицательный результат прямого антиглобулинового теста;
Нормальная активность ADAMTS13
Этиологическая диагностика
У детей с диареей, а также у взрослых, которые имеют продромальные признаки геморрагического поноса, проводится анализ стула (иммуноферментный анализ на шига-токсины (Shiga) или специальные культуральные среды для E. coli O157:H7); однако, к моменту взятия анализа организм пациента может очиститься от микроорганизмов и токсинов.
В нетипичных случаях, то есть пациентам, у которых не было предшествующей инфекции или у которых возник рецидив заболевания, рекомендуется провести тестирование на мутации гена фактора комплемента
Лечение ГУС
Поддерживающая терапия, часто включая гемодиализ
Для случаев, связанных с нарушением регуляции комплемента, иногда экулизумаб или равулизумаб
Типичный, связанный с диареей гемолитико-уретический синдром у детей, вызванный энтерогеморрагической инфекцией, обычно самопроизвольно прекращается и лечится с помощью поддерживающей терапии, антибиотики не применяются. Более половины пациентов нуждаются в почечном диализе. В отличии от тромботической тромбоцитопенической пурпуры, не используют замещение плазмы и кортикостероиды.
У больных с формой ГУС, вызванной дисрегуляцией системы комплемента, ингибиция комплемента экулизумабом или равулизумабом иногда может обратить почечную недостаточность. Дети с известным или предполагаемым наследственным дефицитом комплемент- регулирующих белков, таких как фактор H, особенно склонны реагировать на экулизумаб или равулизумаб.
Основные положения
Тромбоциты и эритроциты разрушаются неиммунологически, что приводит к тромбоцитопении и анемии; у детей часто встречается почечная недостаточность, а у взрослых – гемолитико-уремический синдром (ГУС).
Причина геморрагического колита у детей, как правило, связана с шига-токсином (Shiga) продуцирующими бактериями.
Менее распространенные причины включают нарушение регуляции комплемента из-за множества наследственных и приобретенных причин
Типичный ассоциированный с диареей гемолитико-уремический синдром у детей обычно спонтанно проходит с поддерживающей терапией, хотя более половине заболевших детей требуется гемодиализ.
Комплемент-опосредованный ГУС может реагировать на ингибирование комплемента с помощью экулизумаба или равулизумаба
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
