Генетика лимфобластного лейкоза. Дифференциальный диагноз лимфобластных лимфом.
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Заболеваемость лейкозами высока в развитых странах, в частности, среди белого населения США (мужчины – 11, женщины – 7), на Гавайских островах (мужчины – 11, женщины – 7), Австралии (Квинсленд: мужчины – 12, женщины – 8), Европе (Италия, Варезе: мужчины – 10, женщины – 6), среди евреев Израиля (мужчины – 9, женщины – 6) и низка в большинстве стран Азии (Китай, Шанхай: мужчины – 5, женщины – 4) и Африки (Зимбабве: мужчины – 3, женщины – 3). В России заболеваемость лейкозом достаточно высока (Санкт-Петербург: мужчины – 9, женщины – 5)
Высокая смертность от лейкозов отмечается в Восточной Европе, в частности, в Венгрии (мужчины – 8, женщины – 5), Чехии (мужчины – 7, женщины – 4), Словакии (мужчины – 7, женщины – 4), США (мужнины – 7, женщины – 4), Израиле (мужчины – 7, женщины – 5), В России смертность от лейкозов равна 5 и 4 среди мужчин и женщин соответственна. Показатели смертности ниже в Китае (мужчины - 3, женщины - 2), Японии (мужчины - 4, женщины - 3)
Заболеваемость лейкозами за последние годы стабилизировалась, в некоторых же странах наблюдается ее небольшой рост. Выраженное снижение смертности отмечается для детских лейкозов. Смертность от лейкозов снижается и у взрослых, однако эта тенденция снижения среди взрослых значительно скромнее, чем у детей. Смертность от лейкозов растет среди пожилых людей. Лимфоидный лейкоз составляет около 50%, а миелоидные – 43% всех форм лейкозов. Около 2% составляют моноцитарный и волосатоклеточный лейкоз
Лимфоидным лейкозом (С91) чаще болеют в развитых странах, в Канаде (мужчины – 6, женщины – 4), США (белое население: мужчины – 6, женщины – 3), Израиле (евреи: мужчины – 6, женщины – 2). В Италии и Испании заболеваемость среди мужчин варьирует в пределах 5-9, а среди женщин между 2 и 6. Высокая заболеваемость регистрируется и в других европейских странах, и в Австралии. Заболеваемость низка в Африке (Зимбабве: мужчины – 1, женщины – 1) и Азии (Китай, Шанхай: мужчины – 2, женщины – 1)
Острый, лимфоидный лейкоз (ALL/ОЛЛ) занимает первое место в структуре злокачественных опухолей у детей (30-40%) и составляет не более 5% всех лейкозов у взрослых. Пика заболеваемость ALL достигает у детей в возрасте 2-4 лет. Чаще болеют мальчики, чем девочки. Самая низкая заболеваемость отмечается с 25 до 59 лет. Второй, менее выраженный пик заболеваемости наблюдается в пожилом возрасте
Смертность от ALL среди детей снижается практически во всех развитых странах. Это снижение происходит на фоне роста заболеваемости и объясняется значительным успехом в лечении ALL
Хронический лимфоидный лейкоз (CLL) чаще встречается у пожилых людей в США, Канаде и других развитых странах и редко – в Японии и Китае, а также в Африке. Разницу в заболеваемости CLL (более чем в 30 раз), скорее всего, можно объяснить проблемами, связанными с дифференциальной диагностикой и, соответственно, с недоучетом этой патологии в развивающихся странах. CLL редко встречается до 30. лет. Однако после этого возраста наблюдается рост заболеваемости, которая достигает максимума в 70-80 лет. Мужчины болеют чаще, чем женщины
После выраженного роста заболеваемости CLL в течение первых двух десятилетий второй половины прошлого века заболеваемость и смертность стали снижаться, и эта тенденция продолжается и сейчас
Миелоидным лейкозом (С92-С94) чаще болеют в развитых странах. Высокая заболеваемость отмечается среди белого (мужчины – 5, женщины – 3) и чернокожего населения (мужчины – 4, женщины – 3) США, в Канаде (мужчины – 4, женщины '– 3), в странах Западной Европы – в Италии (Варезе: мужчины – 5,.женщины – 3), Франции (Изер: мужчины – 4, женщины – 3); Австралии (Квинсленд: мужчины – 6, женщины – 4). Заболеваемость миелоидным лейкозом низка в Африке (Зимбабве: мужчины – 1, женщины – 2) и Азии (Китай, Шанхай: мужчины – 2, женщины – 2)
Острый миелоидный лейкоз (AML) составляет 15-25% всех лейкозов у детей и 20-40%.у детей в возрасте до 4 лет. Разницу в заболеваемости AML в разных странах трудно оценить ввиду проблем, связанных с дифференциальной диагностикой и, соответственно, возможным недоучетом этого заболевания. Небольшой пик заболеваемости AML достигается в 5 лет, после чего наблюдается ее снижение. После 10 Лет частота AML начинает расти и достигает максимума в возрасте 70-80 лет. Среди пожилых людей (старше 60 лет) AML чаще болеют мужчины, чем женщины. В раннем возрасте заболеваемость AML среди мужчин и женщин примерно одинаковая
В течение первых двух десятилетий второй половины прошлого века наблюдался рост заболеваемости и смертности од AML. Однако с начала 70-х гг. показатели заболеваемости и смертности стабилизировались
Хронический миелоидный лейкоз (CML) встречается практически с одинаковой частотой в разных частях света. Он составляет не более 1-3% всех лейкозов у детей. С увеличением возраста заболеваемость растет и достигает максимума у пожилых людей. CLL чаще болеют мужчины, чем женщины. Заболеваемость и смертность от CML остается без изменений в большинстве регионов мира
В США 5-летняя выживаемость для всех форм лейкозов равна 39 и 38% среди белых мужчин и женщин и 30 и 31% среди черных мужчин и женщин соответственно. В Западной Европе 5 лет выживают 27%, а в развивающихся, странах – около 15% больных лейкозом. Выживаемость значительно улучшилась у детей, больных ALL. В начале 60-х годов прошлого века в США 5-летняя выживаемость составляла не более 4%. К концу 80-х гг. 5-летняя выживаемость детей, больных ALL, составила 72%. За тот же период 5-летняя выживаемость детей, больных AML, выросла с 3 до 31%. Однако выживаемость среди взрослых, больных AML, остается без изменений. 5-летняя выживаемость CLL остается без изменений и составляет 30-70%, в зависимости от стадии заболевания
Основными доказанными факторами риска лейкозов, которые классифицированы МАИР как канцерогенные для человека, являются ионизирующее излучение, контакт на производстве с бензолом и другими растворителями и курение
Кроме того, риск возникновения лейкозов достоверно повышен у рабочих, занятых на производстве резины и обуви. Резиновая и обувная промышленность отнесена МАИР к 1 группе факторов, канцерогенность которых для человека доказана. Важную роль в этиологии лейкозов, скорее всего, играют онкогенные вирусы
В начале XX в. был отмечен рост заболеваемости лейкозами у врачей-рентгенологов. Однако в последующих когортах рентгенологов рост смертности от лейкозов не был выявлен. Наблюдение за 93000 жителей Хиросимы и Нагасаки, которые пережили атомную бомбардировку, выявило повышение риска лейкозов, связанное с дозой радиации 0,4 Гр и выше. Максимума риск достигал у получивших 3–4 Гр. Повышение риска было отмечено для всех форм лейкозов, кроме CLL. Результаты эпидемиологического изучения заболеваемости и смертности от лейкозов в результате наземных испытаний атомного оружия в штате Невада (США) противоречивы. Противоречивые результаты получены и в отношении участников испытаний ядерного оружия. Не отмечено и повышения заболеваемости и смертности от лейкозов в связи с аварией на Чернобыльской АЭС. В некоторых эпидемиологических исследованиях было выявлено повышение смертности от лейкозов (кроме CLL) у работников ядерных предприятий. Однако эти результаты не были подтверждены в большинстве других исследований. Кроме того, риск лейкозов не был повышен среди работников урановых рудников, испытывающих воздействие больших доз радона. Лучевая терапия некоторых заболеваний и, в первую очередь, злокачественных опухолей также повышает риск развития лейкоза. У больных, получавших лучевую терапию по поводу рака шейки матки, молочной железы и лимфогранулематоза, заболеваемость острым миелобластным лейкозом выше ожидаемой
У больных, которые получали противоопухолевую терапию алкилирующими препаратами, также повышен риск острого миелобластного лейкоза. ОР повышен в 10-300 раз у больных, которые получали алкилирующие препараты по поводу различных лимфопролиферативных заболеваний, лимфом, лимфогранулематоза. Риск развития лейкоза повышен и у больных с солидными опухолями, которые получали алкилирующие препараты. Однако показатели ОР риска у них значительно ниже
Контакт на рабочем месте с бензолом у работников обувной, резиновой, кожевенной, химической, нефтеперерабатывающей промышленности, среди маляров и профессиональных водителей связан с достоверным 3-6-кратным повышением смертности от острого лейкоза и более чем 10-кратным повышением риска развития острого миелоидного лейкоза. Риск лейкозов повышен у фермеров, ветеринаров, работников птицеферм и боен, т.е. представителей профессий, которые имеют контакт с пестицидами, гербицидами, минеральными удобрениями, а также, возможно, с вирусами. Выброс в окружающую среду диоксина в итальянском городе Севесо привел к повышению заболеваемости и смертности от миелоидного лейкоза среди мужского населения. Несколько эпидемиологических исследований указывают на повышенный риск лейкозов у рабочих, занятых на производстве стирола и бутадиена
Большое количество работ указывают на связь между профессией родителей и риском развития лейкозов у детей. Повышенный риск лейкозов, особенно ALL, был выявлен у детей, родители которых работают в химической, резиновой, металлургической, текстильной промышленности или экспонированы на рабочем месте ПАУ, бензолу, растворителям и радиации
Риск острого миелоидного лейкоза повышен до 2 раз у рабочих, экспонированных на рабочем месте к электромагнитному излучению. На основании нескольких эпидемиологических исследований можно заключить, что близость места жительства к высоковольтным линиям приводит к небольшому увеличению риска лейкоза у детей, но это относится лишь к линиям большой мощности
В большинстве эпидемиологических исследований, изучавших роль курения в этиологии лейкозов, показано, что курение повышает риск развития острого миелоидного лейкоза, и это заболевание пополнило длинный список злокачественных опухолей, связанных с курением. На основании оценки риска американские ученые заключили, что 31% всех случаев острого миелоидного лейкоза в США вызваны курением
В литературе описаны семейные формы лейкозов. Заболевание лейкозом в детском возрасте – один из компонентов синдрома семейного рака Ли – Фраумени. Описаны семьи, в которых лейкозами (чаще хроническим лимфоидным) болеют братья и сестры, реже – родители и дети. Острым лимфобластным лейкозом часто болеют однояйцовые близнецы, причем, они заболевают в возрасте до 1 года. Риск развития острого лейкоза в 20-30 раз Повышен у детей с синдромом Дауна. Повышенный риск заболеть лейкозом также связан с наличием таких редких генетических синдромов, как синдром Клайнфелътера (XXY), атаксия-телангиэктазия, анемия Фанкони, синдром Блюма и нейрофиброматоз. Повышенный риск лейкозов связан с терминальными нарушениями в хромосомах. Например, риск хронического миелоидного лейкоза связан с наличием филадельфийской хромосомы
Т-клеточный лейкоз взрослых. В эпидемических по инфицированности HTLV-1 регионах отмечается высокая заболеваемость Т-клеточным лейкозом взрослых (Adult T-cell leukaemia/lymphoma – ATLL). Дескриптивные эпидемиологические исследования выявили кластеры с высокой заболеваемостью ATLL в Японии, Экваториальной Африке и Центральной Америке, которые совпадали с районами, эндемическими по HTLV-I. Сероэпидемиологические исследования показали, что 90% больных ATLL серопозитивны к HTLV-1
В Японии ATLL заболевают 0,6-1,5 на 1000 HTLV-1-инфицированных в возрасте 40-59 лет. Кумулятивный риск заболеть ATLL в течение жизни у HTLV-I-носителей равен 1-5%
Роль HTLV-I в этиологии ATLL подтверждена в аналитических эпидемиологических исследованиях. Когортные исследования HTLV-1-но-сителей, проведенные в Японии, показали, что смертность от ATLL среди HTLV-I-положительных мужчин равна 68,1, а среди женщин – 35,8 на 100 тыс. населения, в то время как ожидаемая смертность среди HTLV-I-отрицательных крайне низка
Исследования методом "случай-контроль", проведенные в Японии, Ямайке, Бразилии, Тринидаде и Тобаго, показали, что в эпидемических районах до 100% всех больных ATLL HTLV-I серопозитивны. Процент серопозитивных больных ATLL также очень высок (>90%) в неэндемических регионах, в то время как частота HTLV-I носительства среди контрольной популяции не превышает в неэндемических районах 1%, а в эндемических регионах – 8%. Процент HTLV-I положительных больных значительно ниже и при других формах Т-клеточных лимфом (3-52%) и других лимфомах (3-25%)
Инфицированность HTLV-I в младенческом и детском возрасте, при которой вирус, скорее всего, передается с молоком матери, по-видимому, играет важную роль в патогенезе ATLL. Серологическое обследование матерей, имеющих детей, больных ATLL и другими формами лимфом, проведенное в Японии, на Ямайке и в Тринидаде, показало, что все без исключения матери больных ATLL HTLV-1-положительны, в то время как среди матерей больных другими формами лимфом HTLV-1-инфи-цированности не выявлялось
Генетика лимфобластного лейкоза. Дифференциальный диагноз лимфобластных лимфом.
Генетика лимфобластного лейкоза. Дифференциальный диагноз лимфобластных лимфом.
Т-лимфобластный лейкоз/лимфома обычно проявляет клональную перегруппиронку одного или более генов Т-клеточного рецептора. Однако поскольку эти изменения с высокой частотой встречаются при В-лимфобластном лейкозе/лимф оме, они не являются специфичными при определении происхождения опухоли. Примерно в 1/3 случаев выявляются транслокации между одним из генов Т-клеточного рецептора и рядом онкогенов.
Утрата 9р встречается приблизительно в 1/3 случаев, что приводит к утрате гена супрессии опухолей CDKNZA. Ген TAL-I, участвующий в контроле гематопоэтического роста, в 25 % случаев дизрегулируется делециями к его регуляторной области.
Несмотря на различные клинические проявления, морфологически Т-лимфобластная лимфома и В-лимфобластная лимфома не различимы. Для них характерно также перекрытие иммуногистохимических профилей со слабой экспрессией CD79a многими Т-лимфобластными лимфомами. Наиболее достоверным отличительным маркером является CD3, экспрессируемый только Т-лимфобластной лимфомой.
На Т-лимфобластную лимфому может быть похож редко встречающийся вариант лимфоидного бластного криза при миелоидном лейкозе. Эти случаи связаны с t(8:13) (p11.2; q11—22). Морфологически инфильтрат похож на лимфобластную лимфому, но содержит также гранулированные промиелоциты и миелоциты.
Таким образом, проявления похожи на миелоидную саркому; исключение составляют случаи, при которых выявляется экспрессия CD3 нсгранулированными бластными клетками. В большинстве случаев заболевание прогрессирует с развитием острого миелоидного лейкоза.
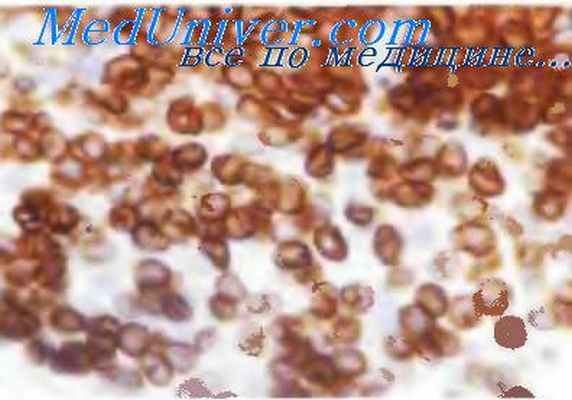
Лифома из зрелых B-клеток.
Зрелые клетки отличаются способностью синтезировать, экс премировать и иногда секретировать молекулы иммуно1лобулина. Значительное разнообразие этих молекул достигается перегруппироккой («тасованием») констант, соединений, разнообразием и вариабельностью областей генов иммуноглобулинов. Дальнейшая модификация происходит в центрах фолликулов за счет соматической мутации генов различных областей.
Таким образом, на генетическом уровне зрелые В-клетки характеризуются наличием измененных генов иммуноглобулинов. В клетках фолликулярнот центра и постфолликулярного центра мутированные гены выявляются в различных областях.
Для зрелых В-клеточных лимфом характерна клональная перегруппировка генов иммуноглобулинов. При возникновении же лимфомы на постфолликулярной стадии развития В-клеток также определяются мутации вариабельной области (гены V-области). В опухолях, развивающихся на стадии формирования центра размножения фолликулов, в
В-клетках отмечаются продолжающиеся мутации генов V-области (т. е. множественные мутации в пределах одного клона). Анализ генов иммуноглобулинон является надежным методом идентификации и подразделения зрелых В-клеточных лимфом.
В-клеточные лимфомы можно разделить на лимфомы с низкой степенью роста (хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома — CLL/SLL, лимфоплазмоцитарная лимфома, лимфома из клеток мантийной зоны, тимфома из клеток маргинальной зоны и фолликулярная лимфома) и лимфомы с высокой степенью роста (диффузная крупноклеточная В-лимфома и лимфома Беркитта) Лимфомы с низкой степенью роста часю трансформируются в лимфомы с высокой долей роста.
В лимфомах с низкой степенью роста определяются повреждения в генах, контролирующих апоптоз, в то время как в лимфомах с кысокой долей роста имеют место аномалии генов, вызывающие нарушение контроля пролиферации (Sanchez-Beato и соавт., 2003).
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ГЕТЕРОГЕННОСТЬ В-КЛЕТОЧНОГО ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА (BIV-ИММУНОВАРИАНТ) У ДЕТЕЙ
Введение. При иммунофенотипировании признаком наиболее зрелой формы В-линейного острого лимфобластного лейкоза (BIV-ОЛЛ) является поверхностная экспрессия молекулы иммуноглобулина. Она обнаруживается преимущественно при лимфоме Беркитта (ЛБ), и врачи в этом случае обычно начинают лечение по протоколам, разработанным для терапии зрелоклеточных лимфом. Однако результаты многочисленных клинических наблюдений показывают, что в редких случаях поверхностная экспрессия легких цепей иммуноглобулинов или иммуноглобулина M выявляется на клетках, не имеющих дополнительных признаков зрелой лимфомы.
Цель исследования – оценить гетерогенность острых лимфобластных лейкозов (ОЛЛ) с поверхностной экспрессией легких и тяжелых цепей иммуноглобулинов и степень ассоциации BIV-иммунофенотипа бластных клеток с ЛБ и другими лимфомами у детей.
Материалы и методы. Проанализированы результаты иммунофенотипирования, цитогенетического и морфологического анализа клеток 54 пациентов, у которых был выявлен зрелый В-клеточный иммунофенотип.
Результаты. Клинико-морфологический диагноз ЛБ был поставлен 39 из 54 пациентов, в то время как остальные 15 пациентов по совокупности признаков были отнесены к группе с ОЛЛ из В-линейных предшественников (ВП-ОЛЛ). Все пациенты, у которых была диагностирована ЛБ, имели 1 из вариантов перестройки гена C-MYC: t(8;14)(q24;q32), t(8;22)(q24;q11) или t(2;8)(p22;q23). В группе ВП-ОЛЛ эти перестройки не выявлены, однако у 8 пациентов имелись перестройки гена KMT2A, которые, в свою очередь, не определены ни в одном случае при ЛБ. У остальных пациентов группы ВП-ОЛЛ специфические перестройки не обнаружены. Пациенты с ВП-ОЛЛ не имели L3-морфологии бластов, характерной для ЛБ. Морфология L1/L2 также детектировалась у 2 пациентов с диагнозом ЛБ.
Заключение. Группа пациентов с детектированным поверхностным IgM на бластных клетках достаточно гетерогенна и включает не только ЛБ, но и редкие случаи ВП-ОЛЛ, в том числе с перестройками в KMT2А. При проведении дифференциальной диагностики только сочетание цитоморфологических, иммунофенотипических и молекулярно-генетических признаков может дать возможность точно дифференцировать ЛБ от ВП-ОЛЛ и выбрать правильную тактику ведения пациента.
Ключевые слова
Об авторах
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ГБУЗ Свердловской области Областная детская клиническая больница № 1; ГАУЗ Свердловской области Центр специализированных видов медицинской помощи, Институт медицинских клеточных технологий
Россия
620149 Екатеринбург, ул. Серафимы Дерябиной, 32; 620026 Екатеринбург, ул. Карла Маркса, 22, корп. А
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
119571 Москва, Ленинский просп., 117
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ГБУЗ Свердловской области Областная детская клиническая больница № 1; ГАУЗ Свердловской области Центр специализированных видов медицинской помощи, Институт медицинских клеточных технологий
Россия
620149 Екатеринбург, ул. Серафимы Дерябиной, 32; 620026 Екатеринбург, ул. Карла Маркса, 22, корп. А
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
197022 Санкт-Петербург, ул. Л. Толстого, 6–8
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
197022 Санкт-Петербург, ул. Л. Толстого, 6–8
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России; Ариэльский университет
Израиль
Кафедра молекулярной биологии факультета естественных наук Ар.У; 197022 Санкт-Петербург, ул. Л. Толстого, 6–8
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ГБУЗ Свердловской области Областная детская клиническая больница № 1; ГАУЗ Свердловской области Центр специализированных видов медицинской помощи, Институт медицинских клеточных технологий
Россия
620149 Екатеринбург, ул. Серафимы Дерябиной, 32; 620026 Екатеринбург, ул. Карла Маркса, 22, корп. А
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
117997 Москва, ГСП-7, ул. Саморы Машела, 1
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России
Россия
Александр Михайлович Попов.
117997 Москва, ГСП-7, ул. Саморы Машела, 1
Список литературы
1. Bene M., Castoldi G., Knapp W. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia 1995;9(10):1783–6. PMID: 7564526.
2. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Eds. Swerdlow S., Campo E., Harris N.L. et al. Lyon, France: IARC, 2008. P. 262–264.
3. Kansal R., Deeb G., Barcos M. et al. Precursor B lymphoblastic leukemia with surface light chain immunoglobulin restriction: A report of 15 patients. Am J Clin Pathol 2004;121(4):512–25. DOI: 10.1309/WTXC-Q5NR-ACVX-TYBY. PMID: 15080303.
4. Li S., Lew G. Is B-lineage acute lymphoblastic leukemia with a mature phenotype and L1 morphology a precursor B-lymphoblastic leukemia/lymphoma or Burkitt leukemia/lymphoma? Arch Pathol Lab Med 2003;127(10):1340–4. DOI: 10.1043/1543-216(2003)1272.0.CO;2. PMID: 14521459.
5. Tsao L., Draoua H.Y., Osunkwo I. et al. Mature B-cell acute lymphoblastic leukemia with t(9;11) translocation: A distinct subset of B-cell acute lymphoblastic leukemia. Mod Pathol 2004;17(7):832–9. DOI: 10.1038/modpathol.3800128. PMID: 15098014.
6. Dworzak M.N., Buldini B., Gaipa G. et al. AIEOP-BFM consensus guidelines 2016 for flow cytometric immunophenotyping of Pediatric acute lymphoblastic leukemia. Cytometry B Clin Cytom 2017. [Epub ahead of print]. DOI: 10.1002/cyto.b.21518. PMID: 28187514.
7. Creutzig U., van den Heuvel-Eibrink M.M., Gibson B. et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood 2012;120(16):3187–205. DOI: 10.1182/blood-2012-03-362608. PMID: 22879540.
9. Frater J.L., Batanian J.R., O’Connor D.M., Grosso L.E. Lymphoblastic leukemia with mature B-cell phenotype in infancy. J Pediatr Hematol Oncol 2004;26(10): 672–7. DOI: 10.1097/01.mph.0000142493.56793.cb. PMID: 15454841.
10. Blin N., Méchinaud F., Talmant P. et al. Mature B-cell lymphoblastic leukemia with MLL rearrangement: an uncommon and distinct subset of childhood acute leukemia. Leukemia 2008;22(5):1056–9. DOI: 10.1038/sj.leu.2404992. PMID: 18007578.
11. Kim B., Lee S.-T., Kim H.J. et al. Acute lymphoblastic leukemia with mature B-cell phenotype and t(9;11;11)(p22;q23; p11.2): a case study and literature review. Ann Lab Med 2014;34(2):166–9. DOI: 10.3343/alm.2014.34.2.166. PMID: 24624357.
12. Krivtsov A.V., Armstrong S.A. MLL translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer 2007;7(11):823–33. DOI: 10.1038/nrc2253. PMID: 17957188.
13. Van Eys J., Pullen J., Head D. et al. The French-American-British (FAB) classification of leukemia: the Pediatric Oncology Group experience with lymphocytic leukemia. Cancer 1986;57(5):1046–51. PMID: 3484662.
14. Finlay J.L., Borcherding W. Acute B-lymphocytic leukemia with L1 morphology: a report of two pediatric cases. Leukemia 1988;2(1):60–2. PMID: 3123810.
16. Angi M., Kamath V., Yuvarani S. et al. The t(8;14)(q24.1;q32) and its variant translocations: A study of 34 cases. Hematol Oncol Stem Cell Ther 2017;10(3):126–34. DOI: 10.1016/j.hemonc.2017.03.002. PMID: 28390216.
Рецензия
Для цитирования:
For citation:
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Генетика лимфобластного лейкоза. Дифференциальный диагноз лимфобластных лимфом.
Острый лимфобластный лейкоз\лимфома (ОЛЛ)– опухолевая болезнь крови, при которой появляются быстро размножающиеся лимфоидные клетки-бласты. (О клетках-бластах мы уже рассказали в главе «Острый лейкоз».)
Симптомы острого лимфобластного лейкоза очень разнообразны. Часто пациент жалуется на слабость, ночную потливость, «ломоту» во всем теле, сильную головную боль; бывают и другие жалобы. При обследовании врач обнаруживает, что у пациента могут быть увеличены печень, селезенка, лимфатические узлы и есть опухолевые клетки-бласты в анализе крови.
Диагноз
Чтобы поставить диагноз, необходимо сделать анализ крови или костного мозга, который называется «проточная цитометрия бластов». Если у пациента есть увеличенные лимфатические узлы, то чтобы поставить диагноз берут его фрагмент для морфологического и и иммуногистохимического исследования. Если заболевание проявляется только увеличением лимфатических узлов, то врачи называют данное состояние «лимфобластной лимфомой». Если же у пациента опухолевые клетки находят в костном мозге, то ставят диагноз «острый лимфобластный лейкоз». Когда врач-морфолог выдает заключение по результатам исследования лимфатического узла, то диагноз он пишет иногда через косую черту, указывая оба заболевания. Это допустимо потому, что прогноз и лечение у этих заболеваний одинаковые. Более точный диагноз ставит лечащий врач на основании всей полноты анализов пациента.
В медицинских документах, записывая диагноз, врачи указывают из каких клеток происходит данный лейкоз (В- или Т-клеточный). Диагноз «лейкоз» сам по себе очень серьезен, но исключительно важными признаками, предсказывающими течение болезни, являются генетические поломки в опухолевых клетках. Их наблюдают и описывают врачи-цитогенетики во время цитогенетического исследования.
Лечение
Лимфобластные лейкозы лечат химиотерапией. Ее можно разделить на 3 этапа: это индукция, консолидация и поддержка. Результатом индукционного этапа должен стать полный ответ (полная ремиссия), то есть можно сказать, что пациент стал «временно здоров». Это означает, что подавляющее большинство опухолевых клеток погибло, самочувствие больного значительно улучшилось, но осталось немного «спящих» опухолевых клеток, поэтому лечение нужно продолжать. Если полный ответ достигнут, то следующий этап называется «консолидация», или закрепление достигнутого результата. Как правило, консолидирущую, или «закрепительную», химиотерапию пациент переносит лучше, хотя состоит она из больших доз химиопрепаратов. В дальнейшем отдельным больным проводят несколько курсов поддерживающей терапии, чтобы небольшими дозами химиопрепаратов уничтожить оставшиеся опухолевые клетки. Несмотря на то, что чаще всего на начальных этапах химиотерапия действует хорошо и большинство пациентов достигают полного ответа, к некоторым пациентам болезнь возвращается, и у таких больных развивается рецидив. Если риск рецидива высок, то чтобы его избежать, молодым пациентам проводят пересадку стволовых клеток крови. Отметим, что, когда в крупных городах России открыли центры трансплантации стволовых клеток крови, результаты лечения наших пациентов значительно улучшились. Они стали такими же, как в гематологических центрах Северной Америки и Европы.
Особенности морфологического исследования лимфом в соответствии с положениями классификации ВОЗ
Авторы: С.М. КУЛИШ, г. Чернигов
Версия для печати
С.М. КУЛИШ, г. Чернигов
Злокачественные лимфомы представляют собой гетерогенную группу опухолей, возникающих из различных типов клеток лимфоидной ткани, которые в норме находятся в лимфоидных органах (лимфатические узлы, миндалины, селезенка, тимус). В то же время лимфомы могут возникать в других органах, таких как мозг, желудок, слюнные железы, матка (экстранодальные лимфомы). Отдельное место занимают MALT-лимфомы — лимфомы, связанные со слизистой оболочкой желудочно-кишечного тракта. Среди злокачественных новообразований лимфомы занимают 5-е место по частоте после рака молочной железы, предстательной железы, легкого и толстой кишки. По данным Национального ракового регистра, в Украине в 1998 г. заболеваемость лимфомами на 10 000 населения составляла 7,5 у взрослых и 2,0 у детей. Лимфомы относятся к тем немногим формам опухолей, смертность от которых во всем мире в последние три десятилетия продолжает неуклонно повышаться. Уровень 5-летней выживаемости взрослых больных с лимфомами, по данным Национального ракового института (США), составляет немногим более 50 %.
Все злокачественные лимфомы принято делить на две большие группы: ходжкинские (болезнь Ходжкина, лимфогранулематоз) и неходжкинские. Диагноз лимфомы должен основываться на гистологическом и иммуногистохимическом исследовании биоптата, полученного при эксцизионной или инцизионной биопсии лимфатического узла или материала из экстранодальных очагов поражения. Результаты исследования срезов, окрашенных гематоксилин-эозином или по Романовскому — Гимзе, позволяют определить вид новообразования, характер роста (узловатый или диффузный), провести дифференциацию с доброкачественными реактивно-гиперпластическими изменениями, метастазами низкодифференцированных опухолей и другими патологическими процессами, а также отнести исследуемую опухоль лимфоидной ткани к одной из групп лимфом, объединенных выраженным морфологическим сходством. В то же время специфичность рутинных гистологических методов для дифференциальной диагностики внутри групп морфологически сходных лимфом в большинстве случаев недостаточна. Иммуногистохимическое исследование опухолей лимфоидной ткани является методом выбора при необходимости дифференциальной диагностики опухолей с выраженным сходством гистологического строения. С целью дифференциальной диагностики необходимо выбрать рациональный состав панели иммунологических маркеров (антител), позволяющий различить гистологически сходные варианты лимфом между собой. Общие принципы иммуногистохимического исследования в диагностике лимфом предусматривают применение в каждом случае панели антител (набор, составленный в соответствии с диагностической гипотезой, возникшей в результате рутинного гистологического исследования биоптата), а не одного какого-либо антитела, и учет комбинации позитивных и негативных результатов реакции в соответствии с известной информацией о морфологическом строении опухоли и иммунофенотипе опухолевых клеток.
При выделении отдельных форм и вариантов злокачественных лимфом полезным является цитологическое изучение отпечатков удаленных лимфатических узлов. Уточнение гистогенеза неходжкинских злокачественных лимфом (НЗЛ) и различных гистологических вариантов лимфогранулематоза (ЛГМ) возможно на основе комплексного применения гистохимических, иммуноцитохимических реакций, методов молекулярно-генетического анализа.
Классификация лимфом в своем развитии эволюционировала от чисто морфологической в комбинации с прогностическими факторами до современной, которая интегрировала в себе не только морфологические критерии, но также и иммуногистохимические и молекулярно-цитогинетеческие данные. Первой клинически значимой следует, видимо, считать классификацию НЗЛ, предложенную М. Rappaport. В этой классификации, основанной на описательных морфологических признаках, учитывался характер роста (нодулярный или диффузный) и цитологические особенности клеток новообразования (низко- и высокодифференцированные лимфоцитарные, гистиоцитарные, из лимфоидных бластов).
Из появившихся в дальнейшем других гистологических классификаций НЗЛ следует отметить Британскую (1973), классификацию Lukes — Collins (1974), Кильскую (1974), первую классификацию ВОЗ (1976), разработанную G. Mathe и М. Rappaport, подготовленную в 1982 г. международной группой экспертов из национального института рака так называемую Рабочую классификацию (Working Formulation) злокачественных лимфом для практического применения.
В практической деятельности специалистов европейских стран широкое признание получила усовершенствованная Кильская классификация. В США для выделения отдельных форм злокачественных лимфом с учетом степени их злокачественности (низкая, промежуточная, высокая) чаще применялась Working Formulation.
Со временем возникла необходимость в пересмотре и уточнении некоторых устоявшихся положений. Выделение новых, прежде неизвестных нозологических форм, вариантов и подвариантов опухолевых заболеваний лимфоидной ткани, совершенствование их диагностики стало возможным на основе новейших технологий, использования последних достижений клеточной иммунологии и молекулярной биологии.
В 1994 г. специалистами, входившими в Международную группу по изучению НЗЛ, была представлена Пересмотренная Европейско-Американская классификация лимфоидных новообразований (REAL classification), в которой был отражен опыт изучения опухолей с нодулярным и диффузным характером роста с использованием морфологических, иммуногистохимических и молекулярно-генетических методов с учетом клинического течения. После надлежащей апробации и внесения необходимых уточнений она стала одним из основных разделов новой классификации ВОЗ опухолевых заболеваний кроветворной и лимфоидной тканей, включающей также миелоидные, гистиоцитарные новообразования и опухоли, возникающие из тучных клеток. Основной принцип предлагаемой классификации состоит в том, что она должна стать стандартом для распознавания нозологических форм и их вариантов, которые имели бы клиническую значимость. Выделение отдельных форм заболевания производится с учетом анализа комбинации морфологических, иммунофенотипических, генетических признаков и клинических данных. В максимально возможной степени должен быть уточнен гистогенез новообразований с учетом исходных нормальных клеток-аналогов. В большинстве типичных случаев НЗЛ диагноз может быть установлен опытным специалистом, хорошо знающим основы и принципы существующих классификаций, на основе изучения рутинных гистологических срезов. Иммунофенотипирование помогает в случаях сложной диагностики, например, когда возникает необходимость отличить доброкачественные лимфоидные инфильтраты (при реактивной гиперплазии лимфатических узлов) от наиболее часто встречающихся неходжкинских злокачественных фолликулярных лимфом. Результаты иммуноцитохимических исследований позволяют также дифференцировать лимфоидные и нелимфоидные новообразования (рак, меланома, саркома, герминогенные опухоли) и метастатические поражения лимфатических узлов; проводить уточненную субклассификацию НЗЛ. В последнем случае предполагается использование результатов иммуноцитохимического исследования для выделения Т- и В-клеточных лимфом; разграничения лимфобластных лимфом, возникающих из лимфоидных клеток-предшественников, и новообразований из зрелых Т- и В-лимфоцитов; субклассификации лимфом из малых В-лимфоцитов (из клеток зародышевых центров лимфоидных фолликулов, клеток мантийной и маргинальной зоны); дифференциации некоторых форм НЗЛ и ЛГМ.
Таким образом, диагноз НЗЛ у большинства больных может быть установлен на основе гистологического и иммуногистохимического исследования. Проведение молекулярно-генетических исследований, которое может оказаться чрезвычайно полезным, необходимо менее чем в 5 % случаев.
Классификация лимфоидных новообразований, предлагаемая ВОЗ
ОПУХОЛИ ИЗ В-КЛЕТОК
— Опухоли из В-клеток-предшественников.
– Лимфобластный лейкоз / лимфома из В-клеток-предшественников.
— Опухоли из зрелых (периферических) В-клеток.
– В-клеточный хронический лимфолейкоз/лимфома из малых лимфоцитов.
– В-клеточный пролимфоцитарный лейкоз.
– В-клеточная лимфома маргинальной зоны селезенки (± ворсинчатые лимфоциты).
Читайте также:
