Генетика нарушений обмена витаминов (кофакторов). Наследование
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Генетический полиморфизм, ассоциированный с риском развития нарушений обмена гомоцистеина (фолатный цикл)
Фолиевая кислота – водорастворимый витамин B9, необходимый для роста и развития кровеносной и иммунной систем. Недостаток фолиевой кислоты может вызвать мегалобластную анемию у взрослых, а при беременности повышает риск развития дефектов нервной
трубки. Производные фолиевой кислоты называются фолатами. Животные и человек не синтезируют фолиевую кислоту, получая ее в основном вместе с пищей. Фолиевая кислота в больших количествах содержится в зеленых овощах с листьями, бобовых, в хлебе из муки грубого помола, дрожжах, печени. Во многих странах законодательство обязывает производителей мучных продуктов обогащать зерна фолиевой кислотой.
Группа соединений фолатов играет ведущую роль в широком спектре жизненно важных процессов:
- стимулирует эритропоэз;
- участвует в синтезе аминокислот, нуклеиновых кислот, пуринов, пиримидинов, витаминов;
- участвует в обмене холина, гистидина;
- является важным сопутствующим фактором в метилировании ДНК и РНК;
- способствует регенерации мышечной ткани;
- влияет на развитие быстрорастущих тканей (кожа, оболочки желудочно-кишечного тракта,
- костный мозг);
- выполняет защитную функцию при беременности по отношению к действию на плод тератогенных и повреждающих факторов;
- способствует нормальному созреванию и функционированию плаценты;
- фолиевая кислота имеет эстрогеноподобное действие, что позволяет снижать прием гормонов при заместительной гормональной терапии.
Данные функции реализуются в процессе метаболизма фолатов, который составляет основу фолатного цикла.
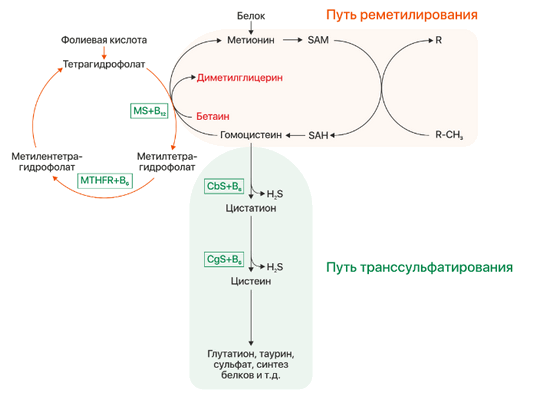
Фолатный цикл – каскадный процесс, контролируемый ферментами, которые в качестве коферментов имеют производные фолиевой кислоты. Ключевым этапом в данном процессе является синтез метионина из гомоцистеина. Это достигается в процессе превращения фолатов: восстановления 5,10-метилентетрагидрофолата до 5-метилтетрагидрофолата, несущего метильную группу, которая необходима для превращения гомоцистеина в метионин. Восстановление фолатов происходит при участии фермента метилентетрагидрофолат-редуктазы (MTHFR). Метильная группа переносится на B12, который затем отдает ее гомоцистеину, образуя метионин с помощью фермента метионин-синтазы (MTR). Однако в некоторых случаях В12 может окисляться, что приводит к подавлению метионин-синтазы. Для поддержания активности фермента необходимо восстановительное метилирование с помощью фермента метионин-синтаза-редуктазы (MTRR).
Нарушение фолатного цикла приводит к накоплению гомоцистеина в клетках и повышению общего уровня гомоцистеина в плазме крови. Главной формой фолата в плазме является 5-метилтетрагидрофолат, несущий на себе метильную группу, которая необходима для превращения гомоцистеина в метионин. Поскольку кобаламин (витамин B12) служит акцептором метильной группы 5-метилтетрагидрофолата, дефицит этого витамина приводит к «ловушке для фолата». Это тупиковый путь метаболизма, поскольку метилтетрагидрофолат не может восстанавливаться до тетрагидрофолата и возвращаться в фолатный пул.
Это приводит к истощению запаса метионина и выбросу в кровь избытка гомоцистеина, который
обладает атерогенным действием, гипертензивными свойствами, повышает гиперагрегацию тромбоцитов.
Кроме того, гомоцистеин свободно проходит через плаценту и оказывает тератогенное и фетотоксическое действие.
Нарушение метаболизма фолатов и повышение уровня гомоцистеина обусловливают повышенный
риск развития патологических процессов:
- осложнения беременности (фетоплацентарная недостаточность, преэклампсия, преждевременная отслойка нормально расположенной плаценты (ПОНРП), замершая беременность,
- внутриутробная гибель плода);
- пороки развития плода (незаращение нервной трубки (spina bifida), анэнцефалия, деформации лицевого скелета, синдром Дауна, пороки сердца);
- сердечно-сосудистые заболевания (ишемическая болезнь сердца, инфаркт миокарда, атеросклероз, атеротромбоз);
- канцерогенез (колоректальная аденома, рак молочной железы и яичника, острый лимфолейкоз у взрослых);
- усиление побочных эффектов при химиотерапии.
Нарушения фолатного цикла не оказывают изолированного влияния на возникновение венозных тромбозов при применении гормональной заместительной терапии и оральных контрацептивов, однако при наличии других тромбофилических полиморфизмов (особенно лейденской мутации и мутации гена протромбина: 20201 G>A) многократно усиливают их действие.
Причины нарушения фолатного цикла:
- генетические дефекты ферментов фолатного цикла MTHFR, MTR и MTRR;
- дефицит фолиевой кислоты;
- дефицит витаминов В6 и В12._
Анализ полиморфизмов в генах фолатного цикла позволяет определить предрасположенность
к указанным выше патологическим процессам и дает возможность своевременного принятия мер
посредством назначения корректирующей терапии.
П оказания к назначению профиля «Генетика метаболизма фолатов» :
- повышенный уровень гомоцистеина в крови (гипергомоцистеинемия);
- невынашивание беременности, гибель плода;
- рождение ребенка с изолированными пороками нервной трубки, сердца или урогенитального тракта;
- плановая подготовка к беременности;
- наличие ИБС, артериальной гипертонии, атеросклероза или атеротромбоза;
- тромбоэмболия;
- антифосфолипидный синдром;
- семейная предрасположенность к онкологическим заболеваниям;
- назначение оральных контрацептивов и гормональной заместительной терапии;
- назначение химиотерапии.
Полиморфизм гена метионинсинтазы MTR(A2756G)
Ген MTR кодирует аминокислотную последовательность фермента метионинсинтазы - одного из ключевых ферментов обмена метионина, катализирующего образование метионина из гомоцистеина путем его реметиляции. В качестве кофактора в этой реакции принимает участие витамин В12 (кобаламин). Полиморфизм гена MTR связан с аминокислотной заменой (аспарагиновой кислоты на глицин). В результате этой замены функциональная активность фермента изменяется, что приводит к повышению риска синдрома Дауна у плода. Влияние полиморфизма усугубляется повышенным уровнем гомоцистеина.
П оказания к назначению: повторные эпизоды венозных тромбоэмболий в анамнезе, эпизоды тромбоэмболий во время беременности, в послеродовом периоде и во время приёма оральных контрацептивов, необъяснимая гибель плода во 2 или 3 триместрах беременности, мегалобластная анемия, мутация MTRR.
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Полиморфизм гена метилентетрагидрофолатредуктазы MTHFR(A1298C) (тератогенный фактор)
У лиц, гомозиготных и гетерозиготных по данному варианту полиморфизма отмечается некоторое снижение активности МТГФР. Это снижение обычно не сопровождается изменением уровня гомоцистеина в плазме крови, однако сочетание мутантного аллеля E429C с аллелем 677T приводит к снижению уровня фолиевой кислоты. При этом риск дефектов развития невральной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно обе мутации, также снижена. Назначение фолиевой кислоты может значительно улучшить показатели риска последствий мутаций. Частота встречаемости варианта С полиморфизма в популяции: С/С - 3-13%, А/С - 45-55%, преобладающий генотип в популяции: А/А.
Показания к назначению: повторные эпизоды венозных тромбоэмболий в анамнезе, эпизоды тромбоэмболий во время беременности, в послеродовом периоде и во время приёма оральных контрацептивов, необъяснимая гибель плода во 2 или 3 триместрах беременности, дефект невральной трубки у плода в анамнезе.
Полиморфизм гена метилентетрагидрофолатредуктазы MTHFR(С677Т) (наследственная гипергомоцистеинемия)
Частота встречаемости гомозиготного носительства по данной мутации среди белого населения планеты составляет от 5 до 12 %. Гетерозиготная мутация С677Т наблюдается у 50% в популяции. Полиморфизм C677T связан, по крайней мере, с четырьмя группами многофакторных заболеваний: сердечно-сосудистыми заболеваниями (атеросклеротическое поражение сосудов, атеротромбоза и его осложнений), дефектами развития плода (дефект развития нервной трубки), колоректальной аденомой и раком молочной железы и яичника.
Показания к назначению: гипергомоцистеинемия, ИБС и инфаркт миокарда, атеросклероз и атеротромбоз, антифосфолипидный синдром, полипоз кишечника, колоректальная аденома и рак, мутации генов BRCA, цервикальная дисплазия, особенно в сочетании с папилломавирусной инфекцией.
Полиморфизм гена редуктазы метионинсинтазы MTRR(A66G) (тератогенный фактор)
Ген MTRR кодирует фермент метионинсинтазу редуктазу, участвующий в большом количестве биохимических реакций, связанных с переносом метильной группы. Одной из функций МСР является обратное превращение гомоцистеина в метионин. В качестве кофактора в этой реакции принимает участие витамин В12 (кобаламин). Полиморфизм I22M A>G связан с аминокислотной заменой в молекуле фермента МСР. В результате этой замены функциональная активность фермента снижается, что приводит к повышению риска нарушений развития плода – дефектов невральной трубки. Влияние полиморфизма усугубляется дефицитом витамина В12. При сочетании полиморфизма I22M A>G гена MTRR с полиморфизмом 677C-> T в гене MTHFR риск увеличивается. Полиморфизм I22M A->G гена MTRR также усиливает гипергомоцистеинемию, вызываемую полиморфизмом 677C-> T в гене MTHFR.
Показания к назначению: повторные эпизоды венозных тромбоэмболий в анамнезе, эпизоды тромбоэмболий во время беременности, в послеродовом периоде и во время приёма оральных контрацептивов, необъяснимая гибель плода во 2 или 3 триместрах беременности.
Генетика нарушений обмена витаминов (кофакторов). Наследование
Генетика фенилкетонурии. Наследование
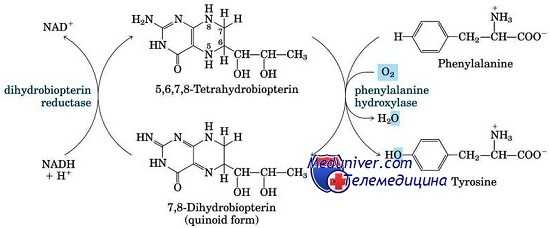
Аномалии, приводящие к увеличению уровня фенилаланина крови, чаще всего недостаточность фенилаланингидроксилаза (ФАГ) или фенилкетонурия (ФКУ), иллюстрируют почти все принципы биохимической генетики, относящиеся к дефектам ферментов. Все генетические аномалии метаболизма фенилаланина — следствие мутаций со снижением функции в гене, кодирующем ФАГ, или в генах, необходимых для синтеза или восстановления ее кофактора, ВН4.
Классическую фенилкетонурию (ФКУ) по праву считают образцовым представителем врожденных ошибок метаболизма. Это аутосомно-рецессивное заболевание распада фенилаланина, вызванное мутациями в гене, кодирующем ФАГ, фермент, преобразующий фенилаланин в тирозин. Открытие фенилкетонурии (ФКУ) Фелингом в 1934 г. впервые продемонстрировало генетический дефект как причину умственной отсталости.
Из-за неспособности к утилизации фенилаланина пациенты с фенилкетонурией (ФКУ) накапливают эту аминокислоту в жидкостях тела. Гиперфенилаланинемия повреждает формирующуюся в раннем детстве ЦНС и создает помехи функционированию зрелого мозга. Небольшая часть фенилаланина метаболизируется по альтернативным путям, производя повышенные количества фенилпировиноградной кислоты (кетокислота, по которой названа болезнь) и других метаболитов, выделяющихся с мочой.
Любопытно, что хотя ферментный дефект известен уже десятилетия, точный патогенетический механизм, каким образом увеличение фенилаланина повреждает мозг, все еще неизвестен. Важно, что развитие неврологического ущерба, вызванного метаболическим блоком при классической ФКУ, может в основном предупреждаться изменениями диеты, предохраняющими от накопления фенилаланина. Лечение фенилкетонурии (ФКУ) стало образцом для лечения многих метаболических болезней, исходы которых могут улучшаться за счет предотвращения накопления субстрата фермента и его производных.
Скрининг новорожденных на фенилкетонурию (ФКУ)
Широко используется популяционный скрининг новорожденных на фенилкетонурию (ФКУ). Фенилкетонурия (ФКУ) — образец генетических болезней, для которых оправдан массовый неонатальный скрининг; заболевание сравнительно часто встречается в ряде популяций (до 1 на 2900 живых новорожденных). Лечение, начатое в начале жизни, весьма эффективно; без лечения неизбежно развивается тяжелая умственная отсталость. Скрининг-тесты выполняют через несколько дней после рождения.
Капельку крови, полученную при проколе пятки, наносят на бумажный фильтр, высушивают и отправляют в централизованную лабораторию для оценки уровня фенилаланина в крови и соотношения фенилаланин/ тирозин. В прошлом образцы собирали перед выпиской ребенка из роддома. Тенденция к ранней выписке матери и новорожденного после родов изменила эту практику. Тест предпочтительно не делать до возраста 24 ч, поскольку уровень фенилаланина при фенилкетонурии (ФКУ) повышается только после рождения. Положительные результаты теста должны быть быстро подтверждены, поскольку задержка начала лечения более 4 нед после родов не позволяет избежать влияния на интеллектуальное состояние пациентов с фенилкетонурией (ФКУ).
Различные формы фенилкетонурии и гиперфенилаланинемия
Поскольку фенилкетонурия (ФКУ) связана с выраженной недостаточностью активности фенилаланингидроксилазы (ФАГ) (менее 1% по сравнению с контролем), мутантная ФАГ, имеющая остаточную активность, вызывает менее тяжелые фенотипические проявления, так называемую гиперфенилаланинемию и атипичную фенилкетонурию (ФКУ).
Гиперфенилаланинемию, отличную от фенилкетонурии (ФКУ), диагностируют, если концентрация фенилаланина в плазме ниже 1 ммоль/л на фоне нормальной диеты. Эта степень гиперфенилаланинемии только в 10 раз выше нормы и значительно ниже, чем концентрации, обнаруживаемые при классической фенилкетонурии (ФКУ) (>1 ммоль/л). Умеренное увеличение фенилаланина при гиперфенилаланинемии не способно повреждать функции мозга и может даже быть благоприятным, если увеличение небольшое (
Атипичная фенилкетонурия (ФКУ) — категория, включающая пациентов с промежуточным уровнем фенилаланина между классической ФКУ и гиперфенилаланинемией; такие пациенты требуют некоторого ограничения фенилаланина в диете, но меньшего, чем для пациентов с классической фенилкетонурии (ФКУ). Комплекс из этих трех клинических фенотипов с мутациями в гене ФАГ — пример клинической гетерогенности.
Гиперфенилаланинемии: аллельная и локусная гетерогенность при фенилкетонурии (ФКУ)
Молекулярные дефекты в гене фенилаланингидроксилазы. У пациентов с гиперфенилаланинемией, включая классическую фенилкетонурию (ФКУ), атипичную фенилкетонурию (ФКУ) и доброкачественные гиперфенилаланинемии, обнаружена поразительная степень аллельной гетерогенности в локусе фенилаланингидроксилазы (ФАГ) (более 400 различных мутаций по всему миру).
Подавляющее большинство аллелей фенилаланингидроксилазы (ФАГ) — достаточно редкие мутации, нарушающие ферментные свойства фенилаланингидроксилазы (ФАГ) и приводящие к гиперфенилаланинемии, хотя также обнаружены и доброкачественные полиморфизмы или менее частые доброкачественные варианты.
В популяциях европейского происхождения около двух третей известных мутантных хромосом представлены шестью мутациями. Шесть других мутаций ответственны за чуть более 80% мутаций фенилаланингидроксилазы (ФАГ) в азиатских популяциях. Остальные патогенные мутации встречаются реже. Чтобы сделать эту информацию широкодоступной, международным консорциумом разработана база данных мутаций в гене фенилаланингидроксилазы (ФАГ).
Во всех популяциях существует выраженная генетическая гетерогенность фенилаланингидроксилазы (ФАГ). Благодаря высокой степени аллельной гетерогенности в локусе, большинство пациентов с фенилкетонурией (ФКУ) во многих популяциях — компаундные гетерозиготы (т.е. у них присутствуют два разных патогенных аллеля), что полностью соответствует наблюдаемой ферментативной и фенотипической гетерогенности при нарушениях фенилаланингидроксилазы (ФАГ).
Сначала казалось, что знание генотипа фенилаланингидроксилазы (ФАГ) надежно предсказывает детали фенотипа; это ожидание оправдалось не полностью, хотя обнаружена определенная корреляция между генотипом ФАГ и биохимическим фенотипом.
В общих чертах мутации, которые полностью подавляют или резко снижают активность фенилаланингидроксилазы (ФАГ), вызывают классическую фенилкетонурию (ФКУ), тогда как мутации, приводящие к достаточно большой остаточной активности фермента, связаны с легкими фенотипами.
Тем не менее некоторые мутации фенилаланингидроксилазы (ФАГ) у гомозиготных пациентов определяют весь спектр фенотипов, от классической фенилкетонурии (ФКУ) до доброкачественной гиперфенилаланинемии.
Таким образом, стало очевидно, что в формировании фенотипа, наблюдаемого при специфическом генотипе, участвуют другие неопознанные биологические факторы, несомненно, включая гены-модификаторы. Это наблюдение, признанное в настоящее время общей характеристикой множества моногенных болезней, указывает на то, что даже моногенные болезни, подобные фенилкетонурии (ФКУ), — генетически не простые заболевания.
Дефекты в метаболизме тетрагидробиоптерина при фенилкетонурии (ФКУ)
Первоначально считали, что все дети с наследственной гиперфенилаланинемией имеют первичную недостаточность фенилаланингидроксилазы (ФАГ). Сейчас ясно, что примерно у 1-3% пациентов ген ФАГ нормален, а их гиперфенилаланинемия — результат генетического дефекта в одном из нескольких других генов, задействованных в синтезе или регенерации кофактора ФАГ, ВН4. Ассоциация одного фенотипа, например гиперфенилаланинемии, с мутациями в разных генах — пример локусной гетерогенности.
Как показывают мутации в генах, кодирующих белок фенилаланингидроксилазы (ФАГ) и метаболизм его кофактора биоптерина, белки, закодированные генами, демонстрирующими локусную гетерогенность, обычно входят в одну цепочку биохимических реакций. Пациенты с недостаточностью ВН4 сначала были выявлены из-за того, что, несмотря на успешное поддержание в диете низкой концентрации фенилаланина, у них рано развивались глубокие неврологические проблемы.
Плохие результаты частично объясняются необходимостью кофактора ВН4 для активности двух других ферментов, тирозингидроксилазы и триптофангидроксилазы. Обе этих гидроксилазы критичны для синтеза моноаминовых нейротрансмиттеров, таких как дегидроксифенилаланин, норэпинефрин, эпинефрин и серотонин. Пациенты с недостаточностью ВН4 имеют нарушение или в его биосинтезе из ГТФ, или в регенерации ВН4. Подобно классической фенилкетонурии (ФКУ), нарушение наследуется по аутосомно-рецессивному типу.
Очень важно отличать пациентов с дефектами в метаболизме ВН4 от больных с мутациями в фенилаланингидроксилазы (ФАГ), поскольку их лечение заметно разнится. Во-первых, так как белковая структура фенилаланингидроксилазы (ФАГ) у больных с нарушениями ВН4 нормальная, ее активность может восстанавливаться, если этим пациентам давать большие дозы ВН4, что приводит к снижению уровня фенилаланина плазмы. Следовательно, степень ограничения фенилаланина в диете пациентов с дефектами в метаболизме ВН4 может быть значительно уменьшена, а некоторые пациенты могут перейти на нормальную диету (т.е. без ограничения фенилаланина).
Во-вторых, необходимо также постараться нормализовать уровень нейротрансмиттеров в мозге этих пациентов, назначая продукты тирозингидроксилазы и триптофангидроксилазы: L-dopa и 5-гидрокситриптофан соответственно. По этим соображениям всем новорожденным с гиперфенилаланинемией показано обследование для определения аномалий в метаболизме ВН4.
Реакция на тетрагидробиоптерин при мутациях в гене ФАГ при фенилкетонурии (ФКУ)
У большинства пациентов с мутациями в гене фенилаланингидроксилазы (ФАГ), а не в метаболизме ВН4, отмечено отчетливое уменьшение уровня фенилаланина крови на фоне перорального приема больших доз кофактора фенилаланингидроксилазы (ФАГ) ВН4. Лучше отвечают на такое лечение пациенты со значимой остаточной активностью фенилаланингидроксилазы (ФАГ) (т.е. пациенты с атипичной фенилкетонурией (ФКУ) и гиперфенилаланинемией), но также поддается лечению небольшое число пациентов даже с классической фенилкетонурией (ФКУ). В то же время наличие остаточной активности ФАГ не дает гарантии влияния на уровень фенилаланина плазмы при назначении ВН4.
Наиболее вероятно, что степень ответной реакции на ВН4 зависит от специфических свойств каждого мутантного белка фенилаланингидроксилазы (ФАГ), отражающих лежащую в основе мутаций ФАГ аллельную гетерогенность. Показано, что введение в диету ВН4 оказывает лечебный эффект через несколько механизмов, вызванных повышением количества нормального кофактора, входящего в контакт с мутантным.
Эти механизмы включают стабилизацию мутантного фермента, защиту фермента от разложения клеткой, увеличение поступления кофактора к ферменту, имеющего низкое сродство с ВН4, и другие полезные эффекты в кинетических и каталитических свойствах фермента. Обеспечение повышенного количества кофактора — общая стратегия, применяемая в лечении многих врожденных ошибок метаболизма.
Материнская фенилкетонурия
Обычно успешное лечение фенилкетонурии (ФКУ) позволяет больным гомозиготам вести полноценную жизнь и иметь практически нормальные перспективы деторождения. В прошлом диету с низким содержанием фенилаланина прекращали у большинства пациентов с ФКУ в среднем детстве, основываясь на предположении (ошибочном, как установлено в настоящее время), что функционирование зрелой нервной системы не нарушается при возврате гиперфенилаланине-мии. Впоследствии было обнаружено, что почти все потомство женщин с фенилкетонурией (ФКУ), не получавших лечения, аномально; большинство этих детей с задержкой умственного развития, многие имеют микроцефалию, задержку роста и пороки развития, особенно сердца.
Как предсказывают принципы менделирующего наследования, все эти дети — гетерозиготы. Таким образом, задержка их развития вызвана не собственной генетической конституцией, а высокотератогенным эффектом высоких уровней фенилаланина в материнской крови. Соответственно необходимо, чтобы женщины с фенилкетонурией (ФКУ), планирующие беременность, начинали соблюдать диету с низким содержанием фенилаланина еще до зачатия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Генетика ферментопатий (ферментативной недостаточности). Наследование
Следующие фундаментальные понятия важны для понимания и лечения ферментопатий.
• Ферментопатии почти всегда рецессивные. Большинство ферментов синтезируются в количествах, значительно превышающих минимальные биохимические потребности, поэтому гетерозиготы с 50% остаточной активностью клинически здоровы. Фактически большинство ферментов могут поддерживать нормальные уровни субстрата и конечного продукта при остаточной активности менее 10% (например, гексозаминидаза А). Исключение — ферменты синтеза порфиринов (см. обсуждение острой перемежающейся порфирии в основном тексте).
• Накопление субстрата или недостаток конечного продукта. Поскольку функция фермента — преобразовывать субстрат в конечный продукт, все патофизиологические последствия ферментопатий можно отнести к накоплению субстрата, недостатку продукта или некоторой комбинации этих ситуаций.

• «Мелкие» и «крупные» субстраты. Существует важное различие между дефектами ферментов, когда субстрат — «небольшая» молекула, например фенилаланин, которая может легко распространяться в жидкостях тела диффузией или транспортом, и дефектами, когда субстрат — макромолекула, типа мукополисахаридов, задерживающихся в пределах органеллы или клетки.
Патологические изменения «макромолекулярных» болезней ограничены тканью, в которых накапливается субстрат, тогда как место болезни при нарушении обмена малых молекул часто непредсказуемо, поскольку неметаболизированный субстрат или его производные могут свободно перемещаться по всему организму, повреждая клетки, которые могут не иметь отношения к патологическому ферменту.
• Недостаточная активность многочисленных ферментов. Пациент с моногенным дефектом может иметь нарушение функции более одного фермента. Существует несколько механизмов для этого: ферменты могут использовать общий кофактор (например, недостаточность ВН4); ферменты могут иметь общую субъединицу или единый механизм активации, процессинга или стабилизации белка (например, GМ2-ганглиозидозы); ферменты могут обрабатываться общим модифицирующим ферментом, и в его отсутствие они инактивируются или нарушается их поступление в соответствующую органеллу (например, I-клеточная болезнь, вызванная невозможностью добавить маннозо-6-фосфат к множеству лизосомных ферментов, что нарушает способность клеток распознавать и импортировать ферменты); группа ферментов может отсутствовать или инактивироваться, если органелла, в которой они обнаруживаются в норме, не формируется или аномальна (например, нарушения биогенеза пероксисом).
• Фенотипическая гомология. Патофизиологические и клинические характеристики при ферментной недостаточности часто сходны при болезнях, вызванных недостаточностью разных ферментов, функционирующих в тойже области метаболизма (например, мукополисахаридозы), и других фенотипах, которые могут происходить вследствие частичной или полной недостаточности одного фермента.
Частичная недостаточность часто вызывает некоторое подмножество клинических аномалий, обнаруживаемых при полной недостаточности, хотя этиологическая связь между такими двумя болезнями может быть неочевидной. Например, частичная недостаточность фермента пуринового обмена гуанин-гипоксантинфосфорибоксилтрансферазы вызывает только гиперурикемию, а полная — гиперурикемию, а также тяжелую неврологическую патологию, синдром Леша-Найена, имеющую сходство с церебральным параличом.
Гомоцистинурия
Впервые гомоцистинурия была описана в 1962 году в Северной Ирландии: Карсон и Нилл (Carson и Neill) наблюдали двух светловолосых голубоглазых братьев с выраженной задержкой развития и офтальмологическими нарушениями. Спустя десятилетие, в 1972 году, Фриман и его коллеги описали другой вариант заболевания, обусловленный дефицитом фермента метилентетрагидрофолатредуктазы. Авторы обследовали 15-летнюю чернокожую девушку, у которой задержка нервно-психического развития была выраженам слабее, но в течение последних двух лет наблюдались прогрессирующие психические нарушения. Через 12 лет Шух (Schuh) и его соавторы описали случай гомоцистинурии у грудного ребенка с выраженной задержкой психомоторного развития и признаками мегалобластической анемии.
Гомоцистинурия — наследственное нарушение обмена метионина, наследуемое по аутосомно-рецессивному типу. Метионин — незаменимая серосодержащая аминокислота, которая используется для создания непротеиногенной аминокислоты гомоцистеина, синтеза белков (взаимодействие метионина с тРНК является необходимым для создания первой пептидной связи будущего белка) и ряда других важных соединений, благодаря тому, что является донором метильной группы.
В зависимости от того, на каком уровне происходит нарушение обмена метионина, выделяют несколько форм заболевания:
- Классическая гомоцистинурия — обусловлена дефицитом фермента цистатион-бета-синтазы (CbS), лимитирующего синтез цистатиона из гомоцистеина. Ген CBS (кодирующий вышеупомянутый энзим) локализован на длинном плече 21 хромосомы в локусе 1q21-q22.1. Его различные мутации способны привести к развитию гомоцистинурии двух разных фенотипов: пиридоксин (витамин B6) зависимого и пиридоксин (витамин B6) независимого. Средняя частота встречаемости данной формы заболевания до сих пор точно не установлена, т. к. неонатальный скрининг на гомоцистинурию проводится не во всех странах (есть данные, что она составляет 1: 58–1:335000, в странах Ближнего Востока 1:1800–1:8000).
- Гомоцистинурия, обусловленная дефицитом фермента метилентетрагидрофолатредуктазы (MTHFR). Причинный ген картирован на коротком плече 1 хромосомы в локусе 1p36.22. Заболевание встречается крайне редко, его частота не установлена.
- Гомоцистинурия, обусловленная нарушением метаболизма кобаламина (Сbl). Имена эта форма была описана в 1984. Заболевание встречается крайне редко, частота его не установлена. Существует несколько типов гомоцистинурии, связанных с кобаламинами, к настоящему времени наиболее известны:
- гомоцистинурия, вызванная дефицитом метилкобаламина (кобаламин тип G, CblG). Ген локализован на коротком плече 5 хромосомы.
- гомоцистинурия, вызванная дефицитом метилкобаламина (кобаламин тип Е, CblE). Ген локализован на длинном плече 1 хромосомы.
Патофизиология
При классическом варианте гомоцистинурии из-за дефекта CbS происходит накопление гомоцистеина и его метаболитов в крови и моче. Гомоцистеин синтезируется во всех органах и является токсичным веществом в первую очередь для эндотелия и нейронов. Его токсичность обусловлена, во-первых, наличием реактивной сульфгидрильной группы, которая способна к окислению при физиологическом pH в присутствии кислорода, что ведет к появлению активных форм кислорода и дальнейшему перекисному окислению липидов, повреждению ДНК и апоптозу. Во-вторых, гомоцистеин способен формировать дисульфидные связи со свободной сульфгидрильной группой цистеина в белках, нарушая функцию последних. В-третьих, один из метаболитов гомоцистеина, гомоцистеина тиолактон, соединяясь с лизином протеинов, провоцирует формирование токсических полимеров, агрегатов или амилоида, что является фактором риска нейродегенерации. Помимо этого, белки, присоединившие гомоцистеина тиолактон, становятся антигенном и способствуют развитию иммунной реакции, являющейся важным модулятором атерогенеза.![]()
Рисунок 1 | Метаболизм гомоцистеина. CbS — цистатион-бета-синтаза, MS — метионинсинтаза, MTHFR — метилентетрагидрофолатредуктаза, SAM — S-аденозинметионин, SAH — S-аденозингомоцистеин.
Несмотря на то, что синтез гомоцистеина происходит практически повсеместно в организме, его утилизация реализуется преимущественно в почках и печени двумя путями: реметилированием и транссульфарацией (см. рис. 1). В сосудистой ткани и коже за неимением ферментов другого пути происходят реакции реметилирования, остальные ткани осуществляют детоксикацию гомоцистеина обоими путями в том или ином соотношении.
При повышение уровня клеточного метионина осуществляется путь транссульфарации: происходит синтез гомоцистеина, который в свою очередь конвертируется в цистатион под действием фермента CbS и кофермента витамина B6. Затем из цистатиона под действием цистатион-гамма-лиазы (CgL) и пиридоксина образуется цистеин. При низком же уровне метионина происходит реакция реметилирования: гомоцистеин принимает метильную группу от метилтетрагидрофолата, превращаясь в метионин. Данная реакция происходит в присутствии фермента метионинсинтазы и кофермента метилкобаламина (витамин B12, CblG), поэтому при нарушении обмена кобаламинов (Cbl) будет развиваться клиника гомоцистинурии. Синтез донора метильной группы регулируется ферментом метилентетрагидрофолатредуктазой (MTHFR), его дефект будет так же вести к развитию заболевания.Клиническая картина
Клиническая картина гомоцистинурии зависит от формы заболевания и может иметь различную степень выраженности.
При классической гомоцистинурии больные дети имеют мягкие, вьющиеся светлые волосы, румянец на щеках, голубой цвет глаз и «морфаноидный» внешний вид — высокий рост, астеничное телосложение, длинные конечности, арахнодактилия. Помимо этого, возможно развитие кифосколиоза с воронкообразной или килевидной деформацией грудной клетки, вальгусной установки коленных суставов, умеренного остеопороза и переломов у детей старшего возраста. Наиболее типичным поражением глаз являются подвывих (вывих) хрусталика, миопия и вторичная глаукома, также встречаются дети с атрофией зрительных нервов и отслойкой сетчатки. Интеллект детей снижен значительно, задержка развития обращает на себя внимание еще в младенчестве. Неврологическая симптоматика весьма полиморфна и меняется с возрастом (см. табл. 1). Изменения в сердечно-сосудистой системе проявляются развитием тромбоэмболии в сосудах мелкого и среднего калибра, что является главной причиной инсультов и ранней смерти. B6-зависимая гомоцистинурия обычно протекает мягче, чем B6-независимый вариант.Для больных гомоцистинурией, вызванной дефицитом MTHFR и нарушением обмена Cbl, характерны микроцефалия, умеренное отставание в психомоторном развитии. При отсутствии лечения возможно резкое нарастание нарушений в нервной системе, иногда приводящей к смерти. У больных, заболевание которых в детстве протекало мягко, с минимальной выраженностью клиники, в подростковом и взрослом возрасте происходит резкое ухудшение состояния. При этом изменение неврологической симптоматики происходит трехфазно: после периода нормального развития в раннем детстве (фаза 1), у детей старшего возраста обнаруживается микроцефалия и психомоторные нарушения (фаза 2), затем происходит стремительное нарастание психо-неврологических симптомов (фаза 3), иногда сопровождающееся дыхательной недостаточностью, что может привести к смерти.
Помимо этого, при нарушении обмена Cbl развивается мегалобластическая анемия, что является важным признаком для дифференциальной диагностики.Таблица 1 | Неврологическая симптоматика в различных возрастных периодах.
Нарушение CbS Нарушение обмена Cbl Нарушение MTHFR Неонатальный период, первый год жизни Острые неврологические нарушения - + + Неонатальные приступы - - + Задержка развития + + + Гидроцефалия - +/- + Нистагм - + - Раннее и позднее детство Инсульт + + + Нервно-психическая задержка развития, обычно трехфазная - + + Спастический тетрапарез - + + Психиатрическая симптоматика + + + Нистагм - + - Подростковый возраст, взрослые Нервно-психическая задержка развития - + + Комбинированная дегенерация спинного мозга - + + Инсульт + + + Миоклония - + + Необъяснимые острые психиатрические симптомы + + + Нистагм - + - Примечания: CbS — цистатион-бета-синтаза, Cbl — кобаламин, MTHFR — метилентетрагидрофолатредуктаза.
Диагности ка
В странах, где неонатальный скрининг включает исследование на гомоцистинурию при помощи теста Гатри или тандемной масс-спектрометрии (подобно фенилкетонурии) — диагностика значительно упрощена. Но к сожалению, таких стран немного и Россия не в их числе.
Заподозрить заболевание у новорожденных детей и детей раннего возраста помогают неврологические и офтальмологические нарушения. При этом важно дифференциировать гомоцистинурию от болезни Морфана в виду схожести фенотипических проявлений. Главные отличия: тип наследования (гомоцистинурия наследуется по аутосомно-рецессивному типу, а болезнь Морфана — по аутосомно-доминантному) и нарушение аминокислотного спектра сыворотки крови (при гомоцистинурии). Помимо этого, у детей с болезнью Морфана наблюдаются менее тяжелое поражение глаз, наличие аневризмы аорты, отсутствие интеллектуальных нарушений и остеопороза.
В качестве скринингового метода обнаружения метионина возможно использование качественной реакции с цианиднитропруссидом — при наличие серосодержащих аминокислот моча окрасится в свекольный цвет. Для дифференциальной диагностики между формами заболевания определяют уровень метионина, гомоцистеина и цистеина в плазме крови и моче (см. табл. 2), а также используют молекулярно-генетические методы.Таблица 2 | Изменения уровней метионина, гомоцистеина и цистеина при различных формах гомоцистинурии.
Общий гомоцистеин плазмы Метионин плазмы Цистеин плазмы и мочи Нарушение CbS ↑↑ ↑ ↓ Нарушение обмена Cbl ↑↑ ↓ ↑ Нарушение MTHFR ↑↑ ↓ / N ↑ Примечания: CbS — цистеин-бета-синтаза, Cbl — кобаламин, MTHFR — метилентетрагидрофолатредуктаза.
При подтверждении диагноза классическая гомоцистинурия (гомоцистинурия, обусловлена дефицитом фермента CbS)” проводят тест с витамином B6 для определения фенотипического варианта заболевания, что важно для последующего лечения.
Методы лечения
Выбор метода лечения зависит от формы заболевания.
При классической B6-зависимой гомоцистинурии рационально назначение пиридоксина, начиная с малых доз (200–250 мг/день для новорожденных и детей раннего возраста, 400–500 мг/день для детей позднего возраста и взрослых). Доза подбирается индивидуально и принимается в течение нескольких недель под контролем маркеров заболевания. Важно ограничить прием больших доз витамина B6 в течение длительного времени, т. к. он начинает оказывать токсический эффект и может вызвать респираторные нарушения, периферическую нейропатию и рабдомиолиз.Больным с B6-независимой гомоцистинурией показана строгая ограничительная диета: уровень метионина снижается за счет уменьшения потребления белковых продуктов. Для обеспечения физиологической концентрации метионина и цистеина, а также предотвращения белково-энергетической недостаточности, возможно применение аминокислотных смесей с низким содержанием метионина и высоким цистеина.
Бетаин наряду с метилтетрагидрофолатом (см. рис. 1) является донором метильной группы для гомоцистеина. Его прием при B6-резистентной форме гомоцистинурии обеспечивает альтернативный путь синтеза метионина и уменьшает уровень гомоцистеина в крови.
Прием витамина B12, кофактора метионинсинтазы, возможен при всех формах гомоцистинурии. Его натуральная форма (гидроксикобаламин) более эффективна, чем синтетическая (цианкобаламин). При классической гомоцистинурии витамин B12 назначается per os в малых дозах под контролем уровня витамина в плазме крови для предотвращения дефицита кобаламинов. При заболевании, вызванном дефицитом кобаламинов, витамин B12 применяется инъекционно ежедневно.
Назначение фолиевой кислоты (витамин B9) при классической гомоцистинурии (per os 1–5 мг/день ) предотвращает развитие фолатной недостаточности. При дефекте обмена Cbl длительный прием больших доз (5–30 мг/день) витамина B9 компенсирует фолатную ловушку и вызванные ею гематологические изменения (при недостаточности витамина B12 нарушается цикл фолатов и количество фолиевой кислоты в клетке постепенно уменьшается). При недостаточности фермента MTHFR также назначаются большие дозы фолиевой кислоты (5–45 мг/день) и рибофлавин (витамин B2), который является кофактором фермента и может стабилизировать мутантный энзим (см. рис. 1).
Дефицит витаминов группы B
![витамины группы В]()
Данное вещество относится к водорастворимым, соответственно, не может накапливаться в тканях, поскольку избыток выводится мочевыделительной системой. Исключение составляет витамин В12. Для нормальной жизнедеятельности организма они должны поступать с пищей ежедневно в необходимых количествах, а недостаток ведет к различным нарушениям.
Причины дефицита витаминов группы B
Выделяют следующие предпосылки дефицита витаминов группы B:
- Первичные — экзогенные и алиментарные:
- нарушение принципов рационального питания;
- низкое содержание витаминов в пище;
- голодание и применение несбалансированных диет;
- неправильное хранение и приготовление продуктов, ведущее к дефициту витаминов группы B в них;
- особенности национальной, традиционной или религиозной кухни.
- Вторичные — эндогенные:
- снижение синтеза витаминов группы B нормальной кишечной микрофлорой из-за заболевания органов ЖКТ, а также дефицит в результате побочного действия лекарственных препаратов, например, из-за приема антибиотиков или химиотерапии;
- снижение всасывания из-за заболеваний ЖКТ — синдром мальабсорбции, болезни печени, генетические поломки;
- наследственные или врожденные дефекты, приводящие к незрелости транспортных форм витаминов группы B;
- наличие внутрикишечных паразитов, которые потребляют поступающие питательные вещества;
- инактивация применяемыми лекарственными препаратами или ксенобиотиками;
- повышенная экскреция из-за заболеваний почек.
Кроме того, отдельной группой стоят причины, при которых возникает повышенная потребность в витаминах:
- период интенсивного роста — детский возраст, беременность;
- интенсивные физические и психические нагрузки;
- длительные стрессовые ситуации;
- неблагоприятные факторы окружающей среды — воздействие радионуклидов, тяжелых металлов, пестицидов и других ксенобиотиков.
Симптомы дефицита витаминов группы B
- В1-авитаминоз приводит к развитию болезни Бери-бери, для которой характерно поражение сердечно-сосудистой и нервной системы. Больные жалуются на парезы, нарушение кожной чувствительности, слабость, одышку, тахикардию, расстройство зрения и нарушение психики.
- Недостаток В2. Развивается дистрофия кожи и слизистых, дерматиты, конъюнктивиты, стоматиты.
- Авитаминоз В3. Развивается пеллагра, характеризуется комплексом 3Д: дерматит, диарея, деменция.
- Недостаток В5. Выпадение волос или их раннее поседение, боли в мышцах, судороги.
- В6. Характерны полиневриты верхних и нижних конечностей, дерматиты, анемии.
- Авитаминоз В12 характеризуется мегалобластной анемией, полинейропатией.
Лечение дефицита витаминов группы B
Выделяют два вида коррекции дефицита витаминов группы B: лечебную и профилактическую.
Лечебная тактика подразумевает применение высоких доз витаминов группы B длительными курсами. Коррекция проводится под строгим контролем врача при наличии клинических и лабораторных данных, подтверждающих витаминный дефицит. В настоящее время первичные алиментарные авитаминозы встречаются редко. В основном данная форма дефицита витаминов группы B развивается на фоне патологии желудочно-кишечного тракта или при наследственных нарушениях витаминного обмена. В этом случае прием пероральных форм препаратов не всегда оказывает ожидаемое лечебное воздействие, поэтому некоторым группам пациентов назначается инъекционное введение витаминных поли- или монопрепаратов.
Профилактическая тактика устранения дефицита витаминов группы B подразумевает прием препаратов в дозировке, близкой к суточной потребности. Такая терапия может назначаться и без доказанной витаминной недостаточности.
Медико-генетический центр «Геномед» проводит диагностику наследственных и приобретенных нарушений обмена витаминов, что позволяет подобрать тактику коррекции гипо- и авитаминозов.
Читайте также:
- гомоцистинурия, вызванная дефицитом метилкобаламина (кобаламин тип G, CblG). Ген локализован на коротком плече 5 хромосомы.