Генная терапия онкологических заболеваний (рака)
Добавил пользователь Валентин П. Обновлено: 08.01.2026
В 5-10% случаев развитие опухолей связано с наследственной предрасположенностью. Но даже наличие злокачественных опухолей у нескольких родственников далеко не всегда говорит о семейных генетических мутациях. Когда имеет смысл проходить генетическое тестирование?
Рассказывают научные сотрудники лаборатории молекулярной онкологии НМИЦ онкологии им. Н. Н. Петрова Светлана Николаевна Алексахина и Григорий Аркадьевич Янус.
Прежде всего, нужно сказать, что все случаи злокачественных опухолей связаны с мутациями (изменениями) генов, контролирующих рост и деление клеток. Но очень важно, что в большинстве случаев все эти мутации соматические, то есть возникают они в клетках человека после рождения, последовательно, в течение долгого времени, случайно или под действием канцерогенов окружающей среды. Но у некоторых людей первый шаг к возникновению опухоли уже был сделан до их рождения: первая мутация в этой цепочке – наследственная. Это значит, что она передалась от одного из родителей (как правило), или от обоих родителей (редкая ситуация), а может быть, впервые возникла в одной из двух половых клеток, соединившихся при зачатии человека («мутация de novo»). Как правило, человек с такой наследственной мутацией ничем не отличается по внешним признакам от людей без подобных мутаций. Единственное отличие – резко повышенный, иногда даже неизбежный риск заболеть раком какой-то одной или нескольких разновидностей.

Довольно часто к нам обращаются «онкологически здоровые» пациенты: у их родственников были диагностированы злокачественные опухоли, и они обеспокоены возможностью развития онкологического заболевания у себя. В лаборатории такие люди хотят пройти обследование на наследственную предрасположенность к онкологическим заболеваниям.
Мы рекомендуем проходить генетическое обследование на наследственный рак, в первую очередь, не здоровым родственникам, а самим онкологическим пациентам. В случае, если заболевание возникло из-за наследственной мутации, вероятность найти его у уже заболевшего члена семьи выше. Если в семье уже обнаружена наследственная мутация, то родственникам рекомендуется выполнять исследование только одного ранее обнаруженного патогенного генетического варианта.

Известно около сотни различных наследственных опухолевых синдромов, каждый из которых связан со своим геном или несколькими генами, и для каждого из которых характерно повышение риска «своих» разновидностей рака. Поэтому молекулярно-генетическое исследование на определение наследственной предрасположенности рекомендовано пациентам, соответствующим определенным критериям. Приведем несколько примеров:
Рак молочной железы
Гены: BRCA1, BRCA2, PALB2, ATM, CHEK2, TP53
Критерии:
- Возраст начала заболевания – менее 45 лет;
- Билатеральное (развитие опухолей двух молочных железах) или первично-множественное* (в данном случае, опухоль молочной железы и яичников) заболевание;
- Хотя бы один родственник первой степени родства с диагностированным раком молочной железы или раком яичников или как минимум два родственника второй степени родства с диагностированным раком молочной железы или раком яичников;
- Трижды негативный рецепторный статус опухоли.
! Соответствие как минимум одному критерию
* Первично-множественный рак – это независимое возникновение и развитие у одного пациента двух или более новообразований. При этом пораженными могут быть не только разные органы, но и парные (молочные железы, легкие и др.), а также возможно мультицентрическое поражение одного органа
Рак яичников
Гены: BRCA1, BRCA2, BRIP1
- Диагноз «серозная или эндометриоидная карцинома яичников» (вне зависимости от возраста и семейного анамнеза)
Рак предстательной железы
Гены: BRCA2, ATM
- Возраст начала заболевания – менее 55 лет;
- Хотя бы один родственник первой степени родства с диагностированным раком предстательной железы, раком молочной железы или раком яичников.
Рак желудка
Гены: CDH1, PALB2, BRCA1, BRCA2
- Возраст начала заболевания – до 40 лет;
- Наличие отягощенного семейного анамнеза в первой линии родства;
Рак поджелудочной железы
Гены: BRCA2, PALB2, CDKN2A, STK11, ATM, TP53, MSH2, MLH1, PRSS1
- Рак поджелудочной железы у родственника первой линии родства;
- Более двух случаев рака поджелудочной железы в семье;
- Семейная и личная история согласуется с а) наследственным раком молочной железы и яичников, б) синдромом Линча, в) синдромом Пейтца-Йегерса, г) синдромом множественных диспластичных невусов и меланомы.
Колоректальные опухоли
Существует 12 разновидностей наследственного рака толстой кишки. Самые частые – синдром Линча (рак толстой кишки или эндометрия развивается на фоне отсутствия выраженного полипоза), семейный аденоматозный полипоз (рак развивается на фоне сотен или тысяч полипов толстой кишки — полипоза), MUTYH-ассоциированный полипоз (рак развивается на фоне десятков, реже – сотен полипов, быстрее обычного превращающихся в злокачественные опухоли)
Синдром Линча
Гены: MLH1, MSH2, MSH6, PMS2, EPCAM
В настоящее время всем больным раком толстой кишки и тела матки (эндометрия) проводят одно из двух сопоставимых исследований:
- Генетический тест на изобилие в опухолевых клетках однотипных мутаций, так называемый феномен «микросателлитной нестабильности»;
- Иммуногистохимический тест на потерю опухолевыми клетками белков MLH1, MSH2, MSH6 или PMS2.
Наличие микросателлитной нестабильности и/или потеря белкового продукта генов MLH1, MSH2, MSH6 или PMS2 а) дает онкологу основание назначить иммунотерапию, б) может произойти у пациентов, страдающих синдромом Линча. Часто у таких лиц:
- реализация онкологического риска происходит до 50 лет;
- есть семейная история опухолей, относящихся к спектру синдрома Линча (рак тела матки, рак почечной лоханки, рак мочевого пузыря, рак мочеточника, рак тонкой кишки, рак желудка);
- первично-множественные опухоли различных отделов кишки и/или тела матки.
Семейный аденоматозный полипоз
Гены: APC, MUTYH
Наличие десятков, сотен или тысяч полипов толстой (и иногда тонкой) кишки (обычно выявляются с подросткового возраста).
- APC-негативный полипоз толстой кишки;
- Наличие в опухоли кишки определенной редкой соматической мутации в гене KRAS: c.34G>T (p.G12C)*.
Этот раковый синдром наследуется по рецессивному типу, то есть для развития болезни человек должен унаследовать дефектные гены от обоих родителей. У родителей при этом обычно наблюдается одна мутантная копия гена MUTYH, дающая крайне незначительное, но все же наблюдаемое повышение шанса заболеть опухолью кишки.
Меланома
Гены: CDKN2A, редко CDK4, BAP1, POT1 и TERT
- Первично-множественные меланомы и/или рак поджелудочной железы (2 у пациентов младше 40 лет, 3 у прочих);
- Хотя бы один родственник первой степени родства с меланомой и/или раком поджелудочной железы младше 40 лет;
- Два и более родственника первой степени родства с меланомой и/или раком поджелудочной железы
Рак щитовидной железы
Гены: RET
- Гистологический диагноз «медуллярная карцинома щитовидной железы»
- Часто заболевание сочетается с аденомами паращитовидных желез и опухолями надпочечников (феохромоцитомами), или с множественными невриномами ЖКТ.
Какие генетические тесты необходимо выполнить?
Нередко клиническая картина дает возможность выполнить исследование на один-два наиболее вероятных и значимых гена. Например, для пациентов с диагнозом рак молочной железы, рак яичников или рак предстательной железы рекомендовано выполнять анализ полной последовательности генов BRCA1 и BRCA2. Сейчас при соответствии клиническим критериям наследственных опухолей исследования последовательности генов BRCA1 и BRCA2 для пациентов с опухолями молочной железы и опухолями яичников может быть выполнено в рамках программы ОМС.

Мутации в генах BRCA1 и BRCA2 также могут быть причиной развития опухолей поджелудочной железы и желудка.
Другой пример: пациентам с аденоматозным полипозом толстой кишки рекомендуется выполнять исследование на мутации в гене APC. Если тест оказывается отрицательным, следует выполнить исследование на мутации в гене MUTYH (эти исследования в программу ОМС не входит, выполняются за счет средств пациента).
При подозрении на наследственный опухолевый синдром, ассоциированный с большим числом генов, или наличием подозрения на различные опухолевые синдромы выполняется исследование крови пациента методом секвенирования нового поколения (NGS). В лаборатории молекулярной онкологии НМИЦ онкологии им. Н. Н. Петрова анализируются сразу 70 генов, ассоциированных с опухолевыми синдромами, в том числе очень редкими.
Что делать, если генетическая мутация обнаружена?
В некоторых случаях обнаружение наследственной мутации дает возможность подобрать более эффективную терапию. Так, за счет механизмов генетических нарушений для BRCA-ассоциированных опухолей показана высокая чувствительность к препаратам платины, а также PARP-ингибиторам.
При обнаружении наследственной мутации рекомендуется генетическое обследование родственников – в этом случае проверяется уже наличие конкретной мутации. Вероятность передачи мутации от родителя ребенку – 50%.
Клинически здоровым родственникам с выявленной патогенной мутацией практически всегда можно предложить программу обследования или профилактических медицинских вмешательств, снижающих или устраняющих риск развития рака.
При обследовании родственников возможен «ступенчатый подход», сначала обследование проходят ближайшие родственники, если у кого-то обнаружена мутация, анализы уже сдают его родственники первой линии.
Обследование здоровых людей может быть выполнено по их желанию. Однако стоит учесть, что отсутствие наследственных мутаций не исключает возможности развития опухолей в течение жизни, так как чаще всего рак развивается спорадически (случайно) или в связи с наличием неизвестных нам пока наследственных факторов.
Как проводится генетическое исследование?
Наследственная мутация обнаруживается во всех клетках организма. Поэтому наиболее оптимальным образцом для исследования является венозная кровь. Для выполнения исследования достаточно 3-5 мл крови. ДНК для исследования получают из лимфоцитов крови.
Индивидуальный набор мутаций человека не меняется в течение его жизни, поэтому кровь для анализа можно сдавать вне зависимости от приемов пищи и лекарственных средств.
Разумеется, это значит, что достаточно однократного выполнения анализа, однако в некоторых ситуациях, когда наличие или отсутствие мутации критически значимо для планирования лечения, существует практика перепроверки результата, чтобы полностью исключить и без того очень низкую вероятность технической ошибки.


Авторская публикация:
Григорий Аркадьевич Янус, к.м.н., научный сотрудник лаборатории молекулярной онкологии

Авторская публикация:
Светлана Николаевна Алексахина, к.б.н., старший научный сотрудник лаборатории молекулярной онкологии
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Генная терапия онкологических заболеваний (рака)
Генная терапия рака - возможности
Одна из задач генной терапии при раке заключается в подавлении активности онкогена или восстановлении функции гена-супрессора. Дефектный ген может быть заменен нормальным, такой процесс обозначается как гомологичная рекомбинация; однако при современном состоянии науки эффективность этой методики недостаточна для клинического применения.
С помощью доступных векторов можно ввести какой-либо ген не прицельно, а случайным образом в делящиеся клетки, однако дефектные гены при этом не удаляются. Опухолевый ген-супрессор ТР53 представляет привлекательную мишень для генной терапии, т. к. его дефекты встречаются в большинстве злокачественных опухолей человека.
Мыши, у которых методами генной инженерии выключена функция гена ТР53, выглядят нормальными при рождении, однако к 6 мес. все умирают от опухолей. Введение гена ТР53 дикого (исходного) типа в дефектные клетки invitro предотвращает злокачественную трансформацию, даже в случаях множественных генетических аномалий. Влияние белка Тр53 в фармакологических дозах на злокачественные клетки остается загадкой, т. к. клинические исследования у людей ограничены.
Влияние на эффекты онкогена возможно одним илидвумя способами. Во-первых, можно попытаться удалить/вывести продукт онкогена или заблокировать его функцию. Во-вторых, можно использовать экзогенные или синтезирующиеся в клетке антисмысловые олигонуклеотиды для прекращения транскрипции онкогена (нарушение синтеза мРНК).

Антисмысловые олигонуклеотиды могут вводиться системно. In vitro показано, что экзогенные антисмысловые олигонуклеотиды способны подавлять рост опухолевых клеток. Эффективность этих олигонуклеотидов продолжают изучать в нескольких исследованиях, посвященных методам генной терапии лейкозов.
Основные достижения генной терапии ограничены исследованиями на модельных системах in vitro, в которых используют опухолевые клетки с хорошо изученными генетическими дефектами. Некоторый успех достигнут при системном введении антисмысловых олигонуклеотидов в доклинических исследованиях терапии солидных новообразований. Следующий метод связан с введением в опухолевые клетки гена цитокина, повышающего их иммуногенность.
Цитокины оказывают стимулирующее влияние на Т-лимфоциты, вызывая их активацию, а повышение содержания в области иммунизации цитокинов за счет их инъекции облегчает развитие иммунного ответа. Предполагается, что более высокая и, возможно, более эффективная концентрация цитокинов может быть создана не за счет инъекции, а за счет их местной продукции.
Следовательно, могут быть созданы генетически модифицированные опухолевые клетки, синтезирующие необходимые молекулы, и на основе этого возможно производство противоопухолевой вакцины. Проводятся клинические исследования с применением этой технологии у больных с плоскоклеточным раком, нейробластомой, глиобластомой, раком толстой кишки, мелкоклеточным раком легкого, РЯ. Получены клетки, продуцирующие различные цитокины, в т. ч. интерлейкины-2, -4, -5 и -6, а также макрофагальный колониестимулирующий фактор, фактор некроза опухоли и молекулы межклеточного взаимодействия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В настоящее время возможность воздействия на геном опухолевых клеток с целью вызвать их гибель или подавить рост стала более реальной, поскольку мы уже многое знаем о генетических изменениях, приводящих к малигнизации клеток. Для проявления эффекта ген должен попасть в клетку. Доставка его в клетку осуществляется с помощью вектора.
Это может быть вирус, потерявший способность к репликации, внутри которого находится ген, обычно содержащий промотор. Попав в клетку, ген активируется. Наряду с этим ген можно заключить в липосомы. Также возможно использовать вирусы, обладающие способностью к селективной репликации в опухолевых клетках.
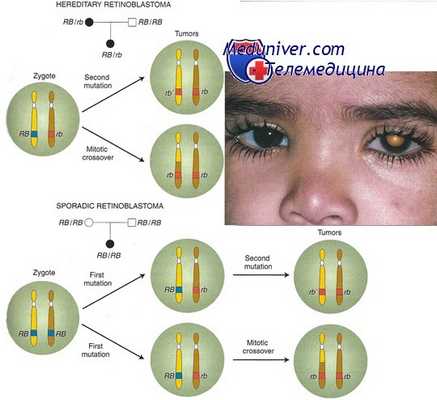
Такая селективность может быть связана с необходимостью прохождения клеткой деления для активации гена или же с отсутствием активного белка р53, или продукта гена RB (ретинобластомы). Близкий подход состоит в использовании вируса, дефектного по репликации, который размножается только в случае, когда происходит экспрессия промотора здоровых клеток. Это имеет место, например, для промотора гена, кодирующего синтез специфического антигена простаты при раке этого органа.
Целью генной терапии рака может быть одна из следующих:
1. Восстановление дефектной функции гена-супрессора роста опухоли. Было показано, что восстановление функции таких супрессорных генов, как р53 или АРС (семейный коли-полипоз), ингибирует рост модельных опухолей. Это является выдающимся результатом, так как существует множественность генетических дефектов, характерных для раковых клеток.
2. Блокирование эффекта онкогена, в котором произошла мутация или наступила его гиперэкспрессия. Для введения факторов, блокирующих эффект доминантных онкогенов и тем самым рост опухоли (олигонуклеотидов или рибозимов), использовали вирусные векторы. Однако наиболее успешный результат был получен при использовании небольших молекул (т. е. лекарственных средств), блокирующих эффект онкогенов. К числу таких молекул относится иматиниб.
3. Введение в клетку гена, способного переводить лечебный препарат в активную форму или вызывать ее гибель иным способом. Преимущество использования гена, активирующего препарат, заключается в том, что активная форма оказывает токсическое действие на клетки, расположенные на определенном расстоянии от той, в которую проник ген. Это так называемый байстендер-эффект.
Такой эффект на сосудистую систему опухоли проявляется, когда в клетки опухоли вводят гены, ответственные за процесс антиангиогенеза.
4. Изменение чувствительности опухоли к атаке со стороны иммунной системы организма. Могут быть использованы векторы, усиливающие экспрессию антигенов, которые увеличивают чувствительность опухолевых клеток к компонентам иммунной защиты.
В настоящее время ни один из этих подходов не исчерпал своих возможностей. Достигнутые в настоящее время успехи в области применения лекарственных препаратов и моноклональных антител для подавления опухолевого роста в какой-то степени сделали менее привлекательными разработку новых терапевтических средств, которая должна включать исследования способов доставки генов в клетки и обеспечения их функционирования.
Материалы конгрессов и конференций
Необъяснимы международные различия в частоте рака предстательной железы (РПЖ): в богатом, с высокой продолжительностью жизни Сингапуре - 3,5/100000, в процветающей Швеции с долгоживущим населением – 48/100000.
В когорте заболевших РПЖ только одна треть смертей связана с прогрессированием опухолевого процесса, а две трети обусловлены присущими этой возрастной группе инсультами и инфарктами миокарда.
РПЖ относится к медленно прогрессирующим формам. Ежедневно пролиферируют 3% опухолевых клеток и 2% погибают через механизм апоптоза (2).
Большинство простатических раков возникают из секреторных эпителиальных клеток периферической зоны. Нет связи между раком и доброкачественной гиперплазией, клетки последней не малигнизируются (3).
PSA – наиболее эффективный сывороточный маркер в онкологии. При скрининге РПЖ обнаруживается у 27% мужчину, имеющих концентрацию PSA в пределах 3-4 ng/ml и в 50% случаев при больших показателях. Метастазы в кости выявляются при сканировании только в том случае, когда уровень PSA превышает 20 ng/ml (4).
При уровне PSA>10 ng/ml прорастание опухолью капсулы простаты выявляется почти у 100% больных; при II стадии PSA>10 ng/ml регистрируется только у 31% заболевших (5).
Уровень PSA активно используется химиотерапевтами и урологами для оценки противоопухолевого эффекта гормонов или химиопрепаратов. Значимым считается падение этого маркера на 75-80%.
Повышение PSA обнаруживается за несколько месяцев до выявления на сканограммах костей единственных признаков метастазирования (7).
Несмотря на это и некоторые другие исследования такого же плана доминируют принципы активного излечивающего подхода к больным со II стадией РПЖ. Рецидивы болезни после радикального лечения у этой категории пациентов отмечаются в 20-25% случаев (9, 10).
Американские урологи, предлагая больным по существу два равных по эффективности метода лечения при II-ой стадии, исходят из следующих предпосылок: операция рекомендуется больным моложе 60 лет, с уровнем PSA менее 10 ng/ml, со степенью по Глисону 6 или меньше; при таких параметрах существуют шансы прожить 10 лет. Лучевая терапия рекомендуется пациентам старше 60 лет, с уровнем PSA>10 ng/ml, со степенью по Глисону 7 или больше (11).
Спорной остается вопрос о том, добавлять к радикальной простатэктомии или к радикальной лучевой терапии методы андрогенного подавления при II стадии болезни или нет.
Bolla et al. рандомизировали 400 пациентов с Т1 и Т2 на 2 группы: получавшие только лучевую терапию или лучевую терапию с гозерелином. 5 лет выжили после облучения 62% больных, в группе с облучением и гозерелином - 79% (12). Аналогичные результаты достигнуты и в других исследованиях (13).
Известны работы, отрицающие значение андрогенного подавления после радикальных простатэктомий при II стадии РПЖ. (14).
Убедительное исследование выполнено американской группой ECOG. Больным со II стадией выполнялась простатэктомия и тазовая лимфодиссекция, после чего пациенты были рандомизированы на группу наблюдения и группу, в которой производилась орхэктомия или ежемесячно назначался гозерелин. Через 7 лет в 1-ой группе умерли 18/51 (35,3%) больных, во 2-ой группе – 7/47 (14,9%) (15).
Главным методом лечения экстракапсулярного РПЖ (III стадия) является лучевая терапия. Простатэктомия не выполняется из-за высокой вероятности отдаленного метастазирования. Предпочтение отдается конформальному облучению, возможно и интерстициальное или наружное облучение на ускорителях (50 Gy на таз и 70 Gy на предстательную железу). Выживаемость в течение 5 лет достигается в диапазоне 72-78%.
Назначение в этой стадии дополнительно к облучению методов андрогенного подавления представляется более убедительным. С подачи американской группы RTOG применение методов андрогенного подавления вместе с радикальной лучевой терапией принято стандартом в США, поскольку в комбинированной группе лучше показатели безрецидивной выживаемости, меньше рецидивов (71% в контроле и 46% в комбинированной группе). Показано, что применение гормональных методов повышает радиочувствительность опухолевых клеток (этому способствует уменьшение размеров простаты, улучшение кровоснабжения, уменьшение гипоксии опухолевых клеток) (13).
Раковые клетки предстательной железы чувствительны к андрогенам так же как нормальные клетки этого органа. Дигидротестостерон соединяется с андрогенными рецепторами (которые присущи 95% клеток), и этот комплекс, взаимодействуя с ДНК, приводит к контролируемой в норме и неконтролируемой в опухолях стимуляции пролиферации и снижению дифференцировки, а значит и уровня физиологической смерти клеток.
Реально для лечения РПЖ в IV стадии применяют МАБ (максимальную или полную андрогенную блокаду) или кастрацию (хирургическую или медикаментозную производными LH-RH) или антиандрогены (бикалутамид, флутамид, анандрон, андрокур).
При МАБ подавляется выработка тестостерона клетками Лейдига в яичках и тормозится периферическое взаимодействие андрогенов, синтезируемых в надпочечниках, с рецепторами опухолевых клеток.
В 1989 г. Северной Американской Интергруппой были опубликованы материалы сравнения МАБ и одного лейпролида у 300 больных РПЖ IV стадии. Время до прогрессирования составило 16,9 мес. и 13,8 мес., медиана выживаемости 35,6 мес. и 28,3 мес. (лучшие показатели отмечены при МАБ) (16).
Последующий анализ подгрупп с хорошим статусом по Карновскому и локализацией метастазов в лимфоузлах и скелете выявил разницу во времени до прогрессирования в 29 мес. и в медиане выживаемости до 19 мес. в пользу МАБ группы (17).
Орхэктомия + Анандрон в международном исследовании сравнивались только с орхэктомией. Регрессия и стабилизация отмечены после МАБ в 78%, после кастрации - в 62%, безрецидивная выживаемость составила 37 мес. и 30 мес. (18).
Главные споры ведутся между сторонниками МАБ и теми исследователями, которые предлагают в качестве I линии лечение больных РПЖ лучевую или медикаментозную кастрацию. Позицию последней укрепили результаты исследований, проведенных в Дании (гозерелин + флутамид, орхэктомия + флутамид и монотерапия гозерелином) и Международной группой по изучению РПЖ (гозерелин + флутамид и гозерелин), в которых не было найдено преимуществ МАБ. Острая дискуссия продолжается (19, 20).
Международная группа PCTCG выполнила в 1995 г. и 2000 г. мета анализ 25 сравнительных исследований по оценке эффективности МАБ и орхэктомии (в том числе и медикаментозной), при этом у авторов получилось, что преимущества от МАБ статистически недостоверны.
Итак, МАБ - активный метод сдерживания пролиферации гормоночувствительного рака простаты. Одновременное применение кастрации и антиандрогенов диктуется еще и тем, что после кастрации надпочечники более интенсивно синтезируют андрогены. Т.о., хоронить метод преждевременно.
Некоторые урологи (например, В.Б.Матвеев), предпочитает в качестве 1-ой линии эндокринной терапии назначать больным с не очень агрессивным течением антиандрогены. Эти препараты конечно удобнее и менее ранимы для больных, чем кастрация. Особенно привлекателен из-за малой токсичности касодекс, при назначении которого сохраняются сексуальные функции и интерес в большей степени, чем при использовании других антиандрогенов. Вместе с тем, прямое сравнение касодекса с орхэктомией в очень крупных исследованиях (с участием 1200 и 243 больных) выявило преимущества лишь в симптоматическом эффекте в пользу касодекса. Но время до прогрессирования и медиана выживаемости были
статистически значимо более продолжительными в группе больных, которым была проведена орхэктомия. (21, 22).
Оригинальная концепция прерывистой эндокринной терапии диссеминированного РПЖ разработана в 1993 г. Akakura et al. Они изучили на экспериментальной модели влияние подавления андрогенов на состав и поведение стволовых клеток и заметили, что сдерживается дифференцировка андрогензависимых клеток (23). В соответствии с их концепцией для возобновления роста чувствительного клона клеток нужны андрогены. Практически тактика выглядит следующим образом: с помощью LH-RH аналогов и антиандрогенов добиваются снижения PSA до нормальных цифр в течение 6 мес., после чего терапия прерывается и осуществляется мониторинг PSA, после его подъема в течение нескольких месяцев или возобновления клинических симптомов повторяется андрогенная блокада. Таким образом, цель этого метода – подольше сохранить чувствительные к гормонам клоны клеток. Задача состоит в том, чтобы не добить их сразу, превратить болезнь в хроническую, более продолжительную и менее злокачественную, продлить период, при котором могут с успехом применяться эндокринные препараты. Качество жизни при прерывистой терапии, несомненно, лучше. Относительно выживаемости – пока не ясно. По предварительным данным она не отличается от выживаемости, обеспечиваемой классической МАБ (24).
В работе Grossfeld интерметирующая терапия была применена у 61 пациента, единственным проявлением у них был подъем PSA выше нормы. За 30 мес. наблюдения больные получили от 1 до 5 циклов эндокринотерапии. 45% времени они были свободны от применения гормонов. Лишь у 5 (8,1%) пациентов отмечено прогрессирование опухоли (25). Сравнение эффективности непрерывной и прерывистой терапии продолжается во многих международных организациях.
После развития андрогенной независимости опухолевых клеток начинается самый тяжелый заключительный этап в жизни больных РПЖ. Медиана выживаемости этой группы пациентов варьирует от 9 до 12 мес. Не один из химиопрепаратов в режиме монотерапии не обладает эффективностью выше 25%. Мало того, в обзоре Yagоda (1993) утверждается, что для препаратов того времени средняя активность составляла 8,7% (26).
Среди противоопухолевых препаратов в наши дни используют эстрамустин (раньше думали, что это гормоноцитостатик, сейчас показано, что главным в механизме действия является антимикротрубочковый эффект), доксорубицин, эпирубицин, митоксантрон, паклитаксел, доцетаксел, карбоплатин, цисплатин, циклофосфамид, митомицин, винорельбин, этопозид (27).
Предпочтение отдается комбинированной терапии. Материалы сведены в табл. 1.
Таблица 1.
Эффективность различных схем химиотерапии при РПЖ.
| Состав комбинации | Снижение PSA>80% | Медиана выживаемости (мес.) | Публикации |
|---|---|---|---|
| Эстрамустин + Вепезид | 28,5-58% | 9,9-13 | 28, 29 |
| Эстрамустин + Винбластин | - | 11,9 | 30 |
| Доксорубицин + Циклофосфамид | 28,6% | 11 | 31 |
| Митомицин + Доксорубицин + Фторурацил | 16,2% | 9 | 32 |
| Этопозид + Эпирубицин + Карбоплатин | 25% | 11 | 33 |
| Эстрамустин + Паклитаксел | 53-64% | - | 34 |
| Эстрамустин + Паклитаксел + Этопозид | - | 21 | 35 |
| Эстрамустин + Доцетаксел | 45-74% | 23 | 36 |
| Митоксантрон + Преднизон | 25% | 10 | 37 |
| Оксалиплатин + Фторурацил | Клиническое улучшение 39% | 11,4 | 38 |
| Митоксантрон + Доцетаксел | 42% | - | 39 |
| Доцетаксел + Винбластин | 60% | - | 40 |
В течение последних лет развиваются новые подходы к терапии опухолей. Прогресс в области фундаментальных наук расширил наши представления о механизмах роста опухолей, их дифференцировки, инвазии и метастазирования. Молекулярные исследования дают возможность идентифицировать мишени для вновь создаваемых лекарств.
При РПЖ, например, обнаружена гиперэкспрессия матрикс металлопротеиназ. Эти ферменты играют важную роль в процессах инвазии, метастазировании и ангиогенеза. Энзимы способны разрушать коллагены, фибронектин, ламинин, мембранные гликопротеины (41).
Созданы несколько ингибиторов матрикс металлопротеиназ, среди них маримастат. Начаты его испытания. Этот оральный препарат малотоксичен, регистрируются лишь артралгии. Пока показано, что больные РПЖ получавшие этот препарат медленнее прогрессируют и у них меньше клинических проявлений (42).
Известно значение ангиогенеза в развитии первичной опухоли предстательной железы и ее метастазов. Подсчитана микрососудистая плотность (число сосудов на 1 мм2) в ткани простаты (43). В нормальной предстательной железе этот показатель равен 8,6; при доброкачественной простатической гиперплазии – 70,2; в раковой опухоли простаты - 81,2; в метастазах РПЖ - 154,6. Для роста опухоли размером 2 мм требуется обязательное образование капилляров.
Активно изучается роль ингибиторов и стимуляторов ангиогенеза при РПЖ. В частности показано, что ангиостатин – ингибитор ангиогенеза, регулируемый супрессорными генами, в повышенных количествах определяется в простатических клетках. Высказано предположение, что именно этим объясняется относительно замедленный рост РПЖ (44). При РПЖ разрабатываются препараты, мишенями которых являются стимуляторы ангиогенеза (васкулярный эндотелиальный фактор роста, фибробластный фактор роста, тимидин фосфорилаза), а также вещества, способные стимулировать экспрессию естественных ингибиторов ангиогенеза в опухоли и метастазах (ангиостатин, тромбоспондин, талидомид и др.).
Пять основных семейств пептидных факторов роста вовлечены в процесс нормального и опухолевого простатического роста. Среди них - трансформирующие факторы роста ? и ? (TGF-? и TGF-?), эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF) и фибробластный фактор роста (FGF). EGF, TGF-?, IGF, FGF стимулируют пролиферацию простатических клеток (в том числе и опухолевых), TGF-? cтимулирует дифференцировку клеток и апоптоз. Все эти факторы в норме «заводятся» в результате андрогенного взаимодействия с клеточным рецептором и ДНК. При РПЖ в связи с мутацией регуляторных генов разрушаются механизмы созревания клеток. Угнетение факторов роста и прерывание киназнозависимых сигналов – обещающий терапевтический подход. Создаются моноклональные антитела против рецепторов этих факторов роста. Начаты их исследования при раке простаты (45).
Итак, чрезвычайно важной является разработка контроля андрогеннезависимого РПЖ, поскольку медиана выживаемости носителей этих опухолей не превышает 1 года. Интенсивный поиск в области молекулярной биологии дает основание надеяться на революционные достижения.
Список литературы:
1.Gittes K.F. N. Engl. J Med. 1991, 324:236-245.
2. Berges R.R., et.al. Clin. Canc. Res. 1995; 1:473-480.
3. Carter B.S., et.al. In “Reviews on Endocrine-related cancer”, 1991, pp.13-18.
4. Chybowski F.M., et al. J. Urol.1991; 145; 333.
5. Hudson M.A., et al. J. Urol. 1989; 142:1011-1017.
6.Pound C.R., et. al. Jama 1999; 281: 1591-1597/
7. Eisenberger M., et.al. ASCO Educational book, 1999; 484-491/
8. Haggman M. In Book “Prostate and renal cancer, benign prostatic hyperplasia, erectile dysfunction and basic research”, 2003, pp. 262-266.
9.Johansson J.E., et al. Jama 1997; 277: 467-71.
10. Stattin P., et al. Eur.Urol. 1997; 32: 404-409.
11. Soloway M.S. In “New perspectives in prostate cancer”, 1998, pp. 205-210.
12. Bolla M., et al. N. Engl. J.Med. 1997; 337; 225-230.
13. Pilepich M.V., et al. Int. J. Radiot. Oncol. Biol. Phys. 2001; 50: 1243-1252.
14. Fellow G.J., et al. Br. J. Urol. 1992; 70:3, 304-309.
15. Messing E.M., et al. N. Engl. J. Med. 1999; 341: 1781-1784.
16. Crawford E.D., et al. N. Engl.J.Med. 1989; 321:419.
17. Denis L.J., et al. Urol. 1993, 42:119-130.
18. Janknegt R.A., et al. J. Urol. 1993, 143:77-83.
20. Tyrell C., et al. J.Urol. 1996; 1321-1326.
21. Tyrrell C. et al. Proc. ASCO 1996, ab. 411.
22. Chodac G., et al. Urol. 1995, 46(6):849-855.
23. Akakura B., et al. Canc. 1993, 71:2782-2790.
24. Bruchovsky N., et al. In “New Perspectives in prostate Cancer”. Eds. Belldegrun A., et al., 1999, pp.283-292.
25. Grossfeld G.D., et al. Urol. 2001, 58:240-245.
28. Pienta K.J., et al. Urol. 1997, 50:401-407.
29. Dimopoulos M.A. Urol. 1997, 50:754-758.
30. Hudes G.R., et al. J. Clin. Oncol. 1992, 10:1754-1761.
31. Small E.J., et al. J. Clin. Oncol., 1996; 14: 1617-1625.
32. Blumenstain B., et al. J. Urol. 1993, 150:411-413.
33. Fuse H., et al. Int. Urol. Nephrol. 1996, 28:79-85.
34. Haas N., et al. Urol. 2001, 58:59-64.
35.Smith D.C., et al. Proc. ASCO 2003, ab. 1579.
36. Petrylac D.P., et al. Proc. ASCO 200, ab. 1312.
37. Tannock I., et al. Proc. ASCO 1995, ab. 653.
38. Droz J.P., et al. Ann. Oncol. 2003, 14:1291-1298.
39. Arcenas A.G., et al. Proc. ASCO 2003, ab. 1714.
40. Tester W., et al. Proc. ASCO 2003, ab. 1720.
41. Chambers A.F., et al. J. Nat. Canc. Inst. 1997, 89:1260-1270.
42. Wilding G. ASCO Educational Book 1998; 373-384.
43. Wakui S. et al. J. Pathol 1992, 168:257-282.
44. Gatley S., et al. Canc. Res. 1992, 56:4887-4890.
45. Sternberg C.N. In Book ”Prostate and renal cancer, benign prostatic hyperplasia, erectile dysfunction and basic research”, Eds. Belldegrun A., et al., 2003, pp. 421-435.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Генетика и онкология: главные вопросы
Что такое онкоген? Как возникают мутации в ДНК? Какие мутации провоцируют рак? Кому и чем могут помочь молекулярно-генетические исследования?
На эти и другие вопросы во Всемирный день ДНК отвечает Александр Олегович Иванцов – доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.

Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Читайте также:
