Гипофибриногенемия - клиника, диагностика, лечение
Добавил пользователь Валентин П. Обновлено: 08.01.2026
Дисфибриногенемия - клиника, диагностика, лечение
Дисфибриногенемия — врожденный геморрагипарный синдром, с преобладающе аутосомальным образом передачи. С клинической точки зрения она характеризуется дискретными кровотечениями и происходит на почве аномалийного синтеза фибриногена, количественно нормального, но с качественно измененной молекулой, что разрушает его функцию физиологического субстрата плазматической коагуляции.
Первый случай описал в 1964 г. D. Menache; до настоящего времени казуистика обогатилась более чем 40 типами фибриногена с аномалийной молекулой. Они получили название того населенного пункта, где были обнаружены впервые (как было сделано в случае подразделений типов патологических гемоглобинов). Вот те 41 типа, которые были сообщены до настоящего времени: Альба/ Женева, Амстердам, Балтимор, Бетесда I, II, III, Буэнос-Айрес, Каракас, Чапель-Хилл, Кливленд I, II, Кульвер-Сити, Дитройт, Гиссен, Айова-Сити, Лейвен, Лос-Анджелес, Мальме, Марбург, Мец, Монреаль I, II, Нанси, Нью-Йорк I, II, III, Оклагома, Осло, Париж I, II, III, Парма, Паргам, Филадельфия, Ст. Люис, Токио, Груа, Ванкувер, Висбаден, Цюрих I, II.
Клиника дисфибриногенемии
Больные, страдающие этой болезнью, ведут себя подобно гипофибриногенемикам. Они кровоточат весьма умеренно, почти нигокда спонтанно; кровотечение возникает либо по поводу травмы, либо по поводу хирургического вмешательства. Большинство больных даже асимптоматичны и их диагноз устанавливается в лаборатории по случаю исследований по иным причинам. Однако характерным для всех является тот факт, что они представляют дегисценцию ран (в случае наличия таковых).
Дегисценция происходит в силу двойного механизма: с одной стороны сгусток фибрина, образовавшийся в ране из этого гипофункционального фибриногена не осуществляет сближения ее краев (из-за отсутствия соответствующей динамической ретракции), а с другой стороны он очень малоустойчив к местному фибринолизу, который растворяет его быстрее, чем удается тканям его организовать (типичный пример: фибриноген Кливленд).
Лабораторное исследование при дисфибриногенемии является тем элементом, который ставит диагноз болезни и типологического варианта аномалийного фибриногена.
Результаты использованных тестов при исследовании группируются следующим образом:
а) Тесты с аномалийными результатами: РТТК и TQ, время ко торых явно удлинены и ТТ, TR очень удлиненными. Что касается TLGE, это время несколько короче, симулируя легкий фибринолиз; в действительности речь идет о более скором лизисе сгустка, образованного из фибрина менее, чем посредственного качества. TEG—гата показывает хрупкий сгусток, которые по достижении точки „ma" разрывается ступенями. Наконец, произведение бидименсиональной хроматографии (fingerprint) показывает нам дефект в последовательном порядке аминных кислот, составляющих полипептидные цепи молекулы фибриногена (пример: в фибриноген Detroit в цепях альфа, позиция 19, аргинин заменен серином).
б) Тесты с нормальными результатами. Все факторы коагуляции (за исключением Fbg), исследованные при помощи соответствующих селективных тестов, дают нормальные результаты. Исследование FDP дает нормальный результат. Уровень Fbg, независимо от метода определения — гравиметрический, спектрофотометрический или иммунологический — нормальный. Химический анализ содержания углеводов в Fbg нормальный. Наконец, продолжительность полужизни Fbg нормальная.

Патофизиология дисфибриногенемии. Основным расстройством болезни является порочный синтез молекулы Fbg. Дефект находится на уровне генов индукторов синтеза, которые не ингибированы (как при афибриногенемии), а терпят мутацию информационного кодекса образуя таким образом Fbg с аномалийными характеристиками и с функциональным недостатком коагуляции. Однако ритм синтеза, а также и ритм катаболизма нормальные, так что турновер этого аномалийного Fbg подобен нормальному.
С точки зрения аномалии поведения в отношении механизма плазматической коагуляции аномалийные фибриногены можно разделить на 5 категорий:
— Дефект высвобождения фибринопептидов А и В под действием тромбина (напр.: Fbg Bethesda I и Detroit).
— Дефект продольной поликонденсации фибриновых мономеров (напр.: Fbg Zurich I).
— Ассоциирование обоих вышеуказанных дефектов (напр.: Fbg Baltimore).
— Дефект построения поперечных связей, которые (под действием Ф. XIII) связывают фибриновые мономеры в фибрилы (напр.: Fbg Oklahoma).
— Ассоциирование дефектов, приведенных в пунктах 2 и 4 (напр.: Fbg Paris I).
Генетическая передача дисфибриногенемии делается преобладающе автосомально. Больные, независимо от пола, могут быть гомозиготами по отношению к пороку (напр.: Fbg Detroit, Metz) или гетерозиготами (напр.: Fbg Zurich I). Обе категории однако делают болезнь из-за доминирующего характера порока. Гомозиготы заболевают в более тяжелой форме, a Fbg в плазме тоже аномалийный; у гетерозиготов болезнь выражается клинически легче (они бывают иногда даже асимптоматичными), а в плазме имеют два населения Fbg: аномалийное и нормальное в приблизительно одинаковой пропорции. Отношение случаев гомозиготизма к случаям гетерозиготизма немного склоняется в пользу последних.
Диагностика дисфибриногенемии
Положительный диагноз дисфибриногенемии основывается на сопоставлении клинических и лабораторных данных, причем значение имеют последние.
— Клинические данные: гередо-коллатеральное, а также и личное прошлое в отношении поведения во время травм и хирургических вмешательств.
— Лабораторные данные: тщательное и по возможности исчерпывающее исследование Fbg при помощи всех возможных тестов.
Дифференциальный диагноз дисфибриногенемии ставится по отношению к следующим заболеваниям:
— Афибриногенемия, но в особенности гипофибриногенемия. Однако они имеют очень низкий уровень фибриногена, a TEG представляет трассу с очень маленьким „та", в то время как дисфибриногенемия имеет характерную трассу с большим ступенчатым „та".
— Лечение гепарином. При этом лечении имеется нормальное TR и если производится проба нейтрализации плазмы сульфатом протамина, все тесты нормализируются.
— ДВС. Здесь имеется сокращение TLGE, наличие фибриновых мономеров в циркуляции и FDP; при дисфибриногенемии все эти тесты дают нормальные результаты.
— Приобретенная дисфибриногенемия бывает чрезвычайно редко. Она встречается в эволюции злокачественных печеночных опухолей, множественной миэломе, болезни Вальденштрема и красная волчанка, при которых протеиновый синтез сильно расстроен и интерферирует с синтезом Fbg. Дифференциация производится на основании диагноза первичного заболевания и тщательного изучения семейного и личного прошлого больного.
Эволюция и осложнения дисфибриногенемии. Эволюция болезни доброкачественная, она не отличается необычной смертностью. Наиболее частым и неприятным осложнением является дегисценция ран. Осложнением, к счастью весьма редким, является возникновение тромбоэмболии, благодаря посредственному качеству фибриновых сгустков, которые однако разрешаются без последствий.
Лечение дисфибриногенемии сравнительно легкое, так как большинство больных является либо асимптоматичными, либо легкого клинического типа. Лечение применяется либо в случаях случайно возникших кровотечений, либо как гемостатическая предоперационная подготовка, после чего следует постоперационное лечение, которое должно обеспечить хорошее заживление раны. Используются те же средства, что и при гипофибриногенемии; схема лечения та же самая. Для тех случаев, когда появляются тромбоэмболические осложнения, лечение гепарином в умеренных дозах хорошо и быстро решает задачу.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ДВС-синдром
ДВС-синдром – расстройство гемостаза, связанное с гиперстимуляцией и дефицитом резервов свертывающей системы крови, приводящее к развитию тромботических, микроциркуляторных и геморрагических нарушений. При ДВС-синдроме наблюдается петехиально-гематомная сыпь, повышенная кровоточивость, дисфункция органов, а в острых случаях – развитие шока, гипотонии, сильных кровотечений, ОДН и ОПН. Диагноз устанавливают по характерным признакам и лабораторным тестам системы гемостаза. Лечение ДВС-синдрома направлено на коррекцию гемодинамики и нарушений свертывающей системы (антиагреганты, антикоагулянты, ангиопротекторы, гемотрансфузии, плазмаферез и др.).
Общие сведения
ДВС-синдром (диссеминированное внутрисосудистое свертывание, тромбогеморрагический синдром) – геморрагический диатез, характеризующийся чрезмерным ускорением внутрисосудистой коагуляции, образованием рыхлых сгустков крови в микроциркуляторной сети с развитием гипоксических и дистрофически-некротических измерений в органах. ДВС-синдром представляет опасность для жизни пациента из-за риска возникновения обширных, плохо купируемых кровотечений и острой дисфункции органов (главным образом, легких, почек, надпочечников, печени, селезенки), имеющих обширную микроциркуляторную сеть.
ДВС-синдром можно рассматривать, как неадекватную защитную реакцию, направленную на ликвидацию кровотечения при повреждении кровеносных сосудов и изоляцию организма от пораженных тканей. Встречаемость ДВС-синдрома в различных отраслях практической медицины (гематологии, реаниматологии, хирургии, акушерстве и гинекологии, травматологии и др.) достаточно велика.
Причины ДВС-синдрома
ДВС-синдром развивается на фоне заболеваний, протекающих с повреждением тканей, эндотелия сосудов и клеток крови, сопровождаемых микрогемодинамическими нарушениями и сдвигом гемостаза в сторону гиперкоагуляции. Основной причиной ДВС-синдрома выступают септические осложнения бактериальных и вирусных инфекций, шок любой природы. ДВС-синдром часто сопутствует акушерской патологии - тяжелому гестозу, предлежанию и преждевременной отслойке плаценты, внутриутробной гибели плода, эмболии амниотической жидкостью, ручному отделению последа, атоническим маточным кровотечениям, а также операции кесарево сечение.
Развитие тромбогеморрагического синдрома могут инициировать метастазирующие злокачественные опухоли (рак легкого, рак желудка), обширные травмы, ожоги, серьезные хирургические вмешательства. Нередко ДВС-синдром сопровождает трансфузию крови и ее компонентов, трансплантацию тканей и органов, протезирование сосудов и клапанов сердца, применение искусственного кровообращения.
Способствовать возникновению ДВС-синдрома могут сердечно-сосудистые заболевания, протекающие с гиперфибриногенемией, увеличением вязкости и снижением текучести крови, механическим препятствием кровотоку атеросклеротической бляшкой. К ДВС-синдрому могут приводить прием медикаментов (ОК, ристомицина, диуретиков), острые отравления (например, ядом змеи) и острые аллергические реакции.
Патогенез
Несостоятельность гемостаза при ДВС-синдроме возникает за счет гиперстимуляции свертывающей и быстрого истощения антикоагулянтной и фибринолитической систем гемостаза.
Развитие ДВС-синдрома обуславливается различными факторами, которые появляются в кровяном русле и напрямую активируют процесс свертывания, либо осуществляют это через медиаторы, воздействующие на эндотелий. В качестве активаторов ДВС-синдрома могут выступать токсины, ферменты бактерий, околоплодные воды, иммунные комплексы, стрессовые катехоламины, фосфолипиды, снижение сердечного выброса и кровотока, ацидоз, гиповолемия и др.
Развитие ДВС-синдрома происходит с последовательной сменой 4-х стадий.
I - начальная стадия гиперкоагуляции и внутрисосудистой агрегации клеток. Обусловлена выбросом в кровь тканевого тромбопластина или веществ, обладающих тромбопластиноподобным действием и запускающих внутренний и внешний пути свертывания. Может продолжаться от нескольких минут и часов (при острой форме) до нескольких дней и месяцев (при хронической).
II - стадия прогрессирующей коагулопатии потребления. Характеризуется дефицитом фибриногена, кровяных пластинок и плазменных факторов вследствие их избыточного расхода на тромбообразование и недостаточного возмещения.
III - критическая стадия вторичного фибринолиза и выраженной гипокоагуляции. Отмечается разбалансировка гемостатического процесса (афибриногенемия, накопление патологических продуктов, разрушение эритроцитов) с замедлением свертывания крови (вплоть до полной неспособности к свертыванию).
IV - стадия восстановления. Наблюдаются либо остаточные очаговые дистрофические и некротические изменения в тканях тех или иных органов и выздоровление, либо осложнения в виде острой органной недостаточности.

Классификация ДВС-синдрома
По выраженности и скорости развития ДВС-синдром может быть острым (в т.ч., молниеносным), подострым, хроническим и рецидивирующим. Острая форма тромбогеморрагического синдрома возникает при массивном выбросе в кровь тромбопластина и ему подобных факторов (при акушерской патологии, обширных операциях, травмах, ожогах, синдроме длительного сдавления тканей). Характеризуется ускоренной сменой стадий ДВС-синдрома, отсутствием нормального защитного антикоагуляционного механизма. Подострая и хроническая формы ДВС-синдрома связаны с обширным изменением поверхности эндотелия сосудов (например, вследствие атеросклеротических отложений), выступающим в роли активирующей субстанции.
ДВС-синдром может проявляться локально (ограниченно, в одном органе) и генерализованно (с поражением нескольких органов или всего организма). По компенсаторному потенциалу организма можно выделить компенсированный, субкомпенсированный и декомпенсированный ДВС-синдром. Компенсированная форма протекает бессимптомно, микросгустки лизируются за счет усиления фибринолиза, факторы свертывания восполняются из резервов и путем биосинтеза. Субкомпенсированная форма проявляется в виде гемосиндрома средней степени тяжести; декомпенсированная - характеризуется каскадными реакциями реактивного фибринолиза, несостоятельностью коагуляционных процессов, несворачиваемостью крови.
ДВС-синдром может протекать с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев гемостаза (смешанный патогенез) или с преобладанием активности одного из них.
Симптомы ДВС-синдрома
Клинические проявления ДВС-синдрома определяются темпом развития и распространенностью поражения, стадией процесса, состоянием компенсаторных механизмов, наслоением симптомов заболевания-индуктора. В основе ДВС-синдрома лежит комплекс тромбогеморрагических реакций и дисфункции органов.
При острой манифестной форме быстро (за несколько часов) развивается генерализованный ДВС-синдром, для которого характерно шоковое состояние с гипотонией, потерей сознания, признаками отека легких и острой дыхательной недостаточности. Гемосиндром выражается нарастающей кровоточивостью, массивными и профузными кровотечениями (легочными, маточными, носовыми, желудочно-кишечными). Характерно развитие очагов ишемической дистрофии миокарда, панкреонекроза, эрозивно-язвенного гастроэнтерита. Молниеносная форма ДВС-синдрома свойственна эмболии околоплодными водами, когда коагулопатия стремительно (в течение нескольких минут) переходит в критическую стадию, сопровождаясь кардиопульмонарным и геморрагическим шоком. Летальность матери и ребенка при этой форме ДВС-синдрома приближается к 80%.
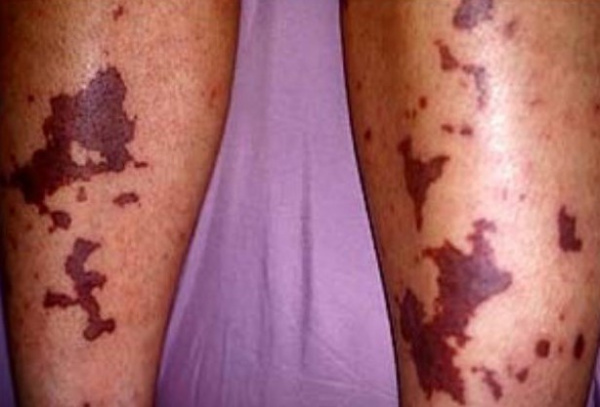
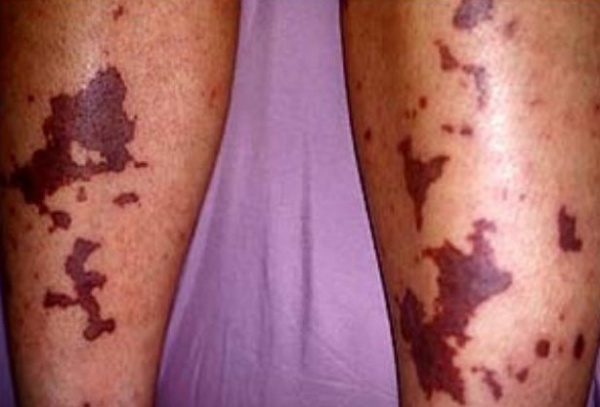
Подострая форма ДВС-синдрома носит локальный характер с более благоприятным течением. Незначительный или умеренный гемосиндром проявляется петехиальной или сливной геморрагической сыпью, синяками и гематомами, усиленной кровоточивостью из мест инъекций и ран, кровотечениями из слизистых оболочек (иногда - «кровавый пот», «кровавые слезы»). Кожа приобретает бледный вид, мраморность, становится холодной на ощупь. В ткани почек, легких, печени, надпочечников, ЖКТ развиваются отек, резкое полнокровие, внутрисосудистая коагуляция, сочетание очагов некроза и множественных кровоизлияний. Самая распространенная - хроническая форма ДВС-синдрома часто имеет бессимптомное течение. Но по мере прогрессирования фонового заболевания нарастают проявления геморрагического диатеза и нарушения функции органов.
ДВС-синдром сопровождается астеническим синдромом, плохим заживлением ран, присоединением гнойной инфекции, развитием келоидных рубцов. К осложнениям ДВС-синдрома относятся гемокоагуляционный шок, острая дыхательная недостаточность, ОПН, некроз печени, язвенная болезнь желудка, инфаркт кишечника, панкреонекроз, ишемический инсульт, острая постгеморрагическая анемия.

Диагностика ДВС-синдрома
Для установления ДВС-синдрома необходимы тщательный сбор анамнеза с поиском этиологического фактора, анализ клинической картины и данных лабораторных исследований (общего анализа крови и мочи, мазка крови, коагулограммы, паракоагуляционных проб, ИФА). Важно оценить характер кровоточивости, уточнить стадию коагулопатии, отражающую глубину нарушений.
Для ДВС-синдрома характерна петехиально-гематомная кровоточивость, геморрагии сразу из нескольких мест. При малосимптомном течении гиперкоагуляция выявляется только лабораторными методами. К обязательным скрининговым тестам относятся определение количества тромбоцитов, фибриногена, АПТВ, протромбинового и тромбинового времени, времени свертывания по Ли-Уайту. Исследование маркеров внутрисосудистого свертывания - РФМК и ПДФ, D-димера методом ИФА и паракоагуляционных проб помогает подтвердить ДВС-синдром.
Критериями ДВС-синдрома являются наличие фрагментированных эритроцитов в мазке крови, дефицит тромбоцитов и фибриногена, повышение концентрации ПДФ, падение активности антитромбина III в сыворотке крови, удлинение АПТВ и тромбинового времени, отсутствие образования или нестабильность сгустка или in vitro. Выполняется оценка функционального состояния «шоковых органов»: легких, почек, печени, сердечно-сосудистой системы, головного мозга. ДВС-синдром необходимо дифференцировать от первичного фибринолиза, других коагулопатических синдромов.
Лечение ДВС-синдрома
Успех лечения ДВС-синдрома возможен при его ранней диагностике. Активные лечебные мероприятия требуются при выраженной симптоматике в виде кровотечений и органной недостаточности. Больных с ДВС-синдромом следует госпитализировать в ОРИТ и при необходимости проводить ИВЛ, активную противошоковую терапию. При малосимптомном ДВС-синдроме основным представляется лечение фоновой патологии, коррекция параметров гемодинамики и функциональных нарушений органов.
Острый ДВС-синдром требует срочного устранения его первопричины, например, экстренного родоразрешения, гистерэктомии - при акушерской патологии или антибиотикотерапии – при септических осложнениях. Для ликвидации гиперкоагуляции показано введение антикоагулянтов (гепарина), дезагрегантов (дипиридамола, пентоксифиллина), фибринолитиков. Больные должны находиться под постоянным динамическим контролем показателей гемостаза.
В качестве заместительной терапии при ДВС-синдроме применяются трансинфузии свежезамороженной плазмы, тромбоцитарной или эритроцитарной массы (при падении уровня тромбоцитов или Hb); криопреципитата (при сердечной недостаточности), физраствора. При кровотечениях, угрожающих жизни, возможно назначение антифибринолитических средств (аминокапроновой к-ты, ингибиторов протеаз). При кожных геморрагиях и ранах накладываются повязки с этамзилатом, гемостатическая губка.
По показаниям применяют кортикостероиды, оксигенотерапию, плазмаферез. Для восстановления микроциркуляции и нарушенных функций органов назначают ангиопротекторы, ноотропные препараты, посиндромную терапию. В случае ОПН проводят гемодиализ, гемодиафильтрацию. При хроническом ДВС-синдроме целесообразно использование дезагрегантов, вазодилататоров, в послеоперационном периоде - гепаринотерапии.
Прогноз и профилактика ДВС-синдрома
Прогноз ДВС-синдрома - вариативный, зависит от основного, этиологически значимого заболевания, тяжести нарушений гемостаза и своевременности начатого лечения. При остром ДВС-синдроме не исключен летальный исход в результате некупируемой большой кровопотери, развития шока, ОПН, острой дыхательной недостаточности, внутренних кровоизлияний. Предупреждение ДВС-синдрома заключается в выявлении пациентов группы риска (особенно, среди беременных и лиц пожилого возраста), лечении фонового заболевания.
Гипофибриногенемия - клиника, диагностика, лечение
Гипофибриногенемия — геморрагический синдром, возникающий благодаря уровню плазматического фибриногена ниже нормального, называющийся иногда и фибриногенопенией или фибринопенией. Он является скорее аномалийным состоянием субъекта, чем болезнью, потому что клинически не проявляется никогда спонтанно; его биологической характеристикой является постоянно пониженный уровень плазматического фибриногена, между 30 и 60 мг/100 мл.
Первые случаи были опубликованы в литературе по специальности в 1935 г. (Risak); с тех пор и до настоящего времени было сообщено о 30 случаях врожденной формы и о множестве случаев приобретенной формы.
Клиника гипофибриногенемии
Гипофибриногенемия не представляет четко очерченной клинической картины, потому что больной никогда не кровоточит спонтанно.
Когда у этих больных появляется геморрагический синдром, он детерминирован одной из следующих причин: возникновение другого расстройства гемостаза, отличного от основного дефекта больного (тромбопения, капиллярная хрупкость, недостаток одного из плазматических факторов коагуляции); открытая или закрытая рана, происшедшая по поводу очень тяжелой травмы; крупное хирургическое вмешательство, которому подвергался больной (отсечение пуповины не влечет за собой геморрагию).
В этих случаях кровоточение явное и принимает клинический аспект геморрагипарного синдрома афибриногенемии, но в более мягкой форме.
Лабораторное исследование при гипофибриногенемии
Тесты на коагуляцию, при помощи которых мы исследуем этих больных, дают результаты, которые можно сгруппировать следующим образом:
а) Тесты отбора (ТС, ТН, РТТ, РТТК, TQ) показывают более или менее удлиненное время (в зависимости от степени фибриногенемии). Что касается TCP — оно в норме,
б) Т тромбина и рептилазы увеличены, что указывает на недостаток фибриногена, в) Т.E.G. показывает низкий „ma", несмотря на то, что тромбоциты и их качество нормальные; следовательно еще один показатель недостатка фибриногена,
г) Дозирование фибриногена подтверждает диагноз: оно показывает низкие цифры, обычно составляя около 50 мг/100 мл. Эти уровни совместимы с ведением нормального образа жизни. Однако когда фибриноген падает ниже этого порога (вследствие преувеличенного расхода, благодаря известным ситуациям) и если в течение этого периода критической гипофибриногенемии происходит тяжелая травма или имеет место хирургическое вмешательство, тогда у носителей этого порока получается клиническое проявление болезни,
д) R.C. широкая и скорая (из-за низкого фибринового материала в сгустке). Это имеет своим последствием высвобождение значительной массы эритроцитов из бедного материала сгустка, что может производить ложное впечатление фибринолиза. е) Все остальные тесты, которые как мы видели, давали и при афибриногенемии нормальные результаты, показывают и в этом случае нормальные цифры.
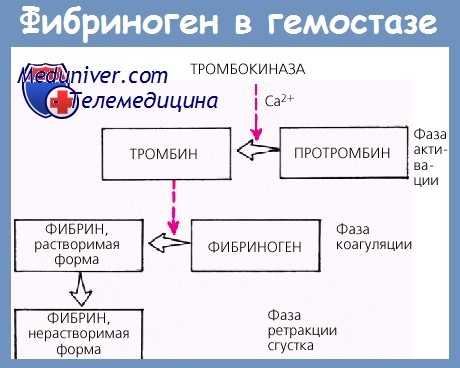
Патофизиология гипофибриногенемии
Гипофибриногенемию можно подразделять на: врожденную (конституциональная фибриногенемия Рисака) и приобретенную.
Приобретенння гипофибриногенемия появляется в результате действия трех возможных механизмов, а именно:
1) Недостаточный синтез Ф.1, вследствие тяжелых заболеваний, затрагивающих печень, туберкулез, аденокарцинома, хроническая гранулоцитарная лейкемия, острая лейкемия, врожденный сифилис, отравление фосфором, отравление хлороформом, острая желтая атрофия и пр.
2) Преувеличенный расход Ф.1., как это наблюдается при всех вариантах синдрома ДВС.
3) Аномалийно сильный и скорый лизис молекулы фибриногена, как это случается при фибринолитических синдромах (фибриногенолитический этап).
Из всех этих условий, лишь первое совпадает со своим конгенитальным гомологом и поэтому мы рассмотрим их вместе в нижеследующем параграфе. Остальные два условия представляют последствия особых нозологических сущностей; они появляются в специальном контексте факторов и будут рассматриваться своевременно (синдром ДВС и фибринолитический синдром).
Кровотечение при гипофибриногенемии того же типа, как и кровотечение при афибриногенемии. Оно может вызываться следующими обстоятельствами: после средних травм (никогда после малых), бывает умеренным и слегка удлиненным, но легко затихает вследствие применения обычных средств (часто оно является сигналом тревоги ведущим к диагнозу болезни); вследствие больших травм или хирургических вмешательств возникает настоящий геморрагический синдром, как при афибриногенемии, но более ограниченной амплитуды — это единственное обстоятельство, когда выражение этого расстройства принимает клинический аспект болезни.
Положительный диагноз гипофибриногенемии ставится таким же образом как и при афибриногенемии. Однако здесь следует заметить, что в случае гипофибриногенемии диагноз ставится гораздо труднее из-за отсутствия клинических проявлений. Так как, чаще всего, речь идет об эффекте тяжелой травмы или хирургического вмешательства, которые вызывают необычно сильное кровотечение, это обстоятельство привлекает внимание врача, который назначает необходимые лабораторные исследования и на основании этих результатов разъясняет положение.
Отличия устанавливаются по отношению любого геморрагического диатеза, представляющего легкие кровотечения. Лабораторные исследования, подтверждающие положительный диагноз, устанавливают также и дифференциальное разграничение, оправдываемое анамнезом больного и предшествующими данными.
Эволюция и осложнения гипофибриногенемии. Во всех случаях болезнь доброкачественная и лишенная осложнений. Те из носителей, которым известен их порок, должны, в профилактических целях, беречься от травм и предупреждать врача в случае хирургических вмешательств. Опасность грозит тем, кто не знает о своем пороке и считает себя нормальным; когда они терпят тяжелую травму или подвергаются (без тщательной проверки) хирургическому вмешательству, у них может возникнуть суровая геморрагия, с которой трудно совладеть. Это единственная критическая ситуация при этом заболевании.
Лечение гипофибриногенемии преследует ту же цель и применяет те же средства, как и при афибриногенемии, имея в виду то обстоятельство, что речь идет о том же основном недостатке, но только разной амплитуды.
Схема лечения более ограниченная, так как уровень фибриногена у больного несколько выше, а тяжесть геморрагических эпизодов меньше. Обычно для их прекращения достаточны 3—4 перфузии фибриногена, применяемые по разу в день через каждые 4 дня. Доза перфузии рассчитывается как и при афибриногенемии, но вводится целиком лишь в первой перфузии, в следующих доза сокращается на половину.
Гипофибриногенемия
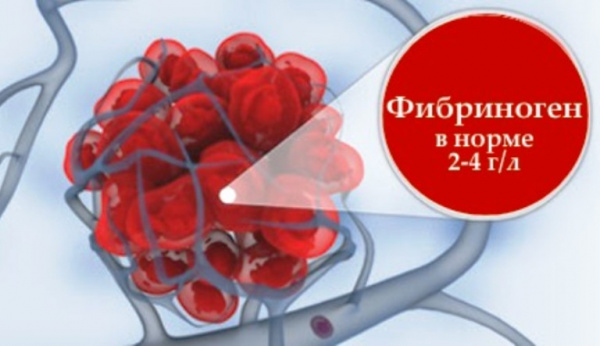
Гипофибриногенемия – это патологическое состояние, характеризующееся снижением содержания фибриногена в крови ниже 2 г/л. Фибриноген является основным белком системы гемостаза, из него формируется тромб, останавливающий кровотечение при повреждении сосудистой стенки. Гипофибриногенемия клинически проявляется геморрагическим синдромом и может развиваться вследствие осложнений беременности, на фоне введения лекарственных препаратов, при тяжелых болезнях печени и пр. Уровень фибриногена исследуется в плазме крови как компонент коагулограммы наряду с МНО, АЧТВ, тромбиновым временем. Коррекция данного состояния осуществляется путем введения свежезамороженной плазмы и устранения этиологического фактора.
Классификация
По природе происхождения гипофибриногенемии можно разделить на:
- Врожденные (так называемые дисфибриногенемии). Это наследственно обусловленные аномалии в структуре фибриногена, часто сочетающиеся со снижением его выработки.
- Приобретенные. Развиваются вследствие заболеваний печени, тромбогеморрагических нарушений и т.д.
Также различают физиологические и патологические гипофибриногенемии. Единственной физиологической причиной считается период новорожденности. В первые дни жизни белковосинтетическая функция печени только начинает формироваться, поэтому норма фибриногена для новорожденных детей ниже, чем у взрослых, и составляет от 1,25 г/л. Все остальные разновидности гипофибриногенемии являются патологическими.
Причины гипофибриногенемии
Заболевания печени
Наиболее распространенной причиной гипофибриногенемии являются болезни печени. Печень – единственный орган, синтезирующий основные белки плазмы крови, в том числе и фибриноген. При тяжелых поражениях печени, уже на стадии печеночной недостаточности, когда происходит массивное разрушение гепатоцитов (цитолиз), в ней прекращается выработка белков. Такое может наблюдаться при следующих патологиях:
- Гепатиты: алкогольный, лекарственный, аутоиммунный, вирусные гепатиты В и С.
- Цирроз печени различной этиологии.
- Первичный склерозирующий холангит.
- Поражения печени при метаболических расстройствах: гемохроматозе, болезни Вильсона-Коновалова.
ДВС-синдром
Еще одной довольно частой причиной гипофибриногенемии выступает крайне тяжелое и жизнеугрожающее состояние – синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), а точнее, его гипокоагуляционная стадия. ДВС-синдром представляет собой расстройство, в начальной фазе которого происходит генерализованное тромбообразование.
Избыточное формирование тромбов приводит к резкому увеличению потребления факторов свертывания, включая фибриноген. В результате этого кровь теряет способность сворачиваться, развиваются кровотечения, нередко фатальные. Заболевания и патологические состояния, вызывающие ДВС-синдром:
- Генерализованные инфекции (сепсис).
- Травматический шок.
- Острый внутрисосудистый гемолиз: переливание несовместимой крови, врожденные гемолитические анемии (серповидно-клеточная анемия, талассемии).
- Злокачественные новообразования.
- Тромботические микроангиопатии: гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура.
- Антифосфолипидный синдром.
- Отравление змеиным ядом.
Беременность
При нормально протекающей беременности происходят некоторые изменения в системе гемостаза, и уровень фибриногена может подняться выше нормы (физиологическая гиперфибриногенемия). Однако, при различных осложнениях, связанных с периодом беременности, концентрация фибриногена снижается. Гипофибриногенемия у беременных женщин может свидетельствовать о следующих состояниях:
- Преждевременная отслойка плаценты.
- Эмболия околоплодными водами.
- Длительное нахождение мертвого плода в матке.
Наследственные гипофибриногенемии
В редких случаях гипофибриногенемия может быть обусловлена мутациями генов, кодирующих синтез фибриногена. К таким патологиям относятся наследственная афибриногенемия (полное отсутствие фибриногена) и гиподисфибриногенемии (аномальные структуры фибриногена в сочетании с уменьшением его выработки). В большинстве случаев клинических симптомов либо нет вообще, либо наблюдаются незначительные геморрагические элементы на коже в виде петехиальных высыпаний. Однако известны и случаи возникновения парадоксальных тромбозов у таких больных.
Введение лекарственных препаратов
Под действием некоторых лекарственных препаратов, применяющихся в лечении острого инфаркта миокарда, ишемического инсульта, а также других видов тромбозов, в крови может снижаться концентрация фибриногена. Эта группа медикаментов называется фибринолитики. Они разделяются на 2 основные подгруппы, вызывающие растворение образовавшихся тромбов. Активаторы плазминогена переводят неактивный плазминоген в активный плазмин, стимулирующий лизис нитей фибрина (тромболизис). Активаторы профибринолизина действуют на эндогенную фибринолитическую систему организма. Все эти ЛС способны вызвать гипофибриногенемию и кровотечения.
Диагностика
Так как причиной гипофибриногенемии могут быть очень серьезные и жизнеугрожающие состояния, ее обнаружение требует немедленного обращения к врачу-терапевту. При подозрении на патологию печени обращают внимание на окраску кожи и слизистых оболочек, выполняют пальпацию печени. Характерные признаки цирроза печени – желтуха, асцит, телеангиэктазии, расширение поверхностных вен области живота. Проводится осмотр кожных покровов на наличие геморрагических элементов – петехиальных высыпаний, экхимозов, гематом. Назначаются дополнительные методы исследования, включающие:
- Общий анализ крови. У больных с ДВС-синдромом и тяжелой патологией печени отмечается резкое снижение уровня тромбоцитов, эритроцитов, гемоглобина. При микроскопии мазка крови пациентов с тромботическими микроангиопатиями обнаруживают шизоциты – морфологические признаки гемолиза.
- Биохимический анализ крови. При заболеваниях печени в крови повышено содержание трансаминаз (АЛТ, АСТ), билирубина, щелочной фосфатазы, снижена концентрация альбумина. Биохимический лабораторный маркер хронического алкоголизма – углеводдефицитный трансферрин.
- Исследования гемостаза. В рутинной коагулограмме, помимо гипофибриногенемии, отмечается удлинение тромбинового и активированного частичного тромбопластинового времени, увеличение МНО. При тромбоэластографии выявляется замедление образования фибринового сгустка.
- Иммунологические исследования. Всех пациентов обязательно проверяют на наличие HbsAg и антител к вирусу гепатита С. При положительном результате выполняется ПЦР с определением вирусной нагрузки и генотипа вируса. В случае подозрения на аутоиммунные патологии печени проводятся анализы на антитела к гладкомышечным клеткам, к микросомам печени, антинуклеарные антитела (ANA, анти-LKM, анти-SMA).
- УЗИ. При УЗИ печени можно выявить ее увеличение, диффузные изменения паренхимы. Акушерское УЗИ позволяет диагностировать осложнения беременности – отслойку плаценты, гибель плода.
- Генетические исследования. Наследственные формы гипофибриногенемии подтверждаются анализом на генетические мутации. Наиболее частыми считаются мутации в генах FGA и FGG.
Коррекция
Медикаментозная терапия
В подавляющем числе случаев терапия таких пациентов ввиду их тяжелого состояния должна проводиться в условиях реанимации и интенсивной терапии. Лишь при бессимптомных формах дисфибриногенемий никакого лечения не требуется. Определение тактики ведения больных, подбор лекарственных препаратов, их дозировки, длительности применения осуществляется только лечащим врачом строго индивидуально. Ведущее направление лечения – купирование кровотечений и профилактика их возникновения. Методы консервативной терапии при гипофибриногенемии:
- Местная гемостатическая терапия. При умеренных кровотечениях, например носовых, достаточно локальных воздействий – давлением, холодом или гемостатической губкой с тромбином.
- Гемотрансфузии. Основу лечения гипофибриногенемии с массивными кровотечениями составляет заместительная терапия – переливания свежезамороженной плазмы, криопреципитата, факторов свертывания.
- Гемостатические ЛС. В дополнение к гемотрансфузиям для борьбы с кровотечениями назначаются препараты, ускоряющие тромбообразование, либо, наоборот, замедляющие растворение тромбов. К ним относятся ингибиторы фибринолиза, активаторы плазминогена, антиферментные средства.
Помимо непосредственной коррекции гипофибриногенемии и борьбы с ее геморрагическими осложнениями, важную роль играет лечение основного заболевания. Больным с алкогольным гепатитом категорически запрещается принимать алкоголь, при лекарственном гепатите срочно прекращается прием гепатотоксического медикамента. В зависимости от этиологии используются следующие лекарственные препараты:
- Противовирусные ЛС. Пациентам с вирусным гепатитом назначаются аналоги нуклеозидов, препараты интерферона, ингибиторы протеазы и РНК-полимеразы.
- Антибиотики. С целью борьбы с сепсисом применяются 2 антибактериальных препарата. До получения результатов микробиологического исследования (бактериального посева) предпочтение отдают антибиотикам с широким спектром действия – пенициллинам, цефалоспоринам, фторхинолонам.
- Противовоспалительные ЛС. При аутоиммунной патологии гепатобилиарной системы (аутоиммунный гепатит, склерозирующий холангит) необходимы ЛС, подавляющие воспалительный процесс – глюкокортикостероиды, цитостатики.
- Гепатопротекторы. Для защиты клеток печени от повреждения и ускорения регенерации гепатоцитов используются препараты желчных кислот, производные аминокислот.
Хирургическое вмешательство
Так как гипофибриногенемия зачастую является признаком крайне неблагоприятного течения беременности, по жизненным показаниям проводится экстренное родоразрешение путем кесарева сечения. При маточном кровотечении, не поддающемся остановке, выполняется полное удаление матки (гистерэктомия). При нахождении в матке мертвого плода проводится операция по его извлечению.
Экспериментальное лечение
Некоторые больные с тяжелыми формами дисфибриногенемии, сопровождающимися массивными кровотечениями, нуждаются в постоянных переливаниях компонентов крови (плазмы, криопреципитата). Поэтому они имеют высокий риск инфицирования гепатитами В, С, ВИЧ. В Китае был разработан и проходит клиническую апробацию рекомбинантный человеческий фибриноген с двойной вирусинактивацией FIBROAAS. Данный препарат может стать альтернативой непрерывным гемотрансфузиям. Однако, по результатам некоторых исследователей, применение человеческого фибриногена сопряжено с повышенным риском тромбообразования. Поэтому его использование возможно только при регулярном лабораторном мониторинге параметров системы гемостаза.
Прогноз
Основными причинами гипофибриногенемии являются тяжелые заболевания, нередко фатальные. Поэтому прогноз для большинства пациентов неблагоприятный. Доброкачественное течение характерно лишь для бессимптомных форм наследственных дисфибриногенемий. Несмотря на это, своевременная диагностика и грамотное лечение способны привести к более благоприятному исходу, и даже к выздоровлению.
3. Гемостаз. Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний// Петрищева Н.Н., Папаян Л.П. – 1999.
Гиперфибриногенемия
Гиперфибриногенемия – патологическое состояние, характеризующееся увеличением концентрации фибриногена в крови более 4 г/л. Помимо важного участия в свертывании крови, фибриноген является одним из основных белков острой фазы. Поэтому любой вид клеточного или тканевого повреждения либо воспалительный процесс сопровождается усилением выработки этого белка. Причиной гиперфибриногенемии могут быть острые инфекции, травмы, ожоги и пр. Уровень фибриногена исследуется в плазме крови в рамках стандартной коагулограммы. Коррекция осуществляется лечением основного заболевания.
Причины гиперфибриногенемии
В период беременности многие системы организма претерпевают значительные изменения. Изменению подвергается и свертывающая система крови. Под влиянием возрастающей концентрации женских половых гормонов (эстрогенов, прогестерона) увеличивается синтез фибриногена, а также активируются другие компоненты гемостаза.
Все эти процессы имеют физиологический смысл, так как обеспечивают предотвращение возможной кровопотери во время родов, которая может быть фатальной для плода. Содержание фибриногена начинает нарастать с середины первого триместра беременности и достигает максимума к концу третьего триместра (иногда составляет до 6 г/л). После родов фибриноген постепенно возвращается к нормальным значениям, поэтому гиперфибриногенемия при беременности не требует никакого лечения.
Инфекции
При любых острых инфекционных заболеваниях, особенно генерализованных (менингококцемия, сепсис), в той или иной степени выраженности происходит выработка медиаторов воспаления и цитокинов – интерлейкинов 1 и 6, фактора некроза опухоли и т.д. Под их действием в печени синтезируются острофазовые белки, такие как С-реактивный белок, белки системы комплемента и фибриноген.
Эти белки оказывают помощь в функционировании клеток иммунной системы (Т-и В-лимфоцитов, нейтрофилов): способствуют миграции клеток к очагу воспаления, стимулируют фагоцитоз, нейтрализуют свободные радикалы. Концентрация фибриногена увеличивается в период разгара болезни и возвращается к норме в течение нескольких дней после выздоровления. Сама по себе гиперфибриногенемия не имеет никаких клинических признаков, а также не требует вмешательства.
Инфаркт миокарда
При инфаркте миокарда возникает некроз участка сердечной мышцы, а также развивается асептическое воспаление. Секретирующиеся острофазовые белки (фибриноген, СРБ) способствуют связыванию и удалению эндогенных веществ, которые образуются в результате деструкции клеток. Гиперфибриногенемия достигает максимума к 5-му дню от развития ИМ и саморазрешается к концу 3 недели.
Прием оральных контрацептивов
Так как женские половые гормоны в высоких концентрациях непосредственно влияют на свертывающую систему крови, а именно, способны вызвать гиперкоагуляцию, длительная гормональная терапия оральными контрацептивами, содержащими эстрогены, может сопровождаться гиперфибриногенемией.
Гормональные препараты имеют довольно широкий спектр применения: предотвращение нежелательной беременности, лечение ряда гинекологических и эндокринных расстройств, борьба с осложнениями тяжело протекающей менопаузы. Клиническим признаком гиперфибриногенемии на фоне приема этих гормональных средств могут быть тромбозы, наиболее часто – тромбоз глубоких вен нижних конечностей.
Злокачественные новообразования
Рост злокачественной опухоли сопровождается разрушением окружающих тканей. При интенсивном распаде клеток в системный кровоток попадают потенциально токсические вещества (калий, миоглобин). Их связывание, нейтрализация и элиминация происходит с участием фибриногена и других белков. Степень гиперфибриногенемии определяется агрессивностью роста образования.
Другие причины
Существуют некоторые заболевания и патологические состояния, которые могут сопровождаться гиперфибриногенемией, однако, механизм ее развития остается неизвестным. Гиперфибриногенемия при данных болезнях не имеет клинических признаков и не требует лечения:
- Эндокринные расстройства: аутоиммунный тиреоидит Хашимото, послеоперационный или врожденный гипотиреоз.
- Болезни накопления: амилоидоз.
При высоких значениях фибриногена нужно обязательно обратиться к врачу-терапевту для выяснения причины. В первую очередь уточняется, принимает ли пациент какие-либо лекарственные препараты. При подозрении на беременность врач спрашивает о дате последней менструации и о наличии симптомов, которые могут быть косвенным признаком беременности – резкое увеличение аппетита, тошнота по утрам. Назначаются дополнительные методы исследования:
- Общий анализ крови. У многих пациентов с гиперфибриногенемией в клиническом анализе крови отмечается лейкоцитоз, увеличение СОЭ.
- Биохимический анализ крови. В биохимическом анализе крови довольно часто обнаруживается высокий СРБ. У больных с инфарктом миокарда выявляется увеличение концентрации МВ-фракции креатининфосфокиназы, лактатдегидрогеназы, аспартатаминотрансферазы.
- Общий анализ мочи. В анализе мочи нередко отмечаются реактивные изменения – лейкоцитурия, изменения относительной плотности. Иногда можно обнаружить значительную протеинурию (при раке почки, амилоидозе).
- Гормональные исследования. Если подозревается беременность, кровь и мочу исследуют на содержание хорионического гонадотропного гормона (ХГЧ). При гипотиреозе в крови определяют уровень тиреотропного гормона, свободного Т4 и Т3, антител к тиреопероксидазе.
- Иммунологические исследования. При инфаркте увеличивается содержание кардиомаркеров – тропонина и миоглобина. При сепсисе повышены уровни прокальцитонина и пресепсина. В зависимости от локализации злокачественной опухоли в крови могут быть увеличены уровни различных онкомаркеров – альфафетопротеина, СА-19-9, СА15-3.
- ЭКГ. Основные электрокардиографические признаки инфаркта – патологический зубец Q, подъем и депрессия сегмента ST в противоположных отведениях. Иногда выявляются нарушения ритма – АВ-блокады, желудочковая тахикардия, фибрилляция желудочков.
- Эхокардиография. На УЗИ сердца при ИМ визуализируются участки гипокинеза. При развитии острой сердечной недостаточности фракция выброса снижается меньше 65%. У части пациентов через неделю после ИМ в рамках синдрома Дресслера может обнаруживаться перикардиальный выпот.
- Коронарная ангиография. Золотым стандартом диагностики инфаркта считается коронарография. Она позволяет определить локализацию стеноза коронарной артерии по дефекту наполнения рентгеноконтрастным веществом.
- Гистологические исследования. Для подтверждения наличия злокачественного образования необходима биопсия. Общие гистологические признаки опухолей – выраженная атипия клеток, нарушение ядерно-цитоплазматического соотношения.
Если причиной гиперфибриногенемии послужил прием пероральных контрацептивов, во избежание развития тромбозов может потребоваться отмена данных препаратов при наличии у пациентки факторов риска (лишний вес, курение, наследственные тромбофилии). Во всех остальных случаях, за исключением беременности, для коррекции гиперфибриногенемии необходима терапия основного заболевания. Применяются следующие виды лечения:
- Элиминация инфекционного возбудителя. При бактериальной инфекции применяют антибактериальные средства. В случае сепсиса используют 2 антибиотика широкого спектра действия – пенициллины, цефалоспорины, фторхинолоны. При гриппе эффективными препаратами являются ингибиторы нейраминидазы.
- Терапия инфаркта миокарда. Для купирования болевого приступа больному вводят наркотические анальгетики, для предотвращения повторного тромбообразования и увеличения зоны повреждения сердечной мышцы назначают антиагреганты и антикоагулянты.
- Химиотерапия. Чтобы перевести пациента со злокачественным онкологическим заболеванием в стадию ремиссии ему проводятся курсы химиотерапии с комбинацией различных цитостатических препаратов – алкилирующих агентов, аналогов нуклеозидов, антиметаболитов.
- Гормональная терапия. Для коррекции гипотиреоза назначаются синтетические препараты, содержащие гормоны щитовидной железы. Доза подбирается индивидуально, учитывая возраст пациента, наличие сопутствующих хронических заболеваний, особенно заболеваний сердца. Контроль эффективности лечения осуществляется определением уровня ТТГ.
Хирургическое лечение
Больным с ИМ проводится операция по реваскуляризации, т.е. восстановлению кровотока в коронарных артериях ‒ чрескожная транслюминальная балонная ангиопластика с последующим стентированием. Через бедренную или лучевую артерию вводится катетер и устанавливается в пораженную коронарную артерию. В месте стеноза с помощью высокого давления происходит разрушение атеросклеротической бляшки, затем на это место ставится стент, расширяющий просвет сосуда.
Больным с множественным поражением коронарных артерий на нескольких участках стентирование будет малоэффективно, поэтому им выполняется открытая операция – аортокоронарное шунтирование. Пациентам с амилоидозом часто требуется трансплантация почки.
Гиперфибриногененемия является признаком тяжести многих воспалительных процессов и может свидетельствовать о неблагоприятном прогнозе. Также она выступает фактором риска венозных или артериальных тромбозов. Поэтому данное лабораторное отклонение требует дальнейшего обследования для своевременной диагностики и лечения заболеваний.
3. Гемостаз. Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний/ Петрищева Н.Н., Папаян Л.П. - 1999.
Читайте также:
