Глаза при аутоиммунном тиреоидите. Экзофтальм при микседеме
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Также: Хронический аутоиммунный тиреоидит, аутоиммунный лимфоцитарный тиреоидит, тиреоидит Хашимото, лимфоаденоматозный зоб, лимфоматозная струма.
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Аутоиммунный тиреоидит - хроническое воспалительное заболевание щитовидной железы (ЩЖ) аутоиммунного генеза, при котором в результате хронически прогрессирующей лимфоидной инфильтрации происходит постепенная деструкция ткани ЩЖ, чаще всего приводящая к развитию первичного гипотиреоза Гипотиреоз - синдром недостаточности щитовидной железы, характеризующийся нервно-психическими расстройствами, отеками лица, конечностей и туловища, брадикардией
.
Заболевание впервые было описано японским хирургом Х.Хашимото в 1912 г. Развивается чаще у женщин после 40 лет. Не вызывает сомнения генетическая обусловленность заболевания, реализующаяся при воздействии факторов окружающей среды (длительный прием избыточного количества йода, ионизирующая радиация, влияние никотина, интерферона). Наследственный генез заболевания подтверждается фактом ассоциации его с определенными антигенами системы HLA, чаще с HLA DR3 и DR5.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Аутоиммунный тиреоидит (АИТ) подразделяют на:
1. Гипертрофический АИТ (зоб Хашимото, классический вариант) - характерно увеличение объема щитовидной железы, гистологически в ткани ЩЖ выявляется массивная лимфоидная инфильтрация с формированием лимфоидных фолликулов, оксифильная трансформация тироцитов.
2. Атрофический АИТ - характерно уменьшение объема ЩЖ, в гистологической картине преобладают признаки фиброза .
Этиология и патогенез
Аутоиммунный тиреоидит (АИТ) развивается на фоне генетически детерминированного дефекта иммунного ответа, приводящего к Т-лимфоцитарной агрессии против собственных тироцитов, заканчивающейся их разрушением. Генетическая обусловленность развития подтверждается фактом ассоциации АИТ с определенными антигенами системы HLA, чаще с HLA DR3 и DR5.
В 50% случаев у родственников пациентов с АИТ обнаруживаются циркулирующие антитела к щитовидной железе. Кроме того, наблюдается сочетание АИТ у одного и того же пациента или в пределах одной семьи с другими аутоиммунными заболеваниями - СД 1 типа, витилиго Витилиго - идиопатическая дисхромия кожи, характеризующаяся появлением депигментированных пятен различных размеров и очертаний молочно-белого цвета с окружающей их зоной умеренной гиперпигментации
, пернициозной анемией, хроническим аутоиммунным гепатитом, ревматоидным артритом и др.
Гистологическая картина характеризуется лимфоцитарной и плазмоцитарной инфильтрацией, онкоцитарной трансформацией тироцитов (образование клеток Гюртле-Ашкенази), разрушением фолликулов и пролиферацией Пролиферация - увеличение числа клеток какой-либо ткани вследствие их размножения
фиброзной (соединительной) ткани, которая замещает нормальную структуру ЩЖ.
Эпидемиология
У женщин встречается в 4-6 раз чаще, чем у мужчин. Соотношение лиц в возрасте 40-60 лет, страдающих аутоиммунным тиреоидитом, между мужчинами и женщинами составляет 10-15:1.
Среди населения различных стран АИТ встречается в 0,1-1,2% случаев (у детей), у детей на 3 больных девочки приходится один мальчик. АИТ редко встречается у детей младше 4 лет, максимум заболеваемости приходится на середину пубертатного периода. У 10-25% практически здоровых лиц с эутиреозом Эутиреоз - нормальное функционирование щитовидной железы, отсутствие симптомов гипо- и гипертиреоза
могут быть обнаружены антитереоидные антитела. Заболеваемость выше у лиц с HLA DR3 и DR5.
Факторы и группы риска
Группы риска :
1. Женщины старше 40 лет, с наследственной предрасположенностью к заболеваниям щитовидной железы или при наличии таковых у ближайших родственников.
2. Лица с HLA DR3 и DR5. Атрофический вариант аутоиммунного тиреоидита ассоциирован с гаплотипом Гаплотип - совокупность аллелей на локусах одной хромосомы (различные формы одного и того же гена, расположенные в одинаковых участках), обычно наследуемых вместе
HLA DR3, а гипертрофический вариант с DR5 HLA-системы.
Фактор риска: длительный прием больших доз йода при спорадическом зобе.
Клиническая картина
Cимптомы, течение
Заболевание развивается постепенно - в течение нескольких недель, месяцев, иногда лет.
Клиническая картина зависит от стадии аутоиммунного процесса, степени поражения щитовидной железы.
Эутиреоидная фаза может продолжаться многие годы или десятилетия, или даже на протяжении всей жизни.
Далее по мере прогрессирования процесса, а именно - постепенной лимфоцитарной инфильтрации ЩЖ и деструкции ее фолликулярного эпителия, число клеток, продуцирующих тиреоидные гормоны, уменьшается. В этих условиях, для того чтобы обеспечить организм достаточным количеством тиреоидных гормонов, усиливается выработка ТТГ (тиреотропного гормона), который гиперстимулирует ЩЖ. За счет этой гиперстимуляции на протяжении неопределенного времени (иногда десятков лет) удается сохранять продукцию Т4 на нормальном уровне. Это фаза субклинического гипотиреоза, где нет явных клинических проявлений, но уровень ТТГ повышен при нормальных значениях Т4.
При дальнейшем разрушении ЩЖ число функционирующих тиреоцитов падает ниже критического уровня, концентрация Т4 в крови снижается и манифестирует гипотиреоз, проявляясь фазой явного гипотиреоза.
Довольно редко АИТ может манифестировать транзиторной тиреотоксической фазой (хаши-токсикоз). Причиной хаши-токсикоза может быть как деструкция ЩЖ, так и ее стимуляция за счет транзиторной выработки стимулирующих антител к рецептору ТТГ. В отличие от тиреотоксикоза при болезни Грейвса (диффузный токсический зоб), хаши-токсикоз в большинстве случаев не имеет выраженной клинической картины тиреотоксикоза и протекает как субклинический (сниженное ТТГ при нормальных значениях Т3 и Т4).
Главным объективным признаком заболевания является зоб (увеличение щитовидной железы). Таким образом основные жалобы больных связаны с увеличением объема ЩЖ:
- чувство затруднения при глотании;
- затруднение дыхания;
- нередко небольшая болезненность в области ЩЖ.
При гипертфроической форме ЩЖ визуально увеличена, при пальпации имеет плотную, неоднородную ("неровную") структуру, не спаяна с окружающими тканями, безболезненная. Иногда может расцениваться как узловой зоб или рак ЩЖ. Напряженность и небольшая болезненность ЩЖ могут отмечаться при быстром увеличении ее размеров.
При атрофической форме объем ЩЖ уменьшен, при пальпации также определяется неоднородность, умеренная плотность, с окружающими тканями ЩЖ не спаяна.
Диагностика
К диагностическим критериям аутоиммунного тиреоидита относят:
1. Повышение уровня циркулирующих антител к щитовидной железе (антитела к тиреопероксидазе (более информативно) и антитела к тиреоглобулину).
2. Обнаружение типичных ультразвуковых данных АИТ (диффузное снижение эхогенности ткани ЩЖ и увеличение ее объема при гипертрофической форме, при атрофической форме - уменьшение объема ЩЖ, как правило меньше 3 мл, с гипоэхогенностью).
3. Первичный гипотиреоз (манифестный или субклинический).
При отсутствии хотя бы одного из перечисленных критериев, диагноз АИТ носит вероятностный характер.
Пункционная биопсия ЩЖ для подтверждения диагноза АИТ не показана. Ее проводят для дифференциальной диагностики с узловым зобом.
После установления диагноза, дальнейшее исследование динамики уровня циркулирующих антител к ЩЖ с целью оценки развития и прогрессирования АИТ, не имеет диагностического и прогностического значения.
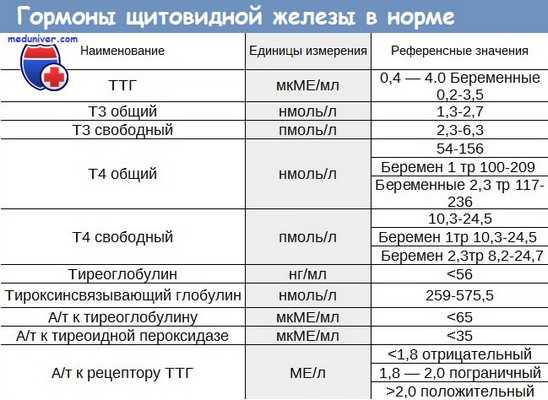
У женщин, планирующих беременность, при выявлении антител к ткани ЩЖ и/или при ультразвуковых признаках АИТ, необходимо исследовать функцию ЩЖ (определение уровня ТТГ и Т4 в сыворотке крови) перед наступлением зачатия, а также в каждом триместре беременности.
Лабораторная диагностика
1. Общий анализ крови: нормо- или гипохромная анемия.
2. Биохимический анализ крови: изменения характерные для гипотиреоза (повышение уровня общего холестерина, триглицеридов, умеренное увеличение креатинина, аспартат-трансаминазы).
3. Гормональное исследование: возможны различные варианты нарушения функции ЩЖ:
- повышение уровня ТТГ, содержание Т4 в пределах нормы (субклинический гипотиреоз);
- повышение уровня ТТГ, снижение Т4 (манифестный гипотиреоз);
- снижение уровня ТТГ, концентрация Т4 в пределах нормы (субклинический тиреотоксикоз).
Без гормональных изменений функции ЩЖ диагноз АИТ не правомочен.
4. Выявление антител к ткани ЩЖ: как правило, отмечается повышение уровня антител к тиреопероксидазе (ТПО) или тиреоглобулину (ТГ). Одновременный подъем титра антител к ТПО и ТГ указывает на наличие или высокий риск аутоиммунной патологии.
Дифференциальный диагноз
Дифференциально-диагностический поиск при аутоиммунном тиреоидите необходимо проводить в зависимости от функционального состояния ЩЖ и характеристики зоба.
Гипертиреоидную фазу (хаши-токсикоз) следует дифференцировать с диффузным токсическим зобом.
В пользу аутоиммунного тиреоидита свидетельствуют:
- наличие аутоиммунного заболевания (в частности АИТ) у близких родственников;
- субклинический гипертиреоз;
- умеренная выраженность клинических симптомов;
- непродолжительный период тиреотоксикоза (менее полугода);
- отсутствие повышения титра антител к рецептору ТТГ;
- характерная УЗИ-картина;
- быстрое достижение эутиреоза при назначении незначительных доз тиреостатиков.
Эутиреоидную фазу следует дифференцировать с диффузным нетоксическим (эндемическим) зобом (особенно в районах с йоддефицитной недостаточностью).
Псевдоузловая форма аутоиммунного тиреоидита дифференцируется с узловым зобом, раком щитовидной железы. Пункционная биопсия в данном случае является информативной. Типичным морфологическим признаком для АИТ является локальная или распространенная инфильтрация лимфоцитами ткани ЩЖ (очаги поражения состоят из лимфоцитов, плазматических клеток и макрофагов, наблюдается пенетрация лимфоцитов в цитоплазму ацинарных клеток, что не характерно для нормальной структуры ЩЖ), а также наличие больших оксифильных клеток Гюртле-Ашкенази.
Осложнения
Лечение
Цели лечения:
1. Компенсация функции щитовидной железы (поддержание концентрации ТТГ в пределах 0,5 - 1,5 мМЕ/л).
2. Коррекция нарушений, связанных с увеличением объема щитовидной железы (при наличии).
В настоящее время признано неэффективным и нецелесообразным использование левотироксина натрия при отсутствии нарушений функционального состояния ЩЖ, а также глюкокортикоидов, иммунодепрессантов, плазмофереза/гемосорбции , лазерной терапии с целью коррекции антитиреоидных антител.
Доза левотироксина натрия, требующаяся для заместительной терапии при гипотиреозе на фоне АИТ, составляет в среднем 1,6 мкг/кг массы тела в сутки или 100-150 мкг/сут. Традиционно при подборе индивидуальной терапии L-тироксин назначают, начиная с относительно малых доз (12,5-25 мкг/сут.), постепенно повышая их до достижения эутиреоидного состояния.
Левотироксин натрий внутрь утром натощак, за 30 мин. до завтрака, 12.5-50 мкг/сут., с последующим повышением дозы на 25-50 мкг/сут. до 100-150 мкг/сут. - пожизненно (под контролем уровня ТТГ).
Спустя год делается попытка отмены препарата, чтобы исключить транзиторный характер нарушений функции ЩЖ.
Эффективность терапии оценивают по уровню ТТГ: при назначении полной заместительной дозировки - через 2-3 месяца, затем 1 раз в 6 месяцев, в дальнейшем - 1 раз в год.
Согласно клиническим рекомендациям Российской ассоциации эндокринологов, физиологические дозы йода (около 200 мкг/сут.) не оказывают отрицательного влияния на функцию ЩЖ при уже существующем гипотиреозе, вызванном АИТ. При назначении препаратов, содержащих йод, следует помнить о возможном повышении потребности в тиреоидных гормонах.
В гипертиреоидной фазе АИТ не следует назначать тиреостатики, лучше обойтись симптоматической терапией (ß-адреноблокаторы): пропронолол внутрь 20-40 мг 3-4 раза в день, до ликвидации клинических симптомов.
Оперативное лечение показано при значительном увеличении ЩЖ с признаками компрессии окружающих органов и тканей, а также при быстром росте размеров ЩЖ на фоне длительно существующего умеренного увеличения ЩЖ.
Прогноз
Естественным течением аутоиммунного тиреоидита является развитие стойкого гипотиреоза, с назначением пожизненной заместительной гормонотерапии левотироксином натрия.
Вероятность развития гипотиреоза у женщины с повышенным уровнем АТ-ТПО и нормальным уровнем ТТГ составляет около 2% в год, вероятность развития явного гипотиреоза у женщины с субклиническим гипотиреозом (ТТГ повышена, Т4 в норме) и повышенном уровне АТ-ТПО составляет 4,5% в год.
У женщин-носительниц АТ-ТПО без нарушения функции ЩЖ, при наступлении беременности повышается риск развития гипотиреоза и так называемой гестационной гипотироксинемии. В связи с этим у таких женщин необходим контроль функции ЩЖ на ранних сроках беременности, а при необходимости и на более поздних сроках.
Глаза при аутоиммунном тиреоидите. Экзофтальм при микседеме
Аутоиммунный тиреоидит: клиника и диагностика
Распространенной патологией среди заболеваний щитовидной железы является аутоиммунный тиреоидит (thyreoiditis; лимфоцитарный тиреоидит, зоб Хасимото). Число операций по поводу аутоиммунного тиреоидита составляет 4,2—5,1 % от числа всех операций на щитовидной железе. У детей на аутоиммунный тиреоидит приходится 40 % случаев всех наблюдений по поводу увеличения щитовидной железы [Калинин А.П., Киселева Т.П.].
В эпидемиологических исследованиях, проведенных в Хабаровске, установлено, что среди заболеваний щитовидной железы аутоиммунный тиреоидит составляет значительную часть — 18 % всех случаев [Котова Л.Н. Рябова Т.Н., Кулагина С.В., Никонова С.Ф.].
Чаще аутоиммунный тиреоидит встречается у женщин. Соотношение женщин и мужчин с этой формой тиреоидита составляет 10—15:1. Наиболее часто заболевание выявляется в возрасте 40—50 лет.
Аутоиммунный тиреоидит обычно развивается постепенно в течение нескольких лет, хотя возможно и более быстрое развитие. Основные жалобы больных связаны с увеличением щитовидной железы, чувством затруднения при глотании, иногда с затруднением дыхания. Может отмечаться незначительная болезненность в области щитовидной железы. Ведущими симптомами являются увеличение щитовидной железы и ее характерная относительная плотность. Железа чаще всего увеличена диффузно, не всегда симметрично, поверхность ровная или бугристая, размеры ее варьируют в широких пределах — от едва заметного увеличения до больших.
По современным представлениям, аутоиммунный тиреоидит является заболеванием весьма неоднородным с точки зрения клинической картины. Т.П.Киселевой в докладе на III Всероссийском съезде эндокринологов представлены результаты клинико-иммуноморфологического обследования 576 больных аутоиммунным тиреоидитом. У 70,4 % обследованных выявлены признаки субклинического гипотиреоза, у 28 % установлен эутиреоз, а у 1,6 % обнаружен тиреотоксикоз.
В диагностике аутоиммунного тиреоидита важное значение имеют данные цитологического анализа биоптатов щитовидной железы, получаемых при аспирационной пункции или трепанобиопсии. Для аутоиммунного тиреоидита характерно наличие в пунктате лимфоцитов, клеток Ашкенази—Гюртля, значительно реже встречаются плазматические клетки.
По данным непрямой тиреолимфографии с использованием сверхжидких масляных контрастных препаратов (липоидола, миодила и др.), при аутоиммунном тиреоидите сохраняется четкое изображение щитовидной железы, преимущественно с субкапсулярным распределением контрастного вещества и длительной его задержкой. Структурный рисунок щитовидной железы приобретает вид грубых гранул и трабекул различной величины.
Большое значение при аутоиммунном тиреоидите имеет оценка функционального состояния щитовидной железы, что позволяет назначать соответствующую гормонотерапию. В этих случаях наиболее информативным является тест с тиролиберином, реакция на введение которого при гипотиреозе повышена.
В дифференциальной диагностике аутоиммунного тиреоидита определенную роль играет ультразвуковое исследование, позволяющее определить топографию, размеры железы, выявить наличие сочетанного узлового и полинодозного зоба и оценить структуру узлового образования, что имеет важное значение в определении вероятности его злокачественности [Озерова О.Е., Демидов В.Н., Базарова Э.Н.].
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Поражение глаз при акромегалии. Глаза при аденоме гипофиза
В основе заболеваний гипоталамо-гипофизарной системы (морфофункционального объединения структур гипоталамуса и гипофиза) лежат опухолевые процессы, генетически обусловленные нарушения, нейроинфекции, черепно-мозговые и психические травмы, изменения соотношений нейромедиаторов в центральной нервной системе, возможные, в частности, у женщин после родов, абортов, и другие процессы, приводящие к нарушению синхронизации деятельности ферментативных систем, участвующих в синтезе гормонов гипоталамуса и гипофиза. К болезням, связанным с функциональными нарушениями гипоталамо-гипофизарной системы, относятся акромегалия, гипопитуитаризм, гигантизм, болезнь Иценко—Кушинга, несахарный диабет.
Тесное анатомическое соседство и функциональная связь зрительных нервов, хиазмы и зрительных трактов с гипоталамо-гипофизарной областью обусловливают изменения органа зрения при различной гипоталамо-гипофизарной патологии.
Акромегалия — нейроэндокринное заболевание, обусловленное поражением гипоталамо-гипофизарной системы, характеризуется избыточной секрецией соматотропного гормона (гормона роста), вырабатываемого в передней доле гипофиза (аденогипофизе). В основе акромегалии в большинстве случаев лежит гормонально-активная аденома гипофиза (гипоталамонезависимая акромегалия). Значительно реже заболевание развивается в результате стимулирующего влияния на гипофиз повышенных количеств соматолиберина — нейрогормона гипоталамуса при воспалительных процессах в межуточном мозге (гипоталамозависимая акромегалия). Акромегалия — редкое заболевание, отличающееся хроническим, медленно прогрессирующим течением.
Она наблюдается как у женщин, так и у мужчин, первично диагностируется преимущественно в возрасте 20—40 лет. У детей акромегалия встречается очень редко — в мировой литературе с 1890 по 1929 г. опубликовано всего 25 наблюдений акромегалии у детей до 15 лет (15 мальчиков и 10 девочек) — и сочетается обычно с гигантизмом. Клинические проявления акромегалии многообразны, что объясняется нарушением гормонообразования не только в гипофизе, но и в других эндокринных железах — в щитовидной, поджелудочной, половых, надпочечниках, а также непосредственно увеличением внутричерепного новообразования.

Больные жалуются на головную боль, боль в руках, суставах, пояснице. Кожа становится утолщенной, собирается в складки. В результате гипертрофии потовых и сальных желез усиливается потливость, кожа влажная и сальная. Наблюдается лопатообразное увеличение кистей рук и стоп, особенно пяточной кости. Характерные изменения костей выявляются при рентгенографии: увеличение размеров турецкого седла, увеличение и утолщение костей черепа, кистей и стоп, остеопороз.
При акромегалии часто отмечают артериальную гипертензию. В крови повышена концентрация соматотропного гормона [Марова Е.И., Авакян М.Р., Снигирева Р.Я., Жвирска-Корчала К., Зых Ф., Илевич Л. и др., Жуковский М.А., Баранов В.Л.].
Нередко при акромегалии раньше всего обращают на себя внимание офтальмологические проявления, возникающие в результате гормональных гипоталамо-гипофизарных нарушений, механического сдавления хиазмы новообразованием гипофиза и повышения внутричерепного давления. Одним из ранних глазных симптомов акромегалии является угасание, а иногда и полное исчезновение макулярных рефлексов, объясняемое влиянием соматотропного гормона на состояние фоторецепторного комплекса.
При исследовании поля зрения у таких больных наблюдается его выпадение с височной стороны, а также центральные относительные и абсолютные скотомы (в начальных стадиях — на красный, а в дальнейшем — и на белый цвет). У больных с аденомой гипофиза и жалобами на появившееся ухудшение зрения выявляются дистрофические изменения в макулярной области, а также двусторонние, реже односторонние, начальные атрофии дисков зрительных нервов и сужение центральной артерии сетчатки (верхней и нижней ее ветвей).
На более поздних стадиях акромегалии, обусловленной аденомой гипофиза, развивается полная атрофия зрительных нервов, реже — застойные диски зрительных нервов (при росте аденомы кверху, ведущему к сдавлению полости третьего желудочка мозга). У больных акромегалией могут быть и такие офтальмологические проявления, как миопатия глазодвигательных мышц, экзофтальм, сходящееся и расходящееся косоглазие. Описано наблюдение внезапно возникшего приступа болезненной офтальмоплегии с отсутствием отведения, ограничением опускания и вращения глазных яблок, мидриазом с параличом аккомодации у 49-летнего мужчины с гипофизарной аденомой, проросшей в кавернозный синус. Довольно часто у больных акромегалией выявляется нарушение гидродинамики глаза с повышением внутриглазного давления и развитием глаукомы.
Патологические изменения органа зрения при своевременном и эффективном лечении акромегалии в большинстве случаев частично или полностью обратимы.
Эндокринная офтальмопатия ( Аутоиммунная офтальмопатия , Офтальмопатия Грейвса , Тиреоидная офтальмопатия )
Эндокринная офтальмопатия – это органоспецифическое прогрессирующее поражение мягких тканей орбиты и глаза, развивающееся на фоне аутоиммунной патологии щитовидной железы. Течение эндокринной офтальмопатии характеризуется экзофтальмом, диплопией, отечностью и воспалением тканей глаза, ограничением подвижности глазных яблок, изменениями роговицы, ДЗН, внутриглазной гипертензией. Диагностика эндокринной офтальмопатии требует проведения офтальмологического обследования (экзофтальмометрии, биомикроскопии, КТ орбиты); исследования состояния иммунной системы (определение уровня Ig, Ат к ТГ, Ат к ТПО, антиядерных антител и др.), эндокринологического обследования (Т4 св., Т3 св., УЗИ щитовидной железы, пункционной биопсии). Лечение эндокринной офтальмопатии направлено на достижение эутиреоидного состояния; может включать медикаментозную терапию или удаление щитовидной железы.
МКБ-10
Общие сведения
Эндокринная офтальмопатия (тиреоидная офтальмопатия, офтальмопатия Грейвса, аутоиммунная офтальмопатия) – аутоиммунный процесс, протекающий со специфическим поражением ретробульбарных тканей и сопровождающийся экзофтальмом и офтальмоплегией различной степени выраженности. Впервые заболевание было подробно описано К. Грейвсом в 1776 г.
Эндокринная офтальмопатия - проблема, представляющая клинический интерес для эндокринологии и офтальмологии. Эндокринной офтальмопатией страдает примерно 2 % всего населения, при этом среди женщин заболевание развивается в 5-8 раз чаще, чем среди мужчин. Возрастная динамика характеризуется двумя пиками манифестации офтальмопатии Грейвса – в 40-45 лет и 60-65 лет. Эндокринная офтальмопатия также может развиваться в детском возрасте, чаще у девочек первого и второго десятилетия жизни.
Причины
Факторы, инициирующие эндокринную офтальмопатию, до сих пор окончательно не выяснены. В роли пусковых механизмов могут выступать:
- респираторные инфекции,
- малые дозы радиации,
- инсоляция,
- курение,
- соли тяжелых металлов,
- стресс,
- аутоиммунные заболевания (сахарный диабет и пр.), вызывающие специфический иммунный ответ.
Отмечена ассоциация эндокринной офтальмопатии с некоторыми антигенами HLA-системы: HLA-DR3, HLA-DR4, HLA-B8. Мягкие формы эндокринной офтальмопатии чаще встречаются среди лиц молодого возраста, тяжелые формы заболевания характерны для пожилых людей.
Патогенез
Предполагается, что вследствие спонтанной мутации Т-лимфоциты начинают взаимодействовать с рецепторами мембран клеток глазных мышц и вызывают в них специфические изменения. Аутоиммунная реакция Т-лимфоцитов и клеток-мишеней сопровождается высвобождением цитокинов (интерлейкина, фактора некроза опухолей, γ-интерферона, трансформирующего фактора роста b, фактора роста тромбоцитов, инсулиноподобного фактора роста 1), которые индуцируют пролиферацию фибробластов, образование коллагена и выработку гликозаминогликанов. Последние, в свою очередь, способствуют связыванию воды, развитию отека и увеличению объема ретробульбарной клетчатки. Отек и инфильтрация тканей орбиты со временем сменяются фиброзированием, в результате чего экзофтальм становится необратимым.
В развитии эндокринной офтальмопатии выделяют фазу воспалительной экссудации, фазу инфильтрации, которая сменяется фазой пролиферации и фиброза. С учетом выраженности глазной симптоматики выделяют три формы эндокринной офтальмопатии:
- Тиреотоксический зкзофтальм. Характеризуется незначительной истинной или ложной протрузией глазных яблок, ретракцией верхнего века, отставанием века при опускании глаз, тремором закрытых век, блеском глаз, недостаточностью конвергенции.
- Отечный экзофтальм. Об отечном экзофтальме говорят при выстоянии глазных яблок на 25–30 мм, выраженном двустороннем отеке периорбитальных тканей, диплопии, резкой ограниченности подвижности глазных яблок. Дальнейшее прогрессирование эндокринной офтальмопатии сопровождается полной офтальмоплегией, несмыканием глазных щелей, хемозом конъюнктивы, язвами роговицы, застойными явлениями на глазном дне, болями в орбите, венозным стазом. В клиническом течении отечного экзофтальма выделяют фазы компенсации, субкомпенсации и декомпенсации.
- Эндокринную миопатию. При эндокринной миопатии имеет место слабость чаще прямых глазодвигательных мышц, приводящая к диплопии, невозможности отведения глаз кнаружи и кверху, косоглазию, отклонению глазного яблока книзу. Вследствие гипертрофии глазодвигательных мышц прогрессирующе нарастает их коллагеновая дегенерация.
Для обозначения выраженности эндокринной офтальмопатии в России обычно используются классификация В. Г. Баранова, согласно которой выделяют 3 степени эндокринной офтальмопатии.
- Критериями эндокринной офтальмопатии 1 степени служат: невыраженный экзофтальм (15,9 мм), умеренная отечность век. Ткани конъюнктивы при этом интактны, функция глазодвигательных мышц не нарушена.
- Эндокринная офтальмопатия 2 степени характеризуется умеренно выраженным экзофтальмом (17,9 мм), значительным отеком век, выраженным отеком конъюнктивы, периодическим двоением.
- При эндокринной офтальмопатии 3 степени выявляются выраженные признаки экзофтальма (20,8 мм и более), диплопия стойкого характера, невозможность полного смыкания век, изъязвление роговицы, явления атрофии зрительного нерва.
Симптомы эндокринной офтальмопатии
К ранним клиническим проявлениям эндокринной офтальмопатии относятся преходящие ощущения «песка» и давления в глазах, слезотечение либо сухость глаз, светобоязнь, отечность периорбитальной области. В дальнейшем развивается экзофтальм, который вначале носит асимметричный или односторонний характер.
На стадии развернутых клинических проявлений названные симптомы эндокринной офтальмопатии становятся постоянными; к ним добавляется заметное увеличение выстояния глазных яблок, инъекция конъюнктивы и склеры, припухлость век, диплопия, головные боли. Невозможность полного смыкания век приводит к образованию язв роговицы, развитию конъюнктивита и иридоциклита. Воспалительная инфильтрация слезной железы усугубляется синдромом сухого глаза.
При выраженном экзофтальме может возникать компрессия зрительного нерва, приводящая к его последующей атрофии. Механическое ограничение подвижности глазных яблок приводит к увеличению внутриглазного давления и развитию, так называемой, псевдоглаукомы; в некоторых случаях развивается окклюзия вен сетчатки. Вовлечение глазных мышц нередко сопровождается развитием косоглазия.
Диагностический алгоритм при эндокринной офтальмопатии предполагает обследование пациента эндокринологом и офтальмологом с выполнением комплекса инструментальных и лабораторных процедур.
1. Эндокринологическое обследование направлено на уточнение функции щитовидной железы и включает исследование тиреоидных гормонов (свободных Т4 и Т3), антител к ткани щитовидной железы (Ат к тиреоглобулину и Ат к тиреопероксидазе), проведение УЗИ щитовидной железы. В случае выявления узлов щитовидной железы диаметром более 1 см, показано выполнение пункционной биопсии.
2. Функциональное офтальмологическое обследование при эндокринной офтальмопатии преследует цель уточнения зрительной функции. Функциональный блок включает:
- визометрию
- периметрию
- исследование конвергенции
- электрофизиологические исследования
- биометрические исследования глаза (экзофтальмометрия, измерение угла косоглазия) - позволяют определить высоту выстояния и степень отклонения глазных яблок
3. Методы визуализации направлены на морфлогическую оценку структур глаза. Включают следующие исследования:
- осмотр глазного дна (офтальмоскопия) производится для исключения развития нейропатии зрительного нерва
- биомикроскопия - с целью оценки состояния структур глаза
- тонометрия - выполняется для выявления внутриглазной гипертензии
- УЗИ, МРТ, КТ орбит) позволяют дифференцировать эндокринную офтальмопатию от опухолей ретробульбарной клетчатки.
4. Иммунологическое обследование. При эндокринной офтальмопатии чрезвычайно важным представляется обследование иммунной системы больного. Изменения клеточного и гуморального иммунитета при эндокринной офтальмопатии характеризуется снижением числа CD3+ T-лимфоцитов, изменением соотношения CD3+ и лимфоцитов, уменьшением количества CD8+T-cynpeccopoв; возрастанием уровня IgG, антиядерных антител; повышением титра Ат к ТГ, ТПО, АМАb (глазным мышцам), второму коллоидному антигену. По показаниям выполняется биопсия пораженных глазодвигательных мышц.
Экзофтальм при эндокринной офтальмопатии следует дифференцировать с псевдоэкзофтальмом, наблюдаемым при высокой степени близорукости, орбитальном целлюлите (флегмоне глазницы), опухолях (гемангиомах и саркомах орбиты, менингиомах и др.).
Лечение эндокринной офтальмопатии
Патогенетическая терапия
Лечебная тактика определяется стадией эндокринной офтальмопатии, степенью нарушения функции щитовидной железы и обратимостью патологических изменений. Все варианты лечения направлены на достижение эутиреоидного состояния.
- Иммуносупрессивная терапия. Включает назначение глюкокортикоидов (преднизолон), оказывающих противоотечное, противовоспалительное и иммуносупрессивное действие. Кортикостероиды применяются внутрь и в виде ретробульбарных инъекций. При угрозе потери зрения проводится пульс-терапия метилпреднизолоном, рентгенотерапия орбит. Использование глюкокортикоидов противопоказано при язвенной болезни желудка или двенадцатиперстной кишки, панкреатите, тромбофлебитах, артериальной гипертензии, нарушении свертываемости крови, психических и онкологических заболеваниях.
- Экстракорпоральная гемокоррекция. Методами, дополняющими иммуносупрессивную терапию, служат плазмаферез, гемосорбция, иммуносорбция, криоаферез.
- Коррекция функции ЩЖ. При наличии нарушений функции щитовидной железы проводится ее коррекция тиростатиками (при тиреотоксикозе) или тиреоидными гормонами (при гипотиреозе).
- Хирургическая тактика. При невозможности стабилизации функции щитовидной железы может потребоваться выполнение тиреоидэктомии с последующей ЗГТ.
Офтальмологическое лечение
Симптоматическая терапия при эндокринной офтальмопатии направлена на нормализацию метаболических процессов в тканях и нервно-мышечной передачи. В этих целях назначаются инъекции актовегина, прозерина, инстилляции капель, закладывание мазей и гелей, прием витаминов А и Е. Из методов физиотерапии при эндокринной офтальмопатии используется электрофорез с лидазой или алоэ, магнитотерапия на область орбит.
Возможное хирургическое лечение эндокринной офтальмопатии включает три типа офтальмологических операций:
- Декомпрессия орбиты. Направлена на увеличение объема глазницы и показана при прогрессирующей нейропатии зрительного нерва, выраженном экзофтальме, изъязвлениях роговицы, подвывихе глазного яблока и др. ситуациях. Декомпрессия орбиты (орбитотомия) достигается путем резекции одной или нескольких ее стенок, удаления ретробульбарной клетчатки.
- Операции на глазодвигательных мышцах. Показаны при развитии стойкой болезненной диплопии, паралитического косоглазия, если его не удается скорригировать призматическими очками.
- Операции на веках. Представляют большую группу разнообразных пластических и функциональных вмешательств, выбор которых диктуется развившимся нарушением (ретракцией, спастическим заворотом, лагофтальмом, пролапсом слезной железы, грыжей с выпадением орбитальной клетчатки и пр.).
В 1-2 % случаев наблюдается особо тяжелое течение эндокринной офтальмопатии, приводящее к тяжелым зрительным осложнениям или остаточным явлениям. Своевременное медицинское вмешательство позволяет добиться индуцированной ремиссии и избежать тяжелых последствий заболевания. Результатом терапии у 30% больных служит клиническое улучшение, у 60% - стабилизация течения эндокринной офтальмопатии, у 10% - дальнейшее прогрессирование заболевания.
Микседема ( Микседематозный отек , Слизистый отек )
Микседема – это эндокринное заболевание, развивающееся при снижении или полном прекращении поступления в кровь тиреоидных гормонов. Является крайней, клинически выраженной формой гипотиреоза. Характеризуется слизистым отеком кожи и подкожной клетчатки, наиболее заметным на лице и шее. Отечность проявляется распуханием подбородка и области вокруг глаз, изменением голоса, малоразборчивой речью, сужением носовых ходов, кашлем, одышкой. Диагноз устанавливается по результатам осмотра, анализа крови на Т4, Т3 и ТТГ, УЗИ и радиоизотопного исследования щитовидной железы (ЩЖ). Лечение основано на гормонозаместительной терапии.
Синонимичные названия микседемы – слизистый отек, микседематозный отек. Поскольку болезнь вызвана гипотиреозом, ее распространенность выше в регионах с йододефицитом. Среди разных возрастных групп эпидемиология также неравномерна, микседеме наиболее подвержены женщины в период климактерической перестройки организма. Частота заболеваемости у этой категории населения в 5-10 раз выше, чем в общей популяции. Среди пациентов с болезнями ЩЖ у женщин микседема диагностируется в 2-2,5% случаев, у мужчин – в 0,2% случаев. У детей патология может быть врожденной или приобретенной, сопровождается задержкой умственного и физического развития.
Причины микседемы
Фактором формирования микседематозного отека является гипотиреоз. На начальных стадиях он не вызывает структурных изменений в органах, при адекватной терапии полностью компенсируется. При отсутствии лечения нарушения становятся необратимыми, больные нуждаются в пожизненном приеме лекарств. С учетом этиологического признака различают четыре вида микседемы:
- Первичная. В основе лежит первичный гипотиреоз – дефицит гормонов, обусловленный снижением функций ЩЖ. Заболевание возникает после операций на органе, в результате воздействия радиационного излучения, при тиреоидите Хашимото, инфильтрационных заболеваниях железы, дефиците или переизбытке йода.
- Вторичная. Патология провоцируется гипотиреозом, развившимся на базе расстройств гипофиза или гипоталамуса. Эти железы ответственны за выработку тиреотропина и тиреотропин-рилизинг-гормона, контролирующих секрецию тироксина, трийодтиронина. Непосредственной причиной микседемы может стать болезнь Симмондса, пангипопитуитаризм.
- Претибиальная. Данная разновидность болезни радикально отличается от предыдущих – ее вызывает не дефицит, а избыток йодсодержащих гормонов. Причиной формирования становится многоузловой токсический зоб.
- Идиопатическая. В некоторых случаях этиология отека остается неизвестной. У пациентов сохраняются нормальные размеры и функциональность ЩЖ, гормоны секретируются в необходимом количестве при сниженной реакции тканей и органов.
При длительном дефиците йодированных гормонов замедляется синтез белков, усиливаются процессы их распада. В межклеточном пространстве скапливаются альбумины, гиалуроновая кислота и другие мукополисахариды, обладающие гидрофильностью и задерживающие воду в тканях. Большое количество жидкости связывается с тканевым коллоидом, образуется муцин – слизеподобное соединение. Его накопление внешне проявляется утолщением тканей – отеками. При избытке муцина во внутренних органах их размеры увеличиваются, нарушается микроциркуляция крови, в тканях развиваются дистрофические процессы. На фоне сниженного уровня Т4 и Т3 повышается активность антидиуретического гормона, что усугубляет отечность, поскольку гормон усиливает процесс реабсорбции неконцентрированной мочи в протоках почек, тем самым уменьшая объем вторичной мочи и удерживая жидкость внутри организма.
Симптомы микседемы
Ключевой симптом – отек подкожной клетчатки и кожи. При надавливании форма и цвет кожных покровов не изменяются, покраснений, побледнений, углублений или отпечатков не остается. Больше всего отечность выражена на шее и лице, при тяжелом течении распространяется на все тело. Лицо становится одутловатым, маскообразным. Его черты огрубляются, область подбородка увеличивается в размерах, мимика упрощается. Рот постоянно приоткрыт, носовое дыхание нарушено вследствие отека слизистой оболочки носа. Из-за отечности голосовых связок голос грубеет, появляется охриплость, осиплость, кашель. Пациенты страдают от одышки.
Симптоматика слизистого отека сочетается с клинической картиной гипотиреоза. Больные вялые, сонливые, медлительные, малоподвижные. Испытывают зябкость, плохо переносят пребывание на улице в холодное время года, часто мерзнут дома, особенно когда остаются без движения. Характерна мышечная слабость, заторможенность движений и мыслительных процессов – трудности концентрации и переключения внимания, запоминания информации. Пациенты находятся в депрессивном или субдепрессивном состоянии, плачут, теряют интерес к происходящему. Нередко отмечаются загрудинные, головные и мышечные боли. Аппетит снижен, процесс пищеварения замедлен, часто возникают запоры.
В детстве микседема приводит к задержке умственного, физического и полового развития. Чем раньше началось заболевание, тем сильнее выражены отклонения. При врожденной форме микседемы диагностируется кретинизм. Конечности деформируются, нарушается формирование зубов, запаздывает их прорезывание и смена. Отечность тканей головы создает «карикатурность», грубость черт лица: нос плоский и широкий, глаза глубоко и широко посаженные, язык увеличен, выпадает изо рта. Интеллектуальный дефект умеренный или глубокий, в тяжелых случаях отсутствует речь и навыки самообслуживания.
Претибиальная микседема, развивающаяся при тиреотоксикозе, проявляется локальной симптоматикой. Кожа голеней утолщается, имеет шероховатую поверхность, приобретает красновато-синеватый оттенок. Появляются признаки чрезмерного ороговения. На пораженных участках увеличиваются волосяные фолликулы, волосы усиленно выпадают, нарастает зуд. Тиреотоксикоз обуславливает наличие тахикардии, болей и дискомфорта в области сердца, мышечную слабость, повышенную раздражительность, беспокойство, рассеянность, тремор. Зачастую усиливается аппетит, снижается вес.
Тяжелое течение микседемы способно привести к развитию микседематозной комы. В группе повышенного риска находятся старики и пожилые люди, пациенты с длительно текущим гипотиреозом, перенесшие острые инфекции, подвергшиеся переохлаждению или интоксикации. Коматозное состояние проявляется резкой гипотермией, замедлением дыхания и пульса, внезапной артериальной гипотонией, острой кишечной непроходимостью и задержкой мочи, помрачением сознания, сердечной недостаточностью. Смертельный исход наступает в 80% случаев.
Обследование пациентов с подозрением на микседему проводит врач-эндокринолог. Во время клинического опроса больные жалуются на сонливость, зябкость, слабость, снижение работоспособности, сухость кожи, головные боли. Объективно отмечается отечность лица, шеи и конечностей, бледность, нарушения носового дыхания, одышка, гипотермия, брадикардия, артериальная гипотензия. Лицо равномерно одутловатое, глазные щели сужены, контуры лица сглажены, возможен парадоксально яркий румянец на щеках. Для подтверждения диагноза микседемы и ее дифференциации с почечной, печеночной и надпочечниковой недостаточностью, синдромом неадекватной секреции АДГ, синдромом идиопатических отеков проводятся инструментальные и лабораторные исследования:
- Общий, биохимический анализы крови. Определяется повышенное содержание белков, липопротеидов и холестерина, сниженный уровень йода, неорганического фосфора, гемоглобина (гипохромная анемия), увеличенное число лимфоцитов и эозинофилов. СОЭ часто выше нормы.
- Исследование гормонов в крови. Патогномоничный признак гипотиреоза – низкий уровень общего и свободного тироксина (Т4), трийодтиронина (Т3). Повышенная концентрация тиреотропного гормона указывает на первичный гипотиреоз, пониженная – на вторичный гипотиреоз.
- Сцинтиграфия щитовидной железы. При изучении активности железистой ткани наблюдается слабое поглощение радиоактивного йода. Недостаточность общего захвата препарата выявляет снижение функциональности клеток. По равномерности свечения оценивается наличие эктопированных участков, узловых образований.
- УЗИ щитовидной железы. Ультразвуковое исследование позволяет визуализировать строение и размеры органа. Процедура проводится для обнаружения или подтверждения отсутствия новообразований как факторов микседемы – узлов, опухолей, кальцинатов. Для гипотиреоза характерен уменьшенный объем ткани железы.
Лечение микседемы
Основное направление терапии – этиотропное, нацеленное на устранение причины микседематозного отека (гипотиреоза). Гормонозамещающие препараты нормализуют уровень тиреоидных гормонов. Для того чтобы в короткие сроки улучшить самочувствие больных, повысить качество их жизни, проводится поддерживающее лечение. При комплексном подходе пациентам назначается:
- Гормонозаместительная терапия. Препараты тиреоидных гормонов – тироксина, трийодтиронина – широко применяются в эндокринологии для компенсации гипотиреотических состояний. Поскольку в большинстве случаев щитовидная железа утрачивает способность к самовосстановлению, терапия является пожизненной. Оценка эффективности проводится через 1-1,5 месяца после начала курса, затем – один раз в 6-12 месяцев.
- Глюкокортикоидные препараты. При претибиальной микседеме, наличии воспалительных и аутоиммунных процессов используются глюкокортикостероиды. Медикаменты этой группы оказывают противовоспалительное и иммунодепрессивное действие, подавляют активность аутоантител. Улучшение самочувствия отмечается уже с первых дней лечения.
- Диета. Всем больным показано питание с ограниченным содержанием соли и жиров. Это позволяет уменьшить отечность, нормализовать концентрацию холестерина и липопротеинов. В случаях, когда микседема спровоцирована йододефицитным гипотиреозом, составляется рацион с продуктами, богатыми йодом – морской капустой, морепродуктами, орехами. Дополнительно назначаются пищевые йодсодержащие добавки.
- Симптоматическая терапия. Для уменьшения отечности применяются диуретики и мочегонные сборы трав, рекомендуется ношение компрессионного белья. При наличии выраженных сердечно-сосудистых нарушений необходимы корректоры функционального состояния миокарда, кардиотонические и антиаритмические средства, ноотропы.
Прогноз и профилактика
Для микседемы характерно медленное нарастание симптоматики, поэтому своевременная диагностика и адекватная терапия позволяют поддерживать доброкачественное течение болезни с сохранением высокого качества жизни пациентов. При врожденной форме заболевания прогноз неоднозначен. К профилактическим методам относится корректное лечение гипотиреоза, периодический контроль уровня гормонов, консультации и осмотры эндокринолога. Людям, имеющим наследственную отягощенность, проживающим в йододефицитных регионах, подвергшимся облучению, необходимы плановые УЗИ железы. Женщинам в периоды беременности и менопаузы рекомендован прием йодсодержащих добавок.
2. Клинические особенности и заместительная терапия при гипотиреозе разной этиологии: Автореферат диссертации/ Мадиярова М.Ш. – 2015.
4. Неврологические и клинико-иммунологические аспекты первичного гипотиреоза: Автореферат диссертации/ Никанорова Т.Ю. – 2006.
Читайте также:
- Отеки при сердечной недостаточности. Причины отеков при сердечной недостаточности
- Рентгенограмма при болезни Паннера (неравномерной оссификации эпифиза головки мыщелка)
- Влияние варфарина и гепарина на плод беременной
- Воздействие гипотермии на давление. Нормализация давления при отрезвлении
- Послевоенная фтизиохирургия. Достижения отечественной фтизиохирургии
