Глюкокортикоиды при физиологическом стрессе. Синтез кортизола
Добавил пользователь Валентин П. Обновлено: 27.01.2026
В свете появляющихся новых данных взгляд на систему гипоталамус-гипофиз-надпочечники-органы-мишени претерпевает значительные изменения, и наряду с механизмом отрицательной обратной связи, возникают предположения о существовании других регуляторных механизмов синтеза, активации и дезактивации ГКС. Тем не менее, в настоящее время имеется сравнительно небольшой объем данных о взаимосвязи между системной и местной продукцией кортизола в тканях. Неуклонный рост числа пациентов с сахарным диабетом (преимущественно 2 типа) и ожирением ставит новые задачи по разработке эффективных лекарственных средств и форм их доставки, методов своевременного выявления и профилактики развития заболевания. Понимание этих процессов позволит создать необходимую научную базу для поиска и разработки новых мишеней для фармакотерапии заболеваний, ассоциированных с нарушением синтеза, активации и действия ГКС.
Ключевые слова
Для цитирования:
For citation:
Введение
В основе любого научного открытия лежит накопление большого количества клинических наблюдений, литературных данных с последующей суммацией и систематизацией знаний и выдвижением новой гипотезы. В настоящее время имеется достаточное количество информации о механизмах действия кортизола и его клеточных мишенях, локального и системного действия, однако продолжающиеся экспериментальные исследования открывают все больше новых данных о биологической роли гормона. Исходным субстратом в стероидогенезе служит холестерин, либо получаемый с пищей, либо синтезируемый эндогенно из ацетата. Три основных пути биосинтеза в корковом веществе надпочечников приводят к образованию глюкокортикоидов, минералокортикоидов и надпочечниковых андрогенов. Наружная (клубочковая) зона участвует преимущественно в биосинтезе альдостерона, а внутренние (пучковая и сетчатая) служат местом биосинтеза глюкокортикоидов и андрогенов. Основным глюкокортикоидным гормоном у человека является гидрокортизон (кортизол). Суточная секреция кортизола составляет 15–30 мг и обладает выраженным суточным ритмом. Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. В норме на долю свободного, биологически активного кортизола приходится около 5% его количества, присутствующего в крови. Приблизительно 90% кортизола связывается специфическим белком (а2-глобулином) – транскортином, обладающим высоким средством к гормону. Менее 5% кортизола связывается белком с низким сродством – альбумином. Необходимо отметить, что именно от количества свободного кортизола зависит его биологическая активность, проявляющаяся в непосредственном воздействии на ткани. В норме глюкокортикостероиды (ГКС) участвуют во всех видах обмена (в метаболизме белков, углеводов, липидов), в связи с чем патофизиологические и клинические изменения при гиперкортицизме колеблются в широких пределах. Гиперпродукция глюкокортикоидов может быть следствием повышения уровня адренокортикотропного гормона при опухолях гипофиза (болезнь Иценко-Кушинга), опухолях, происходящих из других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола корой надпочечников (синдром Иценко-Кушинга). На примере этих орфанных заболеваний изучены различные эффекты избытка кортизола на органы и ткани. При гиперкортицизме наблюдаются нарушение толерантности к глюкозе или сахарный диабет, обусловленные стимуляцией глюконеогенеза и развитием инсулинорезистентности, усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани, своеобразное перераспределение и изменения морфологического состава жировой ткани. Как известно, глюкокортикоиды моделируют физиологию жировой ткани, изменяя секрецию адипокинов непосредственно или в связи с развивающейся инсулинорезистентностью, стимулируют дифференцировку адипоцитов, способствуя образованию новых клеток жировой ткани посредством активации транскрипции ряда ключевых генов [1, 2]. Гипернатриемия, гипокалиемия и, как следствие, артериальная гипертензия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Кортизол и метаболический синдром
Хорошо известно, что ГКС оказывают влияние на распределение жировой ткани. Ряд исследований показал, что пациенты с ожирением имеют гиперактивацию фермента 11β-HSD1 в жировой ткани [4, 5] и гепатоцитах, ключевого фермента, стимулирующего конверсию метаболически неактивного кортизона в активный кортизол (рис. 1). Напротив, 11β-гидроксистероид дегидрогеназа 2 (11β-HSD2), катализирующая превращение кортизона в кортизол, имела низкую экспрессию.
Рис.1 Конверсия кортизола в кортизон
Как упоминалось ранее, было выдвинуто предположение, что активность 11β-HSD1 может быть одним из патогенетических механизмов, лежащих в основе развития метаболического синдрома. Данные экспериментальных исследований на животных показали, что селективная 11β-HSD1 гиперэкспрессия в жировой ткани (аналогично тому, что наблюдается у пациентов с ожирением) приводила к развитию метаболического синдрома, и, в частности, дислипидемии, ожирению, гипертензии, связанной с активацией системы ренин-ангиотензин-альдостерон, инсулинорезистентности и нарушению углеводного обмена. Кроме того, адипоциты имели больший размер (рис. 2), чем обычно, основной эффект наблюдался в висцеральной жировой ткани, возможно, из-за более высокой плотности рецепторов к ГКС [6, 7, 8].
Рис. 2 Электронная микрофотография адипоцитов
Полученные данные позволили рассматривать 11b-HSD1 в качестве новой мишени для фармакотерапии. II фаза рандомизированного двойного слепого плацебо-контролируемого исследования эффективности селективного ингибитора 11b-HSD1 (INCB013739) у пациентов с избыточной массой тела/ожирением и СД 2 типа показали статистически значимое увеличение печеночной и периферической чувствительности к инсулину, снижению глюкозы в плазме натощак, общего холестерина и липопротеинов низкой плотности (ЛПНП), триглицеридов плазмы и уровня АД [9]. Открытым остается вопрос: каким образом локальная гиперпродукция ГКС влияет на системный уровень кортизола и нарушается ли при этом механизм отрицательной обратной связи?
Кортизол и кардиоваскулярные риски
По данным Colao A. и соавт., в течение пяти лет после наступления ремиссии болезни Иценко-Кушинга концентрации холестерина, ЛПНП, индекс атерогенности, уровень инсулина остаются выше референсных значений, что определяет этих пациентов в группу высокого риска по сердечно-сосудистым осложнениям даже после достижения ремиссии заболевания [10–12].
Помимо перечисленных метаболических факторов, лежащих в основе кардиоваскулярных нарушений, кортизол оказывает ингибирующее действие на ангиогенез. Под ангиогенезом стоит понимать процесс роста новых кровеносных сосудов, который является необходимым в репарации тканей и при иных заболеваниях, протекающих с развитием ишемии ткани, таких как ишемическая болезнь сердца, хроническая артериальная недостаточность нижних конечностей и тд.
Регулирование ангиогенеза гипоксией является важным компонентом гомеостаза. В норме в ответ на снижение содержания кислорода в тканях, гипо ксие индуцируемый фактор Ia (HIF-1) стимулирует рост новых сосудов. Тот же механизм срабатывает и в ишемизированных тканях [13].
HIF-1 контролируемое производство фактора роста эндотелия сосудов (VEGF) приводит к аутокринной передаче сигнала, что имеет решающее значение для ангиогенеза. Многие из биологических процессов в ангиогенезе, инвазия внеклеточного матрикса и формирование трубки эндотелиальными клетками стимулируются в условиях гипоксии через HIF-1, который активирует транскрипцию десятков генов, чьи белковые продукты играют решающую роль в этих процессах [14].
Как показывают данные исследований, в процессе патологической перестройки миокарда, его гипертрофии, а затем дилятации с развитием сердечной недостаточности, одну из ключевых ролей играет HIF-1. HIF-1 стимулирует выработку VEGF, который, в свою очередь, связывается с рецептором на поверхности эндотелиальных клеток. После чего происходит активация сигнального пути ERK (Ras-ERK и MAPK/ERK), стимулирующего пролиферацию и миграцию эндотелиоцитов [15, 16, 17].
Глюкокортикоид-опосредованное ингибирование ангиогенеза играет важную роль в физиологии, патофизиологии и терапевтических подходах к некоторым заболеваниям. Тем не менее, механизмы, посредством которых глюкокортикоиды ингибируют рост новых кровеносных сосудов, до конца не изучены. В экспериментальном исследовании James J. Logie и соавт. продемонстрировано, что даже физиологические уровни глюкокортикоидов подавляют ангиогенез, непосредственно предотвращая формирование сосудистой трубки эндотелиальными клетками. В процессе ангиогенеза эндотелиальные клетки начинают активно пролиферировать, запускается процесс трансформации их морфологической структуры, что приводит к формированию высокоупорядоченных клеточных линий, составляющих внутренний слой новообразованных сосудов.
Воздействие кортизола снижает образование межклеточных контактов, не ухудшая при этом пролиферации, миграции или жизнеспособности эндотелиальных клеток. Предыдущие исследования показывают, что глюкокортикоиды подавляют ангиогенез путем ингибирования синтеза VEGF [18, 19, 20], что доказывает ингибирующее действие кортизола на сигнальные пути, который инициирует образование тубул.
Таким образом, в условиях гиперсекреции кортизола VEGF-опосредованный ангиогенез нарушается, что быстрее приводит к дезадаптации процессов компенсации сердечной деятельности и развитию тяжелой сердечной недостаточности, что и обуславливает неблагоприятный прогноз у пациентов с гиперкортицизмом любой этиологии.
Синтез кортизола в коже. Регуляция репарации
Ожирение и ассоциированные с ожирением состояния сопровождаются нарушениями физиологической репарации, что увеличивает вероятность замедленного заживления ран. Люди с ожирением имеют высокий риск развития венозных язв, различных кожных заболеваний (например, кандидоза, эритразмы) или более серьезных кожных инфекций (например, целлюлита, некротизирующего фасцита), гнойных осложнений после хирургических вмешательств. Однако роль ГКС в регуляции репарации ран в настоящее время достаточно плохо изучена.
Наряду с тканью надпочечников, синтезирующей глюкокортикоиды, все больше данных стало появляться о местах вненадпочечниковой продукции кортизола, к ним относятся мозг, легкие, сердце, тимус, клети иммунной системы и кожа [21, 22].
Несмотря на основную функцию кожи служить барьером для защиты внутренней среды организма от агрессивных воздействий, последние исследования в дерматологии были посвящены изучению способности клеток эпидермиса секретировать гормоны. Способность взаимодействовать с центральной нервной системой посредством локальной продукции в системный кровоток гормонов, нейропептидов, нейротрансмиттеров и других регуляторных факторов позволяет рассматривать кожу как нейроэндокринный орган [23].
Кератиноциты – первые клетки, которые реагируют на повреждение целостности кожного покрова, запускающего каскад реакций, что способствует изменению фенотипа кератиноцитов, приводит к их миграции и пролиферации, изменению способности кератиноцитов к адгезии и конфигурации цитоскелета [24] (рис. 3).
Рис. 3 Иммунофлюоресцентная микрофотография кератиноцитов
Кератиноциты обладают способностью синтезировать холестерин, который является предшественником всех стероидных гормонов. Кроме того, как показывает ряд исследований, клетки кожи способны секретировать гипоталамо-гипофизарные гормоны: проопиомеланокортин, адренокортикотропный гормон, тиреотропный гормон и соматотропный гормон [25, 26, 27, 28].
Экспрессия ключевых ферментов стероидогенеза в коже подтверждает предположение о том, что эпидермис может быть основным местом вненадпочечникового синтеза кортизола. Как и ожидалось, ферменты, которые контролируют активность кортизола, а именно конверсию в неактивный кортизон 11b-HSD1 и 11b-HSD2, также экспрессируются множеством подтипов кератиноцитов. Экспрессия CYP11B1 преимущественно выражена в базальных и супрабазальных слоях эпидермиса. Эти слои эпидермиса имеют наибольшую способность к пролиферации и являются основными источниками для регенерации тканей [29].
Экспрессия CYP11B1, ключевого фермента синтеза кортизола, повышается в ответ на воздействие АКТГ или провоспалительных цитокинов IL-1, что свидетельствует о прямом стимулирующем действии провоспалительных цитокинов [30] и снижается в ответ на метирапон. По всей видимости, секреция кортизола в ответ на повреждение ткани сначала повышается и достигает пика спустя 48 ч после воздействия повреждающего агента, а затем, при переходе раны в стадию пролиферации, постепенно снижается к исходному уровню спустя 96 ч, что подтверждают данные исследований на культуре человеческих кератиноцитов. Спустя 96 ч увеличивается экспрессия 11-HSD2 – фермента, конвертирующего преобразование активного кортизола в неактивный кортизон. Чтобы подтвердить предположение о существовании отрицательной обратной связи кортизол/IL-1, в культуру клеток добавляли ингибитор синтеза кортизола – метирапон. По сравнению с контролем, в группе метирапона отмечалось повышение экспрессии IL-1, что подтверждает наличие петли обратной связи, которая регулирует первоначальный ответ на повреждение ткани, предотвращая избыточное воспаление, которое может привести к дальнейшему повреждению тканей.
По данным последних исследований, глюкортикоиды действуют через Wnt-сигнальный путь, тем самым влияя на клеточный цикл кератиноцитов, ингибируя пролиферацию, миграцию, и индуцируя клеточную дифференцировку. Кроме того, ГКС ингибируют влияние эпидермального фактора роста (EGF), который непосредственно стимулирует миграцию и пролиферацию клеток [31, 32].
Таким образом, даже при функциональном гиперкортицизме за счет описанных механизмов нарушается нормальная репарация ткани. Эпидермис ран теряет способность к пролиферации и миграции, что может приводить к длительной персистенции раневых де фектов.
Заключение
В свете появляющихся новых данных, взгляд на систему гипоталамус-гипофиз-надпочечники-органы-мишени претерпевает значительные изменения, и наряду с механизмом отрицательной обратной связи возникают предположения о существовании других регуляторных механизмов синтеза, активации и дезактивации ГКС. Тем не менее, в настоящее время имеется сравнительно небольшой объем данных о взаимосвязи между системной и местной продукцией кортизола в тканях. Понимание этих процессов позволит создать необходимую научную базу для поиска и разработки новых мишеней для фармакотерапии заболеваний, ассоциированых с нарушением синтеза, активации и действия ГКС.
Глюкокортикоиды при физиологическом стрессе. Синтез кортизола
Глюкокортикоиды при физиологическом стрессе. Синтез кортизола
а) Физиологический стресс увеличивает АКТГ и адренокортикальную секрецию. Как указывалось ранее, все виды физического и умственного стресса через несколько минут от начала могут приводить к чрезвычайному увеличению секреции АКГ и, соответственно, кор-тизола, иногда в 20 раз. Такой быстрый и мощный секреторный ответ после травмы показан на рисунке ниже.
Быстрая реакция коры надпочечников крыс на стресс, вызванный переломом большой и малой берцовых костей в момент, отмеченный 0 (у крысы кортикостерон секретируется вместо кортизола) Механизм регуляции глюкокортикоидной секреции. АКТГ — адренокортикотропный гормон; КРФ - кортикотропин-рилизинг фактор
Болевые стимулы, вызванные физическим стрессом, передают сигналы через ствол мозга наверх, главным образом в срединное возвышение гипоталамуса, как показано на рисунке выше. Образующийся кортикотропин-рилизинг гормон направляется в гипоталамо-гипофизарную портальную систему, и в течение нескольких минут в крови появляется большое количество кортизола.
Умственный стресс также быстро приводит к увеличению продукции АКТГ. Предполагают, что это является результатом возросшей активности лимбической системы, особенно в области амигдалы и гиппокампа. Обе структуры затем передают сигналы зад немедиальному гипоталамусу.
б) Тормозные влияния кортизола на гипоталамус и аденогипофиз, ведущие к снижению продукции АКТГ. Кортизол непосредственно путем отрицательной обратной связи действует на:
(1) гипоталамус, снижая образование КРГ;
(2) переднюю долю гипофиза, снижая образование АКТГ.
Обе обратные связи опосредованы концентрацией кортизола в плазме, поэтому если концентрация кортизола становится слишком большой, обратная связь автоматически снижает продукцию АКТГ для обеспечения нормального уровня кортизола в плазме крови.
в) Кратко о системе управления продукцией кортизола. На рисунке выше показана система, управляющая продукцией кортизола. Пусковым моментом является возбуждение гипоталамуса различными видами стресса. Стрессорные стимулы активируют систему, что в итоге приводит к быстрому выделению кортизола. Кортизол, в свою очередь, инициирует серию метаболических эффектов, направленных на уменьшение повреждающего действия стрессорной ситуации.
Существует непосредственная обратная связь между кортизолом и гипоталамусом, равно как между кортизолом и аденогипофизом, снижающая концентрацию кортизола в плазме в периоды, когда организм не подвергается действию стресса.
Решающая роль в регуляции уровня выделения кортизола принадлежит стрессорным стимулам; они всегда могут прервать тормозные влияния самого кортизола, в то же время могут вызвать многократное увеличение его продукции на протяжении суток (для облегчения понимания просим вас изучить рисунок ниже) либо пролонгировать секрецию в случае хронического стресса.
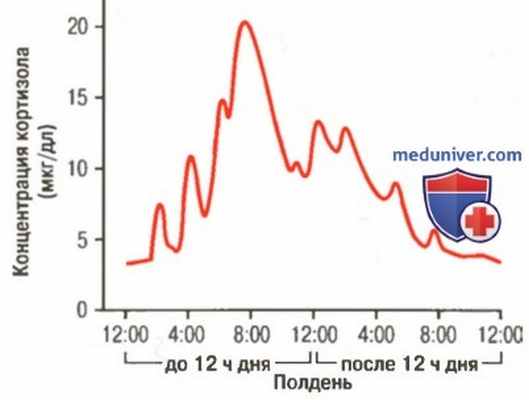
Типичная представленность концентрации кортизола на протяжении суток. Отметьте размахи колебаний уровня секреции наряду с всплеском секреции на протяжении часа после утреннего подъема
г) Циркадные ритмы глюкокортикоидной секреции. Скорость секреции КРГ, АКТГ и кортизола высока ранним утром, но снижается поздно вечером, как это показано на рисунке выше; уровень кортизола в крови колеблется от высокого (около 20 мкг/дл) во время, предшествующее утреннему вставанию, до низкого (около 5 мкг/дл) — ближе к полуночи. Это является результатом 24-часовых циклических изменений активности гипоталамуса, приводящих к изменению продукции кортизола. Если человек меняет ритм сна и бодрствования, цикл меняется соответственно, поэтому измерение уровня кортизола в крови показательно, когда осуществляемая манипуляция совпадает с периодом его циклической представленности в крови.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Глюкокортикоиды при физиологическом стрессе. Синтез кортизола
Исследование суточных колебаний содержащихся в слюне стероидных гормонов – кортизола и дегидроэпиандростерона, – принимающих участие в нейроэндокринных механизмах развития стресса, а также отражающих стадийность его течения и адаптивные возможности организма.
Определяемые параметры: - Кортизол (утро) - Кортизол (полдень) - Кортизол (день) - Кортизол (полдень +день)/2 - Кортизол (вечер) - Общий кортизол - Дегидроэпиандростерон (ДГЭА) (утро) - Дегидроэпиандростерон (ДГЭА) (полдень) - Дегидроэпиандростерон (ДГЭА) (день) - Дегидроэпиандростерон (ДГЭА) (полдень+день)/2 - Дегидроэпиандростерон (ДГЭА) (вечер) - Соотношение ДГЭА/Кортизол (маркер стрессоустойчивости).
Синонимы русские
Кортизол (утренняя, дневная, вечерняя и ночная порции), дегидроэпиандростерон (ДГЭА), соотношение ДГЭА и кортизола (маркер стрессоустойчивости) в слюне.
Синонимы английские
24 hour Salivary Adrenal Stress Profile, Salivary cortisol and dehydroepiandrosterone (DHEA) measurement.
Метод исследования
Высокоэффективная жидкостная хроматография-масс-спектрометрия (ВЭЖХ-МС).
Единицы измерения
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- За сутки и в течение всего периода сбора слюны исключить употребление кофеина, алкоголя, физические нагрузки.
- Прием седативных препаратов, кортизона ацетата, эстрогенов, пероральных контрацептивов, глюкокортикоидных препаратов (в т. ч. мазей) может вызвать повышение уровня кортизола. Отмена лекарственных препаратов осуществляется строго по рекомендации лечащего врача.
- Не курить в течение 1 часа до сбора слюны.
- За 10 минут до сбора слюны прополоскать рот водой.
- За 30 минут до сбора слюны воздержаться от приема пищи, чистки зубов, использования зубной нити, ополаскивателей полости рта и жевательной резинки.
Общая информация об исследовании
Человек в процессе своей жизнедеятельности постоянно подвергается воздействию различных неблагоприятных факторов. Причем в современном мире среди них на первый план выходят, прежде всего, техногенные и психосоциальные воздействия: физическая и умственная перегрузка, малоподвижный образ жизни, длительное отсутствие отдыха, эмоциональное истощение, монотонный труд, конфликты, общая неудовлетворенность и т.д. Действие таких факторов на организм человека приводит его в состояние стресса. Стресс – это комплекс физиологических изменений в работе нервной и эндокринной систем, а также других внутренних органов, возникающий в ответ на действие раздражителя. Он является защитной, приспособительной реакцией, позволяющей организму, мобилизовав все возможные резервы, пережить неблагоприятный период.
Одним из физиологических механизмов развития стрессовой реакции является активация гипоталамо-гипофизарно-надпочечниковой системы: гипоталамус выделяет кортиколиберин, стимулирующий секрецию гипофизом адренокортикотропного гормона (АКТГ), а под влиянием АКТГ в коре надпочечников активизируется выработка стероидного гормона кортизола. Изменения обмена веществ, возникающие в организме под влиянием кортизола, имеют решающее значение для успешной адаптации к стрессовому воздействию. В условиях стресса нервной ткани требуется большое количество энергии, которое обеспечивается за счет синтеза глюкозы из неуглеводных веществ. Часть белков скелетной мускулатуры под действием кортизола распадается до начальных компонентов – аминокислот, из которых потом образуется глюкоза. В этом заключается катаболическое действие гормона, которое в период адаптации к стрессору помогает эффективно распределять энергетические ресурсы организма. Вместе с тем длительное сохранение такой перестройки обмена веществ оказывало бы негативное влияние на организм, потому существуют физиологические механизмы торможения синтеза кортизола. Они включают, прежде всего, уменьшение выработки кортиколиберина под действием самого кортизола (так называемая отрицательная обратная связь) и параллельное образование надпочечниками другого стероидного гормона – дегидроэпиандростерона (ДГЭА), который оказывает противоположное кортизолу действие. Постоянное содержание в крови определенного количества ДГЭА предотвращает развитие психологической дезадаптации и стресс-индуцированных заболеваний. Кроме того, в ряде современных исследований по влиянию стресса на здоровье человека показана связь между соотношением ДГЭА/кортизол и развитием нарушений в деятельности сердечно-сосудистой, нервной и репродуктивной систем, а также социальной адаптации.
Первая стадия – реакция тревоги – стадия мобилизации адаптационных возможностей организма. Это нормальный кратковременный ответ на стресс. На этой стадии активизируется работа гипоталамо-гипофизарно-надпочечниковой системы, возрастает уровень кортизола в крови, начинают преобладать процессы катаболизма для повышенного энергетического обеспечения нервной системы. Паттерн изменений в гормональном профиле слюны на этой стадии будет следующим: повышенный уровень кортизола, нормальный уровень ДГЭА.
Вторая стадия – стадия сопротивляемости – характеризуется долговременной адаптацией к продолжающемуся действию стрессора. Благодаря формированию адаптивных механизмов, расход энергии в эту стадию становится меньше, однако количество вырабатываемых гормонов, в том числе кортизола, остается повышенным – соответствует потребностям организма в условиях действия стрессора. При этом общий субстрат, необходимый для синтеза кортизола и ДГЭА, уходит исключительно на производство первого, вследствие чего уровень ДГЭА снижается. Это первый признак усталости надпочечников. Гормональный паттерн в слюне: повышенный уровень кортизола и низкий уровень ДГЭА.
Третья стадия – стадия истощения – наступает, если действие повреждающего фактора не закончилось, однако адаптивные возможности организма уже исчерпаны. Истощение надпочечников на этой стадии проявляется снижением уровня как кортизола, так и ДГЭА. Сначала паттерн в слюне изменится до нормального уровня кортизола и сниженного уровня ДГЭА, а затем будут определяться низкие концентрации обоих гормонов.
В последующем при успешной адаптации к стрессору или прекращению его действия в начале восстановления надпочечников постепенно нормализуется уровень ДГЭА, при этом концентрация кортизола остается низкой.
В крови определенная часть кортизола и ДГЭА находится в связанном с белками плазмы состоянии и не обладает биологической активностью. С диагностической целью предпочтительнее определять концентрацию именно свободных, то есть не связанных с плазменными белками, гормонов. Содержащиеся в крови молекулы могут проходить через мембрану, отделяющую кровеносное русло от протоков слюнных желез. Свободные фракции стероидных гормонов, являясь липофильными молекулами с относительно небольшой молекулярной массой, могут свободно проникать через мембрану слюнных желез, а для связанных с плазменными белками она, напротив, непроницаема. Таким образом, измерение концентрации гормонов в слюне дает информацию об уровне их биологически активных – "свободных" фракций.
Выработка кортизола надпочечниками подчиняется суточному ритму – она максимальна в утренние часы и достигает минимальных значений к ночи. Вариации интенсивности секреции кортизола довольно значительны, поэтому для исследования необходимо не менее 4 образцов биологического материала, собранных в разные периоды суток. Использование слюны в качестве материала для исследования в данной ситуации обладает большими преимуществами, так как ее сбор это неинвазивная, безболезненная и удобная процедура.
Для чего используется исследование?
Исследование эндокринной реакции на острый и хронический стресс;
в спортивной медицине – для диагностики "синдрома перетренированности";
в производственной медицине в целях дифференцировки легко и плохо адаптирующихся людей (например, при работе, сопровождаемой высокой вероятностью развития стресса).
Когда назначается исследование?
При наличии симптомов и признаков длительного стресса или дисфункции надпочечников, которые могут проявляться в том числе:
такими неврологическими расстройствами, как синдром хронической усталости (особенно усталость в утреннее время), расстройства настроения, депрессия, беспокойство, нарушения памяти и концентрации;
расстройствами обмена веществ – ожирение (часто накопление жира в области талии и на животе), дисфункция щитовидной железы, нарушения менструального цикла;
расстройствами пищеварения – запоры, диарея, рефлюксы желчи в желудке и пищеводе, язвенная болезнь;
Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 12, стр. 1535-1545
Известны функциональная связь гипоталамо-гипофизарно-адреналовой и тиреоидной систем и защитный эффект гормонов их эффекторного звена при стрессе. Однако их взаимодействие в этих условиях не исследовано. Цель работы – установить значение йодсодержащих тиреоидных гормонов для реализации стресс-протекторного эффекта гидрокортизона при эмоциональном стрессе. Эксперименты были выполнены на 300 белых беспородных крысах-самцах массой 220–240 г. Стресс создавали путем “дефицита времени”. Тиреоидный статус изменяли путем введения тиреостатика мерказолила (внутрижелудочно, 25 мг/кг, 20 дней), снижающего уровень йодсодержащих тиреоидных гормонов в крови, или L-тироксина в малых дозах (таким же образом, 1.5–3 мкг/кг, 28 дней). Гидрокортизон (внутрибрюшинно, 50 мг/кг) вводили за 1 ч до формирования состояния стресса. Интенсивность стресс-реакции исследовали по: 1) изменению относительной массы надпочечников, тимуса и селезенки; 2) уровню кортикостероидов и инсулина в крови; 3) поражению слизистой оболочки желудка через 1 ч после стресса. Результаты обработаны непараметрическими методами с использованием U-критерия Манна–Уитни, Statistica 10.0. Найдено, что малые дозы L-тироксина ограничивают изменения относительной массы стресс-сенситивных органов, содержания кортикостероидов и инсулина в крови, повреждение слизистой оболочки желудка при стрессе. Гидрокортизон лимитирует вызванные стрессом сдвиги относительной массы надпочечников и тимуса, предупреждает падение концентрации инсулина в крови и оказывает гастропротективный эффект при стрессе. Экспериментальный гипотиреоз достоверно снижает выраженность защитного действия гидрокортизона при стрессе. Вывод: для осуществления стресс-протекторного эффекта гидрокортизона необходимы йодсодержащие гормоны щитовидной железы.
Высокая доля заболеваний, имеющих стрессорную этиологию, определяет необходимость поиска новых способов повышения устойчивости организма к действию стрессорных факторов. Перспективное направление таких исследований – изучение антистрессорного потенциала эндогенных факторов, в частности, гормонов, обеспечивающих пролонгированные реакции на действие экстремальных раздражителей. Еще Г. Селье была описана роль глюкокортикоидов [1], заключающаяся в срочной мобилизации глюкозы [2], что формирует энергетическую базу для осуществления адаптационных реакций.
Введение экзогенных аналогов глюкокортикоидов минимизирует интенсивность стрессорного ответа. Аналогичное действие продемонстрировано для йодсодержащих тиреоидных гормонов (ЙТГ) при воздействии стрессоров различной природы: иммобилизационного [4], температурного, физического и химического [5], эмоционального [6], нейрогенного и радиционного [7].
Имеются данные, доказывающие функциональную взаимосвязь гипоталамо-гипофизарно-адреналовой системы и тиреоидной систем. Глюкокортикоиды участвуют в регуляции метаболизма йода в щитовидной железе [8]: у адреналэктомированых крыс отсутствует ингибирующий эффект высоких доз йодида калия на захват йода тиреоцитами и синтез тиреоидных гормонов при однократном введении (1000 суточных доз), и развивается гипертиреоз при многократном введении (от 1 до 500 суточных доз в течение 14 дней). С другой стороны, йод-индуцированная блокада щитовидной железы (8 мкг йодида калия /100 г массы тела в течение 5 дней) приводит к кратковременному повышению концентрации кортизола в крови крыс, что указывает на стимуляцию функции надпочечников в этих условиях [9]. Подобная связь обнаружена и при стрессе. Экспериментальный гипотиреоз (2.5 мг/100 г массы тела тирозола, 28 дней) обусловливает более низкую концентрацию кортизола в крови крыс при температурном воздействии (облучение инфракрасной лампой в течение 5 ч) [10]. Повышение сывороточного уровня кортикостероидов после эмоционально-болевого стресса коррелирует со снижением содержания йода в щитовидной железе крыс [8].
Однако значение ЙТГ для осуществления биологического действия глюкокортикоидов в условиях стресса не изучено.
Цель исследования: установить значение йодсодержащих тиреоидных гормонов для реализации стресс-протекторного эффекта гидрокортизона при эмоциональном стрессе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 300 белых половозрелых беспородных крысах-самцах. В опыт брали 3-месячных животных, полученных из питомника “Рапполово” (РФ). К концу эксперимента их масса составляла 220–240 г. При проведении экспериментов соблюдены требования гуманного обращения с экспериментальными животными, содержащиеся в методических указаниях “Положение о порядке использования лабораторных животных в научно-исследовательских работах и педагогическом процессе учреждении образования “Витебский государственный ордена Дружбы народов медицинский университет” и мерах по реализации требований биомедицинской этики”. Эмоциональный стресс вызывали путем моделирования “дефицита времени” [11]. Для этого крыс (по одной особи) помещали в нижнюю часть спирального лабиринта, который быстро заполняли водой. Стараясь избежать контакта с ней, животное вынуждено было перемещаться вверх и никак не могло повлиять на обстановку в которой оказалось.
Было сформировано 10 экспериментальных групп: “Контроль”, “Стресс”, “Мерказолил”, “Мерказолил + стресс”, “L-тироксин”, “L-тироксин + стресс”, “Гидрокортизон”, “Гидрокортизон + стресс”, “Мерказолил + гидрокортизон”, “Мерказолил + гидрокортизон + стресс”.
Для снижения уровня тиреоидных гормонов в крови использовали мерказолил (внутрижелудочно в 1%-ном крахмальном клейстере в дозе 25 мг/кг в течение 20 дней), для его повышения до верхних границ физиологической нормы – L-тироксин в малых дозах (таким же способом 1.5–3 мкг/кг в течение 28 дней). Гидрокортизон вводили за 1 ч до создания стресса (внутрибрюшинно в виде раствора в пропиленгликоле в дозе 50 мг/кг). Всем остальным группам крыс внутрижелудочно вводили 1%-ный крахмальный клейстер в течение 28 дней. Интенсивность общего адаптационного синдрома характеризовали по классической “триаде”: 1) относительная масса надпочечников, тимуса и селезенки (мг/г); 2) уровень кортикостероидов и инсулина в крови; 3) состояние слизистой оболочки желудка (СОЖ). Концентрацию гормонов определяли иммуноферментным методом, после чего рассчитывали кортикостероид-инсулиновый (К/И) коэффициент: чем он выше, тем интенсивнее напряженность компенсаторных механизмов и меньше резервные возможности организма [12]. В эксперимент животных забирали через 1 ч после воздействия.
Для исследования состояния СОЖ крыс за 24 ч до эксперимента лишали пищи, сохраняя свободный доступ к воде. Поражение СОЖ изучали по частоте (отношениe числа животных, имевших кровоизлияния в слизистой оболочки желудка, к общему количеству крыс в группе, выраженное в %), тяжести (в баллах: 0 – отсутствие кровоизлияний; 0.5 – гиперемия; 1 – единичные (1 или 2) точечные кровоизлияния; 2 – множественные (более 3) незначительные (площадью около 1 мм 2 ) кровоизлияния; 3 – множественные значительные (площадью более 1 мм 2 ) кровоизлияния; 4 – массивные кровоизлияния, охватывающие практически всю поверхность слизистой [13, в нашей модификации]. Рассчитывали индекс поражения СОЖ, как произведение частоты и средней тяжести поражения в группе, деленное на 100. Частоту поражения СОЖ изучали у 30 крыс, тяжесть – у 10, остальные показатели стресс-реакции – у 6 животных, выбранных случайным образом из каждой экспериментальной группы.
Статистическую обработку результатов проводили с помощью программы Statistica 10.0” (StatSoftinc., STA999K347156-W), используя непараметрические методы. При межгрупповом сравнении для анализа различий по количественным параметрам использовали U-критерий Манна–Уитни. Данные по частоте поражения СОЖ обрабатывали с использованием модулей Непараметрические статистики, Таблицы 2 × 2 (использовали точный критерий Фишера), данные по тяжести повреждения СОЖ – с использованием модулей: “Основные статистики и таблицы”, “Таблицы и заголовки”, “Подробные двухвходовые таблицы” (модификации критерия χ 2 – метод Пирсона и метод максимального правдоподобия). Критическим уровнем значимости был принят p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Рис. 1.
Таблица 1.
Влияние введения L-тироксина, гидрокортизона и мерказолила на состояние слизистой оболочки желудка крыс в условиях стресса
Примечание. n – число животных в группе; p – обозначение достоверности различий.
Введение L-тироксина в малых дозах, которое, как показано ранее [14], не изменяло прирост массы тела, частоту сердечных сокращений, уровень ЙТГ в крови, не оказало влияния на изученные нами показатели стресс-реакции.
Введение гидрокортизона вызвало повышение сывороточного уровня инсулина на 15% (p < 0.05) и не повлияло на другие изученные нами параметры (p > 0.05).
Для того, чтобы выяснить значение ЙТГ в реализации стресс-протекторного эффекта гидрокортизона, далее исследовали возможность его осуществления у гипотиреоидных животных. Введение гидрокортизона крысам со сниженным уровнем йодсодержащих тиреоидных гормонов (группа № 9 в табл. 1) повысило концентрацию кортикостероидов и инсулина в крови: по сравнению с группой “Мерказолил” (группа № 7 в табл. 1) на 22 и 24% (p < 0.01).
После стресса у таких крыс относительная масса надпочечников и селезенки не изменялась в отличие от эутиреоидных животных, подвергнутых стрессу после получения гидрокортизона, а тимуса – падала практически в такой же степени (на 11%) (p < 0.01). Тот факт, что относительная масса надпочечников не возрастала, по нашему мнению, определил отсутствие увеличения уровня кортикостероидов в крови (р > 0.05 по сравнению с группой “Мерказолил + гидрокортизон”), наблюдавшееся после стресса у животных, которым вводили гидрокортизон. Содержание инсулина, как и в указанной группе сравнения, не изменялось. В результате этого значение К/И коэффициента практически не изменилось. Поражение СОЖ развивалось у всех животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Обнаруженные в нашем исследовании изменения относительной массы надпочечников, тимуса и селезенки, уровня кортикостероидов и инсулина в крови, поражение СОЖ были установлены и другими авторами при стрессах различной природы: холодовом [15], тепловом [16], иммобилизационном [17], психологическом [18] и др., что доказывает их неспецифический характер.
Нами установлено, что малые дозы L-тироксина и гидрокортизон снижают интенсивность общего адаптационного синдрома при эмоциональном стрессе, моделируемом “дефицитом времени”, – ограничивают изменения относительной массы надпочечников, селезенки и тимуса, уровня стресс-гормонов в крови и возрастание К/И коэффициента, повреждение СОЖ. Такое действие указанных гормонов отмечали и другие авторы. Так, введение тиреоидина новорожденным поросятам (10 мг/кг массы тела в течение 32-х дней) предупреждало развитие стресса при отъеме их от матери [6]; малые дозы тироксина (5.2 мкг/г массы тела в течение 6-ти дней) ограничивали изменения активности митохондриальных ферментов во многих тканях крыс при нейрогенном (плавание в воде с T 30°С в течение 60 мин) и радиационном (гамма-облучение в дозе 6 Гр) стрессах [7].
Введение дексаметазона или гидрокортизона ограничивало изменение концентрации адренокортикотропного гормона, кортизола, кортикостерона и инсулина в крови при стрессе, вызванном введением катетера [3], электрокожным раздражением и “новизной обстановки” [19], а также поражение СОЖ при его индукции нестероидным противовоспалительным препаратом индометацином [20].
Мы полагаем, что защитный эффект L-тироксина связан прежде всего с геномным действием: взаимодействие Т3 с локализованным в ядре рецептором TRβ активирует фосфатидилинозитол-3-киназу (PI3K); связывание и Т3, и Т4 с интегрином αvβ3 активирует ферменты внутриклеточных сигнальных путей митоген-активируемой протеинкиназы. Результат – стимуляция транскрипции генов, кодирующих синтез специфических клеточных белков. Кроме того, связывание Т3 с ανβ3 активирует PI3K посредством формирования белок-белковых комплексов с участием р85а регуляторной субъединицы фермента [21]. Помимо ЙТГ стресс-протекторный эффект может оказывать и тиролиберин, после связывания которого с рецепторами происходит активация аденилатциклазы с последующим образованием цАМФ – универсального регулятора внутриклеточных процессов [22]. Имеют значение и стимуляция тирелиберином энергетического обмена, регуляция перекисного окисления липидов, опиоидной и ГАМК-ергической систем, его нейропротекторные и антигипоксические свойства, защитное действие на мембраны клеток [23]. Отметим, что число рецепторов тиролиберина и количество его мРНК увеличиваются глюкокортикоидами.
Их действие в примененной нами дозе (12.5 мг в преднизолоновом эквиваленте) также опосредовано геномными эффектами: после связывания глюкортикоидов с рецепторами происходит ремоделирование шаперонного комплекса (Hsp23, 70, 90) и ядерная транслокация комплекса глюкортикоидный гормон–рецептор с участием импортинов (α-7 и α-8), позволяющих ему взаимодействовать с элементами цитоскелета и передвигаться вдоль микротрубочек в ядро [24].
Введение гидрокортизона, как и L-тироксина, минимизирует вызванные стрессом изменения относительной массы стресс-сенситивных органов и поражение СОЖ, предупреждает падение уровня инсулина в крови, ограничивает рост К/И коэффициента.
Также в работе обнаружено, что у гипотиреоидных животных не происходит повышения относительной массы надпочечников и уровня кортикостероидов в крови при развитии стресса. Вероятно, это определяется снижением скорости белкового синтеза при гипотиреозе [25], вследствие чего не происходит стимуляции секреции АКТГ – гормона пептидной природы. Падение его уровня у гипотиреоидных крыс было показано в работе [26]. В совокупности с этими результатами меньшее изменение относительной массы тимуса и отсутствие снижения относительной массы селезенки, которые вызываются глюкокортикоидами, могут свидетельствовать о подавлении реакции гипоталамо-гипофизарно-адренокортикальной системы в ответ на стрессовое воздействие при дефиците ЙТГ. Следует подчеркнуть, что введение L-тироксина не исключило реализацию реакций общего адаптационного синдрома, а только снизило их интенсивность, т.е. минимизировало негативное действие избытка стресс-гормонов.
При экспериментальном гипотиреозе не выявляется защитный эффект экзогенных глюкокортикоидов (у таких животных не происходит увеличения относительной массы надпочечников, наблюдается меньшая масса тимуса и селезенки, более низкая концентрация кортикостероидов и инсулина в крови), бóльшее поражение СОЖ, что свидетельствует о том, что для осуществления такого эффекта гидрокортизона во многом необходимы ЙТГ.
Кортизол (Гидрокортизон, Cortisol)
Краткая характеристика определяемого вещества Кортизол
Кортизол – стероидный гормон, основной представитель глюкокортикоидов, вырабатывается в пучковой зоне коры надпочечников под контролем адренокортикотропного гормона (АКТГ) гипофиза, выработка которого зависит от совокупности поступающих нейрональных и гуморальных стимулов, а также уровня кортизола в крови (по принципу отрицательной обратной связи). В крови большая часть гормона находится в неактивном состоянии: 75% кортизола связано с кортикостероидсвязывающим белком (транскортином), 15% слабо связано с альбумином. Около 10% циркулирует в свободной форме и является биологически активной фракцией гормона. Кортизол подвергается метаболическим превращениям преимущественно в печени, период полураспада составляет 80-110 минут, конъюгаты кортизола выводятся из организма с мочой. Для кортизола характерен суточный ритм секреции с максимумом в утренние часы (6-8 часов) и минимумом в вечернее (22-23 часа) время. Секреция кортизола мало меняется с возрастом. При беременности наблюдается прогрессивный рост концентрации кортизола, связанный с повышением содержания транскортина: в поздние сроки беременности до 2-5-кратного повышения. Суточный ритм выделения этого гормона может нарушаться под воздействием стресса – физического или психологического. В спортивной медицине повышение уровня кортизола в крови расценивается как один из маркеров утомления.
Глюкокортикоиды прямо или опосредованно регулируют практически все физиологические и биохимические процессы, рецепторы к ним обнаружены во всех тканях организма. Кортизол играет ведущую роль в реакциях организма на стрессовую ситуацию, участвуют в поддержании артериального давления, усиливает катаболизм белков, а также повышает уровень глюкозы в крови. Кортизол обладает мощным противовоспалительным действием. Подавление иммунного ответа связано с ослаблением процессинга антигенов, снижением выработки антител, нарушением различных звеньев лимфопоэза. Гиперчувствительность организма к различным агентам под действием кортизола снижается.
Механизмы влияния на жировую ткань разнообразны, и зависят от ее локализации. В конечностях кортизол активирует липолиз, а в верхней половине туловища – к усилению липогенеза. При гиперкортицизме происходит типичное перераспределение подкожно-жировой клетчатки с увеличением объема жировой ткани в области лица, шеи, груди, живота и истончением рук и ног. При избыточной секреции кортизола проявляется его минералокортикоидная активность – наблюдается задержка натрия в организме, отеки и гипокалиемия, а вследствие повышения гломерулярной фильтрации увеличивается диурез. Избыток глюкокортикоидов формирует отрицательный баланс кальция.
С какой целью определяют уровень Кортизола в сыворотке крови
Кортизол является основным глюкокортикоидным гормоном, индикатором функции коры надпочечников. Определение его уровня в крови проводится с целью дифференциальной диагностики синдрома Иценко-Кушинга и болезни Аддисона, скрининга и диагностики первичной и вторичной недостаточности надпочечников, а также для оценки эффективности лечения вышеуказанных патологий.
Синдром Иценко-Кушинга – клинический синдром, который развивается вследствие повышенного содержания глюкокортикоидов в крови. Может развиваться при избыточной эндогенной секреции кортизола при аденоме или карциноме коры надпочечников, АКТГ-секретирующей опухоли локализованной вне гипофиза либо быть следствием длительной терапии глюкокортикоидами, когда их используют как противовоспалительные или иммуносупрессивные средства. Клиническая картина включает характерный тип ожирения (с неравномерным перераспределением подкожно-жировой клетчатки в область верхней части тела и живота), лунообразное лицо, артериальную гипертензию, гирсутизм, нарушение толерантности к углеводам, нарушение репродуктивных функций и нейропсихиатрические симптомы.
Болезнь Иценко-Кушинга представляет собой гипофиз-зависимую форму гиперкортицизма как результат АКТГ-секретирующей аденомы гипофиза.
В дифференциальной диагностике синдрома и болезни Иценко-Кушинга могут быть использованы определение уровня кортизола в сыворотке крови, суточной моче (см. тест № 178 ) или слюне (см. тест № 1508 ) АКТГ, а также функциональные пробы и оценку суточных ритмов секреции кортизола (теряется у пациентов с синдромом Иценко-Кушинга). Злоупотребление алкоголем может имитировать по клиническим и биохимическим проявлениям синдром Иценко-Кушинга (изменения обратимы при отказе от алкоголя). Ожирение также может приводить к сходным клиническим проявлениям. В связи с высокой вариабельностью физиологической секреции кортизола и его уровня в сыворотке крови в случайно взятых пробах (в том числе и в утренние часы), в начальном скрининге эндогенного гиперкортицизма предпочтительно использовать оценку суточного выделения кортизола с мочой и/или исследование кортизола в вечерней пробе слюны (собранной в 23 часа вечера). В мочу и слюну попадает преимущественно свободный, не связанный с белками кортизол, и результат таких тестов отражает уровень биологически активного кортизола крови, при использовании суточной мочи – усредненно за сутки, а в пробе слюны – на момент ее сбора вечером.
Надпочечниковая недостаточность – синдром, обусловленный дефицитом синтеза и секреции кортизола в коре надпочечников.
Болезнь Аддисона (первичная надпочечниковая недостаточность) обусловлена патологией надпочечников в результате воздействия внешних факторов: кровоизлияния, инфекционного, опухолевого, аутоиммунного поражения или после адреналэктомии.
При вторичной и третичной надпочечниковой недостаточности низкий уровень кортизола может быть связан со сниженной секрецией адренокортикотропного гомона (АКТГ) гипофиза или нарушением секреции кортикотропин-рилизинггормона (КРГ) в гипоталамусе. В дифференциальной диагностике надпочечниковой недостаточности применяется определение уровня АКТГ и кортизола базальных и при проведении диагностических проб.
Частой причиной недостаточности надпочечников является состояние, связанное с последствиями фармакологического введения глюкокортикоидов, которые подавляют синтез эндогенных регуляторных гормонов и кортизола.
Врожденная дисфункция коры надпочечников. Причиной развития любой формы врожденной дисфункции являются мутации генов, отвечающих за синтез ферментов или транспортных белков, участвующих в биосинтезе кортизола. Наиболее частая форма, встречающаяся более чем в 90% случаев, обусловлена дефицитом фермента 21-гидроксилазы. Нарушение синтеза кортизола вследствие недостаточности фермента 21-гидроксилазы ведет к тому, что по механизму отрицательной обратной связи избыток АКТГ стимулирует корковый слой надпочечников, что вызывает ее гиперплазию. При этом из-за существующего ферментативного блока на пути стероидогенеза накапливаются предшественники кортизола и андрогенов, пути образования которых не заблокированы (17-ОН-прогестерон, ДЭА-SO4, андростендион, тестостерон). У женщин клинические проявления этого синдрома сходны с синдромом поликистозных яичников или идиопатическим гирсутизмом.
Правила подготовки к исследованию на Кортизол
В каких случаях проводят анализ крови на Кортизол:
- дифференциальная диагностика синдрома и болезни Иценко-Кушинга (при проведении функциональных проб);
- скрининг и диагностика первичной и вторичной надпочечниковой недостаточности.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Читайте также:
