Гормоны сосудов. Гормоны эндотелия. Эндотелин. Регуляторная функция гормонов сосудистого эндотелия. Эндотелиалъный гиперполяризующий фактор.
Добавил пользователь Владимир З. Обновлено: 24.01.2026
1. Гомазков О. А. Система эндотелиновых пептидов: механизмы кардиоваскулярных патологий // Вопросы медицинской химии. Биомедицинская химия. – 1999. – Т. 45, № 4. – С. 290-302.
2. Чазова И. Е., Мартынюк Т. В., Масенко В. П., Миронова Н. А. и др. Роль лёгких в метаболизме некоторых маркёров повреждения эндотелия в норме и при первичной лёгочной гипертензии // Кардиология. 2003 – Т. 40, № 8. – С. 13-15.
3. Adner M., Cardell L. O., Sj`berg T., Ottosson A., Edvinsson L. Contractile endothelin-B receptors in human small bronchi // Eur. Respir. J. – 1996. – № 9. – P. 351-355.
4. Antonopoulos A., Kyriacou C., Kazianis G. Significance of Endothelin-1 in Myocardial Infarction // Hellenic J. Cardiol. – 2007. – Vol. 48. – P. 161-164.
5. Arai H., Hori S., Aramori I., Ohkubo H., Nakanishi S. Cloning and expression of a cDNA encoding an endothelin receptor // Nature, Lond. – 1990. – Vol. 348. – P. 730-732; Sakurai T., Yanagisawa M., Takuwa Y., Miyazaki H., et al. Cloning of a cDNA encoding a non-isopeptide-selective subtype of the endothelin receptor // Nature, Lond. – 348. – P. 732-735.
6. Bacakoglu F., Atasever A., Ozhan M.H. et al. Plasma and bronchoalveolar lavage fluid levels of endothelin-1 in patients with chronic obstructive pulmonary disease and pulmonary hypertension // Respiration. – 2003. – Vol. 70. – P. 594-599.
7. Badr K. F., Murrey J. J., Brever M. D., Takahashi K. etal. Mesangial cell, glomerular and renal vascular responses to endothelin in the rat kidney. Elucidation of signal transduction pathways // J. Chin. Invest. – 1989. – Vol. 83. – P. 336-342.
Прошло уже больше 20 лет с открытия эндотелинов, и за этот период было проведено огромное число работ, посвящённых изучению функций данного полипептида. Были изучены и исследованы предшественники, ферменты, участвующие в его образовании, места синтеза и утилизации, рецепторы и основные сигнальные пути, через которые эндотелин реализует свои функции. Но интерес ученых к эндотелинам все равно не утихает, а переходит на более новый уровень. В 1985 г. Hickey показал, что эндотелий сосудов выделяет вазоконстрикторное вещество пептидной природы, которое оказывает продолжительное сосудосуживающее действие. В 1988 г. японским исследователем Yanagisawa M. et al. это соединение было выделено из культуры клеток эндотелия аорты свиньи и названо эндотелином (по месту происхождения) [1].
Эндотелин — это самый мощный сосудосуживающий бициклический полипептид, который состоит из 21 аминокислоты. Аминокислотные остатки связаны двумя бисульфидными связями и образует изомеры. В настоящее время было обнаружено три изоформы эндотелина. Основная ее форма-это эндотелин-1(EТ-1), а остальные изоформы – это эндотелин-2 и эндотелин-3 (EТ-2 и EТ-3), которые отличаются друг от друга особенностями последовательности аминокислот в структуре соединения. В ходе многочисленных экспериментов было выяснено, что эндотелий секретирует большой эндотелин (проэндотелин) (38 аминокислотных остатков). А при действии эндотелинпревращаюшего фермента, который находится внутри и на поверхности эндотелия, из большого эндотелина образуются изомеры эндотелинов. [1]
Внутри человеческого генома каждый из эндотелинов представлен отдельным геном, кодирующим специфический предшественник для зрелой изоформы. В гене имеются специальные участки связывания различных субстратов, регулирующих экспрессию эндотелинов.
Основное количество EТ-1 вырабатывается в эндотелии сосудов и вносит наибольший вклад в активность эндотелиновой системы. Кроме эндотелиоцитов сосудов, EТ-1 может вырабатываться гладкомышечными клетками аорты, эпителиальными клетками почек, гепатоцитами, астроцитами, клетками эндометрия, клетками бронхиальных желёз, нейтрофилами и альвеолярными макрофагами.
EТ-1 не депонируется внутриклеточно. Он синтезируется в ответ на различные стимулы и сразу секретируется во внешнюю среду. Секреция этого пептида широко регулируется на уровне его синтеза de novo.
Предшественником эндотелина является препроэндотелин, состоящий из 212 аминокислотных остатков. Под воздействием специфической эндопротеазы от него отщепляется так называемый большой эндотелин (bigET). В дальнейшем большой эндотелин расщепляется при помощи эндотелинпревращающего фермента (ЭПФ), в результате чего образуется EТ-1. ЭПФ относится к группе мембраносвязанных металлопротеиназ, участвующих в образовании многих пептидных гормонов и нейропептидов. ЭПФ локализуется в сосудах лёгких, сердца, почек, поджелудочной железы и других органов. Важную роль в синтезе эндотелинов играют тромбин и тромбоциты. Они в своем роде являются активизирующими эндотелинпревращающими ферментами. Но сами эндотелины могут вызывать адгезию или агрегацию тромбоцитов [2].
Факторами, которые активируют синтез эндотелина, являются некоторые химические и физические стимулы, способные инициировать вазоконстрикцию. К ним можно отнести некоторые гормоны, например, адреналин, инсулин, вазопрессин, вещества, имеющие пептидную природу (ангиотензин II, интерлейкин 1, эндотоксин, сам эндотелин и различные ксенобиотики). А физико-химическими стимулами синтеза эндотелина служат гипоксия и высокая осмолярность.
Замедляющим воздействием на синтез эндотелина обладают оксид азота и некоторые другие соединения, активирующие синтез цГМФ и обладающие сосудорасширяющим действием [3].
Роль эндотелинов в организме изучена не полностью, но его основным механизмом действия считают высвобождение кальция. Это вызывает стимуляцию всех фаз гемостаза, начиная с агрегации тромбоцитов и заканчивая образованием красного тромба; кроме того, это приводит к сокращению и росту гладких мышц сосудов, что способствует утолщению стенки сосудов и уменьшении их диаметра, иначе говоря, вазоконстрикции.
Таким образом, EТ-1 является главной изоформой в кардиоваскулярной системе человека. А роль других изоформ остается не до конца изученной. Существуют некоторые предположения, что эндотелин-2 может служить в почках в качестве медиатора, а эндотелин-2 в кишечнике и ЦНС.
EТ 1 действует как паракринный и аутокринный медиатор, а не как циркулирующий эндокринный гормон, поэтому его плазменная концентрация не может полностью отражать его физиологическое действие [4].
Период жизни EТ-1 в плазме составляет примерно 2 мин. Он связан с его эффективным удалением из кровотока лёгочным и почечным сосудистым ложем. Это происходит, когда EТ связывается со специфическими EТВ-рецепторами, которые непосредственно расположены на поверхностях клеток, после чего происходят его деградация, (предполагают, что это происходит внутри лизосом).
EТА рецептор состоит из 427 аминокислотных остатков и связывает отдельные изоформы EТ со следующей аффинностью: ЕТ-1 > ЕТ-2 > ЕТ-3.
EТА рецепторы преобладают в гладкомышечных клетках сосудов и сердца, при этом они отсутствуют в эндотелии. Взаимодействие EТ 1 с EТА-рецепторами вызывает стойкую вазоконстрикцию и пролиферацию гладкомышечных клеток. EТВ-рецептор состоит из 442 аминокислотных остатков и связывает все эндотелины с одинаковой аффинностью. EТВ-рецепторы располагаются в эндотелиальных и гладкомышечных клетках и обнаруживаются в основном в головном мозге, лёгких, почках и аорте. При патологических состояниях EТ-рецепторы регулируются по-разному и это ведёт к дисбалансу эффектов в направлении вазоконстрикции и пролиферации клеток [5].
Эффекты EТ-1 на сердце разнообразны. Нормальная концентрация EТ-1 производит положительный инотропный эффект посредством увеличения уровня внутриклеточного кальция, в то время как повышенное содержание EТ 1 в плазме приводит к снижению сердечного выброса. Это происходит вследствие преобладающего вазоконстрикторного действия EТ-1 как на уровне периферических, так и коронарных сосудов, приводя, таким образом, к повышению постнагрузки и уменьшению перфузии миокарда. Антагонисты EТ оказывают отрицательный эффект на сократимость миокарда у здоровых лиц с нормальным уровнем EТ-1 в плазме, но улучшают её у пациентов с выраженной дисфункцией желудочков. EТ-1 также продуцируется в культуре эндокардиальных клеток.
Секретируемый пептид может действовать в качестве паракринного медиатора на соседние миоциты, проводящую систему или коронарные сосуды. В кардиомиоцитах, сердечных мембранах и в атриовентрикулярном узле были обнаружены высокоаффинные участки связывания, специфичные для EТ-1. В человеческом сердце гибридизация in situ показала, что рецепторы EТА и EТВ мРНК локализуются в миокарде предсердия и желудочков, атриовентрикулярной и эндокардиальной проводящей системе и клетках эндокарда. Прямое действие EТ 1 на сердце включает положительный инотропный и хронотропный эффекты, так же, как и увеличение длительности действия потенциала. Эндотелины могут вовлекаться в развитие гипертрофии миокарда. Они являются потенциальными вазоконстрикторами. Коронаросуживающий эффект EТ-1 может иметь серьёзные последствия для сердечной деятельности: увеличение конечного диастолического объёма, электрокардиографические признаки ишемии миокарда, свободный выброс лактата и в более высоких дозах желудочковую фибрилляцию и смерть.
Концентрация EТ-1 в плазме крови повышается при хронической сердечной недостаточности главным образом за счёт появления большого EТ-1, что свидетельствует скорее о повышении синтеза EТ-1, нежели о падении его клиренса.
EТ-1 обладает проаритмогенным эффектом, что особенно важно у больных с сердечной недостаточностью, т. к. у пациентов этой группы аритмии являются главной причиной летального исхода. У пациентов с неосложнённым течением острого инфаркта миокарда (ОИМ) уровень EТ-1 в плазме крови повышается в течение нескольких часов, достигая максимума к 6-му часу и возвращаясь к норме к 24-му часу. У больных с ОИМ, осложнённым отёком лёгких или кардиогенным шоком, уровень EТ-1 остаётся повышенным более длительный период.
Нарушение функций ЕТ-1 может привести к возникновению ряда сердечно-сосудистых заболеваний, например, ИБС и инфаркт миокарда. В организме происходит нарушение метаболизма и изменение сердечного ритма. Считается, что эндотелин-1 является одним из причин возникновения легочной гипертензии, поражения почек, повреждению стенок сосудов, нарушений работы головного мозга, сахарного диабета [6].
Также основную роль эндотелина-2 приписывают к женскому организму. Ее содержание увеличивается при процессе овуляции. В экспериментах над крысами было научно доказано что интенсивная работа EТ-2 наблюдается при разрыве фолликула. А при плохой работе эндотелина или при ее недостаточности возникают нарушения процесса овуляции, и не будет формироваться желтое тело. Кроме того, EТ-2 играет немаловажное значение в нормальном функционировании легких, терморегуляции, пищеварении, гомеостазе.
Антагонисты рецепторов ET используются для лечения многочисленных сердечно-сосудистых заболеваний, включая легочную и системную гипертензию, застойную сердечную недостаточность, инфаркт миокарда, сосудистый рестеноз и атеросклероз, почечную недостаточность, цереброваскулярные заболевания и рак [6].
Связь эндотелинов с почками.
В почках EТ секретируется в нескольких зонах, где действует паракринно и аутокринно на рецепторы клеток мишеней. Из-за своих биологических эффектов (включая вазоактивные свойства) EТ вносит вклад в регуляцию почечного кровотока, почечного потока плазмы, уровня клубочковой фильтрации, натриевого и водного транспорта в разных участках нефрона. Плазменная концентрация иммунореактивного EТ-1 находится в обратной зависимости с функцией почек. Однако биологическое действие EТ-1 длится значительно дольше, чем его присутствие в среде (около 60 мин) вследствие почти необратимого связывания с рецепторами клеток мишеней. EТ-1 синтезируется эндотелием клубочков и почечными эпителиальными клетками. Системное введение EТ-1 приводит к повышению сопротивления почечных сосудов и заметному снижению кровотока в почках. Как и при системном воздействии EТ-1 на артериальное давление, почечной вазоконстрикции предшествует транзиторная вазодилатация.
EТ-1 является наиболее мощным среди соединений, повышающих сопротивление сосудов почек. Он более чем в 30 раз превышает действие ангиотензина II и в 50 раз эффект норадреналина при добавлении к изолированным перфузируемым почкам кролика и крысы. Влияние EТ-1 на функцию канальцев заключается в уменьшении натрийуреза.
Диурез при системном введении EТ-1 снижается преимущественно за счёт уменьшения уровня клубочковой фильтрации (КФ) и почечного кровотока в целом. Однако некоторые исследователи описывали усиление диуреза при системном введении EТ-1, несмотря на приведённые эффекты. Предполагалось, что усиление диуреза может быть вызвано EТ-1 ингибированием реабсорбции воды в канальцевой сети почек [7].
Большое число экспериментальных данных даёт основания предполагать вовлечение EТ-1 в патофизиологию хронической почечной недостаточности (ХПН), при которой отмечается как повышение уровня EТ-1 в плазме крови, так и увеличение его почечной экскреции. При этом у нормотензивных больных с ХПН повышение уровня EТ 1 в плазме крови может отсутствовать, тогда как у больных с ХПН, осложнённой развитием гипертензии, он значительно повышен. EТ-1 проявляет себя как противовоспалительный медиатор. Он вызывает внутрисосудистую секвестрацию лейкоцитов и повышает экстравазацию альбумина и отёка лёгких у морских свинок. Высвобождение EТ-1 влияет на секрецию гистамина с последующей вторичной аккумуляцией гранулоцитов через специфическую активацию EТА-рецепторов [7].
Гормоны сосудов. Гормоны эндотелия. Эндотелин. Регуляторная функция гормонов сосудистого эндотелия. Эндотелиалъный гиперполяризующий фактор.
Ренин. Ренин - ангиотензин - альдостероновая система. Образование ренина и основные функции ренин-ангиотензин-альдостероновой системы.
Ренин образуется в виде г роренина и секретируется в юкстагломерулярном аппарате (ЮГА) (от латинских слов juxta — около, glomerulus — клубочек) почек миоэпителиоидными клетками приносящей артериолы клубочка, получившими название юкстагломерулярных (ЮГК). Структура ЮГА приведена на рис. 6.27. В ЮГА кроме ЮГК также входит прилегающая к приносящим артериолам часть дистального канальца нефрона, многослойный эпителий которого образует здесь плотное пятно — macula densa. Секреция ренина в ЮГК регулируется четырьмя основными влияниями. Во-первых, величиной давления крови в приносящей артериоле, т. е. степенью ее растяжения. Снижение растяжения активирует, а увеличение — подавляет секрецию ренина. Во-вторых, регуляция секреции ренина зависит от концентрации натрия в мочедистального канальца, которая воспринимается macula densa — своеобразным Na-рецептором. Чем больше натрия оказывается в моче дистального канальца, тем выше уровень секреции ренина. В-третьих, секреция ренина регулируется симпатическими нервами, ветви которых заканчиваются на ЮГК, медиатор норадреналин через бета-адре-норецепторы стимулирует секрецию ренина. В-четвертых, регуляция секреции ренина осуществляется по механизму отрицательной обратной связи, включаемой уровнем в крови других компонентов системы — ангиотен-зина и альдостерона, а также их эффектами — содержанием в крови натрия, калия, артериальным давлением, концентрацией простагландинов в почке, образующихся под влиянием ангиотензина.
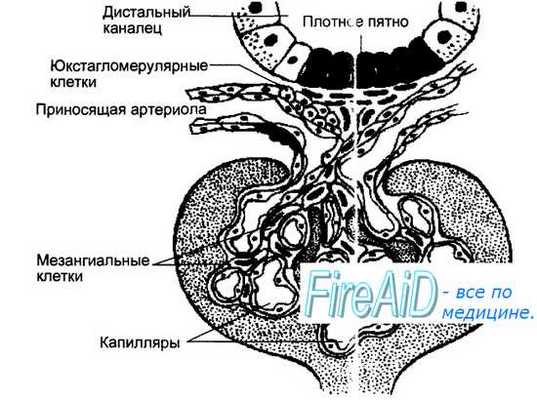
Рис. 6.27. Схема юкстагломерулярного аппарата почек, включающего юкстагломерулярные клетки стенки приносящей артериолы, клетки плотного пятна (macula densa) стенки дистального канальца и мезангиальные клетки. Основное место выработки ренина — юкстагломерулярные клетки приноящей артериолы клубочка.
Кроме почек образование ренина происходит в эндотелии кровеносных сосудов многих тканей, миокарде, головном мозге, слюнных железах, клубочковой зоне коры надпочечников.
Секретированный в кровь ренин вызывает расщепление альфа-глобулина плазмы крови — ангиотензиногена, образующегося в печени. При этом в крови образуется (рис. 6.1-8) малоактивный декапептид ангиотензин-I, который в сосудах почек, легких и других тканей подвергается действию превращающего фермента (карбоксикатепсин, кининаза-2), отщепляющего от ангиотензина-1 две аминокислоты. Образующийся октапептид ангиотензин-II обладает большим числом различных физиологических эффектов, в том числе стимуляцией клубочковой зоны коры надпочечников, секретирующей альдостерон, что и дало основание называть эту систему ренин-ангиотензин-альдостероновой.
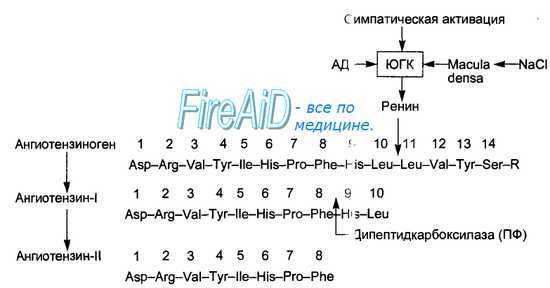
Рис. 6.28. Активация секреции ренина и образование в крови ангиотензина-II. Показаны три вида стимулов для секреции ренина юкстагломерулярными клетками почек: снижение АД в приносящей артериоле клубочка, повышение симпатической активности, влияния macula densa, вызванные сдвигами уровня натрия. Под влиянием фермента ренина от молекулы белка ангиотензиногена отщепляется декапептид — ангиотензин-I. Этот пептид подвергается воздействию превращающегося фермента (ПФ) дипептидкарбоксилазы клеток эндотелия сосудов легких, почек и др., отщепляющей две аминокислоты. Образующийся октапептид является ангиотензином-II.
Ангиотензин-II, кроме стимуляции продукции альдостерона, обладает следующими эффектами:
• вызывает сужение артериальных сосудов,
• активирует симпатическую нервную систему как на уровне центров, так и способствуя синтезу и освобождению норадреналина в синапсах,
• повышает сократимость миокарда,
• увеличивает реабсорбцию натрия и ослабляет клубочковую фильтрацию в почках,
• способствует формированию чувства жажды и питьевого поведения.
Таким образом, ренин-ангиотензин-альдостероновая система участвует в регуляции системного и почечного кровообращения, объема циркулирующей крови, водно-солевого обмена и поведения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Биологическая роль эндотелия в условиях нормы
В работе предствлены современные данные отечественной и зарубежной литературы относительно биологической роли эндотелия сосудов в условиях нормы, участия эндотелия в регуляции сосудистого тонуса, коагуляционного потенциала крови, регуляции адгезии лейкоцитов, регуляции проницаемости сосудов и их реэндотелизацию за счет факторов роста
Ключевые слова
Обзор
Агабеков А.И., Рзаева Т.Ш.
Научные руководители: д.м.н., проф. Чеснокова Н.П., д.м.н., проф. Барсуков В.Ю
Кафедра патологической физиологии им. А.А. Богомольца
Введение
Эндотелиальные клетки имеют.гетерогенную структуру, обладающую многообразными функциями, а нарушение структуры и функций эндотелия является инициирующим фактором развития различных форм патологии. Эндотелиальная выстилка сосудов весьма разнообразна, в ряде органов и тканей имеет плотные межклеточные контакты, носит непрерывный характер, что свойственно для гематоэнцефалического барьера. В других органах и тканях, в частности, в почках, ряде эндокринных желез, эндотелий носит фенестрированный, синусоидальный характер, и тем самым обеспечивает селективную проницаемость для различных веществ (З. А. Лупинская, А. Г.Зарифьян, Т. Ц. Гурович, С. Г. Шлейфер 2008)
Сосудистый эндотелий, по мнению ряда авторов, является эндокринным органом, и выполняет многочисленные функции, в частности, регуляцию коагуляционного потенциала крови, а также сосудистого тонуса. Эндотелиальные клетки опосредуют воспалительные и иммунные процессы; регулируют адгезию лейкоцитов; модулируют окисление липидов; регулируют проницаемость сосудов, их реэндотелизацию за счет факторов роста.
Целью данной работы явился анализ данных литературы отечественных и зарубежных авторов относительно роли эндотелия в регуляции функциональной активности сосудистой стенки в условиях нормы.
Эндотелиальные факторы, регулирующие сосудистый тонус.
Среди эндотелиальных факторов, влияющих на сосудистый тонус, выделяют вазодилатирующие факторы, к которым относятся NO, EDHF (эндотелиальный гиперполяризующий фактор), простациклин, адреномедуллин, моноокись углерода, пуриновые основания, эндогенные каннабиоиды, Na-уретический пептид С, кинины и ряд других. К вазоконстрикторным факторам, продуцируемым эндотелиальными клетками, относятся тромбоксан А2, эндотелины, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II. Балланс между факторами релаксации и констрикции определяет тонус сосудов и соответственно величину местного кровотока. (Каде А.Х., Занин С.А., Губарева Е.А. и др. , 2011)
Вазодилатирующие факторы, продуцируемые эндотелием
Касаясь биологических эффектов ряда вазодилатирующих соединений, синтезируемых в эндотелиальных клетках, следует прежде всего остановиться на эффектах NO.
NО образуется в клетках эндотелия из L-аргинина под действием фермента NO-синтетазы. Имеются два уровня секреции NO — базальный и стимулированный. Тонус сосудов в покое осуществляется постоянной базальной секрецией. Некоторые химические вещества: ацетилхолин, АТФ, брадикинин, а также гипоксия или механическая деформация увеличивают синтез NO. Стимулируя гуанилатциклазу, NO увеличивает образование цГМФ в гладкомышечных клетках, тромбоцитах, что обусловливает расслабление сосудов, ингибирует пролиферацию гладкомышечных клеток и тормозит активность тромбоцитов и макрофагов. (В. Ф. Киричук, А. П. Ребров, С. И. Россошанская, 2005)
Простациклин синтезируется преимущественно в эндотелии. Основным механизмом, регулирующим его образование, является активность ферментов циклооксигиназ. Простациклин оказывает вазодилатирующее действие за счет стимуляции специфических рецепторов, локализованных на гладкомышечных клеток сосудов, что ведет к повышению активности в клетках аденилатциклазы и увеличение образования цАМФ. (Дзгоева Ф. У., Кутырина И. М. 2000)
При блокировании действия NO и простациклина вазодилатацию вызывает эндотелиальный фактор гиперполяризации (EDNF). Данный фактор выделяется только под действием некоторых стимулов: ацетилхолина, брадикинина, тромбина, гистамина, субстанции Р, АДФ, АТФ. EDNF является мощным вазодилататором, воздействующим на Cа ++ -зависимые К + -каналы гладкомышечных клеток сосудов, стимулируя выход из них ионов калия, который вызывает их гиперполяризацию и расслабление.
Пуриновые основания, эндогенными источниками которых являются тромбоциты, эндотелиоциты, нейроны и другие клетки, действуют на различные рецепторы клеток сосудистой стенки: при воздействии на рецепторы эндотелия, происходит стимуляция образования основных вазодилатирующих факторов: простациклина, оксида азота, эндотелиального гиперполяризующего фактора; при воздействии на рецепторы гладкомышечных клеток сосудов пуриновые нуклеотиды вызывают эндотелий-независимую вазодилатацию.
К эндогенным каннабиоидам относят анаидамид и 2-арахидонилглицерин, источниками которых являются клетки эндотеия, тромбоциты, лейкоциты, макрофаги, а также периваскулярные нервные окончания. Анаидамид и 2-арахидонилглицерин образуются в больших количествах при активации тромбоцитов и моноцитов и участвуют в механизмах снижения артериального давления при различных патологических состояниях. (Чурюканов М. В., Чурюканов В. В., 2004)
Известны еще два фактора, выделяемые эндотелием и вызывающие дилатацию сосудов: натрийуретический пептид С-типа (НПС) и адреномедуллин. Натрийуретический пептид С вызывает релаксацию сосудов и угнетает пролиферацию гладкомышечных клеток. Большей частью НПС синтезируется в эндотелии, воздействует на рецепторы гладкомышечных клеток, вызывая увеличение образования цГМФ, приводящего к расширению сосуда. Адреномедуллин действует как прямой вазодилататор за счет увеличения продукции цАМФ. В результате активации аденилатциклазы образуется из препроадреномедуллина в эндотелиальных и гладкомышечных клетках сосудов. Доказано. что сосудорасширяющее действие адреномедуллина связано как с эндотелий-зависимыми, так и с эндотелий-независимыми механизмами. Предполагается наличие специфических рецепторов к адреномедуллину. (Kitamura K. et al. Adrenomedullin, 1993)
Моноокись углерода образуется из гема под действием двух изоформ гемоксигеназ (НО-1 и НО2). Образуется СО в различных регионах, но преимущественно - в эндотелии сосудов мозга (Faraci F.M., Heistad D.D., 1998), где участвуют в регуляции кровотока, непосредственно вызывая расслабление мозговых сосудов. (Черток В. М., Коцюба А. Е., 2012)
Калликреин-кининовая система. Вазодилатирующий эффект кининов связан с активацией В2 рецепторов на эндотелии и образованием основных эндотелиальных вазодилатирующих факторов - NO, простациклина, EDHF.
Вазоконстрикторные факторы, продуцируемые эндотелием
Эндотелиальные факторы вызывают сужение сосудов, что связано с отсутствием высвобождения факторов релаксации и с продукцией констриктивных агентов. К вазоконстрикторам, синтезирующимся в эндотелиальных клетках относят эндотелины, тромбоксан А2, 20-HETE (20-гидрооксиэйкозотетраеновая кислота), ангиотензин II.
Эндотелины - наиболее мощные вазоактивные вещества. Самый изученный представитель данной группы - эндотелин-1. В физиологических концентрациях он действует на эндотелиальные рецепторы, вызывая высвобождение факторов релаксации, а в более высоких - активируют рецепторы на гладкомышечных клетках, стимулируя стойкую вазоконстрикцию и пролиферацию медии. (Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А., 2016)
Тромбоксан А2 преимущественно синтезируется в тромбоцитах, но некоторое его количество образуется в эндотелии. Специфические рецепторы к нему расположены на гладкомышечных клетках сосудистой стенки. Сокращение гладкомышечных клеток при стимуляции тромбоксаном связано со снижением активности аденилатциклазы и повышением содержания внутриклеточного кальция. (Дзгоева Ф. У., Кутырина И. М., 2000)
Ангиотензин ||, образуется в результате активации ренин-ангиотензиновой системы и является одним из наиболее сильных вазоконстрикторов. Активация данной системы может происходить как на системном уровне при выделении ренина клетками юкстагломерулярного комплекса почек, так и локально, на уровне эндотелия, в котором образуется ренин и ангиотензин-превращающий фермент. (Бабак О. Я., Кравченко Н. А. 2005)
Вазоконстрикторную функцию выполняет 20-гидроксиэйкозотетраеновая кислота (20-НЕТЕ) - продукт обмена арахидоновой кислоты по монооксигеназному пути. 20-НЕТЕ, действуя на гладкомышечные клетки сосудов, вызывает деполяризацию клеточных мембран. Его образование увеличивается под действием ангиотензина 2 и эндотелина-1, а также при гипероксии и является одним из ведущих факторов высокого артериального давления. Увеличение его образовния сопровождается включением тормозных регуляторных механизмов активацией синтеза простациклина, т.е. сохраняется принцип антагонистической регуляции.
Роль эндотелия в регуляции коагуляционного потенциала крови
Одной из важных функций эндотелия является обеспечение тромборезистентности сосудистой стенки, а с другой стороны ее тромбогенности. К числу тромбогенных факторов, стимулирующих процессы адгезии и агрегации тромбоцитов относится vWF (фактор Виллебранда), PAF (фактор активации тромбоцитов), АДФ, тромбоксан А2 Адгезия тромбоцитов к эндотелию - это начальный этап процессов гемостаза и тромбоза, что приводит к формированию тромбоцитарного тромба, активации плазменных прокоагулянтов с последующим образованием тромбина. К ингибиторам синтеза тромбина относятся: тромбомодулин, протеогликаны, предотвращающие избыточное фибринообразование. Тромборегуляторы оказывают влияние не только на гемостаз, но и проницаемость сосудов, вазомоторные реакции, ангиогенез, клеточную пролиферацию. (Петрищев Н.Н., Власов Т.Д. 2003)
Как указывалось выше, при гипоксии и действии медиаторов, увеличивающих синтез NO, в эндотелиальных клетках, медии и адвентиции синтезируется простациклин. Простациклин активирует аденилатциклазу, следствием чего является увеличение содержания цАМФ, который, помимо выполнения вазодилатирующей функции, препятствует активации тромбоцитов и вызывает релаксацию сосудов. Нарушение синтеза простациклина или снижение его поступления в кровь создает тромбогенную опасность. NO подавляет адгезию и агрегацию тромбоцитов. Этот процесс ассоцирован с увеличением содержания в тромбоцитах цГМФ.
Тромбогенный риск повышается по мере снижения содержания в плазме крови активных антитромбинов, в первую очередь АТ III, при одновременном наличии предрасполагающих факторов — гиперлипидемии, ожирения, диабета, сердечной недостаточности. (Suck G., Traut W. 2000)
Эндотелий играет важную роль в развитии фибринолиза за счет секреции тканевого и урокиназного активаторов плазминогена и его ингибиторов, которые могут или быстро нейтрализовать плазмин, или препятствуют активации плазминогена. Под влиянием гемодинамических факторов, пристеночного напряжения сдвига, трансмурального давления и ряда других факторов возникает динамическое изменение синтеза и секреции тромбогенных и атромбогенных субстанций эндотелия. В физиологических условиях выделение атромбогенных субстанций преобладает над тромбогенными. (Петрищев Н.Н., Власов Т.Д. 2003)
Физиологический антикоагулянтный комплекс - это система протеина С (Pr C), в которую входит тромбомодулин, протеин С, протеин S, тромбин (активатор Pr C) и ингибитор Pr C. Функцией данной системы является ингибирование факторов свертывания крови Va и VIIIa, инактивация ингибитора тканевого активатора плазминогена. (Айламазян Э. К., Мозговая Е. В. 2008)
В регуляции гемостатической функции эндотелия большое значение имеют гормоны вазопрессин, эстрогены, цитокины: интерлейкин-1, TNF- α, гемодинамические факторы. К факторам эндотелиального происхождения, ингибирующим адгезию и агрегацию тромбоцитов, относят простациклины, простагландины Е2, NO.
Значение эндотелия в регуляции адгезии лейкоцитов
Исключительно важную роль играет эндотелий в развитии адгезии лейкоцитов. К адгезивным молекулам эндотелия относятся Р-селектин, GMP-140, ELAM-1, ICAM. Повышение адгезивности эндотелия имеет большое значение в патогенезе воспалительных процессов, атеросклерозе, септическом шоке. Однако до настоящего момента остается не изученным значение нарушения адгезивных свойств сосудистой стенки в патогенезе неоплазий различной локализации и развитии метастазирования малигнизированных клеток.
Значение эндотелиальных клеток в процессе ангиогенеза
Эндотелию принадлежит значительная роль в процессе ангиогенеза в условиях патологии. В стабильном состоянии эндотелиоциты пролиферируют лишь раз в 10 лет. Под действием ангиогенных факторов происходит пролиферация эндотелиоцитов, которая заканчивается их дифференцировкой и реэндотелизацией сосудов. Эндотелий активно участвует в процессе кооперации между эндотелиоцитами и окружающими клетками, выделяя факторы роста (VEGF, FGF-2), вызывая таксис и пролиферацию гладкомышечных клеток и фибробластов.
Эндотелиальная дисфункция является одним из универсальных патогенетических факторов развития таких форм патологии как атеросклероз, гипертоническая болезнь, сахарный диабет, тромбогеморрагический синдром и канцерогенез. Причинами эндотелиальной дисфункции могут быть ишемия, гипоксия тканей, свободно-радикальное повреждение, цитокины и ряд других факторов.
Заключение
В патогенезе заболеваний различного генеза большое значение имеют нарушения функциональной активности сосудистой стенки, являющейся, по существу, эндокринным органом, регулирующим состояние сосудистого тонуса, коагуляционного и тромбоцитарного-сосудистого звеньев системы гемостаза, фибринолиз, адгезивно-агрегационные способности эндотелия, процессы ангиогенеза, экспрессирующие белки МНС I и II классов, участвующих в ряде случаев в представлении антигенов-аллергенов, а также продуцирующим различные цитокины локального и системного действия. В патогенезе заболеваний различной этиологии важная роль относится эндотелиальной дисфункции, в связи с этим абсолютно необходимо знание многочисленных функций сосудистой стенки в условиях нормы и маркеров эндотелиальной дисфункции, свидетельствующих о развитии патологии.
Литература
1. Петрищев Н.Н., Власов Т.Д. Физиология и патофизиология эндотелия/Дисфункция эндотелия. Под ред. Н.Н. Петрищева. СПбГМУ 2003: стр. 4—38.
2. Киричук В. Ф., Ребров А. П., Россошанская С. И. Тромбоз. Гемостаз. Реология./Функции эндотелия сосудистой стенки 2005 №2: стр. 23
3. Каде А.Х., Занин С.А., Губарева Е.А., Туровая А.Ю., Богданова Ю.А., Апсалямова С.О., Мерзлякова С.Н. Физиологические функции сосудистого эндотелия // Фундаментальные исследования. – 2011. – № 11-3. – С. 611-617;
4. Барсуков В.Ю., Чеснокова Н.П., Агабеков А.И., Бизенкова М.Н. Показатели эндотелиальной дисфункции и состояния коагуляционного потенциала крови как объективные критерии инициации и малигнизации клеток при раке толстой кишки // Современные проблемы науки и образования. – 2015. – № 6.;
5. Агеев, Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечно-сосудистых заболеваний / Ф.Т. Агеев // ЖСН. 2004.-Т. 4, № 1.-С. 21-22.
6. Чурюканов М. В., Чурюканов В. В. Функциональная организация и терапевтический потенциал эндогенной каннабиноидной системы //Экспериментальная и клиническая фармакология. – 2004. – Т. 67. – №. 2. – С. 70-78.
7. Воскобой И. В., Семенов А. В., Мазуров А. В. и др. Активность тромбоцитов и функциональное состояние эндотелия у больных с нестабильной стенокардией с благоприятным и неблагоприятным исходом (проспективное исследование) / // Кардиология. — 2002. — № 9. — С. 4-11
8. Бокерия, Л.А. Современное общество и сердечно-сосудистая хирургия / Л.А. Боке-рия // Тез. докл. V Всерос. съезда сердечно-сосудистых хирургов. М., 1999. - С.З-6.
9. Дзгоева Ф. У., Кутырина И. М. Тромбоксан А2 и простациклин у больных хроническим гломерулонефритом и ишемической болезнью сердца в условиях нефротоксического действия рентгеноконтрастных средств //Протективное действие антагонистов кальция. Тер. арх. – 2000. – Т. 6. – С. 42-45.
10. Айламазян Э. К., Мозговая Е. В. Гестоз: теория и практика //М.: МЕДпресс-информ. – 2008. – Т. 272.
11. Черток В. М., Коцюба А. Е. Эндотелиальный (интимальный) механизм регуляции мозговой гемодинамики: трансформация взглядов //Тихоокеанский медицинский журнал. – 2012. – №. 2 (48).
12. Бабак О. Я., Кравченко Н. А. Роль ренин-ангиотензиновой системы в ремоделировании сердца и сосудов //Укр. терапевт. журн. – 2005. – №. 2. – С. 89-96.
13. Дремина Н. Н., Шурыгин М. Г., Шурыгина И. А. Эндотелины в норме и патологии //Международный журнал прикладных и фундаментальных исследований. – 2016. – №. 10-2. – С. 210-214.
14. Kitamura K. et al. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma //Biochemical and biophysical research communications. – 1993. – Т. 192. – №. 2. – С. 553-560
15. Suck G., Traut W. TROMB, a new retrotransposon of the gypsy–Ty3 group from the fly Megaselia scalaris //Gene. – 2000. – Т. 255. – №. 1. – С. 51-57.
16. Baylis C., Vallance P. Measurement of nitrite and nitrate levels in plasma and urine—what does this measure tell us about the activity of the endogenous nitric oxide system? Curr Opin Nephrol Hypertens 1998 Jan;7(l):59-62.
17. Moncada S., Vane J,R. Pharmacology and endogenous roles of prostaglandin endoperoxides, thromboxane A2 and prostacyclin. Pharmacol Rev 1979;30:293-331
18. Faraci F. M., Heistad D. D. Regulation of the cerebral circulation: role of endothelium and potassium channels //Physiological reviews. – 1998. – Т. 78. – №. 1. – С. 53-97.
Клетки сосудистого эндотелия синтезируют и выделяют через апикальную и базальную мембраны три группы гормонов: сосудосуживающие (эндотелины, тромбоксаны), сосудорасширяющие (оксид азота, гиперполяризующий фактор, простагландины) и факторы адгезии и агрегации клеточных элементов.
Эндотелины (ЭТ) являются крупными полипептидами (21 аминокислота), образуются путем частичного гидролиза молекулы предшественника или «большого эндотелина», состоящей из 38 аминокислот, под влиянием связанного с мембраной клетки и находящегося в цитоплазматических везикулах эндотелинпревращающего фермента. Этот фермент локализован в эндотелии сосудов легких, сердца, почек, плаценты, поджелудолчной железы, надпочечников, головного мозга и даже в сосудистых гладких мышцах. Наличие двух форм эндотелинпревращающего фермента (мембрано-связанной и внутриклеточной) определяет и два места образования эндоте-линов — в цитоплазме и на поверхности клеточной мембраны. Эндотелин-превращающий фермент ведет не только к образованию молекул эндотелина, но способен вызывать гидролиз и инактивацию на поверхности эн-дотелиоцитов ряда регуляторных пептидов и гормонов (инсулина, бради-кинина, нейротензина и др.). Активация эндотелинпревращающего фермента происходит под влиянием цитокинов.
Эффекты эндотелинов обусловлены их взаимодействием со специфическими мембранными рецепторами двух типов — ЭТ-А и ЭТ-В. Следствием специфического связывания эндотелина с рецептором является активация систем вторичных посредников (фосфолипаза С, ИФЗ, диацилглицерол, цГМФ и цАМФ, фосфолипазы D и А2). Различают прямые и опосредованные сосудистые эффекты эндотелинов. Прямые эффекты заключаются в действии на гладкие мышцы сосудов. Связывание эндотелина с рецепторами гладких мышц сосудов вызывает их сокращение и вазоконстрикцию (через образование ИФЗ и повышение внутриклеточного Са2+), а также стимуляцию митогенеза и пролиферации клеток (через активацию тирозинкиназы и фосфорилирование тирозина). Взаимодействие эндотелинов с рецепторами клеток эндотелия вызывает реализацию опосредованных эффектов, в виде высвобождения из эндотелия вазоактивных факторов, приводящих к расширению сосудов (N0, гиперполяризующий фактор, простагландины). Кроме сосудистых эффектов эндотелины изменяют секрецию гормонов гипофиза и надпочечников, стимулируют секрецию атрио-пептида миокардом, угнетают эффекты вазопрессина в почках, способствуя диурезу и натрийурезу, увеличивают реакции сердца на симпатические стимулы.
Среди сосудорасширяющих гормонов эндотелия основное место по выраженности и распространенности эффекта занимает оксид азота (N0), постоянно образующийся из L-аргинина под влиянием фермента NO-син-тетазы. Одним из стимулов, активирующих фермент и образование оксида азота, является механическое растяжение стенки сосудов. Активация фермента и синтез оксида азота происходят при действии на мембранные рецепторы эндотелиоцитов ацетилхолина, адреномедуллина, гистамина, брадикинина, АТФ, а также в результате повышения в клетке эндотелия концентрации ионизированного Са2+. NO-синтетаза помимо образования оксида азота стимулирует синтез некоторых цитокинов: интерлейкина — 1(3, альфа-интерферона, тогда как другие цитокины: ИЛ-4, ИЛ-8, ИЛ-10, напротив, подавляют активацию фермента.
Вазодилатирующий эффект N0 опосредуется активацией образования в гладкомышечных клетках цГМФ. Оксид азота также подавляет вазоконстрикторное действие ангиотензина-II. Синтезированный клетками эндотелия оксид азота выделяется не только через базальную мембрану в сторону гладкомышечных клеток кровеносных сосудов, но и через апикальную мембрану, где тормозит адгезию тромбоцитов и лейкоцитов крови к эндо-телиальной выстилке стенки сосуда. Антиагрегантное действие оксида азота отчасти опосредовано простациклином, образующимся в эндотелии.
В нервной системе N0 является модулятором синаптической передачи, так как выявлено его поступление в синаптическую щель и показано инги-бирующее влияние на выделение медиаторных аминокислот.
Эндотелиалъный гиперполяризующий фактор также вызывает дилатацию артериальных и венозных сосудов, но отличается от N0 механизмом действия — способностью активировать ионные каналы (К+,Сl) и снижать возбудимость эндотелиальных клеток.
К числу факторов регуляции адгезии и агрегации клеток относятся многочисленные интегрины и селектины, образуемые клетками эндотелия.
6.7.2. Гормоны эндотелия
Эндотелиальные клетки сосудов также выделяют ряд гормонов через базальную и апикальную мембраны. Среди них тромб океаны, обладающие локальным вазомоторным эффектом, лейкотриены и простагландины. Имеются и другие гормоны, локально регулирующие тонус и просвет сосудов, их проницаемость, слипание и активность иммунокомпетентных клеток, мигрирующих через стенки сосудов. В последнее время привлекли внимание эндотелины, оксид азота, супероксид кислорода и Н2O2. Эти вещества секретируются также в некоторых эндокринных железах и, как медиаторы, нейронами разных отделов нервной системы. Как и производные ненасыщенных жирных кислот, они обладают вазомоторными эффектами. Кроме того, многие из этих гормонов являются источником кислорода, что особенно важно при гипоксии. Последнее подтверждается усиленной секрецией NO, супероксида и гидроперекиси не только при гипоксии, но и при действии других стрессорных факторов. Последующий локальный ацидоз приводит к вазодилатации, синтезу адгезивных белков эндотелия и клеток крови, трансэпителиальной миграции иммунокомпетентных клеток. Кроме того, внутриклеточный ацидоз способствует эндоцитозу и адгезии к клеткам эндотелия метастазирующих клеток.
Эндотелины. Эти гормоны были впервые выделены из эндотелия в 1988 г. Молекула эндотелина представляет собой пептид из 22 аминокислот. Активность эндотелинов во всех тканях-мишенях определяет их кольцевая структура и гидрофобные аминокислоты в С-терминали. Изоформы гормона ЕТ-1, ЕТ-2 и ЕТ-3 различаются по нескольким аминокислотам в кольцевой структуре, тогда как состав С-конца молекулы постоянен. Транскрипция и трансляция про-ЕТ-1 в клетках эндотелия активируются тромбином и вазопрессином.
Клетки эндотелия - не единственный источник эндотелинов. Максимальные концентрации ЕТ-1 определяются в тканях легких и гипофизе, а ЕТ-3 в адено- и нейрогипофизе. Известны два типа рецепторов эндотелинов: ETRA и ETRB, имеющих перекрестную аффинность к ЕТ-1, -2, -3. В гладкомышечных клетках сосудов локализованы оба типа рецепторов, тогда как в эндотелии, главным образом, ETRB. Кроме того, эти рецепторы найдены в клетках легких, сердца, мозга, почках и надпочечниках. Вазомоторные эффекты ЕТ-1 могут иметь разную направленность. Прямое действие гормона через ETRA на гладкомышечные клетки сосудов вызывает Са2+-зависимую вазоконстрикцию.
Запуск опосредованной вазодилатации осуществляется при связывании с ETRB клеток эндотелия: гормон вызывает увеличение синтеза NO и простагландина. Последние, выделяясь из эндотелия, вызывают расслабление гладкомышечных клеток. Вазомоторные эффекты ЕТ-1 дополняются пролиферацией эндотелия и фибробластов, снижением агрегации тромбоцитов, увеличением в сердце секреции АНП, активацией симпатической нервной системы, что обусловило ино- и хронотропные влияния гормона на сердце. В почках ЕТ-1 подавляет вызванный вазопрессином антидиурез, усиливает диурез и натрийурез и снижает секрецию ренина.
Как медиаторы нервной системы эндотелины являются одним из наиболее значимых факторов регуляции мозгового кровотока, перераспределяя его между структурами с разной степенью активности. Этим определяется их участие в некоторых формах поведения и гормонопоэзе в гипофизе, где эндотелины изменяют секрецию вазопрессина, окситоцина, пролактина, гонадотропинов.
Оксид азота (NO). Это соединение является широко распространенным гормоном и медиатором в эндотелии, гладких мышцах сосудов, макрофагах и нейтрофилах. Оно образуется под влиянием энзима NO-синтеазы (NOS). Активация NOS в сосудах и клетках крови происходит Са2+-зависимо под влиянием растяжения стенки сосуда и при гипертензии может вызвать синтез NO. Механизмы опосредования действия перечисленных факторов на увеличение Са2+ в клетке позволяют предполагать участие в активации NOS-зависимого синтеза NO механочувствительных Са2+-каналов или фосфоинозитольной системы трансдукции гормонального сигнала.
Оксид азота обладает выраженным вазодилататорным эффектом, обусловленным снижением рН. Как нейротрансмиттер NO вызывает "неадренергическое, нехолинергическое" торможение в метасимпатической нервной системе и ЦНС, а также длительную синаптическую депрессию в мозжечке. Известно, что в ЦНС возбуждающие аминокислоты, например, глутамат, активируют выделение NO из пресинаптической терминали и, таким образом, включают звено отрицательной обратной связи, поскольку NO подавляет их секрецию.
NO может выполнять функцию внутриклеточного посредника. Так, в нейронах NO блокирует действие цитохром-С-оксидазы - терминального энзима в митохондриальной дыхательной цепи. Это может быть одной из причин нейродегенеративных изменений, характерных для эффектов NO. Вазодилатация и снижение рН под влиянием оксида азота, супероксида кислорода и гидроперекиси облегчает синтез адгезивных белков, адгезию и трансэпителиальную миграцию лейкоцитов.
Ангиогенины. Эндотелий секретирует также и ряд факторов роста, для которых одной из характерных функций является ангиогенез. К ним относятся васкулотропин, монобутирин, тромбоспондин. В разной степени эти факторы участвуют в пролиферации эндотелия, образовании трубки сосуда, синтезе коллагенов, фибронектина, интегринов и других адгезивных белков, определяющих межклеточные контакты в эндотелии, образование базальной мембраны и адгезию (прилипание) к ней эндотелия. По-видимому, комплексы ангиогенинов могут быть органоспецифичны и зависеть от типа сосуда и его диаметра.
Гормоны эндотелия, обладающие реципрокным эффектом на гладкие мышцы сосудов, последовательно и взаимосвязанно активируют синтез гормонов другой группы или их рецепторы. Клетки эндотелия секретируют ряд хемотаксических факторов, что обеспечивает адгезию, а также миграцию иммунокомпетентных клеток из сосуда в ткань. Сходство комплексов цитокинов и арахидонатов, секретируемых клетками эндотелия и крови, обеспечивает функциональное взаимодействие всех компонентов сосудистой системы и системы крови в регуляции гемостаза и фибринолиза, рН плазмы, объема локального кровотока, проницаемости капилляров и других параметров.
Читайте также:
