Лечение интраоперационного разрыва аневризмы головного мозга. Исходы
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
1 «Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова» - филиал ФГБУ «СЗФМИЦ им. В.А. Алмазова» Минздрава РФ
Лечение церебральных аневризм является важной и до конца не решенной медико-социальной проблемой, так как они становятся одной из основных причин нетравматического субарахноидального кровоизлияния, что ведет к инвалидизации или гибели лиц преимущественно трудоспособного возраста. Чаще других носителем церебральных аневризм оказывается средняя мозговая артерия. На сегодняшний день существует два основных метода лечения аневризм: микрохирургическое клипирование и внутрисосудистая эмболизация с применением микроспиралей. Правильный выбор метода вмешательства позволяет повысить эффективность лечения пациентов с данной патологией. Целью настоящего исследования явилось повышение эффективности лечения пациентов с аневризмами средней мозговой артерии. Применение наиболее подходящего метода оперативного вмешательства в каждом конкретном случае повышает эффективность лечения больных с аневризмами средней мозговой артерии.
1. Забродская Ю.М. Патологоанатомическая характеристика изменений в сочленениях артерий основания головного мозга (к проблеме происхождения аневризм) : автореф. дис. … канд. мед. наук. 14.00.15. – СПб., 1996.
2. Медведев Ю.А., Забродская Ю.М. Новая концепция происхождения бифуркационных аневризм артерий основания головного мозга. – СПб. : Изд. РНХИ им. проф. А.Л. Поленова, 2000.
4. Chyatte D., Porterfield R. Nuances of middle cerebral artery aneurysm microsurgery // Neurosurgery. – 2001. - Feb; 48 (2):339-46.
5. van Dijk J.M. Surgical clipping as the preferred treatment for aneurysms of the middle cerebral artery / van Dijk J.M., Groen R.J., Ter Laan M., Jeltema J.R., Mooij J.J., Metzemaekers J.D. // Acta Neurochir (Wien). – 2011. - Nov; 153 (11):2111-7.
6. Heros R.C., Fritsch M.J. Surgical management of middle cerebral artery aneurysms // Neurosurgery. – 2001. - Apr; 48 (4):780-5.
7. Jayaraman M.V. Morphologic assessment of middle cerebral artery aneurysms for endovascular treatment / Jayaraman M.V., Do H.M., Versnick E.J., Steinberg G.K., Marks M.P. // J Stroke Cerebrovasc Dis. – 2007. - Mar-Apr; 16 (2):52-6.
8. Johnson A.K. Stent-assisted embolization of 100 middle cerebral artery aneurysms / Johnson A.K., Heiferman D.M., Lopes D.K. // J Neurosurg. – 2013. - May; 118 (5):950-5.
9. Kim B.M. Coil embolization of unruptured middle cerebral artery aneurysms / Kim B.M., Kim D.I., Park S.I., Kim D.J., Suh S.H., Won Y.S. // Neurosurgery. – 2011. - Feb; 68 (2):346-53.
10. Kim B.M. Endovascular coil embolization of aneurysms with a branch incorporated into the sac / Kim B.M., Park S.I., Kim D.J., Kim D.I., Suh S.H., Kwon T.H., Choi H.S., Won Y.S. // AJNR Am J Neuroradiol. – 2010. - Jan; 31 (1):145-51.
11. Lad S.P. Long-term economic impact of coiling vs clipping for unruptured intracranial aneurysms / Lad S.P., Babu R., Rhee M.S., Franklin R.L., Ugiliweneza B., Hodes J., Nimjee S.M., Zomorodi A.R., Smith T.P., Friedman A.H., Patil C.G., Boakye M. // Neurosurgery. – 2013. - Jun; 72 (6):1000-11.
12. Morgan M.K. Outcome for middle cerebral artery aneurysm surgery / Morgan M.K., Mahattanakul W., Davidson A., Reid J. // Neurosurgery. – 2010. - Sep; 67 (3):755-61.
13. Rinne J. Analysis of 561 patients with 690 middle cerebral artery aneurysms: anatomic and clinical features as correlated to management outcome / Rinne J., Hernesniemi J., Niskanem M. & Vapalaliti M. // Neurosurgery. - 1996. - 38: 2-11
14. Rodríguez-Hernández A. Current management of middle cerebral artery aneurysms: surgical results with a "clip first" policy. / Rodríguez-Hernández A., Sughrue M.E., Akhavan S., Habdank-Kolaczkowski J., Lawton M.T. // Neurosurgery. – 2013. - Mar; 72 (3):415-27.
15. Suzuki S. Endovascular treatment of middle cerebral artery aneurysms with detachable coils: angiographic and clinical outcomes in 115 consecutive patients / Suzuki S., Tateshima S., Jahan R., Duckwiler G.R., Murayama Y., Gonzalez N.R., Viñuela F. // Neurosurgery. – 2009. - May; 64 (5):876-88.
Важную роль в формировании аневризм играет гемодинамический удар, возникающий при повышении артериального давления [2]. Согласно данным Забродской Ю.М. (1996), большую значимость в патогенезе аневризматической болезни приобретают микроскопические изменения сосудистой стенки – происходит гибель гладкомышечных элементов в области развилки сосуда, а затем фиброз средней оболочки сосуда, при этом изменения располагаются не только в области самой развилки, но также распространяются на устья исходящих из бифуркации сосудов [1], что позволяет объяснить преимущественное расположение аневризм (80-90%) в области развилки основного ствола СМА, а также нередко встречающиеся т.н. фузиформноподобные аневризмы данной локализации, т.е. аневризмы с вовлечением артериальных ветвей в шейку и пришеечную область [6].
У больных с аневризмами СМА более отчётлива зависимость от наследственного фактора, поэтому у их родственников следует ожидать более высокий риск кровоизлияния.
В настоящий момент в лечении больных с аневризмами церебральных сосудов применяют два основных метода: микрохирургический, то есть выделение и наложение металлического клипса на шейку аневризмы, и эндоваскулярный – пункция бедренной артерии, катетеризация аневризмы и внутрисосудистое выключение аневризмы из кровотока. Давно ведется спор между приверженцами обоих методов. Сторонники клипирования указывают на большую радикальность выключения аневризмы из кровотока и возможность выполнения реконструктивного клипирования при сложной геометрии аневризматического мешка; приверженцы эндоваскулярного метода указывают на малую инвазивность процедуры, возможность окклюзии аневризмы у больных, находящихся в тяжелом состоянии (H&H IV –V) и другие факторы.
Аневризмы СМА традиционно считаются более подходящими для открытой операции вследствие анатомических особенностей (сравнительно поверхностная топография СМА, благоприятная для внутричерепного доступа, отсутствие выраженных коллатералей, повышающее эффективность временного клипирования), а также частой неблагоприятной геометрии аневризм данной локализации: широкая шейка, вовлечение в состав мешка аневризмы одного или более М2 сегментов. Эти обстоятельства препятствуют тотальной эмболизации и обусловливают высокий риск ишемических осложнений [7]. По мнению Rodriguez-Hernandez A. (2013), J.M.C. Van Dijk (2011) и многих др. исследователей, микрохирургическое вмешательство продолжает оставаться операцией выбора и на современном этапе [5; 14].
Следует отметить, что некоторая неудовлетворённость в достижении радикальной внутрисосудистой окклюзии аневризм СМА имела место на этапе развития и отработки методики эмболизации спиралями. C 2003 года стали доступны интракраниальные саморасширяющиеся стенты, которые открывали новые возможности для более эффективного и безопасного лечения «сложных» церебральных аневризм, однако предпочтение отдавалось другим локализациям. Напротив, в последних публикациях возрастает интерес к использованию стент-ассистенции в лечении аневризм СМА. Согласно данным разных авторов применение стентов позволяет добиться радикальности, сопоставимой с микрохирургическим клипированием, при этом укорачивается послеоперационный период и уменьшаются сроки пребывания пациента в стационаре [11]. Стент-ассистенция все чаще применяется в геморрагическом периоде (JohnsonA.K. et al., 2013), однако данная методика имеет ряд ограничений в связи с необходимостью применения двойной дезагрегантной терапии, которая повышает риск развития осложнений [8].
Таким образом, представленные литературные данные указывают, что в повышении эффективности лечения АСМА стоят задачи, общие для всех аневризм, однако на их решение существенно влияет и данная локализация. Относительно поверхностное расположение СМА, слабый коллатеральный кровоток, всё же не устраняют недостатки открытого оперативного вмешательства. «Фузиформноподобный» характер и другие морфологические особенности затрудняют радикальную эмболизацию АСМА, однако использование наиболее современного внутрисосудистого инструментария, ассистирующих методик могло бы повысить радикальность малоинвазивной внутрисосудистой операции и способствовать лучшему функциональному результату.
Материал и методы. В настоящее исследование были включены 163 больных с 210 аневризмами, из них 174 аневризмы средней мозговой артерии, оперированных в ФГБУ «Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова» с января 2010 по март 2014 г. включительно. Средний возраст больных составил 48,8±0,9 года, соотношение мужчин и женщин – 1:2. Заболевание проявило себя кровоизлиянием у 90 (55,2%) пациентов, другими неврологическими симптомами – у 24 (14,8%). С множественными аневризмами было 38 (23,3%) пациентов. Из них у 31 выявлено 2 аневризмы, у 5 - 3; 4 аневризмы встретились в 2 случаях. У 8 пациентов аневризмы располагались на СМА с одной стороны, зеркальные аневризмы СМА были у 3 пациентов, сочетание аневризмы СМА с аневризмой другой локализации у 27 пациентов.
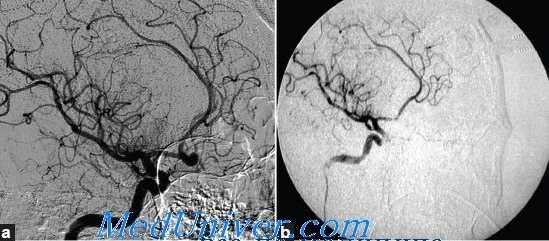
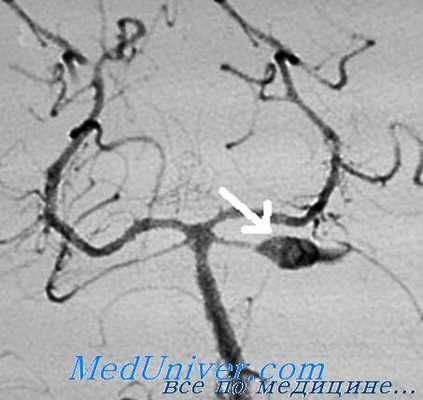
На основании дооперационной ангиографической картины, анализа геометрии аневризм мы разделили их на мешотчатые, фузиформные (веретенообразные) и «фузиформноподобные» аневризмы (рис. 1).

Рис. 1. Виды аневризм: А — мешотчатая, Б — фузиформная, В — фузиформноподобная
К фузиформноподобным мы отнесли те случаи, когда ветви СМА были вовлечены в структуру шейки или отходили непосредственно от мешка аневризмы, что снижало радикальность операции и повышало риски развития как интра-, так и послеоперационных осложнений (рис. 2).
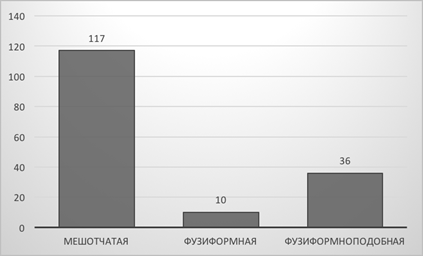
Рис. 2. Распределение аневризм по типу строения
В геморрагическом периоде оперировано 11 (6,7%) больных, в постгеморрагическом – 152 (93,3%). Поздние операции были обусловлены, вероятно, несвоевременным направлением больных в клинику института.
Для проведения сравнительного анализа все пациенты были разделены на две группы: в первую группу вошли пациенты, перенесшие микрохирургическое вмешательство – 71 пациент, во вторую – эндоваскулярное – 92 пациента. Эмболизация аневризм осуществлялась при помощи отделяемых микроспиралей, а в ряде случаев с помощью ассистирующих и потокперенаправляющих стентов. По степени радикальности выделяли тотально-субтотальную эмболизацию – 95-100%, частичную -
Семидесяти одному больному была выполнена 71 микрохирургическая операция: клипирование аневризмы проведено 58 больным; укрепление стенки аневризмы (окутывание фрагментом мышцы) – 4; клипирование, дополненное окутыванием аневризмы мышцей, выполнено 9 пациентам. Хороший результат (OGS 5–4) был достигнут у 81,7% больных. Неудовлетворительный и плохой результат (OGS 1-2) отмечен у 2,8% (рис. 3).
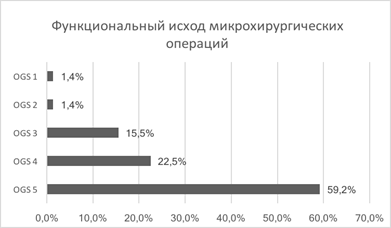
Рис. 3. Функциональный исход микрохирургических операций
При сравнении результатов хирургического лечения в зависимости от типа строения аневризмы было выявлено ухудшение результатов лечения после операций на фузиформных аневризмах. Частота благоприятных исходов (OGS IV-V) при фузиформном строении аневризмы была ниже (66,7%), чем при аневризмах других типов (80-84%). Различие достоверно (p<0,001).
Как и при анализе общих результатов лечения, в оценке эффективности только открытых оперативных вмешательств существенное значение придавали не только клинико-неврологическому исходу, но и определению степени радикальности выключения аневризмы из кровообращения.
Тотального выключения из кровообращения (> 90%) микро-, небольших и больших аневризм достигали чаще, чем гигантских (р=0,02), тогда как попытка клипирования или окутывание аневризмы мышцей (радикальность=0) встречалась чаще при гигантском размере аневризмы. Достоверной зависимости степени радикальности от возраста больного, типа строения аневризмы выявлено не было.
Интраоперационные геморрагические осложнения имели место у 2 (2,8%) больных. Осложнения протекали бессимптомно, неврологическая симптоматика в послеоперационном периоде не наросла, оба больных выписаны с хорошим (OGS V) результатом. Ишемических осложнений отмечено не было. Ретракционная травма была заподозрена, по данным КТ, у 10 (14%) больных. Убедительных неврологических проявлений ретракционной травмы в наших наблюдениях отмечено не было. Послеоперационные эпи- и субдуральные гематомы были выявлены у 2 (2,8%) больных в результате контрольного КТ-исследования. Оба больных были реоперированы, в одном случае пациент умер (OGS I), во втором в последующем произошел частичный регресс неврологической симптоматики (OGS III). Послеоперационные менингиты выявлены у 2 (3%) больных. Послеоперационная летальность в группе составила 1,4%.
Внутрисосудистым методом были оперированы 92 пациента, которым было выполнено 96 внутрисосудистых операций. Хороший исход лечения (OGS 5–4) к моменту выписки имели 79,3% больных. Удовлетворительный (OGS 3) результат лечения был достигнут у 11% больных. Неудовлетворительный результат (OGS1–2) отмечен у 9,7% больных с летальностью 5,4% (рис. 4).
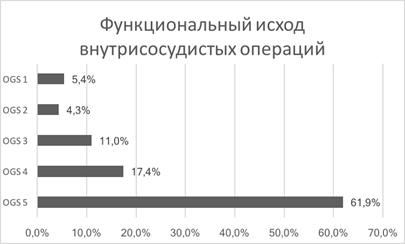
Рис. 4. Функциональный исход внутрисосудистых операций
Нами была выявлена определённая зависимость между функциональным исходом лечения и типом строения мешка аневризм. Неудовлетворительный функциональный исход встречался достоверно чаще после операций на аневризмах с фузиформноподобным типом строения - частота неблагоприятных исходов (OGS I-II) (21%) была выше, чем при операциях на мешотчатых и фузиформных аневризмах (p<0,01). Частота благоприятных исходов (OGS IV-V) была выше у больных с мешотчатыми и фузиформными аневризмами (86,3% и 100% соответственно), чем у больных с фузиформноподобными аневризмами (63,5%). Различие статистически достоверно (p<0,05).
При анализе параметра радикальности достоверной зависимости от типа строения аневризмы выявлено не было.
С использованием стент-ассистенции было прооперировано 16 человек. Радикальность лечения таких аневризм составила 100%, что превысило радикальность лечения без применения стент-ассистенции (84,2%), причем данное различие было достоверным (р<0,05).
Частота хороших и отличных функциональных исходов (OGS 4-5) в группе фузиформных и фузиформноподобных аневризм составила 100% и 63,6% соответственно.
Интраоперационные осложнения имели место у 10 (11%) больных. Ишемические осложнения отмечены у 6 больных (54,5%), геморрагические интраоперационные осложнения - у 4 пациентов (45,5%). К летальному исходу осложнения привели у 3 (21%) больных, к инвалидизации – у 2 (14%).
Среди ишемических интраоперационных осложнений наиболее часто наблюдали миграцию микроспирали из аневризмы в просвет сосуда (50%) и тромбоз несущего сосуда (33,3%). Среди геморрагических осложнений наиболее часто отмечен интраоперационный разрыв аневризмы, у 1 пациента наблюдалось повреждение сосудистой стенки микроинструментом с последующим развитием массивного базального САК. Послеоперационные осложнения отмечены у 14% больных. Повторные кровоизлияния в послеоперационном периоде возникли у 2 больных, при этом исходы были неудовлетворительны (OGS I). Нецеребральные осложнения наблюдали у 7,6% больных. Общая летальность составила 5,4%.
При сравнительном анализе исходов после хирургического вмешательства нами было установлено, что неудовлетворительные результаты лечения (OGS1-2) достоверно чаще встречались у больных, перенесших эндоваскулярную операцию, чем у больных после микрохирургического вмешательства (24% и 0% соответственно), при этом наиболее часто неудовлетворительные исходы (OGS 1-2) были отмечены у группы больных с наиболее сложными, фузиформноподобными аневризмами, а частота хороших и отличных результатов (OGS 4-5) для фузиформноподобных аневризм была выше после микрохирургического вмешательства (80%), чем после эндоваскулярной операции (63,2%).
При сравнении параметра радикальности окклюзии аневризмы в зависимости от типа строения было выявлено, что в отношении фузиформноподобных аневризм показатель радикальности >90% оказался сопоставим для групп микрохирургического и эндоваскулярного вмешательства (86,7% и 84,2% соответственно)
Отдаленные результаты отслеживались у больных в сроки 6-12 месяцев при помощи селективной церебральной ангиографии. Катамнез был отслежен у 69 пациентов (42,3%), из которых 27 пациентов перенесли микрохирургическое вмешательство, 42 - эндоваскулярное. Особое внимание уделялось реканализации и/или росту аневризмы. Так, из 27 пациентов, перенесших микрохирургическую операцию, у 25 (92,6%) реканализации и роста отмечено не было, в двух случаях (7,4%) был отмечен рост аневризмы. Среди пациентов, перенесших внутрисосудистую операцию, реканализация аневризмы была отмечена у 2 пациентов (4,8%), тогда как дальнейший рост аневризмы был выявлен у 5 пациентов (11,9%). Нами была выявлена зависимость частоты роста или реканализации аневризмы от типа строения аневризматического мешка. Так, наиболее часто реканализация и/или рост аневризмы отмечались у пациентов с т.н. фузиформноподобным типом строения аневризмы (55,5%).
Повторные операции по поводу роста и/или реканализации были выполнены 4 (5,9%) пациентам, из них повторная эмболизация микроспиралями была выполнена в 1 случае (25%), в трех случаях (75%) использована реконструкция области развилки СМА с помощью ассистирующих стентов с последующей тотальной эмболизацией заполняющейся части микроспиралями с хорошим функциональным исходом.
Применение стентов позволило нам значительно повысить радикальность лечения наиболее сложных аневризм (100%), при этом хороший функциональный исход в эндоваскулярной группе удалось получить у 79,3% пациентов, что было сопоставимо с исходами в микрохирургической группе и данными литературы [3].
1. Селективное применение внутрисосудистой и внутричерепной операции повышает эффективность лечения больных с аневризмами средней мозговой артерии; применение эндоваскулярных операций после ранее проведенного внутрисосудистого или микрохирургического вмешательства повышает радикальность, не ухудшая функциональный результат.
2. Микрохирургическая операция может выполняться на большинстве аневризм СМА, не ухудшая функциональный исход и имея высокую радикальность в отдаленном периоде.
3. Селективный отбор больных на эмболизацию или микрохирургическое клипирование полностью не предупреждает развитие интра- и послеоперационных осложнений, при этом повышая радикальность. При внутрисосудистых вмешательствах преобладают тромбозы и тромбоэмболические осложнения, при внутричерепных операциях – геморрагические и инфекционные осложнения.
4. Фузиформноподобное строение аневризмы, т.е. вовлечение артериальных ветвей в шейку аневризмы, препятствует радикальности, а также повышает риск интра- и постоперационных осложнений.
5. Применение стент-ассистенции позволяет повысить эффективность лечения у больных с фузиформноподобными аневризмами средней мозговой артерии.
Лечение интраоперационного разрыва аневризмы головного мозга. Исходы
Для остановки кровотечения при интраоперационном разрыве аневризме могут быть использованы прямые и непрямые методы гемостаза. К прямым методам гемостаза относят клипирование аневризмы, закрытие дефекта её стенки при помощи биполярной коагуляции и тампонирование дефекта кусочком марли или фрагментом мышцы, к непрямым методам — глубокую артериальную гипотензию, временное клипирование (ВК) несущего аневризму сосуда и метод внутрисосудистой баллон-окклюзии и аспирации крови.
Выбор метода гемостаза осуществляется в зависимости от времени возникновения кровотечения и его интенсивности. При возникновении внеконтактных интраоперационных разрывов аневризмы на ранних этапах операции можно прибегнуть к двум основным методам — сдавлению общей или внутренней сонной артерии на шее и к индуцированной артериальной гипотензии.
В последние годы в качестве ассистирующей методики нашел свое место метод эндовазальной окклюзии церебральных сосудов, при помощи которого в случае интраоперационных разрывов аневризмы удается контролировать кровотечение. Однако данный метод доступен только в клиниках, имеющих соответствующее оснащение.
При кровотечениях, возникающих на основных этапах операции и имеющих небольшую интенсивность, следует отдавать предпочтение прямым методам гемостаза. При невозможности остановить кровотечение прибегают к методам, снижающим локальное АД (в бассейне несущей аневризму артерии) — временное клипирование несущей артерии и внутрисосудистой баллон-окклюзии. При сильном кровотечении, остановить которое не удается перечисленными способами, средства гемостаза могут быть дополнены индуцированной артериальной гипотензией.
При распространении дефекта стенки аневризмы на стенку несущего её сосуда выполняют треппинг (наложение постоянного клипса на несущую аневризму артерию) или производят пластику образовавшегося дефекта стенки сосуда. Учитывая тяжелые ишемические осложнения треппинга, его выполняют при невозможности остановить кровотечение всеми перечисленными выше способами.
Исходы после интраоперационного разрыва аневризмы
Большинство исследований, и в том числе наше, свидетельствуют о том, что интраоперационный разрыв аневризмы приводит к ухудшению исходов операций и увеличению летальности в 1,5—3 раза. Наиболее частая причина смерти после интраоперационного разрыва аневризмы — ишемическое размягчение вещества головного мозга. В наших наблюдениях летальность у больных, перенесших интраоперационный разрыв аневризмы, возрастала по сравнению с контрольной группой в 2,4 раза - с 7,1 до 17,0%.
Исходы после операций с интраоперационным разрывом аневризмы зависят от того, на каком этапе возник разрыв аневризмы, и интенсивности кровотечения. Прогноз выживания больных после интраоперационного разрыва аневризмы на этапах выделения и клипирования аневризмы в целом благоприятный. Кровь из полости аневризмы попадает во вскрытое субарахноидальное пространство, кровотечение не приводит к формированию внутримозговой или внутрижелу-дочковой гематомы и повышению ВЧД.
Результаты операции преимущественно зависят от деликатности манипуляций хирурга и точности клипирования аневризмы (без стеноза несущей и компрессии перфорирующих артерий). Напротив, прогноз выживания больных неблагоприятный при интраоперационном разрыве аневризмы, происходящих на начальных этапах операции — во время вводного наркоза, и краниотомии, когда кровотечение приводит к быстрому — в течение первых минут — увеличению ВЧД до уровня диастолического АД, нарушению перфузии мозга, АМК, и развитию глубокой церебральной ишемии (J.D. Miller et al., Н. Nornes, Е. Grote и W. Hassler.).
Профилактика интраоперационного разрыва аневризмы осуществляется анестезиологическими и хирургическими методами, предотвращающими увеличение трансмурального давления на стенки аневризмы и растяжения стенок аневризмы во время арахноидального подхода к ней.
Профилактика подъема давления в полости аневризмы обеспечивается укладкой больного и адекватным обезболиванием на этапах вводного наркоза. Давление в полости аневризмы в положении лежа выше, чем в положении полулежа или сидя. Приподнятое положение головы больного во время операции позволяет снизить среднее давление в аневризме на 10% (G. G. Ferguson). Снижению риска внеконтактных интраоперационных разрывов аневризм во время вводного наркоза способствует применение комбинации препаратов, подавляющих прессорную реакцию больного и быструю миорелаксацию с минимальным подъемом АД (А. Ю. Лубнин и соавт.).
Уменьшению риска контактного разрыва аневризмы способствуют:
1) выбор хирургического доступа с учетом локализации аневризмы и направления ее купола (в том числе применение контралатеральных доступов, обеспечивающих подход к аневризме без контакта с ее куполом);
2) выполнение максимально низкой краниотомии, позволяющей произвести арахноидальный доступ с минимальной ретракцией мозга, не приводящей к растяжению купола аневризмы;
3) удаление сгустков крови в области купола аневризмы только после клипирования её шейки;
4) проведение препаровки и клипирования аневризмы на фоне временной окклюзии несущей ее артерии или артериальной гипотензии.
Индуцированная артериальная гипотензия применяется как мера профилактики интраоперационного разрыва аневризмы и как метод непрямого гемостаза. Для более безопасного выделения аневризмы применяют умеренную и глубокую артериальную гипотензию. Р. Уайт и соавт. перед наложением клипсы на шейку аневризмы снижали среднее артериальное давление до 40—55 мм рт. ст. Другие хирурги и анестезиологи ограничиваются снижением систолического АД на наиболее ответственном этапе операции только до 80—90 мм рт. ст. (S. Inomata et al., Н. S. Chang et al.).
На наш взгляд, более безопасным, простым и эффективным методом профилактики интраоперационного разрыва аневримы является превентивное временное клипирование. Превентивное временное клипирование приводит к уменьшению размера аневризмы и напряжения её стенок вследствие снижения локального пульсового АД и АД.
Купол аневризмы становится более пластичным, его можно смещать в стороны и, таким образом, в расширенном пространстве диссекция шейки аневризмы и удаление атеросклеротических бляшек и тромбов из ее пришеечной части и купола осуществляются с меньшими техническими трудностями, при лучшей визуализации и меньшем риске интраоперационного разрыва аневримы. Частота интраоперационного разрыва аневримы при применении превентивного временного клипирования, по сводным данным различных исследователей, снижается в 2,5 — 7 раз, а при возникновении интраоперационного разрыва аневримы кровотечение имеет умеренную интенсивность и легче контролируется. По нашим данным, превентивное временное клипирование позволяет уменьшить частоту интраоперационного разрыва аневримы в 4,1 раза.
Эффективность временного клипирования практически не различается в зависимости от локализации аневризмы. Однако при выполнении временного клипирования, как и в условиях артериальной гипотензии, имеется потенциальная опасность ишемии головного мозга в бассейне соответствующей артерии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Течение разрыва аневризм сосудов головного мозга. Осложнения
Повторный разрыв аневризмы. По нашему опыту, достоверных различий в частоте повторных кровоизлияний в различных возрастных группах нет, что согласуется с данными других авторов. Это осложнение мы наблюдали у 15,3% пациентов моложе 60 лет и у 16,2% пожилых больных. На риск возникновения повторного разрыва АА не влияли локализация аневризмы, объем ВМГ, выраженность САК (по Fisher) и ВЖК (по Graeb). У пожилых пациентов повторный разрыв чаще приходился на 10-е сутки, у пациентов молодого и среднего возраста — на 12-е сутки.
Ишемия головного мозга в результате развития ангиоспазма. Вазоспазм после перенесенного субарахноидального кровоизлияния приводит к существенной инвалидизации и смертности пациентов, переживающих первый разрыв аневризмы. У пожилых пациентов компенсаторные возможности мозгового кровотока ограничены вследствие возрастных изменений сосудов и цереброваскулярной болезни, поэтому в этой группе больных можно чаще ожидать возникновение отсроченного неврологического дефицита, обусловленного вазоспазмом.
Например, М. Matsuda и соавт., изучая особенности мозгового кровотока после субарахноидального кровоизлияния в разных возрастных группах, отметили, что у 60-летних пациентов мозговой кровоток остается сниженным от 3 мес до года, в отличие от более молодых больных, у которых мозговой кровоток возвращается к норме в течение нескольких недель.
По данным Т. Inagawa, несмотря на то что у пожилых пациентов выраженность вазоспазма, наблюдаемого при ангиографии, меньше, клинические проявления его встречаются так же часто, как и у молодых. К. Ока и соавт., оценивая проявления вазоспазма, приводят следующие данные: церебральная ишемия после САК наблюдалась у 27,5% пожилых и 24,6% молодых больных. Из этих групп клинически выраженный и подтвержденный при КТ инфаркт мозга был найден у 92,9% пожилых и у 58% молодых больных. Вазоспазм заканчивался распространенной ишемией чаще у больных старше 60 лет, но ишемия не была для них фатальной.
Н. G. Boecher-Schwarz в своих наблюдениях у больных моложе 60 лет, перенесших субарахноидальное кровоизлияние, чаще выявлял увеличение скорости кровотока по мозговым сосудам, чем у пожилых пациентов. В наших наблюдениях при ЦАГ и ТКДГ у пожилых больных в 1,5 раза реже выявляли ангиоспазм, однако проявления ишемии мозга в виде очагов инфаркта мозга при КТ и неблагоприятных типов (III-IV) на ЭЭГ у этой группы больных встречались в 1,25 раза чаще, чем у молодых пациентов. Очаги ишемии в полушариях головного мозга по данным КТ чаще выявляли у пациентов пожилого возраста, чем у больных моложе 60 лет — в 22,6 и 16,7% случаев соответственно.
Линейная скорость кровотока (ЛСК), при которой мы наиболее часто наблюдали клинические проявления ангиоспазма у пожилых, составила 120 см/с, у пациентов моложе 60 лет - 160 см/с.
Вероятно, с возрастом вследствие атеросклероза сосуды головного мозга теряют свою прежнюю эластичность и сократительную способность за счет уменьшения медиального (мышечного) слоя. Поэтому диаметр просвета сосуда изменяется в меньшей степени под воздействием САК и продуктов распада крови, и ЛСК увеличивается незначительно. Однако даже негрубая трансформация просвета сосуда в результате ангиоспазма у пожилых пациентов чаще приводит к появлению клинически значимой ишемии.
Гидроцефалия после разрыва аневризмы сосуда головного мозга. Хроническая дизрезорбтивная гидроцефалия после субарахноидального кровоизлияния развивается у 20-33% больных. У пожилых этот показатель значительно выше и достигает 44%.
Сроки развития синдрома Хакима-Адамса, обусловленного гидроцефалией, варьируют от нескольких дней до месяцев. Установление давности клинических проявлений синдрома очень важно, так как лучшие результаты ликворошунтирующих операций отмечаются при длительности симптомов не более 6 мес.
Расширение желудочков мозга на КТ, по данным К. Ока и соавт., у пожилых пациентов встречалось в 33,3% случаев после перенесенного САК, в сравнении с 24,5% у более молодых. Из них 82,4% пожилых нуждались в шунтировании ликворной системы и были оперированы. Необходимость дренирования ЦСЖ после САК была значительно обусловлена возрастом, наличием ВЖК, ранней гидроцефалией.
По данным Y. Yoshimoto, наружная гидроцефалия после САК встречается также чаще у пожилых больных (38% в сравнении с 14% в конрольной группе). В 81% случаев субдуральное скопление ЦСЖ было связано с одновременным расширением желудочков. Наличие наружной гидроцефалии коррелировало с необходимостью шунтирования желудочковой системы (48% в сравнении с 21% в контрольной группе). Причем после установки вентрикулоперитонеального дренажа значительно регрессировала и наружная гидроцефалия. Патогенетическими факторами в появлении субдурального скопления ЦСЖ являются сниженная абсорбция ее после САК и наличие отверстий в паутинной оболочке после хирургического лечения АА.
Послеоперационная летальность в соответствующих 4 группах пожилых пациентов была следующей: у пациентов 1-й группы — 14,3%, 2-й группы - 16,6%, 3-й группы - 7,7%, 4-й группы — 20,3%. Самая высокая летальность среди пациентов, которым не было выполнено оперативное вмешательство, наблюдалась в наиболее тяжелой группе больных — с осложненным течением аневризматической болезни и декомпенсацией соматической патологии (4-й вариант) — в 100% случаев.
Мы также сравнили функциональные исходы в выделенных группах пожилых больных и проанализировали летальность в зависимости от сроков оперативного лечения.
В этой группе пациентов в 35,2% случаев отмечена умеренная или глубокая инвалидизация в послеоперационном периоде. Ранние сроки оперативного лечения ухудшали прогноз оперативного лечения пациентов 4-й группы и увеличивали летальность до 29,6%.
Подобные исходы оперативного лечения мы наблюдали и во 2-й группе пожилых больных, с осложненным течением основного заболевания, но с компенсированной соматической патологией. В этой группе отмечена высокая инвалидизация оперированных больных — до 50% и значительная послеоперационная летальность в остром периоде кровоизлияния — 40%.
В настоящее время существующие данные о соотношении возраста и исхода субарахноидального кровоизлияния противоречивы. Большинство авторов указывает, что пожилой возраст предполагает неблагоприятный исход САК. Однако существуют работы, которые демонстрируют, что исход лечения зависит, как правило, больше от исходного клинического состояния и тяжести больного, нежели от возраста.
Есть несколько важных моментов, которые следует учитывать при анализе соотношений между возрастом и исходом заболевания:
1. Пациенты старше 60 лет часто исключаются из группы больных, которых готовят для раннего оперативного вмешательства.
2. Пожилые пациенты чаще находятся в более тяжелом состоянии после субарахноидального кровоизлияния, что имеет более определяющее значение для результата лечения, чем сам возраст.
3. Гипертоническая болезнь и атеросклероз чаще наблюдаются у пожилых пациентов. Эти патологические состояния сами по себе могут непосредственно влиять на неблагоприятный исход независимо от возраста.
Результаты консервативного лечения разорвавшейся аневризмы сосуда головного мозга у пожилых являются неудовлетворительными. В 60-х годах прошлого столетия Н. Locksley показал, что ранняя смертность у пожилых, получавших лишь консервативное лечение после разрыва аневризмы, была приблизительно 50%. В. Ellenbogen также сообщил о летальных исходах у больных старше 65 лет более чем в половине случаев. 5-летняя выживаемость после консервативного лечения у пожилых пациентов после САК была менее 20%. Причиной смертельных исходов у них чаще являлся повторный разрыв аневризмы. Раннее применение антифибринолитической терапии для уменьшения объема кровотечения у пожилых оказалось неэффективным и даже увеличивало смертность и ухудшало результаты в сравнении с группой более молодых пациентов.
Сроки операции при разрыве аневризмы сосуда головного мозга. Прогноз
Проведение раннего хирургического вмешательства, направленного на выключение разорвавшейся аневризмы сосуда головного мозга из кровотока, особенно у пациентов в компенсированном состоянии, может улучшить показатели исходов субарахноидального кровоизлияния. Пожилой возраст не является противопоказанием к раннему клипированию аневризмы.
Например, Е. Moriyama и соавт. наблюдали улучшение исходов после ранней хирургии (в первые 3-е суток после субарахноидального кровоизлияния) у пожилых пациентов с тяжестью состояния I-III степени по шкале Н-Н.
Пациентам с угнетенным уровнем сознания, старше 50 лет, имеющим ангиографические признаки вазоспазма, проводили отсроченные операции. Наиболее обнадеживающие результаты были получены у пациентов, оперированных спустя 7 дней после субарахноидального кровоизлияния.
В исследовании J. D. Laidlaw и соавт. выработана следующая тактика ведения пожилых пациентов с субарахноидальным кровоизлиянием: в первые 3-е суток готовят к операции и оперируют больных с тяжестью I-II степени по шкале Н-Н. Для более тяжелых пациентов принимается выжидательная тактика до стабилизации состояния.

Исключение составляют пациенты с тяжестью состояния III-V степени по шкале Н-Н, доставленные в первые часы после субарахноидального кровоизлияния, которых оперируют при поступлении. При 3-месячной оценке исходов среди больных, оперированных в компенсированном состоянии, у 53% был хороший результат, у 19% — летальный.
У больных в суб- и декомпенсированном состоянии неудовлетворительный результат был отмечен в 65% случаев, летальность — 50%. Несмотря на ультрараннюю хирургию (менее 12 ч от субарахноидального кровоизлияния), повторный разрыв произошел у 9% пожилых больных. По мнению авторов, ранняя, а также ультраранняя хирургия разорвавшихся аневризм сосудов головного мозга на сегодняшний день является приоритетом в выборе лечения субарахноидального кровоизлияния у пожилых больных.
После проведения дообследования и перед планированием оперативного вмешательства необходимо оценить риск неблагоприятного исхода оперативного вмешательства.
Ведущим прогностическим фактором хирургического лечения являлась тяжесть состояния больных в предоперационном периоде. Тяжесть состояния больных была обусловлена наличием неврологического дефицита, выраженностью сопутствующей патологии, анатомической формой кровоизлияния, зависела от возникновения повторного разрыва и развития ангиоспазма и ишемии головного мозга.
Пациенты с тяжестью состояния IV-V ст. по шкале Н-Н имели высокую летальность и, соответственно, неблагоприятный прогноз хирургического лечения. Больные, тяжесть состояния которых оценивалась как III ст. по шкале Н-Н, имели сомнительный прогноз. Развитие заболевания у них часто осложнялось ишемией головного мозга на фоне ангиоспазма или декомпенсацией соматической патологии, что ухудшало течение послеоперационного периода и увеличивало летальность. Благоприятный прогноз хирургического лечения имели пожилые пациенты I-II ст. по Н-Н, летальность после хирургического лечения у этих пациентов была минимальной.
Значимым и отличительным фактором прогноза у пожилых пациентов являлось наличие сопутствующих соматических заболеваний и их сочетания. Высокая летальность (24,5%) и неблагоприятный прогноз хирургического лечения были отмечены у пациентов, имеющих несколько соматических заболеваний (ГБ, ИБС, хронические неспецифические заболевания легких).
Ранние сроки (1-14-е сутки) оперативного вмешательства, выбухание мозга во время основного этапа, интраоперационный разрыв аневризмы и применение временного клипирования были сопряжены у пожилых пациентов с плохими исходами хирургического лечения и также ухудшали прогноз оперативного лечения данной категории больных.
АНЕВРИЗМЫ СОСУДОВ ГОЛОВНОГО МОЗГА
Частая причина геморрагического инсульта. Аневризмы представляют собой выпячивания сосудистой стенки и располагаются обычно в местах деления сосудов. Под действием различных факторов (гипертоническая болезнь, курение, наследственная предрасположенность) происходит рост аневризмы и истончение ее стенки. Указанные процессы в итоге приводят к разрыву аневризмы и кровоизлиянию в мозг и окружающие его пространства. Более половины больных не переносят кровоизлияние и погибают не смотря на интенсивную терапию даже в самых лучших клиниках. Именно поэтому практически во всех случаях рекомендуется профилактическая операция, имеющая целью выключение аневризмы из кровотока.
Общая информация. Диагностика
Хирургическое лечение артериальных аневризм церебральных сосудов на протяжении нескольких десятилетий является одним из основных и наиболее важных направлений работы сосудистого отделения института. Это связано с тем, что методов консервативного лечения данной патологии не существует, а оперативные вмешательства на аневризмах остаются в ряду наиболее сложных нейрохирургических операций. Несмотря на многочисленные исследования, направленные на разработку методов профилактики разрыва аневризм и лечение осложнений аневризматических кровоизлияний, артериальные аневризмы церебральных сосудов по-прежнему являются заболеванием с высокой вероятностью летального исхода или стойкой инвалидизации: при отсутствии хирургической помощи до 70% больных погибают в первый год от начала болезни, 25% выживших остаются инвалидами. Распространенность артериальных аневризм в популяции довольно высока — не менее 0,6% (около 600 человек на 100 000 населения). Частота САК вследствие разрыва аневризм составляет 10–15 случаев на 100 000 населения в год. Таким образом, в России ежегодно в госпитализации нуждается около 18 000 больных с аневризматическим САК. Появление новых диагностических возможностей привело к учащению выявления бессимптомных аневризм, что еще более увеличило количество больных, обращающихся за медицинской помощью.
КТ в режиме ангиографии
За более чем 40-летний период в институте выполнено около 5000 прямых хирургических вмешательств и более 700 эндоваскулярных операций по поводу артериальных аневризм. Число больных, ежегодно поступающих для оперативного вмешательства, возросло со 100 больных в 70-е–80-е годы до 300 и более к настоящему времени. Постоянный анализ этого клинического материала в диссертационных работах, детализация принципов лечения в зависимости от сроков после кровоизлияния, размеров, расположения, анатомических особенностей аневризм, их количества у одного человека, возраста больных, привели к созданию отдельных направлений в хирургии церебральных аневризм. Важнейшую роль в хирургическом лечении аневризм играют методы диагностики заболевания. В настоящее время диагностика аневризм может быть выполнена методами прямой ангиографии, МРТ- и СКТ-ангиографии. Результаты этих трех методов могут быть представлены в объемном изображении (3D-реконструкция). СКТ-АГ в настоящее время может считаться методом выбора в выявлении причины САК.
Особую роль в обследовании больного в остром периоде САК играют методы диагностики ангиоспазма. Транскраниальная ультразвуковая допплерография (ТК УЗДГ), уступая нейровизуализационным методам в чувствительности и специфичности, позволяет оценить динамику ангиоспазма, так как неинвазивность метода дает возможность проводить многократные исследования. КТ и МРТ в различных режимах у больных с аневризмами незаменимы в диагностике и динамическом контроле таких осложнений САК и операции, как внутримозговые гематомы, внутрижелудочковые кровоизлияния, отек и ишемия головного мозга, острая и отсроченная гидроцефалия.
Оставаясь неизменной в основополагающих принципах, хирургия церебральных аневризм постоянно совершенствуется. Современный этап лечения артериальных аневризм в институте можно характеризовать как этап строго дифференцированного и индивидуализированного лечения, выполняемого с учетом всех особенностей течения болезни, морфо-функциональной характеристики аневризм, состояния больного и других факторов. Основой идеологии хирургии аневризм является интеграция и взаимодополнение микрохирургических и эндоваскулярных методов. При микрохирургическом лечении аневризм основной операцией является клипирование шейки аневризмы самозажимающимся клипсом. В зависимости от анатомо-топографических особенностей аневризмы, используются клипсы различного размера и конфигурации. За последние годы в институте разработан и внедрен ряд хирургических и диагностических методов, позволивших улучшить качество выключения более сложных аневризм: внутрисосудистая аспирация крови, интраоперационная ультразвуковая допплерография, флоуметрия, флюоресцентная ангиография.
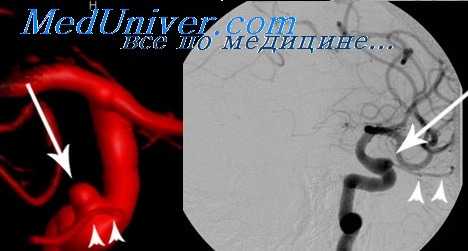
Основными преимуществами эндоваскулярного метода лечения аневризм являются возможность полного выключения аневризмы из кровотока при отсутствии хирургической травмы мозга и возможность выключения аневризм, труднодоступных или недоступных для прямого хирургического вмешательства. Эти преимущества в первую очередь важны у больных в остром периоде кровоизлияния, при аневризмах параклиноидного отдела ВСА и вертебро-базилярного бассейна. Предпочтительным методом эндоваскулярного выключения аневризм следует считать реконструктивные операции — окклюзию полости аневризмы с сохранением просвета несущего сосуда. Для выключения аневризм в настоящее время используется методика окклюзии аневризмы отделяемыми микроспиралями.
Выбор метода выключения аневризмы
Окклюзия аневризмы
со стент-ассистенцией
Преимущества эндовазального лечения в первую очередь важны у больных в остром периоде кровоизлияния, при аневризмах параклиноидного отдела ВСА и вертебро-базилярного бассейна. Основным фактором, определяющим возможность окклюзии аневризмы эндоваскулярным методом до недавнего времени считалось соотношение размера тела аневризмы и ее шейки. Установлено, что чем больше размер аневризмы и шире ее шейка, тем больше вероятность отдаленной реканализации после первоначально тотально выполненной окклюзии. Для решения этой проблемы разработаны стент-ассистирующие методики. Суть стент-ассистирующей методики при лечении аневризм заключается в предотвращении смещения витков спиралей в просвет несущего сосуда. Это достигается следующим образом: первым этапом сосуд на уровне шейки аневризмы устанавливается стент, а затем через ячейку стента проводится микрокатетер, через который доставляются микроспирали. В последние годы появилась новая категория внутричерепных стентов, так называемые потоконаправляющие стенты (flow divert), которые позволяют уменьшать кровоток в аневризме, направляя основной поток крови по несущему сосуду. Тромбирование аневризмы после установки такого стента в среднем наступает в период от 4 до 6 месяцев после операции. Эта методика наиболее эффективна для лечения аневризм крупных и гигантских размеров. В настоящее время в НИИ нейрохирургии ежегодно выполняется около 250 микро-хирургических и 150 эндоваскулярных операций на аневризмах в «холодном» периоде после САК (21 день и более). Выбор метода операции зависит, прежде всего, от анатомических особенностей аневризмы. Эндоваскулярный метод предпочтителен при аневризмах ВСА параклиноидного и инфраклиноидного расположения. При аневризмах развилки СМА и аневризмах ПМА-ПСА чаще проводятся прямые вмешательства, так как особенности строения этих аневризм (преимущественно широкая шейка, близость устьев артерий второго порядка, варианты строения ПСА и др.) и невозможность применения стентов ограничивают использование эндоваскулярного метода. На решение вопроса о методе операции влияет возраст больного — у молодых больных предпочтительны прямые операции, имеющие более высокую радикальность. Ограничением для эндоваскулярного метода являются патологические изгибы и выраженный атеросклероз брахиоцефальных артерий. При необходимости операции со стент-ассистенцией следует учитывать наличие кровотечений различной этиологии в анамнезе, так как установка стента требует в длительного приема антикоагулянтов в послеоперационном периоде. В некоторых случаях микрохирургические операции выполняют вторым этапом в случаях, когда в ходе эндоваскулярного вмешательства достигнута лишь частичная окклюзия аневризмы. Возможны и обратные ситуации — эндоваскулярное вмешательство после паллиативной прямой операции (укрепление аневризмы марлей, неполное клипирование). Результаты микрохирургического лечения аневризм в холодном периоде после САК на протяжении многих лет остаются достаточно хорошими. Риск возникновения нового неврологического дефицита несколько выше при микрохирургическом выключении аневризмы, риск летального исхода выше при эндовазальном лечении.
Лечение больных в остром периоде заболевания
Сравнение внешнего вида мозга
в остром и холодном периоде после САК
Лечение больных в остром периоде после САК – сложная задача, требующая привлечения различных специалистов. Обоснованием операций в остром периоде является, прежде всего, возможность повторных кровоизлияний, которые сопровождаются крайне высокой летальностью. После выключения аневризмы также возможно начало проведения интенсивной сосудистой терапии, направленной на устранение последствий кровоизлияния. На основании анализа результатов хирургического лечения более чем 600 больных в остром периоде САК в институте было показано, что прогностически значимыми критериями оценки исхода операции являются массивность кровоизлияния, состояние больного по шкале Нunt-Нess или WFNS, срок операции после САК. C учетом этих факторов разработаны основные принципы лечения больных. Показания к операции в острой стадии САК должны быть строго индивидуализированы. Для решения вопроса о тактике ведения больного необходимым минимумом является оценка состояния больного по шкале Нunt-Нess или WFNS, КТ, ангиография, ТК УЗДГ с определением выраженности ангиоспазма. Особое внимание следует обращать на срок после кровоизлияния. Операция показана больным в I–II стадии по Нunt–Нess, независимо от срока после САК; в III–IV стадии по Нunt–Нess в сроки от 14 суток после САК. У больных III–IV стадии при операции на 0–3 сутки после САК необходима установка датчиков для послеоперационного контроля ВЧД, так как для этих больных характерно развитие ангиоспазма и отека мозга в раннем послеоперационном периоде . У больных III–IV стадии на 4–7 сутки после САК при наличии умеренного или выраженного ангиоспазма от операции следует воздержаться. Длительность отсрочки операции при ангиоспазме зависит от показателей ТК УЗДГ: операция может быть выполнена при снижении скорости кровотока до соответствующей легкому спазму, либо при стабилизации на уровне умеренного спазма в течение нескольких дней, но не ранее 7-х суток после САК. В V стадии операция показана только при наличии больших внутримозговых гематом. В этих случаях операция наиболее эффективна при максимально ранних вмешательствах. В остром периоде САК методом выбора, особенно у тяжелых больных, следует считать эндоваскулярное выключение аневризмы. В ряде случаев при невозможности полной окклюзии аневризмы можно ограничиться частичным выключением, с последующей повторной операцией после улучшения состояния. Помимо анатомических особенностей, ограничением для проведения эндоваскулярной операции в остром периоде служит выраженный ангиоспазм, препятствующий проведению катетера. При выполнении прямого вмешательства необходимо учитывать, что мозг больного в остром периоде САК значительно более чувствителен к хирургической травме, в связи с этим необходимо использовать максимально щадящие способы доступа к аневризме с ограничением тракции мозга, использованием методов релаксации (осмодиурез, выведение ликвора) и защиты мозга от ишемии.
На протяжении всего периода лечения больных в острой стадии САК ведущей задачей является предотвращение и лечение типичных для кровоизлияния из аневризмы осложнений, в первую очередь, ангиоспазма, отека мозга и острой или отсроченной гидроцефалии. В настоящее время для борьбы с этими осложнениями используется методика внутрисосудистого введения спазмолитиков под контролем ТК УЗДГ, 3Н-терапия в условиях мультимодального мониторинга, декомпрессивная трепанация черепа. За последние 10 лет послеоперационная летальность при прямых операциях в остром периоде составила в среднем 7,3%, а общая смертность — 12,4%. Среди выживших больных 80% полностью независимы в повседневной жизни, около 40% вернулись к работе и учебе. Полученные данные использованы при создании рекомендательного протокола по ведению больных в остром периоде САК совместно с ведущими нейрохирургами России. Опыт института позволил принять участие в нескольких в международных исследованиях, посвященных лечению больных в острой стадии САК.
Лечение крупных и гигантских аневризм
Выключение гигантской аневризмы ВСА
с использованием методики ВАК
Хирургическое лечение крупных и гигантских аневризм — один из самых сложных вопросов сосудистой нейрохирургии. В 70-е годы оперативное пособие у таких больных ограничивалось перевязкой внутренней сонной артерии на шее, при этом послеоперационная летальность составляла 15,2%. С появлением эндовазальной техники стало возможным проведение баллон-окклюзионного теста под контролем ЭЭГ с последующей стационарной окклюзией ВСА. В отдельных случаях данный способ лечения комбинировали с наложением ЭИКМА, однако, послеоперационная летальность в группе гигантских аневризм оставалась высокой. С 1995 года в институте разработана и используется методика внутрисосудистой аспирации крови из аневризмы. Методика ВАК показала себя весьма эффективной в хирургии крупных и гигантских аневризм ВСА, позволила в 4 раза уменьшить послеоперационную летальность и значительно сократить группу больных, которым отказано в хирургическом лечении. В настоящее время отделение располагает самым большим опытом в мире по применению методики ВАК.
Выключение крупной аневризмы с помощью
установки потоко-направляющего стента
Наряду с прямыми вмешательствами, на протяжении многих лет для лечения крупных и гигантских аневризм в институте использовались и эндоваскулярные методы. До появления стент-ассистенции и потоконаправляющих стентов, добиться полного выключения таких аневризм спиралями удавалось редко. Появление стентов существенно изменило возможности эндоваскулярного лечения крупных и гигантских аневризм. С момента использования потоконаправляющих стентов произошло существенное снижение доли деконструктивных операций. Несомненно, что эта технология имеет большие перспективы и в ближайшем будущем существенно изменит структуру эндоваскулярных вмешательств при лечении аневризм в целом.
Микрохирургическое лечение бессимптомных аневризм
До недавнего времени бессимптомные аневризмы выявляли крайне редко. В последние годы широкое распространение и доступность неинвазивных методов нейровизуализации привели к значительному увеличению числа пациентов со случайно выявленными аневризмами. За последние 10 лет в институте оперировано около 400 пациентов с бессимптомными аневризмами. Результаты хирургического лечения в этой категории больных следует признать удовлетворительными. С учетом этих данных, а также крайне высокой вероятностью неблагоприятного исхода при разрыве аневризмы, можно утверждать, что неразорвавшиеся бессимптомные аневризмы в большинстве случаев необходимо оперировать. Следует отметить, что больной должен быть полностью информирован о характере болезни, предстоящей операции и возможных осложнениях.
Множественные аневризмы
К настоящему времени доля больных с множественными аневризмами составляет 20–25% от всех оперируемых в институте больных с аневризмами. В подавляющем большинстве случаев у больного с множественными аневризмами обнаруживают не более двух аневризм, однако встречаются больные с тремя и более аневризмами. Сочетания аневризм по локализации, размерам, количеству, клиническим проявлениям достаточно разнообразны. Первоочередной задачей на этапе диагностики является определение аневризмы, послужившей источником кровоизлияния. Основным принципом лечения МА является первоначальное выключение из кровотока разорвавшейся аневризмы с применением микрохирургической или эндоваскулярной техники в зависимости от анатомических особенностей аневризмы. Операции могут быть выполнены в один и несколько этапов. При лечении множественных аневризм различных сосудистых бассейнов, особенно в остром периоде САК, а также при сложных аневризмах, предпочтительны двухэтапные или многоэтапные вмешательства.
Лечение аневризм у больных детского возраста
Аневризмы головного мозга у детей встречаются редко и могут сочетаться с различной патологией соединительной ткани (с-м Марфана, с-м Элерса-Данлоса) и различными аномалиями развития вилизиева круга. У детей в три раза чаще, чем у взрослых, выявляются аневризмы со сложными анатомическими характеристиками. Псевдотуморозный и ишемический типы течения при «детских» аневризмах встречаются в несколько раз чаще, чем у взрослых. Случайно обнаруженные аневризмы у детей редки. Принципы хирургического лечения аневризм у детей в целом те же, что и у взрослых. Следует отметить, что компенсаторные возможности ребенка при развитии каких-либо осложнений больше, чем у взрослых, поэтому дети легче переносят выключение несущих аневризму артерий. В этой связи деконструктивные операции можно рассматривать как метод выбора в случаях сложных аневризм при невозможности выключения аневризмы с сохранением проходимости артерии.
Читайте также:
- Оценка пневмоэнцефалограмм при эпилепсии. Арахноидит при эпилепсии
- Капиллярная мальформация: причины, симптомы и лечение
- Диск зрительного нерва при альбинизме
- Рентгеновское излучение применяемое в терапии (радиотерапии) рака
- Признаки воспаления слухового прохода. Лечения различного воспаления слухового прохода
