Иммуногенность вакцин. Оценка иммуногенности вакцинации.
Добавил пользователь Евгений Кузнецов Обновлено: 20.01.2026
Сегодня является бесспорным тот факт, что вакцинопрофилактика это наиболее мощный метод борьбы с инфекционной патологией. Вместе с тем, вакцинация относится к числу мероприятий, требующих значительных материальных затрат, поскольку предусматривает охват прививками широкие слои населения. В связи с этим важно иметь правильное представление об эффективности иммунизации. Вакцинопрофилактика как мероприятие оценивается по 3 группам критериев: показатели документированной привитости (охват прививками), уровень иммунологической или клинической эффективности (efficacy) и эпидемиологическая или полевая эффективность (effectiveness). Показатели охвата прививками позволяют косвенно оценить возможное состояние популяционного иммунитета. Объективными критериями качества вакцинного препарата, а также состояния защищенности коллектива против того или иного инфекционного заболевания являются показатели иммунологической (клинической) и эпидемиологической (полевой) эффективности. Иммунологическая эффективность отвечает на вопрос «работает ли вакцина?», в то время как эпидемиологическая – «защищает ли прививка людей?» [3,5]. Иными словами, иммунологическая эффективность вакцины и эффективность иммунизации как профилактического мероприятия – разные понятия. Если под иммунологической эффективностью вакцины принято понимать способность препарата вызывать иммунный ответ у привитого, то эффективность иммунизации – различия в заболеваемости в группе привитых и непривитых лиц [1,2].
Сбор сведений о привитости осуществляется на уровне педиатрического участка по данным журналов профилактических прививок (ф.064-У), карт профилактических прививок (ф.063-у), истории развития ребенка (ф.112-у), сертификата о профилактических прививках (ф.156-у). Эта информация передается в территориальные центры Госсанэпиднадзора, последние анализируют ее по территориям и передают в соответствующие ведомства. Оценка привитости проводится на основании изучения величины охвата прививками лиц декретированного возраста в соответствии с действующим календарем профилактических прививок, введенным Приказом МЗ РФ №375 от 18.12.97. Нормативными показателями охвата прививками в возрастных группах детей до 3-х лет следует считать 95,0%, в старших возрастных группах – 97-98%. Опыт борьбы с оспой показал, что 80-90% охват прививками недостаточен для ликвидации инфекции. Оспу удалось ликвидировать лишь при охвате 99% населения прививками. Это обстоятельство важно учитывать при решении задачи ликвидации других инфекций.
Оценка иммунологической эффективности осуществляется выборочно среди различных групп населения и прицельно в индикаторных группах населения (получающих в соответствии с возрастом прививки), а также в группах риска (детские интернаты, дома ребенка и др.). Основные требования к иммунологическим исследованиям сводятся к следующему: 1) короткий промежуток времени, в течение которого исследуются все испытуемые сыворотки; 2) стандартность используемых диагностических препаратов; 3) высокая чувствительность иммунологического теста [2]. Выбор теста для оценки иммунологической эффективности вакцины зависит от характера иммунитета при данной инфекции. Например, для таких инфекций как столбняк, дифтерия, корь, паротит критерием эффективности вакцины является определение уровня циркулирующих специфических антител, а для туберкулеза, туляремии и бруцеллеза и др. – клеточные реакции (например, кожные реакции замедленной гиперчувствительности). К сожалению, для большинства инфекций, при которых основой защиты является клеточное звено иммунитета, уровни иммунных клеточных реакций не установлены.
Изучение иммунологической эффективности вакцин проводится путем сопоставления титров специфических антител в сыворотке крови привитых до и в разные сроки после иммунизации, а также путем сравнения этих результатов с определяемыми уровнями антител, полученными в те же сроки при обследовании лиц, которым вводили плацебо или препарат сравнения. Плацебо помещают в точно такие же ампулы или флаконы, в которых содержится изучаемая вакцина. Первые сыворотки собираются непосредственно перед вакцинацией, последующие – обычно через месяц после введения препарата. При однократной вакцинации одновременному исследованию подлежат парные сыворотки крови. При двукратной – тройные сыворотки и т.д. Очень важно, чтобы сыворотки, собранные в разные сроки, титровались одновременно. В случае хранения сывороток, взятых в более ранние сроки, может произойти снижение их активности, в результате чего показатели иммуногенности будут искусственно завышены. Сыворотки следует хранить в замороженном состоянии, причем замораживанию должны быть подвергнуты все образцы как ранее собранных сывороток, так и свежих. В этом случае если и наблюдается снижение активности сывороток, то данный факт имеет равное значение для сывороток, полученных в разные сроки.
Необходимость проведения подобных исследований определена неоднозначностью понятий «привит» и «защищен». Имеющийся опыт свидетельствует, что эти понятия далеко не всегда совпадают (рядом авторов это отмечено при дифтерии, кори и эпидемическом паротите). Иммунологическая активность вакцин может отражать ее профилактическую эффективность в том случае, если известен защитный уровень иммунологических показателей при данной инфекции. Защитный уровень антител устанавливается заранее на основании результатов опытов с однонаправленным препаратом. Для каждой инфекции определяется защитный титр антител (для кори, паротита и гриппа он равен 1:10, столбняка 1:20, дифтерии 1:40 в РПГА; для коклюша 0,03 МЕ/мл, гепатита В 0,01 МЕ/мл в иммуноферментной реакции и т.д.). Для инфекций, при которых не установлен защитный уровень антител, приходится проводить испытания профилактической эффективности вакцин по показателям заболеваемости данной инфекцией.
Наиболее объективную оценку иммунологической эффективности вакцин можно получить при вакцинации серонегативных к специфическим антигенам людей. Из таких лиц формируют опытную и контрольную группы. Оценку иммуногенности вакцинного препарата осуществляют на основе определения разницы в числе лиц имеющих антитела в этих двух группах. Коэффициент иммунологической эффективности определяют по следующей формуле:
КЭ - коэффициент иммунологической эффективности;
А – число привитых испытуемым препаратом, у которых исследовали парные сыворотки крови;
Б – то же в контрольной группе лиц;
а – число привитых с возникшим иммунологическим сдвигом;
б – то же в контрольной группе.
Сформировать группы лиц, у которых не определялись бы антитела к широко распространенным возбудителям (грипп, гепатит А и др.) подчас бывает довольно сложно. В таких случаях нередко эффективность препаратов оценивают по нарастанию титров специфических антител до и после вакцинации как в основной, так и в контрольной группе. Иммунологические сдвиги, возникающие при вакцинации, оцениваются также по проценту сероконверсии. Вакцина считается высоко эффективной, если процент сероконверсии составляет 90% и выше. Кроме того, важное значение имеет длительность поствакцинального протективного иммунитета, которая после введения, например, вакцины против желтой лихорадки составляет 10-15 лет, брюшного тифа (вакцины Вианвак и Тифим Ви) – 3 года, гепатита В не менее 7-10 лет. Опубликованы результаты исследований о сохранении антител к вирусу краснухи от 9 до 21 г. после прививки, причем серонегативность обнаруживалась только у 1% привитых вакциной Рудивакс [7].
Для оценки и слежения за уровнем популяционного иммунитета проводится плановый серологический (иммунологический) контроль. Он позволяет выявить группы людей, наиболее подверженных риску заболевания, оценить степень защищенности лиц, привитых с нарушением схемы иммунизации или не имеющих документов о вакцинации, дать оценку и составить прогноз изменения эпидемиологической ситуации на конкретной территории. Отбор лиц для обследования в целях изучения иммуноструктуры проводится на основе кластерной выборки, рекомендованной ВОЗ. Экстренный серологический контроль проводится в очагах инфекционных заболеваний с целью выявления неиммунных лиц, которые контактировали с источником инфекции и подлежат срочной активной или пассивной иммунизации. Он также показан для лиц с неясным прививочным анамнезом, при оценке вакцинального процесса у детей из групп риска, привитых щадящими методами, а также при развитии поствакцинальных осложнений. Результат оценки иммунологической (клинической) эффективности вакцин может дать представление, является ли вакцина иммуногенной и защищает ли она тех, кто привит. В то же время исследования относительной иммуногенности не могут дать ответ, какая из схем вакцинации обеспечивает лучшую защиту, и результаты испытаний клинической эффективности будут трудны для экстраполирования на условия рутинного применения вакцины в популяции. Таким образом, хотя исследования иммунологической эффективности вакцин необходимы, они часто не могут дать четкий ответ о выгоде, связанной с вакцинацией.
Среди исследований эпидемиологической (полевой) эффективности ретроспективный вид анализа наиболее распространен. Один из простых подходов, разработанных в середине 1980-х является скрининговый метод, широко применяющийся в оценочных программах вакцинации не только в развивающихся, но и в развитых странах. Скрининг-исследование требует только два типа данных контроля относительно каждой популяции: соотношение прошедших вакцинацию (PPV) и соотношение пациентов, которые были привиты, но заболели (PCV). Эффективность вакцинации рассчитывается с использованием алгебраического производного классического уравнения VE = 1 – относительный риск (5). Была разработана простая номограмма, позволяющая скрининг-исследованию быть легко применимым. Скрининг имеет два важных ограничения: для того, чтобы исследование было точным, частично привитые пациенты должны быть исключены из опыта, помимо этого большие погрешности могут иметь место всякий раз, когда PPV или PCV очень низки или очень высоки. Тем не менее, метод очень полезен, потому что, подобно всем скрининг-исследованиям, он показывает, являются ли клиническая (иммунологическая) и эпидемиологическая (полевая) эффективность вакцинации приемлемыми или требуют дальнейшего изучения.
В условиях плановой вакцинации применяют обычные эпидемиологические исследования, детально описанные Оренштейном и соавт. [6]. Исследования эпидемиологической (полевой) эффективности прививки прямо отвечают на вопрос, «защищает ли прививка людей?». Оценка эпидемиологической эффективности предусматривает сбор информации об уровне заболеваемости, проявлениях эпидемического процесса во времени, в пространстве и среди различных групп населения. Основными критериями оценки эффекта массовой иммунизации служат не только показатели заболеваемости, но и смертности, изменения в характере очаговости, сезонности и цикличности, возрастной структуре болеющих, а также клинического течения соответствующего инфекционного заболевания. Эти критерии учитываются за достаточно длительный период времени до и после проведения прививок. Предусматривается определение индекса эффективности, коэффициента (показателя) защищенности, коэффициента тяжести клинического течения болезни.
Коэффициент защищенности (Е) определяется по формуле
a – заболеваемость среди лиц, получивших препарат;
б – заболеваемость среди лиц, не получивших препарат.
По показателю защищенности можно определить, каков удельный вес людей из числа получающих вакцинный препарат защищенных от заболевания. Показатель защищенности может с известной долей достоверности выводиться из показателя непосредственного риска, определяемого в когортном эпидемиологическом исследовании.
Иммуногенность вакцин. Оценка иммуногенности вакцинации.
Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
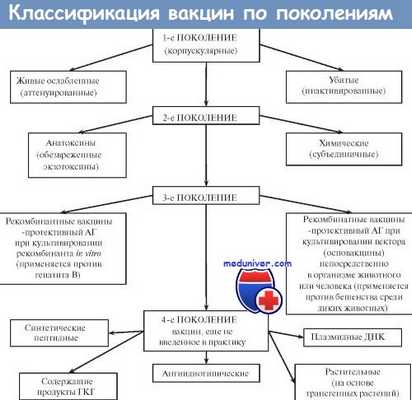
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Экспериментальные исследования в эпидемиологии, основанные на иммунологических тестах, также исходят из сравнительного изучения уровня иммунитета в опытных и контрольных группах лиц. Способность того или иного препарата вызывать выработку иммунитета у привитых называют его профилактической активностью. В тех случаях, когда имеется полная корреляция между уровнем гуморальных антител и их защитной способностью (как, например, при анатоксинах), определение коэффициента эффективности не составляет особого труда.
Для этого в тех или иных реакциях иммунитета определяют число лиц, которые в результате иммунизации приобрели антитела в защитных титрах. При необходимости сравнительной оценки двух или более препаратов процентное соотношение таких лиц к числу привитых каждым из препаратов и будет являться количественным выражением профилактической активности препарата, т. е. коэффициентом его эффективности. При этом следует быть уверенным, что определенный уровень иммунитета является свидетельством защищенности человека от данного заболевания и, конечно, в том, что выбранная методика определения антител является вполне надежной.
Выбор тестов зависит прежде всего от характеристики инфекции, против которой направлено действие препарата. Так, например, при дифтерии и столбняке - это измерение уровня антитоксинов, при оспе - местная реакция, характеризующая чувствительность человека к этой инфекции, при применении атте-нуированной полиомиелитной вакцины - это может быть обнаружение вакцинного штамма, при туберкулезе - кожные пробы и др.
Приведенные примеры свидетельствуют о том, что при оценке ряда профилактических препаратов мы можем избежать необходимости постановки дорогостоящих и сложных эпидемиологических опытов. Кроме того, следует учитывать и то, что с каждым годом уровень заболеваемости основными нозологическими формами становится все ниже, а потому и проведение эпидемиологических наблюдений все труднее. Нельзя не согласиться с И.И.Шатровым (1965), который указывал, что значение иммунологических исследований в современных условиях для изучения эффективности все увеличивающегося количества профилактических препаратов все возрастает.
Определение эффективности вакцины путем изучения защищенности привитых лиц принято называть иммунологическим опытом, а полученный результат - иммунологической эффективностью. Определение же эффективности вакцины при помощи эпидемиологического наблюдения, когда заключение делается на основании сравнения заболеваемости среди привитых и непривитых, принято называть эпидемиологическим опытом, а получаемый результат - эпидемиологической эффективностью.
Для правильной постановки любого иммунологического опыта необходимо соблюдение условий, обязательных для контролируемых опытов, что обеспечит достоверность получаемых результатов.
Изучение иммунологической эффективности того или иного препарата обычно осуществляется определением динамики иммунологических сдвигов в сыворотках крови у привитых. При однократной вакцинации одновременному исследованию подлежат парные сыворотки крови, при двукратной - тройные сыворотки и т. д. Очень важно, чтобы сыворотки, собранные в разные сроки, титровались одновременно. В случае хранения сывороток, взятых в более ранние сроки, может произойти уменьшение их активности, в результате чего показатели иммуногенности будут искусственно завышены.
Сыворотки следует хранить в замороженном состоянии, причем замораживанию должны быть подвергнуты все образцы как ранее собранных сывороток, так и свежих. В этом случае если и наблюдается уменьшение активности сывороток, то оно имеет равное значение для сывороток, полученных в разные сроки.
Первые сыворотки должны собираться непосредственно перед вакцинацией. Сроки забора вторых сывороток определяются исходя из иммунологической характеристики инфекции, против которой направлен препарат. Обычно второе взятие сыворотки крови производится не ранее чем через 30 дней после вакцинации.
Безопасность и опасность прививок. Календарь вакцинации развитых стран
Вакцинацию применяют для профилактики различных инфекционных заболеваний (например, полиомиелита, дифтерии и др.). С её помощью была полностью уничтожена оспа. При пассивной иммунизации в организм вводят антитела (иммуноглобулины), а при активной — вакцины.
Иммуноглобулины. Иммуноглобулины обеспечивают кратковременную защиту организма от определённых инфекций. Кроме того, их применяют для лечения нарушений иммунной системы. Препараты иммуноглобулина человека, изготавливаемые из плазмы крови, содержат антитела к наиболее распространённым вирусам. Специфические иммуноглобулины, получаемые из крови гипериммунных доноров, применяют для лечения уже заражённых пациентов (например, при гепатите В, ветряной оспе, столбняке, эндемическом клещевом энцефалите).
Вакцинация. Цель вакцинации — формирование иммунитета к определённым заболеваниям у неинфицированных лиц. Вакцины получают из вирусов, бактерий или их антигенных компонентов (ацеллюлярные вакцины).
Живые вакцины содержат аттенуированные (ослабленные) штаммы микроорганизмов со сниженной патогенностью (вакцины против паротита, кори, краснухи, полиомиелита, жёлтой лихорадки). Живые вакцины обычно вызывают стойкий продолжительный иммунитет даже после однократного введения. Следует помнить, что они могут вызвать заболевание у пациентов с ослабленным иммунитетом и противопоказаны беременным в связи с высоким риском заражения плода.
Календарь прививок развитых стран
Инактивированные вакцины содержат как инактивированные микроорганизмы (противококлюшная вакцина), так и отдельные антигенные компоненты (например, капсульные полисахариды Streptococcus pneumoniae). При инактивации столбнячного и дифтерийного токсина образуются анатоксины, стимулирующие выработку антител и иммунный ответ организма; при этом отсутствуют клинические признаки заболевания.
Повышению иммуногенности некоторых ацеллюлярных вакцин способствует конъюгация с белками (вакцина против Haemophilus influenzae типа В). Для производства ацеллюлярных вакцин (например, против гепатита В) могут быть использованы методы генной инженерии. В связи с невозможностью репликации компонентов, входящих в их состав, такие вакцины безопасны для пациентов с ослабленным иммунитетом. Для обеспечения оптимального иммунного ответа иногда необходима повторная вакцинация. Цели программ иммунизации населения:
• эрадикация возбудителя (например, при натуральной оспе) — его полное уничтожение в организме человека, животных и окружающей среде;
• элиминация — отсутствие клинических симптомов заболевания при сохранении возбудителя в организме человека, животных или окружающей среде (например, при дифтерии, столбняке, паралитическом полиомиелите);
• сдерживание инфекции — изоляция её очага и предотвращение дальнейшего распространения заболевания. Всеобщая иммунизация помогает защитить от большинства детских инфекционных заболеваний. Цель избирательных программ — проведение иммунизации пациентам из групп риска (например, вакцинация медицинского персонала учреждений здравоохранения против гепатита В).
Национальные программы иммунизации различны в разных странах. Их регулярно корректируют с учётом изменений эпидемиологической обстановки в стране и доступности вакцин.
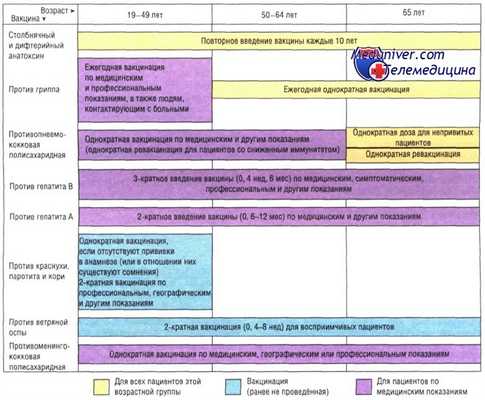
Календарь вакцинации развитых стран
Опасность и безопасность вакцинации
Любые вмешательства в процессы, происходящие в организме человека, сопряжены с определённым риском для пациента. При проведении программ иммунизации граждан риск развития осложнений при возникновении заболевания должен во много раз превышать риск неблагоприятных последствий вакцинации, т.е. первостепенное значение придают безопасности вакцины.
Для оценки последней проводят тщательные клинические исследования, а производство препарата контролируется строгими правилами GMP (good manufacturing practice — надлежащая клиническая практика) — международного стандарта этических норм и качества научных исследований. При использовании вакцины отмечают обстоятельства, при которых она была введена, а также регистрируют её номер.
К сожалению, существование большого количества фальсифицированных иммунных препаратов усиливает страх граждан, компрометирует медицинский персонал и снижает доверие населения к прививкам, что приводит к отказу от вакцинации и увеличению смертности и инвалидизации населения в связи с осложнениями различных инфекционных заболеваний (например, коклюш и корь).
Оптимальное расписание вакцинации в развитых странах приведено на рисунке.
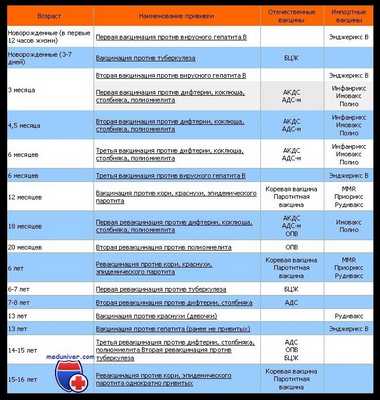
Календарь прививок у новорожденных и грудных детей
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вступление
Продолжающаяся в настоящее время пандемия новой коронавирусной инфекции 2019 года (COVID-19), вызванная коронавирусом 2 тяжелого острого респираторного синдрома SARS-CoV-2, унесла более 4 миллионов жизней (по данным на март 2021 года [1, 2]), и необходимость быстрого внедрения безопасных и эффективных вакцин против данного вируса остается очень высокой. Беспрецедентное в новейшей истории повсеместное распространение пандемии требует применения всех существующих вакцинных платформ, чтобы в конечном счете обеспечить доступность вакцин против SARS-CoV-2 для жителей каждой страны мира.
SARS-CoV-2 относится к подроду Sarbecovirus рода Betacoronavirus и семейству Coronaviridae [3]; в качестве основного рецептора для проникновения в клетки человека вирус использует ангиотензинпревращающий фермент 2 (АПФ2) [4, 5]. Диаметр заключенного в оболочку вириона SARS-CoV-2 составляет 100–150 нм; сам вирион имеет сферическую форму. В нем содержится несколько структурных белков: шипиковый гликопротеин (S), мембранный белок (M), белок оболочки (E), расположенный на поверхности, и белок нуклеокапсида (N), который связан с РНК внутри вирусной частицы. S-белок представляет собой трансмембранный белок слияния I типа, который во время синтеза подвергается значительному гликозилированию; протеаза хозяина расщепляет его на два фрагмента — S1 и S2. Фрагмент S1 содержит рецептор-связывающий домен (РСД), который взаимодействует с рецептором клетки хозяина (т.е. АПФ2). Фрагмент S2 необходим для слияния мембран после еще одного расщепления протеазами клетки хозяина и дальнейших структурных перестроек [6]. Благодаря этим свойствам шипиковый белок и его РСД являются основными мишенями для нейтрализующих антител организма хозяина (НАт) в процессе развития иммунного ответа [7].
Иммунный ответ на инфекцию SARS-CoV-2 активно изучается с целью разработки и улучшения как диагностики заболевания, так и создания и совершенствования вакцин. Как было выявлено в ходе экспериментов, титры НАт являются одними из основных маркеров защиты от SARS-CoV-2, поскольку адоптивный перенос очищенных IgG, которые были получены от выздоравливающих макак-резусов, дозозависимо способствовал формированию иммунной защиты от заражения SARS-CoV-2 у наивных макак-реципиентов [8]. Легкая или средняя степень тяжести течения COVID-19 приводит к выработке НАт, концентрация которых коррелирует с титрами IgG к РСД, определенными методом ELISA; данные титры НАт сохраняются примерно от двух-трех [9, 10] до пяти месяцев [11]. Учитывая возможность снижения концентраций антител после заражения, пристально исследуется более трудный для изучения клеточный компонент иммунитета.
Для разработки вакцин против COVID-19 тестируются многочисленные методы. В настоящее время наиболее часто применяются инактивированные вирусные векторные вакцины, вакцины на основе нуклеиновых кислот (РНК, ДНК) и белковые (субъединичные, вирусоподобные (ВПВ)) вакцины [12]. В качестве основных антигенов, вызывающих синтез НАт, в большинстве вакцин используются S-белок и РСД. Различные передовые технологии разработки вакцин уже продемонстрировали свой потенциал в плане предотвращения развития COVID-19, и несколько таких препаратов, таких как вакцины на основе мРНК и аденовирусные векторные вакцины, после успешного завершения клинических испытаний были одобрены для использования по всему миру [13, 14]. Тем не менее, разработка инактивированных вакцин как более традиционный метод является надежным и экономичным способом, имеющим долгую и успешную историю применения [15, 16]. В Центре Чумакова на культуре клеток Vero были успешно разработаны две инактивированные вакцины против клещевого энцефалита и полиомиелита [22, 23]. Таким образом, вакцина против COVID-19 создавалась на основе ранее отработанной платформы для культивирования клеток с использованием уже отлаженных методов.
Во всем мире разрабатывается несколько инактивированных вакцин против инфекции SARS-CoV-2, и по крайней мере пять из них успешно прошли доклинические и клинические испытания, и их применение было одобрено [17–20]. Тем не менее, несмотря на множество высококачественных публикаций о клинических испытаниях различных вакцин, подробных сведений об общей токсичности, репродуктивной токсичности, профилактической эффективности, иммуногенности и устойчивости иммунного ответа на животных моделях крайне мало.
В данной работе авторы провели оценку безопасности, иммуногенности и устойчивости иммунного ответа на вакцину «КовиВак», созданную на основе цельного вириона, инактивированного β-пропиолактоном, у грызунов и нечеловеческих приматов. У исследованных видов животных не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности, тератогенного действия, а также аллергенных свойств. Вакцина привела к формированию стабильного и сильного гуморального иммунного ответа как в виде специфических IgG к SARS-CoV-2, так и НАт у мышей линии BALB/c, сирийских хомячков и обыкновенных игрунок. В течение года титры НАт существенно не снизились. Профилактическая эффективность вакцины изучалась на сирийских хомячках. Надежность производственного процесса была продемонстрирована путем оценки четырех партий вакцины и сравнения их иммуногенных свойств на мышах.
Результаты
Производство и описание вакцины
Ранее был представлен процесс выделения и генетического описания вакцинного штамма AYDAR-1 [21]. Вирус удалось профильтровать на третьем пассаже и дополнительно очистить путем разбавления. Были созданы первичные, основные и рабочие посевные серии штамма (а именно пассажи под номерами 7, 8 и 9), которые были охарактеризованы в соответствии с национальными руководствами по производству вакцин.
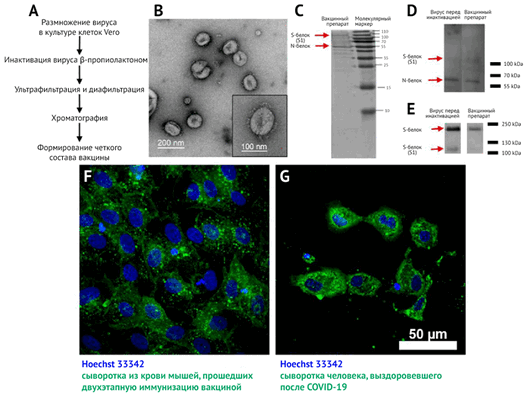
A — Основная последовательность процесса производства вакцины;
B — Трансмиссионная электронная микроскопия (ТЭМ) с негативным контрастированием концентрата инактивированной вакцины после хроматографической очистки; выделенная частица (внизу справа);
C — Электрофорез (SDS-PAGE) вакцинного препарата (очищенный инактивированный вирусный препарат после хроматографии), окрашенный кумасси синим;
D — Вестерн-блоттинг вирусного препарата перед инактивацией и вакцинный препарат (очищенный инактивированный вирусный препарат после хроматографии), окрашенный сывороткой человека-реконвалесцента после COVID-19;
E — Вестерн-блоттинг препарата вируса перед инактивацией и приготовлением вакцины (очищенный препарат инактивированного вируса после хроматографии), окрашенный анти-S-белковой сывороткой кролика;
F — культура клеток Vero, инфицированных SARS-CoV-2 и окрашенных сывороткой мыши, иммунизированной вакциной «КовиВак» (зеленое окрашивание на микрофотографии) и Hoechst 33342 (синее окрашивание на микрофотографии);
G — клетки Vero, инфицированные SARS-CoV-2 и окрашенные сывороткой человека-реконвалесцента после COVID-19 (зеленое окрашивание) и Hoechst 33342 (синее окрашивание).
Благодаря трансмиссионной электронной микроскопии (ТЭМ) (рис. 1B) с негативным контрастированием концентратов были обнаружены плеоморфные сферические вирусные частицы диаметром около 120 нм, покрытые шиповидными структурами длиной 16–20 нм.
Методом ТЭМ (рис. 1B) были подтверждены гомогенность и чистота вакцинного препарата и выявлены вирионы с шипиковыми белками, соотносящиеся по форме и размеру с таковыми, выявляемыми в других исследованиях [26, 27].
В ходе электрофореза SDS-PAGE и вестерн-блоттинга (ВБ) концентратов вакцин перед инактивацией и после хроматографии, окрашенных сыворотками реконвалесцентов после COVID-19 (рис. 1 C и D), были выявлены два основных белка в концентратах: N и S, которые должны содержаться и в препарате вириона. С помощью окрашивания сывороткой анти-S-белка (рис. 1E) были обнаружены две формы S-белка в вирусных препаратах до и после инактивации: S1 и полноразмерный S-белок. Это свидетельствует о том, что в вакцинном препарате присутствует антиген-мишень для индукции синтеза НАт.
Специфичность реактивности антител подтверждается отсутствием свечения (флуоресценции) в неинфицированных клетках культуры Vero.
Изучение эмбрио-, фетотоксичности и тератогенных эффектов в антенатальном и постнатальном периодах развития
Половину (N = 10 из каждой группы) животных в каждой группе умерщвляли на 20-й день беременности. Статистически значимых различий между исследуемыми группами по количеству желтых тел в яичниках, местах имплантации в матке, живым и мертвым плодам не было. Плоды сформировались нормально, топография всех исследованных органов была в пределах анатомической нормы, гистологическое строение соответствовало возрасту эмбрионов, развитие костей было нормальным. Патологических изменений органов и тканей обнаружено не было.
Другая половина (N = 10 из каждой группы) животных в каждой из трех групп вакцинированных была использована для выявления возможных нарушений эмбрионального развития, проявляющихся в постнатальном периоде. За потомством наблюдали в течение 60 дней после рождения. Проводилась оценка общего состояния потомства крыс, выживаемость, прибавка в весе, физическое развитие, сформированность сенсомоторных рефлексов, эмоционально-произвольного поведения и способности точно координировать движения. Соотношение самцов и самок в потомстве во всех группах было практически одинаковым (примерно 1: 1). Во всех исследуемых группах за весь период наблюдения (от рождения до двухмесячного возраста) смертность детенышей не превышала 4 % и достоверно не различалась между группами. В группах не было различий в физическом и неврологическом развитии детенышей крыс, а индивидуально обусловленные значения исследуемых показателей находились в пределах физиологической нормы.
Таким образом, вакцина «КовиВак» не оказала отрицательного влияния на общее состояние беременных крыс. Эмбриотоксических, фетотоксических или тератогенных эффектов обнаружено не было. Вакцинация не привела к увеличению смертности потомства и не повлияла на физическое и психологическое развитие детенышей крыс.
Безопасность
Существует множество тестов для оценки различных параметров безопасности разрабатываемых вакцин на животных моделях. Авторы выбрали классические модельные объекты для исследования безопасности (мыши, морские свинки, крысы и приматы). Для вакцины «КовиВак» проводилась оценка общей острой токсичности у трех видов (мышей, морских свинок и игрунок), хронической токсичности у двух видов (мышей и морских свинок) и гиперчувствительности у морских свинок. По сравнению с группой плацебо никаких изменений выявлено не было. Все показатели были в пределах физиологической нормы.
Существовали предположения о возможной репродуктивной токсичности вакцинных препаратов, содержащих S-белок SARS-CoV-2. Исходя из данных экспериментов авторов на крысах линии Wistar, был сделан вывод о том, что многократная иммунизация вакциной «КовиВак» до или во время беременности не оказывает отрицательного эффекта на внутриутробное или постнатальное развитие потомства.
Таким образом, вакцина «КовиВак» безопасна и может быть использована в клинических испытаниях на людях.
Иммунитет и его стойкость
Краткосрочная иммуногенность вакцины «КовиВак» была оценена на трех животных моделях (двух генетических линиях мышей, сирийских хомячках и обыкновенных игрунках), иммунизированных разными дозами. Вакцина индуцировала синтез НАт у всех изученных видов. Более того, у мышей были обнаружены антитела к двум основным структурным белкам вируса (S и N). В течение первых 2–4 недель не наблюдалось значительных различий между титрами НАт, синтез которых был вызван различными дозами антигена. Различия проявились начиная с пятой недели после первой иммунизации.
Как было отмечено выше, синтез НАт является одним из основных маркеров защиты от SARS-CoV-2 [8]. Следовательно, длительность антительного ответа (НАт) коррелирует с длительностью защиты. После естественного заражения, особенно в случае легкого течения инфекции, ответ в виде НАт довольно слабый и непродолжительный [11].
Сведений об устойчивости иммунитета, вызванного вакциной, очень мало. Хотя в опубликованных доклинических исследованиях показана индукция титров IgG и НАт к SARS-CoV-2 IgG вследствие введения различных вакцин, лишь в немногих работах содержатся данные о продолжительности иммунного ответа. Например, для препарата PiCoVacc (инактивированная вакцина), опубликованы результаты доклинических испытаний, согласно которым титр антител после вакцинации мышей и крыс сохраняется в течение шести недель, а у макак-резусов — до трех недель [25]. В работе, опубликованной Wang с соавт., анализ иммуногенности у животных был ограничен четырьмя неделями [27].
В случае вакцины-кандидата BBV152 измерение иммуногенности при трехдозовом режиме введения проводилось до 25-го дня [29]. Авторы провели оценку долгосрочной иммуногенности у мышей и игрунок в течение одного года. За этот период значительного снижения титров НАт обнаружено не было. Более низкие дозы вводимого антигена приводили к формированию более низкого титра НАт в течение длительного периода наблюдения. Хотя очевидно, что окончательные сведения о длительности иммунитета, обеспечиваемого вакцинами против COVID-19, будут получены в ходе длительных клинических исследований, в данной ситуации животные модели могут служить в качестве удобных суррогатных индикаторов на ранних этапах процесса разработки вакцины. В недавней работе, посвященной клиническому исследованию вакцины на основе мРНК компании Moderna, сообщается о существовании повышенного титра специфических антител в течение как минимум трех месяцев [30]. Согласно экспериментальным данным авторов статьи, вакцина «КовиВак» обеспечивала формирование стабильного длительного иммунитета у мышей и игрунок после двухкомпонентного режима введения препарата.
Профилактическая эффективность
В большинстве недавних исследований в качестве удобной и достоверно нелетальной животной модели профилактической эффективности вакцин против COVID-19 используется золотистый (сирийский) хомячок. У сирийских хомячков инфекция SARS-CoV-2 вызывает значительные патологические изменения в легких и, таким образом, поддерживает развитие стабильного постинфекционного гуморального иммунного ответа в экспериментах с пассивным переносом [35]. Более того, наблюдаемые иммуногистохимические изменения и характер потери массы тела у хомячков сходны с легкой формой инфекции SARS-CoV-2 у человека [36]. В ряде работ продемонстрирована пригодность сирийского хомячка в качестве модели для изучения профилактической эффективности НАт и вакцин против SARS-CoV-2 [37–46], хотя симптомы пневмонии у животного развиваются быстро и протекают тяжело.
Сирийский хомячок в качестве модельного объекта был использован для оценки профилактической эффективности нескольких инактивированных вакцин [47–48], в том числе одобренных для клинического применения [29]. К основным параметрам оценки относят вес животного и присутствие вируса и/или вирусной РНК в мазках из носа, легких и других органов в разные сроки после инфицирования.
В исследовании авторов животные из группы контроля теряли вес до пятого — седьмого дня с момента заражения, тогда как вакцинированные набирали вес с начиная с третьего дня после заражения, что соотносится с данными о BBV152 [29]. Однако потеря веса у контрольных животных в экспериментах авторов была более выраженной — 15 % против 2–10 % в исследовании BBV152. Скорость выведения вирусной РНК из верхних дыхательных путей также была сходной: начиная с седьмого дня после инфицирования в большинстве мазков из носа вирусная РНК не содержалась. Уровень вирусной РНК в легких контрольных животных был одинаковым в обоих исследованиях; по данным авторов, в органах всех контрольных животных содержалась вирусная РНК на четвертые, седьмые и 14-е сутки. Ткани легких вакцинированных животных в основном не содержали вируса: только у одного из пяти хомячков на четвертый и седьмой дни можно было выявить РНК вируса в легких; однако к 14-му дню ткань легких очищалась от вируса. Вирусная РНК была обнаружена в иных тканях (помимо легочной) у животных контрольной группы только на третий день после заражения. Аналогичные результаты были получены для вакцинного препарата BBV152 [29]. Таким образом, представленные результаты демонстрируют профилактическую эффективность вакцины «КовиВак» на модели сирийского хомячка.
Таким образом, для вакцины «КовиВак» не было обнаружено признаков острой/хронической, репродуктивной, эмбрио- и фетотоксичности или тератогенного влияния в антенатальном и постнатальном периодах развития, а также признаков гиперчувствительности у исследованных видов животных. Вакцина способствовала формированию стабильного и устойчивого гуморального иммунного ответа — как в виде специфических IgG к SARS-CoV-2, так и НАт у грызунов и обезьян. Значительного снижения титров НАт в течение одного года не наблюдалось. «КовиВак» продемонстрировала профилактический эффект по отношению к инфекции SARS-CoV-2 у сирийских хомячков. Эти данные стимулируют дальнейшее изучение вакцины «КовиВак» в клинических испытаниях.
Читайте также:
- Медленные инфекции. Медленные вирусные инфекции.
- Нарушения окисления жирных кислот
- Какой макияж отталкивает мужчин? Неудачный макияж
- Признаки беременности. Симптомы беременности. Предположительные ( сомнительные ) признаки беременности.
- Герминогенные опухоли яичников: классификация, герминогенные опухоли яичников клинические рекомендации
