Нарушения окисления жирных кислот
Добавил пользователь Алексей Ф. Обновлено: 10.01.2026
Жиры Жиры Углеводы, белки и жиры обеспечивают 90% сухой массы входящих в рацион продуктов и 100% их энергии. Все эти три вида питательных веществ дают энергию (измеряемую в калориях), но количество энергии. Прочитайте дополнительные сведения (липиды) служат важным источником энергии для организма. Отложенные в организме жиры постоянно расщепляются и вновь синтезируются, чтобы удовлетворить энергетические потребности организма с помощью доступной пищи. Некоторые ферменты помогают расщеплять жиры, чтобы они могли быть преобразованы в энергию.
Лечение нарушений окисления жирных кислот зависит от типа жировых веществ, которые накапливаются в крови и тканях.
Дефицит ацил-КоА-дегидрогеназы со средней длиной цепи (MCAD)
Это нарушение — одно из наиболее распространенных наследственных нарушений метаболизма, особенно среди людей североевропейского происхождения.
Симптомы дефицита MCAD обычно развиваются спустя 2–3 месяца после рождения. Вероятность появления симптомов у детей выше, если они остаются без пищи в течение определенного периода времени (что истощает другие источники энергии) или у них повышается потребность в калориях из-за физических упражнений или болезни. Уровень сахара (глюкозы) в крови значительно падает (гипогликемия), что приводит к спутанности сознания или коме. Ребенок ослабевает, может возникнуть рвота или судороги. В долгосрочной перспективе у детей может наблюдаться задержка умственного и физического развития, увеличение печени, ослабление мышцы сердца, нерегулярное сердцебиение. Может произойти внезапная смерть.
С 2007 года почти каждый штат в США требует, чтобы каждому новорожденному проводился анализ крови на наличие дефицита MCAD. Также могут быть выполнены исследования мочи и других тканей. Для подтверждения диагноза может быть проведен анализ ДНК.
Неотложное лечение приступа дефицита MCAD включает внутривенное введение декстрозы. Для долгосрочного лечения дети должны часто питаться, никогда не пропускать приемы пищи, употреблять пищу с высоким содержанием углеводов и низким содержанием жиров. Полезными могут оказаться пищевые добавки аминокислоты карнитина. Для профилактики слишком сильного снижения уровня глюкозы в крови может быть необходимо употреблять на ночь кукурузный крахмал. Долгосрочный прогноз, как правило, хороший.
Дефицит 3-гидроксиацил-КоА-дегидрогеназы с длинной цепью (LCHAD)
Этот дефицит — второе наиболее распространенное нарушение окисления жирных кислот. Он вызывает симптомы, аналогичные тем, которые вызываются дефицитом MCAD. У людей также может присутствовать прогрессирующее нарушение структуры и функции мышечных стенок камер сердца ( кардиомиопатия Общие сведения о кардиомиопатии Кардиомиопатией называется прогрессирующее нарушение структуры и функции мышечных стенок камер сердца. Различают три основных типа кардиомиопатии: Дилатационная кардиомиопатия, при которой происходит. Прочитайте дополнительные сведенияУ женщины, чей плод страдает дефицитом LCHAD, во время беременности часто отмечается гемолиз (разрушение эритроцитов), повышение уровня ферментов печени (что указывает на поражение печени) и снижение количества тромбоцитов ( синдром ГПНУТ Синдром ГПНУТ Преэклампсия — это новый эпизод или ухудшение имеющегося эпизода повышенного артериального давления, который сопровождается чрезмерным наличием белка в моче и развивается после 20-й недели. Прочитайте дополнительные сведения ).
Врачи ставят диагноз дефицита LCHAD, проводя анализы крови для выявления некоторых жирных кислот. Изучение клеток кожи проводится для измерения уровней некоторых ферментов. Также имеется генетический анализ Генетический скрининг Генетический скрининг используется для того, чтобы определить, имеет ли пара повышенный риск рождения ребенка с наследственными генетическими отклонениями. Наследственные генетические расстройства. Прочитайте дополнительные сведения , который используется для того, чтобы определить, имеет ли пара повышенный риск рождения ребенка с наследственным генетическим заболеванием.
Неотложное лечение приступа дефицита LCHAD предполагает восполнение потери жидкости и внутривенное введение глюкозы, постельный режим, а также пищевые добавки с аминокислотой карнитином. Для долгосрочного лечения дети должны часто питаться, избегать интенсивной физической нагрузки и употреблять пищу с высоким содержанием углеводов. Также детям назначают пищевые добавки с триглицеридами.
Дефицит ацил-КоА-дегидрогеназы с очень длинной цепью (VLCAD)
Это дефицит аналогичен дефициту LCHAD, но у людей обычно присутствует тяжелая кардиомиопатия.
Глутаровая ацидемия II типа
Врачи ставят диагноз глутаровой ацидемии II типа, проводя анализ крови, чтобы выявить накопление некоторых молекул. Изучение клеток кожи проводится для измерения уровней некоторых ферментов. Также имеется генетический анализ.
ПРИМЕЧАНИЕ: Это — пользовательская версия ВРАЧИ: Нажмите здесь, чтобы перейти к профессиональной версии
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Нарушения окисления жирных кислот
Нервная система при нарушении обмена биотина
Основные нарушения обмена витаминов с неврологическими проявлениями представлены в таблице ниже.
Нарушение метаболизма биотина вследствие дефицита метилкарбоксилазы (ДМК) приводит к тяжелым неврологическим нарушениям с гиперлактатемией. Характерными проявлениями являются кожная сыпь, алопеция и нарушения дыхания. Тем не менее, данные симптомы непостоянны, и диагноз должен быть подтвержден в любом случае гиперлактатемии (Baumgartner и Suormala, 2006). Нарушенный транспорт биотина через гематоэнцефалический барьер является причиной биотин-чувствительной болезни базальных ганглиев (БЧББГ), описанной в семьях из стран Ближнего Востока (Ozand et al., 1998).
В связи с тем, что заболевание поддается лечению биотином в очень высоких дозах, важна ранняя диагностика.
а) Биохимические и генетические изменения. Биотин выполняет роль кофактора четырех карбоксилаз человека: ацетил-СоА-карбоксилазы, пропионил-кофермент А карбоксилазы, бета-метилкротонил-кофермент А карбоксилазы и пируваткарбоксилазы. Известны изолированные дефекты как минимум трех ферментов. Два дефекта внутриклеточной утилизации биотина являются причиной ДМК: дефицит голокарбоксилазсинтетазы (ГКС) является нарушением биотинилирования апокарбоксилаз, дефицит биотинидазы является нарушением рециркуляции биотина.
ДМК приводит к характерной органической ацидурии, включающей лактат, метилкротонилглицин и дериваты пропионил-кофермента А. Ферментопатию можно выявить в лейкоцитах или культуре фибробластов, а активность биотинидазы можно определить в сыворотке. Возможна пренатальная диагностика данных двух аутосомных заболеваний. Описаны комплементарные ДНК (кДНК) биотинидазы и ГКС, выявлены мутации, вызывающие заболевание. Гены биотинидазы и ГКС расположены на 3р25 и 21q22.1 хромосоме (Aoki et al., 1995; Moslinger et al., 2003). БЧББГ не имеет биохимических маркеров. Данное заболевание связано с геном транспортера SLC19A3, расположенным на хромосоме 2q36.3 (Zeng et al., 2005).
б) Патофизиология. Патогенез неврологических изменений неясен. Энергетический дефицит в головном мозге, вызванный дисфункцией пируват карбоксилазы, и разнообразные токсические эффекты накопления органических кислот являются возможными патогенетическими механизмами, типичными для дефицита биотинидазы и ГКС. В головном мозге и спинномозговой жидкости человека отмечается низкая активность биотинидазы. Таким образом, нарушение пути рециркуляции биотина может быть причиной ранней депривации биотина в центральной нервной системе. Данный механизм может объяснить большую выраженность неврологического нарушения при недостаточности биотинидазы, чем ГКС.
Основная роль подтверждается тяжестью клинической и неврологической картины, описанной при БЧББГ.
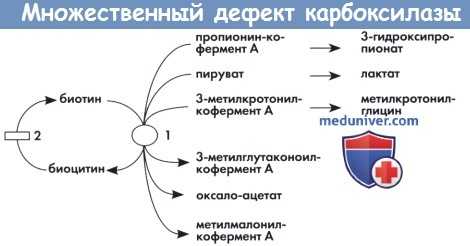
Ферментные блоки при множественном дефекте карбоксилазы.
Апокарбоксилазами являются пропионил-кофермент А карбоксилаза, пируват карбоксилаза и β-метилкротонил-кофермент А карбоксилаза.
1 — голокарбоксилаз синтетаза
2 — биотинидаза
в) Клинические проявления. ДМК характеризуется неврологическими симптомами, кожной сыпью и кетоацидозом, отмечающимся в периоде новорожденности или позднее в младенческом или детском возрасте. Несмотря на частичное совпадение возраста начала заболевания, большая часть форм, начинающихся в период новорожденности, связана с дефицитом ГКС, а более поздние формы — с дефицитом биотинидазы. Формы заболевания, начинающиеся в периоде новорожденности, характеризуются проявлениями, общими с другими ацидуриями с началом в периоде новорожденности. Формы заболевания с поздним началом могут проявляться как остро, так и скрыто.
При остром начале прогрессирующая оглушенность с гипотонией и атаксией развивается после интеркуррентных инфекций. Рефрактерные припадки являются наиболее частым проявлением и могут оставаться единственным симптомом в течение длительного времени. Эритематозная сыпь, алопеция, конъюнктивит или блефарит могут отмечаться на любом этапе болезни, которая прогрессирует, несмотря на возможность транзиторного выздоровления. Хронические формы проявляются стабильным прогрессированием или серией острых приступов, чередующихся с периодами выздоровления. Наиболее частым неврологическим проявлением является нестабильность походки, эпизоды атаксии, гипотонии и регресса развития.
Тонико-клонические или миоклонические припадки или аномальные движения могут развиваться в любое время и оставаться единственным проявлением в течение длительного времени (Wolf, 1995). Проблемы с дыханием с рецидивирующими инфекциями, необъяснимыми эпизодами учащения дыхания или рецидивирующим стридором могут свидетельствовать о синдроме Лея (Hoffman et al., 2005).
Биохимическая диагностика не вызывает затруднений, когда лактатацидоз сочетается со специфической органической ацидурией. Легкое нарушение интеллекта, персистирующая атаксия, атрофия зрительного нерва, аномалии вызванных зрительных потенциалов, поражение сетчатки и нейросенсорная тугоухость могут сохраняться несмотря на лечение, особенно у пациентов с дефицитом биотинидазы (Moslinger et al., 2003; Weber et al., 2004). Результаты КТ и MPT могут быть в пределах нормы или свидетельствовать о некотором отеке мозга, атрофии коры и отсроченной миелинизации у младенцев.
Отмечалась кальцификация базальных ганглиев или пониженная по сравнению с синдромом Лея плотность базальных ганглиев, которая может развиваться через несколько месяцев после неврологической деградации (Grunewald et al., 2004; Hoffman et al., 2005). При аутопсии можно выявить патологические проявления синдрома Лея и множество других признаков, обычных при других органических ацидуриях (Honavar et al., 1992).
БЧББГ был описан у 10 пациентов, родившихся у состоящих в кровном родстве родителей, урожецев Ближнего Востока. Заболевание проявлялось подострой энцефалопатией, начинающейся в детстве. В течение недель развивалась спутанность сознания с последующей утратой основных навыков, началом экстрапирамидной дистонии и пирамидного тетрапареза. У некоторых пациентов на начальном этапе заболевания отмечались генерализованные судороги. При МРТ мозга выявлялись единообразные признаки с двусторонним отеком и дальнейшим некрозом хвостатого ядра и скорлупы. Данный признак предшествовал появлению клинических симптомов у одного пациента, и оставался неизменным у всех пациентов после лечения. В спинномозговой жидкости отмечалось накопление лактата или любых других органических кислот (Ozand et al., 1998).
г) Лечение. Биотин при пероральном применении в очень больших дозах в течение нескольких дней приводит к обратному развитию всех клинических и биологических признаков у пациентов с ДМК. Потребность в биотине обычно составляет около 5-10 мг в сутки. Тем не менее, некоторым пациентам с выраженным дефицитом ГКС может потребоваться строгое ограничение приема белка и более высокие дозы биотина (Baumgartner и Suormala, 2006). У некоторых пациентов с сопутствующими дефекту биотинидазы симптомами отмечаются некоторые последствия в виде небольшой задержки умственного развития и нарушения зрения и слуха. С другой стороны, при проведении профилактического лечения отмечается нормальное развитие. Включение дефекта биотинидазы в неонатальный скрининг может быть полезным (Moslinger et al, 2003; Weber et al., 2004).
При БЧББГ раннее применение биотина в высоких дозах (5-10 мг в сутки) в течение нескольких дней приводит к обратному развитию всех неврологических изменений. Симптомы вновь появляются в течение месяца после прекращения приема биотина. Систематический прием биотина следует рекомендовать всем пациентом, у которых в младенческом возрасте отмечается двусторонний некроз стриатума (Straussberg et al., 2002).
Нервная система при нарушениях митохондриального окисления жирных кислот
Врожденные нарушения митохондриального окисления жирных кислот представляют собой группу заболеваний, влияющих на энергетический метаболизм во время голодания и метаболического стресса. Вследствие этого типичные проявления включают острую метаболическую декомпенсацию, возникающую на фоне голодания, рецидивирующие гипогликемии, синдромы, подобные синдрому Рея, и необъяснимую внезапную младенческую смерть. Хроническое поражение тканей, зависимых от жирных кислот, может приводить к миопатии и кардиомиопатии. Известно около 20 различных дефектов (Wanders et al., 1999; Tein 2002; Vockley, 2002; Longo et al., 2006).
а) Биохимические изменения. Общие пути митохондриального окисления жирных кислот и различные известные дефекты ферментов представлены на рисунке ниже. Длинноцепочечные жирные кислоты, трансформированные в соответствующие эфиры кофермента А, транспортируются в митохондрии с помощью специфического карнитинового переносчика ацил-карнитина, который включают карнитин-пальмитоилтрансферазу I и II (КПТ-1 и КПТ-II) и карнитин-ацил-карнитин транслоказу (КАТ). Ацилкофермент А со средними и короткими цепями легко диффундирует в митохондрии. Первичный дефицит карнитина, КПТ-I, КПТ-II и транслоказы нарушают митохондриальный транспорт длинноцепочечных жирных кислот и следовательно, бета-окисление и кетогенез.
Дальнейшее бета-окисление затрагивает четыре последовательных этапа с участием ферментов, специфичных к длине цепи. На первом этапе необходима специфическая ацил-кофермент А дегидрогеназа, дегидрогеназы очень-длинно-, длинно-, умеренно-длинно- и короткоцепочечного ацил-кофермента A (VLCAD, LCAD, MCAD, SCAD), которые трансформируют жирные кислоты ацил-кофермента А в еноил-кофермент А. Все четыре дегидрогеназы высвобождают электроны, которые проходят через систему транспорта электронов дыхательной цепи. Специфическая система переноса электронов распределена между другими дегидрогеназами флавопротедов: глутарил-кофермент А и изовалерил-кофермент А дегидрогеназами.
Три оставшихся этапа бета-оксиления длинноцепочечных жирных кислот могут протекать под действием единственного трехфункционального белка (ТФБ) для субстратов с длинными цепями или под действием монофункциональных ферментов — для субстратов с короткими и умеренными цепями. Каждый четырехэтапный цикл бета-окисления приводит к высвобождению ацетил-кофермента А, который участвует в цикле Кребса в таких тканях, как сердце и мышцы. В печени в случае голодания ацетил-кофермент А превращается в кетоны (кетогенез), которые переносятся в периферические органы, такие как мозг, для окончательного окисления (кетолиза) и высвобождения энергии. Известные дефекты митохондриального бета-окисления приведены в таблице ниже. Дефицит множественной ацил-кофермент А дегидрогеназы (МАД), также называемой глутаровой ацидурией II типа, вызван дефектом системы передачи электронов. Несколько альтернативных путей приобретают значимость при нарушении митохондриального бета-окисления.
Омега-оксиление в микросомах приводит к образованию характерных дикарбоновых кислот, а интрамитохондриальная конъюгация ацил-кофермента А с глицином и карнитином является важном механизмом детоксикации.
Биохимическая диагностика основана на выявлении аномальных дикарбоновых кислот и сопутствующих продуктов (глицина, карнитина) в моче. Глутаровая ацидурия и ацидурии органических кислот с разветвленными цепями сочетаются с дефицитом МАД. Следует подчеркнуть, что данные специфические показатели лучше всего выявляются при обострении, в то время как в стабильном состоянии наиболее достоверными тестами являются определение общего и эстерифицированного карнитина плазмы и аномальных показателей ацил-карнитина в плазме или в сухой капле крови. Определение скорости окисления жирных кислот в свежих лимфоцитах или культуре фибробластов используется для сужения диапазона поиска специфического дефекта, затем можно провести прямое ферментное исследование для уточнения диагноза. Большая часть дефектов выявляется в культуре фибробластов; тем не менее, определенные отклонения (такие как дефицит мышечной КПТ-1 и SCHAD) могут быть тканеспецифичными (Sim et al., 2002).
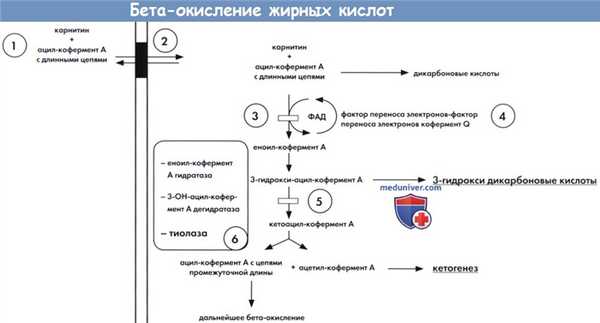
Упрощенная схема бета-окисления длинноцепочечных жирных кислот с указанием мест основных врожденных дефектов.
1 — первичный дефицит карнитина. 2 — карнитин ацилкарнитиновый шунт(карнитин-пальмитоилтрансфераза I и II, карнитин транслоказа).
3 — дегидротаза длинно- и сверхдлинноцепочечного ацил кофермента A (LCAD/VLCAD). 4 — система переноса электронов (МАД, глутаровая ацидурия II типа).
5 — дегидрогеназа длинноцепочечного 3 - гидрокси-ацил-кофермента A (LCHAD). 6 — трифункциональный белок.
Клинически острые проявления заболевания могут включать угрожающие жизни эпизоды гипокетоновой гипогликемии, кардиомиопатии и аритмии, кому и полиорганную недостаточность. Печеночная энцефалопатия с лактатацидозом и гипераммониемией часто путают с синдром Рея. Часто отмечаются миолиз и/или кардиомиопатия различной степени выраженности. В некоторых случаях стремительная неожиданная смерть может быть основанием для диагностики синдрома внезапной смерти младенцев. В большинстве случаев внезапное ухудшение состояния связано с гипокетоновой гипогликемией, лактатацидозом, гипераммониемией, признаками печеночной недостаточности и поражением мышц с повышением уровня креатинкиназы. Несмотря на коррекцию уровня глюкозы в крови, у некоторых пациентов может отмечаться персистирующая сонливость, припадки, дистонические движения или опистотонус вследствие сопутствующего отека головного мозга, что предполагает нейротоксическое действие повышенного уровня жирных кислот. Уровень смертности, особенно среди новорожденных, высокий. Среди выживших часто отмечаются бессимптомные промежуточные эпизоды. Иногда развивается хроническое поражение мышц и сердца или неврологические отклонения с припадками или задержкой развития.
г) Специфические проявления. У новорожденных кроме острых проявлений также встречался аномальный органогенез с дисморфическими проявлениями. Кистозная дисплазия головного мозга и почек и полимикрогирия отмечаются в некоторых случаях дефицита MAD и КПТ-П (North et al., 1995). При дефиците SCAD основные неврологические отклонения такие как гипертония, гиперактивность, нистагм и задержка развития предполагают тяжелое нарушение созревания головного мозга, вероятно, вызванные специфическим нейротоксическим действием метаболитов короткоцепочечных жирных кислот (Bhala et al., 1995; Tein 2002).
Мышечная слабость и рабдомиолиз в результате нарушения энергопродукции являются основными проявлениями нарушения окисления жирных кислот. При таких заболеваниях, за исключением дефицита КПТ-1, описана хроническая мышечная слабость с миопатией и накоплением липидов. При дефиците КПТ-П описана тяжеля миопатия новорожденных без поражения органов (Land et al., 1995). Мышечная слабость в сочетании с прогрессирующей гипертрофической и/или дилатационной кардиомиопатией является характерным проявлением системного дефицита карнитина, распространенного в младенческом возрасте. Описаны случаи позднего начала заболевания во взрослом возрасте в сочетании с сердечной аритмией. Легкая форма MAD во взрослом и подростковом возрасте характеризуется прогрессирующей мышечной слабостью и непереносимостью нагрузок. Диагностика очень важна, так как у некоторых пациентов отмечается улучшение в ответ на применение рибофлавина.
При нарушениях, затрагивающих окисление длинноцепочечных жирных кислот (например КПТ-II, VLCAD, LCHAD, TFP, M/SCHAD и MAD), часто отмечаются эпизоды острого рабдомиолиза и серьезные осложнения. Чаще всего встречается легкая форма дефицита КПТ-II у подростков и взрослых. Заболевание характеризуется приступами рабдомиолиза без поражения других органов и без мышечной слабости в промежутках между приступами. Обострения провоцируются длительными нагрузками, голоданием, интеркурентными инфекциями или нахождением на холоде. Поиск дефектов окисления жирных кислот и особенно дефицита КПТ-П должен быть систематическим и включать диагностическое обследование всех пациентов, у которых впервые развился рабдомиолиз. Рецидивирующие эпизоды миолиза существенно замедляют течение заболевания у пациентов с дефицитом трифункционального протеина или LCAD, у которых в противном случае может развиться прогрессирующая аксональная нейропатия и пигментная ретинопатия (den Boer et al., 2003; Spiekerkoetter et al., 2004; Tyni et al., 2004).
д) Лечение. Основным методом лечения является предотвращение голодания и катаболических состояний. Во время обострения следует немедленно начать внутривенное введение глюкозы (10-12 мг/кг в минуту). Нет однозначных подтверждений, что ограничение потребления жира эффективно при дефиците MCAD. С другой стороны, для пациентов с нарушением метаболизма длинноцепочечных жирных кислот, может быть эффективна диета с низким содержанием жира и поддерживающим приемом триглицеридов. У пациентов с первичным дефицитом карнитина поддерживающее применение карнитина (100-300 мг/кг в сутки) является жизненно необходимым, так как в течение нескольких месяцев приводит к улучшению работы мышц и сердца. При всех других нарушениях вторичный дефицит карнитина обычно компенсируется при дозировке 50-100 мг/кг в сутки. У некоторых пациентов с легкими формами дефицита MAD и SCAD может отмечаться положительный эффект при поддерживающем применении рибофлавина (100 мг/кг в сутки). Доказано, что поддерживающее применение докозагексаеновой кислоты эффективно для предотвращения нейропатии и ретинопатиии у пациентов с LCHAD/TFP. Возможно предотвращение мышечной боли или непереносимости нагрузок путем предварительного приема кукурузного крахмала или триглицеридов с цепями средней длины (Gillingham et al., 2006; Ogier de Baulny и Superti-Furga, 2006).
Причины нарушений в дыхательной цепи
Дыхательная цепь является основной биохимической системой, используемой для получения аэробной энергии всеми эукариотическими организмами. У человека нарушение данных процессов является причиной множества различных митохондриальных болезней, при которых обычным проявлением является нарушение продукции АТФ наряду с недостаточным снабжением энергией одной или нескольких тканей или органов. Эффект варьирует в различных тканях в соответствии с зависимостью от окислительного фосфорилирования.
Мышечная ткань в целом более чувствительна к снижению поступления АТФ, что приводит к появлению различных симптомов, таких как птоз, офтальмоплегия, мышечная слабость, непереносимость нагрузки и кардиомиопатия. Центральная нервная система также весьма чувствительна к дефициту АТФ, приводящему к энцефалопатии, сенсоневральным изменениям и периферической нейропатии. В зависимости от распространенности и выраженности дефекта возможно поражение и других тканей. Чаще всего поражаются почки, печень и ткани желудочно-кишечного тракта.
Клинические проявления митохондриальных заболеваний чрезвычайно гетерогенны. Заболевания могут поражать единичные органы или ткани, но чаще всего проявляются мультисистемными отклонениями, среди которых синдромы, регистрируемые на протяжении нескольких лет (Zeviani и Di Donato 2004; DiMauro и Hirano 2005).
а) Функциональная структура дыхательной цепи. Митохондриальная дыхательная цепь представляет собой группу из пяти ферментных комплексов, встроенных во внутреннюю митохондриальную мембрану. Каждый комплекс состоит из множества полипептидных субъединиц и простетической группы. Кроме того, в состав дыхательной цепи входят два переносчика электронов, коэнзим Q10 и цитохром С. Дыхательная цепь организована таким образом, чтобы служить акцептором электронов от НАДН и ФАДН,, что снижает воздействие факторов, образующихся в процессе промежуточного метаболизма.
Электроны переносятся вдоль дыхательной цепи и соединяются с молекулярным кислородом с образованием воды. Одновременно высвобождающаяся при переходе энергия используется комплексами I, III и IV для переноса протонов (Н+) из митохондриального матрикса в межмембранное пространство. Комплекс V позволяет протонам вернуться в митохондриальный матрикс и использует высвобождаемую энергию для синтеза АТФ из АДФ и минерального фосфата (Chinnery и Schon, 2003; DiMauro и Schon, 2003).

Пируватный цикл Кребса и нарушения дыхательной цепи.
1 — пируват дегидрогеназа. 2 — пируват карбоксилаза. 3 — фумараза.
4 — альфа- кетоглутаратдегидрогеназа. 5 — фактор переноса электронов и фактор переноса электронов кофермент Q дегидрогеназа.
б) Генетические изменения. Приблизительно 90 белковых субъединиц, которые составляют пять комплексов, находятся под двойным генетическим контролем и включают белки, кодируемые ядерной ДНК (яДНК) или митохондриальной ДНК (мтДНК); исключением является комплекс II, который полностью кодируется яДНК. Человеческая мтДНК содержит гены 13 OXPHOS субъединицы (то есть дыхательную цепь, цепь переноса электронов), а также 22 транспортных РНК (тРНК) и две рибосомальных РНК (рРНК), необходимых для внутримитохондриального синтеза. Оставшиеся структурные белки кодируются яДНК, которая также кодирует сотни дополнительных факторов, необходимых для экспрессирования, транспорта и сборки белковых субъединиц, а также для синтеза, экспрессирования и стабилизации мтДНК.
Кроме того, митохондрии не являются статическими органоидами и другие факторы, кодируемые в ядре, регулируют их подвижность, деление и слияние. Установлено, что в общей сложности для работы дыхательной цепи необходимо около 1000 отдельных белков, в основном кодируемых яДНК, мутации которых потенциально являются причинами менделирующих наследственных заболеваний.
Следовательно, митохондриальные заболевания могут быть вызваны мутациями как мтДНК, так и яДНК. Тем не менее, неотличимые клинически заболевания могут быть вызваны отдельными мутациями разных генов в разных геномах. С другой стороны, одна специфическая мутация может приводить к формированию индивидуально варьирующих клинических симптомов.
в) Мутации мтДНК. Данные изменения включают точечные мутации и крупные реаранжировки. Точечные мутации впервые были описаны в генах, кодирующих различные тРНК, что приводило к широко распространенному нарушению синтеза белка. Такие мутации обычно гетероплазматические, наследуются от матери и сочетаются с различными мультисистемными нарушениями. Описаны точечные, приводящие к развитию заболевания, мутации гена 12S рРНК.
Точечные мутации в генах, кодирующих белки, поражают одну из кодируемых в митохондриях субъединиц комплекса I (НАДН дегидрогеназы), комплекса III (цитохрома b), комплекса IV (ЦОГ) или комплекса V (АТФазы 6). У пациентов отмечается склонность скорее к специфически мышечным изменениям, чем к мультисистемным нарушениям, и не выявляется наследование от матери. Тем не менее, ND5, кодирующий 5 субъединицу I комплекса, является участком возникновения множества точечных мутаций, сочетающихся с различными мультисистемными нарушениями.
Значительные перестановки включают уникальные делеции/дупликации мтДНК. Их размер индивидуален, но всегда приводит к делеции нескольких генов, кодирующих белки и тРНК. Данные мутации имеют склонность к спонтанному возникновению и являются гетероплазматическими. Тем не менее, в некоторых случаях возможно наследование от матери с различным фенотипическим экспрессированием у больной женщины и ее потомства.
г) Мутации ядерных генов. Данные изменения включают мутации генов, кодирующих субъединицы комплексов, вспомогательные белки, белковые факторы, необходимые для внутригеномной передачи сигнала, и белковые факторы, необходимые для поддержания мембраны и подвижности митохондрий. Данные мутации являются причиной менделевских аутосомно-рецессивных, доминантных или сцепленных с Х-хромосомой наследственных заболеваний.
Все в большем количестве выявляются мутации генов, кодирующих субъединицы дыхательной цепи. Различные мутации генов, кодирующих субъединицы комплекса I (NDUFS и NDUFV) и комплекса II (SDHA), в основном являются причиной синдрома Ли или подобного синдрома. Выявлены мутации генов (АРТХ, PDSS2, COQ2), кодирующих ферменты, участвующие в биосинтетическом пути кофермента Q10 (Lopez et al., 2006).
Единственный известный ядерный ген, изменения которого принимают участие в формировании дефицита комплекса III, кодирует дополнительный белок, необходимый для соединения единиц. Мутации являются причиной ранних и тяжелых мультисистемных заболеваний, впервые описанных среди жителей Турции; данное заболевание в Финляндии, где отмечается его высокая частота, также называют GRACILE синдром (задержка роста, аминоацидурия, холестаз, избыток железа, лактатацидоз и ранняя смерть). Мутации гена SURF1, отвечающего за сборку ЦОГ, часто сочетаются с синдромом Ли, вызванным дефицитом комплекса VI. Мутации других четырех генов (SCO1, SCO2, СОХ10, СОХ15), отвечающих за сборку ЦОГ, были описаны у пациентов, страдающих энцефалопатией, подобной синдрому Ли, и другими поражениями внутренних органов.
Отдельная форма синдрома Ли с дефицитом ЦОГ, вызванного мутациями гена LRPPRC, была описана в семьях франкоканадцев.
У пациентов с дефицитом мышечной ЦОГ и этилмалоновой ацидурией отмечалась мутация гена ETHE1. В конечном счете изменение гена АТР12 приводит к повреждению сборки комплекса V и становится причиной смертельной энцефалопатии.

в) Мутации в генах, кодирующих факторы внутригеномной передачи сигнала. Данные менделевские заболевания с качественными (делеции) или количественными (деплеции) повреждениями мтДНК являются результатом дисбаланса поступления деоксирибонуклеотидов в митохондрии (Alberio et al., 2007). В патогенезе синдромов митохондриальной деплеции (СМД) участвуют пять генов, ген тимидинкиназы (ТК2) при миопатических формах, ген β-субъединицы АДФ-образующей сукцинил кофермент А синтетазы (SUCLA2) при энцефалопатических формах и ген каталитической субъединицы полимеразы мтДНК (POLG) и MPV17 при гепатоцеребральных формах.
Описано четыре гена в поражениях с множественными делециями или деплециями. Мутации полимеразной части гена POLG встречаются при гетерогенной группе синдромов (Horvath et al., 2006). Это наиболее частая причина прогрессирующей наружной офтальмоплегии, кроме того они сочетаются с большим количеством клинических проявлений, включая синдром Альперса (заболевание, встречающееся в детском возрасте и характеризующееся печеночной недостаточностью и поражением серого вещества) (Gordon, 2006), SANDO (сенсорная атаксическая нейропатия, дизартрия, офтальмоплегия), глухоту, гипогонадизм, припадки, миоклонус, нарушение моторики желудочно-кишечного тракта, имеющее сходство с синдромом MNGIE (митохондриальной нейрогастроинтестинальной энцефаломиеолопатией) и, что важно, паркинсонизм.
Ген, ответственный за синдром MNGIE, кодирует фермент тимидинфосфорилазу (ТФ) (Hirano et al., 2005) и к настоящему моменту уже описано множество его мутаций. Два других гена являются причиной аутосомно-доминантной прогрессирующей внешней офтальмоплегии и множественных делеций ДНК в мышцах, в частности, ген ANT1, кодирующий изоформу транспортера адниннуклеотида, и ген twinkle, кодирующий митохондриальную хеликазу.
Мутации дополнительных ядерных генов являются причиной дефекта синтеза митохондриальных белков. Ген EFG1, кодирующий фактор элонгации, и ген MRPS16, кодирующий митохондриальную рибосомальную субъединицу, связаны с развитием раннего гепатоцеребрального синдрома. Ген PUS1, кодирующий митохондриальный фермент псевдоуридинсинтетазу, связан с миопатией, лактатацидозом и сидеробластной анемией (MI.ASA) (Bykhovskaya et al., 2004).
Несмотря на возрастающее количество информации следует подчеркнуть, что молекулярные исследования все еще не позволяют идентифицировать генетический дефект у 80-90% пациентов детского возраста, у которых в соответствии с клиническими, биологическими и морфологическими признаками имеются нарушения дыхательной цепи.
г) Биологические проявления и диагностические тесты. В педиатрической популяции большая часть (90%) доказанных дефектов дыхательной цепи проявляется повышением уровня лактата в крови, мочевины — в спинномозговой жидкости, часто в сочетании с повышением соотношения лактат: пируват, что свидетельствует о изменении клеточного окислительно-восстановительного статуса. МР спектроскопия головного мозга является неинвазивным и эффективным методом оценки накопления лактата. Кроме того, она позволяет легко диагностировать редко встречающийся дефицит комплекса II по наличию аномального пика сукцината (Lin et al., 2003; Brockmann et al., 2005). У некоторых пациентов в состоянии покоя лактатацидоз не развивается, это зависит от выраженности энергетических нарушений, поражения органов и является следствием первичного дефекта скорости окисления. В некоторых случаях лактатацидоз может быть спровоцирован инфекцией или нагрузочным тестом с глюкозой.
У таких пациентов (обычно с непереносимостью нагрузки) может развиться тяжелая гиперлактацидемия после нетяжелых физических нагрузок. Тем не менее, лактатацидоз не является необходимым признаком заболевания, особенно в позднем детском или подростковом возрасте. Помимо обычной лактатурии, в редких случаях отмечается аномальная экскреция с мочой промежуточных продуктов цикла Кребса, таких как фумарат, альфа-кетоглутарат, сукцинат или 3-метилглутаконовая кислота. Легкая метилмалоновая ацидурия выявлялась в сочетании с мутацией гена SUCLA2, отвечающего за деплецию мтДНК (Carrozzo et al, 2007; Ostergaard et al., 2007). Этилмалоновая ацидурия является признаком этилмалоновой энцефалопатии (состояния, включающего выраженный дефицит комплекса IV в мышцах). Высокие уровни тимидина, деоксиуридина и урацила в крови и моче свидетельствуют о синдроме MNGIE с дефицитом тимидинфосфарилазы. Дефицит карнитина в сыворотке и мышцах может отражать недостаточность окисления жирных кислот. Уровень креатинкиназы (обычно умеренно повышенный) может быть высоким при миопатических формах синдрома деплеции мтДНК (СДМ).
МР спектроскопия может быть полезна у детей старше восьми лет, подростков и взрослых. Оценка соотношения фосфокреатина и минерального фосфора позволяет выявить дефект синтеза АТФ при мышечной нагрузке.
У пациентов с явно выраженным клиническим синдромом диагноз может подтверждаться простым молекулярным генетическим тестированием образцов ДНК. Образцами служат синдром MNGIE (ТР), младенческая энцефалогепатопатия (DGUOK) и младенческая энцефалотубулопатия (DCS1L). Обследование остальных пациентов является более сложным, особенно в связи с тем, что патогенетические мутации могут не определяться в анализе крови. При подозрении на митохондриальную болезнь следует проводить биопсию мышц (Chinnery и Schon, 2003).
Гистохимическое исследование с помощью окраски по Гомори, окраски цитохром С оксидазы и сукцинат-дегидрогеназы (СДГ) позволяет выявить митохондриальную пролиферацию и мозаицизм, что предполагает мутации мтДНК и дефицит комплексов II и IV.
Биохимические исследования включают два основных неисключительных теста с использованием обогащенной митохондриями фракции свежих тканей при полярографических исследованиях или с использованием замороженных тканей для анализа индивидуальной активности ферментов дыхательной цепи с помощью спектрофотометрии. Для исследований чаще всего используются образцы скелетных мышц. Тем не менее, возможно проведение специфических исследований на фибробластах, клетках крови, печени, почек и головного мозга. Теоретически для исследования подходит любая клинически пораженная ткань, т. е. при гепатоэнцефалопатии рекомендовано исследование образца печени. В случае сомнительных результатов биохимического анализа при выраженных клинических проявлениях следует провести исследование нескольких тканей.
При структурном подходе молекулярное исследование следует начинать с саузерн-блоттинга мтДНК для поиска перегруппировок мтДНК и серии аллель-специфических тестов для поиска часто встречающихся точечных мутаций. Дальнейший молекулярный скрининг с учетом клинического фенотипа, семейного анамнеза и результатов биохимических тестов, должен способствовать определению возрастающего количества заболеваний, что обеспечит более точное генетическое консультирование (Chinnery и Schon, 2003; DiMauro et al., 2004b). Основной проблемой точной диагностики митохондриальных заболеваний является отсутствие определенных биомаркеров, которые характеризуют заболевание у всех пациентов. Для улучшения интерпретации были разработаны диагностические схемы для младенцев и детей с целью разграничить вероятность митохондриального заболевания у конкретного пациента на определенную, возможную, вероятную или маловероятную (Bernier et al., 2002, Wolf и Smeitink, 2002).
Расстройства цикла бета-окисления
Расстройства цикла бета-окисления (см. таблицу Расстройства транспорта жирных кислот и митохондриального окисления ) являются одними из нарушений обмена жирных кислот и глицерина Обзор нарушений метаболизма жирных кислот и глицерина (Overview of Fatty Acid and Glycerol Metabolism Disorders) Жирные кислоты являются предпочтительным источником энергии для сердца и важным источником энергии для скелетных мышц при длительной нагрузке. Кроме того, во время голодания большая часть энергетической. Прочитайте дополнительные сведения .
Ацетил-КоА генерируется из жирных кислот путем повторяющихся бета-оксидазных циклов. Набор 4 ферментов (ацил-дегидрогеназа, гидратаза, гидроксиацил дегидрогеназа и лиаза), специфичных для цепей различной длины (очень длинные цепи, длинные цепи, средние цепи и короткие цепи), требуется для полного катаболизирования жирных кислот. Наследование всех дефектов окисления жирных кислот аутосомно-рецессивное Аутосомно-рецессивные Генетические нарушения, вызванные изменениями в одном гене («Менделевские нарушения»), являются самыми простыми для анализа и наиболее хорошо поняты. Если экспрессия признака требует только. Прочитайте дополнительные сведения .
Дефицит среднецепочечной ацил-КоА дегидрогеназы (MCADD)
Этот дефицит является наиболее распространенным дефектом в цикле бета-окисления.
Клинические проявления обычно возникают после 2–3 месяцев ячного возраста и обычно следуют за эпизодом голодания (хотя бы 12 часов). У пациентов возникают рвота и сонливость, которые могут быстро прогрессировать до судорог, комы, а иногда и смерти (что также может выглядеть как синдром внезапной детской смерти). Во время приступов у пациентов отмечаются гипогликемия, гипераммониемия и неожиданно низкое содержание кетонов в моче и сыворотке. Метаболический ацидоз часто присутствует, но может быть поздним проявлением.
MCADD диагностируется на основании обнаружения конъюгатов карнитина среднецепочных жирных кислот в плазме или глицина в моче или путем обнаружения дефицита ферментов в культуре фибробластов; однако изучение ДНК может подтвердить диагноз в большинстве случаев. MCADD теперь входит в рутинный неонатальный скрининг Скрининговые тесты для новорождённых Рекомендации по скринингу новорожденных зависят от клинических условий и государственных стандартов. Определение группы крови показано, если мать имеет кровь группы 0 или резус-отрицательную. Прочитайте дополнительные сведения во всех штатах США.
Лечение острых приступов внутривенным введением 10%-ного раствора декстрозы, в 1,5 раза превышающего поддерживающий уровень жидкости ( Поддерживающее введение жидкости Поддерживающее введение жидкости Обезвоживание – значительное уменьшение количества жидкости в организме и, в разной степени, электролитов. Клинические проявления включают следующие: жажда, вялость, сухость слизистых оболочек. Прочитайте дополнительные сведения ); некоторые врачи также выступают за добавление карнитина во время острых эпизодов. Профилактика состоит в применении диеты с низким содержанием жиров и высоким – углеводов и избегании длительного голодания. Терапия кукурузным крахмалом часто используется, чтобы обеспечить запас безопасности во время ночного голодания.
Недостаточность длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы (НДЦГАН)
Этот недостаток является вторым наиболее распространенным дефектом окисления жирных кислот. Он разделяет многие черты MCADD, но пациенты также могут иметь кардиомиопатии; рабдомиолиз, значительное увеличение креатинкиназы и миоглобинурии при мышечном напряжении; периферическую нейропатию и нарушение функции печени. У матерей, беременных плодом с дефицитом LCHAD, часто наблюдается HELLP-синдром Диагностика Преэклампсия представляет собой впервые возникшую после 20 недель беременности гипертензию на фоне протеинурии, либо усугубление тяжести уже имеющейся гипертензии. Эклампсия – необъяснимые генерализованные. Прочитайте дополнительные сведения (гемолиз, повышенные уровни печеночных ферментов и низкое содержание тромбоцитов) во время беременности.
Диагноз LCHADD основан на присутствии избытка длинноцепочечных гидроксикислот по анализу органической кислоты и на присутствии конъюгатов карнитина в профиле ацилкарнитина или конъюгатов глицина в профиле ацилглицина. Диагноз LCHADD может быть подтвержден путем исследования ферментов фибробластов кожи или генетическим тестированием. LCHADD теперь входит в рутинный неонатальный скрининг Скрининговые тесты для новорождённых Рекомендации по скринингу новорожденных зависят от клинических условий и государственных стандартов. Определение группы крови показано, если мать имеет кровь группы 0 или резус-отрицательную. Прочитайте дополнительные сведения во всех штатах США.
Лечение во время обострений включает гидратацию, высокие дозы глюкозы, постельный режим, подщелачивание мочи и прием добавок карнитина. Длительное лечение включает в себя диету с высоким содержанием углеводов, добавок среднецепочных триглицеридов, а также исключение голодания и физических нагрузок.
Дефицит очень длинноцепочечный ацил-СоА-дегидрогеназы (VLCADD)
Этот дефицит похож на LCHADD, но обычно связан со значительными кардиомиопатиями.
Глутаровая ацидемия типа II
Дефект в передаче электронов от кофермента жирных ацильных дегидрогеназ к электронной транспортной цепи повреждает реакции, вовлекающие жирные кислоты с цепью любой длины (множественный дефицит ацил-КоА дегидрогеназ); окисление нескольких аминокислот также затронуто.
Клинические проявления, таким образом, включают гипогликемию натощак, тяжелый метаболический ацидоз и гипераммониемию.
Глутаровая ацидемия типа II диагностируется на основании увеличения уровня этилмалоновой, глутаровой, 2- и 3-гидроксиглутаровой и других дикарбоновых кислот при анализе на органические кислоты, а также глутарила, изовалерила и других ацилкарнитинов в исследованиях с тандемной масс-спектрометрией. Подтвержающим тестом может быть анализ ДНК.
Лечение глутарового типа ацидемии II аналогично лечению MCADD, за исключением того, что рибофлавин может быть эффективным для некоторых пациентов.
Дополнительная информация
Ниже следует англоязычный ресурс, который может быть информативным. Обратите внимание, что The manual не несет ответственности за содержание этого ресурса.
Online Mendelian Inheritance in Man® (OMIM®) database: полная информация о генах и их молекулярной и хромосомной локализации
Читайте также:
- Результаты шунтирования гидроцефалии. Осложнения
- Генетика семейной гиперхолестеринемии. Наследование, молекулярные основы
- Диагноз многовалентного абдоминального синдрома. Синдром трех перекрестков
- Связывание лекарств с белками плазмы. Распределение лекарства при передозировке
- Обзор принципов фармакотерапии в педиатрии
