Исследование переносимости к гепарину - методика, показатели нормы
Добавил пользователь Евгений Кузнецов Обновлено: 16.01.2026
Для цитирования: Макаров В.А., Кондратьева Т.Б. ПРИМЕНЕНИЕ ГЕПАРИНОВ В КЛИНИЧЕСКОЙ ПРАКТИКЕ. РМЖ. 1998;3:4.
Статья посвящена вопросам профилактики и лечения тромбозов и нарушений микроциркуляции. Описываются гепарины – антикоагулянты приямого действия, получившие наибольшее распространение в мировой клинической практике.
The paper deals with the prevention and treatment of thromboses and microcirculatory disorders, outlines heparins, direct-acting anticoagulants, which are widely used clinical practice all over the world.
Проф. В.А. Макаров, Т.Б. Кондратьева Гематологический центр ВГНЦ, Московская медицинская академия им. И.М. Сеченова
Prof. V.A. Makarov, T.B. Kondratyeva All-Russian Heparinology Research Center, I.M. Sechenov Moscow Medical Academy
П роблемы профилактики и лечения тромбозов, а также нарушений микроциркуляции имеют важное значение для клинической практики. В России и странах СНГ отмечается неуклонный рост числа больных с заболеваниями, сопровождающимися тромбозами и эмболиями. К подобным заболеваниям относятся инфаркт миокарда, тромбозы сосудов конечностей, мозга, легких, глаз и др. Часто тромбоз возникает после оперативных вмешательств, особенно на фоне использования аппаратов искусственного кровообращения. Показано, что причиной тромбоза может быть не только повреждение сосудистой стенки, но и патологические изменения ферментов свертывания крови и естественных антикоагулянтов. Активация свертывающей системы крови (т.е. ферментов, активирующих фибринообразование) характерна и для ДВС-синдрома. Последний является наиболее распространенной формой патологии гемостаза. Он часто встречается при многих заболеваниях и патологических состояниях, в частности при инфекционных болезнях, шоке, травматичных хирургических вмешательствах, терминальных состояниях, акушерской патологии, злокачественных опухолях, деструктивных процессах в органах и тканях, иммунной и иммунокомплексной патологии, острых аллергических реакциях, после обильных кровотечений, массивных гемотрансфузий, при передозировке лекарственных средств с прокоагулянтной активностью и др. [1].
В связи с этим в указанных клинических ситуациях возникает необходимость использования веществ, препятствующих фибринообразованию, т. е. антикоагулянтов. Наибольшее распространение в клинической практике всего мира получили гепарины, относящиеся к группе антикоагулянтов прямого действия (т. е. взаимодействующих непосредственно с факторами свертывания крови).
Гепарины – это различающиеся по молекулярной массе гликозаминогликаны, состоящие из сульфатированных остатков Д-глюкозамина и Д-глюкуроновой кислоты. Эти полимеры образуются в организме человека и животных и содержатся в основном в тучных клетках. Впервые они были обнаружены в 1916 г. J. McLean. В 1918 г. W. Howel и E. Holt выделили этот антикоагулянт из печени собаки (отсюда название – "гепарин"). Клиническое применение гепарина стало возможным после 1930 г., когда были получены его натриевые соли.
Механизм антикоагулянтного действия гепаринов зависит от молекулярной массы. В нефракционированных препаратах (препаратах первого поколения) под названием "гепарин" преобладают высокомолекулярные фракции гликозаминогликана. Действие этих препаратов связано с тем, что они образуют комплекс с антитромбином III, ведущий к возрастанию способности последнего ингибировать тромбин, фактор Хагемана, факторы IX, X, XI и др.
Низкомолекулярные фракции гепарина (менее 6 кД), содержащиеся в таких препаратах, как надропарин, даль- тепарин, эноксипарин, ревипарин и др., обладают иным механизмом антикоагулянтного действия. Последний связан в основном с ингибированием активности фактора Ха. В меньшей степени эти препараты влияют на активность фактора IIа (тромбина) и других факторов свертывания крови. Следует отметить, что для профилактики тромбообразования торможение активности фактора Ха более выгодно, чем воздействие на нижележащие фазы фибринообразования (см. рисунок), так как требует меньшего количества препарата.
Гепарины долгое время выделяли из печени и легких крупного рогатого скота, затем из кишечника свиней, что оказалось выгоднее. Низкомолекулярные гепарины производят путем деполимеризации высоко- и среднемолекулярных полимеров.
В настоящее время основными показаниями для проведения гепаринотерапии определены венозные тромбозы, тромбоэмболия легочной артерии, ДВС-синдром, нестабильная стенокардия, острый инфаркт, ишемический инсульт. С профилактической целью препараты гепарина используют при хирургических вмешательствах, при недостаточности кровообращения, для профилактики свертывания крови при использовании экстракорпорального кровообращения. Таким образом, препараты гепарина применяются у значительного контингента больных.
Несмотря на то что гепаринотерапия проводится уже в течение 6 десятков лет и препараты гепарина доминируют и сегодня над другими антикоагулянтами прямого действия, лечение гепаринами сопряжено с риском возникновения ряда осложнений. В первую очередь – это возникновение кровотечений. Кровотечения при гепаринотерапии связаны не только с избыточной ингибицией фибринообразования, но и с тем, что на фоне данной терапии развивается тромбоцитопения. При этом возможны два варианта тромбоцитопении. При первом варианте кратковременная, быстрокупирующаяся после отмены гепарина тромбоцитопения связана с его способностью активировать агрегационную функцию тромбоцитов, потенцировать действие других стимуляторов агрегации и ослаблять анатиагрегационный эффект простациклина. При втором иммунном варианте наряду с повышенной внутрисосудистой агрегацией и потреблением тромбоцитов в микротромбы выявляются специфические аутоантитела к определенным тромбоцитарным рецепторам.
К числу других осложнений гепаринотерапии относятся аллергические реакции, остеопороз, приапизм, а также снижение уровня антитромбина III.
В последние годы проведено большое количество сравнительных исследований по оценке эффективности, безопасности и удобства клинического использования нефракционированных и низкомолекулярных препаратов гепарина. Установлено, что гепарины низкой молекулярной массы обладают большей биодоступностью (более чем в 3 раза) при подкожном введении, чем нефракционированные препараты. Период полувыведения в 2 – 4 раза больше у низкомолекулярных гепаринов, что способствует удлинению срока действия препарата. В связи с этим препараты низкомолекулярных гепаринов можно вводить 1 – 2 раза в сутки. Различия в фармакокинетике объясняются меньшей склонностью низкомолекулярных гепаринов связываться с белками плазмы, такими как богатый гистидином гликопротеин, тромбоцитарный фактор 4, витронектин, фибронектин, фактор Виллебранда и др. Таким образом, препараты нефракционированного гепарина удаляются в две фазы: фазу быстрого насыщения, т. е. связывания с белком, и фазу почечного клиренса. Гепарины же низкой молекулярной массы почти полностью удаляются почками.
Препараты нефракционированного гепарина вводят внутривенно, в виде капельных инфузий, подкожно, внутримышечно. Низкомолекулярные гепарины вводят подкожно, внутримышечно, а некоторые препараты и перорально.
К преимуществам гепаринов с низкой молекулярной массой относится меньшая вероятность развития тромбоцитопении. Возможно, в значительной степени с этим связан тот факт, что при использовании этих препаратов наблюдается меньший процент геморрагических осложнений. На основе этих закономерностей лечение низкомолекулярными гепаринами не нуждается в таком тщательном лабораторном контроле, как лечение нефракционированными препаратами.
Часто в качестве лабораторного контроля эффективности препарата определяют время свертывания и рекальцификации цельной крови, частичное тромбопластиновое время в различных модификациях, активированное время свертывания. Однако эти методики не отличаются высокой восприимчивостью. Они мало чувствительны к низким концентрациям гепарина в крови. Несколько более восприимчив тест активированного частичного тромбопластинового времени (АЧТВ), а также тромбинового (а лучше тромбинкальциевого) времени. При использовании теста АЧТВ показано, что при гепаринотерапии (нефракциониравонным гепарином) для достижения терапевтического эффекта необходимо удлинение времени в 1,5 – 2,5 раза. Более специфичными являются методы, основанные на измерении активности тромбина при его ингибировании плазмой больного, леченного гепарином (т. е. определяется анти-IIа-антитромбиновая активность гепарина). Чувствительность метода возрастает при такой постановке, когда в плазму вносится тромбин повышенной активности и активность регистрируется с помощью хромогенного субстрата (например, S-2288).
При контроле лечения препаратами низкомолекулярных гепаринов особое значение имеет определение анти-Ха-активности плазмы. В качестве индикатора реакции целесообразно использовать хромогенные субстраты. В связи с этим интересно сравнить соотношение антитромбиновой и анти-Ха-активностей у различных препаратов гепарина. У нефракционированного гепарина она примерно равна 1. У нефракционированных гепаринов это соотношение составляет: для дальтепарина – 2.2, логипарина – 1.5, надропарина – 3.5, эноксопарина – 3.9 [2]. Вопросы дозирования препаратов гепарина и контроля лечения при различных заболеваниях изложены во многих публикациях, справочниках и руководствах [3 – 6].
В последние годы был проведен ряд исследований с анализом больших групп больных по сравнительной оценке клинической эффективности препаратов нефракционированного и низкомолекулярного гепарина. По данным J. Hirst [7], при лечении венозного тромбоза нефракционированными гепаринами и оральными антикоагулянтами повторные венозные тромбоэмболии отмечены в 0,8% случаев, при лечении нефракционированным препаратом и оральными антикоагулянтами – в 3,2%. Смертность в первом случае составила 3,2%, в том числе вследствие тромбоэмболии легочной артерии – 0,1%, а во втором случае – 5,9%, в том числе вследствие тромбоэмболии легочной артерии – 0,2%. Выраженная кровоточивость составила при лечении низкомолекулярными гепаринами 3%, а нефракционированными – 6,7%, малая кровоточивость в первом случае составила 11%, во втором – 9,9%. Улучшение показателей венограмм в первом случае составило 65,3%, во втором – 52%. По данным F.J.J. Turpie [8], смертность при лечении венозных тромбозов нефракционированным гепарином составила 7,1%, а при лечении низкомолекулярным гепарином – 3,9%. При нестабильной стенокардии нефракционированный гепарин и низкомолекулярный гепарин обладают близкими по силе эффектами в плане предотвращения смерти, развития инфаркта миокарда, реваскуляризации и др. [9].
В литературе встречаются данные о том, что низкомолекулярные гепарины более безопасны в плане геморрагических осложнений, чем нефракционированные гепарины при нарушениях мозгового кровообращения [10].
Суммируя изложенное, можно заключить, что в настоящее время большинство исследователей считают низкомолекулярные гепарины по силе действия не уступающими нефракционированному гепарину. Однако, как было указано ранее, они имеют ряд преимуществ. Это объясняет тот факт, что после 13 лет клинического применения низкомолекулярные препараты постепенно вытесняют нефракционированный гепарин во многих областях медицины.
Появление низкомолекулярных гепаринов в клинике совпало по времени с внедрением и других новых антикоагулянтов прямого действия. Речь идет прежде всего о гирудине, его производных, а также синтетических и пептидных ингибиторах тромбина. Указанные препараты не нуждаются в эндогенных кофакторах, в частности антитромбине III. Однако следует учесть, что в случае возникновения опасности геморрагий, отравление этими препаратами труднее купировать, так как они пока не имеют специфических антагонистов. Между тем эффект гепаринов снимается специфическими антагонистами – протамина сульфатом, полибреном и др.
Исходя из тех преимуществ, которыми обладают гепарины, поиск новых антикоагулянтов прямого действия активно ведется среди сульфатированных полимеров. В частности, полисульфаты пентозана, дерматана и др. также применяются за рубежом в клинической практике. Однако они уступают гепаринам по удельной активности и безопасности применения.
В лаборатории патологии и фармакологии гемостаза Гематологического научного центра РАМН [11] разрабатывается новый антикоагулянт хиторин, представляющий собой смесь гепарина и полисульфата хитозана определенной молекулярной массы и степени сульфатирования. Подобный состав обусловлен тем, что авторам впервые удалось показать способность полисульфата хитозана потенцировать антикоагулянтный эффект гепарина. Хиторин, обладая близкой к гепарину удельной активностью, меньше влияет на концентрацию тромбоцитов в крови и обладает меньшей геморрагической активностью. Завершающиеся доклинические испытания свидетельствуют о низкой токсичности хиторина.
Таким образом, за 60 лет применения в клинике препараты гепарина показали высокую эффективность в профилактике и лечении тромбозов и ДВС-синдрома. За последние 13 лет удалось выявить преимущества низкомолекулярных препаратов гепарина перед нефракционированными препаратами. Гепарины служат основой для разработки новых антикоагулянтов прямого действия.
1. Баркаган З.С. Геморрагические заболевания и синдромы. М., Мед., 1988.
2. Annotation: low molecular weight heparin (S). Brit J Haematol 1995;90:1.
3. Баркаган З.С. В кн.: Руководство по гематологии, по ред. А.И. Воробьева, М., Мед., т.2, 1985, с.160.
4. Бокарев И.Н., Щепотин Б.М., Ена Я.Н. Внутрисосудистое свертывание крови. Киев, Здоров`я, 1989.
5. Исследование системы крови в клинической практике. Под ред. Г.И. Козинца и В.А. Макарова, М. Триада-Х, 1997.
6. Машковский М.Д. Лекарственные средства. т.1, Харьков, Торсинг, 1997, с.462.
7. Hirsh J, et al. Low molecular weight heparin in the treatment of patients with acute venous thromboembolism. Thrombos Haemostas 1995;74(1):360.
8. Turpie AJJ. New therapeutic opportunities for heparins: what does low molecular weight heparin offer? Thrombosis and Thrombolysis 1996;3:145.
9. Fragmin During Instability in Coronary Artery Disease (FRJSC) Study Group. Low molecular weight heparin during instability in coronary artery disease. The Lancet 1996;347:561.
10. Kay R, Wong KS, Yu YL, et al. Low molecular weight heparin in ischemic stroke. Fiss study. N Engl Med 1995;333(4):1588.
11. Дрозд Н.Н., Макаров В.А., Башков Г.В. и др. Влияние совместного введения гепарина и сернокислого эфира хитозана на функцию гемостаза. Эксп. и клин. фармакол, 1996, 59, 1, 30.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Исследование переносимости к гепарину - методика, показатели нормы
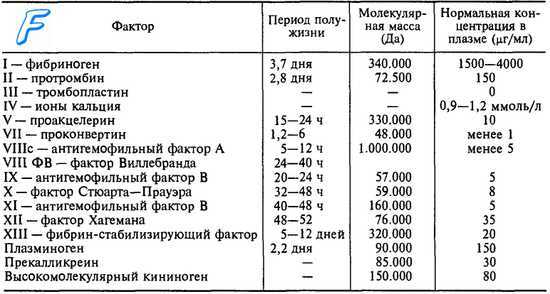
Исследование активности факторов свертывания крови - методика, показатели нормы
Принцип исследования активности факторов свертывания крови заключается в следующем: к исследуемой плазме, оптимально разведенной буфером, добавить реагент, содержащий все факторы протромбиназообразования, за исключением подлежащего исследованию. Время, полученное в присутствии тканего тромбопластина и кальция, прямо пропорционально уровню исследуемого фактора.
Техника дифференцированной дозировки одинакова в отношении всех этих факторов (II, V, VII, X), изменяется лишь реагент, приготовление которого находится в зависимости от присущих ему свойств.
В таблице перечислены реагенты и содержащиеся в них факторы.

Активность фактора II (внутреннего фактора II). Техника. В пробирку для гемолиза влить 0,1 мл исследуемой плазмы, разведенной буфером из расчета 1/10; 0,1 мл адсорбированной на BaSО4 плазмы; 0,05 мл старой сыворотки; 0,1 мл тканевого тромбопластина; 0,1 мл 0,025 М СаС12. Привести в действие хронометр и оставить пробирку в ванне 20 сек.; затем, наклоняя пробирку, проследить образование сгустка.
Нормальные значения укладываются в пределы 25—35 сек. Активность фактора V (внутреннего фактора V). Техника. В пробирку для гемолиза влить 0,1 мл исследуемой плазмы, разведенной с физиологическим раствором или буфером Michaelis, из расчета 1/10; 0,1 мл старой плазмы от здорового человека; 0,1 мл тканевого тромбопластина; 0,1 мл 0,025 М СаС12. Привести в действие хронометр и оставить пробирку в ванне 15 сек., затем провести наблюдение за свертыванием. Нормальные значения колеблются от 20 до 30 сек.
Активность факторов VII и X. Техника. В пробирку для гемолиза влить: 0,1 мл исследуемой плазмы, разведенной с физиологическим раствором или буфером Michaelis, из расчета 1/10; 0,1 мл нормальной плазмы, пропущенной через фильтр Зейтца; 0,1 мл тканевого тромбопластина; 0,1 мл 0,025 М СаС12. Привести в действие хронометр и оставить пробирку в ванне 25 сек. затем, наклонив пробирку, проследить образование сгустка. Норма соответствует 30—40 секундам.
Активность фактора VII можно определить косвенно, следующими способами: а) дозировкой комплекса факторов VII и X; б) дозировкой фактора X, при которой, в качестве активатора, применяется не тканевой тромбопластин (ВК), а гадючий яд Русселля (Stypven). Последний коротко замыкает наличие фактора VII в процессе свертывания внешним путем. Согласованное или несогласованное толкование результатов этих двух дозировок выявляет, соответственно, нормальную или ненормальную активность фактора VII.
Активность фактора X. Техника. В пробирку для гемолиза влить: 0,1 мл исследуемой плазмы; 0,1 мл реагента Stypven-цефалин. Подвергнуть 30-секундной инкубации, добавить 0,1 мл 0,025 М СаС12. Привести в действие хронометр и оставить пробирку в ванне 10 сек., затем, наклонив пробирку, проследить свертывание.
Нормальные значения колеблятся от 14 до 16 сек. Сопоставление результата с более продолжительным временем по предыдущему методу делает возможным выявление недостатка либо фактора VII, либо фактора X.
Тромботест — метод, разработанный Owren. Его применение способствует одновременному измерению следующих 4 факторов свертывания (понижающихся в период лечения антивитамином К): II, VII, IX, X, с использованием искусственного реагента. Техника довольно чувствительная, причем применима и для капиллярной крови, что делает возможным серийное проведение большого числа проб. Результаты приводятся в процентном выражении. При значениях менее 50%, результат тромботеста считается удлиненным.
При проведении лечения антивитамином К терапевтическая зона располагается между 8—15%, в то время как опасная зона — до менее 5%.
Время факторов II + VII + X. Испытание применяется, в частности, для проверки лечения противосвертывающими веществами, типа антивитамин К, подобно тромботесту.
Техника. В пробирку для гемолиза влить: 0,1 мл исследуемой плазмы, разведенной буфером, из расчета 1/10; 0,1 мл адсорбированной плазмы человека в норме; 0,1 мл тромбопластина; 0,1 мл 0,025 М раствора СаСl2. Одновременно привести в действие хронометр и проследить свертывание .
Нормальные значения колеблятся от 25 до 40 сек. Результат можно отразить и в процентном выражении по отношению к кривой эталонирования плазмы в норме. Терапевтическая зона укладывается в пределы от 10 до 20%.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Выявление антитромбоцитных антител: тест угнетения ретракции плазматического сгустка (ТУРС)
Способы выявления антитромбоцитных антител можно отнести к условно иммунологическим и коагулологическим, предполагающим характерные аспекты функции тромбоцитов: расплавление меченных Cr 51 тромбоцитов, "release" фактора 3 тромбоцитов, угнетение ретракции плазматического сгустка.
В настоящее время весьма полезными считаются следующие методы: основанный на угнетении ретракции плазматического сгустка (Поппа-Энаке), и основанный на выделении фактора 3 тромбоцитов (Карпаткина).
Тест угнетения ретракции плазматического сгустка
Тест угнетения ретракции плазматического сгустка (ТУРС) основывается на угнетении — путем иммунологического конфликта — выделения фактора 7 тромбоцитов (Тромбостенин, обеспечивающий тромбодинамическую функцию тромбоцитов). Проследить поведение стандарного числа тромбоцитов (100 000 ± 10 000) изогруппного контрольного лица в норме, в собственной плазме, после инкубации с сывороткой предполагаемого больного — носителя антитромбоцитных антител.
Одновременно обработать ретракцию плазматического сгустка контрольного лица в норме, следовательно без воздействия сыворотки больного, что, для метода представляет значение ссылочного материала.
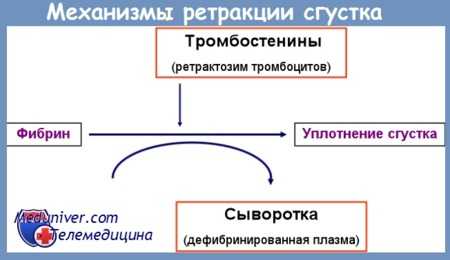
Техника теста угнетения ретракции плазматического сгустка. В пробирку диаметром 16 мм ввести отмеченные материалы, в следующем порядке: 3,4 мл сыворотки исследуемого больного; 1,5 мл плазмы контрольного лица в норме, со стандартным числом тромбоцитов (отобранной и приготовленной в обработанной силиконом пробирке); подвергнуть 30-минутной инкубации в ванне, при +37°С; добавить 0,1 мл раствора тромбина.
Перемешать содержимое и после образования сгустка (20—30 сек.) продержать пробу 60 мин. в ванне, при температуре +37°С; спустя 2 и 10 мин. после образования сгустка бережно отделить его очень тонкой палочкой. По истечении срока инкубации извлечь сгусток фибрина пинцетом, провести им по стенке пробирки, чтобы стекла жидкость и отбросить. Оставшуюся сыворотку измерить в градуированном цилиндре, полученное значение помножить на 20. Нормальный показатель больше 85%.
Результаты теста угнетения ретракции плазматического сгустка. Полученный таким образом результат вычесть из значения, полученного при определении ретракции сгустка контрольного лица в норме (которое должно равняться или превышать 85%). Возможны следующие положения:
— равенство значений либо разница до 5% = результат нормальный;
— разница между ними составляет 5—10% = слабо положительный результат;
— разница больше 10% = результат положительный, что означает наличие антитромбоцитных антител, угнетающих тромбодинамическую функцию тромбоцитов.
Анализ на анти-Ха активность
Анализ на анти-Ха активность – это измерение антикоагулянтной, противосвертывающей активности гепарина. По результатам исследования определяют, насколько угнетена активность 2-го (IIа) и 10-го (Xа) факторов свертывания крови. Метод позволяет оценить действие гепариновой терапии и скорректировать дозу препарата.
Сдать тест на анти-Ха активность гепарина можно в лаборатории гемостаза Медицинского женского центра на Земляном валу. Стоимость услуги – 1 200 рублей. Срок готовности результатов – 1 рабочий день.
Цена анализа на активность гепарина*
- 1 200 Р Анти-Ха активность (гепарин)
- 4 000 Р Первичная консультация гемостазиолога
- 3 000 Р Повторная консультация гемостазиолога
- 300 Р Забор крови
Расчет стоимости лечения Все цены
* Принимаются пациенты старше 18 лет.
Зачем проверять анти-Ха активность гепарина
Анти-Ха активность рекомендовано проверять у следующих категорий пациентов:
- Получающих лечение нефракционным, UFH гепарином;
- Беременных женщин, применяющих фраксипарин, фрагмин, гемапаксан и другие препараты низкомолекулярного гепарина;
- Пациентов с заболеваниями почек, нарушениями свертываемости крови или избыточной массой тела;
- Детей и пожилых людей;
- У всех, находящихся на гепариновой терапии более 10 дней.
Дело в том, что антикоагулянт прямого действия, гепарин, применяют для профилактики и лечения тромбозов, тромбофлебитов, инфаркта миокарда, а также в аппаратах искусственного кровообращения и гемодиализа. Несмотря на наличие рекомендованных профилактических и терапевтических доз, восприимчивость к препарату у каждого пациента разная и зависит от возраста, веса и индивидуальных особенностей организма.
При введении неадекватной дозы у человека могут развиться кровоточивость, резистентность (нечувствительность) плазмы к гепарину, дефицит антитромбина III, тромбоцитопения и другие осложнения.
Специалисты
акушер-гинеколог, специалист в области клинической гемостазиологии, профессор, доктор медицинских наук, академик РАН, вице-президент Российского общества акушеров-гинекологов, Почетный профессор Венского Университета (Австрия)

врач-гемостазиолог, кандидат медицинских наук
Преимущества метода
Метод исследования основан на свойстве гепарина подавлять образование фибринового сгустка и влиять на процесс свертывания крови. Результаты анализа позволяют сравнить реальные показатели анти-Ха активности с допустимыми нормами для профилактики/лечения гепарином и, при необходимости, скорректировать его дозу.
Как проводится анализ на анти-Ха
Анализ сдают через 3-4 часа после подкожного введения гепарина, когда наблюдается максимальный уровень анти-Ха активности препарата в сыворотке крови. В качестве подготовки к исследованию врачи рекомендуют на сутки отказаться от жирной пищи.
При расшифровке результатов берут во внимание исходную дозу гепарина и вид патологии у пациента:
- Для профилактики тромбоза вводят 2500 МЕ препарата в сутки. Норма противосвертывающей активности в таких случаях составляет 0,1-0,4 МЕ/мл.
- При высоком риске тромбоза, тромбоэмболии суточная доза гепарина 5000 МЕ, а норма анти-Ха 0,5-1,0 МЕ/мл.
- При венозных и артериальных тромбоэмболиях, инфаркте миокарда гепариновую терапию назначают из расчета 100 МЕ препарата на 1 кг веса пациента. Референсные значения анти-Ха в крови колеблются от 1,0 до 1,5 МЕ (соответственно, умноженные на вес человека).
Сниженный анти-Ха указывает на риск тромбоза и недостаточную дозу гепарина. Если показатель повышен – дозу препарата уменьшают, так как существует риск кровотечения.
Где сдать в Москве анализ на анти-Ха активность
Анализ на анти-Ха, а также близкие к нему тесты, по которым определяют корректность гепариновой терапии – АЧТВ, тромбоэластограмму, можно сдать в Медицинском Женском Центре на Таганке. При клинике функционирует Научная лаборатория патологий гемостаза, оборудование которой позволяет производить исследования крови повышенной сложности.
Выполнение анализов, расшифровка и выдача результатов – далеко не все возможности экспериментальной лаборатории. Основное направление нашей деятельности – это поиск и внедрение новых методик лечения свертывающей системы крови, в том числе – эффективной и безопасной гепариновой терапии.
После сдачи анализа в МЖЦ, у вас есть уникальная возможность получить консультацию у лучших гемостазиологов Москвы – Макацария Александра Давидовича, Бицадзе Виктории Омаровны и Акиньшиной Светланы Владимировны.
Коагулограмма часть 2
Применяется для исследования свертываемости по внутреннему пути с помощью плазменных факторов свертывания. Предполагает добавление определенных веществ (кефалина и каолина) к рекальцифицированной (с солями Са) плазме. В норме данный показатель находится в пределах от 25 до 39 сек. Увеличение его указывает на терапию антикоагулянтами, некоторые тяжелые заболевания крови и внутренних органов. Удлинение АЧТВ характерно и для гемофилии.
Аутокоагуляционный тест (АКТ)

Также, как и АЧТВ, используется для оценки свертывания по внутреннему пути. Но здесь не используются каолин и кефалин. К тому же в ходе АКТ не исследуется активность фибриногена, и это повышает достоверность оценки остальных факторов свертывания. Кроме того, при АКТ используется разведенная кровь в минимальном количестве. Поэтому для данного метода вполне пригодна кровь, взятая из пальца, что делает АКТ удобным для использования в амбулаторных условиях или в педиатрической практике.
Время рекальцификации плазмы
Свертывание крови при добавлении к ней солей Са. Составляет 1-2 мин. Не имеет большого клинического значения
Протромбин (по Квику)
Фибриноген
Фиброноген один из основополагающих факторов свертывания. Синтезируется печенью. Под действием тромбина расщепляется с образованием фибрин-мономера, который затем полимеризуется. В норме содержание фибриногена в 1 л плазмы крови равно 2-4 г. Данный показатель может снижаться при заболеваниях печени, отравлении некоторыми ядами, укусах змей. Очень часто отмечается физиологически высокий фибриноген при беременности. Кроме того, повышение фибриногенасвидетельствует о гемоконцентрации (сгущении крови) и острых воспалительных процессах.
Тромбиновое время
Данный показатель отображает конечную фазу коагуляции – трансформацию фибриногена в фибрин. В норме ТВ равно 12-16 сек. Образование фибрина из фибриногена стимулируется тромбином и угнетается гепарином, антитромбином III и другими антикоагулянтами. Следовательно, данный показатель будет зависеть от исходного уровня фибриногена, активности тромбина и антикоагулянтов.
Гепарин
Гепарин – высокомолекулярное соединение, синтезируемое печенью, легкими, и в меньшей степени многими другими органами. Гепарин ингибирует образование фибрина и многие другие этапы коагуляции. Нормальное содержание в плазме крови – о, 24-0,6 кЕД/л. Повышение уровня гепарина может быть обусловлено приемом его лекарственного аналога. Данное состояние является потенциально опасным в плане развития кровотечений.
Толерантность плазмы к гепарину
Толерантность плазмы к гепарину – влияние на время свертывания плазмы крови после добавления к ней гепарина. В норме составляет от 10 до 15 мин. Если время увеличивается, говорят о низкой толерантности. Если остается неизменным, то толерантность высокая. Данный показатель используется для прогноза влияния гепарина на свертываемость у конкретного исследуемого лица.
Антитромбин III(АТIII)
Это белковое соединение, синтезируемое печенью и внутренней сосудистой стеной (эндотелием). Как следует из самого названия, действие АТIII направлено против тромбина. Помимо тромбина АТ IIIугнетает и другие факторы свертывания. Активность АТIII , выраженная в процентах, колеблется от 75 до 125%.
Спонтанная фибринолитическая активность
Сформировавшийся тромб в дальнейшем подвергается самопроизвольному растворению – спонтанному фибринолизу. В норме спонтанная фибринолитическая активность составляет от 12 до 16%. Определение этого показателя другим методом находится во временном промежутке от 3 до 5 ч. Усиление фибринолитической активности отмечается при поражении легких, матки, предстательной железы, и других органов, синтезирующих вещества-активаторы фибринолиза. Уменьшение фибринолитической активности нередко сопутствует инфаркту миокарда и злокачественным опухолям.
Плазминоген
Данный белок является предшественником плазмина, запускающего процесс фибринолиза. Плазминоген, как и многие другие факторы гемостаза, в основном синтезируется в печени, и в меньшей степени – в почках, надпочечниках, легких и других органах. Активность плазминогена в сыворотке крови, выраженная в процентах, составляет 80-120%. Повышение плазминогена при острых воспалительных заболеваниях и дефиците витамина К всегда чревато опасностью кровотечений.
Продукты деградации фибрина и фибриногена (ПДФ)
В процессе фибринолиза тромб лизируется, фибриноген распадается на фрагменты – ПДФ, которые обладают выраженной антикоагуляционной активностью. В норме содержание ПДФ в плазме крови невелико – не более 10мг/л. Повышение ПДФ часто отмечается при кровотечениях
Фибриноген Б
Фибриноген Б – образовавшиеся в ходе полимеризации фибрин-мономер полимеризуются. Однако некоторые мономерывыступают во взаимосвязь с фибриногеном и образуют комплекс – фибриноген Б. В норме фибриноген Б не определяется. Его появление в плазме крови указывает на крайне тяжелое состояние, сопровождающееся внутрисосудистым свертыванием.
В данной статье приведены основные, наиболее клинически значимые параметры гемостаза. А вообще в процессах коагуляции, антикоагуляции и фибринолиза принимают участие многие десятки других веществ, относящихся к классу белков, аминокислот, минералов, липидов (жиров) и углеводов.
Читайте также:
- Клиника и диагностика венесуэльского энцефаломиелита. Лечение венесуэльского энцефаломиелита
- Изменения внеклеточной концентрации калия (К).
- Исходы травм уха. Течение травмы наружного уха
- Кортикостероиды при сердечной недостаточности. Гормональные причины гипертрофии миокарда
- Лечение плеврального выпота у плода. Кистозные гигромы с экстрацервикальным распространением
