Кортикостероиды при сердечной недостаточности. Гормональные причины гипертрофии миокарда
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Эндокринные влияния на сердце. Лечение гормональных сердечно-сосудистых заболеваний
Почти все эндокринные заболевания, протекающие с нарушениями секреции отдельных гормонов, сопровождаются выраженными изменениями со стороны сердечно-сосудистой системы, которые нередко выступают на первый план в клинической симптоматологии, обусловливают тяжесть течения и даже исход эндокринного заболевания. К такой эндокринной патологии можно отнести тиреотоксикоз, синдром Иценко — Кушинга, феохромоцитому, первичный альдостеронизм, хроническую недостаточность надпочечников.
Изучение состояния сердечно-сосудистой системы при этих эндокринных заболеваниях позволяет судить и учитывать влияние отдельных гормональных факторов на функции сердца и состояние сосудистого тонуса. Такие эндокринные больные должны наблюдаться и изучаться как эндокринологами, так и терапевтами-кардиологами в тесном сотрудничестве. Такого же совместного изучения и наблюдения требуют больные сахарным диабетом, при котором сосудистая патология обусловливает тяжесть течения диабета и является основной причиной смерти этих больных.
Только всестороннее и детальное изучение изменений системы кровообращения при этих гормональных и обменных нарушениях позволит выявить участие и роль эндокринных факторов в кардиальной патологии.

Имеющиеся на данном этапе фактические сведения свидетельствуют о несомненном участии эндокринной системы в такой распространенной сердечно-сосудистой патологии, как коронарный атеросклероз с его осложнениями, гипертоническая болезнь, сердечная недостаточность. Однако патогенетическое значение гормональных нарушений при этих состояниях пока еще остается не ясным. Четкое представление о роли и значении изменений гормонального профиля у больных с сердечно-сосудистой патологией позволит более обоснованно применять терапию, направленную на восстановление нарушенных гормональных взаимоотношений.
В процессе обсуждения патогенеза отдельных заболеваний эндокринной и сердечно-сосудистой систем было указано на ведущее значение нарушений функционального состояния гипоталамуса в развитии патологии этих систем — нарушений, которые могут отразиться как на регуляции функций отдельных желез внутренней секреции и обменных процессов, так и на изменениях функций сердца и сосудов.
Одним из примеров такой сочетанной патологии, имеющей, по-видимому, единый генез, является нередко наблюдаемое в пожилом возрасте сочетание нарушений регуляции сосудистого тонуса с атеросклерозом коронарных артерий и с нарушениями обменных процессов (углеводного в виде скрытого или явного диабета, жирового обмена в виде ожирения). Все эти вопросы далеки от своего разрешения. Требуется еще много новых фактических данных для подтверждения высказанных предположений.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кортикостероиды при сердечной недостаточности. Гормональные причины гипертрофии миокарда
Под влиянием кортикостероидов поглощение катехоламинов происходит быстрее (В. Г. Шаляпина, 1965). М. П. Барц (1961) установил, что «пермиссивные» действия кортикостероидов осуществляются путем влияния на связывание катехоламинов с белками. При «стрессовых» реакциях обе гормональные системы обеспечивают единый механизм адаптации.
Кортикостероиды поддерживают способность тканей к реакциям на действие катехоламинов, и обе группы гормонов действуют как единое целое (Ramсу, Goldstein, 1957).
Таким образом, сохранение нормального уровня метаболизма в сердечной мышце при повышенной работе зависит от регулирующего влияния надпочечников, которые привлекают к действию ряд адаптационных и компенсаторных механизмов.
Одним из наиболее мощных приспособительных механизмов является гипертрофия сердечной мышцы, благодаря которой иногда на очень длительный срок преодолеваются весьма существенные препятствия в виде клапанных дефектов или большого повышения сопротивления при гипертонии.
Для развития гипертрофии необходим повышенный синтез клеточных белков, что доказано радиологическим методом по интенсивности поглощения меченного по S35 метионина. По данным Ф. З. Меерсона, Bing (1964) и ряда других, при развитии гипертрофии сердечной мышцы синтез клеточного белка значительно увеличивается. Установлено, что при гипертрофии миокарда поглощение С14 гликокола, который переходит в миозин, резко повышается. Ультрамикроскопические исследования состояния сердечной мышцы в процессе развития гипертрофии позволили Bing (1964) установить ряд изменений в клеточных структурах, в особенности в ядерных рибосомах.

В условиях гипертрофии сердечной мышцы меняются обменные процессы, которые дают возможность сердцу увеличить эффективность работы почти в 20 раз, хотя масса сердечной мышцы при этом увеличивается всего в 6 раз (Gant, 1953).
Неотъемлемым компонентом гипертрофии миокарда является увеличение потребления кислорода и питательных веществ сердечной мышцей, что отчасти обеспечивается действием анаболических гормонов. Так, установлено, что в развитии гипертрофии сердечной мышцы весьма существенную роль играет соматотропный гормон (СТГ) передней доли гипофиза, секреция которого всегда повышается в период компенсации и развития гипертрофии миокарда.
Впервые Beznac (1964) обратила внимание на то, что в процессе развития гипертрофии сердечной мышцы важную роль играют гормональные влияния. Она установила, что у гипофизэктомированных животных не происходит гипертрофии левого желудочка при экспериментальном сужении аорты. Применение же СТГ способствовало развитию гипертрофии мышцы сердца при экспериментальных пороках (Barta с соавт., 1965).
Для предотвращения изнашивания и истощения клеток миокарда в условиях повышенной работы необходим энергичный и быстрый синтез специфического белка, который происходит в клеточных ядрах и рибосомах. Существенное влияние на процесс синтеза клеточного белка также оказывает СТГ, который является основным регулятором клеточного белкового обмена. СТГ оказывает воздействие и на митотическую активность клеток, способствуя их регенерации. Совершенно очевидно, что весь этот сложный механизм приспособительных реакций должен приводиться в действие и регулироваться центральным аппаратом адаптации, каковым является гипоталамогипофизарный аппарат.
Привлечение к действию компенсаторных механизмов в виде учащения и усиления сердечных сокращений, а также развитие гипертрофии миокарда могут иногда на длительный срок удовлетворить нужды организма. Однако при продолжающейся повышенной работе сердца в конце концов истощаются его резервные возможности и наступает недостаточность сердца.
Сама по себе гипертрофия сердечной мышцы несет в себе элементы будущей дистрофии миокарда и его недостаточности, так как гипертрофия сердечной мышцы сопровождается ее гипоксией в связи с относительной недостаточностью коронарного кровообращения. В этих условиях нарушаются биохимические процессы, направленные на ресинтез контрактильного белка и фосфатных соединений, что влечет за собой ослабление основной функции миокарда, ее сократимости и провоцирует развитие сердечной недостаточности.
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия – первичное изолированное поражение миокарда, характеризующееся гипертрофией желудочков (чаще левого) при уменьшенном или нормальном объеме их полостей. Клинически гипертрофическая кардиомиопатия проявляется сердечной недостаточностью, болью в грудной клетке, нарушениями ритма, синкопальными состояниями, внезапной смертью. Диагностика гипертрофической кардиомиопатии включает проведение ЭКГ, суточного ЭКГ-мониторирования, ЭхоКГ, рентгенологического исследования, МРТ, ПЭТ сердца. Лечение гипертрофической кардиомиопатии проводится b-адреноблокаторами, блокаторами кальциевых каналов, антикоагулянтами, антиаритмическими препаратами, ингибиторами АПФ; в ряде случаев прибегают к кардиохирургической операции (миотомии, миоэктомии, протезированию митрального клапана, двухкамерной электрокардиостимуляции, имплантации кардиовертер-дефибриллятора).
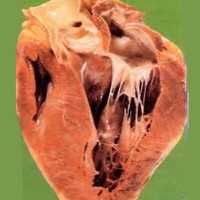
Общие сведения
В кардиологии различают первичные (идиопатические) кардиомиопатии (гипертрофическую, констриктивную, дилатационную, рестриктивную, аритмогенную дисплазию правого желудочка) и специфические вторичные кардиомиопатии (алкогольную, токсическую, метаболическую, климактерическую и ряд других).
Гипертрофическая кардиомиопатия – самостоятельное, не зависящее от других сердечно-сосудистых заболеваний, значительное утолщение миокарда левого (реже правого) желудочка, сопровождающееся уменьшением его полости, нарушением диастолической функции с развитием нарушений сердечного ритма и сердечной недостаточности.
Гипертрофическая кардиомиопатия развивается у 0,2-1,1% населения, чаще мужского пола; средний возраст пациентов составляет от 30 до 50 лет. Коронарный атеросклероз среди больных гипертрофической кардиомиопатией встречается в 15-25 % случаев. Внезапная смерть, вызванная с тяжелыми желудочковыми аритмиями (пароксизмальной желудочковой тахикардией), наступает у 50% пациентов с гипертрофической кардиомиопатией. У 5-9 % больных заболевание осложняется инфекционным эндокардитом, протекающим с поражением митрального или аортального клапана.
Причины
Гипертрофическая кардиомиопатия – заболевание с аутосомно-доминантным типом наследования, поэтому обычно носит семейный характер, что не исключает, однако, возникновение спорадических форм.
В основе семейных случаев гипертрофической кардиомиопатии лежат передаваемые по наследству дефекты генов, кодирующих синтез сократительных белков миокарда (гена тяжелой цепи b-миозина, гена сердечного тропонина Т, гена а-тропомиозина, гена, кодирующего сердечную изоформу миозин-связывающего белка). Спонтанные мутации этих же генов, происходящие под воздействием неблагоприятных факторов среды, обусловливают развитие спорадических форм гипертрофической кардиомиопатии.
Гипертрофия миокарда левого желудочка при гипертрофической кардиомиопатии не связана с врожденными и приобретенными пороками сердца, ИБС, гипертонической болезнью и другими заболеваниями, которые обычно приводят к подобным изменениям.
Патогенез
В патогенезе гипертрофической кардиомиопатии ведущая роль принадлежит компенсаторной гипертрофии сердечной мышцы, обусловленной одним из двух возможных патологических механизмов - нарушением диастолической функции миокарда или обструкцией выходного тракта левого желудочка. Диастолическая дисфункция характеризуется поступлением в желудочки недостаточного количества крови в диастолу, что связано с плохой растяжимостью миокарда, и обусловливает быстрый подъем конечного диастолического давления.
При обструкции выходного отдела левого желудочка имеет место утолщение межжелудочковой перегородки и нарушение движения передней створки митрального клапана. В связи с этим в период изгнания возникает перепад давления между полостью левого желудочка и начальным отрезком аорты, что сопровождается повышением конечного диастолического давления в левом желудочке. Возникающая в этих условиях компенсаторная гиперфункция сопровождается гипертрофией, а затем и дилатацией левого предсердия, в случае же декомпенсации развивается легочная гипертензия.
В ряде случаев гипертрофической кардиомиопатии сопутствует ишемия миокарда, обусловленная снижением вазодилататорного резерва коронарных артерий, увеличением потребности гипертрофированного миокарда в кислороде, сдавлением во время систолы интрамуральных артерий, сопутствующим атеросклерозом венечных артерий и т. д.
Макроскопическими признаками гипертрофической кардиомиопатии служит утолщение стенок левого желудочка при нормальных или уменьшенных размерах его полости, гипертрофия межжелудочковой перегородки, дилатация левого предсердия. Микроскопическая картина гипертрофической кардиомиопатии характеризуется беспорядочным расположением кардиомиоцитов, замещением мышечной ткани на фиброзную, аномальным строением интрамуральных венечных артерий.
Классификация
В соответствии с локализацией гипертрофии выделяют гипертрофическую кардиомиопатию левого и правого желудочков. В свою очередь, гипертрофия левого желудочка может быть асимметричной и симметричной (концентрической). В большинстве случаев выявляется асимметричная гипертрофия межжелудочковой перегородки на всем протяжении или в ее базальных отделах. Реже встречается асимметричной гипертрофия верхушки сердца (апикальная гипертрофическая кардиомиопатия), задней или переднебоковой стенки. На долю симметричной гипертрофии приходится около 30 % случаев.
С учетом наличия градиента систолического давления в полости левого желудочка различают обструктивную и необструктивную гипертрофическую кардиомиопатию. Симметричная гипертрофия левого желудочка, как правило, представляет собой необструктивную форму гипертрофической кардиомиопатии.
Асимметричная гипертрофия может являться как необструктивной, так и обструктивной. Так, синонимом асимметричной гипертрофии межжелудочковой перегородки служит понятие «идиопатический гипертрофический субаортальный стеноз», гипертрофии средней части межжелудочковой перегородки (на уровне папиллярных мышц) – «мезовентрикулярная обструкция». Верхушечная гипертрофия левого желудочка, как правило, представлена необструктивным вариантом.
В зависимости от степени утолщения миокарда выделяют умеренную (15-20 мм), среднюю (21-25 мм) и выраженную (более 25 мм) гипертрофию.
На основании клинико-физиологической классификации выделяют IV стадии гипертрофической кардиомиопатии:
- I - градиент давления в выходном тракте левого желудочка (ВТЛЖ) не более 25 мм рт. ст.; жалобы отсутствуют;
- II - градиент давления в ВТЛЖ возрастает до 36 мм рт. ст.; появляются жалобы при физической нагрузке;
- III - градиент давления в ВТЛЖ увеличивается до 44 мм рт. ст.; появляются стенокардия, одышка;
- IV - градиент давления в ВТЛЖ выше 80 мм рт. ст.; развиваются выраженные нарушения гемодинамики, возможна внезапная сердечная смерть.
Симптомы гипертрофической кардиомиопатии
Длительное время течение гипертрофической кардиомиопатии остается бессимптомным, клиническая манифестация чаще происходит в возрасте 25–40 лет. С учетом преобладающих жалоб выделяют девять клинических форм гипертрофической кардиомиопатии: малосимптомную, вегетодистоническую, кардиалгическую, инфарктоподобную, аритмическую, декомпенсационную, псевдоклапанную, смешанную, молниеносную. Несмотря на то, что каждый клинический вариант характеризуется определенными признаками, всем формам гипертрофической кардиомиопатии присущи общие симптомы.
Необструктивная форма гипертрофической кардиомиопатии, не сопровождающаяся нарушением оттока крови из желудочка, обычно малосимптомна. В этом случае жалобы на одышку, перебои в работе сердца, неритмичный пульс могут отмечаться при выполнении физической нагрузки.
Типичными симптомами обструктивной гипертрофической кардиомиопатии служат приступы ангинозных болей (70%), выраженная одышка (90%), головокружения и обморочные состояния (25-50%), преходящая артериальная гипотензия, нарушения ритма сердца (пароксизмальная тахикардия, фибрилляция предсердий, экстрасистолия). Возможно возникновение приступов сердечной астмы и отека легких. Нередко первым эпизодом проявления гипертрофической кардиомиопатии служит внезапная смерть.
Диагностика
При диагностическом поиске обнаруживается систолический шум, высокий, скорый пульс, смещение верхушечного толчка. Инструментальные методы обследования при гипертрофической кардиомиопатии включают ЭхоКГ, ЭКГ, ФКГ, рентгенографию грудной клетки, холтеровское мониторирование, поликардиографию, ритмокардиографию. С помощью эхокардиографии выявляется гипертрофия МЖП, стенок миокарда желудочка, увеличение размеров левого предсердия, наличие обструкции ВТЛЖ, диастолическая дисфункция левого желудочка.
ЭКГ-признаки гипертрофической кардиомиопатии малоспецифичны и требуют дифференциальной диагностики с очаговыми изменениями миокарда, гипертонической болезнью, ИБС, аортальным стенозом и другими заболеваниями, осложняющимися гипертрофией левого желудочка. Для оценки тяжести гипертрофической кардиомиопатии, прогноза и выработки рекомендаций по лечению используются нагрузочные пробы (велоэргометрия, тредмил-тест).
Суточное мониторирование ЭКГ позволяет документировать пароксизмальные эпизоды желудочковой экстрасистолии и тахикардии, фибрилляции и трепетания предсердий. На фонокардиограмме регистрируется систолический шум различной степени выраженности, сохранность амплитуды I и II тонов. Сфигмография демонстрирует двухвершинную кривую каротидного пульса, характеризующуюся дополнительной волной на подъеме.
При рентгенологическом исследовании изменения контуров сердца (увеличение левых отделов сердца, расширение восходящей части аорты, выбухание ствола и расширение ветвей легочной артерии) обнаруживаются только в развернутой стадии гипертрофической кардиомиопатии. Для получения дополнительных данных за гипертрофическую кардиомиопатию прибегают к проведению зондирования левых отделов сердца, вентрикулографии, коронарографии, сканированию сердца с радиоизотопом таллия, МРТ, ПЭТ сердца. Окончательным подтверждающим методом служит генодиагностика.
Лечение гипертрофической кардиомиопатии
Пациентам с гипертрофической кардиомиопатией (особенно с обструктивной формой) рекомендуется ограничение физических нагрузок, которые могут спровоцировать увеличение градиента давления «левый желудочек-аорта», аритмии сердца и обмороки.
При умеренно выраженных симптомах гипертрофической кардиомиопатии назначают b-адреноблокаторы (пропранолол, атенолол, метопролол) или блокаторы кальциевых каналов (верапамил), уменьшающие ЧСС, удлиняющие диастолу, улучшающие пассивное наполнение левого желудочка и снижающие давление наполнения. В связи с наличием высокого риска развития тромбоэмболий необходим прием антикоагулянтов. При развитии сердечной недостаточности показаны диуретики, ингибиторы АПФ; при нарушениях желудочкового ритма - антиаритмические препараты (амиодарон, дизопирамид).
При обструктивной гипертрофической кардиомиопатии проводится профилактика инфекционного эндокардита, т. к. в результате постоянной травматизации передней створки митрального клапана на ней могут появляться вегетации. Кардиохирургическое лечение гипертрофической кардиомиопатии целесообразно при градиенте давления между левым желудочком и аортой >50 мм рт.ст. В этом случае может выполняться септальная миотомия или миоэктомия, а при структурных изменениях митрального клапана, вызывающих значительную регургитацию, - протезирование митрального клапана.
Для уменьшения обструкции ВТЛЖ показана имплантация двухкамерного электрокардиостимулятора; при наличии желудочковых нарушений ритма - имплантация кардиовертер-дефибриллятора.
Прогноз гипертрофической кардиомиопатии
Течение гипертрофической кардиомиопатии вариабельно. Необструктивная форма гипертрофической кардиомиопатии протекает относительно стабильно, однако при длительном стаже заболевания все же развивается сердечная недостаточность. У 5–10% пациентов возможен самостоятельный регресс гипертрофии; у такого же процента больных отмечается переход гипертрофической кардиомиопатии в дилатационную; еще столько же пациентов сталкивается с осложнением в виде инфекционного эндокардита.
Без лечения летальность при гипертрофической кардиомиопатии составляет 3–8 %, при этом в половине подобных случаев возникает внезапная смерть вследствие фибрилляции желудочков, полной атриовентрикулярной блокады, острого инфаркта миокарда.
Миокардит
Миокардит – воспаление мышечной оболочки сердца (миокарда), чаще ревматического, инфекционного или инфекционно-аллергического характера. Течение миокардита может быть острым или хроническим. Острый миокардит проявляется одышкой, цианозом, отеками на ногах, набуханием вен на шее, болями в сердце, сердцебиением, аритмиями. Часто развитию миокардита предшествует перенесенная инфекция (дифтерия, ангина, скарлатина, грипп и др.). В дальнейшем возможны рецидивы заболевания (при ревматическом миокардите), развитие сердечной недостаточности и тромбоэмболий сосудов различных органов.
Частота заболеваемости миокардитом намного выше статистической из-за поздней диагностики и латентных форм, когда заболевание протекает стерто или в легкой форме. Признаки воспалительного процесса в миокарде в 4–9% случаев обнаруживаются только на аутопсии (по результатам патологоанатомических исследований). От острого миокардита умирает от 1 до 7% больных, у людей молодого возраста в 17-21% случаев он становится причиной внезапной смерти.
Миокардит приводит к развитию сердечной недостаточности и нарушению ритма сердца, что является ведущими причинами летального исхода. Миокардиты встречаются чаще у молодых людей (средний возраст пациентов 30 – 40 лет), хотя заболевание может возникнуть в любом возрасте. Мужчины заболевают миокардитом несколько реже женщин, но у них чаще развиваются тяжелые формы заболевания.
Причины миокардита
Миокардиты включают большую группу заболеваний сердечной мышцы воспалительного генеза, проявляющихся поражением и нарушением функции миокарда. Частой причиной миокардита являются различные инфекционные заболевания:
- вирусные (вирусы Коксаки, гриппа, аденовирусы, герпеса, гепатита В и С);
- бактериальные (коринеобактерии дифтерии, стафилококки, стрептококки, сальмонеллы, хламидии, риккетсии);
- грибковые (аспергиллы, кандиды),;
- паразитарные (трихинеллы, эхинококки) и др.
Тяжелая форма миокардита может возникать при дифтерии, скарлатине, сепсисе. Высокой кардиотропностью обладают вирусы, вызывающие миокардит в 50% случаев. Иногда миокардит развивается при системных заболеваниях соединительной ткани: системной красной волчанке, ревматизме, васкулитах, ревматоидном артрите, при аллергических заболеваниях. Также причиной миокардита может служить токсическое воздействие некоторых лекарственных препаратов, алкоголя, ионизирующее излучение. Тяжелое прогрессирующее течение отличает идиопатический миокардит невыясненной этиологии.
Провоцирующими моментами возникновения миокардита являются острые инфекции (чаще вирусные), очаги хронической инфекции; аллергозы, нарушенные иммунологические реакции; токсическое воздействие на организм (лекарств, алкоголя, наркотиков, ионизирующего излучения, при тиреотоксикозе, уремии и др.).
Миокардит в большинстве случаев сопровождается эндокардитом и перикардитом, реже воспалительный процесс затрагивает только миокард. Повреждение миокарда может возникать при прямом миокардиоцитолитическом действии инфекционного агента; под влиянием токсинов, циркулирующих в крови (в случае системной инфекции); и как результат аллергической или аутоиммунной реакции. Нередко встречаются инфекционно-аллергические миокардиты.
Иммунные нарушения, наблюдаемые при миокардите, проявляются расстройством всех звеньев иммунитета (клеточного, гуморального, фагоцитоза). Инфекционный антиген запускает механизм аутоиммунного повреждения кардиомиоцитов, приводящий к значительным изменениям миокарда: дистрофическим изменениям мышечных волокон, развитию экссудативных или пролиферативных реакций в интерстициальной ткани. Следствием воспалительных процессов при миокардите является разрастание соединительной ткани и развитие кардиосклероза. При миокардите заметно снижается насосная функция сердечной мышцы, что часто носит необратимый характер и приводит к тяжелому состоянию недостаточности кровообращения, нарушениям сердечного ритма и проводимости, служит причиной инвалидности и летального исхода в молодом возрасте.
В зависимости от механизма возникновения и развития миокардита выделяют следующие формы:
- инфекционные и инфекционно-токсические (при гриппе, вирусах группы Коксаки, дифтерии, скарлатине и др.);
- аллергические (иммунные) (сывороточный, инфекционно-аллергический, трансплантационный, лекарственный, миокардиты при системных заболеваниях);
- токсико-аллергические (при тиреотоксикозе, уремии и алкогольном поражении сердца);
- идиопатические (невыясненной природы).
По распространенности воспалительного поражения миокардиты делятся на диффузные и очаговые. По течению различают острые, подострые, хронические (прогрессирующие, рецидивирующие) миокардиты. По степени тяжести - легкий, миокардит средней тяжести, тяжелый.
По характеру воспаления выделяют экссудативно-пролиферативный (воспалительно-инфильтративный, васкулярный, дистрофический, смешанный) и альтернативный (дистрофически-некробиотический) миокардиты. В развитии инфекционного миокардита (как наиболее часто встречающегося) выделяют 4 патогенетические стадии:
- Инфекционно-токсическая
- Иммунологическая
- Дистрофическая
- Миокардиосклеротическая
По клиническим вариантам (по преобладающим клиническим симптомам) различают миокардиты:
- малосимптомный
- болевой или псевдокоронарный
- декомпенсационный (с нарушением кровообращения)
- аритмический
- тромбоэмболический
- псевдоклапанный
- смешанный
Симптомы миокардита
Клиническая симптоматика миокардита зависит от степени поражения миокарда, локализации, остроты и прогрессирования воспалительного процесса в сердечной мышце. Она включает проявления недостаточности сократительной функции миокарда и нарушения ритма сердца. Инфекционно-аллергический миокардит в отличие от ревматического начинается обычно на фоне инфекции или сразу после нее. Начало заболевания может протекать малосимптомно или латентно.
Основные жалобы пациентов - на сильную слабость и утомляемость, одышку при физической нагрузке, боли в области сердца (ноющие или приступообразные), нарушения ритма (сердцебиение, перебои), повышенную потливость, иногда боль в суставах. Температура тела обычно субфебрильная или нормальная. Характерными проявлениями миокардита являются увеличение размеров сердца, понижение артериального давления, недостаточность кровообращения.
Кожные покровы у больных миокардитом бледные, иногда с синюшным оттенком. Пульс учащенный (иногда уреженный), может быть аритмичным. При выраженной сердечной недостаточности наблюдается набухание шейных вен. Возникает нарушение внутрисердечной проводимости, которое даже при небольших очагах поражения может стать причиной аритмии и привести к летальному исходу. Нарушение сердечного ритма проявляется суправентрикулярной (наджелудочковой) экстрасистолией, реже приступами мерцательной аритмии, что заметно ухудшает гемодинамику, усиливает симптомы сердечной недостаточности.
В большинстве случаев в клинической картине миокардита преобладают лишь отдельные из перечисленных выше симптомов. Примерно у трети пациентов миокардит может протекать малосимптомно. При миокардитах, возникающих на фоне коллагеновых заболеваний, а также вирусной инфекции часто возникает сопутствующий перикардит. Идиопатический миокардит имеет тяжелое, иногда злокачественное течение, приводящее к кардиомегалии, тяжелым нарушениям ритма и проводимости сердца и сердечной недостаточности.
Осложнения
При длительно текущем миокардите развиваются склеротические поражения сердечной мышцы, возникает миокардитический кардиосклероз. В случае острого миокардита при тяжелых нарушениях работы сердца быстро прогрессирует сердечная недостаточность, аритмия, становящиеся причиной внезапной смерти.
Существенные трудности в диагностике миокардитов вызывает отсутствие специфических диагностических критериев. Мероприятия по выявлению воспалительного процесса в миокарде включают:
- Сбор анамнеза
- Физикальное обследование пациента - симптомы варьируют от умеренной тахикардии до декомпенсированной желудочковой недостаточности: отеки, набухание шейных вен, нарушение ритма сердца, застойный процесс в легких.
- ЭКГ - нарушение сердечного ритма, возбудимости и проводимости. ЭКГ-изменения при миокардите не являются специфичными, так как сходны с изменениями при различных заболеваниях сердца.
- ЭхоКГ - выявляется патология миокарда (расширение полостей сердца, снижение сократительной способности, нарушение диастолической функции) в разной степени в зависимости от тяжести заболевания.
- Общий, биохимический, иммунологический анализы крови не являются столь специфичными при миокардите и показывают увеличение содержания α2 и γ - глобулинов, повышение титра антител к сердечной мышце, положительную РТМЛ (реакцию торможения миграции лимфоцитов), положительную пробу на С-реактивный белок, повышение сиаловых кислот, активности кардиоспецифичных ферментов. Исследование иммунологических показателей должно проводиться в динамике.
- Рентгенография легких помогает обнаружить увеличение размеров сердца (кардиомегалию) и застойные процессы в легких.
- Бакпосев крови для выявления возбудителя, или ПЦР диагностика.
- Эндомиокардиальная биопсия при помощи зондирования полостей сердца, включающая гистологическое исследование биоптатов миокарда, подтверждает диагноз миокардита не более чем в 37% случаев в связи с тем, что может иметь место очаговое поражение миокарда. Результаты повторной биопсии миокарда дают возможность оценить динамику и исход воспалительного процесса.
- Сцинтиграфия (радиоизотопное исследование) миокарда является физиологичным исследованием (прослеживается естественная миграция лейкоцитов в очаг воспаления и нагноения).
- Магнитно-резонансная томография (МРТ сердца) с контрастированием дает визуализацию воспалительного процесса, отека в миокарде. Чувствительность данного метода составляет 70-75%.
Лечение миокардита
Острая стадия миокардита требует госпитализации в отделение кардиологии, ограничения физической активности, строгого постельного режима на 4 - 8 недель до достижения компенсации кровообращения и восстановления нормальных размеров сердца. Диета при миокардите предполагает ограниченное употребление поваренной соли и жидкости, обогащенное белковое и витаминизированное питание для нормализации метаболических процессов в миокарде.
Терапию миокардита проводят одновременно по четырем направлениям, осуществляя этиологическое, патогенетическое, метаболическое симптоматическое лечение. Этиологическое лечение направлено на подавление инфекционного процесса в организме. Терапию бактериальных инфекций проводят антибиотиками после выделения и определения чувствительности патогенного микроорганизма. При миокардитах вирусного генеза показано назначение противовирусных препаратов.
Необходимым условием успешного лечения миокардитов служит выявление и санация инфекционных очагов, поддерживающих патологический процесс: тонзиллита, отита, гайморита, периодонтита, аднексита, простатита и др. После осуществления санации очагов (хирургической или терапевтической), курса противовирусной или антибактериальной терапии необходимо проведение микробиологического контроля излеченности.
В патогенетическую терапию миокардитов включают противовоспалительные, антигистаминные и иммуносупрессивные препараты. Назначение нестероидных противовоспалительных средств осуществляется индивидуально, с подбором дозировок и длительности курса лечения; критерием отмены служит исчезновение лабораторных и клинических признаков воспаления в миокарде. При тяжелом, прогрессирующем течении миокардита назначаются глюкокортикоидные гормоны. Антигистаминные средства способствуют блокированию медиаторов воспаления.
Для улучшения метаболизма сердечной мышцы при миокардитах применяют препараты калия, инозин, витамины, АТФ, кокарбоксилазу. Симптоматическое лечение миокардитов направлено на устранение аритмий, артериальной гипертензии, симптомов сердечной недостаточности, профилактику тромбоэмболий. Длительность лечения миокардита определяется тяжестью заболевания и эффективностью комплексной терапии и составляет в среднем около полугода, а иногда и дольше.
Прогноз
При латентном малосимптомном течение миокардита возможно самопроизвольное клиническое излечение без отдаленных последствий. В более тяжелых случаях прогноз миокардитов определяется распространенностью поражения миокарда, особенностями воспалительного процесса и тяжестью фонового заболевания.
При развитии сердечной недостаточности у 50% пациентов отмечается улучшение по результатам лечения, у четверти наблюдается стабилизация сердечной деятельности, у оставшихся 25% состояние прогрессирующе ухудшается. Прогноз при миокардитах, осложненных сердечной недостаточностью, зависит от выраженности дисфункции левого желудочка.
Неудовлетворительный прогноз отмечается при некоторых формах миокардитов: гигантоклеточном (100%-ая смертность при консервативной терапии), дифтерийном (смертность составляет до 50–60%), миокардите, вызванном болезнью Шагаса (американским трипаносомозом) и др. У этих пациентов решается вопрос о трансплантации сердца, хотя и не исключается риск развития повторного миокардита и отторжения трансплантата.
Профилактика
Для снижения риска заболеваемости миокардитом рекомендуется соблюдать меры предосторожности при контакте с инфекционными больными, санировать очаги инфекции в организме, избегать укусов клещей, осуществлять вакцинацию против кори, краснухи, гриппа, свинки, полиомиелита.
Пациенты, перенесшие миокардит, проходят диспансерное наблюдение у кардиолога 1 раз в 3 месяца с постепенным восстановлением режима и активности.
Миокардиодистрофия
Миокардиодистрофия – вторичное поражение миокарда, обусловленное метаболическими нарушениями и приводящее к дистрофии и дисфункции сердечной мышцы. Миокардиодистрофия сопровождается кардиалгией, перебоями сердечного ритма, умеренной тахикардией, быстрой утомляемостью, головокружением, одышкой. Диагностика миокардиодистрофии основывается на данных анамнеза и клиники, электрокардиографии, фонокардиографии, рентгенографии, эхокардиографии, МРТ, сцинтиграфии, биохимического исследования крови и др. Лечение миокардиодистрофии предполагает проведение патогенетической терапии кардиотрофиками и симптоматической терапии антиаритмическими, антигипертензивными препаратами, сердечными гликозидами и т. д.
Термином «миокардиодистрофия» (вторичная кардиомиопатия, дистрофия миокарда) в кардиологии объединяют группу невоспалительных и недегенеративных поражений миокарда, сопровождающихся выраженным расстройством обменных процессов и значительным снижением сократительной способности сердечной мышцы. Миокардиодистрофия всегда является вторичным процессом, включающим дисметаболические, электролитные, ферментные, нейрогуморальные и вегетативные нарушения. Миокардиодистрофия характеризуется дистрофией миоцитов и структур проводящей системы сердца, что ведет к нарушению основных функций сердечной мышцы – сократимости, возбудимости, автоматизма, проводимости.
Миокардиодистрофия, особенно на своих начальных стадиях, имеет, как правило, обратимый характер, что отличает ее от дегенеративных изменений миокарда, возникающих при гемохроматозе и амилоидозе сердца.
Причины миокардиодистрофии
К миокардиодистрофии могут приводить самые различные внешние и внутренние факторы, нарушающие протекание обмена веществ и энергии в миокарде. Миокардиодистрофия может развиваться под влиянием:
- острых и хронических экзогенных интоксикаций (алкогольной, лекарственной, промышленной и др.), физических агентов (радиации, вибрации, перегревания);
- эндокринных и обменных нарушений (тиреотоксикоза, гипотиреоза, гиперпаратиреоза, сахарного диабета, ожирения, авитаминоза, синдрома Кушинга, патологического климакса);
- системных заболеваний (коллагенозов, нейромышечной дистрофии),
- инфекций (хронического тонзиллита и др.), болезней пищеварительной системы (цирроза печени, панкреатита, синдрома мальабсорбции).
Причинами миокардиодистрофии у новорожденных и детей раннего возраста могут быть перинатальная энцефалопатия, внутриутробные инфекции, синдром дезадаптации сердечно-сосудистой системы на фоне гипоксии.У спортсменов миокардиодистрофия может возникать в результате чрезмерного физического перенапряжения (патологическое спортивное сердце).
Различные неблагоприятные факторы вызывают расстройство электролитного, белкового, энергетического обмена в кардиомиоцитах, накопление патологических метаболитов. Изменения биохимических процессов в миокарде приводят к нарушению сократительной функции мышечных волокон, различным нарушениям ритма и проводимости, сердечной недостаточности. При устранении этиологического фактора трофические процессы в миоцитах могут полностью восстанавливаться. Однако при длительном неблагоприятном воздействии происходит гибель части кардиомиоцитов и их замещение соединительной тканью – формируется кардиосклероз.
Клинические формы миокардиодистрофии
Миокардиодистрофия при анемиях
Нарушения в миокарде развиваются при уменьшении гемоглобина до 90-80 г/л. На этом фоне развивается гемическая гипоксия, сопровождающаяся энергетическим дефицитом в миокарде. Анемическая миокардиодистрофия может возникать при железодефицитной и гемолитической анемии, при острой и хронической кровопотере, ДВС-синдроме.
Клиническими проявлениями миокардиодистрофии при анемии служат бледность кожных покровов, головокружение, одышка, тахикардия, усиление пульсации сонных артерий. Перкуторное исследование выявляет расширение границ сердца, свидетельствующее о гипертрофии миокарда. Аускультативно обнаруживаются громкие тоны сердца, систолические шумы над сердцем и сосудами, «шум волчка» на шейных сосудах. Сердечная недостаточность развивается при длительной анемии и неадекватном лечении.
Миокардиодистрофия при тиреотоксикозе
Под влиянием избыточного количества тиреоидных гормонов в сердечной мышце снижается синтез аденозинтрифосфорной кислоты (АТФ) и креатинфосфата (КФ), что сопровождается энергетическим, а затем и белковым дефицитом. В то же время, тиреоидные гормоны стимулируют активность симпатической нервной системы, вызывая увеличение ЧСС, минутного объема крови, скорости кровотока, ОЦК. В таких условиях изменение внутрисердечной гемодинамики не может быть подкреплено энергетически, что в итоге приводит к развитию миокардиодистрофии.
В клинике миокардиодистрофии при тиреотоксикозе преобладают аритмии (синусовая тахикардия, экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия). Длительный тиреотоксикоз вызывает хроническую недостаточность кровообращения, преимущественно по правожелудочковому типу, которая проявляется болями в области сердца, отеками, гепатомегалией. Иногда при тиреотоксикозе доминируют симптомы миокардиодистрофии, в связи с чем пациенты обращаются, в первую очередь, к кардиологу, а уже затем попадают к эндокринологу.
Миокардиодистрофия при гипотиреозе
Патогенетической основой миокардиодистрофии при гипотиреозе служит дефицит тиреоидных гормонов, ведущий к снижению активности метаболизма в миокарде. При этом в результате повышения проницаемости сосудов происходит задержка жидкости в миоцитах, что сопровождается развитием дисметаболических и электролитных нарушений (повышением содержания натрия и уменьшением калия).
Миокардиодистрофия при гипотиреозе характеризуется постоянными ноющими болями в сердце, аритмиями (синусовой брадикардией), блокадами (предсердной, атриовентрикулярной, желудочковыми).
Алкогольная и токсическая миокардиодистрофия
Считается, что к алкогольной миокардиодистрофии приводит ежедневный прием 80-100 мл этилового спирта на протяжении 10 лет. Однако при наследственном дефиците ряда ферментов, расщепляющих этанол, стрессах, частых вирусных инфекциях миокардиодистрофия может развиться и в более короткие сроки – за 2-3 года даже при употреблении меньших количеств алкоголя. Алкогольная миокардиодистрофия встречается преимущественно у мужчин 20—50 лет.
Токсическая миокардиодистрофия встречается у лиц, получающих длительную терапию иммунодепрессантами (цитостатиками, глюкокортикостероидами), НПВП, некоторыми антибиотиками, транквилизаторами, а также при отравлениях хлороформом, фосфором, мышьяком, угарным газом и т. д. Такие варианты миокардиодистрофии могут протекать в кардиалгической (болевой), острой аритмической, сочетанной и застойной формах.
Кардиалгическая форма миокардиодистрофии характеризуется щемящими или ноющими болями в грудной клетке, преходящим ощущением жара или зябкости конечностей, потливостью. Больных беспокоит общая слабость, быстрая утомляемость, снижение физической выносливости, головные боли.
Аритмическая форма миокардиодистрофии сопровождается тахикардией, нарушениями ритма и проводимости сердца (синусовой тахи- или брадикардией, экстрасистолией, блокадами ножек пучка Гиса), иногда - приступами фибрилляции и трепетания предсердий. При сочетанной форме миокардиодистрофии отмечаются аритмии и кардиалгии. Проявления застойной миокардиодистрофии обусловлены сердечной недостаточностью и включают одышку при напряжении, кашель, приступы сердечной астмы, отеки на ногах, гидроперикард, гидроторакс, гепатомегалию, асцит.
Тонзиллогенная миокардиодистрофия
Поражения миокарда при тонзиллите возникают у 30—60% пациентов. Тонзиллогенная миокардиодистрофия обычно развивается после серии перенесенных ангин, протекающих с высокой лихорадкой и интоксикацией. В клинике тонзиллогенной миокардиодистрофии превалируют жалобы на боли в области сердца интенсивного характера, выраженную слабость, неритмичный пульс, одышку, очаговую или диффузную потливость, субфебрилитет, артралгии.
Миокардиодистрофия физического перенапряжения
Развивается у спортсменов, выполняющих физические нагрузки, которые превышают их индивидуальные возможности. В этом случае поражению миокарда могут способствовать скрытые хронические очаги инфекции в организме - синусит, тонзиллит, аднексит и пр.; отсутствие полноценного отдыха между тренировками и т. д. В отношении патогенеза миокардиодистрофии физического напряжения выдвинуто ряд теорий: гипоксическая, нейродистрофическая, стероидно-электролитная.
Данный вариант миокардиодистрофии в основном проявляется симптомами общего характера: слабостью, вялостью, быстрой утомляемостью, угнетенным настроением, снижением интереса к спорту. Может возникать сердцебиение, покалывание в области сердца, перебои.
Климактерическая миокардиодистрофия
Развивается вследствие дисгормональных процессов у женщин в возрасте 45 – 50 лет. Климактерическая миокардиодистрофия проявляется болями в области сердца давящего, колющего или ноющего характера, иррадиирующими в левую руку. Кардиалгии усиливаются в связи с «приливами», сопровождаются ощущением жара, учащенным сердцебиением, повышенной потливостью. Сердечная недостаточность при климактерической миокардиодистрофии может развиться при имеющейся сопутствующей артериальной гипертензии.
Диагностика миокардиодистрофии
У пациентов с миокардиодистрофией в анамнезе обычно выявляются заболевания или патологические состояния, сопровождающиеся тканевым гипоксическим синдромом и нарушением метаболических процессов. Объективное исследование сердца обнаруживает нерегулярный пульс, приглушение сердечных тонов, ослабление I тона на верхушке, систолический шум.
При электрокардиографии регистрируются различные аритмии, нарушения процессов реполяризации миокарда, снижение сократительной функции миокарда. Проведение нагрузочных и фармакологических проб при миокардиодистрофии, как правило, дает отрицательные результаты. Фонокардиография обнаруживает изменения соотношения длительности электрической и механической систолы, появление галопного ритма и систолического шума на основании и верхушке, приглушение тонов сердца. С помощью эхокардиографии определяется расширение камер сердца, изменение структуры миокарда, отсутствие органической патологии.
Выявляемая при рентгенографии грудной клетки миопатическая конфигурация сердца, свидетельствует о глубоком поражении миокарда. Сцинтиграфия позволяет оценить метаболизм и перфузию миокарда, выявить очаговые и диффузные дефекты накопления как, указывающие на снижение числа функционирующих кардиомиоцитов.
К биопсии сердечной мышцы прибегают в сомнительных случаях, при неинформативности неинвазивных исследований. Дифференциальный диагноз миокардиодистрофии проводится с ИБС, миокардитами, атеросклеротическим кардиосклерозом, легочным сердцем, пороками сердца.
Лечение миокардиодистрофии
Комплексная терапия миокардиодистрофии складывается из лечения основного заболевания, патогенетической (метаболической) и симптоматической терапии. В связи с этим лечебная тактика при миокардиодистрофии определяется не только кардиологом, но и узкими специалистами – гематологом, отоларингологом, эндокринологом, ревматологом, гинекологом-эндокринологом, спортивным врачом. Больным рекомендуется щадящий физический режим, исключение вредных профессиональных воздействий, контакта с химикатами, приема алкоголя и курения.
Метаболическая терапия миокардиодистрофии предполагает назначение витаминов группы В, кокарбоксилазы, АТФ, препаратов калия и магния, инозина, анаболических стероидов и других препаратов, улучшающих метаболические процессы и питание сердечной мышцы.
При сердечной недостаточности показаны диуретики, сердечные гликозиды; при аритмиях – противоаритмические средства. При климактерической миокардиодистрофии назначается ЗГТ, седативные и гипотензивные препараты. Этиотропная терапия тонзиллогенной миокардиодистрофии требует интенсивного лечения тонзиллита вплоть до тонзиллэктомии.
Прогноз и профилактика миокардиодистрофии
Обратимость изменений миокарда при миокардиодистрофии зависит от своевременности и адекватности лечения основного заболевания. Исходом длительно протекающей миокардиодистрофии служит миокардиосклероз и сердечная недостаточность.
Предупреждение миокардиодистрофии основано на устранении текущих заболеваний, учете возраста и физической подготовки при занятиях спортом, отказе от алкоголя, исключении профессиональных вредностей, полноценном питании, обязательной санации очагов инфекции. Рекомендуются повторные медикаментозные курсы кардиотрофной терапии 2–3 раза в год.
Читайте также:
