Карцинома Меркеля
Добавил пользователь Alex Обновлено: 27.01.2026
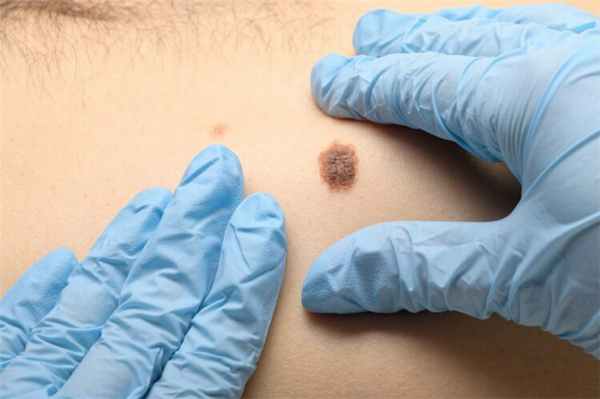
Первый признак заболевания - появление безболезненного образования на коже розового или красно-фиолетового цвета, которое быстро растет (в 2 и более раза за последние 3 месяца). Наиболее часто образования располагаются на подверженных солнцу участках кожных покровов (голова и шеи, конечности) (см. рис.1). MCC отличается высокой склонностью к возникновению местных рецидивов и лимфогенному метастазированию.
Рис.1: кожные проявления Карциномы Меркеля
Первые описания карциномы Меркеля появились в 1972 году. По данным SEER (Surveillance, Epidemiology and End Result Programm) ежегодно регистрируется 0.6 случаев на 100 000 человек. Наибольшая заболеваемость карциномой меркеля приходится на жителей Австралии и Новой Зеландии.
По данным исследования, предпринятого SEER (Surveillance, Epidemiology and End Result Programm) 95% случаев карциномы Меркеля приходится на людей со светлой кожей, при этом риск заболеть данным заболеванием выше у мужчин, чем у женщин.
Рис. 2: На приведенной выше схеме можно увидеть расположение клеток Меркеля в эпидермисе, а также встречающиеся маркеры заболевания (frequently and occasionally observed markers) и вирус-специфические маркеры.
Патогенез
Существует несколько факторов, ассоциированных с карциномой Меркеля. Среди них: полиомавирус, поражающий клетки Меркеля; ультрафиолетовое излучение; иммуносупрессия.
1. Полиомавирус клеток Меркеля (MCPyV)
Является двуцепочечным ДНК-содержащим вирусом. Исследования показали, что полиомавирус был обнаружен в 80% случаев карциномы Меркеля. В одном из исследований, в котором для определения полиомавируса клеток меркеля использовались моноклональные антитела к антигенам, расположенным на Т-лимфоцитах, в 56 случаях из 60 было установлено наличие вируса, в то время как во всех исследуемых образцах методом ПЦР была обнаружена ДНК вируса.
MCPy вирус распространен повсеместно, однако каждой географической области соответствует свой генотипический вариант. Считается что вирус клеток Меркеля является неотъемлемрй частью индивидуального микробиома кожи. Также, по данным Viscidi, Rollison и др. из госпиталя Джона Хопкинса, было отмечено, что с возрастом увеличивается титр антител к Vp1 - вирусному белку, который входит в структуру капсида полиомавируса.
Поражая здоровые клетки, вирус встраивается в их геном и инициирует выработку клеткой онкобелков: LT (large tumor antigen) – большой опухолевый антиген, и sT(small tumor antigen) – малый опухолевый антиген, которые экспрессируются клетками карциномы Меркеля и запускают каскад онкогенеза. LT-белок является конкурентным лигандом к белку ретинобластомы, который в свою очередь ограничивает способность клеток к репликации ДНК, предотвращая её прогрессирование из (G-1) в (S) фазы цикла клеточного деления. LT-антиген связывается с белком ретинобластомы (Rb), и вызывает изменение его конформации, что ведет к диссоциациисвязи с Е2F1, и в дальнейшем к нарушению репликации ДНК и бесконтрольному росту клетки. (более наглядно механизм канцерогенеза можно увидеть на рис.3)
Рис. 3: На данной схеме можно проследить 2 пути канцерогенеза при карциноме Меркеля. На схеме слева, изображен механизм канцерогенеза при вирус-положительной карциноме. На правой части схемы отображен вирус-независимый механизм развития MCC: соматические мутации в RB1 к нарушению его функции и прогрессии клеточного роста.
2. Воздействие ультрафиолета
Действие ультрафиолета как одного из факторов канцерогенеза карциномы Меркеля было доказано рядом исследований:
- Региональные уровни заболеваемости, по данным Robertson, Liang из North Shore Hospital Новой Зеландии, коррелируют с увеличением воздействия солнечного излучения, которое оценивалось ультрафиолетовым индексом.
- В исследовании E.Lunder и R.Stern была проанализирована заболеваемость карциномой Меркеля у пациентов, которые получали терапию псораленом с одновременным облучение УФ-спектром. (PUVA therapy)
Cчитается, что воздействие ультрафиолета является альтернативной причиной развития вирус-негативной карциномы Меркеля.
3. Вирус-негативная Карцинома Меркеля
До конца не установлена непосредственная причина развития вирус-негативной карциномы Меркеля. Считается что в основе патогенеза лежит соматическая мутация в онко-супрессорном гене ТР53 и RB1 гене. Ранее вы уже могли ознакомиться с механизмом канцерогенеза в случае мутации в TP53. Мутации в гене RB1 приводят к нарушению синтеза одноименного белка, который, как было сказано ранее, способен связываться с транскрипционным фактором E2F и тем самым ограничивать прогрессию клеточного деления за счёт нахождения клетки в G1 фазе клеточного цикла (рис.3).
Диагностика карциномы Меркеля
Первыми проявлениями карциномы меркеля является одиночный очаг куполообразной формы красного цвета, имеющий уплотнения вокруг.
Обычно, очаг составляет менее 2 см в диаметре. Цвет образования может варьировать от красного до фиолетового. Кожа над образованием не имеет складок, блестящая, чаще без изъязвления.
Чаще всего карцинома Меркеля, по данным национального Канцер-регистра США, поражает зоны подверженные УФ-облучения:
- голова и шея 43%
- верхние конечности – 24
- нижние конечности -15%
- другие локализации 9%
Клинические проявления карциномы меркеля можно запомнить с помощью акронима AEIOU:
A – asymptomatic - бессимптомность
E – expanding rapidly – скорость роста составляет не более 3 месяцев
I – immune suppression – карцинома Меркеля ассоциирована с иммуносупрессией
O – older than 50 years age - карцинома Меркеля развивается в возрасте старше 50 лет
UV- exposed – карцинома Меркеля наиболее часто поражает людей со светлой кожей.
При наличии хотя бы 3-х из вышеперичисленных критериев увеличивает риск того, что подозрительное образование – карцинома Меркеля.
При дерматоскопии специфических проявлений карциномы Меркеля описано не было. По данным Jalilian C, Chamberlain AJ и др из Melbourne Alfred Hospital, рекомендуемыми критериями постановки диагноза являются: нерегулярность и полиморфизм сосудов, молочно-розовые пятна, белые пятна, зоны лишенные структурности, при этом зоны пигментирования при карциноме Меркеля не выявляются (см.рис 4).
Рис. 4: Карцинома Меркеля при осмотре
Окончательный ответ о наличии или отсутствии MCC дает морфологическое заключение.
Есть 3 морфологических типа карциномы Меркеля, которые не обладают прогностической силой, а помогают дифференцировать MCC от других заболеваний:
1. Промежуточный тип (рис. 5)
2. Мелкоклеточный тип (рис. 6)
3. Трабекулярный тип (рис. 7)
Рис. 5: Промежуточный тип карциномы меркеля: наиболее распространенный морфологический вариант карциномы меркеля. В микроскопе можно увидеть большие узлы из диффузно-расположенных базофильных клеток с характерным круглым овальным ядром и мелким, едва заметным ядрышком
Рис. 6.: Мелкоклеточный вариант. Опухоль представлена мелкими круглыми клетками с овальным гиперхромным ядром. Опухолевые клетки могут объединяться в группы. Опухоль с таким морфологическим типом обладает наиболее агрессивным течением
Рис. 7 Трабекулярный вариант. Опухоль представлена полигональными клетками с выраженной цитоплазной и центрально расположенным ядром с практически незаметным ядрышком. Этот тип опухоли встречается в 10% случаев.
При иммуногистохимическом анализе клетки карциномы Меркеля экспрессируют маркеры характерные и для эпителиальных и для нейроэндокринных клеток. Эпителиальными маркерами являются: AE\AE3, CAM 5.2, пан-цитокератин. К нейроэндокринным маркерам относятся: хромогранин , синаптофизин, соматостатин, кальцитонин и вазо-интестинальный пептид (ВИП).
Цитогенетический и молекулярный анализ
При карциноме меркеля могут быть выявлены множественные хромосомные нарушения. Чаще всего нарушения происходят в 1,5,6, 8 и 13 хромосомах. В 40% случаев мутации затрагивают короткое плечо 1 хромосомы. Описаны соматические мутации в онкосупрессорных генах RB1 и TP53. Мутации в ТР53 описаны в 28% случаев карциномы Меркеля. Инактивация RB1- чаще всего ассоциирована с MCPyV(меркель полиомавирус) – негативной карциномой Меркеля. Реже встречаются мутации генов, кодирующих белки тирозин-киназного сигнального пути (PIK3CA, KIT, PDGFR).
Стадирование
Для стадирования карциномы Меркеля используется классификация AJCC 8th основой которой является система стадирования Yiengpruksawan и др. из Memorial Sloan Kettering Cancer Center:
Стадия I – Лимфаденопатии нет
Стадия IA - Опухоль < 2 cm
Стадия IB - Опухоль >2 cm
Стадия II – Есть регионарная лимфаденопатия
Стадия III – Есть отдаленные метостазы
При диагностике заболевания чаще всего встречается I стадия (55%), затем - II (31%), а также стадия III (6%).
Лечение
Широкое иссечение с отступом от края опухоли 2-3 см – основной подход в лечении карциномы Меркеля на ранней стадии заболевания. Карцинома Меркеля редкое заболевание, поэтому все рекомендации основаны на ретроспективных анализах и описаниях редких случаев заболевания.
В 55% случаев при карциноме Меркеля поражены лимфатические узлы. В связи с этим остается открытым вопрос о необходимости профилактической лимфодиссекции. До появления в практике биопсии сигнального лимфоузла для опухолей более 2 см в диаметре применялась профилактическая лимфодиссекция. По данным Silva и др. (1984) удаление регионарных лимфоузлов рекомендовано при наличии более 10 митозов в морфологическом препарате первичной опухоли, наличии лимфатической инвазии. Cotlar и др. (1986) предлагали выполнять лимфодиссекцию при существовании опухоли более 6 недель. В настоящее время для стадирования заболевания и решения вопроса о лимфодиссекции используют биопсию сигнального лимфоузла.
В случае положительного лимфатического узла, по данным NCCN пациенту рекомендовано выполнение лимфодиссекции или лучевой терапии на область лимфатических узлов. Данные исследования Chen MM, Roman SA и др, в котором было показано увеличение выживаемости в группе пациентов, которым проводилось послеоперационная химиолучевая по сравнению с пациентами которым проводилось только хирургическое лечение или иссечение с последующей лучевой терапией. В рамках данного исследования была выделена группа повышенного риска, критериями которой являются:
первичная опухоль >1.5 cm;
позитивный край резекции;
наличие лимфатической, сосудистой или периневральной инвазии опухоли;
наличие метастаза в региональных лимфоузлах
Рекомендуемая доза, по данным Trans Tasman Oncology Group, составляет 45-50 Гр. В случае позитивного края резекции или наличия метастаза в регионарном лимфоузле доза должна быть увеличена до 55 – 65 Гр.
Химиотерапевтическое лечение, согласно клиническим рекомендациям МЗ РФ, показано больным с метастатической болезнью. 1-й линией химиотерапии является комбинация этопозида и карбоплатина. В качестве второй линии терапии применяется СAV (циклофосфамид-адриамицин-винкристин). Однако, согласно данным исследования Tai Pt, Winquist E и др., химиотерапевтическое лечение показано больным с высоким индексом карнофского или ECOG статусом 0-1 в связи с высоким риском летальных осложнений (7 из 204 случаев (3%)).
Рис. 8: На схеме изображено взаимодействие опухолевой клетки экспрессирующей лиганд к PD-1-рецептору с Т-лимфоцитом. При взаимодействии PD-1 рецептора с лигандом – Т-лимфоцит инактивируется и прекращает противоопухолевое действие. PD-L1 блокаторы нарушают взаимодействие между опухолевой клеткой и Т-лимфоцитов, что приводит к активации противоопухолевого иммунитета.
Во второй фазе исследования JAVELIN Merkel 200 trial ответ на терапию был достигнут у 32% больных. Однако в рамках данного исследования пациентам не был проведен анализ экспрессии опухолью PD-1, с чем может быть связан не самый показательный ответ опухоли на терапию. Нежелательные явления связанные с применением препараты были выявлены в 6% случаев.
Как и другие нейроэндокринные опухоли, клетки карциномы Меркеля экспрессируют рецепторы к соматостатину. Экспрессию рецепторов к соматостатину можно увидеть при выполнении ПЭТ-КТ с пентреотидом меченым индием ( indium-111 pentreotide). Есть данные отдельных клинических случаев, в которых показан полный ответ опухоли на октретид после визуализации опухоли на ПЭТ-КТ с пентреотидом.
Прогноз
Картина пациента с благоприятным прогнозом такова: женщина моложе 65 лет, без коморбидных состояний, с локализованной формой заболевания. Самым сильным негативным фактором в прогнозе заболевания является распространения процесса на лимфатические узлы.
Рис. 9: Графики выживаемости. График 1 — Выживаемость в зависимости от статуса лимфатических узлов. График 2 — Выживаемость в зависимости от стадии заболевания.
По данным Tai PT, Yu E и др.,при локализованной форме заболевания рецидив возникает в 29% случаев, а при поражении лимфатических узлов – 33%. Локальный рецидив обычно развивается в течении 1-го года после первичного лечения опухоли, с медианой появления признаков рецидива в 4 месяца. Медиана общей выживаемости по данным Tai PT, Yu E и др, составила 27 месяцев (с размахом от 1 до 216 месяцев).
Карцинома Меркеля
(нейроэндокринная карцинома; первичный мелкоклеточный рак кожи; трабекулярная карцинома; апудома кожи; анапластическая карцинома)
, MD, Ada West Dermatology and Dermatopathology
Карцинома Меркеля является редкой, агрессивной формой рака кожи, который чаще встречается у пожилых людей европеоидной расы.
Средний возраст в момент постановки диагноза составляет около 75 лет. Карцинома Меркеля также может возникать у более молодых пациентов с иммуносупрессией. Другие факторы риска включают: кумулятивное воздействие ультрафиолетового излучения, воздействие полиомавируса клеток Меркеля, наличие других форм рака (например, множественной миеломы, хронического лимфолейкоза, меланомы Меланома Меланома возникает из меланоцитов в тканях, содержащих пигмент (например, на коже, слизистых оболочках, глазах или в центральной нервной системе). Метастазирование коррелирует с глубиной проникновения. Прочитайте дополнительные сведенияСимптомы и признаки карциномы Меркеля
Кожные проявления обычно плотные, блестящие узлы, телесного или голубовато-красного цвета. Наиболее характерными клиническими признаками их являются быстрый рост и отсутствие боли и болезненности. Хотя карцинома Меркеля может поражать кожу любой части тела, она наиболее часто возникает на открытых участках, подвергающихся инсоляции (например, кожа лица, верхних конечностей).
Диагностика Меркель-карциномы
Диагностика Меркель-карциномы проводится с помощью биопсии.
У большинства пациентов возникают метастазы, и прогноз неблагоприятный.
Лечение карциномы Меркеля
Тактика лечения определяется стадией заболевания
Лечение карциномы Меркеля определяется стадией опухоли и, как правило, включает в себя широкое местное иссечение опухоли, часто сопровождающееся лучевой терапией, лимфодиссекцией, или применением обоих этих методов.
Системная терапия (например, авелумабом или другим ингибитором рецептора запрограммированной гибели клеток 1 типа [PD-1] или обычной химиотерапией) может быть показана при метастатическом или рецидивирующем раке.
Профилактика метастатической карциномы Меркеля
Поскольку возникновение карциномы Меркеля, по-видимому, связано с экспозицией ультрафиолета (УФ), рекомендуется соблюдение ряда мер для уменьшения экспозиции.
Избегание воздействия солнечного света: поиск тени, минимизировать пребывание на открытом воздухе между 10 ч утра и 4 ч дня (когда солнечные лучи наиболее активны), а также избегать приема солнечных ванн и использования соляриев
Пользоваться защитной одеждой: рубашки с длинными рукавами, брюки и широкополые шляпы
Использовать солнцезащитные препараты с фактором защиты (SPF) 30 и более и широким диапазоном защиты от ультрафиолетового излучения УФA/УФB, наносить согласно предписанию (то есть наносить повторно каждые 2 часа или после купания или потоотделения); солнцезащитные препараты для продления экспозиции солнечного света не могут использоваться
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Карцинома Меркеля: современные возможности терапии
- КЛЮЧЕВЫЕ СЛОВА: карцинома Меркеля, полиомавирус клеток Меркеля, PD-1, PDL-1, лучевая терапия, химиотерапия
Согласно классификации Всемирной организации здравоохранения карцинома Меркеля (КМ) – редкая злокачественная первичная опухоль кожи с эпителиальной и нейроэндокринной дифференцировкой [1]. Исходя из современных эпидемиологических данных США и некоторых стран Европы, заболеваемость КМ продолжает увеличиваться. По данным базы SEER (Surveillance, Epidemiology and End Results database), заболеваемость в 2006 г. составила 0,6 случая на 100 000 (0,15 случая на 100 000 в 1986 г.) (рис. 1) с преобладанием мужчин (60%). Ежегодно в США регистрируется около 1500 новых случаев КМ [2]. Эпидемиологических данных по Российской Федерации нет.
Несмотря на рост заболеваемости в мире, КМ остается редкой болезнью, что позволяет относить ее к так называемым орфанным заболеваниям.
Одним из факторов риска развития КМ, скорее всего влияющих на рост заболеваемости, является возраст старше 65 лет (рис. 2). Средний возраст большинства пациентов (71,6%) на момент постановки диагноза – 69–70 лет [3]. При этом наблюдается 5–10-кратное увеличение заболеваемости среди пациентов старше 70 лет по сравнению с пациентами в возрасте до 60 лет.
Факторы риска
Увеличение риска развития КМ связывают с длительным пребыванием на солнце, воздействием ультрафиолетовых лучей. Подтверждение тому – частая локализация КМ на открытых, наиболее подверженных воздействию солнечных лучей участках кожи (голова и шея, конечности).
На увеличение риска развития КМ влияет и состояние иммуносупрессии. Так, КМ среди больных СПИДом наблюдается в 2,3 раза чаще, чем в обычной популяции, в пять раз чаще среди пациентов после трансплантации органа. 15,7-кратное увеличение риска КМ имеет место у пациентов с B-клеточными неоплазиями. В 50% случаев возраст таких пациентов менее 50 лет.
Пациенты, которые получают лечение метоксаленом и РUVA (фотохимиотерапия) по поводу псориаза, характеризуются 100-кратным увеличением риска КМ. Известно несколько клинических случаев спонтанной регрессии КМ после нормализации состояния иммунной системы [4, 5]. Кроме того, в литературе описаны случаи спонтанной регрессии опухоли, как правило у лиц женского пола.
В январе 2008 г. Н. Feng и соавт. представили доказательства возможного вирусного онкогенеза. Авторы исследовали образцы опухоли КМ и обнаружили новый полиомавирус, который был назван полиомавирусом клеток Меркеля [6].
После открытия L. Gross в 1953 г. мышиного полиомавируса было высказано предположение, что полиомавирусы способны вызывать развитие рака у человека [7]. Полиомавирусы могли вызывать развитие опухоли у животных, но это не означало их участие в канцерогенезе опухолей человека. Полиомавирусы часто вызывают латентные инфекции без манифестации болезни, но, например, на фоне иммуносупрессии способны провоцировать развитие опухоли.
Клинические проявления
Как правило, КМ представлена в виде единичного, безболезненного, однородного, неизъязвленного, красно-фиолетового узла. Вместе с тем иногда может наблюдаться изъязвление опухолевого образования, а также мультифокальное распространение заболевания [8].
Локализация
В 50% случаев КМ локализуется в области головы и шеи, в 40% – на коже конечностей, в 10% – на коже туловища и половых органов [8]. На момент постановки диагноза у 15% пациентов уже имеются метастазы в лимфатических узлах, а у 50–70% пациентов они реализуются в более поздние сроки.
Наиболее часто КМ метастазирует в кожу (28%) и регионарные лимфатические узлы (27%), реже – в печень (13%), легкие (10%), кости (10%), головной мозг (6%) [9].
В литературе описаны редкие локализации метастатического процесса: яичко, сердце, поджелудочная железа, желудок, конъюнктива глаза, радужка, костный мозг [9–12].
КМ относится к опухолям, тактику лечения которых должна определять мультидисциплинарная команда специалистов, состоящая из хирургов, радиотерапевтов и онкологов [13].
Хирургическое лечение
Основным вариантом лечения первичной опухоли в отсутствие отдаленного метастазирования считается хирургический. Из-за высокой частоты местных рецидивов рекомендуется делать разрез, отступая 1–3 см от видимых краев опухоли. Традиционно рекомендуется делать отступ 2–3 см в пределах неизмененных тканей. Однако в ряде работ приводится незначительное число местных рецидивов при отступе в пределах 1,1 см [14–16]. Согласно рекомендациям NCCN (National Comprehensive Cancer Network – Национальная всеобщая онкологическая сеть) 2016 г. (version 1. 2016) целесообразно делать отступ в пределах неизмененных тканей на 1–2 см. При наличии метастатического поражения лимфатических узлов выполняется лимфоаденэктомия. В отсутствие клинических и инструментальных данных о метастатическом поражении регионарных лимфатических узлов показано выполнение биопсии сторожевого лимфоузла. Это позволяет выявить микрометастазы в регионарных лимфоузлах у 25% пациентов.
При невозможности выполнения хирургического иссечения опухоли рекомендуется подведение дозы ионизирующего излучения 60–66 Гр. Для создания адекватного дозного распределения используются тканеэквивалентные болюсы. При наличии клинически измененных лимфатических узлов и невозможности выполнения лимфодиссекции целесообразно проведение лучевой терапии на вовлеченный лимфоколлектор в дозе 60–66 Гр.
Адъювантное лечение
КМ чувствительна к лучевой терапии. В рекомендациях NCCN лучевая терапия рекомендована в качестве адъювантной терапии для улучшения местного и регионарного контроля роста опухоли. K. Lewis и соавт. описали значительное снижение частоты локорегионарных рецидивов (относительный риск (ОР) 0,27) и отдаленных метастазов (ОР 0,34) при проведении лучевой терапии как на ложе удаленной опухоли, так и на зоны регионарного метастазирования после радикального хирургического лечения.
T. Jouary и соавт. в 2012 г. опубликовали данные многоцентрового исследования о пользе адъювантной лучевой терапии на ложе удаленной опухоли после широкого иссечения и проведении профилактического облучения на зоны лимфооттока у 83 больных КМ I cтадии. При медиане наблюдения 58 месяцев выявлено значительное снижение частоты регионарных рецидивов в группе больных с проведенным профилактическим облучением (n = 39) по сравнению с контрольной группой (n = 44) – 0 и 16,7% соответственно (р = 0,007) [17].
Рекомендуемая доза послеоперационной лучевой терапии – 50–56 Гр с подведением дозы методом классического фракционирования. При наличии опухолевых клеток в краях резекции дозу целесообразно увеличивать до 60–66 Гр. В целях профилактики в отсутствие пораженных лимфатических узлов показано лучевое воздействие на регионарный коллектор в дозе 46–50 Гр. При проведении регионарной лимфодиссекции, наличии значительного числа пораженных лимфатических узлов, экстракапсулярном распространении опухоли доза облучения увеличивается до 50–60 Гр [18].
Рутинное использование адъювантной химиотерапии не рекомендовано. Исследования, посвященные адъювантной химиотерапии, показали увеличение количества осложнений, а также летальности, обусловленной лечением, без преимуществ в выживаемости [19].
Адъювантная химиотерапия может быть использована только у пациентов с факторами высокого риска прогрессирования заболевания: молодой возраст, состояние иммуносупрессии, метастазы в регионарных лимфатических узлах.
Режимы химиотерапии предусматривают использование препаратов платины (цисплатин или карбоплатин) и этопозида. Одновременная химиолучевая терапия может применяться в адъювантном режиме, но статистически значимых преимуществ в выживаемости при ее использовании не получено. При этом наиболее частым осложнением одновременной химиолучевой терапии являются кожные реакции – 60% и нейтропения – 40% [20–22].
Лечение метастатической болезни
Морфологическая картина КМ схожа с таковой при мелкоклеточном раке легкого (МРЛ). Не случайно в лекарственном лечении этой болезни используются схемы, применяемые при МРЛ. Это режимы с включением антрациклинов, антиметаболитов, циклофосфамида, этопозида и производных платины. Использование данных схем часто сопряжено с высокой токсичностью. Ремиссии непродолжительны, что не приводит к значительному увеличению выживаемости. Поэтому химиотерапия часто используется в качестве паллиативной терапии у пациентов с метастатической болезнью. Из-за высокой степени токсичности большинства препаратов назначение химиотерапии должно рассматриваться в каждом случае индивидуально (особенно у пожилых пациентов).
Предпринимаются попытки использования других лекарственных препаратов. Проводилось исследование II фазы по оценке клинической эффективности иматиниба при распространенной КМ (Southwest Oncology Group Study, 2009), но набор пациентов был прекращен из-за отсутствия эффекта [23]. Вероятно, отсутствие эффективности иматиниба было обусловлено некорректным набором пациентов в исследование. На примере гастроинтестинальных стромальных опухолей показано, что иматиниб работает при наличии в опухоли мутации в гене KIT, которая не была определена в рамках данного исследования.
При местно-распространенной или метастатической стадии КМ для уменьшения размеров образования или симптомов болезни успешно применяется лучевая терапия. Если выполнение хирургического иссечения опухоли не представляется возможным, рекомендуется подведение дозы ионизирующего излучения 60–66 Гр. С паллиативной целью лучевую терапию проводят разовой дозой 3 Гр 10–12 фракций.
По данным литературы, химиотерапия, молекулярно-таргетные препараты не показали высокой эффективности в терапии метастатической болезни. Назрела необходимость создания реестра больных КМ, а также проведения многоцентровых клинических исследований по лечению этого редкого заболевания.
С учетом орфанности заболевания выполнение масштабных клинических исследований затруднено. Не случайно в литературе часто встречаются описание клинических случаев, ретроспективные анализы баз данных или результаты небольших по численности клинических исследований.
Клинический случай
Рассмотрим результаты клинического наблюдения за пациенткой К. 76 лет с третьим рецидивом КМ, которая была успешно излечена с использованием химиолучевой терапии.
В 2011 г. пациентка впервые отметила появление на коже правой щеки образование по типу атеромы, которое лечила самостоятельно антибактериальными мазями. Имел место быстрый рост образования – в течение четырех месяцев более чем в 7–10 раз. После обращения к хирургу в июне 2011 г. выполнено иссечение образования. Заключение гистологического исследования: карцинома Меркеля. В декабре 2011 г. появилось образование в проекции послеоперационного рубца. Больная обратилась к врачу. В связи с небольшими размерами уплотнения рекомендовано наблюдение. После увеличения размеров образования в июне 2012 г. выполнено его иссечение. В ноябре 2012 г. – повторное иссечение рецидива. В декабре 2012 г. появилось уплотнение в околоушной области справа. Пациентка обратилась в РОНЦ им. Н.Н. Блохина. После цитологического исследования пунктата из околоушной области справа сделано заключение: рак из клеток Меркеля. При выполнении иммуногистохимического исследования выявлена экспрессия СК20, хромогранина А, Ki67 – 40%, SSTR 2+, MCPyV 1+, р53 2+.
Учитывая рецидивирующее течение опухоли, короткие периоды ремиссии, локализацию опухоли (околоушная слюнная железа), возраст больной, низкую степень дифференцировки опухоли, специалисты по итогам мультидисциплинарного консилиума рекомендовали проведение химиолучевого лечения с индукционной химиотерапией. С 30 января по 31 мая 2013 г. больной К. выполнено шесть курсов полихимиотерапии по схеме: этопозид 100 мг/м 2 с первого по третий день внутривенно, карбоплатин AUC 5 внутривенно в первый день.
С 17 апреля по 13 июня 2013 г. пациентке проведен курс 3D-конформной дистанционной лучевой терапии. Предлучевая подготовка включала разметку зоны интереса на компьютерном томографе и 3D-планирование лучевой терапии в планирующей системе Eclipse. Лучевая терапия проводилась на аппарате Clinac 2300 C/D на мягкие ткани правой щеки ежедневно, пять раз в неделю, с использованием фотонов энергией 6 MeV, разовая очаговая доза (РОД) – 2,5 Гр, суммарная очаговая доза (СОД) – 50 Гр (55 иГр), на шейно-надподключичную зону справа ежедневно, пять раз в неделю, энергия фотонов – 6 MeV, РОД – 2,5 Гр, СОД – 40 Гр (45 иГр).
Для достижения однородности дозы ионизирующего излучения и ее увеличения в коже и мягких тканях правой щеки использовали тканеэквивалентный болюс.
Лечение пациентка перенесла удовлетворительно. Лучевые реакции: мукозит слизистой оболочки полости рта 2-й степени по шкале RTOG/EORTC; гиперемия кожи зон облучения 1-й степени по шкале RTOG/EORTC [25]. При обследовании через месяц терапии у пациентки достигнут полный регресс опухоли. Очередное контрольное обследование выполнено в марте 2016 г. (33 месяца после завершения лечения). Признаков прогрессирования болезни не зафиксировано.
Перспективы. Иммуноонкологическая терапия
Наилучшие результаты были получены при использовании иммуноонкологической терапии (анти-PD1 и анти-PD-L1). В 2015 г. появились первые данные об успешном использовании анти-PD1-препарата (пембролизумаб) в рамках многоцентрового исследования II фазы. Эти результаты были дополнены и обновлены в 2016 г. [26].
В исследование было включено 26 пациентов с метастатической или местно-распространенной неоперабельной КМ, которые ранее не получали системной терапии. Пембролизумаб вводили в дозе 2 мг/кг каждые три недели внутривенно. Частота объективного ответа среди 25 пациентов, прошедших по крайней мере одно контрольное обследование на фоне терапии, составила 56% (95%-ный доверительный интервал (ДИ) 35–76) (у четырех пациентов достигнут полный ответ, у десяти – частичный). При медиане наблюдения 33 недели (7–53) рецидивы наблюдались у двух (14%) пациентов из 14 с ответом на терапию. Продолжительность ответа варьировалась от 2,2 до 9,7 месяца. Показатель выживаемости без прогрессирования в течение шести месяцев составил 67% (95% ДИ 49–86). Из 26 пациентов 17 (65%) имели полиомавирус-позитивный статус опухоли. Частота объективного ответа среди пациентов с полиомавирус-позитивным статусом опухоли составила 62% (десять из 16 пациентов) и 44% среди пациентов с полиомавирус-негативным статусом опухоли (четверо из девяти). Нежелательные явления 3–4-й степени наблюдались у 15% пациентов. Таким образом, авторы сделали вывод о возможности использования пембролизумаба в качестве терапии первой линии у пациентов с метастатической или местно-распространенной неоперабельной опухолью.
На ASCO 2016 г. также были представлены обновленные результаты изучения анти-PD-L1-препарата (авелумаб) в качестве терапии второй и последующей линий после прогрессирования заболевания на фоне предшествующей стандартной химиотерапии [27]. Внутривенные инфузии авелумаба в дозе 10 мг/кг вводили каждые две недели. Из 88 пациентов, включенных в исследование, 40% получили две и более предшествующие линии химиотерапии (26 пациентов – две линии, десять – три и более). Частота объективного ответа достигла 31,8% (у восьми (9,1%) пациентов полный ответ, у 20 (22,7%) – частичный). Медиана продолжительности ответа не достигнута (95% ДИ 8,3 месяца – оценить невозможно). При этом у 23 (82,1%) из 28 пациентов сохранялся ответ на фоне терапии на момент проведения анализа. Медиана времени до ответа – шесть недель. Показатель выживаемости без прогрессирования в течение шести месяцев составил 40% (95% ДИ 29–50), общей выживаемости – 69% (95% ДИ 58–78). Исследователи пришли к заключению, что авелумаб эффективен у пациентов неблагоприятной группы – рефрактерной к стандартной химиотерапии.
Карцинома Меркеля
Карцинома Меркеля – нейроэндокринный рак кожи, получивший свое название по имени клеток, из которых формируется опухоль. Первые данные о подобных новообразованиях обнаруживаются в медицинской литературе от 1972 года. Тогда болезнь имела название «Трабекулярная карцинома кожи», но уже в 1978 году природа появления новообразований была детализирована — в качестве источника опухоли определили клетки Меркеля, после чего название болезни было изменено.
Статистика
Частота встречаемости карциномы Меркеля составляет 0,6 случаев на 10000 человек.
Клетки Меркеля представляют собой механорецепторы, обеспечивающие чувствительность кожи к прикосновениям. Больше всего их в высокочувствительных участках кожи, например, на ладонях.
Симптомы и особенности развития карциномы Меркеля
Первым симптомом карциномы Меркеля является появление непосредственно самого образования — единичного безболезненного узла красно-фиолетового цвета, располагающегося чаще всего на участках кожи, в большей степени подвергающихся УФ-облучению:
- голова и шея – около 43% всех случаев;
- руки – 24%;
- ноги – 15%;
- туловище – 11%;
- другое расположение (включая половые органы) – 9%.
У 5% пациентов карцинома Меркеля диагностируется на слизистых оболочках.
Поскольку заболевание характеризуется агрессивным развитием, основным признаком карциномы Меркеля является ее быстрый рост. Уже на ранних этапах метастазы определяются в близлежащих лимфатических узлах, а в запущенных случаях – в отдаленных лимфоузлах, легких, печени, головном мозге и костях.
Причины возникновения опухоли Меркеля
Патогенез карциномы Меркеля до сих пор окончательно не ясен. Но среди возможных причин отмечают:
- полиомавирус клеток Меркеля (ДНК содержащий онковирус), обнаруженный в 80% случаев данного заболевания и впервые описанный в 2008 году;
- чрезмерное воздействие на кожу УФ-лучей, наиболее опасное для светлокожих людей;
- соматическая мутация в антионкогене ТР53 и RB1 гене, блокирующих деление злокачественных клеток и защищающих организм от образования опухолей.
- пожилой возраст старше 65 лет — по статистике пациентов старше 60 лет с диагностированной карциномой Меркеля в 10 раз больше, чем в более младшей возрастной группе;
- Не менее важна в патогенезе карциномы Меркеля иммуносупрессия. Люди с хроническим снижением иммунитета в 15 раз более подвержены возникновению этого вида рака. В первую очередь это касается пациентов, перенесших трансплантацию органов, и ВИЧ-инфицированных людей.
Диагностика карциномы Меркеля
Диагностика заболевания включает в себя первичный осмотр, ряд инструментальных и лабораторных процедур. Крайне важным является детальное гистологическое исследование новообразования. Дополнительно назначается:
- УЗИ брюшной полости;
- УЗИ близлежащих к опухоли лимфоузлов;
- рентгенография органов грудной полости.
По статистике, примерно у 25% пациентов с карциномой Меркеля с помощью биопсии определяются микрометастазы в сигнальном лимфатическом узле. Окончательный диагноз можно поставить на основе иммуногистохимического исследования, позволяющего отличить карциному Меркеля от метастаз мелкоклеточного рака легких, В-клеточной лимфомы и анапластической мелкоклеточной меланомы. Также в процессе диагностики заболевания важно определить стадию его развития. Всего выделяют пять стадий карциномы Меркеля:
- I – наличие новообразования без поражения лимфоузлов;
- IA – размер опухоли менее 2 см;
- IB – размер опухоли более 2 см;
- II – поражение регионарных лимфоузлов;
- III – наличие отдаленных метастаз.
Частота первой стадии болезни на момент диагностики составляет около 55%. Третья стадия диагностируется в 6% случаев.
Особенности лечения болезни и прогноз для пациентов
Карцинома Меркеля требует комбинированного лечения — сочетания оперативного удаления опухоли с заходом на окружающие ее ткани с лучевой и химиотерапией.
- хирургическое лечение на ранних стадиях болезни предполагает иссечение образования с отступом от края в 2-3 см;
- при метастазировании в лимфоузлы пациентам показана лимфаденэктомия;
- если операция по каким-либо причинам невозможна, назначается лучевая терапия с ионизирующим излучением 60-66 Гр;
- после оперативного удаления опухоли также назначается лучевая терапия с рекомендуемой дозой 50-56 Гр;
- химиотерапия назначается пациентам с метастатическим и местно распространенным неоперабельным процессом.
Профилактика появления карциномы Меркеля
Специфической профилактики, защищающей от возникновения карциномы Меркеля, нет. Однако, онкологи видят связь между воздействием инсоляции и частотой возникновения заболевания. Именно поэтому по их мнению частота встречаемости карциномы Меркеля растет с каждым годом. С каждым годом частота возникновения карциномы Меркеля увеличивается. Еще одним важным фактором в возникновении карциномы считают хроническую иммуносупрессию. Поэтому основные рекомендации по профилактике — это:
- минимизация времени, проведенного под прямыми солнечными лучами в период с 10 утра до 16 часов дня;
- отказ от солярия;
- использование солнцезащитных средств с фактором защиты от 30+SPF;
- выбор одежды, по максимуму закрывающей тело от солнца.
Также важно вовремя определять состояния, при которых наблюдается активное подавления иммунитета, и корректировать их под наблюдением врача. Для пациентов, прошедших лечение, необходимо проходить соответствующие обследования:
- каждые 6 недель в течение первого года;
- каждые 3 месяца в течение второго года;
- каждые 6 месяцев – в течение третьего года.
Обследование включает в себя осмотр, рентгенографию органов грудной клетки, УЗИ брюшной полости, органов малого таза и забрюшинного пространства.
Преимущества лечения карциномы Меркеля в МеланомаЮнит
МеланомаЮнит является филиалом израильского медицинского центра, чья работа строится на трех базовых принципах — высочайшее качество услуг, опытные специалисты и максимальный комфорт для пациентов.
В клинике используется оборудование от лучших производителей медицинской техники, сертифицированные препараты, проверенные временем и инновационные технологии лечения карциномы Меркеля.
Наши специалисты постоянно повышают свою квалификацию, проходя обучение в России и зарубежом. Задача каждого врача МеланомаЮнит —достижение наилучшего результата для в лечении каждого пациента
Стоимость лечения карциномы Меркеля
Стоимость лечения карциномы Меркеля определяется после диагностики и рассчитывается индивидуально в каждом конкретном случае.
Карцинома Меркеля
В обзоре представлено описание рака кожи из клеток Меркеля, возможных этиологических факторов и механизмов развития, методов диагностики, дифференциальной диагностики и вариантов лечения.
Ключевые слова: рак кожи из клеток Меркеля, нейроэндокринный рак кожи, нейронспецифическая енолаза, хромогранин А.
This review describes merkel cell carcinoma, possible etiological factors and mechanisms of development, methods of diagnosis, differential diagnosis and treatment options.
Key words: merkel cell carcinoma, neuroendocrine carcinoma of the skin, neuronspecific enolase, сhromogranin A.
1. Toker C. Trabecular carcinoma of the skin. Arch dermatology 1972; 105: 107–10.
2. Robert A. Schwartz Skin Cancer. Recognition and Management 2008; 13: 220–5.
3. Iyer J, Thibodeau R, Nghiem P. Merkel Cell Carcinoma. ASCO еducational book 2010; p. 343–8.
4. Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Sience 2008; 319: 1096–100.
5. Goessling W, McKee P, Mayer R. Merkel cell carcinoma. J Clin Oncol 2002; 20: 558–98.
6. Rigel DS. Cancer of the skin. Elsevier 2005; p. 323–7.
7. Becker JC. Merkel cell carcinoma. Annals of Oncology 2010; 21 (Suppl. 7).
8. AJCC Cancer Staging Manual. 7th Ed 2010; p. 315.
9. Gould VE, Moll R, Moll I. Neuroendocrine (Merkel) cells of the skin: hyperplasia, dysplasias and neoplasms. Lab Invest 1985; 52 (4): 334–53.
10. Saito A, Tsutsumida A, Furukawa H et al. Merkel cell carcinoma of the face: an analysis of 16 cases in the Japanese. Journal Plast Reconstr Aesthet Surg; 2008. – doi:10.1016/j.bjps.2008.03.027.
11. Dancey AL, Rayatt SS, Soon C et al. Merkel cell carcinoma: a report of 34 cases and literature review. J Plast Reconstr Aesthet Surg 2006; 59: 1294–9.
12. Allen PJ, Bowne WB, Jaques DP et al. Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clini Oncol 2005; 23: 2300–9.
13. Allen PJ, Zhahg ZF, Coit DG. Surgical management of Merkel cell carcinoma. Ann Surg 1999; 229: 97–105.
14. Messina JL, Reintgen DS, Cruse CW et al. Selective lymphadenectomy in patients with Merkel cell (cutaneous neuroendocrine) carcinoma. Ann Surg Oncol 1997; 4: 389–95.
15. Lewis KG, Weinstock MA, Weaver AL et al. Adjuvant local irradiation for Merkel cell carcinoma. Arch Dermatology 2006; 142: 693–700.
16. Eng TY, Boersma MG, Fuller CD et al. A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clini Oncol 2007; 30: 624–36.
17. Samlowski WE, Moon J, Tuthill RJ et al. A phase II trial of imatinib mesylate in Merkel cell carcinoma: a Southwest Oncology Group Study. J Clin Oncol 2009; 27 (Suppl. 20. Abstr. 9056).
18. Davids MS, Charlton A, Ng SS et al. Response to a novel multitargeted tyrosine kinase inhibitor pazopanib in metastatic Merkel cell carcinoma. J Clin Oncol 2009; 27 (26): 97–100.
19. Di Bartolomeo M, Bajetta E, Buzzoni R et al. Clinical efficacy of octreotide in the treatment of metastatic neuroendocrine tumors. A study by the Italian Trials in Medical Oncology Group. Cancer 1996; 77: 402–8.
20. Ben Shlomo A, Melmed S. Pasireotide – a somatostatin analog for the potential treatment of acromegaly, neuroendocrine tumors and Cushing’s disease. I Drugs 2007; 10: 885–95.
21. Becker J, Mauch С et al. Short German guidelines: Merkel cell carcinoma. J Сompil Blackwell Verlag, Berlin 2008; (Suppl. 1): S15–S16.
Читайте также:
