Катетерная радиочастотная аблация при трепетании и фибрилляции предсердий
Добавил пользователь Skiper Обновлено: 08.01.2026
Настоящая революция в лечении аритмии произошла после появления процедуры с использованием тока высокой частоты. Для большинства нарушений ритма сердца катетерные технологии стали альтернативой лекарствам. Этот вид лечения относится к малоинвазивным вмешательствам и легко переносится пациентами.
Так кому же и при каких типах аритмий показана радиочастотная катетерная аблация (РЧА)?
Фибрилляция предсердий, или мерцательная аритмия
Катетерная аблация фибрилляции предсердий является достаточно эффективным методом лечения определенной категории пациентов. Это относительно молодые и симптомные пациенты с пароксизмальной формой без сопутствующих заболеваний, которые резистентны хотя бы одному антиаритмическому препарату. Направление на процедуру — это всегда совместное решение врача и пациента, основанное на ряде критериев.
Наличие сердечной недостаточности. Фибрилляция предсердий, особенно с высокой частотой сердечных сокращений, может снизить сократительную способность сердца и привести к сердечной недостаточности. В таком случает также оправдано проведение катетерной аблации.
Тип фибрилляции предсердий. При наличии персистирующей фибрилляции предсердий длительностью более одного года проведение процедуры возможно, однако эффективность процедуры ниже, чем при пароксизмальной форме.
Симптомность — главное условие для проведения катетерной аблации. Это значит, что фибрилляция предсердий ощущается пациентом и ограничивает повседневную активность, снижая качество жизни.
Частота рецидивов фибрилляции предсердий. Не вызывает сомнения, что частые пароксизмы (не реже одного раза в три месяца) и неэффективность медикаментозной терапии являются важным критерием отбора пациентов для проведения операции.
Резистентность к антиаритмическим препаратам. Если есть опыт приема одного антиаритмика, который оказался неэффективен, то операция может быть показана. Однако современные рекомендации говорят о возможности проведения аблации как первой линии терапии, если пациент не хочет или не может принимать антиаритмики.
Трепетание предсердий
Радиочастотная катетерная аблация — самый эффективный метод лечения трепетания предсердий. Дело в том, что областью аритмии при типичном трепетании предсердий является определенный участок мышечной ткани в правых отделах сердца, именуемый каво-трикуспидальным перешейком. Нанесение радиочастотных воздействий в этой области устраняет трепетание предсердий. Эффективность операции при типичном трепетании предсердий составляет более 95%. Длительность проведения процедуры по устранению трепетания предсердий минимальна и составляет, как правило, около 30 минут. РЧА позволяет пациенту полностью решить проблему аритмии и не возвращаться к приему антиаритмиков. Вовремя проведенная операция снижает риск развития сердечной недостаточности, позволяя сохранить высокое качество жизни пациента.
Синдром Вольфа-Паркинсона-Уайта (синдром ВПВ)
Предпочтительный метод лечения синдрома Вольфа — Паркинсона — Уайта — катетерная аблация. С помощью этой процедуры можно полностью избавиться от аритмии. Успех операции зависит от местоположения и количества дополнительных путей проведения. В настоящее время проведение антиаритмической терапии у больных с синдромом ВПВ показано только тем пациентам, которые отказываются от проведения процедуры.
Атриовентрикулярная узловая реципрокная тахикардия (АВУРТ)
Особую категорию представляют женщины детородного возраста, так как использование антиаритмических препаратов у них нежелательно. Возникновение аритмии во время беременности всегда осложняет ее течение и может повлиять на развитие плода. Пациенткам, планирующим беременность и имеющим патологию проводящей системы, рекомендовано дообследование. Вопрос хирургического лечения аритмии необходимо рассмотреть еще до наступления беременности, так как ввиду изменения физиологического состояния количество приступов может увеличиться. Современные технологии с большой вероятностью избавят навсегда будущую маму от аритмии. Если все же возникает необходимость проведения операции во время беременности, ее проводят в условиях минимизации радиационного воздействия.
Желудочковые аритмии (желудочковая экстрасистолия и тахикардия)
При выборе тактики лечения пациента с желудочковыми нарушениями ритма сердца важно понимать причину появления аритмии. Она может быть идиопатической (функциональной) и органической (связанной с заболеванием сердца). Катетерная аблация симптомной идиопатической желудочковой экстрасистолии и тахикардии имеет преимущество перед антиаритмической терапией в силу высокой эффективности и низких рисков осложнений. Катетерная аблация органических желудочковых нарушений ритма также активно используется, но от нее нельзя ожидать того, что она изменит естественное течение болезни.
Процедура катетерной аблации
Радиочастотная катетерная аблация (РЧА) — это один из самых современных малоинвазивных хирургических методов, направленных на устранение нарушений аритмии с использованием специальных катетеров, введенных в полость сердца через проколы в сосудах.
Аблация сердца проводится в специально оборудованной операционной, оснащенной:
оборудованием для слежения за жизненно важными функциями организма и проведения реанимационных мероприятий (дефибриллятор, дыхательный аппарат, мониторы)
специализированным электрофизиологическим оборудованием для записи поверхностных и внутрисердечных электрограмм
набором инструментов для проведения катетеризации сердца и электродов-катетеров для проведения электрофизиологичекого исследования и радиочастотной аблации
Процедура катетерной аблации сердца состоит из двух этапов: определения источника аритмии и аблации.
Определение источника аритмии. Вначале процедуры хирург делает прокол в области бедра и через бедренные сосуды заводит катетер в камеры сердца. Катетеры — это тонкие гибкие трубки, которые проходят по сосудам в камеры сердца и подключены к электорофизиологической системе. В режиме реального времени при помощи катетеров и электорофизиологической системы создается трехмерная картина сердца и выявляются места возникновения патологических электрических импульсов, которые вызывают развитие аритмии. Трехмерная реконструкция сердца позволяет врачу видеть, как выглядит сердце изнутри и как проходит импульс. Используемая технология идентична технологии GPS в системах навигации.
Аблация. После определения источника аритмии врач врач позиционирует катетер в зоне очагов аритмии и использует радиочастотный ток для «выключения» этих областей сердца, генерирующих и проводящих патологические электрические импульсы. После проведения аблации аритмогенных зон врач проводит проверку эффективности воздействия с помощью электрофизиологического исследования. Если электрофизиологические показатели удовлетворяют врача, то операцию заканчивают.
Что происходит после катетерной аблации?
По окончании процедуры врач удаляет катетеры, надавливая при этом на место введения катетера для предотвращения кровотечения, и накладывает гемостатические повязки или шов на место пункций. Пациента переводят в отделение и назначают постельный режим в положении на спине на несколько часов, чтобы предупредить кровотечение из места пункции. Пациент наблюдается в стационаре в течение одного дня после проведения катетерной аблации и может быть выписан из клиники на следующий день. В течение последующих нескольких дней пациентам рекомендовано ограничить активность и избегать физического перенапряжения.
Эффективность катетерной аблации
Некоторые виды аритмии могут быть полностью излечимы с помощью катетерной аблации. Это узловая тахикардия, синдром ВПВ, типичное трепетание предсердий. Вероятность рецидива такой аритмии мала и может быть устранена при повторной процедуре.
Фибрилляция предсердий — это хроническое заболевание, поэтому навсегда избавиться от нее пока не возможно. Но с помощью процедуры можно достигнуть достаточно стойкой и длительной ремиссии.
После процедуры катетерной аблации происходит улучшение самочувствия, новые эпизоды сердцебиений не возникают, возвращается нормальный синусовый ритм, если он был неправильным. Но иногда сразу после операции симптомы фибрилляции предсердий сохраняются в течение 8–10 недель. Только после этого периода становится ясно, эффективна ли была аблация. Это связано с тем, что необходимо время для формирования рубцовой ткани в месте радиочастотных воздействий.
Показатели успешности зависят от типа фибрилляции предсердий. Пароксизмальная фибрилляция предсердий может быть устранена у 70–75% пациентов за одну процедуру. Если после катетерной аблации фибрилляция предсердий рецидивирует с прежней частотой и длительностью, оправдано проведение повторного вмешательства. В связи с этим общий показатель успеха может приближаться к 85%. Катетерное лечение персистирующей и длительно персистирующей формы фибрилляции предсердий имеет меньший процент успеха, и чаще требуется более одной процедуры, прежде чем восстановится нормальный ритм.
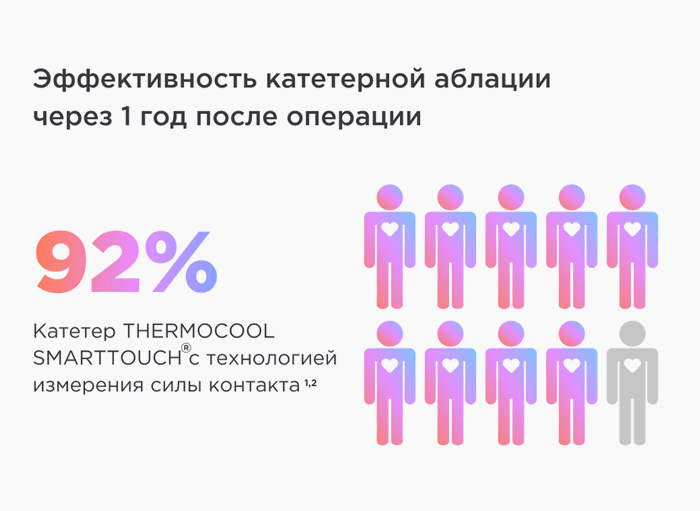
После успешного проведения процедуры может более не требоваться антиаритмических лекарств либо дозу препарата можно будет снизить. Однако любое изменение медикаментозного лечения возможно лишь только после консультации с врачом. Контроль за эффективностью катетерной аблации осуществляется с помощью регистрации длительной ЭКГ (холтеровское мониторирование) ежеквартально в течение 12 месяцев и субъективно пациентом, исходя из его жалоб.
Таким образом, катетерная аблация улучшает качество жизни большинства пациентов с фибрилляцией предсердий, позволяя снизить число эпизодов и тяжесть симптомов в долгосрочной перспективе, а также вернуть нормальный ритм.
Как подготовиться к катетерной аблации?
Процедура проводится в плановом порядке на территории Российской Федерации, выполняется по квоте и бесплатна для пациентов. Обратитесь к вашему аритмологу, чтобы оформить квоту на операцию.
Перед проведением аблации аритмии Вам выдадут список для необходимого предоперационного обследования и назначат дату операции. Нужно будет подписать формы согласия на процедуру. Перед операцией анестезиолог Вас осмотрит, назначит седативные препараты. Если были проблемы с предыдущей анестезией, не забудьте сообщить об этом.
Необходимо соблюдать ряд требований перед операцией:
- Накануне процедуры можно пить и есть как обычно. Не стоит отказываться от ужина, это может ухудшить течение анестезии. Однако в день операции употреблять пищу и пить воду нельзя.
- Прием лекарственных препаратов до операции и утром в день операции согласуйте с лечащим врачом. Некоторые препараты нужно отменить до процедуры, а прием других может быть, наоборот, строго обязателен перед операцией.
- Лучше оставьте украшения дома. Кольца, серьги и цепочки необходимо будет снять перед тем, как Вас отвезут в операционную. Также нужно будет снять съемные зубные протезы, если они у Вас есть.
- В день операции утром необходимо принять душ и удалить волосяной покров в паху и области подмышек с обеих сторон.
Клиники
Источники
- Taghji e et al. Evaluation of a Strategy Aiming to Enclose the Pulmonary Veins With Contiguous and Optimized Radiofrequency Lesions in Paroxysmal Atrial Fibrillation: A Pilot Study. JACC Clin Elecrophysiol, 2018 Jan; 4 (1): 99-108. dol: 10/1016/j.jacep.2017.06.023.
- Сравнение терапии антиаритмических препаратов и радиочастотной аблации у пациентов с пароксизмальной фибрилляцией предсердий. IDE исследование THERMOCOOL® катетера: сравнение Reference: Wiber et. al. JAMA, 2010; 303:303:-340.
Среднее время прочтения — 10 минут.
Катетерная аблация фибрилляции предсердий
У некоторых пациентов не удается удерживать ритм с помощью лекарств. Для них существуют современные хирургические и микрохирургические методы лечения.
Хирургическая операция типа «лабиринт» выполняется под наркозом на остановленном сердце. Правое и левое предсердия разрезаются скальпелем, а затем сшиваются. Таким образом удается сформировать нормальный «путь» для распространения нормального ритма от предсердий на желудочки. Однако эта операция является сложной и требует разрезания грудной клетки.
Врачи, обладающие опытом в лечении нарушений ритма сердца, постоянно разрабатывают новые методы выявления источников аритмии без разрезания грудной клетки (картирования) и прижигания источников фибрилляции предсердий (ФП) так, чтобы ФП исчезла раз и навсегда.
Врачи, обладающие опытом в лечении нарушений ритма сердца, постоянно разрабатывают новые методы выявления (картирования) и прижигания источников фибрилляции предсердий так, чтобы ФП исчезла раз и навсегда. Процедура картирования и прижигания впервые стала использоваться с конца 1990-х годов, с каждым годом внедряются новые варианты картирования и аблации этой аритмии. В настоящее время наилучшие результаты достигаются при использовании специальной системы внутрисердечной навигации (CARTO), которая позволяет управлять специальным катетером, прижигающим аритмию, внутри полостей сердца с точностью до 1 мм. Этот катетер позволяет построить «карту аритмии».
Это довольно сложная и долгая процедура, длящаяся несколько часов, но в большинстве случаев она проходит успешно. Иногда процедуру проводят в несколько этапов, поскольку у конкретного пациента могут отмечаться множественные зоны, участвующие в возникновении и поддержании ФП.
Процедура более эффективна в отношении пациентов с частыми короткими пароксизмами ФП; эффективность процедуры в отношении длительно существующей ФП значительно ниже.
Процедура аблации ФП не лишена рисков. Примерно у 2-3% пациентов наблюдаются серьезные осложнения в виде просачивания крови в области сердца (тампонада), инсульты, повреждение нервов, сужение легочных вен или образование отверстия между предсердиями и пищеводом (предсердно-пищеводная фистула). Многие из этих осложнений излечимы, но требуют, чтобы пациент находился в клинике в течение продолжительного периода времени.
Поэтому для принятия решения о целесообразности проведения процедуры врач взвешивает потенциальную пользу и возможные риски в отношении конкретного пациента, выбирая оптимальное для данного пациента в настоящее время решение. Несмотря на то, что данная процедура несет с собой некоторые риски, она предоставляет реальную возможность выздоровления. Современные компьютерные технологии позволят улучшить эффективность данной процедуры в ближайшие годы.
Катетерная аблация атриовентрикулярного соединения.
Если аблация ФП не эффективна, либо, по мнению врача-специалиста не целесообразна, может сложиться такая ситуация, когда врач выберет метод контроля ритма сердца при помощи кардиостимулятора. Операция заключается в том, что для обеспечения регулярного ритма у некоторых пациентов приходится разрушить атрио-вентрикулярное соединение при помощи катетера и установить стимулятор непосредственно в желудочки, который и будет регулировать ритм пациента. К счастью, такой метод терапии предназначен только для очень тяжелых случаев, когда все другие средства лечения потерпели неудачу.
Трепетание предсердий.
Трепетание предсердий зачастую представляет собой родственную фибрилляции предсердий аритмию, при которой предсердия сокращаются с высокой частотой - до 200-300 сокращений в минуту, и этот быстрый ритм проводится на желудочки и заставляет их сокращаться с частотой 100-150 ударов в минуту. Это приводит к быстрому нарушению нормальной насосной функции сердца. Лечение трепетания предсердий при помощи лекарств обычно бывает неэффективным.
Оптимальным методом лечения пациентов с часто повторяющимися пароксизмами трепетания предсердий также является аблация (прижигание), которая дает положительные результаты приблизительно для 90% пациентов.
Чрезмерно быстрое сердцебиение, источником которого является первичный очаг в желудочках сердца, называется желудочковой тахикардией (ЖТ). Самым распространенным симптомом ЖТ является быстрое сердцебиение, однако ЖТ также может вызвать боль в груди, одышку, головокружение или даже временную потерю сознания. Эта аритмия часто представляет серьезную угрозу для жизни пациента, что требует назначения специальных препаратов, использования инвазивных (аблации при помощи катетеров) или даже хирургических методов лечения.
Обычно устойчивые ЖТ лечат при помощи подшивания под кожу специального устройства - имплантируемого кардиовертера-дефибриллятора (ИКД), которое позволяет оборвать тяжелые приступы аритмии при помощи электрического разряда изнутри.
В некоторых случаях желудочковая тахикардия становится настолько угрожающей или отмечается настолько часто, что принимается решение о проведения процедуры аблации. Сложные компьютерные системы позволяют создать карту возбуждения сердца во время такой тахикардии, чтобы позволяет выявить источник желудочковой тахикардии.
Катетерная аблация фибрилляции предсердий
В норме регулярная работа нашего сердца поддерживается электрическими импульсами, которые генерируются группой специальных клеток. Эти клетки сформированы в компактное образование – синусовый узел, расположенный в верхней части правого предсердия [рис. 1].
При фибрилляции предсердий (мерцательной аритмии) вместо регулярного сердечного ритма в предсердиях возникают множественные электрические волны, приводящие к хаотичным сокращениям обоих предсердий с очень высокой частотой [рис. 2].
Фибрилляция предсердий (мерцательная аритмия), как правило, проявляется учащенным нерегулярным сердечным ритмом, одышкой, плохой переносимостью физических нагрузок. Нередко фибрилляции предсердий протекает бессимптомно и обнаруживается случайно при регистрации ЭКГ. Нередко у пациентов с фибрилляцией предсердий (мерцательной аритмии) обнаруживается еще один вид нарушений сердечного ритма – трепетание предсердий [ рис.3 ]. Симптомы трепетания предсердий мало отличаются от фибрилляции предсердий. Точная диагностика данных нарушений ритма и определение тактики лечения должны определяется кардиологом-аритмологом.
2. Зачем и как лечить фибрилляцию предсердий?
Лечение фибрилляции предсердий ставит своей целью:
- устранение симптомов аритмии, т.е. улучшение качества жизни пациентов;
- устранение угрозы развития сердечной недостаточности;
- профилактика тромбоэмболических осложнений.
По данным мировой медицинской статистики фибрилляция предсердий (мерцательная аритмия) – самое часто встречающаяся (1-2 % в популяции) нарушение сердечного ритма. У значительной части пациентов (до 40%) ФП носит бессимптомный характер. У этой категории больных медикаментозное антиаритмическое или немедикаментозное лечение (катетерная аблация) ФП, как правило, не проводится. Лечение этих пациентов заключается в контроле частоты сердечного ритма и назначении антикоагулянтов для профилактики тромбоэмболических осложнений. Пациентам, у которых фибрилляция предсердий сопровождается описанными выше симптомами назначают постоянную антиаритмическую терапию, направленную на профилактику рецидивов ФП. Приблизительно у одной трети среди всех больных ФП удается подобрать эффективный антиаритмический препарат или их комбинацию.
У 30% больных с симптомной, плохо переносимой фибрилляцией предсердий не удается подобрать эффективную антиаритмическую терапию, либо прием антиаритмических средств противопоказан, сопровождается развитием побочных эффектов или пациенты не хотят придерживаться тактики длительного консервативного медикаментозного лечения. Этой категории больных в соответствии с современными международными и российскими рекомендациями рекомендуется проведение катетерной аблации.
Следует подчеркнуть, что выбор вариантов лечения в каждом конкретном случае – задача кардиолога-аритмолога с учетом мнения пациента и объективных медицинских данных.
3. Катетерная и хирургическая аблация
В зависимости от формы фибрилляция предсердий (пароксизмальная, персистирующая или постоянная), наличия другой патологии со стороны сердечно-сосудистой системы и сопутствующих заболеваний применяются 3 разновидности катетерной (или хирургической) аблации:
• внутрисердечная катетерная аблация – наиболее широко используемый метод немедикаментозного лечения ФП. Катетерная аблация проводится в условиях рентгеноперационной с использованием управляемых катетеров, перемещаемых в камеры сердца через сосудистые доступы (бедренные и подключичные вены). Цель катетерной аблации радикальное устранение «источников» аритмии в левом и (при трепетании предсердий) правом предсердии. В настоящее время широкое клиническое применение нашли 2 вида катетерной аблации: радиочастотная катетерная аблация и баллонная криоаблация.
• катетерная аблация (деструкция) АВ узла – разновидность внутрисердечной катетерной аблации, которая применяется в тех случаях, когда ФП сопровождается стойко высокой частотой сердечных сокращений при невозможности медикаментозного контроля или радикального устранения ФП. Аблация АВ узла проводится только после имплантации искусственного водителя ритма (кардиостимулятора).
• операция «Лабиринт» - хирургическая аблация ФП. Операция «лабиринт» (MAZE) применяется в тех случаях, когда пациенту с ФП показано хирургическое вмешательство на открытом сердце в связи с наличием «основного» заболевания сердца: операция аорто-коронарного шунтирования, протезирование клапанов и т.д. В качестве самостоятельного вмешательства при ФП операция «лабиринт» применяется в виде модифицированных малоинвазивных операций с торакоскопическим доступом и только при неэффективности раннее выполненных попыток катетерной аблации.
4. Радиочастотная или баллонная криоаблация?
Согласно современным представлениям, ключевая роль в развитии ФП принадлежит так называемым «арит0могенным» легочным венам (т.н. триггеры ФП) - крупным сосудам, впадающим в левое предсердие [ рис.4 ]. Именно поэтому, большинству пациентов с пароксизмальной и персистирующей формами фибрилляции предсердий показано выполнение катетерной аблации (изоляции) легочных вен.
Как это работает?
При радиочастотной катетерной аблации изоляция легочных вен достигается нанесением большого количества точечных воздействий с использованием тока высокой частоты. Эти воздействия должны сформировать непрерывную цепь из множества последовательных коагуляционных некрозов вокруг каждой из вен [рис.5A]. При использовании другой технологии - баллонной криоаблации [видео 1] зона некроза вокруг вен создается благодаря воздействию низкой температуры (до - 60ºС) в криобаллоне, расположенном последовательно в каждом из устьев легочных вен [рис.5Б]. В большинстве случаев полная изоляция достигается однократным криовоздействием в течение нескольких минут, что является безусловным преимуществом перед радиочастотной аблацией. Оба вида катетерных аблаций проводятся в рентгеноперационной под наркозом или в условиях глубокой седации. Данные вмешательства являются высокотехнологичными видами медицинской помощи и должны выполняться квалифицированными специалистами с достаточным опытом интервенционных вмешательств.
Видео 1. Баллонная криоаблация
Эффективность и безопасность
Общепринятым определением эффективности катетерной аблации при ФП считается отсутствие любых предсердных аритмий после аблации без применения антиаритмических средств. Контроль за эффективностью осуществляется клинически (самоконтроль пациентов) или с использованием систем длительной регистрации ЭКГ (ХМ ЭКГ или специальные имплантируемые регистраторы сердечного ритма).
Одним из основных факторов, определяющих эффективность катетерных аблаций при ФП является длительность эпизодов фибрилляции. В тех случаях когда приступы аритмии не превышают нескольких часов или дней (т.н. пароксизмальная форма) и, как правило, закачиваются самостоятельно, оперативное лечение максимально эффективно. В сравнительных исследованиях (международное исследование «Fire and Ice») рецидивов ФП в течение первого года не было у 65% больных как после радиочастотной, так и после баллонной криоаблации. При этом, есть наблюдения, что у лиц без сопутствующей кардиальной патологии эффективность баллонной криоаблации может достигать 80-90%.
У пациентов с персистирующей формой ФП, т.е. с аритмией длительностью более 7 дней, а также требующей для восстановления синусового ритма проведения медикаментозной или электрической кардиоверсии, ожидаемая эффективность катетерных аблаций – около 50-60%.
Если после катетерной аблации ФП рецидивирует с прежней частотой и длительностью, оправданным является проведение повторного вмешательства.
Осложнения при катетерной аблации ФП могут проявляться в виде повреждения сосудов в месте пункции, перфорации стенки сердца с развитием тампонады, образование тромбов в полости сердца и тромбоэмболическими осложнениями, термическим повреждением пищевода, развитием пареза диафрагмального нерва и рядом других. Применение современных высокотехнологичных методов контроля во время внутрисердечных вмешательств, достаточный опыт и квалификация врачей позволяет выполнять данные вмешательства эффективно и без значительного риска развития осложнений. Вместе с тем, необходимо четко осознавать, что решение о проведении интервенционного лечения ФП должен принимать врач с достаточным опытом лечения подобной категории больных, объективно учитывая аргументы «за и против».
5. Катетерная аблация ФП в отделе клинической электрофизиологии и рентгенхирургии нарушений ритма
Интервенционная аритмология – одно из основных направлений в научной и клинической работе отдела клинической электрофизиологии с момента его основания в 1990 г. Почти 20 лет насчитывает опыт лечения различных нарушений сердечного ритма с использованием технологии катетерных аблаций.
С 2012 года в отделе был внедрен метод катетерных аблаций при ФП. Сегодня приоритетным методом, используемым в клинической практике отдела клинической электрофизиологии при немедикаментозном лечении ФП является метод баллонной криоаблации. Этот выбор основан на том, что криоаблация при ФП не уступает по эффективности радиочастотной, являясь при этом наиболее безопасным методом интервенционного лечения ФП, что было доказано при анализе многолетнего опыта ведущих мировых центров в лечении ФП.
Специалисты отдела клинической электрофизиологии проводят полноценное предоперационное обследование пациентов, выполняют интервенционное вмешательство и обеспечивают амбулаторное наблюдение за всеми пациентами в течение не менее 1 года после катетерной криоаблации ФП. В тех случаях, когда у пациентов имеются сложные сопутствующие нарушения сердечного ритма применяется комплексное (одномоментное) интервенционное лечение, либо т.н. «гибридная терапия», сочетающая катетерное вмешательство и последующее медикаментозное лечение. В случае рецидива ФП может быть выполнена повторная баллонная криоаблация или радиочастотная катетерная аблация.
Катетерная радиочастотная аблация при трепетании и фибрилляции предсердий
Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва, Россия
ГБУЗ «ГКБ №4» Департамента здравоохранения Москвы, Москва, Россия
Первый МГМУ им. И.М. Сеченова, клиника кардиологии
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Катетерная радиочастотная абляция при лечении фибрилляции и трепетания предсердий у пациентов с коморбидной патологией
Журнал: Кардиология и сердечно-сосудистая хирургия. 2016;9(4): 46‑50
Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва, Россия
Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва, Россия
ГБУЗ «ГКБ №4» Департамента здравоохранения Москвы, Москва, Россия
Первый МГМУ им. И.М. Сеченова, клиника кардиологии
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
По мнению выдающегося современного кардиолога E. Braunwald [1], судьбу человечества в XXI веке определяют три сердечно-сосудистых эпидемии: застойная сердечная недостаточность, аритмия и сахарный диабет (СД).
После фибрилляции предсердий (ФП) самой частой предсердной тахиаритмией является трепетание предсердий (ТП), которое составляет до 10% всех пароксизмальных наджелудочковых тахиаритмий [2]. Каждый год в мире регистрируется около 200 000 новых случаев. ТП встречается в 2-5 раз чаще у мужчин, чем у женщин, а распространенность увеличивается с возрастом.
В настоящее время выделяют типичное и атипичное ТП [3, 4]. Наиболее частым вариантом является типичное, при котором циркуляция импульса происходит вокруг трехстворчатого клапана (ТК) в направлении против часовой стрелки. Характерная особенность данного типа ТП - обязательное повторное прохождение волны возбуждения по кавотрикуспидальному истмусу (КТИ), в связи с чем оно и названо истмусзависимым. К атипичному, или истмуснезависимому, ТП относятся остальные предсердные макроre-entry, в составе цепи которых нет повторного входа возбуждения в область КТИ. Пример такого трепетания: циркуляция электрических волн вокруг митрального клапана (МК), легочных вен (ЛВ), или послеоперационных рубцов в предсердиях [5].
Установлено, что у больных с типичным ТП показатели качества жизни достоверно ниже по сравнению с аналогичными характеристиками практически здоровых лиц. Также у пациентов с ТП в межприступных периодах диагностируются дилатация полостей сердца и снижение сократительной способности миокарда левого желудочка (ЛЖ) по сравнению с аналогичными показателями здоровых добровольцев.
В рекомендациях РКО, ВНОК и АССХ (2012) выделены состояния, ассоциированные с развитием ФП и Т.П. Например, артериальная гипертония (АГ) является фактором риска впервые выявленной ФП; она также повышает риск ее осложнений. Клинически выраженная сердечная недостаточность (СН) II-IV функционального класса (ФК) по NYHA является как причиной, так и следствием аритмий в 30-40% случаев. Тахиаритмическую кардиомиопатию можно заподозрить у пациентов с тахикардией и дисфункцией ЛЖ при отсутствии структурного заболевания сердца. Первичные кардиомиопатии также повышают риск развития ФП, особенно у молодых людей. Данные заболевания у больных с аритмиями встречаются относительно редко (10%). В 30% случаев у пациентов с ФП встречается поражение клапанов сердца. Возникновение аритмии связано с дилатацией левого предсердия (ЛП) при митральных и аортальных пороках сердца. Дефект межпредсердной перегородки ассоциируется с развитием ФП у 10-15% больных. Ишемическая болезнь сердца (ИБС) выявляется примерно у 20% пациентов с Ф.П. Нарушение функции щитовидной железы (ЩЖ) может являться единственной причиной Ф.П. Избыточную массу тела и ожирение отмечают у 25% пациентов с Ф.П. Хроническая обструктивная болезнь легких (ХОБЛ), хотя является скорее маркером сердечно-сосудистого риска, чем специфическим предиктором развития ФП, но диагностируется у 10-15% пациентов с аритмией. Апноэ во время сна предрасполагает к изменению состояния вегетативной системы или увеличению размера предсердий и давления в них, однако может быть патогенетическим фактором аритмии при сочетании с другими заболеваниями. Хроническая болезнь почек (ХБП) также может стать фактором риска сердечно-сосудистых осложнений, ассоциированных с аритмией. ХБП встречается у 10-15% пациентов с ФП, но данные контролируемых исследований на этот счет ограничены. СД способствует изменению предсердий, хотя на сегодняшний день влияние диабета на развитие ФП и ТП до конца не ясно.
В настоящее время в Рекомендациях Американской кардиологической ассоциации и Европейского общества кардиологов по ведению больных с ФП [6] представлены отдельные варианты противорецидивного лечения аритмии у пациентов с АГ, ИБС, ХСН. При этом алгоритма для пациентов с СД не создано, хотя данная патология встречается у 10-25% больных с ФП [7, 8].
На сегодняшний день СД страдают примерно 6% взрослого населения земного шара. По данным государственного регистра (2011), в России С.Д. страдают более 3,3 млн человек (около 300 000 - 1-го типа, около 3 млн - 2-го типа). Однако эти цифры вряд ли отражают реальное положение дел. По расчетам Международной федерации диабета, к 2025 г. количество больных СД увеличится вдвое. Каждый год 3,8 млн человек умирают от его осложнений, из которых 50% составляют сердечно-сосудистые заболевания (ССЗ). Это представляет проблему не только с точки зрения медицины, но и экономики, учитывая, что почти половина больных СД находятся в возрастной категории 40-59 лет.
Вопрос о влиянии СД на развитие впервые возникшей аритмии, а также на рецидивы после проведенного лечения, давно занимает исследователей. Эта тема и по сей день не освещена полностью, хотя проводили ряд эпидемиологических исследований, которые оценивали взаимосвязь ФП и СД. В работах, где не учитывали степень компенсации и продолжительность СД, подобная взаимосвязь не была обнаружена (см. таблицу).

Исследования, оценивающие взаимосвязь сахарного диабета и мерцательной аритмии
В 2005 г. опубликованы данные крупномасштабного исследования, проведенного в Калифорнии на базе госпиталя ветеранов, которое рассматривало СД как фактор риска развития ФП [9]. Было показано, что СД сам по себе является мощным и независимым фактором риска развития ФП и ТП.
Дополнительные сведения о взаимосвязи СД и ФП получены в исследовании, проведенном в Сиэттле [10]. Из него исключали пациентов с СД, не получавших сахарснижающую терапию. Причиной такого решения стало то, что такие больные составляли меньшинство, а связь между нелеченым СД и пароксизмами ФП не прослеживалась [10]. Относительный риск развития ФП у лиц, не получавших сахарснижающую терапию, не отличался достоверно у здоровых лиц. Эта взаимосвязь объясняется тем, что у данных больных отмечали небольшую длительность СД с более легким течением, не отягощенным осложнениями.
Существует ряд зарубежных работ 11, которые демонстрируют, что СД является важным фактором развития ФП. В 2011 г. в работе О.И. Кейко [14] показана роль СД как одного из основных факторов риска возникновения рецидивов ФП после восстановления синусового ритма электроимпульсной терапией.
Механизмы влияния СД на развитие аритмий достаточно сложны. Большинство исследователей предполагают, что диабетическая кардиомиопатия [15] и диабетическая кардиальная автономная нейропатия [16] способствуют появлению ФП. В зарубежных исследованиях показано, что у больных СД к возникновению аритмий и внезапной смерти приводит раннее развитие атеросклероза с последующей ишемией миокарда и нарушениями сердечной реполяризации таких, как удлинение интервала QT и изменение Т-волн, приводящих к электрической нестабильности.
По данным Л.Ю. Моргунова [17], возникновение нарушений ритма может быть связано с эпизодами гипогликемии. Кроме того, для больных СД характерен высокий уровень С-реактивного белка - маркера системного воспаления, который в свою очередь ускоряет развитие миокардиального фиброза и диастолической дисфункции.
В то же время оказалось, что именно механизмы, формирующие нарушения углеводного обмена, наиболее тесно связаны с механизмами формирования потенциала действия кардиомиоцита как в норме, так и при его патологии. Возможно, это и определяет особенности течения и прогноза ФП при СД.
В конце ХХ века было доказано, что наружная сарколемальная мембрана миокардиоцита заключает сложный комплекс медиаторов, одновременно участвующих как в формировании электролитных потоков, исходящих и проникающих внутрь кардиомиоцита и формирующих потенциал действия миокардиальной клетки и периоды ее электрической рефрактерности, так и в регуляции поступления глюкозы в клетку. Этот комплекс включает рецепторы, ионные каналы, а также внутримембранные структуры, частью которых является фосфоинозитоловый механизм. Этот своеобразный глюкозотранспортный механизм активируется или при связывании инсулина с клеточным рецептором, или при воздействии определенных препаратов сульфонилмочевины с клеточным компонентом фосфолипазы С. Образующийся при этом диацилглицерол, стимулируя пируваткиназу С, увеличивает в клетке доступность транспортных переносчиков глюкозы и таким образом способствует поступлению глюкозы внутрь кардиомиоцита.
Активация этого медиаторного пути влечет за собой изменение состояния ряда ионных каналов сарколеммы. В первую очередь это К-АТФ-зависимые каналы, играющие важнейшую роль в формировании потенциала действия кардиомиоцита. От состояния фосфоинозитолового обмена сарколемальной мембраны зависит также состояние внутриклеточного Са-баланса и Na/H-обмена, определяющих возможность миокарда к сокращению и расслаблению, и таким образом его способность к переходу из состояния рефрактерности к состоянию возбуждения и проведению электрического импульса. Отсутствие инсулина или состояние инсулинорезистентности резко нарушает не только поступление глюкозы внутрь миоцита, но и дезинтегрирует электрофизиологическую деятельность его ионных каналов.
СД называют болезнью внутриклеточного обмена Са. При С.Д. отмечается изменение Са-АТФ-азы саркоплазматического ретикулума, нарушение мембранного транспорта Са, снижение активности Na/К-АТФ-азы сарколеммы, дисбаланс между Na/Са- и Na/H-ионными обменами. Свойственная С.Д. 2-го типа гиперинсулинемия, которая воздействует на механизмы регуляции внутриклеточного Са, создает внутриклеточную кальциевую перегрузку в различных тканях, включая и миокард. Дефицит инсулина и гипергликемия усугубляют нарушения внутриклеточного обмена ионов Na и Са. У больных с длительным и тяжелым течением СД при возникновении абсолютного дефицита инсулина содержание ионов Na и Са внутри клетки повышено, что создает высокий риск развития электрофизиологических нарушений, в том числе развития ФП [18]. Однако действуют ли те же механизмы при ТП - неизвестно.
Существует два принципиально различных подхода к лечению ТП: медикаментозный и радиочастотная абляция (РЧА). В настоящее время в ведении пациентов с ТП в РФ наиболее распространенным все еще является консервативный подход 23. Выбор и применение наиболее эффективных способов, позволяющих достичь позитивного антиаритмического эффекта, остаются ответственной и сложной задачей. Подбор антиаритмической терапии (ААТ) в отечественной практике в большинстве случаев осуществляется эмпирическим методом [24]. Примерно у 10-15% больных в результате непредсказуемого действия препарата на проводящую систему сердца развивается проаритмический эффект [25]. Нередко многим больным приходится принимать антиаритмические лекарственные препараты в течение длительного времени, вследствие чего могут возникать серьезные побочные реакции [26].
Согласно данным A. Waldo [27], эффективность AAT, направленной как на купирование, так и на профилактику пароксизмов ТП, является низкой. ТП часто оказывается более резистентным к терапии, чем ФП. А.В. Недоступ и О.В. Благова [28] показали отсутствие эффективности в назначении антиаритмиков II и IV классов в виде монотерапии данной тахиаритмии. Эффективность амиодарона также оказалась недостаточно высокой. Некоторые препараты способствуют переходу ТП в ФП и обратно, преимущественно это относится к антиаритмикам IА класса (хинидин, новокаинамид, дизопирамид), III класса (амиодарон, реже - d, l-соталол) и дигоксину.
На практике врачи часто встречаются с возникновением резистентности к медикаментозной терапии тахиаритмий, причинами чего является исходная рефрактерность и толерантность («ускользание» из-под действия антиаритмика).
В последнее время при лечении больных с типичным ТП широкое распространение получили методы катетерной деструкции перешейка, расположенного между нижней полой веной (НПВ) и периметром ТК.
Катетерная радиочастотная абляция была внедрена в клиническую практику в начале 80-х гг. ХХ века, когда S. Huang [29] в эксперименте на собаках применил радиочастотную энергию для деструкции дополнительного атриовентрикулярного соединения с помощью катетера-электрода, а в 1987 г. впервые провел успешную РЧА атриовентрикулярного соединения у больного с суправентрикулярной тахикардией.
В недавнем прошлом показаниями к РЧА ТП являлись непереносимость или неэффективность ААТ, а также нежелание пациента получать длительную ААТ. За последнее десятилетие такой подход претерпел значительные изменения. В настоящее время общепризнанным методом выбора лечения типичного ТП является РЧА КТП 30. Сonsensus guidelines (2003) и «Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств» (2011) настоятельно рекомендуют проведение РЧА пациентам с ТП.
Клинический опыт, накопленный с начала внедрения данного метода в практику, показал высокую эффективность данной процедуры в лечении аритмий 34.
N. La Pointe [37] ретроспективно оценил 19 825 историй болезни пациентов с первичным диагнозом ТП из 500 американских больниц за 5-летний период (2000-2004). Только у 65,9% пациентов во время стационарного лечения использованы те или иные методы кардиоверсии. Процедуру РЧА при ТП чаще применяли при наличии сопутствующих заболеваний сердца таких, как ХСН, ИБС, кардиомиопатии.
В настоящее время в мире проведено несколько исследований, доказывающих эффективность РЧА аритмий при сопутствующих заболеваниях и их влиянии на риск развития рецидива аритмии после ее проведения.
D. Lakkireddy в своей работе [45] показал, что РЧА у пациентов с протезированными МК и аортальным клапаном является безопасной и эффективной, а в течение года у 80% из них сохранялся синусовый ритм. Однако, по данным P. Santangeli [46], у пациентов с протезированным МК после проведения РЧА рецидивы ФП отмечались чаще по сравнению с контрольной группой. J. Bradfield и соавт. [47] продемонстрировали успешное проведение абляции ТП у больных с тяжелой легочной гипертензией.
При этом катетерная абляция является одной из самых трудоемких электрофизиологических процедур. У 6% пациентов возникают осложнения как во время проведения данной процедуры, так и после нее. Обучение врачей и улучшение технологий - залог сокращения данных побочных эффектов.
Осложнения при проведении эндо-ЭФП и РЧА можно разделить на пять групп:
- обусловленные лучевой нагрузкой;
- связанные с пункцией и катетеризацией сосудов;
- при катетерных манипуляциях;
- обусловленные радиочастотным воздействием (блокады);
- тромбоэмболические осложнения (инсульт).
В настоящее время вопрос риска возникновения осложнений во время и после проведения РЧА у больных СД практически не освещен.
В 2006 г. Р.Б. Тан и соавт. [49] изучали безопасность РЧА у больных с СД 2-го типа. В исследовании приняли участие 263 больных, из которых 31 страдал С.Д. По данным этой работы, СД является независимым фактором риска возникновения осложнений во время РЧА. Было выявлено, что у пациентов с СД 2-го типа чаще развиваются такие осложнения РЧА, как тампонада сердца (3), инсульты (3), гематомы (11) по сравнению с больными, не страдающими СД (29 и 8,2% соответственно).
Несмотря на высокую эффективность и малый риск развития осложнений, РЧА ТП пока не является основным методом лечения в России. Рассмотренные ранее работы по оценке эффективности и безопасности данной процедуры посвящены изучению ФП, а материалы по ТП практически отсутствуют. Не описаны факторы, провоцирующие развитие ТП при СД после проведения РЧА. Остается неясным, влияют ли длительность заболевания и осложнения СД, а также получаемая терапия, на риск развития рецидивов ТП после РЧА.
Таким образом, вопрос проведения РЧА у пациентов с ТП на фоне различных коморбидных заболеваний остается дискуссионным, требует дальнейшего изучения и должен рассматриваться индивидуально в каждом конкретном случае.
Конфликт интересов отсутствует.
* Часть 1 опубликована в журнале «Кардиология и сердечно-сосудистая хирургия» № 3/2016.
РАДИОЧАСТОТНАЯ АБЛАЦИЯ КАВОТРИКУСПИДАЛЬНОГО ПЕРЕШЕЙКА: ВАЖНА ЛИ КЛИНИЧЕСКАЯ ФОРМА ТРЕПЕТАНИЯ ПРЕДСЕРДИЙ?
Ключевые слова
Об авторах
Список литературы
1. Ардашев, А.В. Типичное трепетание предсердий: классификация, клинические проявления, диагностика и лечение. / Ардашев А.В., Желяков Е.Г., Шаваров А.А. и др. // Кардиология - 2010. - № 4, - С. 57-65.
2. Базаев, В.А. Диагностика, показания и результаты нефармакологического лечения больных с трепетанием предсердий: автореф. дис.. доктора мед. наук / Базаев В.А. - М., 2005. - 267 с.
3. Бунин, Ю.А. Трепетание предсердий: современные возможности диагностики и лечения. / Бунин Ю.А. // Рациональная Фармакотерапия в Кардиологии. - 2011. - № 7(1). - С. 57-64.
5. Макарова, Н.В. Трепетание предсердий: причины неэффективного лечения методом радиочастотной катетерной аблации. / Макарова Н.В., Дурманов С.С., Козлов А.В. и др. // Вестник аритмологии. - 2012. -№ 69. - С. 57-64.
6. Покушалов, Е.А. Радиочастотная катетерная аблация трепетания предсердий: автореф. дис.. доктора мед. наук / Покушалов Е.А. - Новосибирск, 2004. - 167 с.
7. Поляков, В.П. Сравнительная оценка эффективности лечения трепетания предсердий кордароном и методом радиочастотной аблации зон трепетания. / Поляков. В.П., Перунова, В.П., Лапшина, Н.В. и др. // Вестник аритмологии. - 2007. - № 46. - С. 36-39.
8. Ohkubo, K. Anatomic and electrophysiologic differences between chronic and paroxysmal atrial flutter: intracardiac echocardiographic analysis. / Ohkubo K., Watanabe I., Okumura Y. // Pacing Clin. Electrophysiol. - 2008. - Vol. 31(4). - P. 432-437.
9. Calkins, H. Экспертный консенсусный документ HRS/EHRA/ECAS по катетерной и хирургической абляции фибрилляции предсердий: рекомендации по отбору и периоперационному ведению пациентов, технике выполнения процедуры; терминология, конечные точки и дизайн клинических испытаний. Перевод Шевченко Ю.Л., Свешникова А.В., Воробьева А.С., Ставцева Ю.В. / Calkins H., Kuck K.H., Cappato R. et al. - HRS/EHRA/ECAS, 2012. - 200 c.
10. Chinitz, J.S. Atrial fibrillation is common after ablation of isolated atrial flutter during long-term follow-up. / Chinitz J.S., Gerstenfeld E.P., Marchlinski F.E. et al. // Heart Rhythm. - 2007. - Vol.4(8). - P. 1029-1033.
11. Chyou, J.Y. Atypical electrocardiographic features of cavotricuspid isthmus-dependent atrial flutter occurring during left atrial fibrillation ablation. / Chyou J.Y., Hickey K., Diamond L. et al. // Ann. Noninvasive Electrocardiol. - 2010. - Vol. 15(3). - P. 200-208.
12. Da Costa, A. Anatomic and electrophysiological differences between chronic and paroxysmal forms of common atrial flutter and comparison with controls. / Da Costa A., Mourot S., Roméyer-Bouchard C. et al. // Pacing Clin. Electrophysiol. - 2004. - Vol. 27(9). - P. 1202-1211.
13. Dizon, J. Changes in low right atrial conduction times during pulmonary vein isolation for atrial fibrillation: correlation with inducibility of typical right atrial flutter. / Dizon J., Biviano A., Whang W. et al. // Europace. - 2011. - Vol. 13. - P. 942-948.
14. Doni, F. Atrial flutter termination by overdrive transesophageal pacing and the facilitating effect of oral propafenone. // Doni F., Della Bella P., Kheir A. et al. // Am. J. Cardiol. - 1995. - Vol. 76(17). - P. 1243-1246.
16. Huang, S. Catheter Ablation of Cardiac Arrhythmias. Second Edition. / Huang S., Wood M. // Elsevier. - 2010. - P. 184-199.
17. Peyrol, M. Characteristics of isolated atrial flutter versus atrial flutter combined with atrial fibrillation. / Peyrol M., Sbragia P., Bonello L. et al. // Arch. Cardiovasc. Dis. - 2011. - Vol. 104(10). - P. 530-535.
18. Schmieder, S. Acute and long-term results of radiofrequency ablation of common atrial flutter and the influence of the right atrial isthmus ablation on the occurrence of atrial fibrillation. / Schmieder S., Ndrepepa G., Dong J. et al. // European Heart Journal. - 2003. - Volume 24, Issue 10. - Р. 956-962.
19. Stambler, B.S. Comparative efficacy of intravenous ibutilide versus procainamide for enhancing termination of atrial flutter by atrial overdrive pacing. / Stambler B.S., Wood M.A., Ellenbogen K.A. // Am. J. Cardiol. - 1996. - Vol. 77(11). - P. 960-966.
Читайте также:
