Киндлинг-эпилепсия. Нейрональный эпилептогенез
Добавил пользователь Morpheus Обновлено: 29.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Эпилепсия: причины появления, симптомы, диагностика и способы лечения.
Определение
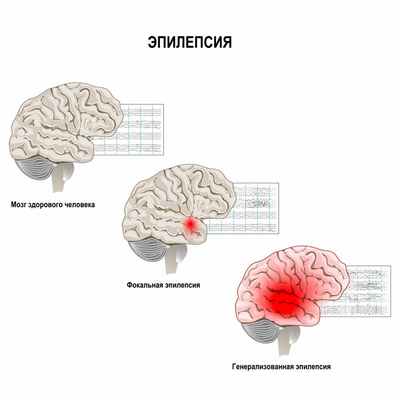
Эпилепсия - хроническое заболевание головного мозга с высоким уровнем инвалидизации, характеризующееся повторяющимися припадками, которые возникают в результате чрезмерных нейронных разрядов и сопровождаются разнообразными нарушениями двигательных, чувствительных, вегетативных, мыслительных и психических функций.
Причины появления эпилепсии
Термин «эпилепсия» происходит от др-греч. ἐπίληπτος - схваченный, пойманный, застигнутый. В России эпилепсию обычно называли «падучей болезнью» и расценивали как «божью кару».
Эпилепсия характеризуется повторными судорожными приступами, а также постепенным развитием характерных для заболевания изменений личности и/или характерным эпилептическим слабоумием.
Основные причины возникновения эпилепсии – индивидуальная предрасположенность и наличие эпилептического повреждения с локальными или генерализованными электрическими изменениями в головном мозге. Нейронная активность мозга при развитии эпилепсии становится аномальной, периодичной и чрезмерной. В группе нейронов возникают внезапные высоковольтные вспышки. Эпилептические нейроны образуют эпилептический очаг, генерирующий гиперсинхронный разряд. Если этот разряд распространяется на весь мозг, возникает генерализованный припадок. Если разряд не распространяется, припадок носит парциальный (локальный) характер.
Эпилептические припадки часто возникают при наследственных заболеваниях нервной системы (липидозах, туберозном склерозе, лейкодистрофии и др.). Возможно повреждение мозга в период беременности (гипоксия плода, инфекция матери, влияние алкоголя и психотропных веществ на организм матери и плода) и во время родов (чрезмерное изменение формы головки при прохождении через родовые пути). Многочисленные токсины, лекарственные препараты, изменения электролитов крови при хронических болезнях почек и печени, опухоли мозга могут повышать нейрональную активность. У детей эпилептические припадки часто возникают на ранних стадиях менингитов и энцефалитов. Тяжелая черепно-мозговая травма также может осложняться эпилепсией.
Таким образом, эпилепсия может быть вызвана (спровоцирована) множеством факторов:
- наследственными;
- врожденными (воздействия на плод во время беременности и родов);
- приобретенными (ставшими следствием предшествующих заболеваний головного мозга с образованием эпилептического очага).
- Идиопатическая эпилепсия.
- Симптоматическая эпилепсия:
- при острых нарушениях мозгового кровообращения;
- менингитах;
- энцефалитах;
- опухолях головного мозга;
- эндогенных интоксикациях (поражении почек, печени, надпочечников, уремии, эклампсии);
- экзогенных интоксикациях (в результате хронического алкоголизма, приема барбитуратов, воздействия углекислого газа, бензола, ртути).
- Простые парциальные приступы (сознание не нарушено):
- с двигательными симптомами;
- с соматосенсорными или специфическими соматосенсорными симптомами;
- с вегетативными симптомами;
- с психическими симптомами.
- Сложные парциальные приступы (с нарушением сознания):
- начинающиеся как простые парциальные приступы и прогрессирующие до нарушения сознания;
- без других проявлений;
- с проявлениями как при простых парциальных приступах;
- с автоматизмами.
- С нарушениями сознания в начале приступа:
- без других проявлений;
- проявляющиеся как простой парциальный приступ;
- с автоматизмами.
- Парциальный приступ с вторичной генерализацией:
- простой парциальный приступ с последующей генерализацией;
- сложный парциальный приступ с последующей генерализацией;
- простой парциальный приступ, переходящий в сложный парциальный приступ с последующей генерализацией.
- Абсансы:
- типичные абсансы;
- атипичные абсансы.
- Миоклонические приступы.
- Клонические приступы.
- Тонические приступы.
- Тонико-клонические приступы.
- Атонические приступы (астатические).
- регулярно повторяющиеся припадки с тонической и клонической фазами и полным выключением сознания;
- регулярно повторяющиеся изолированные сокращения отдельных мышечных групп, только тонические или только клонические судороги и полное выключение сознания;
- изолированные непрекращающиеся судороги определенной группы мышц, которые могут протекать и без выключения сознания;
- регулярно повторяющиеся припадки без мышечной активности, но с полным выключением сознания.
- длительность заболевания;
- наличие эпилепсии у ближайших родственников;
- предыдущие случаи обращения за медицинской помощью по поводу судорог и наличие ранее проведенных исследований и заключений;
- сопутствующие заболевания с целью оценки дополнительных рисков;
- принимаемые на момент обращения к врачу лекарственные препараты.
- К антагонистам ГАМК относятсябикукуллин, пикротоксин, β-карболин, но наиболее часто применяют коразол (пентилентетразол)— неконкуррентный антагонист барбитурового сайта ГАМК-А рецептора, который также обладает способностью непосредственно активировать натриевые каналы.
- К агонистам глутамата относятся местный анестетик кокаин, а также каиновая кислота и ее производные — агонисты каинатных рецепторов глутамата. Эти вещества плохо проникают через гематоэнцефалический барьер, поэтому применяются в форме аппликаций на поверхность мозга в определенной области. Наиболее часто используются при изучении эксайтотоксичности.
- Пилокарпин — М-холиномиметик. Чтобы предотвратить смерть экспериментальных животных от его периферических эффектов, до введения пилокарпина вводится периферический холиноблокатор. Часто применяется вместе с хлоридом лития, который потенцирует его действие и позволяет использовать меньшие дозы.
Симптомы эпилепсии
Парциальные припадки могут возникать в любом возрасте и характеризуются сокращением отдельных мышечных групп – человек совершает мелкие движения кистями, чавкает, больной может воспроизводить нечленораздельные звуки. Наблюдается нарушение чувствительности отдельных областей тела.
Пациент на 1-2 минуты теряет контакт с действительностью, не понимает обращенную к нему речь и иногда активно сопротивляется оказываемой помощи. После завершения припадка больной ничего о нем не помнит.
Парциальные припадки могут иметь двигательные проявления, когда судороги возникают в строго определенной части тела (большом пальце руки, на лице), продолжаясь несколько часов. Судороги могут появляться фокально, а затем распространяться на другие части тела (палец - запястье - предплечье). Припадки могут быть в виде непроизвольных поворотов головы и туловища или кратковременной задержки речи.
Парциальные припадки с вегетативными нарушениями характеризуются внезапным сердцебиением, потоотделением, чувством страха.
Припадки с сенсорными нарушениями проявляются покалываниями в строго определенной области, зрительными (вспышка света) или слуховыми ощущениями, внезапными головокружениями и др.
Припадки с психическими проявлениями отличаются неожиданной утратой способности понимать речь или говорить, появлением навязчивой мысли, ощущения близкого знакомства с местом или ситуацией, галлюцинациями.
Для парциальных сложных припадков характерна определенная степень изменения сознания в начале или в течение припадка. Больной может осознавать припадок, как будто происходит что-то необычное, но оценивает происходящее как сон.
Измененное сознание может быть единственным симптомом сложных парциальных припадков или дополнением к другим их проявлениям (искажению времени, нарушению памяти, появлению единственной доминирующей мысли, галлюцинациям, чувству страха др.).
Генерализованными считаются приступы, развитие которых свидетельствуют о вовлечении в процесс обоих полушарий мозга, в подавляющем большинстве случаев характеризуются потерей сознания. Они могут начинаться с ауры (непроизвольных движений головы, зрительных, слуховых и обонятельных галлюцинаций). Затем больной вскрикивает, теряет сознание и падает, возникают судороги, во время которых он может прикусить язык, появляются пенистые выделения изо рта, непроизвольное мочеиспускание. После припадка больной о припадке не помнит, но его беспокоит головная и мышечная боль.
К генерализованным приступам относятся тонико-клонические, тонические, клонические, миоклонические, атонические приступы и абсансы.
Тонические судороги – это резкие и длительные мышечные сокращения, при которых конечность или все тело застывают в вынужденном положении.
Клонические судороги – это нерегулярные кратковременные спазмы, для которых характерна быстрая смена периодов сокращения и расслабления скелетной мускулатуры.
Атонические припадки – это потеря сознания с внезапной утратой тонуса мышц и таким же быстрым восстановлением. Снижение мышечного тонуса может быть фрагментарным, ограниченным определенным сегментом (конечность, челюсть, голова) или массивным, который приводит к падениями, без предшествующих миоклонических или тонических компонентов.

Генерализованные тонико-клонические приступы характеризуются сменой тонического напряжения всех мышечных групп (тоническая фаза) и прерывистых мышечных сокращений (клоническая фаза) на фоне полной утраты сознания.
Генерализованные миоклонические приступы представляют собой диффузные быстрые асинхронные мышечные подергивания, обусловленные непроизвольным сокращением отдельных мышечных пучков. Могут затрагивать не все мышцы тела, но всегда носят симметричный характер.
Простой абсанс - это непроизвольное, кратковременное (до 15–20 с) внезапно наступающее и не зависящее от воли больного выключение сознания, которое периодически стереотипно повторяется. Кроме утраты сознания других видимых проявлений и нарушений при простом абсансе не отмечается. При выходе из приступа нет недомогания или оглушения, а во время приступа больные могут продолжать совершать начатые до него действия (играть, писать, читать).
Во время сложного абсанса выключение сознания сопровождается сопутствующими видимыми клиническими симптомами (вздрагиванием всего тела или миоклоническими подергиваниями отдельных мышечных групп; обездвиженностью; сгибательными и разгибательными, вращательными движениями и т.д.).
Эпилептический статус возникает спонтанно, судорожные припадки следуют друг за другом и продолжаются около 30 минут.
Клинически различают четыре разновидности эпилептического статуса:
Диагностика эпилепсии
Диагноз устанавливается по совокупности жалоб, характерных для эпилепсии, полученных сведений от пациента о течении болезни, данных лабораторных и инструментальных методов обследования.
У больных с подозрением на эпилепсию уточняются следующие вопросы:
- клинический анализ крови с определением концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоформула и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Киндлинг-эпилепсия. Нейрональный эпилептогенез
Киндлинг-эпилепсия. Нейрональный эпилептогенез
Начиная с 60-х годов, изучается киндлинг-эпилепсия, по-видимому, наиболее адекватная модель эпилепсии человека. При этом длительное слабое повторное раздражение медиобазальных височных структур мозга сопровождается избытком возбуждающих влияний с постепенным развитием очага стойкого возбуждения и распространением локальных эпилептических разрядов на соседние территории.
В настоящее время гипотеза Ch. Sherrington дополнена представлениями о том, что возбудимость нейронов в значительной степени зависит от свойств внутренней мембраны, несинаптического электрогенеза и несинаптических экстрацеллюлярных процессов.
Как известно, для поддержания поляризации нейрона энергия, источником которой является АТФ, расходуется иа деятельность катнонного насоса, поддерживающего градиент Na+ и К+ вне и внутри мембраны с помощью Na—, К—АТФ-азы.
На этот процесс существенно влияют ионы кальция, определяя рабочую конформацию ионпереиосиых каналов мембран н потенциал-зависимые характеристики мембраны нейрона. Имеет значение и ион магния, влияющий на Na— и К—АТФ-азу. Дефицит АТФ приводит к расстройству транспортировки ионов.
Частичная инактивация насоса может возникать при дефиците моноаминов — дофамина, норадреналииа, серотонина. Все это ведет к нестабильности мембраны н повышенной тенденции к пароксизмальному деполяризациоиному сдвигу (ПДС).
Глубокое нарушение функции насоса (например, оубанном) в 100% случаев сопровождается развитием судорожных припадков. Поскольку во время возбуждения нейрона ионы калия не только выходят за пределы клеточной мембраны, но и депонируются глией, очевидно, имеет немаловажное значение н функциональное состояние последней.
Можно полностью согласиться с мнением К. И. Погодаева (1986) о том, что процессы нейронального эпилептогенеза следует рассматривать с точки зрения явлений, происходящих в системе нейрон — глиоцит —миоцит (перициты и эндотелий артерий и капилляров).
Эта система связана с электрохимическим потенциалом ионов К+ и Na+ митохондриальных м цитоплазматических мембран. При «разрядке» нейронов ионные потоки митохондриального и цитоплазм этического К+ устремлены в глиоциты, a Na+—в нейроны; при «зарядке» наблюдается обратное явление.
Автор рассматривает в качестве основы эпилептогенеза формирующуюся под влиянием различных пери- и постнатальных факторов систему нейрон — глиоцит — миоцит с определенной метаболической структурой (относительно высокой концентрацией ионов калия в митохондриях, обусловленной повышенным потреблением кислорода при сниженном образовании АТФ).
Следует еще раз подчеркнуть, что глия рассматривается как наиболее эффективная буферная система, которая связывает калий, выделяющийся из клетки при ее деполяризации. В то же время эпилептогенные поражения характеризуются определенными морфологическими изменениями, среди которых существенны сдвиги в отношении глии (глиоз).
В связи с этим высказано предположение, что глиоз в той или иной степени нарушает способность глин удалять из экстрацеллюлярного пространства калий, что может быть одной из причин эпилептизации нейронов.
Процессы локальной эпилептизации нейронов, по-видимому, могут приводить в действие все три указанных механизма, хотя доля участия каждого из них в различных случаях неодинакова. A. A. Ward и A. R. Wyler (1980), указывая на необычайные свойства эпилептического нейрона (давать разряды потенциалов действия в условиях, при которых нормальный нейрон отвечает только единичными потенциалами или не отвечает совсем), подчеркивают, однако, что единичные нейроны с такими свойствами не могут генерировать эпилептические припадки; только адекватная популяция эпилептических нейронов в локальной области коры имеет основные черты эпилептического очага.
Киндлинг-эффект

Так что же такое Киндлинг-эффект? Суть киндлинг-эффекта в том, что частая подпороговая стимуляция повышает судорожную готовность и может приводить к возникновению самопроизвольных судорог у прежде здорового экспериментального животного. После каждой стимуляции функциональное состояние мозга изменяется, облегчая распространение возбуждения в последующем, — в основе эффекта лежит явление нейрональной пластичности. Грэхам Годдард, описавший эффект одним из первых в 1960-е годы, сравнил этот процесс с разжиганием огня, а в отечественной литературе его часто сравнивают с раскачиванием маятника.
Техника вызывания
Первоначально киндлинг-эффект получали путем электрической стимуляции миндалин крыс. В ответ на стимул одной и той же силы у животного последовательно развиваются клонус лицевых мышц, кивание головой, клонусы конечностей и генерализованные судороги с падением. Получив последнюю разновидность судорог, говорят: «Киндлинг установлен». Первые исследователи докладывали, что нервная ткань такой мыши сохранила способность отвечать на тот же стимул генерализованным припадком после 12 месяцев без стимуляции.
В дальнейшем выяснилось, что не все области мозга одинаково реагируют на стимуляцию. Стимулируя, например, верхние холмики, ретикулярную формацию, мозжечок, эффект получить не удалось. Специфичен эффект стимуляции двигательной коры: первоначально получают парциальные судороги в области, которой соответствует данный участок коры, но впоследствии у таких животных могут развиться самопроизвольные генерализованные судороги, такие же, как и при стимуляции структур лимбической системы, которые оказались наиболее чувствительными: миндалины, бледный шар, обонятельная луковица, прилежащее и хвостатое ядра, гиппокамп. Причина восприимчивости этих образований к киндлингу, возможно, в том, что между ними хорошо развиты кольцевые нейронные связи, которые в норме обеспечивают длительное сохранение возбуждения, а при эпилепсии могут стать основой для его патологической рециркуляции.
Киндлинг можно воспроизвести не только путем электрической стимуляции мозга, но и c помощью веществ-конвульсантов. Принципиально их можно разделить на 2 группы: антагонисты ГАМК и агонисты глутамата, несколько выделяется из этой классификации пилокарпин. Многие из них можно вводить интраперитонеально, что облегчает эксперимент.
Аналогично опытам с электростимуляцией, животным несколько раз вводятся субконвульсивные дозы, при этом также отмечается разная чувствительность областей мозга к конвульсанту. Если вещество вводится интраперитонеально и действует системно, очаги возбуждения сформируются скорее в вышеперечисленных структурах лимбической системы.
Возможно как химическое, так и электростимуляционное моделирование эпилепсии путем одномоментного введения высокой дозы вещества или подачи большого разряда, которые сразу вызывают эпилептический статус, а впоследствии у такого животного наблюдаются спонтанные судорожные приступы. Предполагается, что при этом повреждается участок мозга, который в дальнейшем играет роль эпилептогенного очага, такие модели называются постстатусными и не относятся к эффекту киндлинга.
Такие опыты проводились впоследствии на других животных: кошках, лягушках, кроликах, мартышках, при этом выяснилось, что чувствительность к киндлингу варьируется не только между отдельными областями мозга, но и различна у разных видов животных.
Морфология и физиология
Поскольку речь идет о подпороговой стимуляции, которая не оказывает деструктивного воздействия, речь в случае киндлинг-эффекта идет о функциональных изменениях в нейронах.
Еще в первых экспериментах по киндлингу было показано, что изменениям подвергаются не только непосредственно стимулируемые нейроны, но и связанные с ними. Например, судорожный порог снижался в аналогичных контралатеральных областях мозга и в прилежащих к стимулируемой, и эти изменения сохранялись даже при разрушении первично простимулированной области (трансфер-феномен). Поэтому нельзя утверждать с уверенностью, какое влияние в киндлинг-эффекте преобладает — обосновано оно изменениями в самих нейронах или влиянием со стороны измененных нейронов, связанных с областью первоначальной стимуляции. Нужно отметить, что, когда речь идет об электрической стимуляции, в качестве контрольной группы выступают животные, которым вживили электрод, но стимуляцию не проводили — в некоторой степени это является ограничением киндлинговой модели.
Морфологические изменения, которые обнаруживают при установленном киндлинге, достаточно тонкие и имеют тенденцию со временем ослабевать. Например, при электродной стимуляции гиппокампа, повышается плотность слоя гранулярных клеток зубчатой извилины, уменьшается плотность дендритных шипиков и увеличивается проксимальная часть аксонов, однако эти изменения наиболее выражены в первый день после окончательной стимуляции, а через месяц практически полностью редуцируются. По всей видимости, длительность эффекта разная для разных областей мозга и разных способов установления киндлинга.
Однако именно на примере киндлинга изучался вопрос о сопутствующей эпилепсии нейродегенерации; исследователи пришли к выводу, что она в большой степени связана с сосудистыми причинами, а клинические проявления повреждающей гипоксии нивелируются приемом сосудорасширяющих препаратов — один из примеров того, как моделирование эпилепсии с помощью киндлинг-эффекта может быть использовано при изучении патофизиологии заболевания.
Представляют интерес биохимические исследования, например, экспрессии протоонкогена c-fos в нейронах, вовлеченных в циркуляцию возбуждения, или нейромедиаторных изменений в них. Мета-анализ нескольких исследований экспрессии генов в таких нейронов указывает на около 100 генов, экспрессия активируется достоверно чаще, среди них преобладают связанные с нейродеградацией, оксидативным стрессом и реакциями иммунной системы, однако есть и факторы нейропротекции, что для терапевтических целей немаловажно.
Активно исследуется состояние основных нейромедиаторных систем у животных с установленным киндлингом. Например, противоречивы данные по мускариновым рецепторам — хотя они участвуют в развитии судорог (и возможна их индукция пилокарпином), у мышей с установленным киндлингом плотность мускариновых рецепторов в мозговой ткани снижается.
Норадреналин напротив является, по всей видимости, эндогенным антиконвульсантом. Отмечено, что плотность β-адренорецепторов в стимулируемых областях по сравнению с контрольной группой уменьшается. Интересно, что уровень самого норадреналина в мозговой ткани не меняется, но уменьшается активность тирозин-гидроксилазы, ключевого фермента в пути синтеза норадреналина.
Уровень дофамина, в синтезе которого она также участвует, в мозге крыс снижается.
Изменяется также состояние ГАМК-ергической системы, однако в ее случае не окончательно ясно, является это составляющей патогенеза киндлинг-эпилепсии (причиной) или следствием судорог. Тем не менее, достоверно снижается плотность бензодиазепиновых рецепторов.
Киндлинг-эффект важен не только потому, что это одна из наиболее доступных и воспроизводимых животных моделей эпилепсии, которая позволяет рассмотреть разные патофизиологические аспекты эпилепсии и тестировать новые антиконвульсанты. С одной стороны, этот эффект — наглядное проявление феномена нейрональной пластичности и может использоваться для его изучения. С другой стороны, в последнее время обсуждается применимость теории киндлинга и к другим заболеваниям: пароксизмальным состояниям в неврологии (например, мигрень) и психическим расстройствам, которые эффективно лечатся антиконвульсантами (биполярное аффективное расстройство, обсессивно-компульсивное расстройство, панические атаки, алкогольный абстинентный синдром).
Так же как и для эпилепсии, для них замечено, что каждый приступ увеличивает вероятность последующего — патогенез этого явления может быть основан именно на киндлинг-эффекте, и такое восприятие факта напрямую скажется на подходе к терапии, ведь в таком случае будет отдан приоритет возможно раннему началу лечения и предотвращению каждого эпизода заболевания.
1.3 Механизмы фокального эпилептогенеза
Эпилепсия широко распространенное заболевание. Им страдают около 0,5 % человеческой популяции (Sander and Shorvon 1996). Исследования этого заболевания имеют длительную историю. Еще в 1881 году Gowers писал об эпилепсии: “Abnormal discharges are due to potentiation of excitatory mechanisms or due to failure of intrinsic cerebral inhibitory systems” (Патологические разряды возникают благодаря потенциации возбуждающих механизмов или из-за нарушения внутримозговых тормозных систем). С тех пор эта парадигма не претерпела значительных изменений.
1.3.1 Исследования эпилептогенеза
В настоящее время, исследования событий, происходящих в эпилептическом мозге, проводятся в большом числе лабораторий по всему миру. За последние годы был достигнут определенный прогресс в этом направлении. Показаны изменения в клеточном составе (в частности гибель клеток – (Bernard et al. 2000)), составе рецепторов (Schwarzer et al. 1997), возбудимости мембран (Ketelaars et al. 2001) и синаптической пластичности (Kullmann et al. 2000) при эпилептогенезе. Однако, трудно представить, что все эти события должны произойти одновременно, чтобы мозг стал эпилептическим. В данном случае, необходимо четко разделить причину и следствия заболевания. К сожалению, до настоящего времени причина, инициирующая эпилептогенез, не вполне ясна.
В лабораторных условиях разработан целый ряд экспериментальных моделей in vivo и in vitro. Для создания судорожной активности у животных или электрографической эпилептиформной активности в срезах мозга используются фармакологические препараты (агонисты, антагонисты, модуляторы) повышающие возбудимость или снижающие торможение нейрональной сети (Schwartzkroin 1986). Этот подход дает свои результаты, зачастую определяемые типом воздействия. Однако, значимость их для понимания механизмов заболевания сомнительна.
В качестве эпилептогенных воздействий рассматриваются изменения ионного состава внеклеточной среды. К эпилептиформной пачечной активности приводит повышение внеклеточной концентрации калия, которое оказывает деполяризующий эффект на клетки (McBain 1994; McBain 1995). Электрографическая судорожная активность возникает также при снижении концентрации магния, которое приводит к активации кальциевого тока в нейроны (Tancredi et al. 1988).
Вероятно, одной из самых удачных экспериментальных моделей in vivo является киндлинг (“раскачка”) (Goddard et al. 1969). Его идея заключается в периодической высокочастотной стимуляции чувствительных к эпилептогенезу областей мозга (в частности, гиппокампа) подпороговыми для развития судорог стимулами (Lothman and Williamson 1994; McNamara et al. 1985). Эпизоды стимуляции следуют с интервалом (в зависимости от протокола) от нескольких часов до суток. При этом с каждой последующей стимуляцией мозг становится более чувствительным к развитию судорожной активности. После окончания эпизодов стимуляции состояние повышенной чувствительности к судорожной активности длится месяцами. Преимущество этого подхода заключается в том, что более физиологичная, чем фармакологические воздействия, электрическая стимуляция приводит к долговременным изменениям в мозге. Эти изменения можно изучать в течение длительного времени после отмены эпилептогенного стимула, что позволяет получить данные не только о событиях, происходящих при судорожной активности, но и механизмах их поддержания.
Наконец, разработан ряд генетических моделей эпилептогенеза. Получены животные, обладающие склонностью к судорожной активности. Одной из таких моделей являются крысы, впадающие в судороги при предъявлении звукового стимула (Garcia-Cairasco et al. 1996). В России на базе крыс линии Вистар были выведены животные обладающие судорожной реакцией на звуковые стимулы (линия Крушинского-Молодкиной) (Батуев и др., 1997). Тем не менее, в клинической практике не было описано аудиогенной эпилепсии у человека, что несколько ограничивает использование данных полученных в этих моделях (Dr.A.Wurz,personalcommunucation).
Интенсивная работа ведется при клинических исследованиях эпилепсии на человеке. Для этого проводят электрические энцефалографические и компьютерные томографические исследования. Для исследований in vitro используются срезы левого или правого гиппокампа, полученные в результате его хирургического удаления. Такая операция является в настоящее время рутинной в случае парциальной эпилепсии левой или правой височной доли (Isokawa et al. 1993; Schroder et al. 2000; Schwartzkroin 1986; Tursky et al. 1976). Однако, сложность invitroисследований на ткани человека заключается в фактическом отсутствии контроля (здоровой ткани для сравнения). Другим подходом исследований на человеке является генетический анализ ДНК, полученной из крови. Исследования ДНК пациентов с эпилепсией указывает на наличие у них мутаций в субъединицах калиевых (Spauschus et al. 1999) и кальциевых, в частности, P/Q типа (Jouvenceau et al. 2001) каналов. Эти каналы, находящиеся в большинстве клеток мозга, играют важную роль в возбудимости нейрональной сети и кальциевом гомеостазе. Функциональные нарушения в данных каналах в силу их широкой распространенности способны произвести изменения во всех системах мозга и сдвинуть баланс в сторону его гипервозбудимости.
научная статья по теме РАЗВИТИЕ ПЕНТИЛЕНТЕТРАЗОЛОВОГО КИНДЛИНГА У КРЫС СОПРОВОЖДАЕТСЯ УВЕЛИЧЕНИЕМ ЭКСПРЕССИИ ДАБЛКОРТИНА В ГИППОКАМПЕ Медицина и здравоохранение

Текст научной статьи на тему «РАЗВИТИЕ ПЕНТИЛЕНТЕТРАЗОЛОВОГО КИНДЛИНГА У КРЫС СОПРОВОЖДАЕТСЯ УВЕЛИЧЕНИЕМ ЭКСПРЕССИИ ДАБЛКОРТИНА В ГИППОКАМПЕ»
РАЗВИТИЕ ПЕНТИЛЕНТЕТРАЗОЛОВОГО КИНДЛИНГА У КРЫС СОПРОВОЖДАЕТСЯ УВЕЛИЧЕНИЕМ ЭКСПРЕССИИ ДАБЛКОРТИНА В ГИППОКАМПЕ
© 2009 г. В. А. Аниол*, А. А. Яковлев, М. Ю. Степаничев, Н. А. Лазарева, Н. В. Гуляева
Учреждение Российской академии наук Институт высшей нервной деятельности и нейрофизиологии РАН
Даблкортин - белок с молекулярной массой 50 кДа, который экспрессируется в нейронах на ранних стадиях дифференцировки. В работе проведено исследование экспрессии даблкортина в гиппокам-пе крыс при хроническом введении пентилентетразола. Крыс декапитировали после 1, 3, 5 и 13 инъекций подпороговой дозы хемоконвульсанта и содержание даблкортина оценивали с помощью Western-blot-анализа. Установлено, что в гиппокампе антитела к даблкортину взаимодействовали с белками с молекулярной массой 50 и 70 кДа. Экспрессия даблкортина повышалась после 13 инъекций пентилентетразола, что свидетельствует об интенсификации процессов нейрогенеза в гиппокампе крыс с повышенной судорожной готовностью. Белки массой 70 кДа были обнаружены в коре и гиппокампе, и изменение их экспрессии не было связано с изменением экспрессии даблкортина.
Ключевые слова: гиппокамп, нейрогенез, даблкортин, пентилентетразол, эпилепсия.
Процесс постоянного образования новых клеток в гиппокампе взрослых млекопитающих был впервые открыт Altman и соавт. в 60-х годах XX в. 3. За полвека, прошедшие с тех пор, было установлено, что часть этих клеток становится нейронами и встраивается в существующие ней-рональные сети гиппокампа, а часть дает начало глии. Как само образование новых клеток, так и процесс их дифференцировки в нейроны или глию находится под регулирующим воздействием разнообразных внешних и внутренних факторов. Одним из таких факторов является судорожная активность. Были высказаны предположения о вкладе постнатального нейрогенеза в процессы развития судорожных состояний, что стимулировало исследования в этой области. В ряде работ было показано, что судороги, вызванные введением хемоконвульсантов или электрическим раздражением проэпилептогенных участков мозга, сопровождаются усилением пролиферации клеток в гиппокампе и увеличением числа молодых нейронов в нем [4, 5]. Наряду с этим существуют работы, в которых демонстрировалась возможность ослабления нейрогенеза на фоне судорожной активности [6, 7]. Имеющиеся противоречия могут быть связаны с различными экспериментальными подходами к выработке судорог, а также с затруднениями интерпретации результатов двойного окрашивания с использованием марке-
ров зрелых нейронов. Наряду с этим существуют белки, присутствующие только в незрелых, молодых нейронах, что позволяет по уровню их экспрессии напрямую определять интенсивность нейрогенеза. Одним из таких маркеров является даблкортин ^оиЫесогйп), представляющий собой белок, ассоциированный с микротрубочками ней-робластов и незрелых нейронов и опосредующий процессы их миграции. Даблкортин экспрессируется в нейробластах и незрелых нейронах в течение нескольких недель после их образования [8]. Процесс созревания нейрона, его встраивание в гранулярный слой зубчатой фасции, ветвление дендритов и установление синаптической связи с пирамидными клетками поля СА3 сопровождается постепенным исчезновением экспрессии даблкортина. Зрелые нейроны гранулярного слоя зубчатой фасции уже не экспрессируют даблкортин. В связи с этим даблкортин может быть использован в качестве маркера незрелых нейронов, что позволит изучать процессы постнатального нейрогенеза. В настоящем исследовании мы определяли экспрессию даблкортина в гиппокампе крыс на разных этапах пентилентетразолового киндлинга (ПТЗК), являющегося общепринятой моделью эпилептогенеза и хронической судорожной активности.
МАТЕРИАЛЫ И МЕТОДЫ
Для выработки ПТЗК было использовано 35 самцов крыс линии Wistar в возрасте 2 мес массой тела 150-200 г к началу эксперимента. Крыс
РАЗВИТИЕ ПЕНТИЛЕНТЕТРАЗОЛОВОГО КИНДЛИНГА
содержали по пять особей в пластмассовых клетках при искусственном световом режиме (день 8 : 0020 : 00) и свободном доступе к воде и пище. Для оценки экспрессии даблкортина в гиппокампе животных на разных стадиях развития ПТЗК было сформировано 5 групп: контрольная (n = 8) и 4 подопытных группы, которым вводили ПТЗ внутрибрюшинно в дозе 37.5 мг/кг массы тела 1, 3, 5 и 13 раз (n = 6-7). Контрольным животным внутрибрюшинно вводили изотонический раствор NaCl. Введение пентилентетразола (ПТЗ) осуществляли каждые вторые сутки с перерывом на выходные дни в одно и то же время (11 : 00). В течение 20 мин после инъекции ПТЗ оценивали судорожную активность животных в баллах, как описано ранее [9].
На следующий день после последнего введения ПТЗ животных декапитировали, извлекали головной мозг, затем выделяли гиппокамп и замораживали его в жидком азоте до использования. Для выделения белковой фракции гиппокамп гомогенизировали в Тризоле в соотношении 1 г на 15 мл, после чего из полученного гомогена-та выделяли белковую фракцию методом фенол-хлороформной экстракции. Затем определяли концентрацию белка в каждой пробе по методу Брэдфорд [10] при помощи спектрофотометра Ultrospec II (LKB Biochrom, UK). После этого разводили все образцы до одинаковой концентрации белка 6 мг/мл. Пробы денатурировали кипячением в буферном растворе и наносили на полиакри-ламидный гель (содержание акриламида 10% для определения даблкортина и 12% для определения а-тубулина). Затем белки переносили с геля на нитроцеллюлозную мембрану и далее обрабатывали по стандартной методике Western-blot. Для определения даблкортина применяли первичные поликлональные антитела кролика к даблкорти-ну (1 : 2000; Abcam, UK) и вторичные антитела козы к IgG кролика, конъюгированные с перокси-дазой хрена (1 : 1000; Bio-Rad Laboratories, USA). Для определения а-тубулина применяли первичные моноклональные антитела мыши к а-тубу-лину (1 : 20000; Sigma, USA) и вторичные антитела козы к IgG мыши, конъюгированные с перок-сидазой хрена (1 : 1000; Bio-Rad Laboratories, USA). Проявку проводили методом люминолзависимой хемилюминесценции, результаты фиксировали на фотопленке и обрабатывали при помощи программы Total Lab. Результаты анализа содержания даблкортина нормировали по а-тубулину для каждого животного. Статистическую обработку и анализ результатов проводили при помощи пакета программ "Statistica for Windows". Данные представлены в виде M ± S.E.M.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Хроническое введение ПТЗ крысам приводит к развитию киндлинга, сопровождающегося повышением судорожной готовности и усилением конвульсивных проявлений в ответ на каждую последующую инъекцию ПТЗ. В настоящем исследовании наблюдалось усиление внешних судорожных проявлений с 1.93 ± 0.05 баллов после первой инъекции ПТЗ до 3.05 ± 0.05 баллов после последней инъекции ПТЗ.
Ход процессов созревания молодых клеток, образовавшихся в зубчатой фасции гиппокампа, можно проследить по экспрессии ими различных белков, характерных для разных стадий диффе-ренцировки. Недифференцированные мультипо-тентные клетки экспрессируют маркер астроци-тарной глии - глиальный фибриллярный кислый белок (GFAP). Вступление клетки на путь нейро-нальной дифференцировки сопровождается исчезновением GFAP и появлением наиболее раннего маркера нейрональной дифференцировки -даблкортина, экспрессирующегося в нейробла-стах и незрелых нейронах примерно с 4-х по 26-е сут развития [11]. В это время клетка мигрирует из субгранулярного слоя зубчатой фасции в гранулярный и там встраивается в нейрональную сеть, протягивая дендрит в молекулярный слой, а аксон - в поле CA3 и устанавливая синаптические контакты. Зрелый нейрон перестает экспресси-ровать даблкортин, на смену которому постепенно приходят белки, характерные для взрослого гранулярного нейрона - NeuN и кальбиндин [8]. Таким образом, измерение уровня даблкортина в гиппокампе позволяет оценить число молодых, недавно образовавшихся клеток, уже вступивших на нейрональный путь дифференцировки, но еще не достигших стадии зрелого нейрона.
Даблкортин обычно выявляется при иммуно-гистохимическом окрашивании срезов мозга контрольной крысы в некоторых клетках гранулярного слоя зубчатой фасции (рис 1А). Даблкортин был локализован в цитоплазме клеток, но не в их ядре. Окрашивались также отростки клеток в молекулярном слое зубчатой фасции. В системе боковых желудочков и рострального миграционного русла также отмечалось интенсивное окрашивание клеток и их отростков (рис 1Б). В остальных областях мозга положительного окрашивания на даблкортин обнаружено не было.
Уровень экспрессии даблкортина в отделах мозга исследовали с помощью Western-Ыot-анали-за. В экстрактах гиппокампа крыс всех групп было обнаружено две полосы, примерно соответ-
Рис. 1. Окрашивание клеток, экспрессирующих даблкортин, в гранулярном слое зубчатой фасции (ЗФ) гиппокампа крыс (A) и в субвентрикулярной области боковых желудочков (Б) непрямым иммунопероксидазным методом. А. Даблкортин локализован в цитоплазме и отростках клеток, расположенных на границе гранулярного слоя ЗФ и поля СА4 гиппокампа. Б. Клетки, экспрессирующие даблкортин (отмечены стрелками), расположены в толще суб-вентрикулярного слоя. Окраска поликлональными антителами кролика к даблкортину (1 : 500; Abcam, UK), антителами козы к IgG кролика, конъюгированными с биотином (1 : 800; Sigma, USA), и стрептавидин-пероксидазным комплексом (1 : 100; Имтек, Россия). Об. х40, ок. х10.
контроль ПТЗ 1 ПТЗ 3 ПТЗ 5 ПТЗ 13 кора
Рис. 2. Экспрессия даблкортина (Dcx) в гиппокампе крыс на разных стадиях ПТЗК (контроль-ПТЗ 13). В экстрактах гиппокампа антителами к Dcx выкрашивались две полосы в области 50 и 70 кДа. Даблкортину соответствовала полоса 50 кДа. В неокортексе присутствовала лишь полоса в области 70 кДа.
ствующие фракциям белков с молекулярной массой 50 и 70 кДа (рис. 2). Полоса 50 кДа соответствует даблкортину. Предполагается, что полоса 70 кДа может принадлежать комплексу дабл
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Читайте также:
