Клиника и диагностика атаксии-телеангиэктазии
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Кожные болезни:
Популярные разделы сайта:
Атаксия-телеангиэктазия - диагностика, лечение
Атаксия-телеангиэктазия - редкое заболевание, наследуемее по аутосомно-рецессивному типу и характеризующееся развитием прогрессирующей церебральной атаксии, окулокутанной телеангиэктазией и рецидивирующими инфекционными заболеваниями дыхательных путей и повышенной склонностью к развитию лимфоретикулярных злокачественных новообразований.
Синонимы: синдром Луи-Бар.
Эпидемиология атаксии-телеангиэктазии
Возраст: развитие телеангиэктазии наблюдается в возрасте 3-5 лет, при этом появлению кожных высыпаний может предшествовать атаксия.
Пол: не имеет значения.
Заболеваемость: среди гомозигот - более 1 случая на 40000 новорожденных, частота генов - 1:100 (1% в популяции являются гетерозиготами).
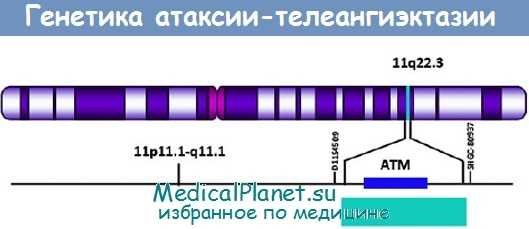
Генетика: наследуется по аутосомно-рецессивному типу, отмечается дефект в хромосоме 11q22-23.
Патофизиология атаксии-телеангиэктазии. Атаксия-телеангиэктазия вызвана мутацией в ATM-гене, локализованном в хромосоме llq22. ATM отвечает за целостность хромосом; таким образом, в клетках пациентов с атаксией-телеангиэктазией наблюдается нестабильность структуры хромосом.
Анамнез атаксии-телеангиэктазии. У больных атаксией-телеангиэктазией вначале развивается атаксия - вскоре после того, как ребенок начинает учиться ходить.
Кожные высыпания появляются в возрасте от 3 до 5 лет в виде мелких симметричных телеангиэктазии в конъюнктиве, при этом в процесс постепенно вовлекается кожа лица, туловища и конечностей. С возрастом и при отсутствии защиты от солнечных лучей кожа становится склеротичной и приобретает пестрый вид из-за развития гипо- и гиперпигментации.
Клиника атаксии-телеангиэктазии
Тип высыпаний: телеангиэктазии, склероз, фолликулярный гиперкератоз.
Цвет: красный, коричневый, пестрая окраска кожи из-за гипо-, и гиперпигментации.
Локализация: телеангиэктазии в конъюнктиве, на веках, ушах, скулах, шеи, области декольте, локтевых/подколенных ямках, тыльных поверхностях кистей и стоп. Склеродермоподобные изменения на коже лица (маскообразное лицо), предплечий и кистей. Волосы: диффузное поседение волос, гирсутизм в области верхних и нижних конечностей.
Другое: диффузная сухость кожи, экзематозный и себорейный дерматит.
Общие проявления атаксии-телеангиэктазии
Нервная система: атаксия, медлительность движений, снижение интеллекта (30% случаев), хореоатетоз, слюнотечение, характерное движение глазных яблок, маскообразное лицо, сутулая осанка, опущенные плечи, наклонное положение головы, периферическая нейропатия, спи-нальная мышечная атрофия.
Дыхательная система: инфекционные заболевания дыхательных путей, ринит, бронхит, пневмония и бронхоэктазия (75-80% случаев).
Иммунология: нарушение гуморального ответа (дефицит IgA, IgE) и клеточно-опосредованного иммунитета (лимфопения, нарушение лимфоцитарной трансформации). Структурные аномалии тимуса и лимфатических узлов.
Новообразования: лимфоретикулярные злокачественные процессы (ходжкинская лимфома, лимфосаркома, ретикулярная клеточная саркома, лейкемия), другие неопластические заболевания (дисгерминома яичников, медуллобластома, карциномы ЖКТ) (15% случаев).
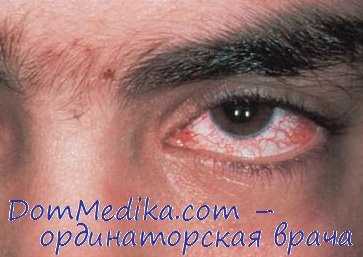
Дифференциальная диагностика атаксии-телеангиэктазии. Атаксию-телеангиэктазию следует дифференцировать со звездчатой гемангиомой, серпигинирующей ангиомой, наследственной геморрагической телеангиэктазией (болезнь Ослера-Рандю-Вебера), генерализованной идиопатической телеангиэктазией и пятнистой эруптивной персистирующей телеангиэктазией (вариантом мастоцитоза).
Лабораторная диагностика атаксии-телеангиэктазии
Патогистология: расширенные кровеносные сосуды субкапиллярного сплетения в области телеангиэктазии.
Серологические исследования: повышенный уровень альфа-фетопротеина сыворотки.
Биохимический анализ крови: нарушение толерантности к глюкозе, повышенный уровень печеночных ферментов.
Течение и прогноз атаксии-телеангиэктазии
Пациенты с атаксией-телеангиэктазией имеют неблагоприятный прогноз. Смертельный исход обычно наступает в позднем детском или раннем подростковом возрасте в результате бронхоэктазии и дыхательной недостаточности, развившихся вторично после рецидивирующих инфекций дыхательных путей (в 15% случаев возникают лимфоретикулярные злокачественные новообразования).
Во взрослом возрасте у больных развиваются тяжелые неврологические нарушения, пациенты не могут передвигаться без посторонней помощи и вынуждены использовать кресло-каталку.
Лечение атаксии-телеангиэктазии
Лечение при атаксии-телеангиэктазии носит в большей степени поддерживающий характер. При инфекционных заболеваний дыхательных путей назначается антибиотикотерапия; проводится лечение бронхоэктазии; при контрактурах применяются физиопроцедуры; для минимизации актинических кожных проявлений рекомендовано использование фотозащитных средств и избегание солнечного света.
Необходимы генетическое консультирование и пренатальная диагностика (исследование альфа-фетопротеина в амниотической жидкости и выявление спонтанных хромосомных нарушений в амниоцитах).
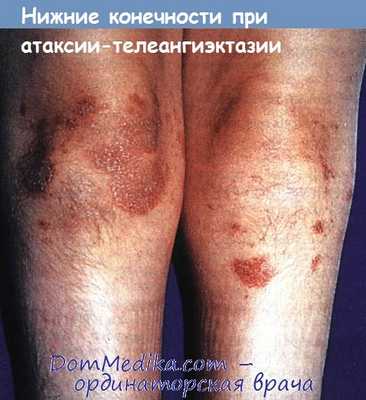
Гирсутизм нижних конечностей и экхимозы, развившиеся вторично вследствие атаксии и падений
Синдром Луи-Бар
Синдром Луи-Бар (атаксия-телеангиэктазия) — наследственное заболевание, проявляющееся мозжечковой атаксией, телеангиэктазиями кожи и конъюнктивы глаз, недостаточностью Т-клеточного звена иммунитета. Последнее приводит к тому, что синдром Луи-Бар сопровождается частыми респираторными инфекциями и склонностью к возникновению злокачественных опухолей. Диагностируется синдром Луи-Бар на основании анамнеза и клинической картины заболевания, данных иммунограммы, результатов офтальмологического и отоларингологического обследования, МРТ головного мозга и рентгенографии легких. В настоящее время синдром Луи-Бар не имеет специфического и эффективного лечения.
Общие сведения
Синдром Луи-Бар впервые был описан в 1941 году во Франции. Нет точных данных о том, с какой частотой синдром Луи-Бар встречается среди современного населения. По некоторым сведениям эта цифра составляет 1 случай на 40 тысяч новорожденных. Однако, необходимо учитывать, что при смерти в раннем детском возрасте синдром Луи-Бар обычно остается не диагностированным. Известно, что заболевание одинаково часто поражает мальчиков и девочек. В неврологии синдром Луи-Бар относится к так называемым факомотозам — генетически обусловленным сочетанным поражениям кожи и нервной системы. В эту группу также входят нейрофиброматоз Реклингхаузена, ангиоматоз Стерджа—Вебера, туберозный склероз и др.
Причины и патогенез
В основе патологических изменений, сопровождающих синдром Луи-Бар, лежат генетические нарушения, приводящие к развитию врожденной нейроэктодермальной дисплазии. Синдром Луи-Бар является аутосомно-рецессивным заболеванием, т. е. проявляется клинически только при получении рецессивного гена сразу от обоих родителей.
Морфологически атаксия-телеангиэктазия характеризуется дегенеративными изменениями тканей мозжечка, в частности потерей зернистых клеток и клеток Пуркинье. Дегенеративные изменения могут затрагивать зубчатое ядро мозжечка (nucleus dentatus), черную субстанцию (substantia nigra) и некоторые отделы коры головного мозга, иногда поражаются спиномозжечковые пути и задние столбы спинного мозга.
Синдром Луи-Бар сочетается с гипоплазией или аплазией тимуса, а также с врожденным дефицитом IgA и IgE. Эти нарушения в системе иммунитета приводят к появлению у пациентов частых инфекционных заболеваний, склонных к длительному и осложненному течению. Кроме того, иммунные нарушения могут потенцировать развитие злокачественных новообразований, зачастую берущих свое начало в структурах лимфоретикулярной системы.
Клинические проявления синдрома Луи-Бар
Атаксия. Наиболее часто синдром Луи-Бар начинает проявляться клинически в возрасте от 5 месяцев до 3 лет. Во всех случаях заболевания синдром Луи-Бар манифестирует с появления мозжечковой атаксии, признаки которой становятся очевидными, когда ребенок начинает ходить. Наблюдаются нарушения равновесия и походки, дрожание во время двигательного акта (интенционный тремор), качание туловища и головы. Зачастую атаксия настолько выражена, что имеющий синдром Луи-Бар больной не может ходить. Мозжечковая атаксия сочетается с мозжечковой дизартрией, характеризующейся невнятной скандированной речью. Отмечается мышечная гипотония, снижение или полное исчезновение сухожильных рефлексов, нистагм, глазодвигательные нарушения и косоглазие.
Телеангиэктазии. В большинстве случаев появление сопровождающих синдром Луи-Бар телеангиэктазий происходит в возрасте от 3 до 6 лет. В некоторых случаях их возникновение отмечается в более поздний период и очень редко в течение первого месяца жизни. Телеангиэктазии (сосудистые звездочки) представляют собой имеющие различную форму красноватые или розовые пятнышки или разветвления. Они обусловлены расширением мелких сосудов кожи. Следует отметить, что телеангиэктазии могут быть проявлением многих других заболеваний (например, розацеа, СКВ, дерматомиозита, пигментной ксеродермы, хронического лучевого дерматита, мастоцитоза и пр.). Однако в сочетании с атаксией они дают специфическую для синдрома Луи-Бар клиническую картину.
Синдром Луи-Бар характеризуется изначальным возникновением телеангиэктазий на конъюнктиве глазного яблока, где они имеют вид «паучков». Затем сосудистые звездочки появляются на коже век, носа, лица и шеи, локтевых и коленных сгибов, предплечий, тыльной поверхности стоп и кистей. Телеангиэктазии могут также наблюдаться на слизистой оболочке мягкого и твердого неба. Наиболее выражены сосудистые звездочки в тех местах кожного покрова, где он подвергается воздействию солнечных лучей. В первую очередь это лицо, где телеангиэктазии образуют целые «пучки». При этом кожа теряет свою эластичность и становится плотной, что напоминает изменения, типичные для склеродермии.
Кожные проявления атаксии-телеангиэктазии могут включать появление веснушек и пятен цвета кофе с молоком, участков обесцвеченной кожи. Наличие гипо- и гиперпигментаций делает кожные симптомы синдрома Луи-Бар схожими с клиникой пойкилодермии. У многих больных отмечается сухость кожи и участки гиперкератоза. Может наблюдаться гипертрихоз, ранняя седина волос, кожные элементы, напоминающие акне или проявления псориаза.
Инфекции дыхательных путей. Характеризующее синдром Луи-Бар поражение иммунной системы приводит к возникновению частых рецидивирующих инфекций дыхательных путей и уха: хронических ринитов, фарингитов, бронхитов, пневмоний, отитов, синуситов. Их особенностями являются: стертость границ между периодом обострения и ремиссии, скудность физикальных данных, плохая чувствительность к антибактериальной терапии и длительное течение. Каждая подобная инфекция может стать для больного атаксией-телеангиэктазией смертельно опасной. Частые заболевания легких приводят к развитию бронхоэктазов и пневмосклероза.
Злокачественные новообразования. Среди пациентов, имеющих синдром Луи-Бар, злокачественные опухолевые процессы отмечаются в 1000 раз чаще, чем в среднем у населения. Наиболее распространенными среди них являются лейкемия и лимфома. Особенностью онкопатологии в случае синдрома Луи-Бар является повышенная чувствительность пациентов к воздействию ионизирующего излучения, что полностью исключает применение лучевой терапии при их лечении.
Диагностика синдрома Луи-Бар
Постановка диагноза атаксии-телеангиэктазии требует комплексного подхода, учитывающего анамнез заболевания, его клинические проявления, данные иммунологических и инструментальных исследований, а также результаты ДНК-диагностики. Пациент с подозрением на синдром Луи-Бар должен пройти обследование не только у невролога, но и у дерматолога, отоларинголога, офтальмолога, иммунолога, пульмонолога, онколога.
Лабораторная диагностика синдрома Луи-Бар включает клинический анализ крови, в котором у 1/3 пациентов наблюдается снижение количества лимфоцитов. Обязательно проводится исследование уровня иммуноглобулинов крови, которое выявляет значительное снижение IgA и IgE, в 10-12% случаев IgG. Примерно у 40% пациентов синдром Луи-Бар сопровождается аутоиммунными реакциями, о которых свидетельствует наличие аутоантител к митохондриям, тиреоглобулину, иммуноглобулинам.
Из инструментальных способов диагностики синдрома Луи-Бар могут применяться: УЗИ тимуса, МРТ головного мозга, фарингоскопия, риноскопия, рентгенография легких. При помощи УЗИ диагностируется аплазия или гипоплазия тимуса. МРТ головного мозга выявляет атрофию мозжечка, расширение IV желудочка. Рентгенография легких необходима для диагностики очаговой или крупозной пневмонии, выявления очагов пневмосклероза и бронхоэктатических изменений.
Лечение и прогноз синдрома Луи-Бар
К сожалению, эффективные методы лечения синдрома Луи-Бар до настоящего времени остаются предметом поиска. В современной медицине возможно применение лишь паллиативного симптоматического лечения соматических и иммунологических нарушений. Продлению жизни пациентов, имеющих синдром Луи-Бар, способствует иммунокоррегирующая терапия препаратами тимуса и гамма-глобулином, витаминотерапия в высоких дозировках и интенсивная терапия любого инфекционного процесса. По показаниям применяют противовирусные препараты, антибиотики широкого спектра действия, противогрибковые средства, глюкокортикостероиды.
В связи с отсутствием эффективных способов лечения синдром Луи-Бар имеет неблагоприятный прогноз как для выздоровления, так и для жизни. Больные этим заболеванием редко доживают до 20 лет. В большинстве случаев они погибают от инфекционных осложнений и онкологических заболеваний.
Клиника и диагностика атаксии-телеангиэктазии
Атаксия-телеангиэктазия - причины, механизмы развития, патанатомия
Несмотря на то, что патологоанатомические признаки и течение атаксии-телеангиэктазии (АТ) более тесно связаны с наследственными дегенеративными заболеваниями, в частности, спинно-мозжечковыми дегенерациями, среди которых данное заболевание является вторым по частоте после атаксии Фридрейха, атаксия-телеангиэктазия (АТ) рассматривается в этой группе статей на сайте, так как с клинической точки зрения проявления и диагностика данного заболевания в большинстве случаев сходны с нейрокожными синдромами, хотя оно также может рассматриваться как дегенеративное генетическое заболевание.
Атаксия-телеангиэктазия является наследственным заболеванием, связанным с нестабильностью ДНК, характеризующимся прогрессирующей мозжечковой атаксией и хореоатетозами, прогрессирующими телеангиоэктазиями кожи и глаз, иммунодефицитом с восприимчивостью к инфекциям легких и придаточных пазух носа, нарушением созревания органов, повышенной чувствительностью к ионизирующему излучению и высокой частотой злокачественных новообразований.
Атаксия-телеангиэктазия представляет собой мультисистемное генетическое заболевание с аутосомно-рецессивным типом наследования. Поврежденные гены расположены на 11q22-23 хромосоме (Shiloh, 1995). Выделен ген, кодирующий белок (ATM-белок), сходный с фосфатидилинозитол-3’-киназой млекопитающих (Savitsky et al., 1995), а мутации данного гена были выявлены во всех четырех комплиментационных группах, что указывает то, что при данном заболевании повреждается только один локус. Белок АТМ является ядерным белком и играет ключевую роль в стабилизации и репарации двухцепочечной молекулы ДНК и, таким образом, принимает участие в обеспечении стабильности клеточного цикла и защите генома.
Известно множество мутаций данного гена, большая часть из которых является нулевыми мутациями (Gilad et al., 1996). Также встречаются менее выраженные мутации, вызывающие более легкие случаи заболевания (Gilad et al., 1998, Taylor и Byrd, 2005).
Механизм развития и патологическая анатомия атаксии-телеангиэктазия. Аномальная репарация двухцепочечной молекулы ДНК приводит к множеству последствий. Считается, что ATM-белок (протеинкиназа) контролирует клеточный цикл, в частности, контрольные точки G1 и G2/M. Данный белок играет ключевую роль в выявлении дефектов двухцепочечной молекулы ДНК и блокировании клеточного цикла (Lavin et al., 2005). Таким образом, дефект ATM-белка допускает индуцированную активацию клеточного цикла, которая может отклоняться в сторону апоптоза. Одним из важных последствий является аномальная чувствительность к ионизирующему излучению и определенным радиомиметическим препаратам, а чувствительность к ультрафиолету не изменяется (Barlow et al., 1999). В дальнейшем клетки могут встраивать аномальную последовательность в свою ДНК, что приводит к разрывам хромосом и хроматид.
После повреждения АТ-клетка возобновляет синтез ДНК с неадекватной скоростью в связи с дефектом контроля системы репарации клетки после повреждения (Chun и Gatti, 2004). Мутации носят гетерогенный характер и приводят к различной степени активации про-теинкиназы, что коррелирует с тяжестью заболевания (более поздним началом и легкими формами заболевания). Значительная доля (10%) разрывов хромосом всегда постоянна. Хромосомные поломки распределены беспорядочно, а неслучайные хромосомные перестройки выборочно поражают 7 и 14 хромосомы на участках, связанных с рецепторами Т-клеток и кодированием тяжелых цепей иммуноглобулинов и с развитием злокачественных гематологических заболеваний (Hecht и Hecht, 1985; Aurias и Dutrillaux, 1986). Данные участки включают диски 7р14, 7р35, 14q2 и 14qter. Также часто поражаются 2 и 22 хромосомы (диски 2р11, 2р12 и 22q 11) (Gatti et al., 1985). Приблизительно в 10% случаев клон клеток с транслокацией участка 14-14 с точечным разрывом в области 14q32 может быть связан с возникновением злокачественных опухолей.
Описанные нарушения могут объяснять частоту инфекционных заболеваний и новообразований, особенно лимфоидной ткани, но они могут также влиять и на стабильность генома, увеличивая чувствительность к злокачественным заболеваниям даже в случае гетерозиготного состояния. Механизмы, объясняющие развитие неврологических заболеваний, аплазию тимуса, телеангиэктазии, задержку роста и нарушение созревания органов, не выявлены. Имеются общие нарушения дифференцировки тканей, объясняющие частоту повышения уровня альфа-фетопротеина (АФП) и фетального сывороточного белка печеночного происхождения, что является показателем дедифференцировки клеток печени.
В ряде работ предполагается возможная связь атаксии-телеангиэктазии (АТ) с нарушением регуляции суперсемейства генов иммуноглобулинов, включающего гены рецепторов Т-клеток (Peterson и Funkhouser, 1989). Нарушен нормальный переход от продукции иммуноглобулинов IgM к продукции иммуноглобулинов IgG, от IgA к IgE, то же самое может касаться созревания Т-клеток, на поверхности которых экспрессированы гамма/дельта рецепторы вместо альфа/бета-рецепторов (Carbonari et al., 1990). Вероятно, отсутствие или мутация единственного белка, кодируемого 11 хромосомой, может объяснить иммунологические и, возможно, даже неврологические проявления заболевания (Kastan, 1995).
Основным неврологическим нарушением в центральной нервной системе является дегенерация лаброцитов и клеток Пуркинье в мозжечке (De Leon et al., 1976; Paula-Barbosa et al., 1983). Обычно сосудистые аномалии не обнаруживаются, за исключением поздних дегенеративных сосудисто-глиальных узлов в белом веществе. Повреждения базальных ганглиев выявляются лишь изредка (Boder 1985). Дегенерация спинномозговых путей и клеток передних рогов часто выявляется на поздних стадиях заболевания. Нуклеоцитомегалия является признаком нескольких типов клеток, особенно в периферических нервах (De Leon et al., 1976).
Атаксии
Атаксия (от греч. ataxia — беспорядок) — расстройство координации движений; весьма часто встречающееся нарушение моторики. Сила в конечностях незначительно снижена или сохранена полностью. Движения становятся неточными, неловкими, расстраивается их преемственность и последовательность, нарушено равновесие в положении стоя и при ходьбе. Статическая атаксия — нарушение равновесия в положении стоя, динамическая атаксия — нарушение координации при движении. Диагностика атаксии включает неврологический осмотр, ЭЭГ, ЭМГ, МРТ головного мозга, при подозрении на наследственный характер заболевания - анализ ДНК. Терапия и прогноз развития атаксии зависят от причины ее возникновения.
МКБ-10
Атаксия (от греч. ataxia — беспорядок) — расстройство координации движений; весьма часто встречающееся нарушение моторики. Сила в конечностях незначительно снижена или сохранена полностью. Движения становятся неточными, неловкими, расстраивается их преемственность и последовательность, нарушено равновесие в положении стоя и при ходьбе. Статическая атаксия — нарушение равновесия в положении стоя, динамическая атаксия — нарушение координации при движении.
Нормальная координация движений возможна только при высокоавтоматизированной и содружественной деятельности ряда отделов ЦНС — проводников глубокомышечной чувствительности, вестибулярного аппарата, коры височной и лобной областей и мозжечка — центрального орган координации движений.
Классификация атаксий
В клинической практике различают несколько видов атаксий:
- сенситивная (или заднестолбовая) атаксия — нарушение проводников глубокомышечной чувствительности;
- мозжечковая атаксия — поражение мозжечка;
- вестибулярная атаксия — поражение вестибулярного аппарата;
- корковая атаксия — поражение коры височно-затылочной или лобной области.
Симптомы атаксии
Возникновение сенситивной атаксии обусловлено поражением задних столбов (пучков Голля и Бурдаха), реже задних нервов, периферических узлов, коры теменной доли мозга, зрительного бугра (фуникулярный миелоз, спинная сухотка, опухоли, сосудистые нарушения). Возможно ее проявление, как во всех конечностях, так и в одной ноге или руке. Наиболее показательны явления сенситивной атаксии, возникающей в результате расстройства суставно-мышечного чувства в нижних конечностях. Пациент неустойчив, при ходьбе чрезмерно сгибает ноги в тазобедренных и коленных суставах, чересчур сильно ступает на пол (штампующая походка). Зачастую возникает ощущение ходьбы по вате или ковру. Пациенты стараются компенсировать расстройство двигательных функций с помощью зрения — при ходьбе постоянно смотрят себе под ноги. Это позволяет заметно уменьшить проявления атаксии, а закрытие глаз, наоборот, их усугубляет. Тяжелые поражения задних столбцов практически лишают возможности стоять и ходить.
Мозжечковая атаксия — следствие поражения червя мозжечка, его полушарий и ножек. В позе Ромберга и при ходьбе пациент заваливается (вплоть до падения) в сторону пораженного полушария мозжечка. В случае поражения червя мозжечка возможно падение в любую сторону или назад. Пациент пошатывается при ходьбе, широко ставит ноги. Фланговая походка резко нарушена. Движения размашисты, замедленны и неловки (в большей степени со стороны пораженного полушария мозжечка). Расстройство координации почти неизменно при контроле зрения (открытые и закрытые глаза). Наблюдается нарушение речи — она замедляется, становится растянутой, толчкообразной, нередко скандированной. Почерк становится размашистым, неравномерным, наблюдается макрография. Возможно понижение мышечного тонуса (в большей степени на стороне поражения), а также нарушение сухожильных рефлексов. Мозжечковая атаксия может быть симптомом энцефалита различной этиологии, рассеянного склероза, злокачественного новообразования, сосудистого очага в стволе или мозжечке мозга .
Вестибулярная атаксия развивается при поражении одного из разделов вестибулярного аппарата — лабиринта, вестибулярного нерва, ядер в стволе мозга и коркового центра в височной доле мозга. Основным признаком вестибулярной атаксии является системное головокружение (пациенту кажется, что все окружающие его предметы движутся в одном направлении), при поворотах головы головокружение усиливается. В связи с этим пациент беспорядочно шатается или падает, а движения головой совершает с заметной осторожностью. Кроме того, для вестибулярной атаксии характерны тошнота, рвота и горизонтальный нистагм. Вестибулярная атаксия наблюдается при стволовых энцефалитах, заболеваниях уха, опухолях IV желудочка мозга, а также при синдроме Меньера.
Развитие корковой атаксии (лобной) обусловлено поражением лобной доли мозга, вызванным дисфункцией лобно-мостомозжечковой системы. При лобной атаксии в максимальной степени страдает нога, контралатеральная пораженному полушарию мозжечка. При ходьбе наблюдается неустойчивость (в большей степени на поворотах), наклон или заваливание в сторону, ипсилатеральной пораженному полушарию. При тяжелых поражениях лобной доли пациенты вообще не могут ходить и стоять. Контроль зрения никак не сказывается на выраженности нарушений при ходьбе. Корковой атаксии свойственны и другие симптомы, характерные для поражения лобной доли — хватательный рефлекс, изменения психики, нарушение обоняния. Симптомокомплекс лобной атаксии весьма схож с мозжечковой атаксией. Основным отличием поражения мозжечка является доказательная гипотония в атактичной конечности. Причины лобной атаксии — абсцессы, опухоли, нарушения мозгового кровообращения.
Наследственная мозжечковая Пьера-Мари атаксия — наследственное заболевание хронического прогрессирующего характера. Передается по аутосомно-доминантному типу. Его основное проявление — мозжечковая атаксия. Патоген обладает высокой пенетрантностью, пропуск поколений встречается весьма редко. Характерным патологоанатомическим признаком атаксии Пьера-Мари является гипоплазия мозжечка, реже — атрофия нижних олив, моста мозга (варолиева моста). Зачастую данные признаки сочетаются с комбинированной дегенерацией спинальных систем (клиническая картина напоминает спиноцеребеллярную атаксию Фридрейха).
Средний возраст начала болезни — 35 лет, когда появляется нарушение походки. Впоследствии к нему присоединяется нарушение мимики, речи и атаксия в руках. Наблюдается статическая атаксия, адиадохокинез, дисметрия. Сухожильные рефлексы повышены (до патологических рефлексов). Возможны непроизвольные мышечные вздрагивания. Сила в мышцах конечностей снижена. Наблюдается прогрессирующие глазодвигательные нарушения — парез отводящего нерва, птоз, недостаточность конвенгерции, реже — симптом Аргайла Робертсона, атрофия зрительных нервов, снижение остроты зрения, сужение полей зрения. Психические нарушения проявляются в виде депрессий, снижения интеллекта.
Семейная Фридрейха атаксия — наследственное заболевание хронического прогрессирующего характера. Передается по аутосомно-доминантному типу. Его основное проявление — смешанная сенсетивно-мозжечковая атаксия, возникающая в результате комбинированного поражения спинальных систем. Среди родителей пациентов весьма часто встречаются кровные браки. Характерный патологоанатомический признак атаксии Фридрейха — нарастающая дегенерация боковых и задних столбов спинного мозга (до продолговатого мозга). В большей степени поражаются пучки Голля. Кроме того поражены клетки столбов Кларка, а вместе с ними и задний спиноцеребеллярный путь.
Основной симптом атаксии Фридрейха — атаксия, выражающаяся в неуверенной, неуклюжей походке. Пациент шагает размашисто, отклоняясь от центра в стороны и широко ставя ноги. Шарко обозначил такую походку, как табетически-мозжечковую. С развитием заболевания дискоординация распространяется на руки, мышцы грудной клетки и лицо. Меняется мимика, речь становится замедленной, толчкообразной. Сухожильные и надкостничные рефлексы значительно снижены или отсутствуют (в первую очередь на ногах, в дальнейшем и на верхних конечностях). В большинстве случаев снижен слух.
С развитием атаксии Фридрейха проявляются экстраневральные нарушения — поражения сердца и изменения скелета. На ЭКГ — деформация предсердного зубца, нарушение ритма. Наблюдается приступообразная боль в сердце, тахикардия, одышка (как результат физического напряжения). Изменения скелета выражаются в характерном изменении формы стопы — склонности к частым вывихам суставов, увеличению свода и экстензии пальцев, а также кифосколиоз. Среди эндокринных нарушений, сопровождающих атаксию Фридрейха, отмечаются диабет, гипогонадизм, инфантилизм.
Атаксия-телеангиэктазия (синдром Луи-Бар) — наследственное заболевание (группа факоматозов), передающееся по аутосомно-рецессивному типу. Очень часто сопровождается дисгаммаглобулинемией и гипоплазией вилочковой железы. Развитие болезни начинается в раннем детском возрасте, когда проявляются первые атаксические расстройства. В дальнейшем атаксия прогрессирует и уже к 10 годам ходьба практически невозможна. Нередко синдром Луи-Бар сопровождается экстрапирамидными симптомами (гиперкинезы миоклонического и атетоидного типа, гипокинезия), умственной отсталостью, поражением черепных нервов. Характерна наклонность к повторным инфекциям (риниты, синуситы, бронхиты, пневмонии), что в первую очередь связано с недостаточностью иммунологических реакций организма. В связи с дефицитом Т-зависимых лимфоцитов и иммуноглобулинов класса А, велик риск возникновения злокачественных новообразований.
Осложнения атаксии
- Склонность к повторным инфекционным заболеваниям.
- Хроническая сердечная недостаточность.
- Все виды дыхательной недостаточности.
Диагностика атаксии
Диагностирование атаксии основано на идентификации заболеваний в семье пациента и наличии атаксий. ЭЭГ головного мозга при атаксии Пьера Мари и атаксии Фридрейха выявляет следующие нарушения: диффузная дельта- и тета-активность, редукция альфа-ритма. В лабораторных исследованиях наблюдается нарушение обмена аминокислот (концентрация лейцина и аланина снижена, также снижена их экскреция с мочой). На МРТ головного мозга обнаруживается атрофия стволов спинного и головного мозга, а также верхних отделов червя. С помощью электромиографии выявляют аксонально-демиелинизирующее поражение сенсорных волокон периферических нервов.
При дифференциации атаксии необходимо учитывать вариабельность клинической картины атаксии. В клинической практике наблюдаются рудиментарные разновидности атаксии и ее переходные формы, когда клинические проявления схожи с симптомами семейной параплегии (спастической), невральной амиотрофии и рассеянного склероза.
Для диагностирования наследственных атаксий необходимо проведение прямой или косвенной ДНК-диагностики. С помощью молекулярно-генетических методов диагностируют атаксию у пациента, после чего проводят косвенную ДНК-диагностику. С ее помощью устанавливают возможность наследования патогена атаксии другими детьми в семье. Возможно проведение комплексной ДНК-диагностики, для нее понадобится биоматериал всех членов семьи (биологические родители ребенка и все другие дети этой родительской пары). В редких случаях показана пренатальная ДНК-диагностика.
Лечение и прогноз атаксии
Лечение атаксии проводит невролог. Оно преимущественно симптоматическое и должно включать в себя: общеукрепляющую терапию (витамины группы В, АТФ, антихолинэстеразные средства); специальный комплекс гимнастических упражнений ЛФК, направленных на укрепление мышц и уменьшение дискоординация. При атаксии Фридрейха, учитывая патогенез заболевания, большую роль в лечении могут играть препараты, поддерживающие функции митохондрий (янтарная кислота, рибофлавин, коэнзим Q10, витамин Е).
Для лечения атаксии-телеангиэктазии, кроме вышеуказанных алгоритмов, необходима коррекция иммунодефицита. Для этого назначают курс лечения иммуноглобулином. Лучевая терапия в таких случаях противопоказана, кроме этого следует избегать чрезмерного рентгеновского излучения и продолжительного пребывания на солнце.
Прогноз геномных наследственных заболеваний малоблагоприятен. Отмечается медленное прогрессирование нервно-психических нарушений. Трудоспособность в большей части случаев снижена. Однако, благодаря симптоматическому лечению и предотвращению повторных инфекционных заболеваний, травм и интоксикаций пациенты имеют возможность дожить до преклонного возраста. С профилактической целью следует избегать рождения детей в семьях, где есть больные наследственной атаксией. Кроме этого, рекомендуется исключить возможность любых родственных браков.
Спиноцеребеллярные атаксии
Спиноцеребеллярные атаксии – группа генетически разнородных наследственных заболеваний неврологического характера, которые проявляются различными расстройствами работы мозжечка и иногда базальных ядер головного мозга. Симптомами этого состояния являются: развитие атаксии и неустойчивой походки, нарушение координации движений и другие неврологические проявления. Диагностика спиноцеребеллярных атаксий производится на основании данных неврологического осмотра, изучения наследственного анамнеза больного, магнитно-резонансной томографии и молекулярно-генетических исследований. Специфического лечения этой патологии на сегодняшний момент не существует, для сохранения оптимального качества жизни больного используют методы поддерживающей и симптоматической терапии.
Спиноцеребеллярные атаксии – группа наследственных неврологических состояний, характеризующихся развитием прогрессирующей дегенерации клеток мозжечка и иногда базальных ядер вплоть до их полной атрофии. Впервые одно из заболеваний этой группы было описано еще в 1891 году немецким невропатологом П. Менцелем, который выявил развитие атаксии, офтальмоплегии и других неврологических нарушений в рамках одной семьи. Дальнейшие исследования показали, что это состояние (известное сейчас как спиноцеребеллярная атаксия 1-го типа) наследуется по аутосомно-доминантному механизму.
Причины и классификация спиноцеребеллярных атаксий
Несмотря на значительное генетическое и отчасти клиническое разнообразие спиноцеребеллярных атаксий, молекулярные механизмы генетических нарушений при этих заболеваниях очень сходны. Основная причина патологии заключается в изменении количества тринуклеотидных последовательностей (CAG) в кодирующей части ассоциированных с заболеванием генов. Это приводит к увеличению количества аминокислоты глутамина в полученном белке, что изменяет физико-химические свойства протеина и нарушает его функции. В ряде случаев вышеуказанные белки прямо или косвенно участвуют в метаболизме нервной ткани, поэтому изменение их структуры приводит к спиноцеребеллярной атаксии. В настоящее время лучше всего изучены молекулярные механизмы 6 основных разновидностей этого заболевания – данные формы патологии встречаются наиболее часто и в совокупности составляют более 90% случаев спиноцеребеллярной атаксии.
Спиноцеребеллярная атаксия 1-го типа считается самым распространенным и самым изученным вариантом данной патологии. Ее причиной выступают мутации в гене ATXN1, который располагается на 6-й хромосоме. В норме данный ген имеет не более 36 CAG-повторов, увеличение их количества приводит к развитию заболевания. Продуктом экспрессии гена ATXN1 является особый ДНК-связывающий белок, активно участвующий в метаболизме клеток Пуркинье мозжечка – при наличии мутантной разновидности гена это приводит к появлению агрегантов и постепенной дегенерации, что и становится причиной спиноцеребеллярной атаксии.
Спиноцеребеллярная атаксия 2-го типа – менее распространенный вариант заболевания, этиология не так тщательно изучена. Причиной патологии является увеличение количества CAG-повторов в гене ATXN2, локализованном на 12-й хромосоме. В здоровом варианте гена количество вышеуказанных последовательностей составляет от 15 до 36, тогда как при спиноцеребеллярной атаксии их может быть свыше 100. Функции белка, который кодируется геном ATXN2, на сегодняшний момент неизвестны.
Спиноцеребеллярная атаксия тип 3 (другое название – болезнь Мачадо-Джозефа в честь двух больных, у которых впервые было описано данное состояние) – причиной этого варианта патологии выступают нарушения в гене ATXN3, расположенном на 14-й хромосоме. В норме количество CAG-повторов в этом гене не превышает 47, при развитии заболевания обнаруживается от 53 до 68 повторов. Данный ген кодирует белок, который предположительно участвует в энергетическом обмене нейронов мозжечка и базальных ядер.
Спиноцеребеллярная атаксия тип 6 – сравнительно редкий вид заболевания, обусловленный дефектами в гене CACNA1A, локализованном на 19-й хромосоме. Для развития патологии достаточно очень незначительного увеличения количества CAG-повторов – если в нормальном варианте гена их обнаруживают 5-20, то при наличии атаксии – 21-26. Ген CACNA1A кодирует белок-субъединицу кальциевых каналов, расположенных на нейронах мозжечка. Помимо спиноцеребеллярной атаксии, нарушения в гене CACNA1A обуславливают развитие эпизодической атаксии и некоторые наследственные формы мигрени.
Спиноцеребеллярная атаксия тип 7 – данная разновидность патологии вызывается нарушениями структуры гена ATXN7, который располагается на 3-й хромосоме. У здорового человека количество CAG-повторов составляет не более 35, тогда как при заболевании их количество может достигать нескольких сотен. Функции белка, который кодирует ген ATXN7, на сегодняшний момент изучаются.
Спиноцеребеллярная атаксия тип 8 обусловлена генетическим дефектом гена ATXN8, расположенного на 13-й хромосоме. Как и в других случаях, суть генетического дефекта при этом состоянии заключается в изменении количества тринуклеотидных последовательностей CAG – обычно их около 15-50, тогда как при патологии количество повторов может составлять свыше 1200.
Практически при любом типе спиноцеребеллярной атаксии патологическая форма белка, чрезмерно богатая глутамином, формирует отложения в ядрах или цитоплазме нейронов мозжечка и базальных ядер в виде плотных агрегатов. Этот процесс идет тем быстрее, чем сильнее количество CAG-повторов в ключевом гене отличается от нормы. Этим же объясняется механизм антиципации симптомов спиноцеребеллярной атаксии – в процессе мейоза при образовании половых клеток количество вышеуказанных тринуклеотидных последовательностей может увеличиваться, что приводит к усилению симптомов.
Так как подобное явление чаще имеет место при формировании мужских половых клеток, это становится причиной так называемой «отцовской передачи», когда антиципация регистрируется только при передаче заболевания от отца потомству. Многие врачи-генетики полагают, что основная причина спиноцеребеллярных атаксий лежит не в увеличении «гистидиновых» тринуклеотидов, а в делеции так называемых регулирующих триплетов, разделяющих участки CAG-повторов. Например, при первом типе заболевания это CAT, при втором CAA – они регулируют количество CAG-повторов и сохраняют стабильность их количества во время мейоза.
Симптомы спиноцеребеллярных атаксий
Чаще всего развитие спиноцеребеллярной атаксии начинается с появления простой неуклюжести в движениях, особенно при ходьбе, беге. В дальнейшем возникает тремор рук, нарушения походки, паралич глазодвигательных мышц (офтальмоплегия), изменяется почерк больного (становится крупнее, строки неровные). В конечном итоге заболевание приводит к выраженной мозжечковой атаксии, расстройствам пирамидальных и экстрапирамидальных путей, паркинсонизму. Некоторые формы патологии характеризуются выраженными нарушениями зрения – развитием атрофии зрительного нерва, пигментной дегенерации сетчатки и других процессов.
Диагностика
Выявление спиноцеребеллярной атаксии производится на основании данных неврологического осмотра, изучения наследственного анамнеза, магнитно-резонансной томографии головного мозга и молекулярно-генетических исследований. При осмотре больных на разных стадиях развития патологии определяются различные по выраженности неврологические нарушения – тремор конечностей, атаксия, изменения речи и голоса, на конечных этапах – дисфагия. Некоторые формы спиноцеребеллярной атаксии сопровождаются достаточно быстрым развитием нарушений зрения, приводящим к полной слепоте. Многолетнее наблюдение за такими больными подтверждает неуклонно прогрессирующее течение заболевания. При изучении наследственного анамнеза могут определяться характерные признаки спиноцеребеллярной атаксии – аутосомно-доминантное наследование, наличие антиципации при передаче болезни от отца.
На МРТ головного мозга при спиноцеребеллярной атаксии обнаруживаются очаги демиелинизации и нейродегенерации в области полушарий, червя мозжечка и базальных ядер. На терминальных стадиях развития заболевания может отмечаться полная атрофия мозжечка. Молекулярно-генетические исследования при спиноцеребеллярной атаксии сводятся к поиску патологически увеличенного количества CAG-повторов в генах, ассоциированных с этим заболеванием. В настоящее время большинство лабораторий мира осуществляет поиск этого дефекта в генах, наиболее часто приводящих к развитию патологии – ATXN1, ATXN2, ATXN3, ATXN7, ATXN8 и CACNA1A.
Лечение спиноцеребеллярной атаксии
Специфическое лечение патологии отсутствует, поддерживающая терапия способна несколько замедлить развитие спиноцеребеллярной атаксии, но единого мнения по поводу ее эффективности на сегодняшний момент нет. Применяют витаминотерапию (Е, А, группы В), ноотропные средства, стимуляторы обмена веществ (рибоксин) и метаболизма в нервной ткани. При развитии непроизвольных движений рекомендуют использовать клоназепам и галоперидол. Важную роль в сдерживании прогрессирования спиноцеребеллярной атаксии играет лечебная физкультура – регулярное выполнение правильно подобранного комплекса упражнений позволяет укрепить мышцы и снизить выраженность расстройств равновесия. С этой же целью рекомендуют проведение сеансов лечебного массажа, процедуры электромиостимуляции.
Прогноз и профилактика
В долгосрочной перспективе прогноз любой формы спиноцеребеллярной атаксии неблагоприятный – это заболевание характеризуется выраженным прогрессирующим течением и со временем приводит сначала к инвалидизации, а затем к смерти больного. Однако в конкретном случае прогноз может быть и менее негативным – например, при развитии патологии в пожилом возрасте и своевременно начатом поддерживающем лечении большинство тяжелых симптомов попросту не успеет проявиться. Если спиноцеребеллярная атаксия возникла в молодом или детском возрасте, продолжительность жизни таких больных даже при интенсивном лечении и тщательном уходе будет резко снижена.
Профилактика осуществляется методом медико-генетического консультирования родителей, наследственный анамнез которых отягощен по этому состоянию, и генетической пренатальной диагностики. При этом необходимо учитывать аутосомно-доминантный характер наследования спиноцеребеллярной атаксии и такие особенности ее передачи, как антиципация.
Читайте также:
