Побочные эффекты и осложнения лечения гливеком (Glivec, Gleevec)
Добавил пользователь Алексей Ф. Обновлено: 20.01.2026
Гливек (Glivec, Gleevec) в лечении хронического миелолейкоза (ХМЛ) - схема терапии, эффективность
С начала 1990 г., когда в результате разностороннего изучения патогенеза хронического миелоидного лейкоза (ХМЛ) стало очевидным, что обусловленная t(9;22)(q34;q11) активация ABL-тирозинкиназы является пусковым механизмом развития болезни, стали разрабатывать препарат, обладающий ингибирующим тирозинкиназу эффектом.
В результате многолетней работы Brian Druker из Dana Farber Cancer Institute в Бостоне (США) создан препарат STI 571 (signal trunsduction inhibitor), получивший название «Гливек» (Glivec, Gleevec), или «Иматиниба мезилат» (imatinib mesylate). Появление препарата направленного патогенетического действия ознаменовало начало новой эры в терапии ХМЛ.
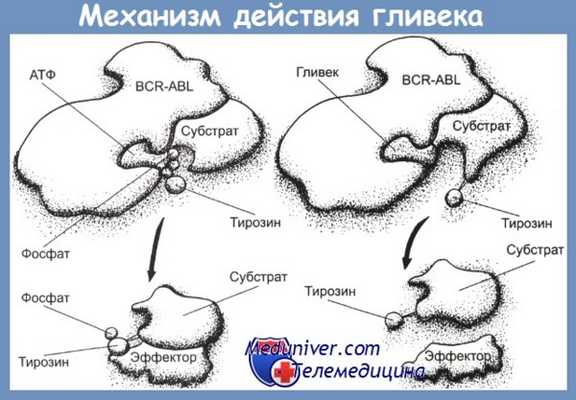
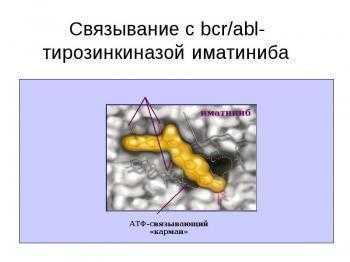
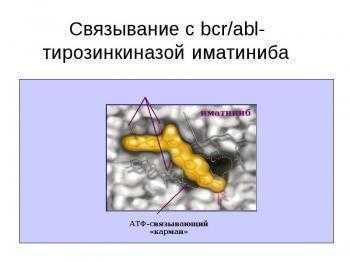
Гливек является производным 2-фениламинопиримидина (CH2SО3H). Исследования в культуре клеток больных ХМЛ показали, что гливек подавляет рост Ph-позитивных клеток, почти не действуя на Ph-негативные клетки. Механизм блокирующего активность ABL-тирозинкиназы действия гливека связан с встраиванием молекулы препарата в то место в молекуле ABL-тирозинкиназы — АТФ-карман, куда обычно встраивается АТФ.
С помощью рентгеновской кристаллографии доказано, что гливек встраивается в этот карман вместо АТФ, препятствуя тем самым фосфорилированию тирозина. Это приводит к блоку сигнала пролиферации в BCR-ABL-позитивных клетках, в результате чего они подвергаются апоптозу. В культуре клеток К562 показано очень быстрое действие гливека: фосфорилирование прекращается уже через 1 мин после введения гливека, подавление пролиферации и апоптоз — после 16—20 ч инкубации. В то же время исследования на больных показали необходимость значительно более продолжительного воздействия гливека: подавление фосфорилирования достигалось лишь через 3—4 дня.
Гливек принимают внутрь. Биодоступность гливека при пероральном приеме составляет более 97 %, она не зависит от возраста и приема пищи. Фармакологические исследования не обнаружили влияния массы тела на концентрацию гливека в плазме, поэтому препарат дозируется независимо от этого показателя. Для гливека характерна быстрая всасываемость с максимумом концентрации в плазме через 1—2 ч после приема. Время полувыведения препарата составляет от 18 до 22 ч, что позволяет принимать его один раз в день.
Примерно 96 % препарата связывается с белками плазмы, особенно с альбумином и гликопротеинами и в очень незначительной степени — с липопротеинами. Более 80 % гливека и его метаболитов выводится в течение 7 дней после приема однократной дозы. Препарат выводится главным образом (68 %) через кишечник, и только около 13% — почками.
По всей вероятности, гливек не проникает через гематоэнцефалический барьер. В опытах на животных показано, что даже при назначении очень высоких доз гливека, в результате чего концентрация в плазме в 10 раз превышает терапевтическую, в цереброспинальной жидкости она в 3 раза ниже терапевтической и в 155 раз ниже, чем в плазме.
В отечественных исследованиях получены столь же высокие результаты. По данным Гематологического научного центра РАМН, полный гематологический ответ при лечении гливеком получен у 96 % больных в хронической стадии хронического миелоидного лейкоза, ранее лечившихся ИНФ-а в комплексе с Ara-C, у 43 % больных — большой цитогенетический ответ, при этом в течение 18 мес лечения частота полной цитогенетической ремиссии увеличилась с 16 до 37 %.
Даже в фазе акселерации через 6 мес лечения у 30 % больных получен большой цитогенетический ответ, а при продолжении лечения до 18 и 24 мес — у 45 и 51 % соответственно при 39 % полного цитогенетического ответа.
Ухудшение гематологических или цитогенетических показателей за время лечения наблюдали у 10,3 % больных, получавших ИФН-а + Ara-C, и лишь у 1,4 % леченных гливеком, переход в стадию акселерации или развитие бластного криза — у 4,7 и 1,1 % соответственно. Немаловажной оказалась и разница в переносимости терапии: перевести в противоположную группу из-за непереносимости лечения пришлось 19 % больных из группы леченных ИФН-а + + Ara-C и лишь менее 1 % больных, получавших гливек.
В 2003 г. были опубликованы результаты этого исследования после 19 мес лечения. Полная гематологическая ремиссия достигнута у 97 % получавших гливек и 69 % леченных ИФН-а + Ara-C. Большой цитогенетический ответ достигнут и сохранился в течение всего срока наблюдения у 87 % больных, получавших гливек, и лишь у 35 % леченных комбинацией ИФН-а и Ara-C, a полная цитогенетическая ремиссия — соответственно у 76 и 14 %. Результаты этого исследования показывают, что при терапии гливеком, проводимой с самого начала заболевания, большинство больных хроническим миелоидным лейкозом имеют шанс прожить 10 лет.
Числовая сравнительная оценка качества жизни показала статистически достоверный более высокий уровень в группе получавших гливек. Более того, в группе больных, вначале получавших комбинацию ИФН-а и Ara-C, a затем переведенных на лечение гливеком, общая оценка качества жизни за время наблюдения оказалась выше, чем у больных, продолживших терапию ИФН-а + Ara-С.
Анализ течения болезни у 553 больных, с самого начала получавших гливек, провели после 2 лет терапии. Данные анализа показали следующее: полная гематологическая ремиссия сохранилась у 95 % больных, большой цитогенетический ответ констатирован к концу срока наблюдения у 88 %, полная цитогенетическая ремиссия — у 79 %, не было перехода в более продвинутую стадию у 96 %, выживаемость также составила 96 %. В зависимости от прогностического индекса по Socal оказалось, что полная цитогенетическая ремиссия достигнута и сохранялась в течение анализируемого срока у 84 % больных группы низкого риска прогрессирования, у 77 % группы промежуточного и у 62 % больных группы высокого риска. Течение заболевания без признаков прогрессирования отмечено соответственно у 95, 89 и 85 % больных. Ни при каком лечении до появления гливека не было подобных результатов.
Недавно подведенные итоги 5-летних наблюдений за больными, вошедшими в это исследование, показали, что терапия гливеком принципиально изменила течение хронического миелоидного лейкоза. Через 5 лет после начала терапии гливеком ранее не леченных больных ХМЛ в хронической стадии полная гематологическая ремиссия сохранялась у 97 % больных, большой цитогенетический ответ наблюдали у 88 %, полная цитогенетическая ремиссия была у 82 %. Общая 5-летняя выживаемость составила 90 %, у 93 % больных сохранялась хроническая стадия заболевания.
Менее чем у 1 % больных ежегодно наблюдалось прогрессирование в стадию акселерации или развитие бластного криза. Не отмечали прогрессирования болезни у 96 % больных, у которых в течение первых 12 мес лечения была достигнута молекулярная ремиссия (уменьшение транскрипта BCR/ABL более чем на 3 log; 3 log — это в 1000 раз), и у 81 % больных, у которых наблюдалась полная цитогенетическая ремиссия, но не было достигнуто молекулярной ремиссии. Как известно, при терапии миелосаном, начиная со второго года наблюдения, переход в стадию акселерации или развитие бластного криза ежегодно наблюдали у 15—20 % больных.
В 2004 г. опубликованы результаты лечения гливеком 235 больных в стадии акселерации и 260 больных в стадии бластного криза. Больные получали 600 мг препарата ежедневно. Через 36 мес от начала лечения были живы 55 % больных, начавших лечение в стадии акселерации и 14 % в стадии бластного криза. Выживаемость строго коррелировала с достижением большого цитогенетического ответа: 3-летняя выживаемость больных в стадии акселерации при достижении такого ответа в течение первых 3 мес лечения составила 85 % и 52 % больных без большого цитогенетического ответа.
Результаты лечения больных в поздней хронической стадии при лечебных дозах препарата 400—600 мг/сут были еще лучше: большой цитогенетический ответ получен у 65% больных, полный — у 52%. У 82 % больных большой цитогенетический ответ сохранялся в течение 3 лет.
Живы в течение 3 лет 88 % больных этой группы, причем у 80 % из них без признаков прогрессирования болезни.
Наилучшая выживаемость достигается у больных, у которых большой цитогенетический ответ в хронической стадии или любой цитогенетический ответ в стадии акселерации получен в течение первых 3 мес терапии. В стадии акселерации получение цитогенетического ответа после 3 мес лечения гливеком оказалось даже более значимым прогностическим фактором, чем наличие клональной эволюции. При получении даже минимального цитогенетического ответа в течение первых 3 мес у 83 % больных позже достигается большой цитогенетический ответ, при этом у 54 % — полная цитогенетическая ремиссия.
Если минимальный цитогенетический ответ получен в течение 6—12 мес терапии, то частота большого цитогенетического ответа и полной цитогенетиче-ской ремиссии в дальнейшем составляли соответственно 68 и 35 %. В тех случаях, когда в течение первых 3 мес лечения не наблюдали даже минимального цитогенетического ответа, только у 12 % больных можно было ожидать его достижения в дальнейшем, а при отсутствии цитогенетического ответа в первые 6 мес — только у 4 % больных. При неполучении цитогенетического ответа в течение 12 мес лечения возможность его достижения в дальнейшем равна 0.
Исследование экспрессии 380 генов у ранее не леченных больных, получавших гливек в течение 12 мес, позволило выявить 18 генов, по уровню экспрессии которых различались больные с молекулярной ремиссией к этому времени и те, у кого молекулярного ответа получено не было. Оказалось, что у резистентных к гливеку в 1,9—7,5 раза более выражена экспрессия генов, участвующих в передаче пролиферативного сигнала, процессах апоптоза, клеточной адгезии и регуляции клеточного цикла.
Накопление опыта в лечении гливеком показало, что стабильная гематологическая и цитогенетическая ремиссия сохраняется в тех случаях, когда удается добиться уменьшения количества BCR-ABL-позитивных клеток не менее чем на 3 логарифма (3 log). Уменьшение на 3 log и более количества определяемого транскрипта BCR-ABL (по соотношению BCR-ABL/BCR) рассматривается как большая молекулярная ремиссия. Анализ данных, полученных после 30 мес лечения, показал отсутствие про-грессирования заболевания у всех (100%) больных, у которых в течение первые 12 мес лечения достигнута редукция патологического клона на 3 log или более, и у 93 % больных с редукцией этого клона менее чем на 3 log. Течение болезни без прогрессирования в период, равный 30 мес, наблюдали у 82 % больных, у которых не было получено полной цитогенетической ремиссии в первые 12 мес лечения.
Показано, что при назначении гливека по 600—800 мг/сут и одновременном проведении двух 7-дневных курсов терапии цитозин-арабинозидом по 200 мг/м2 в сутки через 18 мес лечения у 51 % больных была достигнута редукция опухолевого клона более чем 3 log, а у 28 % — более чем на 4,5 log. Из 127 больных, получивших такое лечение, через 18 мес были живы 99 % и 94 % не имели признаков прогрессирования болезни. Лишь у 30 больных не была достигнута большая молекулярная ремиссия (не удалось уменьшить количество BCR-ABL-позитивных клеток на 3 log и более). У двух из них обнаружены мутации в ABL-тирозинкиназном домене белка BCR-ABL. Эти данные подтверждены в кооперированном исследовании из Италии, в котором участвовало 23 центра.
Больным, которые по своим клинико-гематологическим показателям относились к группе промежуточного прогноза по системе Socal, в качестве первоначального лечения назначали 800 мг гливека в сутки. Через 6 мес лечения полная гематологическая ремиссия достигнута у 98 %, полная цитогенетическая — у 87 % больных. После 12 мес лечения полная цитогенетическая ремиссия констатирована у 94 % больных, большая молекулярная ремиссия (уменьшение транскрипта BCL/ABL более чем на 3 log) — у 56 %.
Гливек большинством больных переносится очень хорошо. Наиболее частые проявления негематологической токсичности (тошнота, рвота, диарея, головные боли, мышечные судороги, отеки) возникают у 30—50 % больных, но только у 1—2 % их выраженность превышает I—II степень по шкале ВОЗ и требует временной отмены препарата.
Обычно суточную дозу гливека 400 мг назначают однократно натощак или через 1,5—2 ч после завтрака. Однако у ряда больных при приеме препарата натощак может наблюдаться нерезко выраженная тошнота. В таких случаях рекомендуется принимать препарат вместе с пищей, а если тошнота сохраняется и после этого, разделить дозу препарата на 2 приема.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Побочные эффекты и осложнения лечения гливеком (Glivec, Gleevec)
Одним из серьезных побочных явлений лечения гливеком, возникающих у 1—2 % больных, являются отеки, чаще всего небольшие и ограниченные периорбитальными областями, но иногда значительные, сопровождающиеся плевральным или перикардиальным выпотом. С учетом этого при отмечаемой больным быстрой прибавке массы тела или наличии видимых отеков необходимо провести тщательное обследование его и назначить диуретики, а при значительных отеках — временно отменить препарат.
Метаболизм гливека осуществляется преимущественно в печени. В связи с этим при нарушении функции печени возможно повышение концентрации гливека в крови. Кроме того, следует иметь в виду, что метаболизм происходит с участием группы ферментов CYP3A4/5, относящихся к системе цитохрома Р-450. Некоторые лекарственные препараты, которые больной вынужден принимать одновременно с гливеком по различным причинам, повышают активность указанных ферментов и поэтому могут ускорять метаболизм гливека, снижая тем самым его концентрацию в крови, а следовательно, и эффективность.
Снижение концентрации гливека в плазме в результате стимуляции указанных печеночных ферментов происходит при приеме глюкокортикоидов, пирамидона, рифампицина, фенобарбитала. Ингибируют указанные печеночные ферменты и тем самым могут вызвать повышение концентрации гливека в плазме с увеличением его токсичности итраконазол и кетоконазол, циклоспорин, эритромицин, ранитидин, верапамил. При лечении гливеком не следует употреблять парацетамол, хотя эта рекомендация основана на единичном случае развития печеночной недостаточности при совместном применении гливека и больших доз парацетамола.
Повышение уровня билирубина и трансаминаз наблюдается редко, однако в течение 1-го месяца терапии следует производить биохимический анализ крови каждые 2 нед, а в последующем при нормальных показателях — каждый месяц. Отмена препарата необходима при 4—5-кратном повышении показателей. Менее чем у 1 % больных приходится отменять препарат из-за гепатотоксичности.
Очень редко наблюдается индивидуальная непереносимость препарата. Описано развитие локальных некрозов печеночной ткани после 11 дней приема гливека по 400 мг/сут и тяжелого дескваматозного поражения кожи и слизистых оболочек после 17 дней приема гливека по 800 мг в день. В обоих случаях отмена препарата привела к быстрой регрессии всех симптомов.
Иногда при приеме гливека появляются судороги в кистях рук, стопах, голенях или бедрах. Причина этого явления неизвестна, так как уровень кальция и магния в сыворотке крови при этом обычно не изменяется. Тем не менее применение препаратов кальция и магния, как правило, приводит к исчезновению этого симптома.
У 20—40 % больных в первый месяц приема гливека появляются боли в костях или суставах. Причина этого также неизвестна. При резко выраженных болях можно назначить нестероидные противовоспалительные препараты. В большинстве случаев через 1—2 мес эти явления самостоятельно проходят.
Редко появляется кожная сыпь, обычно исчезающая после приема антигистаминных препаратов. У больных с высоким содержанием базофилов в крови иногда появляются уртикарные высыпания, вызванные высвобождением гистамина из разрушающихся базофилов.
У некоторых больных отмечается диарея, обычно нерезко выраженная и прекращающаяся при использовании препаратов, снижающих моторику кишечника.
Многие больные при лечении гливеком отмечают прибавку массы тела, которую они, как правило, связывают с улучшением самочувствия и повышением аппетита.
В опытах на мышах выявлен тератогенный эффект гливека, поэтому его не следует принимать при беременности. В этих же опытах была показана активная экскреция препарата с молоком, что исключает грудное вскармливание ребенка при лечении матери гливеком.
Имеются данные о беременностях и родах как у женщин, принимавших гливек длительное время (до 1,5 года), так и у женщин, чьи мужья принимали гливек. Части женщин произведено медицинское прерывание беременности, у некоторых возникли спонтанные аборты, несколько родили здоровых детей.
Гематологическая токсичность редко бывает причиной отмены препарата. Тем не менее перерывы в лечении из-за гематологической токсичности III—IV степени по шкале ВОЗ (нейтрофилов менее 1•109/л и менее 0,5•109/л соответственно, тромбоцитов менее 50•109/л и менее 10•109/л соответственно) приходится делать у 25—30 % больных. Миелосупрессия в первую очередь связана с подавлением препаратом пролиферации клеток-носителей гена BCR-ABL. Однако гливек является ингибитором и других протеинкиназ, в частности киназы c-kit — рецептора фактора стволовых клеток (SCF).
Показано, что гливек подавляет активность киназы c-kit при концентрациях, необходимых для подавления BCR-ABL-позитивных клеток, поэтому частично может быть подавлена пролиферация и здоровых стволовых кроветворных клеток. Это же, по всей вероятности, является причиной частого появления признаков дисплазии различных ростков гемопоэза при лечении гливеком.
Миелосупрессия чаще наблюдается в продвинутых стадиях болезни. Если нейтропения или тромбоцитопения развивается у больного в стадии акселерации либо бластного криза при отсутствии инфекционных или геморрагических осложнений, препарат обычно не отменяют и проводят мероприятия по коррекции показателей (введение колониестимулирующих факторов, переливание тромбоцитов). При возникновении миелосупрессии у больного в хронической стадии делают короткие перерывы в лечении.
Обычно лечение гливеком возобновляют как только уровень гранулоцитов достигает 1,5•109/л и тромбоцитов — 75•109/л. Следует иметь в виду, что в этой группе больных цитогенетические ремиссии достигаются реже и позже, чем в группе больных, которым препарат не пришлось отменять. При повторном развитии миелосупрессии приходится вновь делать короткие перерывы. Некоторые авторы в этих случаях рекомендуют снизить ежедневную дозу гливека до 300 мг, однако это может способствовать развитию резистентности к препарату.
В настоящее время предложена прогностическая модель, учитывающая 2 фактора: снижение уровня гранулоцитов ниже 1•109/л и обнаружение более 65 % Ph-позитивных клеток после 3 мес терапии. К группе низкого риска прогрессирования заболевания отнесены больные, у которых отсутствуют оба фактора (не было в течение первых 3 мес лечения снижения содержания гранулоцитов ниже 1•109/л и к концу 3-го месяца лечения обнаруживалось менее 65 % Ph-позитивных клеток).
В группу промежуточного риска входят больные, у которых имеется один из двух показателей, в группу высокого риска прогрессирования — больные, у которых обнаружены оба неблагоприятных показателя. Показана высокодостоверная разница как в прогрессировании, так и в выживаемости в течение 2 лет наблюдения между больными трех прогностических групп: отсутствие признаков прогрессирования наблюдали у 100 % больных группы низкого риска, у 66 % группы промежуточного и лишь у 15 % больных высокого риска, выживаемость на этот период составила соответственно 100, 82 и 40 %.
Снижение уровня гемоглобина до 80—100 г/л наблюдается нередко. При плохой переносимости анемии или более низких показателях рекомендуется не отменять гливек, а производить гемотрансфузии эритроцитов.
При восстановлении нормального гемопоэза в результате терапии все показатели постепенно нормализуются.
Описание препарата ГЛИВЕК ® (GLIVEC ® )

Капсулы от оранжевого до серовато-оранжевого цвета, непрозрачные, с красной надписью "NVR" и "SI".
| 1 капс. | |
| иматиниб (в форме иматиниба мезилата) | 100 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая, кросповидон, магния стеарат, кремния диоксид коллоидный безводный, желатин, титана диоксид (Е171), железа оксид желтый (Е172), железа оксид красный (Е172).
12 шт. - блистеры (10) - коробки картонные.
Описание активных компонентов препарата ГЛИВЕК ® . Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата. Дата обновления: 14.01.2006 г.
Фармакологическое действие
Ингибитор протеинтирозинкиназы. Ингибирует фермент Bcr-Abl-тирозинкиназу на клеточном уровне, in vitro и in vivo. Селективно подавляет пролиферацию и вызывает апоптоз клеточных линий, позитивных по Bcr-Abl, а также молодых лейкозных клеток при хроническом миелолейкозе с положительной филадельфийской хромосомой и при остром лимфобластном лейкозе.
В исследованиях по трансформации колоний, проведенных на пробах периферической крови и костного мозга, было показано, что иматиниб селективно ингибирует Bcr-Abl-позитивные колонии, полученные у больных хроническим миелолейкозом.
В исследованиях, проведенных in vivo на животных моделях с использованием Bcr-Abl-позитивных опухолевых клеток, было показано, что иматиниб обладает противоопухолевой активностью при монотерапии.
Кроме того, иматиниб является ингибитором рецепторов тирозин-киназы для фактора роста тромбоцитов и фактора стволовых клеток, а также подавляет клеточные реакции, опосредуемые вышеназванными факторами.
In vitro иматиниб ингибирует пролиферацию и индуцирует апоптоз клеток стромальных опухолей ЖКТ, экспрессирующих kit-мутации.
Фармакокинетика
После приема внутрь биодоступность в среднем 98%. Коэффициент вариации для AUC составляет 40-60%. При приеме с пищей с высоким содержанием жиров, по сравнению с приемом натощак, отмечается незначительное снижение степени абсорбции (уменьшение C max на 11%, AUC - на 7.4%) и замедление скорости абсорбции (удлинение T max на 1.5 ч).
При клинически значимых концентрациях иматиниба его связывание с белками плазмы составляет около 95% (главным образом с альбумином и кислым альфа-гликопротеином, в незначительной степени - с липопротеином).
Основным метаболитом иматиниба, циркулирующим в кровяном русле, является N-деметилированное пиперазиновое производное, которое in vitro обладает фармакологической активностью, сходной с таковой неизмененного активного вещества. Значение AUC для метаболита составляет 16% от AUC иматиниба.
После приема внутрь 14 C-меченого иматиниба за 7 дней было выведено с калом 68% введенной дозы и с мочой 13% дозы. В неизмененном виде выводится около 25% дозы (20% - с калом и 5% - с мочой). Остальное количество иматиниба выводится в виде метаболитов.
T 1/2 иматиниба у здоровых добровольцев составил около 18 ч.
При нарушении функции печени возможно повышение концентрации иматиниба в плазме крови.
Показания к применению
Впервые выявленный положительный по филадельфийской хромосоме хронический миелоидный лейкоз (Ph+ ХМЛ) у детей и взрослых; Ph+ ХМЛ в хронической фазе при неудаче предшествующей терапии интерфероном альфа или в фазе акселерации, или бластного криза у детей и взрослых; впервые диагностированный положительный по филадельфийской хромосоме острый лимфобластный лейкоз (Ph+ ОЛЛ) у детей и взрослых пациентов в комбинации с химиотерапией; рецидивирующий или рефрактерный Ph+ ОЛЛ у взрослых пациентов в качестве монотерапии; миелодиспластические/миелопролиферативные заболевания, связанные с генными перестройками рецептора фактора роста тромбоцитов, у взрослых пациентов; системный мастоцитоз у взрослых пациентов с отсутствием D816V c-Kit мутации или с неизвестным c-Kit мутационным статусом; гиперэозинофильный синдром и/или хронический эозинофильный лейкоз у взрослых пациентов с позитивной или негативной аномальной FIP1L1-PDGRF альфа-тирозинкиназой; неоперабельные и/или метастатические злокачественные гастроинтестинальные стромальные опухоли (ГИСО), позитивные по c-Kit (CD117) у взрослых пациентов; адъювантная терапия у взрослых пациентов с ГИСО, позитивными по c-Kit (CD117); неоперабельная, рецидивирующая и/или метастатическая выбухающая дерматофибросаркома у взрослых пациентов.
Режим дозирования
Внутрь. Дозу, схему применения и продолжительность лечения устанавливают индивидуально, в зависимости от показаний и возраста пациента.
Побочные действия
- нечасто - опоясывающий герпес, герпес простой, назофарингит, пневмония, синусит, воспаление подкожной клетчатки, инфекции верхних дыхательных путей, грипп, инфекции мочевыводящих путей, гастроэнтерит, сепсис;
- редко - микоз.
Со стороны системы кроветворения: очень часто - нейтропения, тромбоцитопения, анемия; часто - панцитопения, фебрильная нейтропения; нечасто - тромбоцитемия, лимфопения, угнетение костномозгового кроветворения, эозинофилия, лимфаденопатия; редко - гемолитическая анемия
- очень часто - увеличение массы тела;
- часто - анорексия, снижение массы тела;
- нечасто - гипокалиемия, повышение аппетита, гипофосфатемия, снижение аппетита, дегидратация, гиперурикемия, подагра, гиперкальциемия, гипергликемия, гипонатриемия;
- редко - гиперкалиемия, гипомагниемия.
- часто - бессонница;
- нечасто - депрессия, снижение либидо, тревога;
- редко - спутанность сознания.
- очень часто - головная боль;
- часто - головокружение, парестезии, нарушение вкуса, гипестезия;
- нечасто - мигрень, сомноленция, обморок, периферическая нейропатия, нарушения памяти, ишиас, синдром "беспокойных" ног, тремор, геморрагический инсульт;
- редко - повышение внутричерепного давления, судороги, неврит зрительного нерва.
- часто - отек век, повышение слезоотделения, конъюнктивальные кровоизлияния, конъюнктивит, синдром "сухого глаза", нечеткость (затуманенность) зрения;
- нечасто - раздражение глаз, боль в глазах, орбитальный отек, кровоизлияния в склеру, ретинальное кровоизлияние, блефарит, макулярный отек;
- редко - катаракта, отек диска зрительного нерва, глаукома.
- часто - приливы, кровоизлияния;
- нечасто - ощущение сердцебиения, тахикардия, хроническая сердечная недостаточность, отек легких, повышение или снижение АД, гематома, субдуральная гематома, похолодание конечностей, синдром Рейно;
- редко - аритмия, фибрилляция предсердий, остановка сердца, инфаркт миокарда, стенокардия, перикардиальный выпот.
- часто - носовое кровотечение, одышка, кашель;
- нечасто - плевральный выпот, боли в глотке или гортани, фарингит;
- редко - плевральная боль, легочный фиброз, легочная гипертензия, легочное кровоизлияние.
- очень часто - тошнота, рвота, диарея, диспепсия, боли в животе;
- часто - вздутие живота, метеоризм, запор, гастроэзофагеальный рефлюкс, сухость во рту, гастрит;
- нечасто - стоматит, изъязвление слизистой оболочки полости рта, желудочно-кишечное кровотечение, отрыжка, мелена, эзофагит, асцит, язва желудка, рвота кровью, хейлит, дисфагия, панкреатит;
- редко - колит, паралитическая/обтурационная кишечная непроходимость, воспаление толстой кишки.
- часто - повышение активности печеночных трансаминаз;
- нечасто - желтуха, гепатит, гипербилирубинемия;
- редко - печеночная недостаточность, некроз печени.
- очень часто - периорбитальный отек, дерматит, экзема, кожная сыпь;
- часто - кожный зуд, отечность лица, сухость кожи, эритема, алопеция, ночная потливость, реакции фотосенсибилизации;
- нечасто - пустулезная сыпь, петехии, повышенное потоотделение, крапивница, экхимоз, предрасположенность к образованию гематом, гипотрихоз, гиперпигментация/гипопигментация кожи, эксфолиативный дерматит, повреждение ногтей, фолликулит, петехии, псориаз, пурпура, буллезная сыпь;
- редко - острый фебрильный нейтрофильный дерматоз (синдром Свита), изменение цвета ногтей, ангионевротический отек, везикулярная сыпь, многоформная эритема, лейкопластический васкулит, синдром Стивенса-Джонсона, острая генерализованная пустулезная экзантема.
- очень часто - мышечные спазмы и судороги, мышечно-скелетные боли, включая миалгии и артралгии, боль в костях;
- часто - припухание суставов;
- нечасто - скованность мышц и суставов;
- редко - мышечная слабость, артрит.
- нечасто - боли в почках, гематурия, острая почечная недостаточность, частое мочеиспускание.
- нечасто - гинекомастия, эректильная дисфункция, меноррагия, нарушения менструального цикла, сексуальная дисфункция, боль в сосках, увеличение молочных желез, отек мошонки.
- очень часто - задержка жидкости, отеки, повышенная утомляемость;
- часто - слабость, повышение температуры тела, анасарка, озноб, дрожь;
- нечасто - боль в груди, общее недомогание.
- нечасто - повышение концентрации креатинина в крови, повышение активности КФК в крови, повышение активности ЩФ, ЛДГ;
- редко - повышение активности амилазы в плазме крови.
Противопоказания к применению
Повышенная чувствительность к иматинибу; беременность, период грудного вскармливания; детский возраст (эффективность и безопасность не установлены) до 1 года у пациентов с Ph+ острым лимфобластным лейкозом, до 2 лет у пациентов с Ph+ хроническим миелоидным лейкозом, до 18 лет по остальным показаниям.
- пациенты с тяжелой печеночной недостаточностью;
- пациенты с тяжелыми нарушениями функции почек;
- пациенты с заболеваниями сердечно-сосудистой системы или при наличии факторов риска развития сердечной недостаточности;
- при проведении регулярной процедуры гемодиализа;
- при одновременном применении с препаратами, ингибирующими изофермент CYP3A4, сильными индукторами изофермента CYP3A4. препаратами, являющимися субстратами изофермента CYP3A4;
- при одновременном применении с парацетамолом, варфарином.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
С осторожностью применять у пациентов с тяжелой печеночной недостаточностью.
Применение при нарушениях функции почек
Применение у пожилых пациентов
С осторожностью следует применять у пожилых пациентов.
Наибольшая частота развития задержки жидкости отмечается у пожилых пациентов с сопутствующими заболеваниями сердечно-сосудистой системы.
Применение у детей
Иматиниб противопоказан к применению в возрасте до 1 года у пациентов с Ph+ острым лимфобластным лейкозом; до 2 лет у пациентов с Ph+ хроническим миелоидным лейкозом; до 18 лет по остальным показаниям.
Особые указания
Лечение иматинибом следует проводить только под наблюдением врача, имеющего опыт работы с противоопухолевыми препаратами.
При применении иматиниба отмечались случаи выраженной задержки жидкости, рекомендуется регулярно контролировать массу тела. В случае неожиданного быстрого увеличения массы тела следует провести обследование и при необходимости временно прекратить терапию иматинибом, и/или начать применение диуретиков.
При применении иматиниба отмечалось развитие нейтропении или тромбоцитопении; эти явления имели четкую связь со стадией заболевания, частота их возникновения была выше у пациентов с ХМЛ в фазе бластного криза или фазе акселерации по сравнению с пациентами с ХМЛ в хронической фазе. Может возникнуть необходимость во временном приостановлении терапии или уменьшении дозы иматиниба.
При применении иматиниба рекомендуется регулярно проводить клинические анализы крови и осуществлять контроль функции печени (трансаминазы, билирубин, ЩФ). При применении у пациентов с заболеваниями печени следует регулярно проводить клинический анализ крови и определять активность печеночных ферментов.
Иматиниб и его метаболиты выводятся почками в незначительной степени. Клиренс креатинина снижается с возрастом, при этом возраст не имеет значимого влияния на фармакокинетические показатели иматиниба. Не отмечено корреляции экспозиции иматиниба и степени нарушения функции почек у пациентов с нарушением функции почек от легкой (клиренс креатинина 40-59 мл/мин) до тяжелой (клиренс креатинина
Следует обеспечить тщательное наблюдение пациентов с заболеваниями сердечно-сосудистой системы, факторами риска развития сердечной недостаточности, а также пациентов с почечной недостаточностью в анамнезе. При выявлении признаков или симптомов, указывающих на данные состояния, следует провести оценку состояния пациента и начать соответствующее лечение.
У пациентов с миелодиспластическими/миелопролиферативными заболеваниями и высоким количеством эозинофилов следует проводить ЭКГи определять концентрацию кардиоспецифичного тропонина в сыворотке крови. При выявлении отклонений от нормы в начале терапии следует рассмотреть возможность профилактического применения системных ГКС в течение 1-2 недель одновременно с иматинибом.
Необходимо контролировать состояние ЖКТ у пациентов с метастатическими злокачественными ГИСО (боль в животе, желудочно-кишечные кровотечения, запор и другие) в начале и на всем протяжении терапии иматинибом. В случае необходимости следует рассмотреть возможность отмены терапии иматинибом.
Вследствие риска развития синдрома лизиса опухоли перед применением иматиниба следует при необходимости скорректировать клинически выраженную дегидратацию и повышение концентрации мочевой кислоты.
У пациентов, являющихся носителями вируса гепатита В, возможна реактивация данного вируса после терапии препаратами ингибиторами BCR-ABLтирозинкиназы, такими как иматиниб. В некоторых случаях при применении препаратов данного класса отмечено развитие острой печеночной недостаточности или фульминантного гепатита, приводящих к трансплантации печени или летальному исходу.
Перед началом терапии иматинибом всех пациентов следует обследовать на наличие вируса гепатита В. Состояние пациента, являющегося носителем вируса гепатита В, при необходимости лечения иматинибом следует тщательно контролировать на предмет развития признаков и симптомов активного инфекционного процесса как во время терапии иматинибом, так и в течение нескольких месяцев после ее окончания.
Влияние на способность к вождению автотранспорта и управлению механизмами
Некоторые побочные эффекты, такие как головокружение и нечеткость зрения, могут отрицательно влиять на способность к управлению автотранспортом и к выполнению других потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций. В связи с этим, пациентам при проявлении описанных нежелательных явлений следует воздержаться от выполнения указанных видов деятельности.
Лекарственное взаимодействие
При одновременном применении иманитиба с препаратами, ингибирующими изофермент CYP3A4 цитохрома Р450, например, ингибиторами вирусной протеазы (индинавир, лопинавир, ритонавир, саквинавир, телапревир, нелфинавир, боцепревир), противогрибковыми препаратами группы азолов (в т.ч. кетоконазол, итраконазол, позаконазол, вориконазол), некоторыми антибиотиками макролидами (эритромицин, кларитромицин, телитромицин), возможно замедление метаболизма иматиниба и увеличение его концентрации в плазме крови. Необходима осторожность при одновременном применении иматиниба с препаратами ингибиторами изоферментов CYP3A4.
- карбамазепин, окскарбазепин, фенитоин, примидон), может привести к усилению метаболизма иматиниба и, как следствие, уменьшению его концентрации в плазме крови и неэффективности терапии. Следует избегать одновременного применения иматиниба и сильных индукторов изофермента CYP3A4.
При одновременном применении иматиниба и симвастатина отмечается увеличение C max и AUC симвастатина в 2 и 3.5 раза соответственно, что является следствием ингибирования CYP3A4 иматинибом. Рекомендуется соблюдать осторожность при одновременном применении иматиниба и препаратов, являющихся субстратами CYP3A4 и имеющих узкий диапазон терапевтической концентрации (например, циклоспорин, пимозид, такролимус, сиролимус, эрготамин, фентанил, терфенадин, бортезомиб, доцетаксел, хинидин). Иматиниб может увеличивать концентрации в сыворотке крови других препаратов, метаболизирующихся изоферментом CYP3A4 (триазолобензодпазеппны, дигидропиридин, блокаторы "медленных" кальциевых каналов, большинство ингибиторов ГМГ-КоА-редуктазы, в т.ч. статины).
Иматиниб также ингибирует изофермент CYP2C9 и изофермент CYP2C19 in vitro. При одновременном применении с варфарином наблюдалось удлинение протромбинового времени. При одновременном применении с кумариновыми производными необходим краткосрочный мониторинг протромбинового времени в начале и конце терапии, а также при изменении режима дозирования. В качестве альтернативы варфарину следует рассмотреть вопрос о применении низкомолекулярных гепаринов.
Недостаточно изучен вопрос лекарственного взаимодействия иматиниба и препаратов для химиотерапии у пациентов с Ph+ ОЛЛ. Необходимо соблюдать осторожность при одновременном применении иматиниба и химиотерапевтических препаратов в связи с возможным увеличением риска развития лекарственных осложнений, таких как гепатотоксичность, миелосупрессия и других.
При комбинации иматиниба с химиотерапевтическими препаратами в высоких дозах возможно развитие транзиторной печеночной токсичности в виде увеличения активности печеночных трансаминаз и гипербилирубинемии. При комбинации иматиниба и режимов химиотерапии, которые потенциально могут вызывать нарушения функции печени, следует предусмотреть контроль функции печени.
In vitroиматиниб ингибирует изофермент CYP2D6 цитохрома Р450 в тех же концентрациях, в которых он ингибирует изофермент CYP3A4.
У пациентов после тиреоидэктомии, получающих заместительную гормональную терапию левотироксином натрия, возможно снижение его концентрации при одновременном применении с иматинибом.
Гливек

Товары из категории - Препараты для лечения онкологических заболеваний


Lilly [Эли Лилли энд Компани]



EBEWE Pharma [Эбеве Фарма]


Инструкция по применению
Немного фактов
Гливек противолейкозное средство, обладающее выраженными цитостатическими свойствами. Широко применяется в таргетно-прицельной терапии онкологических заболеваний крови. Избирательно воздействует на атипичные клетки, в которых имеются характерные для патологии генетические изменения.

Нозологическая классификация болезней (МКБ-10)
Противоопухолевый препарат используется при лечении следующих категорий онкозаболеваний:
- C26 недоброкачественные опухоли в ЖКТ и в прилегающих органах неуточненной локализации;
- C44.9 недоброкачественные опухоли кожных покровов неуточненной локализации;
- C78.8 вторичные недоброкачественные опухоли в органах пищеварительной системы;
- C79.2 вторичные недоброкачественные опухоли в кожных покровах;
- C91.0 острая лимфобластная лейкемия (ОЛЛ);
- C92.1 вялотекущий миелолейкоз (хронический миелоидный лейкоз, ХМЛ);
- C96.2 недоброкачественные тучноклеточные новообразования;
- D46 гетерогенные клональные патологии, характеризующиеся дисплазией в костном мозге;
- D47.1 вялотекущие миелопролиферативные патологии;
- D72.1 повышенная концентрация эозинофилов.
Форма выпуска и биохимический состав
Гливек выпускается в виде оранжевых продолговатых капсул, заключенных в желатиновые кишечнорастворимые оболочки. В них содержатся такие компоненты:
- иматиниба мезилат (по 100 мг в каждой капсуле);
- поливинилпирролидон;
- полисорб;
- магния стеарат;
- МКЦ;
- двуокись титана;
- лецитин соевый;
- пищевые добавки Е171 и Е172.
Капсулы расфасованы в блистерные пластины по 10 штук. В картонной бело-голубой пачке содержится 140 капсул и инструкция по применению антибластомного медпрепарата.
Фармакотерапевтические свойства
Иматиниба мезилат относится к селективным (избирательным) ингибиторам тирозин-специфической протеинкиназы. Он препятствует биосинтезу фосфотрансфераз типа Bcr-Abl, которые возникают в результате объединения мутированного гена Abl и части гена Bcr. Гливек подавляет пролиферацию атипичных клеток и стимулирует апоптоз раковых линий, которые экспрессируют атипичные клетки и специфическую протеинкиназу типа Bcr-Abl.
Таргетный цитостатик применяется в терапии больных с позитивной филадельфийской хромосомой. Активные метаболиты лекарства препятствуют дальнейшему развитию Bcr-Abl-позитивных колоний раковых клеток, вследствие чего наблюдается регресс лимфобластомной лейкемии и вялотекущего миелолейкоза.
При применении противолейкозного средства нарушается пролиферация раковых клеток, а также индуцируется апоптоз стромальных новообразований в пищеварительном тракте. Противоопухолевое действие обусловлено инактивацией специфических рецепторов к факторам роста клеточных пластин (тромбоцитов), которые стимулируют развитие онкологических патологий гиперэозинофильного синдрома.
Действующие компоненты лекарства препятствуют передаче сигналов в раковых клетках, а также нарушают митотические процессы, возникающих по причине сбоев в регуляции функций факторов роста тромбоцитов. Противоопухолевая терапия капсулами Гливек увеличивает выживаемость больных при неоперабельных стромальных новообразованиях и онкологических заболеваниях крови на 35-40%.
Согласно результатам исследований, адъювантное лечение иматинибом на протяжении 1 года уменьшает вероятность рецидивов гастроинтестинальных новообразований на 89-92%. Профилактика злокачественных опухолей в ЖКТ в течение 3 лет приводит к существенному увеличению выживаемости пациентов без проявления патологических симптомов заболевания.
При приеме внутрь биодоступность иматиниба мезилата равна 97-98%. В случае употребления жирной пищи скорость всасывания активных метаболитов лекарства снижается, но незначительно. Не менее 95% активных компонентов связываются с белковыми структурами в крови, в особенности с альбуминами, липопротеинами и гликопротеинами.
Согласно инструкции, иматиниба мезилат расщепляется в паренхиматозной ткани с последующим образованием N-деметилированных пиперазиновых производных. Главный метаболит цитостатического средства обладает выраженными фармакотерапевтическими свойствами, что было неоднократно подтверждено в испытания in vitro. Степень связывания продуктов распада иматиниба с альбуминами составляет примерно 93-95%.

После приема внутрь одной дозы медпрепарата лекарственные метаболиты выводятся на протяжении недели преимущественно с каловыми массами (более 68%) и уриной. В неизмененном виде выводится только 25% иматиниба мезилата, при этом период его полураспада составляет в среднем 18 часов.
Гливек применяется в молекулярно-прицельной и адъювантной терапии онкологических патологий крови, кожи и ЖКТ. Показаниями к назначению ингибитора протеинкиназы считаются:
- вялотекущий миелолейкоз с Ph+ при неэффективном предшествующем лечении интерфероновыми медпрепаратами;
- впервые диагностированный ХМЛ с позитивной филадельфийской хромосомой (Ph+);
- ХМЛ с Ph+ у детей при диагностировании бластного криза;
- ОЛЛ с Ph+ у больных при параллельном применении химиотерапии;
- молекулярно-прицельная терапия больных при рецидивирующем остром лимфобластомном лейкозе;
- миелопролиферативные патологии, возникающие на фоне генных изменений в рецепторах фактора роста кровяных пластин;
- масцитоз у взрослых пациентов с неопределенным c-Kit мутированным статусом;
- вялотекущая эозинофильная лейкемия или эозинофилия периферической крови с мутированной альфа-тирозинкиназой;
- прогрессирующее недоброкачественные стромальные новообразования в органах пищеварения;
- профилактическое лечение стромальных новообразований в ЖКТ, положительных по c-Kit.
Инструкцией по применению рекомендуется применять цитостатический медпрепарат в таргетной терапии дерматофибросарком и гастроинтестинальных новообразований, которые невозможно удалить хирургическим путем.
Дозировочный режим
Противолейкозный препарат необходимо принимать внутрь во время еды, запивая 250 мл питьевой воды. Таким образом удается снизить вероятность раздражения слизистых ЖКТ и развития кишечных нарушений.
Дозы до 600.0 мг нужно принимать 1 раз в день за один прием. При назначении 800.0 мг иматиниба мезилата и более дозы делят на два приема в день.
Детям и больным, которые не способны самостоятельно проглотить капсулу, рекомендуется принимать лекарство в разбавленном виде. Содержимое капсулы можно смешивать с негазированной водой или натуральным яблочным соком.
Продолжительность курса лечения зависит от терапевтического ответа пациента, т.е. фармакотерапию продолжают до тех пор, пока сохраняется противоопухолевый эффект. При этом дозировка определяется типом онкологической патологии, скоростью ее прогрессирования и возрастом больного:
- ХМЛ в стадии хронического развития 400.0 мг в день;
- бластный криз у детей или ХМЛ в стадии акселерации 600.0 мг в день;
- Ph+ при ОЛЛ 600.0 мг в день;
- миелопролиферативные патологии 400.0 мг в день;
- неоперабельные стромальные новообразования 400.0 мг в день;
- адъювантное лечение стромальных новообразований 400.0 мг в день на протяжении 36 месяцев;
- системный мацитоз у взрослых 400.0 мг в сутки;
- гиперэозинофильный синдром 400.0 мг в сутки.

Инструкцией по применению рекомендуется рассчитывать дозировку для детей, ориентируясь на площадь поверхности тела. При ХМЛ назначается не более 340.0 мг на м2 тела в сутки. Стандартная дневная доза для детей школьного возраста не может превышать 600.0 мг. Чтобы предотвратить кишечные расстройства, желательно разделять установленную врачом дозу на два приема.
Особые категории больных
В связи с тем, что Гливек метаболизируется преимущественно паренхимой, больным с легкой и среднетяжелой печеночной недостаточности назначают не более 400.0 иматиниба в сутки. При обнаружении побочных токсических эффектов дозировку уменьшают на 20-25%. Больные с печеночным циррозом и другими патологиями печени должны проходить фармакотерапию под пристальным наблюдением медперсонала.
Почки практически не принимают участие в метаболизации противолейкозного средства, поэтому для больных с нарушенной клубочковой фильтрацией дозировочный режим не изменяют. В случае применения системного гемодиализа молекулярно-прицельную терапию начинают с минимально возможной терапевтической дозы 400.0 мг.

Пациентам в возрасте от 65 лет дозировку не уменьшают, т.к. возрастные изменения в организме практически никак не сказываются на скорости абсорбции и метаболизации иматиниба.
Гестация и лактация
Известно, что таргетный цитостатик обладает выраженной репродуктивной токсичностью, поэтому при отсутствии жизненных показаний его не используют при лечении женщин во время вынашивания плода или кормления грудью.
Совместимость с алкоголем
Алкоголь усиливает токсическое действие иматиниба мезилата на ЖКТ и нервную систему, поэтому во время прохождения таргетной и адъювантной терапии следует воздержаться от употребления этанолсодержащих напитков.
Взаимодействие с медикаментами
Сочетанный прием капсул Гливек и ингибиторов изоэнзима CYP3A4 сопровождается повышением концентрации иматиниба в общем кровотоке. Поэтому не рекомендуется комбинировать антибластомный медпрепарат с Кларитромицином, Кетоконазолом и другими ингибиторами печеночных ферментов.

Таргетный цитостатик увеличивает плазменную концентрацию медикаментов, которые расщепляются под воздействием изоэнзима CYP3A4. По этой причине не следует сочетать иматиниб с ингибиторами ГМГ-КоА-редуктазы, триазоло-бензодиазепинами и блокаторами кальциевых каналов.
Случаи передозировки
Прием противоракового препарата в дозировке от 1200.0 мг на протяжении недели у больных с ХМЛ вызывать следующие признаки передозировки:
- брюшная водянка 2-й степени;
- гипербилирубинемия;
- мышечные судороги;
- увеличение сывороточной концентрации креатинина.
Для нормализации состояния следует на время прекратить противолейкозную терапию. В течение месяца необходимо контролировать работу органов детоксикации, уровень печеночных ферментов и билирубина в кровотоке.
Побочные реакции
Профиль безопасности цитостатического средства изучен хорошо. При прохождении молекулярно-прицельной терапии больные могут жаловаться на такие побочные эффекты:
- головные боли;
- диспепсические явления;
- мышечные судороги;
- кишечные нарушения;
- абдоминальные боли;
- миелосупрессия;
- обтурация ЖКТ;
- перфорация тонкого кишечника;
- дыхательная недостаточность;
- синдром лизиса опухоли;
- обострение инфекционных патологий;
- фебрильная нейтропения.
В случае возникновения нежелательных эффектов, угрожающих жизни больного, терапию на время прекращают или уменьшают суточную дозу иматиниба.

Согласно инструкции, таргетный цитостатик не назначают больным, которые не достигли 2-летнего возраста. Также противопоказаниями к назначению ингибитора протеинкиназы являются:
- гиперчувствительность к компонентам;
- печеночная недостаточность 3-й степени;
- почечный цирроз в стадии декомпенсации;
- гестация и грудное вскармливание;
- частое проведение системного гемодиализа.
С осторожностью используют лекарство при нарушении сократительной функции миокарда, фиброзном поражении паренхимы и гипербилирубинемии.
Аналоги
Заменить Гливек можно цитостатическими средствами на основе иматиниба мезилата:
- Винат;
- Эгитидин;
- Неопакс;
- Иматеро;
- Иматиниб-Виста;
- Алвотиниб.
Условия продажи и хранения
Противолейкозное средство продается только по рецепту. Хранятся капсулы при комнатной температуре в недоступном для света месте в течение 36 месяцев.
Гливек во Владивостоке





Читайте также:
