Компартмент-синдром
Добавил пользователь Morpheus Обновлено: 27.01.2026
Ключевые слова
Об авторах
ФГБОУ ВО “Российский национальный исследовательский медицинский университет им. Н.И. Пирогова”; Городская клиническая больница №31 Департамента здравоохранения г. Москвы
Россия
доктор мед. наук, профессор, заведующий кафедрой госпитальной хирургии №2 лечебного факультета РНИМУ им. Н.И. Пирогова
Городская клиническая больница №31 Департамента здравоохранения г. Москвы
Россия
канд. мед. наук, заведующий 2-м хирургическим отделением ГКБ №31
ФГБОУ ВО “Российский национальный исследовательский медицинский университет им. Н.И. Пирогова”; Городская клиническая больница №31 Департамента здравоохранения г. Москвы
Россия
доктор мед. наук, профессор кафедры госпитальной хирургии №2 лечебного факультета РНИМУ им. Н.И. Пирогова
Городская клиническая больница №31 Департамента здравоохранения г. Москвы
Россия
врач-хирург 2-го хирургического отделения ГКБ №31
Список литературы
1. Buter A., Imrie C.W., Carter C.R., Evans S., Me Kay С.J. Dynamic nature of early organ dysfunction determines outcome in acute pancreatitis. Br. J. Surg. 2002; 89 (3): 298–302.
2. Гельфанд Б.Р., Проценко Д.Н., Подачин П.В., Чубченко С.В., Лапшина И.Ю. Синдром абдоминальной гипертензии: состояние проблемы. Медицинский алфавит. Неотложная медицина. 2010; 3: 34–42.
3. Burch J.M., Moore E.E., Moore F.A., Franciose R. The abdominal compartment syndrome. Surg. Clin. N. Am. 1996; 74 (4): 833–842.
4. Кrоn I.L., Harman Р.К., Nolan S.P. The measurement of intraabdominal pressure as a criterion for abdominal re-exploration. Ann. Surg. 1984; 199 (1): 28–30.
5. Dambrauskas Z., Parseliunas A., Maleckas A., Gulbinas A., Baranskas G., Pundzius J. Interventional and surgical management of abdominal compartment syndrome in severe acute pancreatitis. Medicina (Kaunas). 2010; 46 (4): 249–255.
6. Mohapatra В. Abdominal compartment syndrome. Indian J. Crit. Care Med. 2004; 8 (1): 26–32.
7. Mayberry J.C., Mullins R.J., Crass R.A., Trunkey D.D. Prevention of abdominal compartment syndrome by absorbable mesh prothesis closure. Arch. Surg. 1997; 132 (9): 957–961.
8. Мыльников А.Г., Паньков А.Г., Чурадзе Б.Т., Усачев О.Ю., Шабрин А.В., Шаповальянц С.Г. Способ декомпрессии брюшной полости при лечении абдоминального компартмент-синдрома у больных деструктивным панкреатитом. Хирургия. Журнал имени Н.И. Пирогова. 2012; 1: 61–67.
9. Cheatham M.L., Fowler J., Pappas P. Subkutaneus linea alba fasciotomy: a less morbid treatment for abdominal compartment syndrome. Am. Surg. 2008; 74 (8): 746–749.
10. Dakin J.F., Nahouraii R., Gentilechi P., Kini S., Gagner M. Subcutaneous endoscopic fasciotomy in a porcine model of abdominal compartment syndrome: a feasibility stady. J. Laparoendosc. Adv. Surg. Tech. A. 2004; 14 (6): 339–344.
11. Leppaniemi A.K., Hienonen P.A., Siren J., Kuitunen A.H., Lindstrom O.K., Kemppainen E.A. Treatment of abdominal compartment syndrome with subcutaneous anterior abdominal fasciotomy in severe acute pancreatitis. World J. Surg. 2006; 30 (10): 1922–1924.
12. Шаповальянц С.Г., Мыльников А.Г., Паньков А.Г., Шабрин А.В. Способ лечения абдоминального компартмент-синдрома при остром деструктивном панкреатите. Патент на изобретение №2397715. 27 августа 2010 г.
Компартмент-синдром предплечья
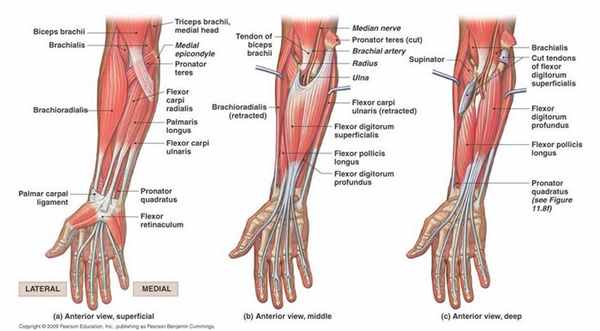
Компартмент-синдром предплечья (КСП) – это состояние, при котором давление внутри закрытого костно-фасциального ложа (футляра, компартмента) повышается до такой степени, что нарушает микроциркуляцию, и это ведет к повреждению тканей. Другими словами, данное состояние можно описать как кровотечение или отек, которые приводят к повышенному давлению в фасциальном футляре и нарушают микроциркуляцию в этом пространстве, и, следовательно, функционирование тканей в этой области, что приводит к их ишемии. Этому могут предшествовать (но не обязательно) перелом или травматическое повреждение предплечья.
Несмотря на редкость, КСП является общепризнанным диагнозом, который может привести к серьезным проблемам, если его не диагностировать и не лечить на ранней стадии.
- Сенсорные нарушения возникают в течение 30 минут.
- Необратимые изменения мышц (например, некроз) — в течение 3-8 часов.
- Необратимые повреждения нервов — в течение 12-24 часов.
Этиология
Травматические факторы
- Переломы предплечья – включая как диафизарные переломы предплечья, так и переломы дистального отдела лучевой кости (наиболее частые).
- Травмы с размозжением тканей (посттравматический краш-синдром).
- Пенетрирующие повреждения.
Нетравматические факторы
- Реперфузионное повреждение.
- Ангиопластика или ангиография.
- Использование внутривенных катетеров.
- Введение запрещенных препаратов.
- Коагулопатии или нарушения свертываемости крови.
- Гематома у пациентов, получавших лечение антикоагулянтами.
- Стягивающая одежда или лонгеты.
- Ожоги.
- Укусы насекомых.
Клинически значимая анатомия
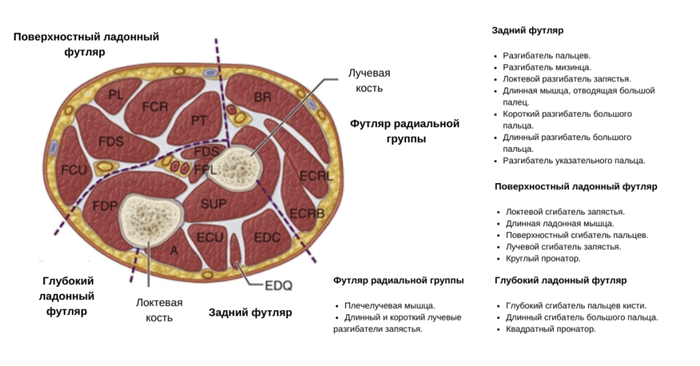
Клинически значимая анатомия
В области предплечья находится четыре футляра: дорсальный, поверхностный ладонный, глубокий ладонный и радиальный.
Задний футляр (иннервируется задним межкостным нервом):
- Разгибатель пальцев.
- Разгибатель мизинца.
- Локтевой разгибатель запястья.
- Длинная мышца, отводящая большой палец (длинный абдуктор).
- Короткий разгибатель большого пальца.
- Длинный разгибатель большого пальца.
- Разгибатель указательного пальца.
Поверхностный ладонный футляр (иннервируется срединным и локтевым нервами):
- Локтевой сгибатель запястья.
- Длинная ладонная мышца.
- Поверхностный сгибатель пальцев.
- Лучевой сгибатель запястья.
- Круглый пронатор.
Глубокий ладонный футляр (иннервируется передним межкостным нервом):
- Глубокий сгибатель пальцев кисти.
- Длинный сгибатель большого пальца.
- Квадратный пронатор.
Футляр радиальной группы предплечья или мобильный тампон (иннервируется поверхностной ветвью лучевого нерва):
- Плечелучевая мышца.
- Длинный и короткий лучевые разгибатели запястья.
Более глубокая мускулатура предплечья в большей степени подвержена ишемическим и компрессионным повреждениям из-за фасциальных границ, препятствующих расширению этих мышц.
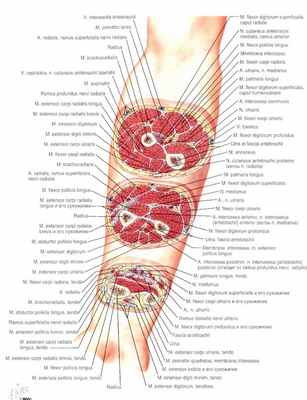
Анатомия предплечья
Лучевая и локтевая кости связаны очень тугой межкостной мембраной. Тут же по направлению к ладонной поверхности предплечья от этой мембраны располагается длинный сгибатель большого пальца и глубокий сгибатель пальцев кисти. Это наиболее часто повреждаемые мышцы на поздней стадии КСП.
Чтобы не пропустить ничего интересного, подписывайтесь на наш Telegram-канал.
Поверхностные мышцы-сгибатели предплечья (поверхностный сгибатель пальцев руки, локтевой сгибатель запястья и лучевой сгибатель запястья) также склонны к ишемическим повреждениям, но эта склонность менее выражена из-за их более поверхностного расположения и менее жесткой поверхностной фасции.
На тыльной (дорсальной) стороне предплечья находятся разгибатели пальцев и запястья, которые могут быть повреждены при КСП, но это случается не так часто, как в случае с футляром глубоких сгибателей.
Наконец, футляр радиальной группы предплечья, состоящий из плечелучевой мышцы и лучевых разгибателей запястья, также может повреждаться при КСП. Контрактура футляра радиальной группы встречается нечасто.
Срединный нерв травмируется при КСП наиболее часто из-за своего более глубокого расположения, а также при наличии ишемической контрактуры Volkmann, поскольку оказывается заключенным в фиброзную ткань. В средней части предплечья срединный нерв пролегает между глубоким и поверхностным ладонным футлярами предплечья. Кроме того, передний межкостный нерв проходит по дну глубокого ладонного футляра. Передний межкостный нерв обеспечивает двигательную иннервацию глубоких сгибателей (глубокий сгибатель пальцев и длинный сгибатель большого пальца кисти). Таким образом компартмент-синдром, затрагивающий глубокий ладонный футляр, может оказывать двойное разрушающее воздействие.
Друзья, совсем скоро состоится семинар Анны Овсянниковой «Реабилитация кисти после перелома дистального отдела лучевой кости (перелом «луча в типичном месте») и переломов пястных костей». Узнать подробнее…
Локтевой нерв также может повреждаться вследствие КСП, особенно если это приводит к сильным ишемическим контрактурам. В средней части предплечья он ограничен поверхностным сгибателем пальцев, локтевым сгибателем запястья и глубоким сгибателем пальцев. Несмотря на то, что локтевой нерв проходит более поверхностно, по сравнению со срединным нервом, он может серьезно пострадать при компартмент-синдроме предплечья.
Лучевой нерв проходит по дну футляра радиальной группы, а задний межкостный нерв находится на дне заднего футляра. Положение лучевого нерва и заднего межкостного нерва делает их менее склонными к ишемическому повреждению, однако они могут повреждаться при КСП, особенно, если он достаточно выражен и вовлекает тыльную сторону предплечья или футляр радиальной группы.
Клиническая картина
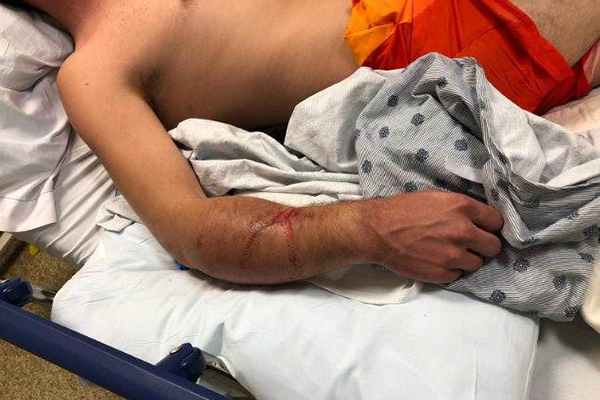
Компартмент-синдром предплечья
У пациентов обычно наблюдается отечность предплечья, они жалуются на боль и трудности при движении рукой и запястьем, особенно при пассивных движениях. Эти симптомы могут также сопровождаться парестезией в руке (в зависимости от клинического течения болезни). Отличительными признаками компартмент-синдрома являются: боль, несоразмерная характеру и степени повреждения, бледность кожи, парестезия, паралич и отсутствие пульса. Несоразмерная боль и боль при пассивном растяжении пальцев считаются первичными и наиболее специфическими признаками компартмент-синдрома у пациентов, находящихся в сознании.
Клиническая картина в соответствии с футлярами предплечья:
- Боль при пассивном сгибании пальца (пястно-фаланговые суставы).
- Выпрямленное положение пальцев.
- Слабая чувствительность в области пястно-фаланговых суставов.
- Минимальный сенсорный дефицит.
- Боль при пассивном разгибании пальцев/запястья.
- Болезненность ладонной поверхности предплечья.
- Согнутое положение пальцев.
- Слабость при сгибании пальцев/запястья.
- Снижение чувствительности в зонах иннервации срединного и локтевого нервов.
Футляр радиальной группы:
- Боль при пассивном сгибании запястья/разгибании локтя.
- Слабость при разгибании запястья.
- Уменьшение чувствительности в зоне иннервации поверхностной ветви лучевого нерва.
Диагностика
Диагноз КСП обычно ставится после клинического осмотра и измерения давления в футлярах.
Измерение давления в компартменте
Клиническими отличительными признаками являются: несоразмерная боль, бледность, парестезия, паралич и отсутствие пульса. Шестой симптом – боль при пассивном растяжении – теперь также включен как один из специфических признаков. Несоразмерная боль и боль при пассивном растяжении пальцев считаются первичными и наиболее чувствительными признаками КСП. Напротив, отсутствие пульса – это симптом поздней стадии или даже терминальной стадии, следовательно компартмент-синдром может некоторое время присутствовать при наличии пульса.
Лечение при компартмент-синдроме предплечья
Фасциотомия при компартмент-синдроме
Физическая терапия
Роль физиотерапии при лечении данного состояния жизненно важна (протокол RICE), особенно в послеоперационном периоде (кистевая терапия). Физический терапевт может использовать методы, которые облегчат боль, улучшат амплитуду движений, силу пораженных мышц и функциональную активность верхней конечности.
Декомпрессионная лапаротомия при остром абдоминальном компартмент-синдроме
Компартмент-синдром (КС) — это патологическое состояние, развивающееся при повышении давления в анатомически замкнутом пространстве. Ввиду того, что брюшная полость является таковым, повышение внутрибрюшного давления может оказывать отрицательное влияние на функцию органов желудочно-кишечного тракта, дыхательную, сердечно-сосудистую, мочевыделительную и центральную нервную системы. Данного вида патологическое состояние определено как абдоминальный компартмент-синдром (АКС). Главным патофизиологическим компонентом АКС является внутрибрюшная гипертензия, приводящая к нарушению перфузии внутренних органов, развитию полиорганной недостаточности и гибели пациента. Закрытая травма живота и операции на органах брюшной полости по поводу острой хирургической патологии — наиболее частая причина АКС. Частота развития АКС составляет 5,5%, нарушение сопровождается крайне высокой летальностью — более 80%.
Роль и возможности декомпрессионной лапаротомии при лечении АКС не совсем ясны и описаны в исследованиях недостаточно убедительно и противоречиво с точки зрения оценки выживаемости. Цель исследования состояла в том, чтобы представить новые данные обоснованности хирургической декомпрессии брюшной полости и показать ее роль в достижении снижения смертности при АКС. Работа выполнена под руководством профессора Мирча Мурешан (Mircea Muresan) из Университета медицины и фармации в Тыргу-Муреш (University of Medicine and Pharmacy of Tirgu Mures), Румыния, и опубликована в феврале 2017 г. в журнале «Medicine (Baltimore)».
Описанное одноцентровое исследование включало 134 пациента с высоким риском развития АКС. У 64 участников развился АКС разной степени выраженности. Внутрибрюшное давление как один из главных показателей тяжести АКС определяли путем его измерения в мочевом пузыре каждый час. Анализировали степень нарушения функции внутренних органов в сопоставлении с уровнем внутрибрюшной гипертензии. Проводимое лечение было стандартизировано в соответствии с рекомендациями Международной согласительной конференции (2013 и 2014 г.) Всемирного общества по изучению абдоминального компартмент-синдрома (World Society of Abdominal Compartment Syndrome — WSACS). Главным достижением было снижение внутрибрюшного давления и определение влияния этого фактора на повышение выживаемости пациентов с АКС. Как отмечено в исследовании, благодаря использованию вакуумной декомпрессии удалось добиться снижения внутрибрюшного давления и общей летальности, включая и группу пациентов с панкреонекрозом, до 27,3%. Общая летальность при всех формах АКС снизилась благодаря использованию вакуумной хирургической декомпрессии в комплексном лечении на 8,7%. Хирургическая декомпрессия, выполненная в пределах первых 24 ч от момента развития АКС, ассоциировалась со значительным снижением риска летального исхода (отношение шансов <1). В среднем декомпрессионную лапаротомию выполняли в период 16,23 ч от момента установления диагноза АКС.
Осложнения, возникающие во время лапаротомной декомпрессии: инфицирование лапаротомной раны (n=2), кишечная непроходимость (n=1). Удаление отечной тканевой жидкости выполняли попутно с раневым отделяемым в рамках проведения вакуумной хирургической декомпрессии. В случае кишечной непроходимости проведена операция по устранению механической причины — рассечение спаек. Окончательное закрытие брюшной полости проводили в среднем через 11,7 дня (9–14 дней).
Таким образом, проведенное исследование показало высокую эффективность клинического применения лапаротомной вакуумной декомпрессии для повышения качества лечения больных с АКС. Применение вакуумной декомпрессии в терапии пациентов с АКС на фоне панкреонекроза может рассматриваться как метод выбора для повышения эффективности лечения этого грозного заболевания, сопровождающегося высокой летальностью.
Компартмент-синдром
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
Способ декомпрессии брюшной полости при лечении абдоминального компартмент-синдрома у больных деструктивным панкреатитом
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(1): 61‑66
Мыльников А.Г., Паньков А.Г., Чурадзе Б.Т., Усачев О.Ю., Шабрин А.В., Шаповальянц С.Г. Способ декомпрессии брюшной полости при лечении абдоминального компартмент-синдрома у больных деструктивным панкреатитом. Хирургия. Журнал им. Н.И. Пирогова. 2012;(1):61‑66.
Myl'nikov AG, Pan'kov AG, Churadze BT, Usachev OIu, Shabrin AV, Shapoval’yants SG. The abdominal decompression for the treatment of the compartment syndrome in patients with the destructive pancreatitis. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(1):61‑66. (In Russ.).
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
Абдоминальным компартмент-синдромом (АКС) называют внезапное повышение давления в брюшной полости, которая представляет собой замкнутое пространство, в результате чего возникают глубокие нарушения функций дыхательной и сердечно-сосудистой систем, а также снижается перфузия печени, кишечника, почек и головного мозга [1, 10, 18].
Негативное влияние повышенного внутрибрюшного давления (ВБД) на различные органы и системы организма человека известно уже на протяжении почти 100 лет. Впервые связь между повышенным давлением в брюшной полости и нарушением функции сердечно-сосудистой системы с летальным исходом описал Эмерсон в 1911 г. [4]. Однако понимание того, что брюшная полость является замкнутым пространством, и стройная концепция внутрибрюшной гипертензии, которая может реализоваться в АКС, впервые появились в 80-х годах XX века [19]. Лишь через 10 лет после выявления патофизиологических закономерностей развития данного состояния стали внедряться хирургические методы его коррекции.
В норме ВБД близко к нулю. После лапаротомии оно может подниматься до 10 мм рт.ст., а изменения функции внутренних органов появляются при быстром подъеме давления в брюшной полости выше 15 мм. Таким образом, под термином «внутрибрюшная гипертензия» (ВБГ) понимается увеличение ВБД выше 15 мм рт.ст., что сопровождается начальными явлениями физиологических нарушений в организме [20].
В свою очередь о возникновении АКС можно говорить в том случае, когда ВБГ сопровождается недостаточностью функции одного или нескольких органов [18].
Выделяют 4 степени повышения ВБД: при I давление в брюшной полости составляет 10-15 мм рт.ст., при II - 16-25 мм, при II - 26-35 мм и при IV превышает 35 мм рт.ст., компартмент-синдром чаще возникает при II и IV степенях ВБГ [3, 17, 18].
Для измерения ВБД предложены прямые и непрямые методы. В настоящее время наиболее простым и распространенным является способ непрямой оценки давления в брюшной полости по уровню давления в мочевом пузыре. Метод не требует специальной аппаратуры и позволяет осуществлять мониторинг на протяжении любого необходимого промежутка времени. В группе больных с высоким риском развития ВБГ измерение внутрибрюшного давления проводят каждые 12 ч, а при необходимости и чаще [11, 13]. При этом необходимо обратить внимание на то, что величина давления в мочевом пузыре должна оцениваться только в совокупности с клинико-лабораторными показателями в связи с тем, что существует так называемая хроническая ВБГ. Основными причинами, приводящими к подобному состоянию, являются беременность, асцит, ожирение, крупные опухоли брюшной полости и забрюшинные опухоли. Кардинальное отличие острой ВБГ от хронической заключается в том, что последняя, развиваясь постепенно, не приводит к полиорганной недостаточности (ПОН), т.е. к АКС; у этих пациентов прямой зависимости между ВБД и функцией внутренних органов нет.
Системное влияние ВБГ на организм человека складывается из следующих составляющих: угнетение сердечной и дыхательной функций преимущественно за счет механических факторов (высокое стояние диафрагмы, уменьшение возврата венозной крови к сердцу на фоне компрессии нижней полой вены), снижение диуреза вплоть до анурии вследствие сдавления почечных вен, нарушение барьерной функции кишечника на фоне его гипоксии, что приводит к транслокации микроорганизмов через неповрежденную стенку кишки в воротный кровоток, лимфатические сосуды и брюшную полость с возможным ранним развитием сепсиса при отсутствии очевидного в общепринятом смысле его источника. Кроме того, увеличение объема внутренних органов, связанное с их отеком в условиях сдавления воротной вены, реализуется в дальнейшем повышении ВБД, замыкая таким образом порочный патофизиологический круг [1, 18].

Среди причин, приводящих к острому повышению ВБД и, как следствие, к АКС, выделяют спонтанные, послеоперационные, посттравматические и ятрогенные (см. таблицу).
Причина ВБГ может локализоваться в забрюшинном пространстве в виде отека и воспаления забрюшинной клетчатки или ретроперитонеальной гематомы либо в брюшной полости при непроходимости или парезе кишечника вследствие различных заболеваний, избыточном пневмоперитонеуме, широком тампонировании брюшной полости или ушивании ее с натяжением, например при аутопластическом закрытии дефекта брюшной стенки при больших вентральных грыжах [15, 18].
При остром деструктивном панкреатите (ОДП) наибольшее влияние на уровень ВБД оказывает массивная секвестрация жидкости в забрюшинную клетчатку, что значительно уменьшает объем брюшной полости, вследствие чего давление в ней возрастает; парез кишечника и асцит в этом случае играют значительно меньшую роль. Развитие ВБГ приходится на первую - стерильную - фазу заболевания, точнее - на первые 3-4 сут его течения, когда происходит быстрое накопление экссудата в парапанкреатическом, параколическом, реже в паранефральном клетчаточных пространствах. С учетом морфологической концепции развития панкреонекроза становится ясным, что более обширная деструкция поджелудочной железы (ПЖ) и забрюшинной жировой клетчатки значительно чаще может приводить к развитию ВБГ и соответственно АКС.

Летальность при возникновении АКС даже при своевременном проведении надлежащих лечебных мероприятий весьма высока и достигает 42-68%, а отсутствие адекватной коррекции или ее задержка всего на несколько часов неминуемо приводит к смерти больного [12]. Лечение данного состояния заключается в немедленном снижении ВБД путем декомпрессии брюшной полости, для чего обычно выполняют тотальную срединную лапаротомию (релапаротомию), устраняют причину ВБГ и увеличивают объем брюшной полости различными способами, чаще всего путем подшивания к апоневрозу по периметру раны заплаты из синтетического материала [6, 16, 21], подкожную клетчатку при этом тампонируют, швы на кожу не накладывают (рис. 1). Рисунок 1. Увеличение объема брюшной полости при АКС на фоне перитонита.
Если возникают показания к релапаротомии (например, запланированные санации брюшной полости при распространенном перитоните), последнюю выполняют путем рассечения заплаты, операцию завершают наложением швов на рассеченные края. После стихания проявлений основного заболевания, снижения ВБД и купирования ПОН заплату удаляют, а целостность брюшной стенки восстанавливают окончательно, включая ушивание апоневроза.
Сложность декомпрессии брюшной полости при АКС, возникшем на фоне ОДП, заключается в том, что лапаротомия в первой фазе его течения является крайне нежелательной и даже вредной манипуляцией в связи с практически неизбежным инфицированием еще не подвергшихся секвестрации некротизированных зон, что значительно усугубляет прогноз [9]. Кроме того, в развитии ПОН при панкреонекрозе, кроме АКС, важную роль играет цитокиновая агрессия, быстро устранить которую как хирургическим, так и неоперативным путем невозможно. Это означает, что снижение ВБГ при ОДП ликвидирует лишь одно из звеньев патогенеза ПОН, но не излечивает ее полностью.
На основании этих предпосылок мы пришли к мнению, что при выборе наиболее предпочтительного способа декомпрессии брюшной полости при АКС, возникшем у пациентов с ОДП, необходимо придерживаться следующих критериев:
1) операция должна приводить к максимальному увеличению объема брюшной полости;
2) обязательно сохранение полной герметичности париетальной брюшины;
3) вмешательство по возможности должно быть минимально травматичным.
Всем перечисленным условиям удовлетворяет так называемая фасциотомия, т.е. широкое рассечение апоневроза по белой линии живота. Объем брюшной полости при этой манипуляции увеличивается за счет расхождения прямых мышц живота и растяжения кожи и брюшины, герметичность брюшной полости сохраняется. При этом операция производится из небольших (2-3 см) кожных разрезов.
Нами разработан и впервые применен в клинической практике способ фасциотомии для лечения АКС при ОДП с благоприятным результатом [1] .
Влияние фасциотомии на течение АКС было ранее изучено в эксперименте на свиньях. Оказалось, что в результате операции у наблюдавшихся животных произошло быстрое снижение ВБД и усиление мезентериального кровотока [7].
В литературе удалось найти немногочисленные описания единичных клинических наблюдений фасциотомии, выполненной с целью лечения АКС, в том числе при остром панкреатите [8, 14] и при политравме [5]. Авторы руководствовались схожими предпосылками, однако технические аспекты описанной операции отличаются от разработанных нами, при этом нет указаний на выздоровление больных после ликвидации у них АКС.
Приводим собственное наблюдение.
Больной Б., 32 лет, поступил в клинику через 8 ч после появления симптомов острого панкреатита, которые возникли после употребления большого количества алкоголя. Состояние при поступлении было расценено как тяжелое: бледные кожные покровы с «мраморным» оттенком, тахикардия до 140 ударов в 1 мин, склонность к гипотензии (АД 100/60 мм рт.ст.), гиповолемия с уровнем Нb 192 г/л. Госпитализирован в отделение реанимации, где начата комплексная интенсивная терапия, исходный уровень ВБД был равен 8 мм рт.ст. При УЗИ обнаружены острый панкреатит, небольшое количество свободной жидкости в сальниковой сумке, признаки параколита слева.
Выполнена ЭГДС (выявлен эрозивный гастродуоденит), установлен назоеюнальный зонд, через который осуществляли энтеральное питание и селективную деконтаминацию кишечника.
На 2-е сутки заболевания и лечения на фоне относительно стабильного состояния у пациента отметили увеличение живота в объеме, при этом уровень ВБД составил 14 мм рт.ст. Диагностирована ВБГ I степени, лечение продолжено.
К началу 3-х суток развилась дыхательная недостаточность и энцефалопатия, что потребовало применения искусственной вентиляции легких и медикаментозной седации, в это же время обнаружили двустороннее геморрагическое пропитывание подкожной клетчатки в поясничных областях с переходом на бедра, что явилось свидетельством обширного тяжелого деструктивного процесса.
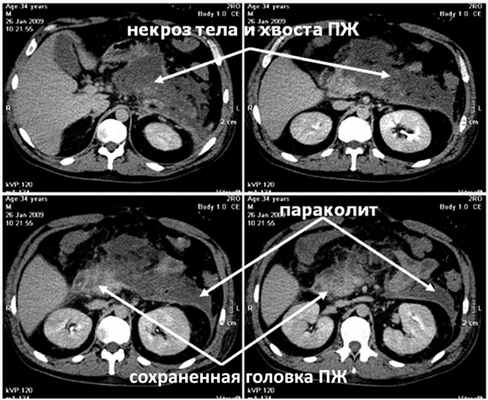
Выполнена КТ с внутривенным контрастным усилением (рис. 3, а), Рисунок 3. Компьютерные томограммы больного Б. а - при поступлении. Субтотальный некроз ПЖ, параколит слева. при которой диагностирован полный некроз тела и хвоста ПЖ с сохранением жизнеспособности только ее головки, парапанкреатит, левосторонний параколит, распространяющийся до подвздошной области.
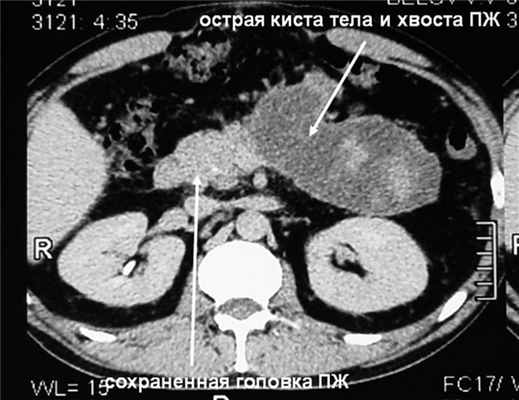
К середине этих же суток на фоне быстрого повышения ВБД до 28 мм рт.ст., что сопровождалось еще более значительным увеличением объема живота, возникли анурия и гипотензия с АД 75/40 мм рт.ст. Начато внутривенное введение дофамина в увеличивающихся дозах, максимально 12 мкг на 1 кг массы тела в 1 мин - без эффекта, затем - адреналина в дозе 0,15 мг на 1 кг массы тела в 1 мин, чем удалось стабилизировать АД на уровне 125/75 мм рт.ст. Проявления дыхательной недостаточности значительно усугубились - на фоне принудительной исскуственной вентиляции легких 100% кислородом индекс оксигенации снизился до критического уровня, составив 115 (нижняя граница нормы 350). Уровни мочевины и креатинина в сыворотке крови в это же время повысились до 32 ммоль/л и 298 мкмоль/л соответственно. Таким образом, на 3-и сутки заболевания и лечения у больного с субтотальным некрозом ПЖ и обширным некрозом забрюшинной жировой клетчатки отмечена развернутая картина прогрессирующей ПОН с недостаточностью функции четырех органов или систем (легких, почек, головного мозга, сердца и сосудов), что произошло на фоне ВБГ III степени. Диагностирован АКС, в связи с чем пациенту экстренно выполнили фасциотомию путем рассечения апоневроза по белой линии живота от мечевидного отростка до лонного сочленения без вскрытия брюшины из двух небольших кожных разрезов длиной по 3 см. Через 30 мин после операции ВБД снизилось с 28 до 19 мм рт.ст., а через 4 ч - до 14 мм рт.ст., после чего восстановился нормальный темп диуреза, показатели гемодинамики позволили прекратить инфузию адреналина, была уменьшена дыхательная поддержка. На 2-е сутки после операции ВБД снизилось до 8 мм рт.ст., на 3-и сутки - до 5 мм рт.ст. и впоследствии не повышалось. Суточный диурез составлял 2-2,5 л, показатели мочевины и креатинина крови к 5-м суткам после декомпрессии брюшной полости снизились до нормы. Постепенно индекс оксигенации повысился до нормальной величины, на 6-е сутки после операции больной был переведен на режим вспомогательной вентиляции, а через 10 сут после фасциотомии - на самостоятельное дыхание. Швы с ран сняты в срок, зажили первичным натяжением. Фазу инфекционных осложнений ОДП удалось миновать путем комплексной профилактики, включающей внутривенное введение тиенама в дозе 3 г в сутки, энтеральное зондовое питание и селективную деконтаминацию желудочно-кишечного тракта. На 14-е сутки лечения больной переведен в хирургическое отделение. Необходимости выполнения чрескожных диагностических и лечебных вмешательств под контролем УЗИ, а также хирургической некрсеквестрэктомии не возникло. В области некротизированных тела и хвоста ПЖ образовалась острая псевдокиста размером 17×7×7 см, параколит регрессировал (см. рис. 3, б). Рисунок 3. Компьютерные томограммы больного Б. б -перед выпиской. Через 29 сут лечения больной был выписан.
Госпитализирован через 3 мес в плановом порядке (рис. 4). Рисунок 4. Вид передней брюшной стенки того же больного перед грыжесечением. При компьютерной томографии (рис. 5) Рисунок 5. Компьютерная томограмма того же больного перед грыжесечением. киста уменьшилась в размерах до 12×5×4 см, начинает замещаться рубцовой тканью, клинические проявления ее отсутствуют, признаков сахарного диабета и экскреторной недостаточности ПЖ нет.
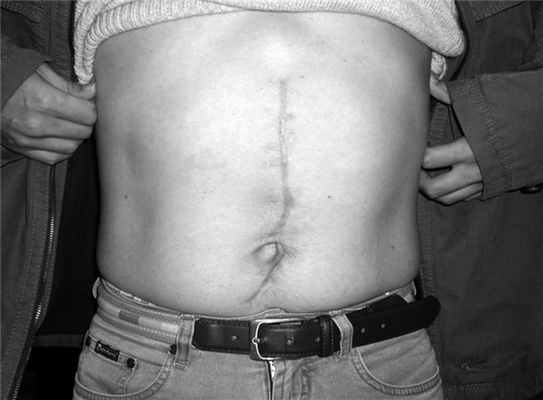
Выполнено грыжесечение с пластикой дефекта в апоневрозе синтетическим аллотрансплантатом, послеоперационный период протекал без осложнений (рис. 6). Рисунок 6. Вид передней брюшной стенки того же больного после грыжесечения.
Представленное наблюдение демонстрирует, с одной стороны, важную роль внутрибрюшной гипертензии в развитии и стремительном прогрессировании полиорганной недостаточности при тяжелом деструктивном панкреатите, с другой - достоинства своевременно выполненного оригинального способа декомпрессии брюшной полости, осуществленного без вскрытия брюшины. Вовремя сделанная фасциотомия и использование современного комплекса интенсивной терапии позволили добиться излечения больного, находившегося в крайне тяжелом состоянии, без выполнения миниинвазивных вмешательств и травматичной некрсеквестрэктомии.
[1] Патент на изобретение№2397715 с приоритетом от 26.03.09 [2]. Выдан Федеральной службой по интеллектуальной собственности.
Компартмент-синдром
Цель настоящего исследования заключалась врасширении знаний об остром компартмент-синдроме (ОКС), обусловленном физической нагрузкой, и о частоте сопутствующих заболеваний, связанных с поздней диагностикой.
Острый компартмент-синдром (ОКС) представляет собой хотя и нечастную, но периодически наблюдаемую в современной ортопедической практике патологию, которая требует немедленной хирургической декомпрессии. Компартмент-синдром можно описать как состояние, при котором повышенное давление в ограниченном объеме мягких тканей приводит к нарушению циркуляции и функции таких тканей. ОКС чаще всего встречается у молодых людей. Цель настоящего исследования заключалась в расширении знаний об остром компартмент-синдроме, обусловленном физической нагрузкой, и о частоте сопутствующих заболеваний, связанных с поздней диагностикой.
В соответствии с одобрением экспертного совета организации авторы выполнили ретроспективный обзор медицинских карт (за период с 1997 по 2013 гг.), в ходе которого оценивали данные пациентов, подвергшихся ургентной фасциотомии по поводу острого компартмент-синдрома, обусловленного физической нагрузкой (ОКС-ФН). В качестве группы сравнения были выбраны мужчины с закрытыми переломами большеберцовой кости, которые возникли во время занятий спортом. Все случаи ОКС-ФН относились к нижней конечности.
В группе ОКС-ФН среднее время с момента появления симптомов до установления диагноза составило 97 часов. У четырех пациентов первоначально диагноз отсутствовал. При обращении к врачу у 6 из 7 пациентов наблюдались неврологические симптомы, хотя нарушений перфузии не отмечалось ни у одного из них. Среднее подфасциальное давление составляло 91 мм рт. ст. Все пациенты подверглись фасциотомии переднего и латерального костно-фасциального футляра, что потребовало в среднем четырех операций. Средний период наблюдения составил 270 дней. При последнем осмотре в периоде наблюдения у двух из четырех пациентов с отсутствующим диагнозом отмечались существенные неврологические и функциональные нарушения. У остальных пяти пациентов наблюдалось полное восстановление. Пациенты с ОКС, вызванным переломом, были моложе; период с момента появления первых симптомов до установления диагноза был короче, и во время вмешательства требовалась декомпрессия большего количества костно-фасциальных футляров.
Хотя патофизиология данного расстройства хорошо известна врачам, специализирующимся на лечении пациентов с костно-мышечными травмами, диагноз часто вызывает затруднения и предполагает высокий уровень клинической настороженности в отношении компартмент-синдрома. Поздняя диагностика, которая влечет за собой задержку лечения, может привести к стойкой инвалидизации. Поздно установленный или отсутствующий диагноз может иметь катастрофические последствия как для больного, так и для медицинского персонала. Поскольку данная патология характеризуется быстрым прогрессированием, для предотвращения дальнейшей ишемии и некроза тканей необходимы срочная диагностика и лечение. Следовательно, быстрое установление диагноза является критически важной составляющей и требует высокого уровня настороженности со стороны лечащей бригады.
Читайте также:
